正丁醚制备
正丁醚的制备

注意事项: 注意事项: (1)分水器必须用铁夹固定,防止支管折断。 (2)根据理论计算失水体积为1.5ml,因为有 单分子脱水的副产物生成,实际分出水的体积 约大于计算量,故分水器放满水后先放掉约 1.7ml水。
3.加热回流分水 用电热套小火加热至微沸,控制温度134— 135℃(40—50V电压稳定)。反应生成的水 以共沸物形式蒸出,经冷凝后收集在分水器 下层,上层比水轻的有机相积至分水器支管 时返回反应瓶中。大约回流1-1.5小时,当三 颈瓶中反应液温度达到134一136℃,且无水 蒸出时停止反应。若继续加热,则反应液变 黑并有较多副产物烯生成。
正丁醚的制备
化学化工学院
一、实验目的
1 、掌握醇脱水制醚的反应原理和实 验方法。 2 、学习使用分水器的应式:
2CH3CH2CH2CH2OH H2SO4 134~~135℃ CH3CH2CH2CH2OCH2CH2CH2CH3 + H2O
副反应: 副反应:
CH3CH2CH2CH2OH H2SO4 140℃ CH3CH CHCH3 + CH3CH2CH (主) (次) CH2 + H2O
五、实验关键及注意事项
实验的关键是温度的合理控制,防止副反应 的增多。 注意分液的正确操作。 注意装置的正确安装。 也可以在分水器中加饱和食盐水以降低正丁 醇和正丁醚在水中的溶解度。
六、思考题
1、制备乙醚和正丁醚在反应原理和实验操作上有 什么不同? 什么不同? 2 、 为什么要将混合物倒入 为什么要将混合物倒入25mL水中 ? 各步洗涤 水中? 水中 的目的是什么? 的目的是什么? 使用分水器的目的是什么? 3、使用分水器的目的是什么?
结 束 放 映
(二)粗品精制
将反应液冷却到室温后倒入盛有25mI水 的分液漏斗中,充分振摇,静置后弃去下层 液体(去水)。上层粗产物依次用8ml50%硫 酸分别洗涤两次、10ml水洗涤,用1g无水氯 化钙干燥。干燥后的产物滤入50ml蒸馏瓶中 蒸馏,收集139—142οC馏分。
正丁醚的制备

正丁醚的制备正丁醚是一种有机化合物,化学式为C4H10O,主要用作溶剂和提取剂,也是合成其他有机化合物的重要原料。
正丁醚的制备可以通过多种方法进行,下面将介绍其中一种常见的方法。
实验材料:1. 丁醇(C4H9OH)2. 浓硫酸(H2SO4)3. 六氯化铈(CeCl3)4. 硫酸铵((NH4)2SO4)5. 水(H2O)实验步骤:1. 在干燥的圆底烧瓶中加入50 ml丁醇。
2. 向丁醇中加入2 ml浓硫酸,并拌匀。
3. 在冷水浴中加热反应溶液,保持温度在80℃左右。
4. 将2 g六氯化铈加入反应溶液中,并继续加热反应1小时。
5. 将反应溶液倾倒入分液漏斗中,加入30 ml水,并振荡混合。
6. 用硫酸铵溶液洗涤有机相。
7. 使用旋转蒸发器将有机相脱水,得到正丁醚。
反应机理:此反应是一种酸催化的弱氧化还原反应。
浓硫酸为催化剂,能使丁醇发生质子化反应,生成正丁基离子。
六氯化铈是这个反应中的氧化剂,它能将丁基离子氧化为丁醛,然后再还原为正丁醚。
反应中,硫酸铵用于洗涤有机相,去除硫酸等杂质。
应用:正丁醚作为溶剂可应用于有机化学实验室中,如萃取、色谱分离、溶解等。
此外,正丁醚也有一定的工业应用,在化学合成、油漆制造、纺织化学等行业中都有所应用。
安全注意事项:1. 浓硫酸具有强酸性和强氧化性,应注意避免与皮肤和眼睛接触,使用时应穿戴好安全手套和护目镜等防护用具。
2. 六氯化铈为一种有毒物质,应注意避免吸入、吞食和与皮肤和眼睛接触,使用时应穿戴好防护用具。
3. 反应中产生的氧气及氧气混合物为易燃气体,应注意避免火源及对其它物质的危害。
正丁醚的制备
反应装置
蒸馏纯化装置
步骤: 反应
按图装置仪器。在250mL三颈园底烧瓶中, 加入31mL正丁醇和约5mL浓 硫酸, 摇动使混合均匀, 并加入几粒沸石。在分水器中装(V-3)mL水, 然后将 烧瓶在石棉网上用小火加热, 使瓶内液体沸腾, 开始回馏, 在分水器中可以发 现液面增加, 这是由于反应生成的水以及未反应的正丁醇,经冷凝管聚集在分 水器内, 由于比重的不同, 水在下层, 而比重较水轻的正丁醇浮于水面而流回 到反应瓶中, 继续加热到瓶内温度升高到134~135℃(约需1h)。待分水器已
全部被水充满时, 表示反应已基本完成。
纯化 反应物冷却后, 把反应物连同分水器中的水一起到入内盛50mL水的分液 漏斗中,充分振摇, 静止后, 分出产物正丁醚, 用两份15 mL50%硫酸萃取洗涤 两次, 再用15 mL水洗涤两次, 然后用无水氯化钙(1~2g)干燥。 干燥后的产 物仔细地注入50mL蒸馏烧瓶中, 蒸馏收集139~144℃的馏份。
正丁醚的制备
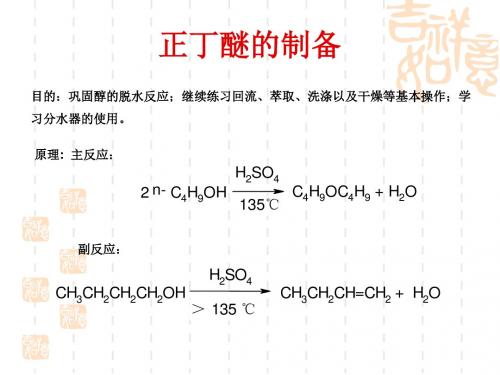
目的:巩固醇的脱水反应;继续练习回流、萃取、洗涤以及干燥等基本操作;学 习分水器的使用。 原理: 主反应:
2 n- C4H9OH
H2SO4 135℃ C4H9OC4H9 + H2O
副反应:
H2SO4 CH3CH2CH2CH2OH > 135 ℃ CH3CH2CH=CH2 + H2O
装置:
注意事项:
ቤተ መጻሕፍቲ ባይዱ
1)加热回流时加热速度不能过快,反应后期可适当提高加热功率,但反 应温度不能过高,防止副反应和积炭; 2)用硫酸洗涤时应注意硫酸的加入速度; 3)蒸馏时防止蒸干。 问题: 1) 如何严格控制反应温度?怎样得知反应比较完全了? 2) 各步洗涤的目的是什么?
正丁醚的制备

实验九正丁醚的制备一、实验目的1、掌握醇分子间脱水制备醚的反应原理和实验方法。
2、学习使用分水器的实验操作。
二、实验原理2C4H9OH—→C4H9-O-C4H9+ H2O副反应:CH3CH2CH2CH2OH —→C2H5CH=CH2+ H2O三、药品和仪器正丁醇,浓硫酸,无水氯化钙,5%氢氧化钠,饱和氯化钙、100ml三口瓶、球形冷凝管、分水器、温度计、分液漏斗、25ml蒸馏瓶、装置:正丁醚反应装置蒸馏装置四、实验操作1、在50ml三口烧瓶中,加入15.5ml正丁醇、2.5ml浓硫酸和几粒沸石,摇匀后,一口装上温度计,温度计插入液面以下,另一口装上分水器,分水器的上端接一回流冷凝管。
先在分水器内放置(V-1)ml水,另一口用塞子塞紧。
2、然后将三口瓶放在电热套小火加热至微沸,进行分水。
反应中产生的水经冷凝后收集在分水器的下层,上层有机相积至分水器支管时,即可返回烧瓶。
3、大约经1.5h后,三口瓶中反应液温度可达134一136℃。
当分水器全部被水充满时停止反应。
若继续加热,则反应液变黑并有较多副产物烯生成。
4、将反应液冷却到室温后倒人盛有12ml水的分液漏斗中,充分振摇,静置后弃去下层液体。
5、上层粗产物依次用6ml水、4ml 5%氢氧化钠溶液、4ml水和4ml饱和氮化钙溶液洗涤,用1g无水氯化钙干燥。
6、干燥后的产物滤入蒸馏瓶中蒸馏,收集140—144℃馏分计算产率。
五、实验注意事项1、本实验根据理论计算失水体积为0.8ml,故分水器放满水后先放掉约1ml水。
2、制备正丁醚的较宜温度是130一140℃,但开始回流时,这个温度很难达到,因为正丁醚可与水形成共沸点物(沸点94.1℃含水33.4%);另外,正丁醚与水及正丁醇形成三元共沸物(沸点90.6℃,含水29.9%,正丁醇34.6%),正丁醇也可与水形成共沸物(沸点93℃,含水44.5%),故应在100—115℃之间反应半小时之后可达到130℃以上。
正丁醚的制备

试验装置(粗产品旳精制)
注意事项: 1.安装顺序 2.温度计旳位置 3.冷凝管旳种类 及使用范围
五、试验流程
正丁醇 浓H2SO4
回流 过程
分水器
有机层
无水
CaCl2
干燥
粗正丁醚
分液 漏斗
有机层
50 %
H2SO4
洗涤
蒸馏
搜集正丁醚馏分 (140~144℃)
问题五 为何用50%H2SO4洗涤粗产品?
2C4H9OH————H2O
×
2 74 g
18g
12.5 g
x x=1.52g
本试验是用12.5g正丁醇脱水制取正丁 醚,应该脱水旳量为1.52g
所以,在试验此前预先在分水器里加
(V-2)ml水,V为分水器旳体积,加上反应 后来生成旳水一起恰好充斥分水器,而使 汽化冷凝后旳反应物正丁醇、正丁醚等恰 好溢流返回反应瓶中,从而到达自动分离 旳目旳。
正丁醚旳制备
一、试验目旳
1.掌握醇分子间脱水制备醚旳反 应原理和试验措施;
2.学习使用分水器旳试验操作。
二、试验原理
主反应
副反应
反应特点:
(1)可逆反应:为提升反应产率,本试验采用边反应边 把生成旳水与反应体系分离,从而使平衡向右移动。
(2)需酸催化:浓硫酸为催化剂。
三、主要试剂及产品旳物理常数
分
名称
子 量
性状
折 光 率
密度
熔点 ℃
沸点 ℃
溶解度 (水)
正丁醇 74.1 无色液 1.399 0.89 -89.8 118
915
不不
正丁醚 130.23 无色液 1.3992 0.764 -98 142.4 小于
正丁醚的制备

1.正丁醚的制备
实验步骤
在50ml三口瓶中,加进15.5ml正丁醇、2.5ml浓硫酸和几粒沸石,摇匀后按图装置仪器.三口瓶一侧口装上温度计,温度计水银球应浸入液面以下,中间口装上分水器,分水器的上接一回流冷凝管,先在分水器内放置一定量的水,小心开启旋塞放出2ml水,把水的位置做好记号,另一口用塞子塞紧。
然后将烧瓶放在石棉网上用小火加热,保持反应物微沸,回流分水。
随着反应的进行,回流液经冷凝后收集于分水器内,分液后水层沉于下层,上层有机相积至分水器支管时,即可返回烧瓶。
当烧瓶内反应物温度上升至135℃左右,分水器全部被水充满时,即可停止反应。
大约需要1.5h.若继续加热,则反应液变黑并有较多副产物产生。
将反应液冷却到室温后,拆除装置,将反应液倒人盛有25mI水的分液漏斗中,充分摇振,静置分层后弃去下层液体。
上层粗产物依次用12.5ml水、8ml 5%氢氧化钠溶液、8ml水和8ml饱和氮化钙溶液洗涤,然后用1g无水氯化钙干燥。
干燥后的产物滤入25ml蒸馏瓶中,蒸馏收集140—144οC馏分,产量3-4g。
纯粹正丁醚的沸点142.4οC,折射率 n D201.3992
本实验约需6h。
正丁醚的制备

正丁醚的制备一.实验目的 1.学习和掌握正丁醚的制备原理和方法2.掌握分液漏斗的使用,带分水器的回流操作二.反应式三.实验试剂 正丁醇 31ml ,浓硫酸 5ml ,50% H 2SO 4 / H 2O四.实验步骤配料(加一粒沸石)安装反应装置分水器加水 小火加热沸腾,回流 45m in停火,冷却改为蒸馏装置 补加一粒沸石 蒸 馏15m l 50% H SO / H O洗两次,除正丁醇 出 液(H 2O,正丁醇,正丁醚)有机层 有机层15ml H 2O 洗两次,除H 2SO 4 有机层1-1.5g CaCl 2干燥除水 粗产物蒸 馏收集139-143℃馏分产品(称重上交,计算产率)五.实验注意事项1.加料时摇荡烧瓶使浓硫酸与正丁醇混合均匀2.了解分水器的原理和使用范围,正确使用分水器3.回流反应时,用小火加热,不可用分层火焰4.改为蒸馏装置时,要充分冷却,再加1~2粒沸石,防止暴沸5.在后处理洗涤过程中,要清楚有机层和水层及各步洗涤的目的6.用无水CaCl 2 干燥时,所用锥形瓶要干燥无水7.H 2SO 4分清98%浓硫酸和50%硫酸讲解部分:1.实验反应的关键是控制反应温度(强调火焰的调节,反应瓶底离石棉网0.5-1cm 的距离,避免温度太高)2.配料时,先加正丁醇,再缓加浓H 2SO 4 ,并晃动烧瓶,同时用冷水浴冷却;否则温度上升太高,浓H 2SO 4 会将正丁醇氧化。
2 CH 3CH 2CH 2CH 2OH( CH 3CH 2CH 2CH 2 )2 O H 2O +24主反应:副反应: CH 3CH 2CH 2CH 2OH CH 3CH 2CH = CH 2 H 2O H 2S O 4 , >135 ℃+反应仪器装置的安装要点(第一次合成实验则讲)3.分水器①安装装好反应瓶,调好高度后,装分水器,首先向分水器中加水到离支管处2-3mm ,再试一下分水器是否能顺利的放水、并不漏水。
②介绍分水器的原理和使用方法,特别是放水的具体操作,控制流出速度。
正丁醚的制备有机实验

正丁醚的制备正丁醚常用作有机反应的溶剂。
实验室制备正丁醚的主要实验装置如下图:反应物和产物的相关数据如下合成正丁醚的步骤:①将6 mL浓硫酸和37 g正丁醇,按一定顺序添加到A中,并加几粒沸石。
②加热A中反应液,迅速升温至135℃,维持反应一段时间。
分离提纯:③待A中液体冷却后将其缓慢倒入盛有70 mL水的分液漏斗中,振摇后静置,分液得粗产物。
④粗产物依次用40 mL水、20 mL NaOH溶液和40 mL水洗涤,分液后加入约3 g无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11 g。
请回答:(1)步骤①中浓硫酸和正丁醇的添加顺序为______________________________。
写出步骤②中制备正丁醚的化学方程式______________________________。
(2)加热A前,需先从__________(填“a”或“b”)口向B中通入水。
(3)步骤③的目的是初步洗去,振摇后静置,粗产物应从分液漏斗的(填“上”或“下”)口分离出。
(4)步骤④中最后一次水洗的目的为______________________________。
(5)步骤⑤中,加热蒸馏时应收集__________(填选项字母)左右的馏分。
a.100℃b.117℃c.135℃d.142℃(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A。
分水器中上层液体的主要成分为__________,下层液体的主要成分为__________。
(填物质名称)(7)本实验中,正丁醚的产率为__________。
(1)先加正丁醇,再加浓H2SO4或将浓H2SO4滴加到正丁醇中(2)b(3)浓H2SO4上(4)洗去有机层中残留的NaOH及中和反应生成的盐Na2SO4(5)d(6)正丁醇水(7)33.85%试题分析:(1)步骤①中浓硫酸和正丁醇的添加顺序为先加正丁醇,再加浓H 2 SO 4。
正丁醚的制备

分水器的作用是把反应产生的水从反应体系中分离开来,也就是降低产物的浓度使得平衡反应向右移动,从而提高反应的产量。
要求反应物或溶剂和水是不互溶的,而且密度应该是比水小的,这样在分水器里水就能和反应物或溶剂分层,上层的反应物或溶剂又能继续流回反应体系继续反应,而在下层的水就可以从反应体系里分离开来了。
带水剂就是能够和水作用产生共沸物使得水更易被蒸出物质。
正丁醚的制备一、实验目的和要求1. 掌握醇分子间脱水制备丁醚的原理和方法。
2. 学习使用分水器的实验操作。
二、反应式大多数有机化合物在醚中都有良好的溶解度,有些反应(如Grignard反应)必放在醚中进行,因此,醚是有机合成中常用的溶剂。
醇的分子间脱水是制备单纯醚常用的方法,实验室常用的脱水剂是浓硫酸,酸的作用是将一分子醇的羟基转变成更好的离去基因。
这种方法通常用来从低级伯醇合成相应的简单醚,除硫酸外,还可用磷酸和离子交换树脂。
由于反应是可逆的,通常采用蒸出反应产物(醚或水)的方法,使反应向有利于生成酸的方向移动。
同时必须严格控制反应温度,以减少副产物烯及二烷基硫酸酯的生成。
在制取正丁醚时,由于原料正丁醇(沸点117.7℃)和产物正了醚(沸点142℃)的沸点都较高,故可使反应在装有水分离器的回流装置中进行,控制加热温度,并将生成的水或水的共沸物不断蒸出。
虽然蒸出的水中会含有正丁醇等有机物,但是由于正丁醇等在水中溶解度较小,相对密度又较水轻,浮于水层之上。
因此借水分离器可使绝大部分的正丁醇等自动连续地返回反应瓶中,而水则沉于水分离器的下部,根据蒸出的水的体积,可以估计反应的进行程度。
七、注释✧V为分水器的体积,本实验根据理论计算失水体积为3ml,实际分出水的体积略大于计算量,故分水器放满水后先分掉约3.5mL水。
✧制备正丁醚的较宜温度是130—140℃,但这一温度在开始回流时是很难达到的。
日为正丁醚可与水形成共沸物(沸点94.1℃,含水33.4%),另外,正丁醚与水及正丁醇形成三元共沸物(沸点90.6℃,含水29.0%,正了醇34.6%),正丁醇与水也可形成共沸物(沸点93.0℃,含水44.5%)。
实验一 正丁醚的制备

五、注意事项
1.大致安排台面和确定装配仪器的位置。然 后放好铁架台,按照从下到上,从左到右 的原则逐个装配。拆卸时,按照与装配时 相反的顺序,逐个拆除。
2.加料时,正丁醇和浓硫酸需要混合均匀。 如不充分摇动混匀,硫酸局部过浓,加热 后易使反应溶液变黑。
3.按反应式计算,生成水的量约为1.5ml左右, 但是实际分出水的体积要略大于理论计算量, 这是因为有单分子脱水的副产物生成。
6.如果忘记加沸石,需稍冷却后再补加;中途停 止加热,要补加新的沸石。
7.使用浓硫酸要小心,接触皮肤要用水冲洗。 要分清98%浓硫酸和50%硫酸。(正丁醇 能溶于50 %硫酸,而正丁醚溶解很少。 50 %硫酸的配制方法:20 mL浓硫酸缓 慢加入到34 mL水中。)
六、数据处理
样品名称:
,质量: ,
4.制备正丁醚的较适宜温度是130-140 ℃, 由于各种恒沸物的存在,控制温度在100115 ℃之间较合适。随着水被蒸出,温度逐 渐升高,最后达到135 ℃以上。如果温度升 得太高,反应溶液会炭化变黑,并有大量副产 物丁烯生成。
5.加热时,控制好温度,使回流蒸气不超过回流 冷凝管的1/3处。回流太慢,水带不出来,产 率很低;回流太快,温度高,硫酸将有机物炭 化,反应液变黑,温度过高会有副产物生成。
使用前试一下分水器是否漏水,能否顺利的放 水。
3 使用试剂: 正丁醇,浓硫酸,无水CaCl2
四、实验步骤
1.在50 mL两颈瓶中加入15.5 mL 正丁醇,2.5 mL 浓硫酸,两粒沸石,摇动混合均匀,安好 装置。分水器内加水至支管后放去2mL水即分 水器内有( V-2 ) ml水。开始小火加热,保持瓶 内液体微沸,开始回流,温度控制低于135 ℃。 待分水器已全部被水充满时表示反应已基本完 成(约需1-1.5小时),停止加热。
正丁醚的制备

实验一正丁醚的制备一、实验原理醇分子间脱水生成醚是制备简单醚的常用方法。
用硫酸作为催化剂,在不同温度下正丁醇和硫酸作用生成的产物会有不同,主要是正丁醚或丁烯,因此反应须严格控制温度。
主反应:二、实验目的1、练习掌握正丁醚制备实验仪器的装卸。
2、学习使用分水器的实验操作。
3、掌握正丁醚合成的反应原理4、掌握分离提纯的方法及操作三、药品和仪器药品:正丁醇,浓硫酸,无水氯化钙,5%氢氧化钠,饱和氯化钙、沸石器材:100ml三口瓶、球形冷凝管、分水器、温度计(0-150℃)、铁架台、电热套、分液漏斗(125ml)、25ml蒸馏瓶、电热套、锥形瓶(100ml)、量筒(10ml、50ml)四、实验步骤1、在100ml三口烧瓶中,加入31ml正丁醇。
2、在冷水浴中分多次加5ml浓硫酸和几粒沸石,摇匀后,一口装上温度计,温度计插入液面以下,另一口装上分水器,分水器的上端接一回流冷凝管。
先在分水器内放置(V-3.5)ml水,另一口用塞子塞紧。
3、然后将三口瓶放在电热套小火加热至微沸,进行分水。
反应中产生的水经冷凝后收集在分水器的下层,上层有机相积至分水器支管时,即可返回烧瓶。
4、大约经1.5h后,三口瓶中反应液温度达138-140℃时停止加热。
若继续加热,则反应液变黑并有较多副产物烯生成。
5、将反应液及分水器中的液体冷却到室温后倒入盛有50ml水的分液漏斗中,充分振摇,静置后弃去下层液体。
6、上层粗产物依次用25ml水、15ml5%的氢氧化钠、25ml水、15ml饱和氯化钙溶液洗涤。
7、将粗产物倒入干燥锥形瓶中,用3g无水氯化钙干燥15分钟。
注意旋摇锥形瓶。
8、将干燥后的产物滤入蒸馏瓶中蒸馏,收集140—144℃馏分。
9、计算产率。
五、实验流程图六、实验装置图七、实验注意事项(1)正丁醇与浓硫酸混合时要慢要均匀,防止局部碳化。
(2)V为分水器的体积,本实验根据理论计算失水体积为3ml,实际分出水的体积略大于计算量,故分水器放满水后先分掉约3.5mL水。
有机化学实验正丁醚的制备

正丁醚的制备一、实验目的掌握醇分子间脱永制醒的反应原理和实验方法:学习使用分水器的实验操作。
二、实验原理三、实验步骤在干燥的100mL三颈圆底烧瓶中,放入12.5g(155mL)正丁醇和4 g(2.2 mL)浓确酸摇使混合并加人几粒沸石。
按装置图317一个瓶口上装上温度计温度计的水银球必须浸入液面以下。
在另一个瓶口上装上油水分离器,分水器上端接一回流冷凝管,先在分水器中放置(V-2)mL水1,然后将烧瓶在石棉网上用小火加热,使烧瓶内液体微沸开始回流。
随着反应的进行,分水器中液面增高,这是由于反应生成的水,以及未反应的正丁醇,经冷凝管冷凝后聚集于分水器内,由于相对密度的不同水在下层,而上层较水轻的有机相积至分水器支管时即可返回反应烧瓶中[2],继续加热到烧瓶内温度升高到135℃左右。
分水器已全部被水充满时,表示反应已基本完成,约需1h。
如继续加热,则溶液变黑,并有大量副产物丁烯生成。
反应物冷却后,将混合物连同分水器里的水一起倒人盛有25mL 水的分液漏斗中,充分振摇,静止后,分出产物粗制正丁醚。
用16mL50%硫酸分2次洗涤”,再用10mL水洗涤,然后用无水氯化钙干燥。
将干燥后的产物仔细地注人蒸馏烧瓶中,蒸馏收集139~142量5~6g,产率45%~54%。
四、实验药品及仪器仪器:100ml三口瓶,球形冷凝管,分水器,温度计,125ml分液漏斗,50ml蒸馏瓶五、实验装置图六、思考题1.如何得知反应已经比较完全?答:分水器全部被水充满时,可认为反应比较完全。
2.反应物冷却后为什么要倒入50ml水中?各步的洗涤目的何在?答:反应物倒入50ml水中以除去正丁醇。
在5%NaOH溶液中以除去副产品丁烯,加水除NaOH,加饱和CaCl2除去水与醇。
3.能否用本实验方法由乙醇和2-丁醇制备乙基仲丁基醚?你认为用什么方法比较好?答:不能,因为会发生重排反应,使副产物增多。
可使用威廉孙制醚法。
正丁醚的制备实验报告课件

正丁醚的制备实验报告课件
制备正丁醚的实验报告课件
1. 实验目的:
掌握制备正丁醚的方法,并了解醚的制备实验。
2. 实验原理:
正丁醚是一种无色液体,易挥发。
制备正丁醚的方法之一是通过正丁醇的酸催化缩合反应。
在该反应中,醇与酸发生缩合反应,生成醚和水。
3. 实验仪器与试剂:
仪器:反应瓶、冷凝器、加热器等。
试剂:正丁醇、浓硫酸。
4. 实验步骤:
(1) 在一个干净的反应瓶中加入20 mL正丁醇。
(2) 加入适量的浓硫酸,注意慢慢加入并充分搅拌。
(3) 放入反应热水浴中,加热反应混合物,保持温度在70-80℃左右。
(4) 反应进行时,观察反应混合物的变化,生成的正丁醚可以通过挥发性的气味进行初步判断。
(5) 反应结束后,将反应瓶取出,冷却。
(6) 将反应瓶连接到冷凝器,收集生成的正丁醚。
5. 实验注意事项:
(1) 实验过程中要注意操作规范,避免发生危险。
(2) 实验室应保持通风良好,以防挥发性物质引起中毒。
(3) 实验结束后要注意废弃物的处理,遵循实验室安全环保的原则。
6. 实验结果与分析:
通过实验,我们成功地制备了正丁醚。
通过观察反应混合物的变化和挥发性气味,可以初步确认正丁醚的生成。
7. 实验总结:
通过本次实验,我们了解了正丁醚的制备方法,并学习了醚的制备实验。
制备醚的反应通常需要酸催化,且操作要谨慎,可以通过观察物质的变化和气味来初步判断反应的进行。
实验结果符合预期,实验成功。
这就是制备正丁醚的实验报告课件,希望对您有帮助!。
正丁醚的制备及表征

正丁醚的制备一、实验目的 :1、掌握醇分子间脱水制备醚的反应原理和实验方法;2、学习使用分水器的实验操作。
二、实验原理 :主反应:副反应:三、主要仪器、试剂用量及规格:仪器:三颈烧瓶、 分水器、冷凝管、温度计(200℃)、分液漏斗、电热套、接液管、蒸馏头、电热套试剂:正丁醇12.5g(15.5mL)、浓H 2SO 4 4g(2.2mL)、无水CaCl 2、沸石 四、主要试剂及产品的物理常数:表1主要试剂及产品的物理常数表2几种恒沸混合物的沸点与组成2C 4H 9OH H 2SO 4C 4H 9-O-C 4H 9+H 2O2C 4H 9OH H 2SO 4C 2H 5CH=CH 2+H 2O五、实验流程:六、实验装置图:(1)回流分水装置 (2)改造的蒸馏装置七、纯化流程图:八、主要步骤其注意事项:(一)制备阶段:用分水器分液干燥蒸馏回流分液 洗涤后1.安装回流分水装置:如图(1)所示。
在三口烧瓶上装分水器和温度计,分水器上端再连一回流冷凝管。
2.加药品:在100ml三口烧瓶中加入31ml正丁醇,将5ml浓硫酸慢慢加入,并摇荡使浓硫酸与正丁醇混合均匀,加少许沸石。
3.分水器中可事先加入一定量的水。
【注:水的量可等于分水器的总容量减去反应完全时可能生成的水量】4. 加热反应:将三口烧瓶用小火加热,保持沸腾回流约1h。
随着反应的进行,分水器中的水层不断增加,反应液的温度也逐渐上升。
如果分水器中的水层超过了支管而流回烧瓶时,可打开螺旋夹放掉一部分水。
当生成的水量到达4.5~5ml,瓶中反应液温度到达150℃左右时,停止加热。
如果加热时间过长,溶液会变黑并有大量副产物丁烯生成。
(二)后处理阶段:1. 改装成简易蒸馏装置:待反应物稍冷,拆除分水器,将仪器改装成简易蒸馏装置。
【注:分水器里的水与上层的油层需一并倒入三口瓶里,不能丢掉。
】2. 蒸馏收集反应液:加少许沸石,进行蒸馏直至无馏出液为止。
【注:蒸馏前可先加入一定量的水,利用正丁醚与水形成二元共沸混合物,沸点降低为94.1 ℃,而不是单独正丁醚的沸点142℃,可以有效地避免温度过高发生有机物碳化,提高产物的产量。
实验十三 正丁醚的制备

实验十三正丁醚的制备一、实验目的1(掌握醇分子间脱水制醚的反应原理和实验方法。
2(学习使用分水器的实验操作。
二.实验原理:正丁醚常采用浓硫酸催化正丁醇进行分子间脱水的方法制备。
反应式:oHSO , 134~135 C24CHCHCHOCHCHCHCH + HOCH2 CHCHCHCHOH3222222323222 副反应:HSO24CH + HOCHCHCHCHOH4823222o>135 C三、实验仪器与药品:100mL三颈烧瓶、分水器、回流冷凝管、接受弯头、温度计、蒸馏头、分液漏斗、锥形瓶正丁醇12.5g (15.5mL)、浓硫酸(d=1.84)4g (2.2mL)、无水氯化钙四. 实验步骤:1.在100mL三颈烧瓶中,加入12.5g(15.5mL)正丁醇和约4g(2.2mL)浓硫酸,摇动使混合均匀,并加入几粒沸石。
在三颈瓶的一瓶口装上温度计,另一瓶口装上分水器,分水器上端接回流冷凝管。
在分水器中放置(V-2)mL水,然后将烧瓶在石棉网上用小火加热,回流。
继续加热到瓶内温度升高到134~135C(约需20min)。
待分水器已全部被水充满时,表示反应已基本完成。
2.冷却反应物,将它连同分水器里的水一起倒入内盛25mL水的分液漏斗中,充分振摇,静止,分出产物粗制正丁醚。
用两份8mL50%硫酸洗涤两次,再用10mL 水洗涤一次,然后用无水氯化钙干燥。
干燥后的产物倒入蒸馏烧瓶中,蒸馏收集139~142?C馏分。
称重,计算产率。
20 纯正丁醚为无色液体,bp为142?C,n 1.3992。
D注:[1]反应中分水器内液面增加,这是由于反应生成的水以及未反应的正丁醇,经冷凝管冷凝后聚积于分水器内,由于比重不同,水在下层,正丁醇浮于水面而流回到反应瓶中。
V为分水器的容积。
[2]丁醇溶于50%硫酸中,而正丁醚则很少溶解,以此除去正丁醇。
五、问题讨论1.反应结束为什么要将混合物倒入25mL水,中各步洗涤的目的是什么,答:将混合物倒入25mL水中分出醚层;用50,HSO洗粗产品主要洗除副24产物丁烯和未反应完的原料正丁醇。
实验四 正丁醚的合成

实验四 正丁醚的合成一、实验目的1.通过正丁醇分子间脱水反应制备正丁醚,理解醇脱水反应原理。
2.掌握分水器的使用条件和应用方法、冷凝管的选用3.常压蒸馏的操作方法,进一步掌握蒸馏及沸点测定的技术。
4.正确安装带有分水器的回流装置。
5.学习分液漏斗的使用,区别萃取和洗涤的关系。
6.了解化合物的干燥和干燥剂的使用。
二、实验原理 反应方程式如下:2 CH 3CH 2CH 2CH 2OH(CH 3CH 2CH 2CH 2)2O + H 2O副反应:CH 3CH 2CH 2CH 2OHCH 3CH 2CH=CH 2 + H 2O三、仪器及试剂1.仪器:带分水器回流装置一套;萃取装置一套;蒸馏装置一套。
2.试剂: 正丁醇50g (62mL, 0.67mol );浓硫酸(d=1.84) 5mL ;无水氯化钙;沸石;饱和食盐水;饱和氯化钙;5%氢氧化钠溶液。
四、主要试剂及产品的物理常数:(文献值)五、基本操作训练分水装置的应用、萃取洗涤操作、液态化合物的干燥和蒸馏操作。
【实验流程】用分水器 分液干燥 蒸馏 回流 分液洗涤后六、实验步骤在装有62mL正丁醇的150mL三口烧瓶中,边摇边滴加9m L浓硫酸,加入几粒沸石后,中间口按装分水器,在分水器中加入V-7.0mL水[1]后,另一口用塞子塞紧,按照图3.4装置仪器,三口瓶的另一侧口装上温度计,温度计水银球应插入液面以下,开始加热回流。
当分水器已全部充满时,水层不再变化,瓶中反应温度达135︒C[2],表示反应已基本完成。
待反应冷却至室温后,倒入盛有100 mL水的分液漏斗中,充分振荡,静止分层后弃去下层液体,上层的粗产物依次经过50mL水、30mL5%NaOH[3]、30 mL水、30mL饱和氯化钙溶液进行洗涤[4],然后加入2~4g无水氯化钙于试剂瓶中进行干燥。
将干燥后的产物滤去干燥剂加入25(或50)mL的圆底烧瓶中,加入几粒沸石后,再将仪器改装成蒸馏装置进行蒸馏,收集140~144︒C的馏分。
实验:正丁醚的制备

二、实验原理
主反应:
浓 硫 酸
+ C 2 H 3 C (H 2 ) O 3 H1 3 5 ℃ C H 3 C (H 2 ) O 3C (H 2 ) C 3 H 3H O 2
副反应:
+ + 浓 硫 酸
C H 2 C 3 ( H 2 O ) 3 H > 1 3 5 C ℃ H C 3 H C H C H 3 C H C 3 H C 2 H C H 2 H O 2
用油水分离器将反应中生成的水移出反应体系, 使平衡向右移动,提高产率,同时控制反应温度, 避免烯烃生成。
上页 下页 返回 退出
在分水器中先充满水 到支管,然后放出 1mL水,随着瓶内液 体沸腾回流,冷凝液 收集于分水器中,此 时水沉于下层而被分 出反应体系,有机液 体浮于上层,积至支 管口时即返回烧瓶中 继续反应。
上页 下页 返回 退退出
油水分离器
1:如何判断反应进行得比较完全了?
提问 上页 下页 返回 退出
三、试剂及仪器
试剂:
仪器:
•正丁醇 7.8mL •浓硫酸 1.3mL •3mol/L氢氧化钠溶 液 •无水氯化钙
• 半微量有机合成玻璃 仪器;
• 折光仪;
上页 下页 返回 退出
四、实验步骤
1.在100mL三口(或二口)烧瓶中加入7.8mL正丁醇,在不 断摇动烧瓶下慢慢加入1.3mL浓硫酸,使之与正丁醇充 分混合; 2.安装好反应装置。加热回流,当反应液的温度升高到 134~135℃,分水器约收集水1mL左右时,停止加热; 3.等反应物冷却后,把反应物与分水器中的水一起倒入 一个装有20mL水的分液漏斗中,振摇静置后分出下层 液体; 4.上层粗产物依次用水、3mol.L-1NaOH溶液、水及饱和 CaCl2溶液洗涤,用无水CaCl2干燥产物; 5.蒸馏,收集140~144℃馏分; 6.测定产品的折光率。
正丁醚的制备

分水装置: 分水装置:
分水器
实验步骤: 实验步骤:
100 mL圆底烧瓶 15.5 mL正丁醇 振摇 3 mL浓硫酸 1-2粒沸石 混合均匀,装分水装置 有机层 加热至微沸,回流分水 至分水器基本被水充满 无水CaCl2 干燥 收集140-144℃馏分 2×25 mL水洗涤 10 mL 5% NaOH水溶液洗涤 10 mL水洗涤 2×10 mL饱和氯化钙溶液洗涤 水层
注意事项: 注意事项:
在碱洗过程中,不宜激烈地摇动分液漏斗,否则严重乳 化,难以分层。 由于每次萃取时有机层均在上层,因此每次萃取完毕只 需放出下层水溶液,上层有机层不必倒出即可直接加入下 次洗涤所需水溶液进行下一次萃取洗涤。
思考题: 思考题:
使用分水器的目的是什么? 制备正丁醚时,试计算理论上应分出多少体积的 水?实际上往往超过理论值,为什么? 反应物冷却后,为什么要倒入水中?精制时,各 步洗涤的目的何在?
有C
Br
目的和要求: 目的和要求:
掌握由正丁醇脱水制备正丁醚的方法和原理。 掌握分水装置的安装和操作。 巩固萃取和蒸馏的基本操作。
实验原理: 实验原理:
醇分子间脱水生成醚是制备简单醚的常用方法。用 硫酸作为催化剂,在不同温度下正丁醇和硫酸作用生成 的产物会有不同,主要是正丁醚或丁烯,因此反应须严 格控制温度。 主反应:
有机层
倾倒入蒸馏瓶,蒸馏
冷却后,倾入含50 mL水 的分液漏斗中
产物称重或量体积,计算产率 水层
产物折光率:1.3992;密度:0.769 g/mL
注意事项: 注意事项:
投料时须充分摇动,否则硫酸局部过浓,加热后易使反 应溶液变黑。 按反应方程式计算,生成水约为1.5 g左右,实际分出水 层的体积大于理论计算量,因为有单分子脱水的副产物生 成。因此,将分水器中装满水后,先分掉约1.75 mL水。 反应开始回流时,因为有恒沸物的存在,温度不可能马 上达到 135℃。但随着水被蒸出,温度逐渐升高,最后达 到 135℃以上,即应停止加热。如果温度升得太高,反应 溶液会炭化变黑,并有大量副产物丁烯生成。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
正丁醚的制备
一、实验目的
1、掌握醇分子间脱水制备醚的反应原理和实验方法。
2、学习共沸脱水的原理和分水器的实验操作。
二、实验原理
2C4H9
OH C4H9-O-C4H9+ H2O
副反应CH3CH2CH2CH2OH C2H5CH=CH2 + H2O
本实验主反应为可逆反应,为了提高产率,利用正丁醇能与生成的正丁醚及水形成共沸物[见注2]的特性,可把生成的水从反应体系中分离出来。
三、药品和仪器
仪器:100ml三口瓶,球形冷凝管,分水器,温度计,125ml分液漏斗,50ml蒸馏瓶。
四、实验装置(如图)
反应装置图三口瓶
分水器
温
度
计球
形
冷
凝
管
五、实验操作
在100ml三口烧瓶中,加入31ml正丁醇、4.5ml浓硫酸和几粒沸石,摇匀后,一口装上温度计,温度计插入液面以下,另一口装上分水器,分水器的上端接一回流冷凝管。
先在分水器内放置(V-4.0)ml水,另一口用塞子塞紧。
然后将三口瓶放在石棉网上小火加热至微沸,进行分水。
反应中产生的水经冷凝后收集在分水器的下层,上层有机相积至分水器支管时,即可返回烧瓶。
大约经1.5h后,三口瓶中反应液温度可达134一136℃。
当分水器全部被水充满时停止反应。
若继续加热,则反应液变黑并有较多副产物烯生成。
将反应液冷却到室温后倒人盛有50mI水的分液漏斗中,充分振摇,静置后弃去下层液体。
上层粗产物依次用25ml水、15ml 5%氢氧化钠溶液、15ml水和15ml饱和氯化钙溶液洗涤,用1-2g无水氯化钙干燥。
干燥后的产物倾入50ml梨形瓶中蒸馏,收集140—144οC馏分,产量7-8g。
纯粹正丁醚的沸点142.4οC,n D201.3992
本实验需6h。
六、实验注意事项
1、本实验根据理论计算失水体积为3ml,但实际分出水的体积略大于计算量,故分水器放满水后先放掉约4.0ml水。
2、制备正丁醚的较宜温度是130-140℃,但开始回流时,这个温度很难达到,因为正丁醚可与水形成共沸点物(沸点94.1℃含水33.4%);另外,正丁醚与水及正丁醇形成三元共沸物(沸点90.6℃,含水29.9%,正丁醇34.6%),正丁醇也可与水形成共沸物(沸点93℃,含水44.5%),故应在100—115℃之间反应半小时之后可达到130℃以上。
3、在碱洗过程中,不要太剧烈地摇动分液漏斗,否则生成乳浊液,分离困准。
4、正丁醇溶在饱和氯化钙溶液中,而正丁醚微溶。
七、思考题
1、如何得知反应已经比较完全?
2、反应物冷却后为什么要倒入50ml水中?各步洗涤的目的何在?
3、能否用本实验方法由乙醇和2-丁醇制备乙基仲丁基醚?你认为用什么方法比较好?
广州陶粒,广州陶粒厂5wrVFkK3gXQ2。
