共价化合物、离子化合物
共价化合物 离子化合物

共价化合物离子化合物共价化合物和离子化合物是化学中两种不同类型的化合物。
共价化合物是由共用电子对连接起来的原子组成的化合物,而离子化合物是由正离子和负离子组成的化合物。
两者在物理性质和化学性质上有很大的区别。
共价化合物是由非金属原子通过共用电子对形成的。
在共价键中,原子通过共享一个或多个电子对来保持连接。
这种连接形式使得共价化合物通常具有较低的熔点和沸点,而且通常处于液体或气体状态。
同时,共价化合物通常不导电,因为电子在原子之间共享,而没有完全转移。
例如,水是一种共价化合物,由氧原子和两个氢原子通过共用电子对连接而成。
水不导电,因为它的电子没有完全转移到某个原子上。
离子化合物是由离子组成的。
离子是带电的原子或分子,它们可以是正离子(失去电子)或负离子(获得电子)。
离子通过电荷吸引力相互连接。
由于离子之间的电荷吸引力较强,离子化合物通常具有较高的熔点和沸点,并且通常是固体。
与共价化合物不同,离子化合物在溶液中可以导电,因为离子在溶液中可以自由移动。
例如,氯化钠是一种离子化合物,由钠离子和氯离子组成。
当氯化钠溶解在水中时,离子会分离并在溶液中自由移动,导致溶液具有导电性。
共价化合物和离子化合物在化学性质上也有很大的区别。
共价化合物通常是较为稳定的,因为共用电子对形成了较强的化学键。
它们通常在化学反应中不容易发生变化。
然而,离子化合物在溶液中可以发生离解反应,其中离子会与其他物质发生反应。
这是因为离子化合物中的正负离子具有较强的电荷,使得它们与其他物质之间的反应更容易发生。
在实际应用中,共价化合物和离子化合物有着广泛的用途。
共价化合物常用于有机化学中,用于制备药物、塑料和化妆品等。
离子化合物常用于无机化学中,用于制备陶瓷、肥料和电池等。
这些化合物的不同性质和用途使得它们在化学研究和工业生产中具有重要的地位。
总结起来,共价化合物和离子化合物是两种不同类型的化合物,它们在物理性质和化学性质上有很大的区别。
离子化合物和共价化合物的判断

离子化合物和共价化合物的判断1离子化合物和共价化合物的概念离子化合物与共价化合物是化学中最基本的2种物质,它们存在于天然界各处。
它们的主要差别在于化学性质和结构上。
离子化合物是指由正负离子组成的化合物,例如氯化钠;共价化合物是指由共价键结合而成的化合物,例如水。
2离子化合物和共价化合物的化学性质离子化合物和共价化合物有着不同的化学性质,反映在盐溶解度、溶解过程以及溶解过程中溶解度的改变等方面。
离子化合物的溶解过程更适合金属离子的溶解过程,可以很快实现溶解。
而共价化合物的溶解过程更适合氢键的形成,溶解过程的速度较慢。
离子化合物中,离子之间的电荷极性导致他们有很强的亲核能力,盐型离子化合物容易形成阴离子和阳离子的离子缔合物;而共价键是由原子之间共享一个或几个电子而形成,电子密度分布较均匀,共价化合物没有明显的极性或电荷。
3离子化合物和共价化合物的结构离子化合物由离子构成,有一定结构安排,在体外可以形成晶体;共价化合物则是由它们的原子构成,没有明显的三维结构,并且在体外不能形成晶体;离子化合物一般是固体状态,能形成晶体,在一定条件下可以进入液体或气体状态;而共价化合物在体外一般是气体、液体状态,不能形成晶体,但也可由结晶条件下转变为固体状态。
4如何判断离子化合物和共价化合物要正确判断离子化合物和共价化合物,必须从化学结构及化学性质的差异入手进行判断。
离子化合物由正负离子组成,它们的原子间存在极性,常常形成固态的晶体;而共价化合物的原子间没有极性,它们的原子间存在共价键,不能形成固态的晶体。
此外,还可以从溶解过程及溶解度的改变,以及气体状态下吸收光谱特征及能量分辨率这几个方面来判断离子化合物和共价化合物的区别。
以上就是离子化合物和共价化合物的主要区别。
离子化合物和共价化合物,是一种对立的概念,各具特点,互相存在,构成了物理和化学世界的基本原理,并且被广泛应用到各种实际当中。
只有了解这两种化合物的本质,才能正确应用它们,为工业及学术研究做出贡献。
常见的共价化合物与离子化合物

常见的共价化合物与离子化合物你有没有想过,化学里的那些物质,怎么就能让我们身边的世界变得如此精彩?别说你没想过,化学无处不在,可能你每天都和它打交道呢。
比如说,水,我们都知道它是H₂O的化学式吧?可是你知道吗?这水里可藏着一种“隐秘的力量”,它可是由两种非常不同的物质组成的。
一边是氧,另一边是氢,氧嘛,通常喜欢“拽”一点,氢则有点软弱,基本上就是氧在主导,氢乖乖的跟在后头。
你看这就是一个典型的共价化合物:氧和氢通过共用电子,组建了一座“桥梁”,从而形成了水。
真是巧妙!这就是共价化合物的一大特色,原子们手牵手,相互分享自己的电子,组成了一个个稳定的小团队,谁也不抢谁的风头,真是和谐得很!再说说离子化合物,哎哟,这可就有点火药味儿了。
你想想,盐,就是我们常吃的食盐,它是NaCl,也就是氯化钠。
你要是看看它背后发生的故事,简直可以写成一部惊险小说。
钠和氯本来两个都挺“倔”的,各自都有自己的“主权”,但是呢,钠这个家伙,特别“怕”丢掉自己的电子,一看氯那边有点贪心,直接就把电子给甩过去了。
钠一甩手,电子就飞到氯那儿,结果呢?钠变成了一个带正电的阳离子,氯则成了一个带负电的阴离子。
这两个人,虽然各自变了模样,但就这么一来一往,两个电荷互相吸引,没一会儿就形成了一个稳定的离子化合物——盐。
哇,这场交换可有点儿“狠”,钠就这样变了样,氯也完成了“逆袭”。
你瞧,这不就是离子化合物的魅力吗?两种物质通过交换电子,达成了某种“协议”,结果变得比之前还要牢靠!这两种化合物,看似是两种截然不同的存在,但其实它们背后都遵循着一个共同的规则:它们都想追求稳定。
所以说,无论是共价化合物还是离子化合物,其实都在“为了更好地生活”努力着。
只是它们的方式不同罢了。
共价化合物那种温文尔雅,彼此谦让的方式,真是让人觉得温馨而美好。
而离子化合物呢,直接、粗暴,但是有效。
像是两种性格迥异的朋友,打个比方,想象一下:一个是温文尔雅的学者,另一个是直接粗犷的商人,最终都会为了达成某种目的,而找到最适合自己的方式,达成了“和谐共处”。
离子化合物和共价化合物的判断规律

离子化合物和共价化合物的判断规律Jenny was compiled in January 2021离子化合物和共价化合物的判断规律一.根据元素性质判断活泼的金属元素和活泼的非金属元素之间易形成离子键,它们形成的化合物即为离子化合物。
非金属元素形成的化合物一般为共价化合物。
说明:①活泼金属有:第ⅠA 族和第ⅡA 族元素;②活泼非金属有:N 、O 、S 及第Ⅶ族元素。
例如:NaCl 、CaO 、Mg 3N 2是离子化合物;HCl 、H 2SO 4、HNO 3是共价化合物。
二、从化合物的分类情况判断金属氧化物(如K 2O 、Na 2O 、Na 2O 2等)、强碱(如NaOH 、KOH 等)和绝大多数的盐是离子化合物;气态氢化物、非金属氧化物(SiO 2除外)、酸等是共价化合物。
二.根据化合物的熔沸点判断常温下是气态或液态的化合物一定是共价化合物。
例如HCl 、H 2O 是共价化合物。
三.根据化合物的导电性判断熔融状态下能导电的化合物是离子化合物。
四.根据化合物的类型判断①常见的盐中绝大多数都是离子化合物,少数的盐是共价化合物。
如AlCl 3、BeCl 2是共价化合物。
②常见的强碱都是离子化合物,弱碱是共价化合物。
如NaOH 、KOH 、Ca(OH)2、Ba(OH)2等强碱是离子化合物,Cu(OH)2、Fe(OH)3等弱碱是共价化合物。
③活泼金属的氧化物、过氧化物是离子化合物,其他的氧化物、过氧化物一般是共价化合物。
如MgO 、CaO 等是离子化合物;SO 2、SiO 2等是共价化合物。
④活泼金属的氢化物是离子化合物,其他的氢化物是共价化合物。
如NaH 、CaH 2是离子化合物,HCl 、H 2O 是共价化合物。
五.典例解析例1下列物质中属于离子化合物的是()A.苛性钾B.碘化氢C.硫酸D.醋酸解析:苛性钾即氢氧化钾,属于强碱,为离子化合物;碘化氢属于气态氢化物,为共价化合物;C、D中两种酸属于共价化合物。
化学必修2共价化合物和离子化合物课件

离子化合物和共价化合物的比较
学习小结
化合物类别
离子化合物
共价化合物
概念
含有离子键的化合物
只含有共价键的化合物
化学键类型 离子键,可能含有共价键
共价键
熔、沸点 硬度 导电性
较高
一般较低,个别很高(如SiO2)
较大
一般较小,个别很大(如SiO2)
熔融状态下不导电,溶于水有的 熔融状态下或水溶液中导电
导电(如酸),有的不导电(如酒精)
2.C、H、O、Cl、Na五种元素相互结合,写出符合下列条件的化学式: (1)由两种元素组成的离子化合物(写三种):
NaCl、Na2O、Na2O2 (2)由两种元素组成的共价化合物(写六种):
CH4、H2O、H2O2、HCl、CCl4、CO2
(3)由三种元素组成的离子化合物(写三种): NaOH、Na2CO3、NaClO
离子化合物和共价化合物的比较
化合物类别
离子化合物
概念
化学键类型
熔、沸点
硬度
导电性
熔化时破坏的 作用力
学习小结
共价化合物
离子化合物和共价化合物的比较
化合物类别
离子化合物
概念
含有离子键的化合物
化学键类型
熔、沸点
硬度
导电性
熔化时破坏的 作用力
学习小结
共价化合物
离子化合物和共价化合物的比较
化合物类别
离子化合物
导电(如酸),有的不导电(如酒精)
熔化时破坏的 作用力
一定破坏离子键
一般不破坏共价键
离子化合物和共价化合物的比较
学习小结
化合物类别
离子化合物
共价化合物
ห้องสมุดไป่ตู้概念
离子化合物与共价化合物辨析

离子化合物与共价化合物辨析离子化合物与共价化合物的相邻原子之间都存在着强烈的相互作用,但在学习中同学们很容易混淆两个概念,因此解题也容易出错,本文从几个方面进行辨析,以便大家更快掌握其区别。
一、概念1、离子化合物:由阴阳离子形成的化合物,如氯化钠2、共价化合物:原子间通过公用电子对形成分子的化合物,如氯化氢二、快速辨析习题:下列哪些是离子化合物哪些是共价化合物?H2SO4、NaF、NaOH、H2O2、CO2、CH4、Na2O2、PCl3、K2O、CaO、NH4Cl、BeCl2、AlCl3、FeCl3、HCl、H2O、Na2S、H2判断方法:离子化合物:(1)绝大多数盐、强碱、活泼金属氧化物(2)活泼金属元素(IA、IIA)和活泼非金属元素(VIA、VIIA)(包括原子团)形成化合物(3)特例:NH4Cl(注:既有离子键又有共价键)(4)熔融状态下能导电的化合物所以离子化合物如下:NaF、NaOH、Na2O2、 K2O、CaO、NH4Cl、Na2S共价化合物:(1)一般非金属元素与非金属元素间形成化合物(包括原子团)(2)特例:BeCl2、AlCl3、FeCl3 是共价化合物(3)所有的酸所以共价化合物如下:H2SO4、H2O2、CO2、CH4、PCl3、BeCl2、AlCl3、FeCl3、HCl、H2O注:H2 虽然是共价键形成的,但是它不是化合物不能误归为共价化合物中。
二、化学键区别、HCl可见,当离子键和共价键同时出现在化合物中,根据离子键优先原则,该化合物为离子化合物,所以离子化合物可有共价键,共价化合物一定没有离子键。
三、电子式书写区别书写离子化合物电子式时,简单阴离子要标出其最外层所有电子,然后加中括号,并标明所带电荷的种类和数目;简单阳离子只需要在元素符号的右上角标明所带电荷的种类和数目在书写共价化合物电子式时,要标出原子之间的成键情况(最外层电子及形成的共用电子对),不标电荷。
下载点数+2: (舒童 2009-3-28 10:39:34) 要学生重点掌握住几个常见的如:氢氧化钠、过氧化钠、四氯化碳、氯化铵、双氧水电子式的书写很有用处,它们体现了化学键的特点。
离子化合物和共价化合物的定义

离子化合物和共价化合物的定义
作为化学反应的基本组成单位,化合物包括离子化合物和共价化合物,它们具有不同的结构和性质。
一、离子化合物:
离子化合物是由亲离子和补离子组成的化合物,它们多余由金属离子
和非金属离子组成。
这类化合物特别容易产生,由于金属离子很容易
负偶素,而非金属离子很容易形成正离子,这就使得它们能够组合成
八面体,十二面体以及更复杂的结构。
常见的离子化合物有氯化钠、
氯化铵等。
二、共价化合物:
共价化合物是由共价键组成的化合物,它们由两个原子通过共享一对
电子而形成的化合物。
它们的分子结构是相当稳定的,几乎不会被极
性沮丧和电荷分解,而且非常稳定。
常见的共价化合物有甲醛、乙醇、氯乙烯等。
总之,离子化合物和共价化合物是两类十分重要的化合物,它们在化
学过程中发挥了重要作用,是无法缺少的重要组成部分,也是我们日
常生活中非常重要的一部分。
共价化合物和离子化合物

共价化合物和离子化合物集团文件版本号:(M928-T898-M248-WU2669-I2896-DQ586-M1988)共价化合物和离子化合物(2006-08-12 09:51:05)共价化合物和离子化合物一、???????? 定义:共价化合物是原子间以共用电子对所组成的化合物。
不含有金属元素或铵根的化合物一定是共价化合物。
此外氯化铝氯化铁氯化铜氢氧化铁高锰酸二氧化猛虽然含有金属元素,但也是共价化合物。
离子化合物由阳离子和阴离子组成的化合物一般情况下:除氯化铝氯化铁氯化铜氢氧化铁高锰酸二氧化猛外。
含有金属元素或铵根的化合物是离子化合物。
二、区别:1、离子化合物都是电解质,且在水溶液和熔融状态下都可以导电共价化合物不都是电解质,若为电解质的在熔融状态下不可导电2、分子晶体和原子晶体都属于共价化合物。
并且分子晶体彼此间引力较小所以在常温常压下往往易于扩散,形成气体;而离子化合物都是由许多带不同电荷的离子以静电引力彼此吸引着、引力较大,所以在常温常压下往往形成固体,硬度较大,质脆,难于压缩,难挥发。
原子晶体通常也为固体。
例1:氯化物一定是共价化合物吗?错,氯化钠是离子化合物。
例2:铝化物一定是共价化合物吗?错,氧化铝是离子化合物。
例3:非金属元素形成的化合物都是共价化合物吗?错,氨盐没有金属元素,但它是离子化合物例4:HNO3, H2SO4 ,H2SO3是共价化合物还是离子化合物?是共价化合物。
既不是金属化合物,又不是铵根盐。
例5:共价化合物都是分子晶体吗?错,二氧化硅晶体中,有一些电子是公用的,所以对每一个原子而言电子数量不变,那么就没有出现离子。
所以说二氧化硅是由原子直接构成,而且SiO2的结构类似于金刚石。
所以原子晶体,不一定为单质.例6:下列能说明氯化氢是共价化合物的事实是?A.氯化氢不易分解 B.液态氯化氢不导电 C.氯化氢溶于水发生电离 D.氯化氢水溶液显酸性注1:共价键与离子键之间本并没有绝对的区别。
共价化合物和离子化合物还有共价键的概念

标题:共价化合物和离子化合物:理解共价键的概念一、介绍在化学中,化合物可以分为共价化合物和离子化合物两种类型。
这两种化合物都与共价键密切相关,而理解共价键的概念对于我们深入研究化学反应和物质特性至关重要。
本文将从浅入深地探讨共价化合物和离子化合物以及共价键的概念,帮助读者更好地理解这一重要的化学知识。
二、共价化合物和离子化合物的定义1. 共价化合物共价化合物是由两种或两种以上非金属元素组成的化合物,它们之间通过共用电子对形成共价键。
共价键的形成使得原子之间形成更加稳定的结构,共价化合物的性质通常较为稳定。
2. 离子化合物离子化合物是由金属和非金属元素组成的化合物,它们之间通过离子键相互连接。
离子化合物通常会形成离子晶体结构,并且具有良好的电导性和溶解性。
三、共价键的概念1. 共价键的形成共价键是由原子之间共享电子对形成的化学键,共享电子对的形成使得原子能够填补各自的外层电子壳,并且形成更加稳定的结构。
2. 共价键的特性共价键具有一定的极性,不同原子之间的电负性差异会导致共价键的极性不同。
而且共价键的强度和稳定性也会受到各种因素的影响。
四、深入探讨共价化合物和离子化合物1. 共价化合物和离子化合物的性质共价化合物通常具有较高的沸点和熔点,而且它们在水中的溶解度通常较低。
而离子化合物则具有良好的电导性和溶解性。
2. 共价化合物和离子化合物的应用共价化合物在有机化学中具有重要的应用价值,而离子化合物在材料科学和电化学中具有广泛的应用。
五、我的个人观点和理解在我看来,共价化合物和离子化合物的形成过程和性质差异使得它们在化学反应和应用中具有不同的作用。
理解共价键的概念对于我们深入研究化学知识、探索新材料具有重要的意义。
六、总结通过本文的探讨,我们对共价化合物和离子化合物以及共价键的概念有了更深入的认识。
希望本文能够帮助读者更加全面、深入地理解这一重要的化学知识。
在本文中,我们深入探讨了共价化合物和离子化合物,以及共价键的概念。
离子化合物和共价化合物

离子化合物和共价化合物
离子化合物与共价化合物差异
1、离子化合物都是电解质,且在水溶液和熔融状态下都可以导电;共价化合物不都是电解质,若为电解质的在熔融状态下不可导电。
2、分子晶体和原子晶体都属于共价化合物。
并且分子晶体彼此间引力较小所以在常温常压下往往易于扩散,形成气体;而离子化合物都是由许多带不同电荷的离子以静电引力彼此吸引着、引力较大,所以在常温常压下往往形成固体,硬度较大,质脆,难于压缩,难挥发。
原子晶体通常也为固体。
怎么区分离子化合物与共价化合物
共价化合物是通过共用电子对形式结合,主要由非金属与非金属元素化合形成,所有的酸都是共价化合物,少部分盐类是共价化合物,非金属氧化物是共价化合物,而Be2Cl2,AlCl3是共价化合物,作为特例。
离子化合物主要由金属与非金属元素化合形成,所有的碱都是离子化合物,大部分盐类是离子化合物,金属氧化物是离子化合物,NH4CL是离子化合物,作为特例!
离子化合物的熔点沸点较高,质硬而脆,共价化合物熔点沸点较低,硬度小,这个主要和作用力有关,离子化合物是通过离子键结合的,而共价化合物是通过分子间作用力结合的。
分子间作用力能量远远小于离子键。
另外,含有离子键的化合物肯定是离子化合物,离子化合物可能含有共价键,如NaOH,共价化合物只含共加价。
离子化合物 共价化合物知识点归纳

离子化合物的存在形式
1、活泼金属与活泼的非金属元素之间形成的化合物
2、金属元素与酸根离子之间形成的化合物。
(酸根离子SO42-、NO3-、CO32-
3、铵根离子(NH4+)和酸根离子之间,或铵根离子与非金属元素之间,
例如NH4Cl、NH4NO3。
4、NaH,KH等活泼金属氢化物。
离子化合物都是强电解质。
在熔融状态下:都可以导电(此类物质加热时易分解或易氧化)。
在水中:有的可以导电,有的不可以导电(此类物质易与水反应或不溶于水)。
在原电池中的作用:形成闭合电路。
常见的离子化合物
许多碱NaOH、KOH、Ba(OH)2
许多盐CaCl2、KNO3、CuSO4、NaCl、KF,
某些碱性氧化物Na2O、K2O
共价化合物:主要以共价键结合形成的化合物。
1、不同种非金属元素的原子结合形成的化合物(如CO
2、ClO2、B2H6、BF
3、NCl3
2、大多数有机化合物
非金属氢化物(如HCl、H2O、NH3等)、
非金属氧化物(如CO2、SO3等)
无水酸(如H2SO4、HNO3等)、
大多数有机化合物(如甲烷、酒精、蔗糖等)都是共价化合物。
共价化合物和离子化合物的区别方法

共价化合物和离子化合物的区别方法一、共价化合物和离子化合物的基本概念。
1.1 共价化合物。
共价化合物啊,就是原子之间靠共用电子对结合在一起的化合物。
就好比几个小伙伴,大家一起分享一些东西(电子),然后就形成了一个小团体(化合物)。
像水(H₂O),氢原子和氧原子就是通过共用电子对结合的。
在这个过程中,原子们都没有完全失去或者得到电子,而是大家商量着来,共享资源,很有点合作共赢的感觉。
1.2 离子化合物。
离子化合物可就不一样喽。
它是由阳离子和阴离子组成的化合物。
这就像是一场“抢夺电子”的大战,一些原子特别“强势”,把别的原子的电子抢过来,这样就形成了阳离子和阴离子。
比如说氯化钠(NaCl),钠原子把自己的一个电子给了氯原子,钠原子变成了带正电的钠离子,氯原子变成了带负电的氯离子,然后阴阳离子因为电荷的吸引就结合在一起了。
二、区别方法。
2.1 从组成元素来看。
2.1.1 共价化合物。
共价化合物通常是由非金属元素组成的。
当然啦,也有一些特殊情况,像氯化铝(AlCl₃)虽然含有金属元素铝,但它却是共价化合物。
这就像是在一群非战斗人员(非金属元素)里混进了一个看似很能打的(金属元素铝),但实际上这个能打的也和大家一起搞合作(形成共价键),而不是去抢夺电子。
2.1.2 离子化合物。
离子化合物呢,一般是由金属元素和非金属元素组成的。
金属元素就像是一群强壮的大汉,非金属元素就像比较弱小的群体,大汉们把弱小群体的东西(电子)抢走,就形成了离子,然后结合成离子化合物。
不过也有铵盐这种特殊的离子化合物,铵根离子(NH₄⁺)虽然没有金属元素,但它就像一个“伪装成金属离子的团队”,和阴离子结合形成离子化合物。
2.2 从物理性质来看。
2.2.1 共价化合物。
共价化合物大多是分子晶体,它们的熔点和沸点通常比较低。
这就好比它们之间的结合力比较小,就像一群松散的小伙伴,稍微给点热,就各自跑开了。
像二氧化碳(CO₂),在常温常压下是气体,熔点和沸点都很低。
离子化合物和共价化合物的区别和举例说明
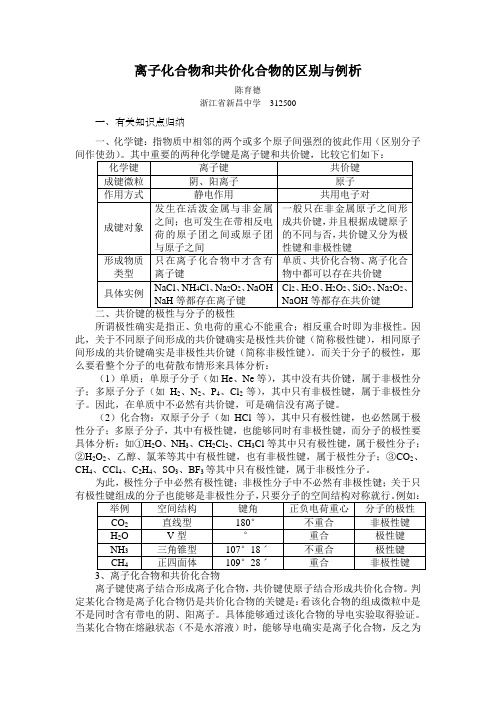
离子化合物和共价化合物的区别与例析陈育德浙江省新昌中学312500一、有关知识点归纳一、化学键:指物质中相邻的两个或多个原子间强烈的彼此作用(区别分子所谓极性确实是指正、负电荷的重心不能重合;相反重合时即为非极性。
因此,关于不同原子间形成的共价键确实是极性共价键(简称极性键),相同原子间形成的共价键确实是非极性共价键(简称非极性键)。
而关于分子的极性,那么要看整个分子的电荷散布情形来具体分析:(1)单质:单原子分子(如He、Ne等),其中没有共价键,属于非极性分子;多原子分子(如H2、N2、P4、Cl2等),其中只有非极性键,属于非极性分子。
因此,在单质中不必然有共价键,可是确信没有离子键。
(2)化合物:双原子分子(如HCl等),其中只有极性键,也必然属于极性分子;多原子分子,其中有极性键,也能够同时有非极性键,而分子的极性要具体分析:如①H2O、NH3、CH2Cl2、CH3Cl等其中只有极性键,属于极性分子;②H2O2、乙醇、氯苯等其中有极性键,也有非极性键,属于极性分子;③CO2、CH4、CCl4、C2H4、SO3、BF3等其中只有极性键,属于非极性分子。
为此,极性分子中必然有极性键;非极性分子中不必然有非极性键;关于只离子键使离子结合形成离子化合物,共价键使原子结合形成共价化合物。
判定某化合物是离子化合物仍是共价化合物的关键是:看该化合物的组成微粒中是不是同时含有带电的阴、阳离子。
具体能够通过该化合物的导电实验取得验证。
当某化合物在熔融状态(不是水溶液)时,能够导电确实是离子化合物,反之为共价化合物。
因为,熔融状态下,离子化合物中的离子键被破坏,从而使阴、阳离子自由运动,在通电时表现导电。
而共价化合物在熔融状态下仍然没有离子,不能导电。
可是,在水溶液的条件下,许多共价化合物也能够发生电离而表现导电。
(1)离子化合物中不必然有金属元素,如铵盐(NH 4Cl 、NH 4H 等),组成上没有金属元素,可是存在离子键,属于离子化合物。
共价化合物、离子化合物

金属与非金属形成共价化合物AlCl3,AlBr3,AlI3,FeCl3,FeBr3,AuCl3,HgCl2,Hg2Cl2,醋酸铅,Mn2O7从规律上来说,除了铵盐,金属和非金属结合形成的化合物是离子化合物,但要记住几个特殊的。
三氧化二铝,三氧化二铍,氮化铝,是原子晶体,就是原子之间全部以共价键结合,是共价化合物。
金属晶体,原子晶体,分子晶体,离子晶体。
金属晶体和分子晶体你能找到吧,所以,如果不是原子晶体(原子晶体是共价化合物),那肯定就是离子晶体。
高中阶段的原子晶体有:晶体硼,晶体硅,晶体锗,金刚石,碳化硅,氮化硼,氮化铝,氮化硅,氧化铝,二氧化硅,离子化合物由阳离子和阴离子构成的化合物。
活泼金属(如钠、钾、钙、镁等)与活泼非金属(如氟、氯、氧、硫等)相互化合时,活泼金属失去电子形成带正电荷的阳离子(如Na+、K+、Ca2+、Mg2+等),活泼非金属得到电子形成带负电荷的阴离子(如F-、Cl-、O2-、S2-等),阳离子和阴离子靠静电作用形成了离子化合物。
例如,氯化钠即是由带正电的钠离子(Na+)和带负电的氯离子(Cl-)构成的离子化合物。
也有的是共价化合物。
许多碱(如NaOH、KOH、Ba(OH)2等)和盐(如CaCl2、KNO3、CuSO4 等)都是离子化合物。
在离子化合物里阳离子所带的正电荷总数等于阴离子所带的负电荷总数,整个化合物呈电中性。
多数离子化合物在固态(或晶态)时不能导电,而它的水溶液或熔融状态则能导电。
离子化合物一般说来,熔点和沸点较高,硬度较大,质脆,难于压缩,难挥发。
某些碱性氧化物,如Na2O、K2O,常见的盐类如NaCl、KF,常见的碱,如NaOH等都属于离子化合物。
常见的离子化合物常见的离子化合物:NaCl,CsCl,Na2O2,NH4Cl酸碱,以及大多数的盐~!并不是所有的碱盐!存在形式离子化合物(ionic compound)是存在于: 1、活泼金属(指第一和第二主族的金属元素)与活泼的非金属元素(指第六和第七主族的元素)之间形成的化合物(但也不全是,比如AlCl3就是共价化合物);2、金属元素与酸根离子之间形成的化合物。
离子化合物和共价化合物

第五节 离子化合物和共价化合物一、离子化合物:1、钠在氯气中燃烧,生成氯化钠: 钠 +氯气二—氯化钠2Na + C2 — 2NaCI2、钠与氯的反应过程(离子的形成过程)3、离子:(1) 、离子;带电的原子或原子团叫做离子。
(2) 、阳离子:带正电的离子叫做阳离子。
(3) 、阴离子:带负电的离子叫做阴离子。
(4) 、离子的表示法:在元素(或原子团)的符号右上角标出所带的电荷数及电性。
ClNa+11 2 172818 Na +标法“—”。
如 A 13+、Ca2+、Na+; C-、O2-、2HCISQ 2-、PQ 3-等,只带1个单位电荷时,数字“1”不写 (5) 、离子的读法:读作“带几个单位的正(负)电荷的某离子”。
如“Al 3+”读作“带3个单位 正荷的铝离子” ;“ CF ”读作“带2个单位正电荷的钙离子” ;“Na + ”读作“带 1个单位正电荷的钠离子” ;“C 「”读作“带1个单位负电荷的氯离子”;“02「” 读作“带2个单位负电荷的氧离子” ;“SQ 2-”读作“带2个单位负电荷的硫酸 根离子“;“PQ 3-”读作“带3个单位负电荷的磷酸根离子”。
4、 离子化合物:由阴、阳离子相互作用而构成的化合物,叫做离子化合物 。
如前面讲到的NaCl 就是离子化合物。
5、 电子式: (1)、电子式:在元素符号周围用小黑点(或x )来表示原子的最外层电子的图示叫做电子(2)、用电子式表示氯化钠和氯化镁的形成过程:Na-^T^ci : —► Nacr+xMgx +a、共价化合物: 1、氢气+氯气.氯化氢H 2 + CL ? 2、氯化氢的形成过程;3、共用电子对:电子对为两个原子所共用,在两个原子核外的空间运动,从而使双方最外层都达到稳定结构,这种电子对,叫做共用电子对。
4、共价化合物:以共用电子对形成分子的化合物叫做共价化合物。
5、共价化合物元素原子的电性:在共价化合物里,元素的原子核电荷数多的吸引共用电子对的能力强?..共用电子对偏向它,.显负电;原子核.电荷数少.的吸•引共用.电子对.的能力弱.,..共用电子对偏离它,显正电。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
金属与非金属形成共价化合物AlCl3,AlBr3,AlI3,FeCl3,FeBr3,AuCl3,HgCl2,Hg2Cl2,醋酸铅,Mn2O7从规律上来说,除了铵盐,金属和非金属结合形成的化合物是离子化合物,但要记住几个特殊的。
三氧化二铝,三氧化二铍,氮化铝,是原子晶体,就是原子之间全部以共价键结合,是共价化合物。
金属晶体,原子晶体,分子晶体,离子晶体。
金属晶体和分子晶体你能找到吧,所以,如果不是原子晶体(原子晶体是共价化合物),那肯定就是离子晶体。
高中阶段的原子晶体有:晶体硼,晶体硅,晶体锗,金刚石,碳化硅,氮化硼,氮化铝,氮化硅,氧化铝,二氧化硅,离子化合物由阳离子和阴离子构成的化合物。
活泼金属(如钠、钾、钙、镁等)与活泼非金属(如氟、氯、氧、硫等)相互化合时,活泼金属失去电子形成带正电荷的阳离子(如Na+、K+、Ca2+、Mg2+等),活泼非金属得到电子形成带负电荷的阴离子(如F-、Cl-、O2-、S2-等),阳离子和阴离子靠静电作用形成了离子化合物。
例如,氯化钠即是由带正电的钠离子(Na+)和带负电的氯离子(Cl-)构成的离子化合物。
也有的是共价化合物。
许多碱(如NaOH、KOH、Ba(OH)2等)和盐(如CaCl2、KNO3、CuSO4 等)都是离子化合物。
在离子化合物里阳离子所带的正电荷总数等于阴离子所带的负电荷总数,整个化合物呈电中性。
多数离子化合物在固态(或晶态)时不能导电,而它的水溶液或熔融状态则能导电。
离子化合物一般说来,熔点和沸点较高,硬度较大,质脆,难于压缩,难挥发。
某些碱性氧化物,如Na2O、K2O,常见的盐类如NaCl、KF,常见的碱,如NaOH等都属于离子化合物。
常见的离子化合物常见的离子化合物:NaCl,CsCl,Na2O2,NH4Cl酸碱,以及大多数的盐~!并不是所有的碱盐!存在形式离子化合物(ionic compound)是存在于: 1、活泼金属(指第一和第二主族的金属元素)与活泼的非金属元素(指第六和第七主族的元素)之间形成的化合物(但也不全是,比如AlCl3就是共价化合物);2、金属元素与酸根离子之间形成的化合物。
(酸根离子如硫酸根离子SO42-、硝酸根离子NO3-、碳酸根离子CO32-等等);3、铵根离子(NH4+)和酸根离子之间,或铵根离子与非金属元素之间,例如NH4Cl、NH4NO3。
离子化合物都是强电解质。
在熔融状态下:都可以导电(此类物质加热时易分解或易氧化)。
在水中:有的可以导电,有的不可以导电(此类物质易与水反应或不溶于水)。
在原电池中的作用:形成闭合电路!与共价化合物的关系离子化合物和共价化合物都涉及到电子的移动。
离子化合物是通过离子键形成的化合物,离子键是由电子转移(失去电子者为阳离子,获得电子者为阴离子)形成的。
即正离子和负离子之间由于静电作用所形成的化学键。
而共价化合物是通过共用电子构成的共价键结合而成的化合物,共价键是化学键的一种,两个或多个原子共同使用它们的外层电子,在理想情况下达到电子饱和的状态,由此组成比较稳定和坚固的化学结构叫做共价键。
与离子键不同的是进入共价键的原子向外不显示电性,因为它们并没有获得或损失电子。
共价键的强度比氢键要强,与离子键差不太多或甚至比离子键强。
常见的离子化合物:NaCl,CsCl,Na2O2,NH4Cl碱,以及大多数的盐!并不是所有的酸、碱、盐区分离子化合物离子化合物由阳离子和阴离子组成的化合物。
活泼金属(如钠、钾、钙、镁等)与活泼非金属(如氟、氯、氧、硫等)相互化合时,活泼金属失去电子形成带正电荷的阳离子(如Na+、K+、Ca2+、Mg2+等),活泼非金属得到电子形成带负电荷的阴离子(如F-、Cl-、O2-、S2-等),阳离子和阴离子靠静电作用形成了离子化合物。
例如,氯化钠即是由带正电的钠离子(Na+)和带负电的氯离子(Cl-)构成的离子化合物。
许多碱(如NaOH、KOH、Ba(OH)2等)和盐(如CaCl2、KNO3、CuSO4 等)都是离子化合物。
在离子化合物里阳离子所带的正电荷总数等于阴离子所带的负电荷总数,整个化合物呈电中性。
多数离子化合物在固态(或晶态)时不能导电,而它的水溶液或熔化状态则能导电。
离子化合物一般说来,熔点和沸点较高,硬度较大,质脆,难于压缩,难挥发。
某些碱性氧化物,如Na2O、K2O,常见的盐类如NaCl、KF,常见的碱,如NaOH 等都属于离子化合物。
离子化合物是存在于1、活泼金属(指第一和第二主族的金属元素)与活泼的非金属元素(指第六和第七主族的元素)之间形成的化合物。
2、金属元素与酸根离子之间形成的化合物。
(酸根离子如硫酸根离子、硝酸根离子、碳酸根离子等等)3、铵根离子(NH4+)和酸根离子之间,或铵根离子与非金属元素之间。
共价化合物存在于非金属元素之间,对于由两种元素形成的化合物。
如果存在于同种非金属元素之间那么是非极性共价键,如是不同种元素之间形成的是极性共价键,他们都是共价化合物。
离子化合物都是电解质,且在水溶液和熔融状态下都可以导电。
在原电池中的作用:形成闭合电路!离子化合物中一定含有至少一个离子键,并且可能同时含有共价键。
区分离子化合物离子化合物由阳离子和阴离子组成的化合物。
活泼金属(如钠、钾、钙、镁等)与活泼非金属(如氟、氯、氧、硫等)相互化合时,活泼金属失去电子形成带正电荷的阳离子(如Na+、K+、Ca2+、Mg2+等),活泼非金属得到电子形成带负电荷的阴离子(如F-、Cl-、O2-、S2-等),阳离子和阴离子靠静电作用形成了离子化合物。
例如,氯化钠即是由带正电的钠离子(Na+)和带负电的氯离子(Cl-)构成的离子化合物。
许多碱(如NaOH、KOH、Ba(OH)2等)和盐(如CaCl2、KNO3、CuSO4 等)都是离子化合物。
在离子化合物里阳离子所带的正电荷总数等于阴离子所带的负电荷总数,整个化合物呈电中性。
多数离子化合物在固态(或晶态)时不能导电,而它的水溶液或熔化状态则能导电。
离子化合物一般说来,熔点和沸点较高,硬度较大,质脆,难于压缩,难挥发。
某些碱性氧化物,如Na2O、K2O,常见的盐类如NaCl、KF,常见的碱,如NaOH等都属于离子化合物。
离子化合物是存在于1、活泼金属(指第一和第二主族的金属元素)与活泼的非金属元素(指第六和第七主族的元素)之间形成的化合物。
2、金属元素与酸根离子之间形成的化合物。
(酸根离子如硫酸根离子、硝酸根离子、碳酸根离子等等)3、铵根离子(NH4+)和酸根离子之间,或铵根离子与非金属元素之间。
共价化合物存在于非金属元素之间,对于由两种元素形成的化合物。
如果存在于同种非金属元素之间那么是非极性共价键,如是不同种元素之间形成的是极性共价键,他们都是共价化合物。
离子化合物都是电解质,且在水溶液和熔融状态下都可以导电。
在原电池中的作用:形成闭合电路!离子化合物中一定含有至少一个离子键,并且可能同时含有共价键。
例如AlCl3含有金属元素,却是共价化合物。
其电子式如下此外还有Becl2(二氯化铍),FeCl3,SnCl4,GeCl4,HgCl2,OsO4,Pt(NH3)2Cl2等等虽然共价化合物的构成元素是一般非金属元素,但某些不活泼的金属元素和非金属之间也可以。
1.共价化合物共价化合物之一某些单质的分子也是依靠共用电子对形成的。
例如氯气的分子就是由两个氯原子各提供一个电子形成共用电子对,电子对同时受两个原子核的作用形成氯分子。
由于同种原子吸引电子能力相仿,电子对不偏向任何一方。
像氯化氢那样,以共用电子对(或共价键)结合在一起的化合物,叫做共价化合物。
如水H2O、二氧化碳CO2、氨NH3等都是常见的共价化合物。
共价化合物一般都是分子晶体,像氯化铝AlCl3是共价化合物。
(氯化铁,氯化汞,碘化银也是共价化合物)共价化合物之二共价化合物的分子是原子间以共用电子对所形成的[1]。
两种非金属元素原子(或不活泼金属元素和非金属元素)化合时,原子间各出一个或多个电子形成电子对,这个电子对受两个原子核的共同吸引,为两个原子所共有,使两个原子形成化合物分子。
例如,氯化氢是氢原子和氯原子各以最外层一个电子形成一个共用电子对而组成的化合物分子。
非金属氢化物(如HCl、H2O、NH3等)、非金属氧化物(如CO2、SO3等)、无水酸(如H2SO4、HNO3等)、大多数有机化合物(如甲烷、酒精、蔗糖等)都是共价化合物。
多数共价化合物在固态时,熔点、沸点较低,硬度较小。
当两种非金属元素的原子形成分子时,由于两个原子都有通过得电子形成8电子稳定结构的趋势,它们得电子的能力差不多,谁也不能把对方的电子夺过来,这样两个原子只能各提供一个电子形成共用电子对,在两个原子的核外空间运动,电子带负电,原子核带正电。
两个原子的原子核同时吸引共用电子对,产生作用力,从而形成了一个分子。
由于两个原子对电子的吸引能力不一样,共用电子对总是偏向得电子能力强的一方,这一方的原子略显负电性,另一方的原子略显正电性,作为整体,分子仍显电中性。
比较典型的共价化合物是水、氯化氢以及二氧化碳。
共用电子对总是偏向氧原子的一方,偏离氢原子的一方。
共价化合物一般硬度小,熔沸点低。
2.离子化合物离子化合物由阳离子和阴离子构成的化合物。
活泼金属(如钠、钾、钙、镁等)与活泼非金属(如氟、氯、氧、硫等)相互化合时,活泼金属失去电子形成带正电荷的阳离子(如Na+、K+、Ca2+、Mg2+等),活泼非金属得到电子形成带负电荷的阴离子(如F-、Cl-、O2-、S2-等),阳离子和阴离子靠静电作用形成了离子化合物。
例如,氯化钠即是由带正电的钠离子(Na+)和带负电的氯离子(Cl-)构成的离子化合物。
许多碱(如NaOH、KOH、Ba(OH)2等)和盐(如CaCl2、KNO3、CuSO4 等)都是离子化合物。
在离子化合物里阳离子所带的正电荷总数等于阴离子所带的负电荷总数,整个化合物呈电中性。
多数离子化合物在固态(或晶态)时不能导电,而它的水溶液或熔融状态则能导电。
离子化合物一般说来,熔点和沸点较高,硬度较大,质脆,难于压缩,难挥发。
某些碱性氧化物,如Na2O、K2O,常见的盐类如NaCl、KF,常见的碱,如NaOH等都属于离子化合物。
离子化合物是存在于:1、活泼金属(指第一和第二主族的金属元素)与活泼的非金属元素(指第六和第七主族的元素)之间形成的化合物。
2、金属元素与酸根离子之间形成的化合物。
(酸根离子如硫酸根离子、硝酸根离子、碳酸根离子等等)3、铵根离子(NH4+)和酸根离子之间,或铵根离子与非金属元素之间。
离子化合物都是强电解质,且在水溶液或熔融状态下都可以导电[1]。
在原电池中的作用:形成闭合电路!*离子化合物与共价化合物的关系离子化合物和共价化合物都涉及到电子的移动。
