TNF简介(发展史、生物学活性、抗肿瘤机制)
肿瘤坏死因子英文缩写

肿瘤坏死因子英文缩写肿瘤坏死因子英文缩写是“TNF”,是一种广泛存在于各类细胞中,能够调节细胞增殖、分化、凋亡及免疫功能等多种生理过程的重要蛋白质。
TNF通过与其受体相互作用,引发一系列的生物反应,进而产生抗病毒、抗血管生成、诱导细胞凋亡等多种生物功能,因此在免疫调节、炎症反应、癌症等多种疾病的发生和发展过程中起着至关重要的作用。
1. TNF的发现和结构TNF是在20世纪70年代初由美国科学家发现的,最早被鉴定出来的是TNF-α和TNF-β两种亚型。
在细胞外,TNF主要是一种非可溶性膜蛋白,具有分子量为26kD的单体,或者是分子量为52kD的双体。
同时,TNF也可以在多种细胞类型之间通过细胞间泡运输进行传递。
2. TNF的生物学功能TNF除了充当一种免疫调节因子外,还具有多种生物学功能。
其中包括:(1)抗病毒功能:TNF可以诱导细胞产生抗病毒蛋白,协同另一种重要的免疫蛋白质,即干扰素(IFN),对病毒产生干扰和杀伤作用。
(2)炎症反应:TNF能够触发和调节免疫细胞产生炎性因子,如IL-1、IL-6、IL-8等,参与炎症反应的调控。
(3)细胞凋亡:TNF可以减少生长因子的作用,并引发细胞的凋亡,从而起到肿瘤抑制和免疫应答的作用。
3. TNF在疾病中的作用由于TNF在生物互作中发挥的作用十分重要,因此当其功能发生异常时,往往会导致一些疾病的发生和发展。
比如:(1)炎性疾病:TNF会不断对机体产生刺激,导致炎症的加剧,如炎症性肠病、类风湿关节炎等。
(2)癌症:TNF可以诱导细胞凋亡,在肿瘤治疗中有一定的作用,但是过度激活TNF的作用也可能导致肿瘤细胞对其产生抵抗性,从而提高肿瘤的生存率。
4. TNF在药物研究中的应用由于TNF在多个生理过程中发挥了重要的作用,因此目前已经有多个针对TNF的治疗药物被研发出来。
例如,抗TNF-α单克隆抗体是用于治疗炎性疾病,如类风湿关节炎等疾病的常规药物之一。
此外,还有一些其他新型药物正在开发中,如针对TNF受体的小分子药物等。
TNF与依纳西普

TNF与依纳西普作者:杨浩然专业:生基学号:14403820摘要:简要介绍肿瘤坏死因子(TNF)的结构和生物学活性,及其在体内进行细胞信号传导的作用机制,并介绍TNF在类风湿性关节炎等自身免疫病中的可能作用。
简要说明TNF抑制剂依那西普的结构及其作用机理。
目前普遍认为,TNF最早是1975年由Carswell发现的。
Carswell在研究中观察到,经卡介苗致敏的小鼠被注射大肠杆菌内毒素后,血清中出现一种物质,该物质在体内可以使移植肿瘤发生出血、坏死,遂将该物质命名为肿瘤坏死因子(tumor necrosis factor, TNF)。
TNF主要由活化的巨噬细胞,NK细胞及T淋巴细胞产生。
1985年Shalaby把巨噬细胞产生的TNF命名为TNF-α,把T淋巴细胞产生的淋巴毒素(lymphotoxin,LT)命名为TNF-β。
虽然TNF-α与TNF-β仅有约30%的同源性,但它们却拥有共同的受体。
TNF-α的生物学活性占TNF总活性的70 %~95 %,因此目前常说的TNF多指TNF-α[1]。
人类TNF-α基因于1985年成功克隆,定位于6p21.4,长约3.6 kbp,有4个外显子和3个内含子,与主要组织相容性复合体(MHC)基因紧密连锁位于HLA-B 和 HLA-C2 位点之间的 MHC3 类基因区内,由TNFA和TNFB组成,分别编码TNF -α和TNF-β。
位于启动子区238位和308位存在单核苷酸多态性,被认为可调节TNF的转录水平,与慢性乙肝、自身免疫性疾病、胰岛素抵抗、肿瘤等多种疾病的易感性相关。
TNF基因编码的mRNA约1.7 kbp,在其3`非翻译区有一段许多细胞因子都具有的保守TTATTTAT序列(AU富含元件,ARE)。
TNF-α前体由233个氨基酸组成(26 kDa),其中包含由76个氨基酸残基组成的信号肽,在TNF转化酶TACE的作用下,切除信号肽,形成成熟的157个氨基酸残基的TNF-α(17 kDa)。
肿瘤坏死因子(TNF

肿瘤坏死因子(TNF实验证明,人的单核细胞被内毒素刺激后可释放出一种物质,这种物质可使实验肿瘤和恶性肿瘤患者的肿瘤坏死,而被称为“肿瘤坏死因子(TNF)”。
肿瘤坏死因子存在于人血中,对败血症性休克、炎症、恶液质、抗癌和防御感染都能起作用。
这种肿瘤坏死因子可通过生物化学方法检出,而且发现与细胞毒性作用密切相关。
1987年国外对79例流脑患者血清肿瘤坏死因子进行测定,发现有18例肿瘤坏死因子阳性者,其肿瘤坏死因子含量均在10单位/毫升以上,最高可达119050单位/毫升;肿瘤坏死因子阳性病例中70%入院时均有败血症性休克。
在1—l例死亡者中,l0例肿瘤坏死因子阳性,仅存活的68例中,肿瘤坏死因子阳性者仅8例。
肿瘤坏死因子含量在440单位/毫升以上者全部死亡。
可见血清肿瘤坏死因子的浓度与流脑病情严重度有关。
而且可以作为判断预后的指标。
目前在国外提倡在流脑患者入院时常规测定血清肿瘤坏死因子浓度。
若血清肿瘤坏死因子浓度高,则预示有凶险的后果。
肿瘤坏死因子究竟是引起败血症休克发病的直接因素,还仅仅是败血症休克病理过程中的一种结果尚不清楚。
但是肿瘤坏死因子作为导致败血症性休克的发生,可能是一种主要中介因子。
探索肿瘤坏死因子的实质,将促使人们寻找清除血中肿瘤坏死因子或中和作用的治疗方法,以企图减少流脑败血症性休克的死亡率。
292.暴发型流脑与补体C3有何关系?补体是机体非特异免疫的重要因素,是—组具有酶活性的球蛋白。
C3是补体的重要成分,含量最高,且补体的两个激活途径均有C3参与。
补体在内毒素休克中起重要作用,对革兰氏阴性菌感染的患者,补体总量及C3含量下降。
根据研究,暴发型流脑休克,体内补体C3亦有明显变化,其补体系统的激活可能是通过激活C3旁路途径,即备解素途径;或由内毒素分子结构中类脂甲部分直接激活C3而激活经典途径。
观察暴发型流脑休克患者与健康人血清C3含量的测定结果,流脑组C3含量明显减低,两者差异非常显著,证明暴发型流脑休克不论其激活补体途径,是经典途径还是替代途径都消耗大量补体C3。
肿瘤坏死因子的研究进展

参考内容
摘要
肿瘤坏死因子(TNF)是一种重要的细胞因子,在免疫应答和炎症反应中发 挥关键作用。近年来,关于TNF的研究已取得显著进展,本次演示将重点其生物 学功能及其在临床应用中的前景。通过综述最新的研究结果,我们将有助于更深 入地了解TNF的生物学功能及其潜在应用。
引言
肿瘤坏死因子是一种能够诱导肿瘤细胞凋亡的细胞因子,其在免疫应答和炎 症反应中发挥关键作用。自TNF发现以来,大量研究致力于探讨其生物学功能和 临床应用。尽管TNF在某些情况下可促进肿瘤生长,但其主要作用仍是抑制肿瘤 细胞生长和诱导细胞凋亡。本次演示将重点综述TNF的生物学功能及其在临床应 用中的前景,以期为相关研究提供参考。
研究成果
虽然TNF在肿瘤治疗中的直接作用尚不清晰,但其与免疫反应的调控密切相 关。研究表明,TNF可以激活免疫细胞,促进肿瘤细胞的凋亡和坏死,进而诱导 抗肿瘤免疫反应。然而,过度的TNF活化也可能导致炎症反应和免疫病理损伤。 因此,针对TNF的免疫调节作用进行深入研究可能为肿瘤治疗提供新的策略。
历史回顾
自TNF被发现以来,其在肿瘤治疗领域的作用一直是研究的热点。早期的研 究主要集中在TNF-α,其在体外实验中具有显著的抗肿瘤活性。然而,临床试验 中,TNF-α的抗肿瘤效果并不显著,部分原因是其在体内的半衰期短,同时缺乏 特异性肿瘤靶向性。随后,TNF-β(也称为淋巴毒素)的研究也逐渐受到重视。 与TNF-α不同,TNF-β主要在淋巴细胞中表达,但其抗肿瘤作用却十分显著。
然而,TNF在肿瘤治疗中也存在一些挑战。例如,一些研究表明,长期使用 TNF可能会导致免疫抑制和炎症反应加重等问题。因此,针对TNF治疗肿瘤的研究 仍需权衡其利弊,以确定最佳治疗方案。
2、抗病毒治疗
TNF信号传导通路的分子机理

TNF信号传导通路的分子机理一、本文概述肿瘤坏死因子(TNF)是一种具有广泛生物活性的细胞因子,参与调控多种细胞过程和生物反应,包括细胞生长、分化、凋亡以及炎症反应等。
TNF信号传导通路是生物体内的重要信号转导系统,对维持细胞稳态和应对外部刺激具有关键作用。
本文旨在深入探讨TNF信号传导通路的分子机理,包括TNF受体的结构特点、信号转导过程的关键分子事件以及通路调控的分子机制等。
通过阐述这些基本问题,有助于我们更好地理解TNF在生物学中的作用,为相关疾病的预防和治疗提供理论支持。
在本文中,我们首先概述了TNF及其受体的基本结构和功能,为后续的信号传导分析奠定基础。
接着,我们详细描述了TNF信号传导通路的主要过程,包括受体激活、信号分子的招募与活化、转录因子的激活以及基因表达的调控等。
我们还探讨了通路中关键分子的作用机制,如TNF受体相关因子(TRAFs)、凋亡信号调节激酶1(ASK1)等。
我们总结了TNF信号传导通路在生物学中的意义,以及其在疾病发生发展中的作用,为未来的研究提供思路。
通过本文的阐述,读者可以对TNF信号传导通路的分子机理有更全面、深入的理解,为相关领域的研究提供有益的参考。
二、TNF及其受体TNF(肿瘤坏死因子)是一种重要的细胞信号分子,它在调节细胞生长、分化、凋亡以及免疫反应等多个生理和病理过程中发挥着关键作用。
TNF有两种主要形式,即TNF-α和TNF-β,其中TNF-α是研究的最为广泛和深入的。
TNF-α主要由活化的巨噬细胞产生,但也可由其他类型的细胞,如自然杀伤细胞、肥大细胞和成纤维细胞等在特定条件下分泌。
TNF通过与特定的受体结合来发挥其生物学效应。
TNF受体(TNFR)主要分为两类:TNFR1(也称为p55或CD120a)和TNFR2(也称为p75或CD120b)。
这两类受体在结构上有所差异,TNFR1包含一个死亡结构域,而TNFR2则含有一个TRAF(TNF受体相关因子)结合位点。
肿瘤坏死因子与其受体相互作用概述

肿瘤坏死因子与其受体相互作用概述摘要肿瘤坏死因子(tumor necrosis factor,简称TNF)是一种由巨噬细胞分泌的小分子蛋白,一种具有广泛意义的多肽因子。
TNF具有抗肿瘤的活性、免疫调节活性、抑制脂蛋白酯酶活性等多种生物学活性。
TNF的生物学活性是通过TNF受体(TNFR)产生的。
本文综述了肿瘤坏死因子TNF与其受体的相互作用和TNF研究的几个热点问题。
关键词肿瘤坏死因子TNF;TNFR;相互作用;生物学活性肿瘤坏死因子(tumor necrosis factor,简称TNF)最先发现于内毒素激活的巨噬细胞中,它是一种仅能杀死肿瘤细胞而不损伤正常细胞的因子,并且发现它能激活中性粒细胞,使其产生超氧化物,释放溶酶体酶,从而能够高效的杀死微生物[1, 2]。
这一发现,推进了微生物抗癌剂的研究。
近年来,肿瘤坏死因子引起各国学者的广泛关注,也取得了很大的研究进展。
研究发现TNF不仅具有促进肿瘤细胞坏死的作用,而且与休克TNF—α发热等免疫应答关系密切。
本文主要对TNF与其受体的相互作用和TNF的生物学作用的研究现状作简要概述。
1.肿瘤坏死因子TNF与其受体简介1.1 肿瘤坏死因子TNF肿瘤坏死因子TNF首先发现于1975年,Carswell等人发现实验性诱生肿瘤的动物被注射BCG后,再注射LPS,血清中会产生一种与内毒素无关,但可引起肿瘤细胞坏死的活性因子,被称为肿瘤坏死因子(Tumor Nerosis Factor ,简称TNF)[3]。
1984年Penica等人分离了人的TNF的cDNA[3]。
目前,人们根据内源性TNF的来源将其分为三种:TNF—α,TNF—β,TNF—γ。
TNF—α又称为恶质素,也是目前研究最多的一种,它不仅可以由巨噬细胞产生,其他细胞如上皮细胞、成纤维细胞、淋巴细胞、平滑肌细胞、肥大细胞、单核细胞和神经胶质细胞等在一定条件下亦有少量产生。
它不含糖基,由157种氨基酸组成,单体分子量约为1.7Kd,PI为5.3,折叠方式为类似三明治的同源三聚体,由两个反向平行的β折叠组成,位于69位和101位的Cys形成连内的二硫键从而把2个β片层连接起来。
肿瘤坏死因子-α(TNF-α)生物学活性测定

响。因为 TNF-β 细胞毒生物学作用等很多生物学效应均与 TNF-α 相似。
肿瘤坏死因子-α(TNF-α)是一种主要由单核-吞噬细胞产生的单核因子,不仅具有选择性 地杀伤某些肿瘤细胞,而且有多种免疫调节作用。其检测方法主要包括生物学活性测定和免 疫学检测方法。其中细胞毒生物学检测方法敏感性较高,最为常用;免疫学检测方法包括酶 联免疫吸附试验(ELISA)和放射免疫测定法。
(一) 原理: TNF-α 受体广泛地分布于多种肿瘤细胞和血细胞,根据 TNF-α 与相应靶细胞结合后引 起不同的生物学效应,建立了多种检测 TNF-α 生物学活性方法。某些肿瘤细胞膜表面的 TNF-α 受体与 TNF-α 结合后,可导致这些肿瘤细胞的死亡,可通过检测对肿瘤细胞的杀伤 能力,来反映 TNF-α 的生物学活性。若这种肿瘤细胞先用 3H-TdR 标记,则被杀伤后3H-TdR 释放至细胞外,牽 I 通过测定肿瘤细胞释放3H-TdR 的量来反映 TNF-α 的杀伤活性。 (二) 操作步骤:
用 DYQ-Ⅱ型多头细胞收集器收集样品于 "9999"型玻璃纤维滤纸上
↓ 烤干后,进行 β 计数
结果判定:
1. TNF-α 作用 24h 后,在倒置显微镜下判定 50%L929 细胞杀伤的稀释度即为1个
TNF-α 活性单位。
2. 根据测得的 cpm 值按下列公式计数活性单位:
TNF-α 活性单位(U/ml)
对照组 cpm 值。
3. 胰蛋白酶和 DNA 酶浓度和消化时间要严格控制,犆?批酶均要摸索最适浓度和时间。
否则,消化时间过长或过短者会影响实验结果。
4. 为了增强检测系统的敏感性,在测定系统中加入放线菌素 D,但浓度不宜过大,一
般最终浓度为 0.5~1μg/ml。
tnf作用原理

tnf作用原理TNF,全称肿瘤坏死因子(Tumor Necrosis Factor),这名字听起来就很霸气呢,感觉像是专门来对付肿瘤这个大坏蛋的。
TNF其实是一种细胞因子,就像是身体里的小信使一样。
你可以把身体想象成一个超级大的社区,细胞就是社区里的居民。
TNF呢,就是那种特别活跃的居民,到处跑来跑去传递消息。
它主要是由免疫细胞产生的,像巨噬细胞啊,这些细胞就像是身体的小卫士,一旦发现有什么不对劲的地方,就开始分泌TNF。
TNF在炎症反应里可是个超级活跃分子。
比如说你不小心划破了手指,这时候细菌就可能趁机而入。
身体的免疫系统马上就警觉起来了,巨噬细胞开始分泌TNF。
TNF 就像个小广播,对着周围的细胞大喊:“有敌人来啦,大家都准备好战斗!”它会让血管扩张,这样就可以有更多的免疫细胞、营养物质什么的快速到达受伤的部位。
就好比是打开了一条绿色通道,让救援部队能够迅速赶到战场。
而且TNF还能让血管的通透性增加呢。
这就像是把小区的大门打开得更大一点,方便免疫细胞能够从血管里钻出来,直接到受伤或者有炎症的地方去。
你想啊,免疫细胞就像一群小战士,它们得赶紧跑到敌人所在的地方去战斗,TNF就是那个给它们指路并且打开方便之门的小机灵鬼。
在抗肿瘤方面,TNF也有它的独特本事。
肿瘤细胞就像是社区里的坏分子,躲在身体里偷偷搞破坏。
TNF就像是一个正义的小使者,它可以直接作用于肿瘤细胞。
它能够启动肿瘤细胞内部的一些程序,让肿瘤细胞自己走向死亡,这就叫做凋亡。
就好像是给肿瘤细胞下了一道命令,让它乖乖地自我毁灭。
有时候TNF还会联合其他的免疫细胞或者免疫分子,一起对肿瘤细胞进行围剿。
比如说它可以和白细胞一起,把肿瘤细胞包围起来,然后一点点地消灭它们。
不过呢,TNF这个小调皮有时候也会惹点小麻烦。
如果身体里TNF的量太多了,或者它在不应该活跃的时候太活跃了,就会引起一些自身免疫性疾病。
就像是它太兴奋了,开始对身体里正常的细胞也发动攻击。
tnf-α产生机制

tnf-α产生机制TNF-α全称为肿瘤坏死因子-α,是一种细胞因子,主要由免疫细胞产生。
TNF-α在炎症、感染及自身免疫性疾病中起到重要作用。
TNF-α的产生是一个复杂的过程,牵涉到多种细胞及生物分子之间的相互作用。
TNF-α主要由免疫细胞产生,包括巨噬细胞、树突状细胞、T淋巴细胞、B淋巴细胞、自然杀伤细胞以及某些类似上皮细胞的上皮样细胞。
这些细胞可以通过两种途径产生TNF-α:氧化应激途径和信号途径。
氧化应激途径是一种非特异性的激活方式,会导致细胞内出现氧化应激反应。
当细胞受到一些刺激,如有害微生物的存在、细胞自身的损伤或者其它物质刺激时,细胞内的NADPH氧化酶开始工作,并产生氧自由基。
这些氧自由基与胞浆中的特定酶结合,形成来自膜表面的氧化物。
接着,这些氧化物可引起细胞膜周围物质的氧化和激活趋化因子如IL-8、IL-6、TNF-α等的释放。
信号途径中,细胞内源性蛋白介导的信号转导途径扮演者重要角色。
当外部刺激作用于细胞膜表面的受体时,会激活分子使其表达,在后续级联反应中迅速触发细胞内的信号转导途径,进而激活NF-κB 和MAPK通路,促进TNF-α的产生和释放。
此外,TNF-α的产生可受到多种因素的影响,包括刺激的类型、刺激的强度、刺激的时间、刺激的地点等等。
不同的细胞类型之间也存在差异,如巨噬细胞受到病毒刺激而产生的TNF-α含量较高,而T 淋巴细胞在受到持续愈基物刺激下产生的TNF-α水平较高。
总之,TNF-α的产生是一个复杂的过程,包括信号途径和氧化应激途径两种途径,并受到多种因素的影响。
深入研究TNF-α的产生机制有助于更好地理解炎症、感染及自身免疫性疾病的病理机制,为疾病的诊断和治疗提供理论基础。
TNF简介(发展史、生物学活性、抗肿瘤机制)

肿瘤坏死因子的发现、发展史肿瘤坏死因子(tumor necrosis factor,TNF)是迄今发现的直接杀伤恶性肿瘤作用最强的生物活性因子,能特异性杀伤肿瘤细胞而对正常细胞无明显的毒性作用,因而受到人们的普遍重视。
目前普遍认为,TNF最早是1975年由Carswell发现的。
Carswell在研究中观察到,经卡介苗致敏的小鼠被注射大肠杆菌内毒素后,血清中出现一种物质,该物质在体内可以使移植肿瘤发生出血、坏死,遂将该物质命名为肿瘤坏死因子(tumor necrosis factor, TNF)。
其实早在十九世纪后期,Coley等就观察到,当肿瘤患者伴有感染时,其肿瘤偶尔可以消退甚至痊愈。
基于这些发现,Coley等开始用一些灭活的G+和G-细菌混合物作为疫苗,来治疗恶性肿瘤,称为“Coley毒素”疗法。
Coley毒素的应用,大大提高了软组织肿瘤患者的生存率,这在当时获得了较高的评价。
1936年,随着Coley的去世,人们对Coley菌苗的兴趣被广泛应用的化疗和放疗所取代。
100多年后的今天,当人们再次关注“Coley毒素”疗法的时候,发现该疗法的主要原理之一就是通过诱导体内产生大量的TNF来实现抗肿瘤作用的。
自Carswell发现TNF后,许多学者进行的其他研究均观察到TNF在体外和体内对多种肿瘤细胞有明显的细胞毒作用。
1984年Pennica等首次克隆了人TNF-α的cDNA,并在大肠杆菌中表达成功。
随后,即有许多学者致力于将TNF应用于临床的研究。
自1987年起,在欧洲(德国、英国、法国、波兰、埃及等)、美国、日本等地陆续有进行TNFⅠ期和Ⅱ期临床试验的报道。
但临床试验的结果给对TNF满怀希望的人们带来的是失望。
TNF类似严重感染所致的不良反应令患者难以耐受,而患者可以耐受的剂量似乎达不到抗肿瘤的浓度。
一时间TNF的临床研究陷入了低谷,进一步的临床研究几乎停滞。
由于TNF明确的抗肿瘤活性,使得不少学者不愿轻易放弃对其的研究。
TNF肿瘤坏死因子的介绍

TNF肿瘤坏死因子的介绍TNF-α(肿瘤坏死因子-α)是一种重要的细胞生物活性因子,是免疫系统中的关键分子之一、它起源于巨噬细胞、单核细胞、淋巴细胞、T细胞等,并且在感染、炎症和免疫反应中起着重要的调节作用。
TNF-α在炎症反应和组织修复过程中发挥着重要的作用。
TNF-α主要由活化的巨噬细胞和T细胞分泌,它的分泌受到多种刺激因素的调控。
在感染时,病原体成分经过细胞感应机制激活细胞表面的受体,这些受体激活之后会引起下游信号通路的激活,最终导致TNF-α的产生和释放。
TNF-α的产生和作用具有很强的时效性,可以迅速对炎症反应作出反应,并诱导其他炎性细胞的积聚和活化。
TNF-α的生物活性非常广泛,它可以通过多种机制参与免疫调节。
首先,TNF-α可以增加细胞表面黏附分子的表达,这些黏附分子对炎症细胞的黏附和集聚起着重要作用。
其次,TNF-α可以增强血管的渗透性,使白细胞更容易穿过血管壁进入炎症区域。
此外,TNF-α还可以促进细胞的凋亡,即程序性细胞死亡,从而清除病原体和受损细胞。
尽管TNF-α在炎症反应和免疫调节中扮演重要角色,但过度产生TNF-α也可能引起炎症反应失控,导致严重的炎症性疾病。
例如,关节炎、炎性肠病、系统性红斑狼疮和肺部感染等疾病的发展与TNF-α的过度产生密切相关。
因此,抑制TNF-α的作用已成为许多药物研发的重要目标之一在临床治疗中,针对TNF-α的治疗策略已被广泛采用。
针对TNF-α的免疫抑制药物已被用于治疗类风湿性关节炎、银屑病和炎性肠病等疾病。
这些药物可以通过结合TNF-α并中和其生物活性来达到治疗的效果。
此外,利用基因工程技术生产的可溶性TNF-α受体融合蛋白也作为治疗TNF-α相关疾病的一种手段。
总之,TNF-α作为一种免疫系统中的重要调节因子,参与多个疾病的发生和发展过程中,具有广泛的生物活性和调节作用。
深入研究TNF-α的分子机制和功能,不仅有助于揭示炎症反应和免疫调节的机制,还为相关疾病的治疗提供了重要的思路和方法。
TNF-α抗肿瘤作用机制

TNF-α抗肿瘤作用机制实现其细胞毒性、抗病毒、免疫调节等生物学功能。
TNFR存在于多种正常细胞及肿瘤细胞表面,TNF-α通过与靶细胞膜上肿瘤坏死因子受体(tumornecrosifactorreceptorTNFR结合。
有TNFR1和TNFR2两种亚型,由于TNFR1胞内区含死亡结构域,溶细胞活性上起主要作用。
Lyu等[1]用scFv23/TNF免疫因子促使SKBR-3-LPTNF天然耐药)细胞表面TNFR1过表达,可提高HER-2/neu过表达的SKBR-3-LP细胞对TNF敏感性。
当TNF-α三聚体与靶细胞膜上TNFR1胞外区结合,PA DDTNFR1assocideathdomainprotein抑制蛋白被释放,PA DD与TNFR1死亡结构域结合,形成TNFR1/PA DD复合体,该复合体招募一系列相关蛋白,引发不同的下游信号通路,促使肿瘤细胞程序性凋亡。
2.1.1 诱导经典和非经典Caspas依赖型细胞凋亡将FA DD招募到TNFR1/PA DD复合体,TNFR1/PA DD复合体通过其死亡结构域和FA DDFaassocideathdomainprotein死亡结构域结合。
FA DD蛋白N端死亡效应结构域(DED可以激活Caspase-8属于ICE/CED3半胱氨酸蛋白酶家族)从而激活Caspase-3通过级联放大反应,引起DNA 断裂和细胞凋亡形态学改变,诱导细胞凋亡。
Chosa等[2]发现用TNF-α预处理HSG细胞,促使Fa受体表达增加,激活Caspas促进HSG细胞凋亡。
TNF-α可通过诱导凋亡启动子如凋亡前体蛋白BidBax表达,激活Caspase-8引起级联放大反应,从而诱导肿瘤细胞凋亡。
同时TNF-α也可诱导非经典的Caspas依赖型细胞凋亡,即改变肿瘤细胞质中线粒体的通透性,释放细胞色素C分泌ROS通过调节凋亡和抗凋亡因子,诱导肿瘤细胞死亡。
2.1.2 招募PA F2激活NF-κB和JNK信号通路PA F2TNFRassocifactor2可以与PA DDN端结合, 当TNF结合TNFR1后。
肿瘤坏死因子代谢

肿瘤坏死因子(TNF)是一种多功能促炎细胞因子,主要由单核细胞/巨噬细胞分泌。
它在脂质代谢、凝血、胰岛素抵抗和内皮功能等方面都有影响。
TNF-α即肿瘤坏死因子α,是TNF超家族的配体,主要作用是调节免疫细胞的功能。
作为一种内源性致热原,它能够促使发热,引起细胞凋亡,并引发炎症等反应。
肿瘤坏死因子的代谢涉及一系列的生物过程。
细胞表面的TNF-α三聚体可以诱导邻近肿瘤细胞和病毒感染细胞的裂解。
此外,TNF-α结合TNF RI和TNF RII,并通过TNF RI的死亡域诱导凋亡信号转导。
注射牛分枝杆菌杆菌卡介苗(BCG)和内毒素后,最初在小鼠血清中鉴定出TNF。
来自这些动物的血清对许多小鼠和人类转化的细胞系具有细胞毒性或细胞抑制作用,并产生出血性坏死。
总的来说,肿瘤坏死因子在人体内发挥着重要的作用,其代谢涉及到多个方面。
更多详细信息建议查阅生物学、医学类书籍或咨询专业医师。
肿瘤坏死因子是什么?

肿瘤坏死因子是什么?
肿瘤坏死因子是一类能使肿瘤发生出血,直接造成肿瘤细胞死亡的细胞因子。
肿瘤坏死因子超家族(TNFSF)在调节适应性免疫、杀伤靶细胞和诱导细胞凋亡等过程中发挥重要作用。
1975年E.A. Carswell等人发现接种卡介苗的小鼠注射细菌脂多糖后,血清中出现一种能使多种肿瘤发生出血性坏死的物质,将其命名为肿瘤坏死因子(tumor necrosis factor,TNF)。
八十年代人们发现其在消耗症中起了重要作用,又称恶液质素。
TNF主要由活化的巨噬细胞,NK细胞及T淋巴细胞产生。
1985年Shalaby把巨噬细胞产生的TNF命名为TNF-α,把T淋巴细胞产生的淋巴毒素(lymphotoxin,LT)命名为TNF-β。
虽然TNF-α与TNF-β仅有约30%的同源性,但它们却拥有共同的受体。
TNFα的生物学活性占TNF总活性的70 %~95 %,因此目前常说的TNF多指TNF-α。
1984年TNF 基因的克隆开辟了临床试验的时代,是第一个用于肿瘤生物疗法的细胞因子,但因其缺少靶向性且有严重的副作用,目前仅用于局部治疗。
肿瘤坏死因子TNF_图文

TNF的生物学活性
Biological activities of TNF
杀杀伤和抑制 肿瘤细胞
2
抗感染
促进髓样白
血病细胞向
巨噬细胞分
4化
6
YOUR TEXT HERE
1
提高中性粒
3 细胞的吞噬
能力
5 TNF是一种
内源性热 原质
促进细胞增 殖和分化
1 杀伤或抑制肿瘤细胞
TNF杀伤肿瘤的机理还不十分清楚,与补体或穿孔素 (perforin)杀伤细胞相比,TNF杀伤细胞没有穿孔现
致细胞死亡。 ②通过TNF对机体免疫功能的调节作用,促进T细胞 及其它杀伤细胞对肿瘤细胞的杀伤。
③TNF作用于血管内皮细胞,损伤内皮细胞或导致血 管功能紊乱,使血管损伤和血栓形成,造成肿瘤组织 的局部血流阻断而发生出血、缺氧坏死
2 提高中性粒细胞的吞噬能力
增加过氧化物阴离子产生,增强ADCC功能, 刺激细胞脱颗粒和分泌髓过氧化物酶。
作用 机制
TNF信号传导的分子机理
(TNF-α)
This is a good space for a short subtitle
TNF受体(TNFR)
• TNF-R2 “配体传递”,独立激活
85%
• TNF-R1
• TNF-R2信号传导复合体
主要细胞效应—激活JNK和NF-
肿瘤坏死因子TNF家族及其受体基础概述
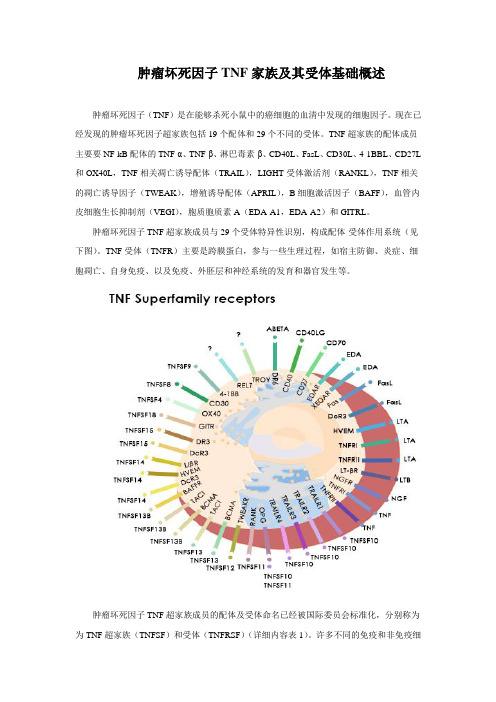
肿瘤坏死因子TNF家族及其受体基础概述肿瘤坏死因子(TNF)是在能够杀死小鼠中的癌细胞的血清中发现的细胞因子。
现在已经发现的肿瘤坏死因子超家族包括19个配体和29个不同的受体。
TNF超家族的配体成员主要要NF-kB配体的TNF-α、TNF-β、淋巴毒素-β、CD40L、FasL、CD30L、4-1BBL、CD27L 和OX40L,TNF相关凋亡诱导配体(TRAIL),LIGHT受体激活剂(RANKL),TNF相关的凋亡诱导因子(TWEAK),增殖诱导配体(APRIL),B细胞激活因子(BAFF),血管内皮细胞生长抑制剂(VEGI),胞质胞质素A(EDA-A1,EDA-A2)和GITRL。
肿瘤坏死因子TNF超家族成员与29个受体特异性识别,构成配体-受体作用系统(见下图)。
TNF受体(TNFR)主要是跨膜蛋白,参与一些生理过程,如宿主防御、炎症、细胞凋亡、自身免疫、以及免疫、外胚层和神经系统的发育和器官发生等。
肿瘤坏死因子TNF超家族成员的配体及受体命名已经被国际委员会标准化,分别称为为TNF超家族(TNFSF)和受体(TNFRSF)(详细内容表1)。
许多不同的免疫和非免疫细胞类型均可产生TNF,包括巨噬细胞、T细胞、肥大细胞、粒细胞、天然杀伤(NK)细胞和非造血细胞,如成纤维细胞、神经元、角质形成细胞和平滑肌细胞。
表达每个配体或受体的细胞类型可以查看表1。
表1:人肿瘤坏死因子TNF家族受体及其配体表达图谱官方名配体表达细胞官方名受体表达细胞TNFSF1 TNF-β、LT-αNK、T、B TNFRSF1ATNFR1(DR1)造血和免疫细胞TNFRSF1B TNFR2 免疫和内皮细胞TNFSF2 TNF-α巨噬细胞、NK、T、BTNFRSF1A/B TNFR1/2 免疫和内皮细胞TNFSF3 LT-β活化的CD4+T细胞、T、DC、NKTNFRSF3 LT-βRNK、CD4+和CD8+ T细胞TNFSF4 OX40L(CD252)B、T、DC、内皮细胞、平滑肌细胞TNFRSF4OX40(CD134)活化的CD4+T细胞、中性粒细胞TNFSF5 CD40L(CD154)活化的CD4+T细胞、肥大细胞、嗜碱性粒细胞、嗜酸性粒细胞、NKTNFRSF5 CD40B、DC、单核细胞、胸腺上皮、Reed-Sternberg细胞TNFSF6 FasL(CD95L、Apo1L)活化的脾细胞、胸腺细胞、非淋巴组织、NKTNFRSF6Fas(CD95、Apo1、DR2)上皮细胞、肝细胞、活化的成熟淋巴细胞和转化细胞TNFRSF6B DcR3 肺和结肠细胞TNFSF7 CD27L(CD70)NK、T、B、肥大细胞、平滑肌细胞、胸腺上皮细胞TNFRSF7 CD27造血祖细胞、CD4+和CD8+T细胞TNFSF8 CD30L(CD153)活化的T、B、单核细胞、粒细胞、髓质胸腺上皮细胞TNFRSF8 CD30 Reed-Sternberg细胞TNFSF9 4-1BBL APC细胞(B、DC、巨噬)、肥大细胞TNFRSF94-1BB(CD137、ILA)T、NK、肥大细胞、嗜中性粒细胞TNFSF10 TRAIL(Apo2L)DC、NK、TTNFRSF10ATRAILR1(DR4、Apo2)大多数正常和转化的细胞TNFRSF10BTRAILR2(DR5)大多数正常和转化的细胞TNFRSF10CTRAILR3(DcR1)大多数正常和转化的细胞TNFRSF10DTRAILR3(DcR2)大多数正常和转化的细胞TNFRSF11BOPG(OCIF)破骨细胞前体,内皮细胞等TNFSF11 RANKL(TRANCE、OPGL、ODF)T、胸腺、淋巴结TNFRSF11ARANK(TRANCER)破骨细胞、成骨细胞、活化的T细胞TNFRSF11BOPG(OCIF)破骨细胞前体,内皮细胞等TNFSF12 TWEAK(Apo3L)单核细胞TNFRSF12ATWEAKR(FN14)内皮细胞和成纤维细胞TNFSF13 APRIL(TALL-2、TRDL-1)巨噬细胞、淋巴细胞、肿瘤细胞TNFRSF13A/17BCMAB、PBL、脾、胸腺、淋巴结、肝脏、肾上腺TNFRSF13B TACIB、活化的T、PBL、脾、胸腺、小肠TNFSF13B BAFF单核细胞、巨噬细TNFRSF13B TACI B、活化的T、PBL、脾、(BLYS、THANK)胞、DC、T 胸腺、小肠TNFRSF13C BAFFRB、T、PBLs、脾脏、淋巴结TNFRSF17 BCMAB、T、PBLs、脾脏、淋巴结TNFSF14 LIGHT(HVEML,LT-γ)粒细胞、单核细胞、DC、TTNFRSF14LIGHTR(HVEM)T、B、单核细胞、淋巴样细胞TNFRSF3 LT-βR非淋巴结造血和基质细胞TNFSF15 VEGI(TL1A)内皮细胞、APC细胞(B、DC、巨噬)TNFRSF25 DR3 NK、TNFRSF6B DcR3 活化的T细胞TNFSF18 GITRL 人脐静脉内皮细胞TNFRSF18GITR(AITR)CD4+ CD25+ T细胞EDA-A1 皮肤EDAR 外胚层衍生物EDA-A2 皮肤XEDAR 外胚层衍生物、胚胎毛囊未识别TNFRSF19 TROY(TAJ)胚胎皮肤、上皮、毛囊、脑未识别TNFRSF19L RELT 淋巴组织、造血组织未识别TNFRSF21 DR6 T未识别TNFRSF16 NGFR(CD271)神经元轴突、雪旺氏细胞、神经细胞肿瘤坏死因子TNF超家族各成员在细胞生物学中重要作用。
tnf-生物制剂[整理版]
![tnf-生物制剂[整理版]](https://img.taocdn.com/s3/m/9f909e6e30b765ce0508763231126edb6f1a76c9.png)
00主要成分每瓶含重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白25毫克,甘露醇40毫克,蔗糖10毫克,三羟甲基氨基甲烷1.2毫克。
用1毫升灭菌注射用水溶解。
00药理毒理001.药理重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白是一个二聚体的融合蛋白,包含人75KDa肿瘤坏死因子受体(TNFR)(p75)的细胞膜外配体结合部分与人IgG1的Fc片段,包含934个氨基酸,表观分子量约为150K道尔顿(KDa)。
00TNF是机体自然产生的一种细胞因子,参与正常的炎症和免疫反应。
在强直性脊柱炎关节病变的炎症反应中,TNF起着重要的作用。
TNF存在55KDa蛋白(p55)和75KDa蛋白(p75)两类受体,它们均以单体的形式存在于细胞表面。
TNF的生物学活性取决于它与细胞表面两类受体分子的结合。
00重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白的作用机制是竞争性地与TNF 结合,阻止TNF与细胞表面TNF受体的结合,抑制TNF的生物学活性。
002.毒理小鼠急性毒性试验结果显示,静脉注射1.09g/kg剂量的重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白,未见毒性反应。
猴长期毒性试验结果显示,每周2次连续皮下注射180天15.0 mg/kg剂量的重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白,未见有明显的毒性。
00药代动力学0032名中国健康成年受试者单次皮下给予重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白后,血清浓度-时间曲线在12.5mg、25mg、37.5 mg、50mg剂量范围内与剂量呈正比例增高。
推荐剂量25mg和50mg后,峰浓度(Cmax)分别为1.5 ±0.5和2.4 ±0.88 μg/mL;达峰时间个体差异大波动于36-72小时间。
AUC分别为213 ±46和362 ±148 μg·h/mL;消除半衰期(t1/2)约为60-90小时;表观分布容积Vd/F约为15~30L/kg,表明主要分布于血液;清除率CL/(F)约为0.1~0.2 L/h。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
肿瘤坏死因子的发现、发展史
肿瘤坏死因子(tumor necrosis factor,TNF)是迄今发现的直接杀伤恶性肿瘤作用最强的生物活性因子,能特异性杀伤肿瘤细胞而对正常细胞无明显的毒性作用,因而受到人们的普遍重视。
目前普遍认为,TNF最早是1975年由Carswell发现的。
Carswell在研究中观察到,经卡介苗致敏的小鼠被注射大肠杆菌内毒素后,血清中出现一种物质,该物质在体内可以使移植肿瘤发生出血、坏死,遂将该物质命名为肿瘤坏死因子(tumor necrosis factor, TNF)。
其实早在十九世纪后期,Coley等就观察到,当肿瘤患者伴有感染时,其肿瘤偶尔可以消退甚至痊愈。
基于这些发现,Coley等开始用一些灭活的G+和G-细菌混合物作为疫苗,来治疗恶性肿瘤,称为“Coley毒素”疗法。
Coley毒素的应用,大大提高了软组织肿瘤患者的生存率,这在当时获得了较高的评价。
1936年,随着Coley的去世,人们对Coley菌苗的兴趣被广泛应用的化疗和放疗所取代。
100多年后的今天,当人们再次关注“Coley毒素”疗法的时候,发现该疗法的主要原理之一就是通过诱导体内产生大量的TNF来实现抗肿瘤作用的。
自Carswell发现TNF后,许多学者进行的其他研究均观察到TNF在体外和体内对多种肿瘤细胞有明显的细胞毒作用。
1984年Pennica等首次克隆了人TNF-α的cDNA,并在大肠杆菌中表达成功。
随后,即有许多学者致力于将TNF应用于临床的研究。
自1987年起,在欧洲(德国、英国、法国、波兰、埃及等)、美国、日本等地陆续有进行TNFⅠ期和Ⅱ期临床试验的报道。
但临床试验的结果给对TNF满怀希望的人们带来的是失望。
TNF类似严重感染所致的不良反应令患者难以耐受,而患者可以耐受的剂量似乎达不到抗肿瘤的浓度。
一时间TNF的临床研究陷入了低谷,进一步的临床研究几乎停滞。
由于TNF明确的抗肿瘤活性,使得不少学者不愿轻易放弃对其的研究。
90年代中期以来,陆续有临床研究者报道了TNF局部用药的临床结果。
证明TNF局部用药(大剂量局部灌流、肿瘤内注射、腔内注射等)既可达到良好的抗肿瘤效果,又可避免全身用药的严重副作用,这一发现重新燃起了人们对TNF的热情。
随着对TNF结构和作用机制的深入研究,一些高效、低毒的TNF变构体不断涌现,TNF 的临床研究又有了新的进展。
下面简单介绍一下TNF。
TNF的生物学活性
TNF是一种真正的多效因子,具有多种生物学效应。
它可直接作用于T细胞、B细胞、Mφ、NK细胞等效应细胞,在细胞水平上发挥作用。
1.与受体结合,引起细胞破坏、死亡
TNF与相应的受体结合后可向细胞内转移,被靶细胞溶酶体摄取导致溶酶体稳定性降低,各种酶外泄,引起细胞溶解。
也有认为TNF通过激活磷脂酶A2,释放超氧化物而引起DNA断裂。
TNF尚可改变靶细胞糖代谢,使细胞内pH降低,导致细胞死亡。
2.损伤内皮细胞,激活凝血系统
TNF可作用于血管内皮细胞,使内皮细胞损伤或导致血管功能紊乱;通过激活凝血系统的活性,导致血管内血栓形成,引起组织供血障碍。
3.引起机体发热
TNF作为内源性致热原,引起发热的机制可能是通过直接刺激下丘脑体温调节中枢和刺激巨噬细胞释放IL-1而引起,还可通过IL-1、TNF-α刺激其它细胞产生IL-6。
4.促进细胞的增殖和分化,调节机体免疫功能
TNF促进T细胞MHCⅠ类抗原表达,增强IL-2依赖的胸腺细胞、T细胞增殖能力,促进IL-2、CSF和IFN-γ等淋巴因子产生,增强有丝分裂原或外来抗原刺激B细胞的增殖和Ig分泌;它能促进T细胞及其它杀伤细胞对肿瘤细胞的杀伤,并增强CTL对病毒感染细胞的杀伤作用。
5.抑制新骨生成、刺激骨吸收
TNF在体外可刺激骨质破坏和再吸收,抑制新骨形成。
将重组TNF加入体外骨培养物可使多核的破骨细胞数增加,矿化的骨质质量下降,骨胶原(骨质的主要成分)合成抑制。
TNF刺激骨吸收是通过诱导成骨细胞产生一种可溶性因子完成的。
6.激活嗜中性粒细胞和巨噬细胞
嗜中性粒细胞是一种特殊的白细胞,它可提供第一道防线,吞噬或杀伤入侵的微生物。
在急性炎症反应阶段,它抗击入侵微生物的同时,也可使宿主组织发生损伤。
TNF-α刺激嗜中性粒细胞可引起噬菌作用、脱颗粒作用和呼吸爆发活动的增加。
TNF可提高中性粒细胞的吞噬能力,增加过氧化物阴离子产生。
同时TNF-α可提高中性粒细胞合成PAF的作用并可促进中性粒细胞粘附到内皮细胞上。
TNF-α也可促进单核巨噬细胞的活化,加速IL-2受体的表达。
TNF抗肿瘤作用的机制
TNF最明显的活性特征是可以在体内或体外特异性杀伤肿瘤细胞,而对正常细胞无明显的毒性作用,且抗肿瘤作用没有明显的种族特异性。
1.通过TNF受体介导的对肿瘤细胞的直接杀伤作用
对TNF敏感的肿瘤细胞表面存在TNF受体(TNFR),TNF通过与该受体结合,引发细胞的一系列变化,最终导致肿瘤细胞的死亡。
研究发现,TNF经过TNFR的识别、结合、内吞,导致一系列的变化,膜蛋白特异性磷酸化,产生大量热能,溶酶体酶类高度活化,膜通透性增加,蛋白酶类溢出,导致细胞溶解;也有证据表明,TNF与受体结合后可使细胞的线粒体产生的自由基增加,使质膜过氧化,引起细胞损伤。
2.抑制细胞生长和诱导凋亡。
TNF与受体结合后,可通过细胞内的一系列级联反应,诱导肿瘤细胞凋亡。
TNF 直接抑制细胞生长的作用也通过肿瘤细胞表面的特异性受体介导。
主要通过影响其蛋白质的代谢,导致肿瘤蛋白质合成减少,分解增加,从而抑制肿瘤生长。
3.通过损伤肿瘤的血供系统而导致肿瘤的坏死
肿瘤的血液供应丰富,对血液供应所减少较为敏感。
TNF-α除了对肿瘤细胞具有细胞毒性作用之外,更重要是它能摧毁实体瘤周围的血管上皮组织,并且通过血栓的形成,阻断肿瘤的血液营养供应,最终导致肿瘤的出血性坏死、消退和消失。
另外,一般肿瘤周围血管组织是没有规则和不完善的,它们表现为血管的多曲折性和多结性等。
而且有些实体瘤本身发生就是缺氧下选择性克隆产生的,远离血管,因此化疗药物很难预期达到这些肿瘤周围并发挥作用,而TNF-α能明显降低实体瘤周围间隙组织的压力,扩大肿瘤周围上皮组织的间隙,并改变肿瘤周围血管的通透性,使联用的化疗药物到达这些靶组织周围, 而且TNF-α能延长药物在肿瘤周围的持续时间,发挥抗肿瘤作用。
TNF还可有促凝作用,可引起肿瘤部位血管内的血栓形成,从而阻断肿瘤的血液供应。
超过一定浓度的TNF-α具有明显的抗新生血管形成作用。
有报道显示TNF-α对形成不超过9天的新生血管组织抑制作用更强烈。
有新的实验证据显示,TNF-α联合其他药物能在分子水平上明显抑制整合素(integrin)αvβ3的活性(这种整合素在肿瘤的新血管形成中起重要作用),进而在动物模型中引发肿瘤血管上皮细胞的解体和凋亡,而这种作用不伤害周围正常血管上皮组织。
这个实验为TNF-α有选择性的抑制肿瘤血管上皮组织的作用提供了分子基础。
4.通过引起肿瘤局部的炎症反应和机体的免疫系统发挥抗肿瘤作用
TNF-α是一种细胞因子,它对人体免疫系统具有很重要的调节作用。
例如,TNF-α对免疫细胞树突状细胞具有催熟作用,具有激活和刺激T细胞作用。
TNF-α可导致肿瘤局部的炎症反应,增强单核细胞、巨噬细胞和中性粒细胞的杀伤作用,增强T细胞的增殖
和杀伤作用,还可诱导产生其他细胞因子如IL-2、IFN等,通过“级联作用”发挥更强的杀肿瘤活性。
另外,TNF-α通过对核内基因的调控,促进肿瘤抑制基因P53的表达,从而加强机体自身的抗肿瘤作用。
5.逆转肿瘤细胞的多药耐药,增加对化疗药物的敏感性
TNF可以逆转肿瘤细胞的多药耐药,增加对化疗药物的敏感性,因而与化疗药物有较好的协同作用。
用对阿霉素耐药的K562细胞株进行研究的结果显示,TNF-α可使K562细胞的耐药性有明显的逆转。
局部灌流治疗时观察到,TNF可使美法伦在肿瘤局部的浓度提高,从而提高美法伦的抗肿瘤活性。
