mrna 阳离子 脂质体
mRNA作为基因治疗

mRNA作为基因治疗:怎样控制蛋白质表达鞠俊0942043010生物技术基地班关键词:mRNA转运,脂质体,细胞核障碍,多聚腺嘌呤尾,mRNA 疫苗摘要:很多年来,在人们看来,在有效的基因治疗中,mRNA是不稳定的。
但在过去十年,几个研究团队面对挑战,不仅用令人惊奇的结果,即蛋白质的连续的高效表达证明了mRNA调节转染的可行性,而且证明比起质粒DNA有一些优势。
这些优势将在这篇综述中被提到。
在所有优势中,首先被强调的是,mRNA不需要穿过核膜去发挥它的生理作用;而且由于缺少了CpG岛的修饰,所以减少了细胞免疫反应。
另外,这篇综述还提到mRNA分子的稳定性,mRNA的修饰以增加它的半衰期以及外源mRNA被成功用作转染的必要性。
而且,这篇综述总结了用作mRNA转染的不同的技术和载体,主要有电打孔,基因枪注射和脂质体转染。
并且暗示,现在大多数的注意力集中在疫苗开发方面。
总之,这篇综述提供了一个广阔的视角,关于mRNA转染的主要的理论知识和实际操作以及它在科学研究中的可能性和缺陷简介:人们对mRNA代替质粒DNA在基因治疗中的兴趣,最近才有所增强。
很长一段时间,mRNA被认为是一种不稳定的分子。
在过去的二十年,mRNA转染的研究一直进行着。
研究组大部分运用非病毒的方式来完成转染,也有一些使用病毒载体的。
所有这些工作证明mRNA的不稳定性被过分估计了。
mRNA转染是一种可以取代质粒DNA的治疗方法。
mRNA进入细胞后,它的生命是有限的;由这个mRNA编码的蛋白质只是持续几天的时间。
显然,这限制了mRNA转染的实用性。
它不能被应用于遗传疾病的治疗,因为治疗需要持续的表达。
然而,当只需要短暂的蛋白表达量时,以mRNA为基础的基因治疗能够比质粒DNA 的使用更有效。
这种情况下,mRNA的转染不仅能完成所有的治疗要求,而且有超过质粒DNA的几个优势。
这里,我们将比较mRNA和质粒DNA,强调在非病毒途径中,外源mRNA转染有效性的保证以及讨论它的可能应用。
转化,转染,转导,感染,中英双字幕解释

转染和转化转染的定义是“将具生物功能的核酸转移或运送到细胞内并使核酸在细胞内维持其生物功能”。
其中,核酸包括DNA(质粒和线性双链DNA),反义寡核苷酸及RNAi(RNA interference)。
基因转染技术已广泛应用于基因组功能研究(基因表达调控,基因功能,信号转导和药物筛选研究)和基因治疗研究。
基因转染需要一定的转染试剂将带有目的基因的载体运送到细胞内。
早期的磷酸钙转染法转染效率很低,且对很多细胞株无效,因此不能满足很多科研工作的需要。
目前,最常用的转染试剂是阳离子脂质体和阳离子聚合物,它们在克服细胞屏障方面跟病毒有很相象的特征,容易透过细胞膜。
其中,阳离子脂质体在体外基因转染中有很高的效率,然而在体内,它迅速被血清清除,在肺组织内累积,诱发强烈的抗炎反应,这将导致高水平的毒性,因此,在很大程度上限制了其应用。
由于阳离子脂质体的局限性,阳离子聚合物转染试剂日益受到重视。
转化特指将质粒DNA或以其为载体构建的重组DNA导入细菌体内,使之获得新的遗传特性的一种方法。
它是微生物遗传、分子遗传、基因工程等研究领域的基本实验技术之一。
受体细胞经过一些特殊方法(如:电击法,CaCl2等化学试剂法)处理后,使细胞膜的通透性发生变化,成为能容许外源DNA分子通过的感受态细胞。
进入细胞的DNA分子通过复制、表达实现遗传信息的转移,使受体细胞出现新的遗传性状。
由外来DNA引起生物体遗传性状改变的过程称为转化(transformation)。
噬菌体常常可感染细菌并将其DNA注入细菌体内,也可引起细菌遗传性状的改变。
通过感染方式将外来DNA 引入宿主细胞,并导致宿主细胞遗传性状改变的过程称为转染(transfection)。
转染是转化的一种特殊形式。
基因工程:有目的的通过分子克隆技术,人为的操作改造基因,改变生物遗传性状的系列过程。
载体:能在连接酶的作用下和外源DNA片段连接并运送DNA分子进入受体细胞的DNA分子。
阳离子脂质体递送STAT3 siRNA抑制黑色素肿瘤细胞探究

阳离子脂质体递送STAT3 siRNA抑制黑色素肿瘤细胞探究邹瑞;彭正松【摘要】利用阳离子脂质体作为载体,用其搭载鱼精蛋白与STAT3 siRNA复合物,通过一系列实验证实该复合体系可显著抑制STAT3基因在黑色素瘤细胞B16中的表达,促进肿瘤细胞的凋亡.首先对载体材料进行了一系列表征测定,检测了不同复合比例下载体和siRNA复合物的粒径和电位.利用载体和siRNA的复合物对B16细胞进行转染并测定转染效率,随后对复合材料的毒性进行了检测.此外还进行了细胞凋亡、平板克隆、荧光定量PCR以及Western Blot等一系列实验来进一步确定载体复合物的有效性.实验结果表明,阳离子脂质体搭载复合了鱼精蛋白的STAT3siRNA表现出了良好的靶向治疗性及优秀的递送效率,且复合体系稳定性良好,毒性低.【期刊名称】《西昌学院学报(自然科学版)》【年(卷),期】2019(033)001【总页数】6页(P28-33)【关键词】阳离子脂质体;鱼精蛋白;siRNA;STAT3【作者】邹瑞;彭正松【作者单位】西华师范大学生命科学学院,四川南充 637009;西华师范大学生命科学学院,四川南充 637009;西昌学院农业科学学院,四川西昌 615000【正文语种】中文【中图分类】R739.51998年,华盛顿卡耐基研究院的Fire A 等首次在秀丽隐杆线虫(C.elegans)发现了一个双链RNA能够沉默蠕形秀丽隐杆线虫基因表达,并证明上述现象属于转录后水平的基因沉默[1],这一现象正式被称为 RNA 干扰(RNAi)。
从 1999年人们发现RNAi 现象[2]的存在到 2001年,RNAi 技术正式应用于哺乳动物细胞基因功能的研究中[3],短短几年内,RNAi技术得到了飞速发展。
毫无疑问,若RNAi技术能有效应用于临床,这将是基因治疗领域的一大突破。
RNAi 能够抵抗转基因或外源性病毒的侵犯。
在体外设计与靶基因mRNA 同源互补的双链RNA后,将这段双链RNA 导入目的细胞,其能够通过同源互补,从而靶向性地降解该mRNA,达到靶基因沉默的效果。
脂质体转染mrna细胞原理

脂质体转染mrna细胞原理
脂质体转染mRNA细胞的原理是利用脂质体作为载体,将目的mRNA包裹在其内部,然后通过与细胞膜融合让mRNA进入细胞质,最终达到将目的mRNA表达出来的目的。
脂质体是由磷脂和胆固醇等组成的微小囊泡结构,与细胞膜结构相似。
其内部的疏水层可以容纳水溶性的物质,包括mRNA分子。
脂质体转染mRNA的步骤如下:
1. 准备目的mRNA:目的mRNA是指需要转染到细胞内进行表达的mRNA,可以是外源的mRNA,也可以是经过In vitro 转录合成的人工合成mRNA。
这些mRNA一般会在实验室中事先准备好。
2. 制备脂质体:将脂质体粉末或液体悬浮液溶解在适当的缓冲液中,形成脂质体溶液。
脂质体通过磷脂的双层结构来包裹mRNA,形成稳定的脂质体-mRNA复合物。
3. 混合脂质体与mRNA:将目的mRNA与脂质体溶液混合,并进行充分的混合和搅拌。
这样就可以使mRNA和脂质体发生相互作用,形成脂质体-mRNA复合物。
4. 转染细胞:将脂质体-mRNA复合物加入到需要转染的细胞培养液中,使其与细胞接触。
脂质体复合物会与细胞膜融合,从而使脂质体内的mRNA进入细胞质。
5. mRAN转录和表达:在细胞质中,脂质体释放的mRNA会
被细胞的核糖体识别,进而进行mRNA转录和翻译,最终使
该mRNA编码的蛋白质在细胞内得到表达。
脂质体作为转染载体具有一定的优势,如制备简单、生物相容性好等。
但是,脂质体转染也存在一些问题,如转染效率较低、引起细胞毒性等。
因此,在实际应用中需对转染条件进行优化,以提高转染效率和减少毒性。
阳离子脂质体基因转染

阳离子脂质体基因转染脂质体(lipofectinregeant,LR)试剂是阳离子脂质体N-[1-2,3-Dioleyoxy,Propyl]-n,n,n-Trimethylammonium Chloride(DOTMA)和Dioleoylphotidye-thanolamine(DOPE)的混合物[1:1(w/w)]。
它适用于把DNA转染入悬浮或贴壁培养细胞中,是目前条件下最方便的转染方法之一。
转染率高,优于磷酸钙法,比它高5~100倍,能把DNA和RNA转染到各种细胞。
用LR进行转染时,首先需优化转染条件,应找出该批LR对转染某一特定细胞适合的用量、作用时间等,对每批LR都要做:第一,先要固定一个DNA的量和DNA/LR混合物与细胞相互作用的时间,DNA可从1~5μg和孵育时间6小时开始,按这两个参数绘出相应LR需用量的曲线,再选用LR和DNA两者最佳的剂量,确定出转染时间(2~24小时)。
因LR对细胞有一定的毒性,转染时间以不超过24小时为宜。
细胞种类:COS-7、BHK、NIH3T3、Hela和Jurkat等任何一种细胞均可作为受体细胞。
1、操作步骤[方法一]:(1)细胞培养:取6孔培养板(或用35mm培养皿),向每孔中加入2mL含1~2×105个细胞培养液,37℃CO2培养至40%~60%汇合时(汇合过分,转染后不利筛选细胞)。
(2)转染液制备:在聚苯乙稀管中制备以下两液(为转染每一个孔细胞所用的量)A液:用不含血清培养基稀释1-10μg DNA,终量100μL,B液:用不含血清培养基稀释2-50μgLR,终量100μL,轻轻混合A、B液,室温中置10-15分钟,稍后会出现微浊现象,但并不妨碍转染(如出现沉淀可能因LR或DNA浓度过高所致,应酌情减量)。
(3)转染准备:用2mL不含血清培养液漂洗两次,再加入1mL不含血清培养液。
(4)转染:把A/B复合物缓缓加入培养液中,摇匀,37℃温箱置6~24小时,吸除无血清转染液,换入正常培养液继续培养。
阳离子脂质体基因递送缺点

阳离子脂质体基因递送缺点
尽管阳离子脂质体在基因递送方面具有许多优点,但它们也存在一些缺点。
以下是阳离子脂质体基因递送的主要缺点:
1.免疫反应
阳离子脂质体作为一种外源性物质,可能会触发机体的免疫反应。
这种免疫反应可能会降低基因递送的效率,甚至可能导致基因治疗失败。
在某些情况下,免疫反应可能对机体造成严重的副作用,因此在使用阳离子脂质体进行基因递送时需要进行严格的评估和监控。
2.细胞毒性
阳离子脂质体可能对某些细胞类型具有毒性,特别是在高浓度或长期使用时。
这种细胞毒性可能会导致基因递送效率降低,甚至可能引起严重的组织损伤。
因此,在使用阳离子脂质体进行基因递送时,需要仔细选择脂质体的类型和浓度,并评估其对细胞的毒性影响。
3.基因整合不稳定
阳离子脂质体递送的基因往往只是暂时存在于细胞内,而不是永久整合到基因组中。
这可能导致基因治疗效果不持久或不稳定。
为了解决这个问题,需要开发更有效的基因整合技术,以提高基因治疗的效率和稳定性。
4.适用范围有限
阳离子脂质体对某些类型的细胞可能不太有效,特别是那些难以穿透的细胞类型。
这限制了阳离子脂质体在某些基因治疗应用中的使用。
因此,需要开发新的基因递送策略和技术,以扩大阳离子脂质体
的适用范围。
5.成本高
与其他基因递送方法相比,阳离子脂质体的制造成本相对较高。
这可能会限制其在临床试验和实际应用中的使用。
为了使阳离子脂质体更广泛地应用于基因治疗领域,需要开发更经济、高效的制造方法和技术。
阳离子脂质体转染操作方法

阳离子脂质体转染操作方法
阳离子脂质体转染是一种常用的基因传递实验技术,可以将核酸载体有效地转染至细胞内。
下面是阳离子脂质体转染的基本操作方法:
1. 细胞培养:选择适合的细胞培养基及条件,将要转染的细胞在培养皿中培养至指定的生长状态,通常是80%~90%的细胞密度。
2. 制备DNA-脂质体复合物:将目标DNA与阳离子脂质体以适当比例混合,制备成DNA-脂质体复合物。
复合物的制备条件可以根据实际情况进行优化,一般来说,将DNA与脂质体按照质量比1:3~1:5混合,在无菌条件下保持15~30分钟使其充分结合。
3. 转染:将DNA-脂质体复合物均匀滴加至细胞培养皿中,注意避免产生气泡,插入培养皿中心。
轻轻摇晃培养皿使其均匀分布,然后将培养皿放回密闭的培养箱中,继续培养。
4. 代谢酶抑制:在培养细胞转染后的前24小时内,添加代谢酶抑制剂(如10 μg/mL的氨基葡萄糖苷或10 mM的2-脱氧-D-葡萄糖)来提高转染效率。
5. 培养:根据需要的实验设计,继续培养细胞,通常在转染后24~72小时进行下一步的实验。
需要注意的是,每个细胞系对阳离子脂质体的适应性不同,因此在实际操作中需要进行不同的试验优化。
同时,与脂质体浓度、DNA浓度、转染时间等因素也需要进行优化。
mRNA_疫苗的研究及应用进展

生物技术进展 2023 年 第 13 卷 第 4 期 492 ~ 498Current Biotechnology ISSN 2095‑2341进展评述ReviewsmRNA 疫苗的研究及应用进展蔚丹1 , 马云龙1 , 万方1 * , 武建强2 *1.内蒙古农业大学生命科学学院,呼和浩特 010010;2.内蒙古医科大学基础医学院,呼和浩特 010107摘要:与传统疫苗相比,mRNA 疫苗具有高效、安全、低成本等优点,但它的应用一直受到体内传递不稳定、翻译效率较低等技术问题的限制。
新型冠状病毒的流行及其疫苗的研发加速了mRNA 疫苗的研发和批准,特别是在mRNA 结构修饰及脂质纳米颗粒构建等方面有了突破性进展,如使用优化后核苷、帽子结构的mRNA 疫苗稳定性大大提高,替换低使用频率的密码子可提高其翻译效率等。
目前常用的mRNA 递送系统有脂质纳米颗粒、聚合物载体、类病毒载体等。
综述了mRNA 疫苗的发展历程、作用机制、修饰技术突破和递送系统方面的研究及应用进展,以期促进mRNA 疫苗的深入研究及应用。
关键词:mRNA 疫苗;作用机制;递送系统DOI :10.19586/j.20952341.2023.0015中图分类号:Q812, R373 文献标志码:AAdvances on Research and Application of mRNA VaccinesYU Dan 1 , MA Yunlong 1 , WAN Fang 1 * , WU Jianqiang 2 *1.Faculty of Life Science , Inner Mongolia Agricultural University , Huhehot 010010, China ;2.College of Basic Medicine , Inner Mongolia Medical University , Huhehot 010107, ChinaAbstract :Compared with traditional vaccines , mRNA vaccines have the advantages of high efficiency , safety and low cost , but its application has been limited by technical problems such as unstable in vivo delivery and low translation efficiency. The prevalence of SARS -CoV -2 virus and their vaccine development have accelerated the development and approval of mRNA vaccines ,especially breakthroughs in mRNA structural modification and construction of lipid nanoparticles , for example , the stability of mRNA vaccines using optimized nucleoside and cap structures is greatly improved , and the replacement of codons with low fre⁃quency of use can improve their translation efficiency. The commonly used mRNA delivery systems are lipid nanoparticles , poly⁃mer vectors , virus -like vectors , etc. The research and application progress of development history , mechanism of action , techno⁃logical breakthroughs in modification , and delivery systems of mRNA vaccines were reviewed in order to promote the in -depth re⁃search and application of mRNA vaccines.Key words :mRNA vaccine ; mechanism of action ; delivery systemmRNA 疫苗是一种通过体外转录技术合成后选择合适的递送系统将mRNA 运输进入机体,依靠细胞自身的翻译系统将mRNA 翻译成目标蛋白,从而达到临床治疗目的的先进疗法[1]。
mRNA-LNP通过脾免疫细胞诱导强效的抗肿瘤免疫反应 (2)

mRNA-LNP肿瘤疫苗通过脾免疫细胞诱导强效抗肿瘤效应有效的肿瘤疫苗需要长期的高效的CD8 T细胞免疫反应。
系统免疫似乎是最有效的途径,但需要调整LNP组成将mRNA递送至抗原提呈细胞。
本文使用质量源于设计的方法学,调整mRNA-LNP的组成,在一轮优化筛选实验中,就实现了高效的肿瘤特异性的CD8 T细胞免疫反应。
优化的LNP成分增加了多个脾免疫细胞群对mRNA的摄取。
I型干扰素和吞噬细胞被发现对T细胞反应至关重要。
本文也发现了一个尚未确定的作用,B细胞在疫苗诱导的CD8 T细胞免疫反应中的作用。
优化后的LNPs在非人灵长类动物中表现出类似的,以脾脏为中心的生物分布特征,并且没有造成肝脾的组织病理学改变,保证了它们可以进一步用于临床评估。
结果:1.DOE优化的LNP处方实现最大化T细胞免疫反应LNP处方包含可电离脂质涂层体SS-EC,胆固醇,DOPE和PEG化脂质。
人乳头瘤病毒16(HPV16)原癌蛋白E7被用作抗原。
使用DOE方法学,建立LNP库用于解决脂质摩尔比例和PEG脂质化学结构对T细胞免疫反应的影响。
三个酰基链长度和化学结构及分子量不同的PEG分子,分别为DMG-PEG2000,DSG-PEG2000和DSPE-PEG1000,被用于研究。
对于每种PEG脂质,LNP以4种脂质成分的11种不同摩尔比例,产生了33 种LNPs(见表1)。
11种摩尔比例来源于罗克摩尔混合设计,其中四种脂质各有5个摩尔比水平。
胆固醇被用作“填充”变量,以实现总摩尔百分比100%(图1A)。
这种设计特别适应二次响应面模型的生成,比传统的中心复合或Box-Behnken设计(分别需要15和13次实验)更经济。
LNP处方组成和特性(大小,PDI,mRNA比例,包封,Zeta电位)见表1。
所有的LNP在4℃可以保持稳定1个月。
LNPs被静脉注射3次,每次间隔1周,第3次注射后5天,测定血液中E7特定的CD8 T细胞比例。
阳离子吸附核酸并用脂质体包裹原理

阳离子吸附核酸并用脂质体包裹原理阳离子吸附核酸并用脂质体包裹的原理是一种常用的核酸转染方法,广泛应用于分子生物学实验和基因治疗研究中。
它通过阳离子与核酸的静电相互作用力吸附核酸,并通过脂质体包裹提供一种稳定的载体系统,以便将核酸有效地引入细胞内。
阳离子吸附核酸的原理可以追溯到很久以前,早在19世纪末,科学家就发现DNA和RNA都带有负电荷。
而阳离子是带有正电荷的离子,它们能够与带有负电荷的DNA或RNA分子形成静电相互作用力。
这种静电作用力足以克服核酸分子之间的互斥力,使得阳离子能够有效地吸附在核酸分子上。
在实验中,常用的阳离子有聚乙烯亚胺(PEI)、聚赖氨酸(poly-L-lysine)等。
它们可以通过与DNA或RNA之间的静电相互作用力来形成稳定的复合物。
一旦形成复合物,阳离子便能够保护核酸分子不受降解酶的攻击,并提供一种较好的携带系统。
然而,直接将阳离子和核酸复合物引入细胞内并不是一种高效的转染方法,这是因为阳离子核酸复合物在溶液中往往呈现凝聚状态,且表面带有正电荷,容易与细胞膜上的负电荷结构相互作用,导致细胞吸附率低。
此外,由于阳离子和核酸复合物的固有性质,它们在细胞内的释放效率也不高。
为了解决这些问题,科学家们引入了脂质体包裹的策略。
脂质体是一种由磷脂双分子层构成的微小囊泡,在水溶液中形成二维胞外液态结构。
脂质体具有很强的亲水性和脂性,使得它们能够与胆固醇、磷脂酰甘油等成分共同组装成稳定的微粒体,形成一种内部为水相、外部为脂相的结构。
这种结构为核酸的靶向输送提供了良好的载体。
在脂质体包裹的过程中,一般会选择一种或多种阳离子和核酸形成复合物,然后将复合物与脂质体共同包裹。
这样,核酸可以被有效地包裹在脂质体内部,形成稳定的复合物。
同时,脂质体的外层也使得核酸能够更好地与细胞膜相互作用,提高核酸的吸附率和转染效率。
此外,脂质体还能够降解和释放核酸,进一步提高核酸在细胞内的效果。
总结起来,阳离子吸附核酸并用脂质体包裹的原理利用了阳离子和核酸之间的静电相互作用力,以及脂质体的包裹和传递能力。
常用阳离子脂质

常用阳离子脂质自20世纪70年代DNA重组技术诞生,以重组DNA技术为核心的现代生物技术产业蓬勃发展,已有十多个基因工程药物上市。
以基因工程药物为主的各种基因工程产品和细胞工程产品陆续商品化。
在基因治疗中,基因载体是外源基因得以进入受体细胞的关键,其中,阳离子脂质体目前被认为是靶向性好,副作用小,稳定性好和转染效率较高的理想载体。
阳离子脂质体通常由一种阳离子脂质和一种中性辅助脂质在适当的条件下复合而成,阳离子脂质体转染效率与阳离子脂质的组成密切相关。
1、常用阳离子脂质缩写名化学名DOTMA 氯化三甲基-2, 3-二油烯氧基丙基铵DOTAP 溴化三甲基-2, 3-二油酰氧基丙基铵DOSPA 三氟乙酸二甲基-2, 3 -二油烯氧基丙基-2-(2-精胺甲酰氨基)乙基铵DTAB 溴化三甲基十二烷基铵TTAB 溴化三甲基十四烷基铵CTAB 溴化三甲基十六烷基铵DDAB 溴化二甲基双十八烷基铵DORI 溴化二甲基-2-羟乙基-2,3-二油酰氧基丙基铵DORIE 溴化二甲基-2-羟乙基-2,3-二油烯氧基丙基铵DORIE-HP 溴化二甲基-3-羟丙基-2,3-二油烯氧基丙基铵DORIE-HB 溴化二甲基-4-羟丁基-2,3-二油烯氧基丙基铵DORIE-HPc 溴化二甲基-5-羟戊基-2,3-二油烯氧基丙基铵DPRIE 溴化二甲基-2-羟乙基-2,3-双十六烷氧基丙基铵DSRIE 溴化二甲基-2-羟乙基-2,3-双十八烷氧基丙基铵DMRIE 溴化二甲基-2-羟乙基-2,3-双十四烷氧基丙基铵DOGS N-(2-精胺甲酰基)-N’, N’ -双十八烷基甘氨酰胺DOSC 1,2-二油酰-3-琥珀酰-sn-甘油胆碱酯DC-Chol 3β-[N-(N’,N’-二甲基胺乙基)胺基甲酰基]胆固醇LPLL 脂质多聚-L-赖氨酸SA 硬脂胺2、常用辅助脂质辅助脂质主要有磷脂酰乙醇胺(PE)、磷脂酰胆碱(PC)、胆固醇(Chol)等。
阳离子脂质体制备

阳离子脂质体制备
阳离子脂质体制备
一、原料准备
1、抗原:已经纯化的、经过酶联免疫吸附测定法和细胞膜抗体校正法鉴定的标准化的预抗原(有些蛋白质在细胞膜上表达,需要细胞膜抗体校正);
2、表位蛋白:纯化的、标准化并且经过蛋白质印迹证实的表位蛋白;
3、磷脂单体:乙腈溶解的椰子油中的磷脂单体;
4、厌氧细菌:经过特定条件培养出的厌氧细菌;
5、其他材料:抗酶标准溶液、双盐缓冲液、低渗透调节液、注射用水。
二、制备过程
1、将抗原稀释成抗原溶液(稀释以抗原在预测应用中的浓度为准);
2、将磷脂单体稀释为预混合溶液;
3、将预混合溶液和表位蛋白配比搅拌均匀,经低渗透调节液调整至pH为7.4;
4、加入厌氧细菌,混合均匀,经双盐缓冲液调整至pH为
6.5,在4℃下孵育2小时;
5、加入抗酶标准溶液,稀释成注射用水,隔夜稳定,稀释200倍,制备抗原脂质体;
6、处理抗原脂质体,过滤、反渗、离心、冻干等,最终成品为经免疫动力学筛选的抗原脂质体。
三、注意事项
1、抗原溶液、磷脂单体混合溶液必须经双盐缓冲液调整至
pH7.4;
2、添加厌氧细菌时,要将pH值再次调整至6.5;
3、厌氧细菌处理时,一定要注意相应的条件控制(温度、时间等);
4、抗原脂质体溶液稀释至最终用于动物接种的容量时,要用抗酶标准溶液抗击抗酶活性;
5、抗原脂质体制备完成后,一定要进行质量控制,保证其高品质;
6、抗原脂质体应尽快使用,避免变质;
7、在处理时,要注意清洁卫生。
mRNA疫苗的纳米材料递送系统

mRNA疫苗的纳⽶材料递送系统COVID-19⼤流⾏将mRNA疫苗推向了⽣物技术和制药⼯业的中⼼阶段。
疫苗开发的速度也超出了预期,在SARS-CoV-2序列公开10个⽉后就有疫苗⾯世。
这⼀成功不仅证明了⽣物技术和制药⼯业有能⼒应对紧迫和未得到满⾜的全球需求,⽽且也证明了mRNA作为⼀种药物形式的固有能⼒,与常规疫苗相⽐,mRNA疫苗具有成本低、⽣产效率⾼、安全性⾼的优势,且拥有合成任何⼀种蛋⽩的潜能,因此,对于传统疫苗⽆⼒应对的新型传染性病毒有巨⼤应⽤潜⼒。
然⽽,由于mRNA分⼦的不稳定性、先天免疫原性⾼及体内递送效率低等原因,mRNA疫苗的应⽤⼀直受到限制。
要实现mRNA疫苗的⼴泛应⽤,需重点解决递送技术。
mRNA 疫苗需要有合适的递送载体将其递送⾄体内,才能有更好的免疫效果,开发⾼效⽆毒的递送系统是 mRNA 疫苗成功的关键。
美国乔治梅森⼤学⽣物⼯程系主任Michael D. Buschmann教授在综述中阐述了mRNA传递系统的发展,总结SARS-CoV-2 mRNA疫苗的临床前和临床研究结果,重点介绍了⽬前SARS-CoV-2疫苗临床试验中使⽤的脂质纳⽶粒,并且对脂质纳⽶粒在mRNA疫苗中的作⽤进⾏了分析。
在COVID-19之前,mRNA疫苗已⽤于临床前和临床研究,包括流感,寨卡病毒,艾滋病毒,埃博拉病毒,狂⽝病,疟疾,⽣殖器疱疹,⼸形⾍病等。
在⽬前针对新型冠状病毒COVID19疫苗竞赛中,基于mRNA疫苗已初见成效,⽬前正在进⾏的mRNA疫苗⼈体试验共有⼋个,分别是由BioNTech/Pfizer、Moderna、CureVac、Sanofi/TranslateBio、Arcturus/Duke NUS新加坡医学院、伦敦帝国理⼯学院、泰国Chula-longkorn⼤学和Providence Therapeutics领导。
值得注意的是,其中两项试验公布了中期第3阶段试验结果,报告了两次30µg或100µg剂量后编码棘突蛋⽩免疫原的mRNA序列(以脂质纳⽶颗粒形式递送)以及SARS-CoV-2感染率降低94%以上的疗效。
mrna 的化学递送方法

mrna 的化学递送方法
mRNA(信使RNA)的化学递送方法是指将mRNA分子引入细胞内的技术。
这种技术在基因治疗、疫苗研发和细胞治疗等领域具有重要意义。
目前,有几种常见的mRNA化学递送方法:
1. 脂质体递送,脂质体是一种由脂质和蛋白质组成的纳米级粒子,可以包裹mRNA并将其引入细胞内。
这种方法被广泛应用于mRNA疫苗的开发,例如新冠疫苗就是使用脂质体技术将mRNA引入人体细胞中,从而产生免疫反应。
2. 聚合物递送,聚合物可以与mRNA形成复合物,保护mRNA免受降解,并帮助其进入细胞内。
这种方法在基因治疗领域得到广泛应用,可以通过改变聚合物的化学性质来调节mRNA的释放速度和靶向性。
3. 化学修饰,对mRNA分子进行化学修饰可以增加其稳定性和细胞摄取能力,从而提高递送效率。
例如,修饰mRNA的帽结构和聚腺苷酸尾部可以提高其稳定性,使其更容易进入细胞内。
4. 电转染,通过应用电场来促进细胞膜通透性,从而实现
mRNA的递送。
这种方法在实验室研究中被广泛使用,但在临床应用中还存在挑战。
总的来说,mRNA的化学递送方法涉及到脂质体、聚合物、化学修饰和电转染等技术。
这些方法在不同的应用领域具有各自的优势和局限性,科学家们正在不断努力改进这些方法,以提高mRNA的递送效率和安全性,推动基因治疗和疫苗研发等领域的发展。
RNA干扰(RNAi)实验原理与方法

RNA干扰(RNAi)实验原理与方法将与mRNA对应的正义RNA和反义RNA组成的双链RNA(dsRNA)导入细胞,可以使mRNA发生特异性的降解,导致其相应的基因沉默。
这种转录后基因沉默机制(post-transcriptional gene silencing, PTGS)被称为RNA干扰(RNAi)。
RNA干扰包括起始阶段和效应阶段(inititation and effector steps)。
在RNAi效应阶段,siRNA双链结合一个核酶复合物从而形成所谓RNA诱导沉默复合物(RNA-induced silencing complex, RISC)。
关键词:RNA干扰RNAi正义RNA反义RNA dsRN APTGSRISC转录后基因沉默机制RNA诱导沉默复合物近年来的研究表明,将与mRNA对应的正义RNA和反义RNA组成的双链RNA(dsRNA)导入细胞,可以使mRNA发生特异性的降解,导致其相应的基因沉默。
这种转录后基因沉默机制(post-transcriptional gene silencing, PTGS)被称为RNA干扰(RNAi)。
一、RNAi的分子机制通过生化和遗传学研究表明,RNA干扰包括起始阶段和效应阶段(inititation and effector st eps)。
在起始阶段,加入的小分子RNA被切割为21-23核苷酸长的小分子干扰RNA片段(small interfering RNAs, siRNAs)。
证据表明;一个称为Dicer的酶,是RNase III家族中特异识别双链RNA的一员,它能以一种ATP依赖的方式逐步切割由外源导入或者由转基因,病毒感染等各种方式引入的双链RNA,切割将RNA降解为19-21bp的双链RNAs(si RNAs),每个片段的3’端都有2个碱基突出。
在RNAi效应阶段,siRNA双链结合一个核酶复合物从而形成所谓RNA诱导沉默复合物(RNA-induced silencing complex, RISC)。
阳离子脂质体转染原理

阳离子脂质体转染原理阳离子脂质体 (Cationic liposome) 转染技术是一项常用的基因转染工具。
本文将介绍阳离子脂质体转染的原理、优势以及使用注意事项。
一、原理在阳离子脂质体转染中,阳离子脂质体作为载体将目标基因导入细胞。
其原理主要基于脂质体膜及其表面上的阳离子与细胞膜中的阴离子相互作用,从而形成一个稳定的脂质体-细胞复合体。
此外,脂质体通过包裹目标基因,可以提高基因在细胞内的稳定性和可达性,从而增加基因的表达效率。
具体地,脂质体根据其结构可分为正电荷和负电荷两种。
阳离子脂质体的化学结构为:两个羟基移去 H+, 用烃基取代的胆甾酸盐、甘油为脂头,两个线型长链烃基由酯键连接,为脂尾。
阳离子脂质体外表带有正电荷,因为两个正电荷会相互排斥,使其稳定性增加,可以与细胞膜上的负电荷组成电荷复合体,从而实现细胞内目标基因的导入。
二、优势1. 适用于广泛的细胞类型:阳离子脂质体可用于多种类型的细胞,包括哺乳动物细胞、植物细胞和微生物细胞等。
2. 转染效率高:阳离子脂质体可将目标基因高效地导入细胞,提高基因表达效率。
3. 非病毒载体:相比较病毒载体进行基因转染,阳离子脂质体具有较低的细胞毒性,并且对细胞的影响较小。
4. 易于生产和操作:阳离子脂质体制备简单,易于大规模生产,并且转染操作相对简单。
三、注意事项1. 选择合适的脂质体:不同的细胞类型对阳离子脂质体的稳定性和导入效率有不同的要求,因此需要针对不同的细胞类型选择适合的脂质体。
2. 选择合适的DNA量和浓度:过高的DNA量和过低的DNA浓度都会影响转染效率。
一般而言,脂质体和DNA的摩尔比应该在2:1至4:1范围内。
3. 环境影响:阳离子脂质体易受到pH值、离子浓度、温度等环境因素的影响,因此需要保持实验环境相对稳定。
4. 注意细胞毒性:虽然相对于病毒载体,阳离子脂质体的细胞毒性较小,但部分阳离子脂质体可能仍会对细胞造成一定的毒性影响。
因此需要在转染实验中控制好脂质体的用量和浓度,避免对细胞造成不必要的伤害。
mrna-lnp制备

mRNA-LNP的制备方法有多种,包括脂质体挤出法、薄膜水化法、纳米沉淀法、微流控以及冲击射流式混合法等。
不同的制备方法有各自的优势与缺陷,制备出的LNP能否保持其囊泡均匀稳定,成了评价LNP质量的重要指标。
同时,mRNA-LNP的制备也涉及到一些特定步骤。
例如,在脂质体法制备过程中,需要先将磷脂等成分溶解在有机溶剂中,然后通过旋转蒸发等方法去除有机溶剂,再将其与mRNA溶液混合,通过超声或高压匀质等方法制备成脂质体。
之后,再通过挤出或其他方法制备成均匀的mRNA-LNP。
具体制备方法及步骤可能会因实际需求和配方进行调整,建议咨询相关领域专业人士获取更准确的信息。
脂质体递送系统用于mRNA疫苗的抗肿瘤治疗
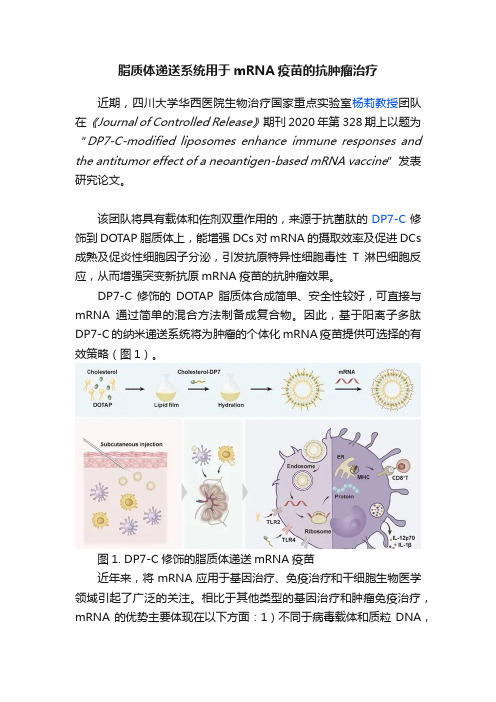
脂质体递送系统用于mRNA疫苗的抗肿瘤治疗近期,四川大学华西医院生物治疗国家重点实验室杨莉教授团队在《Journal of Controlled Release》期刊2020年第328期上以题为“DP7-C-modified liposomes enhance immune responses and the antitumor effect of a neoantigen-based mRNA vaccine”发表研究论文。
该团队将具有载体和佐剂双重作用的,来源于抗菌肽的DP7-C修饰到DOTAP脂质体上,能增强DCs对mRNA的摄取效率及促进DCs 成熟及促炎性细胞因子分泌,引发抗原特异性细胞毒性T淋巴细胞反应,从而增强突变新抗原mRNA疫苗的抗肿瘤效果。
DP7-C修饰的DOTAP脂质体合成简单、安全性较好,可直接与mRNA通过简单的混合方法制备成复合物。
因此,基于阳离子多肽DP7-C的纳米递送系统将为肿瘤的个体化mRNA疫苗提供可选择的有效策略(图1)。
图1. DP7-C修饰的脂质体递送mRNA疫苗近年来,将mRNA应用于基因治疗、免疫治疗和干细胞生物医学领域引起了广泛的关注。
相比于其他类型的基因治疗和肿瘤免疫治疗,mRNA的优势主要体现在以下方面:1)不同于病毒载体和质粒DNA,mRNA不需要整合到宿主的基因组中,所以可以避免可能的插入突变以及异常转录;2)相比于质粒DNA,mRNA组成元件更少,并且可生物降解,仅在短期内起作用,从而降低了产生副作用的风险;3)在个体化免疫治疗的流程中,mRNA相比于肽疫苗具有明显的优势,比如合成成本低、合成周期短,可同时编码多个抗原序列并且不受MHC 单倍型的限制。
此外伴随着mRNA结构工程的发展,例如5'端帽子结构和3'端polyA 尾巴的修饰,极大地改善了mRNA的稳定性差、翻译效率低且易降解的缺点,提高了mRNA在细胞内的翻译效率和稳定性,促进了mRNA疗法的应用。
mrna疫苗结构

mrna疫苗结构
mRNA疫苗是一种新型疫苗,其结构由四个主要组成部分构成:
1. mRNA序列:这是指在疫苗中使用的一种人工制造的mRNA序列。
该序列编码了一些病原体表面的蛋白质,如新冠病毒的S蛋白。
一旦注射入体内,该mRNA 序列会指示身体自行制造该病原体蛋白质,从而刺激人体免疫系统产生抗体。
2.脂质体:疫苗的mRNA序列被包含在脂质体中。
脂质体是脂质分子的球形结构,可以将mRNA序列包裹起来并帮助它进入人体细胞。
脂质体还可以保护mRNA序列不受身体内其他分子的攻击。
3.毒素:某些mRNA疫苗会添加一些毒素成分,使得接种者能够更好地产生免疫反应,并能够刺激其免疫系统进一步产生更多的抗体。
4.稳定剂:为了确保疫苗中的mRNA序列在储存和运输中不会被损坏,一些稳定剂,如蔗糖和甘油,也会被加入到疫苗中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
mrna 阳离子脂质体
mRNA阳离子脂质体是一种重要的基因递送系统,被广泛应用于基因治疗和疫苗开发领域。
本文将介绍mRNA阳离子脂质体的定义、结构、工作原理以及在基因治疗和疫苗开发中的应用。
一、定义
mRNA阳离子脂质体是一种由阳离子脂质包裹的mRNA分子的纳米粒子。
阳离子脂质由正电荷的脂质组成,能够与负电荷的mRNA结合形成稳定的复合物。
二、结构
mRNA阳离子脂质体通常由四个组分构成:mRNA负载部分、阳离子脂质、PEG修饰剂和靶向配体。
1. mRNA负载部分:mRNA负载部分是mRNA阳离子脂质体的核心组成部分,负责携带目标基因信息。
mRNA负载部分由独特的序列决定,可以编码特定的蛋白质。
2. 阳离子脂质:阳离子脂质是mRNA阳离子脂质体的外层包裹物,由正电荷的脂质分子构成。
阳离子脂质能够与mRNA负载部分中的负电荷相互作用,形成稳定的纳米粒子。
3. PEG修饰剂:PEG修饰剂是一种带有聚乙二醇基团的化合物,用于提高mRNA阳离子脂质体的稳定性和生物相容性。
PEG修饰剂可以降低mRNA阳离子脂质体与免疫系统的相互作用,延长其在体内的循
4. 靶向配体:靶向配体是一种结合在mRNA阳离子脂质体表面的分子,能够与特定的细胞受体结合,实现靶向递送。
靶向配体可以提高mRNA阳离子脂质体对特定细胞的选择性。
三、工作原理
mRNA阳离子脂质体通过一系列的步骤实现基因递送。
首先,阳离子脂质与mRNA负载部分相互作用,形成稳定的复合物。
然后,mRNA 阳离子脂质体通过靶向配体与特定的细胞受体结合,实现靶向递送。
一旦进入细胞内,mRNA负载部分被释放,并被细胞的核糖体翻译为蛋白质。
四、应用
mRNA阳离子脂质体在基因治疗和疫苗开发中具有广泛的应用前景。
1. 基因治疗:mRNA阳离子脂质体可以用于治疗遗传性疾病和癌症等疾病。
通过携带特定的修饰mRNA,mRNA阳离子脂质体能够在细胞内编码所需的蛋白质,实现疾病的基因矫正。
2. 疫苗开发:mRNA阳离子脂质体被广泛应用于新型疫苗的开发。
mRNA阳离子脂质体可以携带特定的病毒抗原编码mRNA,通过诱导宿主细胞合成病毒抗原蛋白,从而激发免疫反应,并产生特异性的免疫保护。
mRNA阳离子脂质体作为一种重要的基因递送系统,具有广泛的应用前景。
其结构由mRNA负载部分、阳离子脂质、PEG修饰剂和靶向配体组成。
mRNA阳离子脂质体通过与细胞受体的结合,实现靶向递送,进而在细胞内转录和翻译目标基因。
在基因治疗和疫苗开发领域,mRNA阳离子脂质体已经取得了显著的进展,并展现出巨大的潜力。
未来,随着技术的不断进步和优化,mRNA阳离子脂质体将为基因治疗和疫苗开发带来更多机会和挑战。
