脂质体制备方法
脂质体的制备方法

脂质体的制备方法脂质体是一种在生物医学领域中具有广泛应用前景的载体,它可以用于药物传递、基因治疗等方面。
脂质体的制备方法有多种,下面将介绍其中常用的几种方法。
首先,膜溶解法是一种常见的脂质体制备方法。
在这种方法中,磷脂溶解在有机溶剂中,然后将水相缓慢注入有机相中,通过超声或搅拌等手段使两相混合,形成脂质体。
这种方法制备的脂质体粒径分布较窄,适用于一些需要较为均匀粒径的应用。
其次,薄膜水合法也是一种常用的脂质体制备方法。
在这种方法中,磷脂溶解在有机溶剂中,然后将溶液旋转蒸发,形成薄膜,最后通过加入适量的缓冲液使薄膜迅速水合膨胀,形成脂质体。
这种方法制备的脂质体结构较为稳定,适用于一些需要长期保存的应用。
另外,脂质体凝胶法也是一种常见的制备方法。
在这种方法中,磷脂和胆固醇混合后,加入溶剂并加热,形成透明的溶液,然后冷却形成凝胶,最后通过加入缓冲液使凝胶水合膨胀,形成脂质体。
这种方法制备的脂质体具有较高的稳定性和载药量,适用于一些需要长期保存和高载药量的应用。
最后,脂质体膜内溶解法也是一种常用的制备方法。
在这种方法中,磷脂和胆固醇混合后,在有机溶剂中形成薄膜,然后将药物溶解在内水相中,最后将内水相缓慢注入有机相中,通过超声或搅拌等手段使两相混合,形成脂质体。
这种方法制备的脂质体可以实现药物的高效载荷,适用于一些需要高效载药的应用。
综上所述,脂质体的制备方法有多种,每种方法都有其适用的场景和特点。
在选择制备方法时,需要根据具体的应用要求和实验条件进行综合考虑,以选择最适合的制备方法。
希望本文介绍的内容能对脂质体的制备方法有所帮助。
脂质体的制备方法

脂质体的制备方法
脂质体是一种由磷脂类物质构成的微小球形结构,可以用来包封各种水溶性和不溶性的药物。
以下是制备脂质体的一般方法,不包含标题及重复文字。
1. 选择适当的脂质组分:按照需要包封的药物性质(如极性、脂溶性)选择相应的磷脂类物质,常用的有磷脂酰胆碱(PC)、磷脂酰甘油(PG)、磷脂酰丝氨酸(PS)等。
2. 选择合适的方法:制备脂质体的常用方法有薄膜法、乳化法、脂肪酸分散法等。
根据药物特性和制备要求选择合适的方法。
3. 薄膜法制备脂质体:将L-α-磷脂酰胆碱和药物以适当比例
溶解于有机溶剂中(如氯仿),用旋转蒸发器除去溶剂,形成薄膜。
加入适量水溶液,通过超声波处理或机械震荡破碎薄膜,生成脂质体悬浮液。
4. 乳化法制备脂质体:将磷脂、药物和辅助乳化剂(如表面活性剂)溶解于有机溶剂中。
将该溶液滴加到含有乳化剂的水相中,并用机械手段(如超声波)进行乳化处理,形成脂质体。
5. 脂肪酸分散法制备脂质体:将药物与脂肪酸(如硬脂酸)按一定比例共熔,然后迅速冷却。
通过乳化剂或超声波等方法将该混合物乳化成脂质体。
6. 脂质体的后处理:根据需要可以对脂质体进行一些后处理步骤,如冻干、冻融法提高脂质体稳定性等。
综上所述,脂质体的制备方法可以根据实际需求选择薄膜法、乳化法或脂肪酸分散法。
制备时要选择适当的脂质组分,并根据需要进行后处理以提高脂质体的稳定性。
脂质体的制备方法

脂质体的制备方法
脂质体是一种由两层磷脂分子构成的微小囊泡,内部可以包裹
水溶性或脂溶性的药物。
由于其良好的生物相容性和药物传递性能,脂质体在药物输送领域得到了广泛的应用。
下面我们将介绍脂质体
的制备方法。
首先,脂质体的制备需要选择合适的磷脂。
常用的磷脂有卵磷脂、大豆磷脂、磷脂酰胆碱等。
在实验室条件下,我们可以根据需
要选择不同种类的磷脂来制备脂质体。
其次,将所选的磷脂溶解在有机溶剂中,得到磷脂溶液。
常用
的有机溶剂有氯仿、甲醇、乙醇等。
在此过程中需要注意控制温度
和溶剂的选择,以确保磷脂能够完全溶解。
接下来,将药物溶解在水相中。
需要注意的是,药物的选择应
当考虑其溶解度和药效学特性。
将药物溶液缓慢滴加到磷脂溶液中,并利用超声波或机械搅拌等方法使两相充分混合。
然后,利用旋转蒸发、薄膜超滤、凝胶层析等方法去除有机溶剂,得到脂质体悬浮液。
在此步骤中需要注意控制温度和压力,以
避免对脂质体结构的破坏。
最后,通过超声处理、高压均质等方法对脂质体悬浮液进行处理,得到均匀、稳定的脂质体悬浮液。
在此过程中需要注意控制处
理时间和能量密度,以确保脂质体的质量和稳定性。
综上所述,脂质体的制备方法包括选择合适的磷脂、溶解磷脂、药物的溶解和混合、去除有机溶剂以及最后的处理步骤。
在实际操
作中,需要严格控制各个步骤的条件,以确保脂质体的质量和稳定性。
希望以上内容能够对您有所帮助。
脂质体的制备及其应用

脂质体的制备及其应用近年来,脂质体在制药领域里展现出了广阔的应用前景。
从初期的制备到现在的技术逐渐成熟,脂质体已经成为制药工业中最热门的制剂载体之一。
本文将介绍脂质体的制备及其应用。
一、脂质体的制备1. 胆固醇和磷脂共混法该制备法是最早的脂质体制备方法之一,实现较为简单。
只需将胆固醇和磷脂以特定比例共混,并使用水或其他溶剂进行溶解,即可制备出脂质体。
2. 薄膜法该制备法是制备脂质体的另一种常见方法。
将磷脂及其他组份按一定比例混合,并在热水浴中加热搅拌,并持续将其挤压,形成薄膜,薄膜会自行聚集形成脂质体。
3. 超声波法该制备法利用超声波的力量将水相和油相分散均匀,从而形成脂质体。
简单易行且可重复性良好,所以是制备脂质体最常用的方法之一。
二、脂质体的应用1. 药物传递脂质体是一种非常好的药物传递载体,由于其构成和细胞膜相似,因此可有效载药物,并快速进入人体细胞。
脂质体还可以用于治疗肿瘤和炎症。
2. 增强药物传递的稳定性很多药物容易被分解,但是通过使用脂质体,这些药物可以被稳定传递,并防止药物在消化过程中被分解。
对于某些对稳定性要求极高的药物,如RNA、DNA和酶,脂质体的应用显得尤为重要。
3. 疫苗传递最近几年,脂质体在疫苗传递方面展现出自己的优势。
将疫苗包裹在脂质体中,可呈现出更好的抗原肽处理,并取得良好的抗体反应。
这让脂质体成为了一种非常良好的疫苗传递载体。
4. 脂质体在饮食保健品中的应用还有一些饮食保健品在其制备过程中也可以使用脂质体。
例如,脂质体可用于保护鱼油或其他有益成分的品质和稳定性,并让它们更方便地传递到人体内。
总的来说,脂质体已成为制药工业中不可或缺的一部分,并在医药、食品及化妆品等领域发挥着重要作用。
脂质体的制备方法也在不断更新,未来必将有更多的应用领域,为人类健康和生活发挥更大的作用。
脂质体的制备

脂质体的制备脂质体是一种常见的生物细胞的一种重要的结构元素,它拥有独特的外型和内部结构,含有丰富的脂质和蛋白质,能够构成细胞的支架并且能赋予细胞丰富的功能。
脂质体也可以被用于制备有药效负载物质(如药物、基因治疗药物等)的药物载体,有助于药物更好地穿越血脑屏障,从而更有效地治疗神经系统疾病。
因此,脂质体制备技术受到了科学家们的关注。
1、脂质体制备技术主要有三种:溶胀法、过失法和双膜法,其中溶胀法是最常见的。
溶胀法的原理是利用热溶剂应力和化学应力使表面活性剂脂质形成脂质体。
过失法是利用热溶剂或难溶的脂质的溶解度的变化使其形成脂质体,这种方法的优点是能够大量制备单组分微粒,但缺点是生成的脂质体不稳定,多组分混合也不利于微粒的形成。
双膜法是由水溶性溶剂和水不溶的溶剂混合之后,表面活性剂脂质分相聚合形成微胶囊,该方法制备的脂质体在稳定性上有很大的提高,有利于多组分混合。
2、脂质体制备需要一系列操作步骤,包括溶剂准备放入热循环搅拌器中,调整温度和搅拌速度,根据不同的技术,使脂质体形成并分离。
其中,调节温度和搅拌速度是关键步骤,必须在合理温度范围内,以保证溶液和混合能够有效完成,同时保证搅拌速度和时间,让脂质体形成并分离。
3、在实际操作中,应考虑实验室条件、材料特性和安全性,根据实验需要确定溶剂的比例,并保证材料的完整性及包覆物的质量。
另外,脂质体的安放也需要非常严格的管理,及时进行筛选试验,以保证其品质及有效投入使用。
脂质体的制备是一种微观尺度上的操作,通过合理的物理处理,可以使脂质体具有一定的结构稳定性,可以承载药物和其它物质,发挥药物平台作用,比较安全有效地用于药物载体制备,为药物的有效穿越血脑屏障而打开新的立体思路。
脂质体制备工艺流程

脂质体制备工艺流程脂质体是一种由磷脂和胆固醇等成分组成的小型纳米载体,具有良好的生物相容性和生物可降解性。
脂质体在药物递送和基因治疗方面具有广泛的应用前景。
下面将重点介绍脂质体的制备工艺流程。
一、磷脂选择脂质体的制备以磷脂为主要原料,常用的磷脂有卵磷脂、磷脂酰胆碱、磷脂酰丝氨酸等。
选择适合的磷脂是制备高质量脂质体的重要因素。
二、制备方法1. 薄膜分散法将磷脂溶解在有机溶剂中制备成薄膜,再加入药物或基因,利用机械或超声分散制备脂质体。
该法制备的脂质体颗粒分布比较均匀,适合制备小型脂质体。
2. 溶剂挥发法将磷脂溶解在有机溶剂中,加入药物或基因,通过挥发有机溶剂制备脂质体。
该法可以制备大量的脂质体,但颗粒大小分布不如薄膜分散法。
3. 冻干法将磷脂溶解在水相中,加入药物或基因,通过冻干、再溶解、超声或机械处理制备脂质体。
该法制备的脂质体稳定性较好,适合制备高含药量的脂质体。
三、性质调节为了满足不同的应用需求,可以通过改变脂质体的表面性质、大小、药物包载量和脂质组分来调节脂质体的性质。
常用的方法有加入表面活性剂、多肽等改变脂质体表面性质,改变磷脂组分、添加胆固醇等调节脂质体结构和稳定性。
四、质量检测在脂质体制备过程中,应注意生产环境的净化和卫生,保证脂质体的质量安全。
脂质体质量的检测方法包括颗粒大小、分布、多分散性、药物包载量、稳定性等方面的指标测定。
综上所述,脂质体的制备工艺包括磷脂选择、制备方法、性质调节和质量检测。
通过合理选择磷脂和制备方法以及进行性质调节和质量检测,可以得到性质稳定、药物包载量高的高质量脂质体,为药物递送和基因治疗等领域提供了广阔的应用前景。
脂质体制备
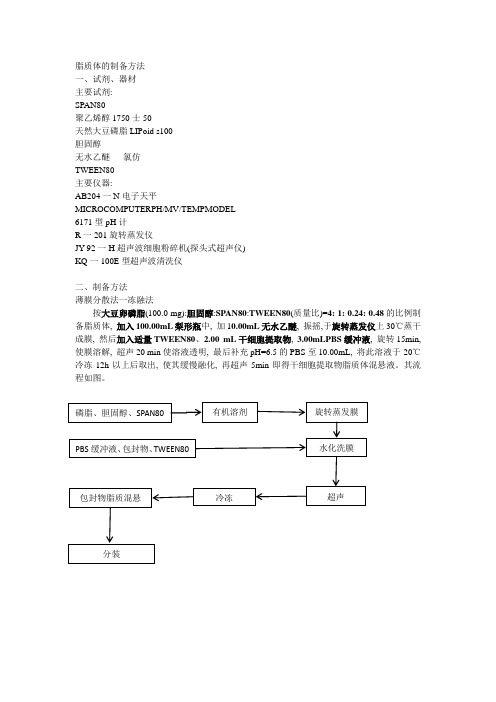
脂质体的制备方法
一、试剂、器材
主要试剂:
SPAN80
聚乙烯醇1750士50
天然大豆磷脂LIPoid s100
胆固醇
无水乙醚氯仿
TWEEN80
主要仪器:
AB204一N电子天平
MICROCOMPUTERPH/MV/TEMPMODEL
6171型pH计
R一201旋转蒸发仪
JY-92一H超声波细胞粉碎机(探头式超声仪)
KQ一100E型超声波清洗仪
二、制备方法
薄膜分散法一冻融法
按大豆卵磷脂(100.0mg):胆固醇:SPAN80:TWEEN80(质量比)=4:1:0.24:0.48的比例制备脂质体,加入100.00mL梨形瓶中,加10.00mL无水乙醚,振摇,于旋转蒸发仪上30℃蒸干成膜,然后加入适量TWEEN80、2.00mL干细胞提取物,3.00mLPBS缓冲液,旋转15min,使膜溶解,超声20min使溶液透明,最后补充pH=6.5的PBS至10.00mL,将此溶液于-20℃冷冻12h以上后取出,使其缓慢融化,再超声5min即得干细胞提取物脂质体混悬液。
其流程如图。
脂质体制备方法

2 脂质体的制备方法2.1 薄膜蒸发法该方法是将脂质及芯材(脂溶性药物)溶于有机溶剂,然后将此溶液置于大圆底烧瓶中,再旋转减压蒸干,磷脂在烧瓶内壁上会形成一层很薄的膜,然后加入一定量的缓冲溶液(生理盐水),充分振荡烧瓶使脂质膜水化脱落,即可制得脂质体。
尽管薄膜分散法是使用最广泛的方法,由于这种方法比较原始,所以尚存在较多缺点。
用该方法制备得到的脂质体的粒径较大且不均匀,为了使其粒径更小、更均匀,可通过超声波仪处理,在一定程度上降低脂质体的粒径,从而提高包封率。
如采用此法制备得到的细辛脑脂质体的包封率达54. 1%[5]。
2.2超声波法MLVs的混悬液经超声波处理,再通过Sepharose 2B或4B柱色谱仪可去除较大的脂质体和MLVs。
常用的方法有探针型和水浴型。
小量脂质悬液(高浓度脂质或黏性水溶液)需要高能量时用探针型。
水浴型更适于大量的稀释脂质。
郑宁等[6]采用薄膜-超声分散法制备依托泊苷脂质体,按均匀设计的最优组合制备脂质体的平均包封率为(61.58±0.83)% ,粒径均小于2μm,体外释药达到了长效缓释的作用,60Co灭菌后脂质体较稳定。
李维凤等[7]以薄膜-超声法和乙醚注入法制备硝苯地平脂质体,结果表明薄膜蒸发法和超声法综合使用,所得脂质体粒径均匀,粒度小,且多为单室。
2.3复乳法(二次乳化法)这种方法是先将脂质溶于有机溶剂,加入待包封芯材的溶液,乳化得到W/O初乳,其次将初乳加入到10倍体积的水溶液中混合,进一步乳化得到W/O/W乳液,然后在一定温度下去除有机溶剂即可得到脂质体,其包封率变化较大,一般为20%-80%。
通过研究发现,在第二步乳化过程和有机溶剂的去除过程中,对脂质体的粒径有较大影响的因素是温度,较低的温度有利于减小脂质体的粒径。
姚瑶等[8]采用二次乳化法制备的酪丝亮肽多囊脂质体,不仅稳定性好,80%的粒径分布在20-30μm,且包封率为92. 43%。
2.4反相蒸发法(逆相蒸发法)反相蒸发法最初由Szoka和Papahadjopoulos于1978年提出,这种方法适用于脂质成分中磷脂占有较大的比例,且芯材中水溶性成分较多的情况。
脂质体制备的方法

脂质体制备的方法脂质体是一种由脂质分子组成的微细粒子,主要用于制备及输送药物、基因和化妆品成分等。
脂质体具有优异的生物相容性和生物可降解性,并且可以有效稳定和保护被包封的药物或成分。
目前,常用的脂质体制备方法包括薄膜溶解法、乳化法、胶束法、膜断裂法、气相法等。
下面将详细介绍这些方法。
薄膜溶解法是一种利用脂质和溶剂溶解及薄膜形成原理制备脂质体的方法。
首先,选择适当的脂质和溶剂。
常用的脂质有磷脂类(如磷脂酰胆碱、磷脂酰丝氨酸)、脂肪醇(如固体脂肪醇)、脂肪酸等。
常用的溶剂有乙醇、二甲酚、甲醇和酯类溶剂。
然后,将脂质和溶剂溶解在一起,通过快速旋转薄膜机或制备配制机将溶液薄膜扩散到玻璃底板上,在适当的温度和时间下形成脂质质体。
最后,通过超声处理或其他方法将脂质质体分散成脂质体悬浮液。
乳化法是一种利用乳化剂和脂质相互作用生成脂质体的方法。
乳化剂常用的有表面活性剂和共乳剂。
表面活性剂包括非离子型(如Tween系列)和阴离子型(如脂肪酸钠盐)。
共乳剂包括长链脂肪醇(如固体脂肪醇)、糖(如蔗糖、葡萄糖)和胆汁酸类。
首先,将乳化剂和脂质在适当比例下溶解在无水有机溶剂中。
然后,加入水相,通过机械剪切或超声处理将脂质和乳化剂形成乳液。
最后,通过去除有机相或冷冻干燥等方法获得脂质体。
胶束法是一种利用表面活性剂和脂质相互作用形成胶束后制备脂质体的方法。
首先,选择适当的表面活性剂,如磷脂酰胆碱、磷脂酰丝氨酸等。
然后,将表面活性剂溶解在溶剂中,通过搅拌、超声处理等方法形成胶束。
最后,将胶束与药物或成分混合,通过快速稀释或其他方法获得脂质体。
膜断裂法是一种利用高压处理使脂质质体断裂形成脂质体的方法。
首先,通过之前介绍的方法制备脂质质体悬浮液。
然后,将悬浮液经过高压处理,使脂质质体断裂成小颗粒,形成脂质体。
最后,通过超声处理或其他方法除去未断裂的脂质颗粒,获得脂质体。
气相法是一种利用空气或氮气吹淋使脂质溶液蒸发形成脂质体的方法。
脂质体制备工艺流程

脂质体制备工艺流程
脂质体是一种类似于自然界中存在的脂质体的微小粒子,在药物输送中具有广泛的应用。
脂质体制备工艺流程主要包括以下几个环节: 1. 液相制备:首先需要将所需的药物、脂质体原料和乳化剂等
组分按照一定比例加入到水相中。
然后,使用机械搅拌或超声波处理等方法,使其形成一个稳定的乳液。
2. 单步法制备:将脂质体原料和药物共同混合,然后通过乳化
和超声波处理等方式制备脂质体。
3. 反向微乳化法:将脂质体原料和乳化剂,以及反相剂等组分
混合,形成一个稳定的反向微乳液,然后通过添加外相使得脂质体形成。
4. 油水两相法:将脂质体原料和药物溶于有机溶剂中,然后将
其滴加到水相中,形成一个乳液,最终通过去除有机溶剂使得脂质体形成。
脂质体制备的工艺流程具有一定的复杂性,在实际操作中需要根据具体的要求进行选择和调整。
同时,还需要注意稳定性、纯度等方面的问题,以确保制备出的脂质体具有良好的药物输送效果。
- 1 -。
脂质体制备方法

脂质体制备方法
脂质体是一种由脂质构成的微粒,常用于药物传递和基因转染等领域。
常见的脂质体制备方法包括以下几种:
1. 脂质薄膜混悬法(Thin-film hydration method):将脂质和
药物按一定比例溶解在有机溶剂中,制备成薄膜,然后通过加入缓冲溶液或其他溶液来重悬薄膜,形成脂质体。
2. 油水乳化法(Emulsion method):将脂质和药物溶解在水
相和油相中,通过机械剪切或超声波处理使两相乳化,并形成脂质体。
3. 水介质溶解法(Ether injection method):将脂质和药物溶
解在有机溶剂中,然后使用高速搅拌或机械剪切射入水相中,并迅速挥发有机溶剂,使脂质形成粒状结构。
4. 反向脂质体法(Reverse phase evaporation method):将脂质和药物按一定比例混合,加入有机溶剂形成混合体系,然后加入水相,通过振荡或加热使有机溶剂插入水相,形成胶束,最后去除有机溶剂,得到脂质体。
5. 膜片发育法(Lipid film hydration method):将脂质溶解在
有机溶剂中形成薄膜,将溶剂挥发干燥后,加入含有药物的水相,经超声辐照或搅拌使薄膜与水相均匀悬浮,并形成脂质体。
这些方法各有优缺点,选择合适的方法取决于具体应用的要求和物质特性。
制备脂质体的方法

制备脂质体的方法
脂质体的制备方法大体可以分为液相法和固相法。
(1)液相法:
此方法通常是由磷脂、脂肪酸和蛋白质或其它物质组成的混合溶液形成脂质体,具体操作步骤如下:
①将磷脂和脂肪酸加入微量水中,混合搅拌至完全溶解;
②将蛋白质或其它物质加入上述混合溶液中,再搅拌混合;
③在pH值、温度适宜条件下进行静置,使脂质体形成;
④该混合溶液中的离子性物质会对脂质体的形成产生影响,需要进行离子交换柱净化,去除杂质;
⑤当脂质体形成后,冰箱冷却一段时间,使其固化,最后将其离心收集。
(2)固相法:
此方法的基本原理是将脂质和蛋白质混合,然后用乙醇/水混合物溶解,再加入极性溶剂萃取,使脂质体形成,具体操作步骤如下:
①将磷脂、脂肪酸和蛋白质混合,并加入乙醇/水混合物溶解;
②将溶解后的混合液用真空过滤,去除乙醇;
③加入极性溶剂,使其混合物形成脂质体;
④用离心机将混合物中的脂质体收集,再利用冰箱冷却,使其固化;
⑤最后用溶剂洗脱,去除其余的极性溶剂,即可得到所需的脂质体。
制备脂质体的方法

制备脂质体的方法脂质体是一种由磷脂类物质构成的微型结构,常用于药物传递和基因传递等领域。
制备脂质体的方法有多种,下面我将详细介绍其中几种常用的方法。
1. 脂质溶液混合法:这是最常见的制备脂质体的方法之一。
首先,选择合适的脂质和胆固醇进行溶解,在有机溶剂(如氯仿、甲醇等)中制备脂质溶液。
然后,将要包封的药物或基因载体等添加到脂质溶液中,形成混合溶液。
接着,通过旋转蒸发法或其他方法除去有机溶剂,得到干燥的脂质膜。
最后,在适当条件下,如加入缓冲溶液或具有适当水分含量的溶剂,使脂质膜重新形成多层脂质囊泡。
2. 混合溶剂蒸发法:这种方法适用于制备大量脂质体。
首先,选择合适的脂质和胆固醇,如磷脂类物质(如卵磷脂、磷脂酰乙醇胺等)和胆固醇等,在有机溶剂(如氯仿、甲醇等)中制备脂质溶液。
然后,将混合溶液加入到气候箱或旋转蒸发仪中,使有机溶剂慢慢挥发,形成脂质膜。
最后,使用缓冲溶液重新形成多层脂质囊泡。
3. 超声法:这是一种制备大量脂质体的常用方法。
首先,选择合适的脂质和胆固醇,在有机溶剂中制备脂质溶液。
然后,将脂质溶液以滴定或喷雾的方式添加到含有表面活性剂(如Tween-80)的水溶液中,并通过超声处理使其均匀分散。
超声会产生高频震荡波,使脂质在水相中形成多层脂质囊泡。
最后,使用适当的方法,如超速离心法或滤膜法,将所得脂质体分离出来。
4. 凝胶转移法:这是一种制备大量稳定脂质体的方法。
首先,将脂质和胆固醇等溶解在有机溶剂中,制备脂质溶液。
然后,将脂质溶液与含有水的凝胶混合,制备脂质-凝胶混合物。
接着,通过连续冻结-解冻循环进行转移,使溶胶凝胶中的水逐渐转移到脂质-凝胶混合物中,形成脂质体。
以上是几种常用的制备脂质体的方法。
通过选择适当的方法以及脂质和胆固醇的组合,可以制备出具有不同性质和功能的脂质体。
这些脂质体在药物传递和基因传递等领域具有广泛的应用潜力。
简答题听写出制备脂质体的五种常用方法

简答题听写出制备脂质体的五种常用方法
(1)注入法
将类脂质和脂溶性药物共溶于有机溶剂中(一般多采用乙醚)作为油相,水溶性药物加人磷酸盐缓冲液中作为水相。
然后将油相经注射器缓缓注入加热至50℃~60℃。
(2)薄膜分散法
将类脂质与脂溶性药物溶于三氯甲烷(或其他有机溶剂)中,然后将三氯甲烷溶液在烧瓶中旋转蒸发,使在烧瓶内壁上形成薄膜;加入含有水溶性药物的磷酸盐缓冲液,不断振摇或搅拌,即可生成脂质体,其粒径约为1~5μm。
(3)超声波分散法
绝大多数为单室脂质体。
(4)逆相蒸发法
得大单室脂质体,包封药量大,适合于包封水溶性药物及大分子生物活性物质,如各种抗生素、胰岛素、免疫球蛋白、碱性磷酯酶、核酸等。
(5)用磁力搅拌器搅拌的水相中,继续搅拌挥尽有机溶剂,即得脂质体。
粒径大,不宜作静脉用。
再经超声或通过高压乳匀机,所得产品大多为单室脂质体。
脂质体的制备方法

脂质体的制备方法
脂质体是一种由脂质构成的微小囊泡,可用于药物传递和技术研究。
以下是脂质体的一种常见制备方法:
1. 脂质选择:选择适当的脂质作为载体,常见的脂质包括磷脂(如磷脂酰胆碱和磷脂酰乙醇胺)、胆固醇等。
根据需要可选择不同种类和比例的脂质。
2. 溶剂选择:将所选的脂质溶解在一个合适的溶剂中,常见的溶剂有无水乙醇、氯仿、二氯甲烷等。
溶剂的选择应该考虑到其对脂质的溶解性和对目标应用的安全性。
3. 溶剂去除:使用旋转蒸发仪、氮气吹干等方法将溶剂去除,以便得到脂质的薄膜或干燥物。
4. 水相制备:将药物或其他要包含在脂质体内的物质溶解在适当的水相中,形成水相溶液。
5. 水相与脂质相结合:将脂质的薄膜或干燥物加入水相中,并使用超声波处理、机械切割等方法将其混合均匀。
使脂质与水相形成乳液。
6. 制备脂质体:使用超声波处理、乳化机等方法对乳液进行进一步处理,使脂质体形成更加均匀和稳定的粒子。
7. 进一步处理(可选):根据需要,可以进行进一步的处理,如使用超滤、离心、冷冻干燥等方法对脂质体进行纯化和浓缩。
以上是一种常见的脂质体制备方法,但具体的制备步骤和条件可能会因实际情况和目标应用的不同而有所差异。
因此,在制备脂质体时应结合具体要求和设备条件进行调整。
脂质体的制备和应用

脂质体的制备和应用脂质体是一种具有生物相容性和可控释放性的纳米粒子。
它由一层或多层脂质分子组成,内部可装载药物或其他活性分子,可用于制备药物纳米载体、化妆品、食品添加剂等。
本文将从脂质体的制备和应用两个方面进行论述。
一、脂质体的制备脂质体的制备方法主要有两种:膜溶法和乳化法。
膜溶法是将两种或多种脂质在适当的溶剂中混合,使其形成可溶的薄膜,再通过一定的方法使膜状脂质分子团聚为球形的脂质体。
这种制备方法能够制备出不同的脂质体结构,如单层脂质体、多层脂质体、脂质体纳米囊泡、异构脂质体等,各种结构的脂质体在载药和释药方面都有其独特的特点。
但这种方法制备出的脂质体的形状和大小比较难控制,存在着较大的批次差异性。
乳化法是将一定的脂质、表面活性剂、油相和水相等成分按一定的比例混合,然后进行超声波或机械搅拌等加工,制备出直径约为50~200 nm的脂质体。
由于该方法制备的脂质体比较均匀,易于批量制备,成本较低,因此是制备脂质体的常用方法之一。
二、脂质体的应用脂质体作为一种优良的药物纳米载体,在药物传递、治疗等方面发挥着重要作用,下面分别从药物纳米载体、化妆品、食品添加剂等方面进行阐述。
1. 药物纳米载体脂质体可作为药物纳米载体来输送药物,可用于改善药物的生物利用度、提高药物的稳定性、降低药物副作用和缩短药物作用时间等。
临床上,脂质体已得到广泛应用,如含有异丙肾上腺素的脂质体制剂,用于治疗心血管系统疾病;脂质体氟替卡松乳剂,用于治疗儿童哮喘等。
此外,脂质体还可以结合靶向纳米技术,通过修饰脂质体表面的靶向物质,使其“找到并粘附”在靶细胞上,进一步提高药物的靶向性和效果。
2. 化妆品脂质体还可用于化妆品的制备和应用。
与普通化妆品不同,脂质体化妆品能够带来更好的修复效果。
这是因为脂质体具有良好的生物相容性,可渗透入皮肤细胞、发挥长时间的药效;同时脂质体尺寸小,能够更好地适应皮肤细胞的形态和结构。
值得一提的是,脂质体还能够改善化妆品中活性成分的稳定性,如纳米透明质酸脂质体化妆品,能在保湿的同时降低透明质酸分子的分解,从而更好地发挥保湿效果。
脂质体的制备方法及工艺流程

脂质体的制备方法及工艺流程
脂质体是一种由脂质分子组成的微小球形结构体,具有良好的生物相容性和生物降解性,可用于药物传递、基因传递、基因治疗、疫苗制备等领域。
本文介绍了脂质体的制备方法及工艺流程。
脂质体制备方法:
1. 膜法制备法:将脂质分子溶解在有机溶剂中,再利用蒸发浓缩、旋转蒸发等方法制备脂质体。
2. 水相沉淀法:将脂质分子与胆固醇、表面活性剂等混合,再将其加入到含有生理盐水的水相中,以形成脂质体。
3. 反应溶液法:利用化学反应使脂质分子聚合成脂质体。
脂质体制备工艺流程:
1. 材料准备:准备脂质分子、胆固醇、表面活性剂等材料。
2. 溶解:将脂质分子、胆固醇等在有机溶剂中溶解,制备脂质体溶液。
3. 调节pH值:将脂质体溶液的pH值调节至合适的范围。
4. 加入水相:将脂质体溶液滴加入含有生理盐水的水相中。
5. 超声处理:利用超声波将脂质体均匀分散在水相中。
6. 离心:将制备好的脂质体溶液进行离心,分离出脂质体。
7. 洗涤:用生理盐水等洗涤剂洗涤脂质体,去除杂质。
8. 保存:将洗涤好的脂质体溶液保存在低温处,避免脂质体破坏。
以上就是脂质体的制备方法及工艺流程的介绍,希望能对相关
人员有所帮助。
脂质体的制备方法

脂质体的制备方法
脂质体是一种在生物医药领域中应用广泛的载体,可以用于药物传递、基因转
染等领域。
脂质体的制备方法多种多样,下面将介绍几种常用的制备方法。
首先,常见的脂质体制备方法之一是薄膜溶解法。
这种方法是将所需的脂质和
胆固醇按一定的摩尔比溶解在有机溶剂中,然后蒸发除去溶剂,得到薄膜,再用含有水溶液进行重溶,形成脂质体。
这种方法简单易行,制备的脂质体质量较好。
其次,还有脱水膜膨胀法。
这种方法是将所需的脂质和胆固醇溶解在有机溶剂中,然后蒸发除去溶剂,得到脂质膜,再用含有脱水剂的溶液使脂质膜膨胀,形成脂质体。
这种方法制备的脂质体内部结构较为均匀,适用于一些特殊药物的载体。
另外,还有超声法制备脂质体的方法。
这种方法是将所需的脂质和胆固醇溶解
在有机溶剂中,然后通过超声波作用使其形成脂质体。
这种方法制备的脂质体颗粒大小较为均匀,适用于一些需要粒径较小的药物载体。
除此之外,还有脂质体凝胶法。
这种方法是将所需的脂质和胆固醇溶解在有机
溶剂中,然后加入水溶液,形成脂质体凝胶,再用超声或机械方法使凝胶分散成脂质体。
这种方法制备的脂质体内部结构较为稳定,适用于一些需要长时间存储的药物。
总的来说,脂质体的制备方法多种多样,可以根据具体的需要选择合适的方法。
不同的方法制备的脂质体具有不同的特点,可以满足不同的药物载体需求。
希望以上介绍的方法可以为相关研究和实践提供一定的参考和帮助。
药物制剂中脂质体的制备与应用研究

药物制剂中脂质体的制备与应用研究近年来,随着药物研究的深入,脂质体作为一种重要的药物载体逐渐受到了广泛关注。
脂质体是一种由磷脂类物质组成的微囊体,具有优异的生物相容性和生物降解性,对水溶性和油溶性药物都有良好的包封效果。
本文将重点讨论脂质体的制备方法及其在药物制剂中的应用研究。
一、脂质体的制备方法1. 脂膜溶解法脂膜溶解法是一种常用的脂质体制备方法。
其主要步骤是将磷脂溶解在有机溶剂中,然后加入药物,通过溶剂蒸发或超声乳化等方法形成脂质体。
这种方法制备的脂质体具有较小的粒径和较高的药物包封率。
2. 沉淀法沉淀法是一种通过药物与磷脂的共沉淀形成脂质体的方法。
药物和磷脂在溶液中共同形成微囊体,然后通过离心等方法分离得到脂质体。
这种方法制备的脂质体结构较为稳定,能够有效保护药物免受外界环境的干扰。
3. 脂质指位法脂质指位法是一种通过指位的膨胀作用使药物与磷脂相互混合形成脂质体的方法。
该方法制备的脂质体具有较高的药物包封率和较好的稳定性,适用于疏水性药物的制备。
二、脂质体在药物制剂中的应用1. 提高药物稳定性脂质体作为一种良好的药物载体,能够有效保护药物免受外界环境的干扰。
在药物制剂中加入脂质体可以提高药物的稳定性,延长药物的有效期,并减少药物的副作用。
2. 改善药物生物利用度脂质体能够提高药物的生物利用度,增加药物的口服吸收。
脂质体由于具有与细胞膜相似的结构,能够在胃肠道中与细胞膜融合,促进药物的吸收。
因此,在口服给药制剂中加入脂质体可以提高药物的生物利用度,减少药物的剂量。
3. 改善药物的靶向性脂质体可以通过改变其表面性质,使药物能够更好地靶向到病灶部位。
例如,通过改变脂质体的表面电荷,可以增强脂质体对肿瘤细胞的亲和力,实现药物的靶向输送。
4. 提高药物的溶解度和稳定性脂质体在药物制剂中添加后,可以显著提高药物的溶解度和稳定性。
由于脂质体具有良好的生物相容性和降解性,能够与药物形成亲和性较好的结合,从而改善药物的溶解度和稳定性,提高药物的疗效。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
微脂體(又称脂质体)及其制备方法一二微脂體(又称脂质体)微脂體起源於1960 年代中期,Bangham博士等人首先提出,在磷酸脂薄膜上加入含鹽分的水溶液後,再加以搖晃,會使脂質形成具有通透性的小球;196 8年,Sessa 和Weissmann 等人正式將此小球狀的物體命名為微脂體(liposo me)並做出明確的定義: 指出微脂體是由一到數層脂質雙層膜(lipid bilayer)所組成的微小的囊泡,有自行密合(self-closing)的特性。
微脂體由脂雙層膜包裹水溶液形成,由於構造的特性,可同時作為厭水性(hydrophobic)及親水性(hydrophilic)藥品的載體,厭水性藥品可以嵌入脂雙層中,而親水性藥品則可包覆在微脂體內的水溶液層中。
如同細胞膜,微脂體的脂質膜為脂雙層構造,由同時具有親水性端及厭水性端的脂質所構成,脂雙層由厭水性端相對向內而親水性端面向水溶液構成,組成中的兩性物質以磷酸脂質最為常見。
微脂體的形成是兩性物質在水溶液中,依照熱力學原理,趨向最穩定的排列方式而自動形成。
微脂體的性質深受組成脂質影響,脂質在水溶液的電性,決定微脂體是中性或帶有負電荷、正電荷。
此外,磷酸脂碳鏈部分的長短,不飽和鍵數目,會決定微脂體的臨界溫度(transition temperature, Tc),影響膜的緊密度。
一般來說,碳鏈長度越長臨界溫度越高,雙鍵數越多則臨界溫度越低,常見的DPPC(dipalmitoylp hosphatidylcholine)与DSPC(distearoylphosphatidylcholine)的臨界溫度分別是42℃與56℃,而Egg PC(egg phosphatidylcholine)與POPC(palmitoyl oleoyl phosphatidylcholine)的Tc 則低於0℃。
臨界溫度影響微脂體包裹及結合藥物的緊密度,當外界溫度高於Tc時,對膜有通透性的藥物,較容易通過膜;此外,當外界溫度處於臨界溫度時,微脂體脂質雙層膜中的脂質,會因為流動性不一致而使微脂體表面產生裂縫,造成內部藥物的釋出。
在磷脂質內加入膽固醇,會對微脂體性質產生下列影響:增加微脂體在血液中的安定性,較不易發生破裂;減少水溶性分子對微脂體脂膜的通透性;增加微脂體的安定性,使其在血液循環中存在的時間較長。
微脂體可依脂雙層的層數或是粒子大小,加以命名或分類:(1) Multilamellar vesicle(MLV)是具有多層脂雙層之微脂體,粒子大小介於100-1000 nm,特色是粒子內具多層脂質膜,一般而言,乾燥後的脂質薄膜,直接水合後,即形成MLV,體積通常較為龐大,脂質含量較高。
MLV 的脂雙層數,一般在五層以上;小於五層的MLV 又稱為oligo-lamellar liposomes 或paucilamellar vesicle。
(2) Large Unilamellar Vesicle ( LUV) 則是單層脂雙層所構成的微脂體,一般指1000 nm 等級(250-2500 nm 或更大)的微脂體,動物細胞便是一種LU V。
(3) Intermediate-sized Unilamellar Vesicle (IUV) 也是單層脂雙層所構成的微脂體,一般指100 nm 等級(25-250 nm)的微脂體。
不過,目前一般文獻已經很少使用IUV,而是將它併入SUV 中。
(4) Small Unilamellar Vesicle (SUV)是單層脂雙層所構成的小微脂體,早期的分類指特定磷酸脂所能夠成的最小微脂體(一般以超音波震盪製成)。
如egg PC 以生理食鹽水(normal saline) 水合的SUV 是15 nm;DPPC 則是25 nm。
製備微脂體最傳統的方法是薄膜搖振法。
如今已經發展出非常多種製備微脂體的方法,包括:1.) 薄膜搖振法(Thin film method; Hand-shaking method):又稱做Ban gham’s method,將脂質以有機溶劑如氯仿(chloroform)、甲醇(methanol)及乙醇(ethanol)等溶解,均勻混合後,利用旋轉真空乾燥機(rotary evapor ator) 使圓底瓶內的溶劑揮發之後,即可在瓶壁上形成均勻的脂質膜,在臨界溫度以上的溫度條件下,將欲包覆物質的水溶液和脂質膜混合,用手左右搖動,將瓶壁上的脂質膜振下來,脂質在水溶液中即會自動形成MLV。
2.) 冷凍-再解凍(freez-thaw)、均質(homogenization)及超音波震盪法(soni cation method):利用微脂體破裂後會再自行密合的特性,以機械性的力量均質或超音波震盪的方式,或者多次冷凍、再解凍的方式,造成微脂體的破裂及重組再密合,最後可形成大小較均勻的單層微脂體。
3.) 反相蒸發法(Reverse phase evaporation method):以有機溶劑溶解高濃度的脂質,快速混入對於脂質量而言體積極少的藥品水溶液,將兩者混合均勻後再以旋轉真空乾燥機使有機溶劑揮發,形成包覆率較高的微脂體。
這種方法適合用來包覆較為稀少或是較珍貴的藥品及蛋白質。
4.) 有機溶劑注射法(solvent injection)和清潔劑透析法(detergent dialysi s):利用有機溶劑和清潔劑溶解脂質,與準備包覆的水溶液混合形成微脂體後,以透析法除去有機溶劑和清潔劑。
5.) 濾膜擠出法(Extrusion ):可將上述方法製成的微脂體,改變成所需粒徑大小的單層微脂體。
MLV或LUV置於擠壓器(extruder)中,加熱到臨界溫度以上的溫度,以氮氣或氬氣加壓,即能將粒徑較大的微脂體擠成接近濾膜孔徑大小的微脂體。
重複擠壓數次後,即可製造出所需粒徑大小且粒徑分佈範圍相當窄的微脂體。
利用這種方法製成的微脂體可將粒徑大小控制到一百奈米以下。
微脂粒在體內之舉止,依其本身的型態、粒徑、脂質組成、表面電荷及服用者的生理狀況、投藥部位等而有很大差異。
微脂粒於靜脈注射後,在血液中至少與兩類血漿蛋白發生作用,1)所謂調理素(opsonins)可附著於微脂粒表面,促使其被RES之吞食細胞噬食。
2)高密度脂蛋白(HDL)襲擊微脂粒,藉phosph atidylcholine transferase活性蛋白之助,抽掉微脂粒上之磷脂分子,使微脂粒破洞或崩潰,內容物漏出。
此二作用皆導致微脂粒在體內之半減期縮短。
目前已研究出幾種改善之道以延長微脂粒在血液循環中之半減期,此種微脂粒稱為長命微脂粒(stealth liposomes)。
微脂粒的表面可設法接上抗體或受質,在體內發揮指向功能。
針對目標細胞膜上的特殊抗原或受體,將對應抗體或受質分子接在微脂粒上,可使絕大部份的微脂粒聚集至目標細胞。
微脂粒與細胞作用的機制有數種:1)膜組成交換(intermembrane transf er):即微脂粒膜的組成與細胞膜的組成中有一部份互相交換;2)吸著(ads orption):微脂粒附著於細胞膜;3)膜融合(fusion):微脂粒與細胞膜融合,將包容物送進細胞內;4)吞食(phagocytosis, endocytosis):微脂粒被細胞吞食。
欲使微脂粒依期望之機制與細胞作用,則要設計微脂粒。
阳离子脂质体(cationic liposome) 介导转染核酸进入真核细胞的方法是从8 0 年代中期发展起来的一种最具创新性的、高效的转染(transfection) 技术。
阳性脂质体(cationic liposome) ,又称阳离子脂质体、正电荷脂质体(positively ch arged liposome) ,是一种本身带有正电荷的脂质囊泡。
它可作为荷负电物质的传递载体,特别适用于蛋白质、多肽和寡核苷酸类物质、脱氧核糖核酸(DNA) 、核糖核酸(RNA) 等,所以在基因治疗方面有独特应用,近年来,成为在体外研究基因功能和基因表达调控机理的重要手段。
阳性脂质体介导的转染法可将外源基因导入任意种类哺乳动物的原代细胞或连续培养的细胞,在贴壁培养体系和悬浮培养体系中均能应用,并且能得到顺时表达(transient expression)和稳定表达(stable expression)的细胞株。
1.阳性脂质体的组成绝大多数阳性脂质体是由一种中性磷脂和一种或多种阳性成分组成。
中性磷脂和阳性成分都是具有亲水和疏水两种基团,其分子间相互间隔定向排列形成类脂双分子层。
其中,中性磷脂起到稳定双层膜和降低阳性成分毒性的作用,同时提供阳性脂质的细胞渗透功能。
阳性成分是具有不同化学结构的两性分子,多为双链季铵盐型表面活性剂,为整个脂质体提供正电荷,有很强的细胞膜去稳定化作用。
目前,使用最广泛的阳性成分有以N-[1-(2,3-二油酰氧基)丙基]-N,N,N-三甲基氯化铵(DOTMA)、3β-[ N-( Nˊ, Nˊ-二甲基胺乙基) 胺基甲酰基]胆固醇(DC-Ch ol)、2,3-二油酰氧-N-[2(精胺羧基酰胺)乙基]-N,N-二甲基-1-丙基-三氟乙酸铵(DO SPA) 、1 ,2-二油酰氧丙基-N,N,N-三甲基溴化铵(DOTAP)等,具有体外稳定性好,体内可被生物降解的特点,但具有一定的细胞毒性。
2.阳性脂质体介导基因转染的作用机制阳性脂质体介导的基因转染过程中,阳性脂质体的重要性体现在三个方面:(1)与DNA形成脂质体-DNA复合物(2)与细胞膜的作用(3)将DNA释放到细胞中。
2.1 阳性脂质体-DNA复合物(Lipoplex)的形成最初人们认为,阳性脂质体的表面带正电荷,能被核酸中带负电荷的磷酸根所吸附,这样通过阳性脂质体的介导,可以把核酸物质结合到细胞膜上。
Gershon于1993年使用电镜技术,研究了复合物的形成和结构特征。
他认为,阳性脂质体最初结合到DNA分子上,在核酸分子上形成成束的囊泡聚合物。
当聚合达到一定程度时,DNA 诱导的脂质体膜融合和脂质体诱导的DNA断裂同时发生,断裂后的DNA分子被包封于重新形成的脂质体中。
后来,Stefan Huebner等于1999年系统地阐述了复合物的结构特征及形成机理。
他指出,复合物的形成与脂质体/DNA的电荷比例有密切联系。
复合物有三种形式:(1)由DNA包裹的单层囊泡(2)由单层囊泡组成的寡聚复合物(3)多层囊泡聚合物。
并且他提出“脂质体滚动”:当一个由DNA包裹的单层囊泡被另一个“模板”囊泡吸附,随即发生断裂,沿着“模板”囊泡“滚动”,依此类推,就形成了多层囊泡聚合物,这就解释了复合物缺口形成的原因。
目前,这一观点已逐渐为广大研究者所认可。
2.2 细胞对阳性脂质体-DNA复合物的摄取最初的研究指出,最初的研究指出,对于带负电荷的核酸物质(DNA、RNA和寡核苷酸) ,主要是通过胞饮作用(endocytosis)进入靶细胞的。
