第十章 各类化合物的重要反应 第五节
各类化合物的合成

CH2
CHCH2OH + HCl
C6H5CH2Br + H2O
NaOH
C6H5CH2OH + HBr
2.醛或酮的还原
(1)催化还原
醛或酮分子中的羰基,在Pt、Ni等存在下催化加氢成为羟基。
R2C
O
LiAlH 4 H
2
or NiH or Pt 2,Ni
R2CHOH
(2)Meerwein-Ponndorf-Verly还原
CH3
Pd CH3 Pd O CH3 H2H 2 2 C 2H ethyl 5OHacetate - + CH Br 3 C Na CH3CHC (298K,1atm) CH3CHC (-NaBr) O
C
CH3
环壬炔-6-酮
2. 烯烃硼氢化-质子化:
CH3 CH3CH2CH2C=CH2 (1) BH3:THF (2) CH3COOH, heat CH3 CH3CH2CH2CHCH3
R R
C
O
Zn-Hg HCl
R R
CH2
此法对芳酮较好,对酸敏感的醛或酮不能使用,这时可
使用黄鸣龙法,两种方法互为补充。
O CCH3
Zn-Hg,HCl
Δ
CH2CH3
4. 羰基间接还原成亚甲基
烷烃的反应
烷烃的反应活性较低,在光照或加热条件下,能与卤素 发生卤代反应。 氯代 烷烃的氯代反应是按游离基历程(机理)进行的
CH3 CH3 C CH2
H H 22
Ni Pd CC 2H 5OH 2H 5OH (298K,1atm) (298K,50atm)
CH3 CH3 C CH2 H H
O NaNH2 CH3CHC CH (-NH3) 环壬炔-6-酮 CH3 Pd O 2H2 excess H2 ethyl acetate Pt, pressure CH3CHCH2CH2CH3
2015届高考化学总复习 第十章 第五节高分子化合物 有机合成推断精讲课件

的方程式为:
有机合成的基本思路 (1)分析碳链的变化:有无碳链的增长或缩短,有无成环或开环。 (2)分析官能团的改变:引入了什么官能团,是否要注意官能团的 保护。 (3)读懂信息:题中的信息可能会成为物质转化中的重要一环,因 而要认真分析信息中牵涉到的官能团(或碳链的结构)与原料、产 品或中间产物之间的联系。
有弱酸性,E为醇类,呈中性,故D的酸性比E的强,c错;E
为醇类,分子间可形成氢键,其沸点高于相对分子质量比 E 还小的对孟烷,d正确。(4)由G的分子式和有关信息可知 G的 结构简式为 的 ,则G与E发生酯化反应得到H,H
结构简式为
,反应Ⅱ则是H发生加聚反
应得到高分子,依据烯烃的性质 ( 可发生加聚反应 ) 知反应 Ⅱ
第十章
烃的衍生物和营养物质 高分子化合物和有机合成
第五节 高分子化合物 有机合成推断
有机合成
1.有机合成路线设计的思维模型。
2.官能团的转化。
(1)官能团的引入。
引入官能团
卤素原子
引入方法
①烃与X2取代; ②不饱和烃与X2、HX加成; ③醇与氢卤酸(HX)取代 ①烯烃与水加成; ②醛或酮与氢气加成; ③卤代烃在碱性条件下水解; ④酯的水解; ⑤葡萄糖发酵生成乙醇
解析:本题通过有机合成意在考查考生对烃的衍生物的性质 的理解、应用和有机反应类型等。(1)结合合成路线可知A为 甲苯,(CH3)2CHCl 与甲苯(A) 发生取代反应得到 B, B的结构 简式为 ;B→对孟烷是B中苯环与氢气 发生加成反应 ( 有机化学中把加氢的反应也叫还原反应 ) ;甲 苯的同系物中相对分子质量最小的物质是苯。(2)C与溴水反 应能生成沉淀,则C应含有酚羟基,结合结构分析,苯环上Leabharlann 羟基碳碳双键 碳氧双键
第五节 加单氧酶系及其诱导作用

第五节加单氧酶系及其诱导作用在生物医学领域内,人们对药物在哺乳动物体内经由一定的生化机制进行的生物转化作用,已经给与了极大的关注,对来自哺乳类的细胞色素P450电子传递系统进行了广泛的研究。
该系统涉及许多类型药物的氧化作用,例如:芳香及脂肪族化合物的羟基化;N-,O-和S-去烷基化,以及S-和N-氧化作用。
Smith和Rosazza详尽地综述和比较了微生物和哺乳类地药物代谢系统,考虑了所有上述提取的反应以及还原和水解转化、结合作用。
目前,在微生物和哺乳类代谢系统中最引人入胜的相似点,或许莫过于它们各自的细胞色素P450均一蛋白加单氧酶系。
下面就简要地介绍微生物和哺乳类之间这种外线粒体电子传递系统的异同点,目的在于提供一种对于药物代谢研究中运用微生物模型的明晰的生物化学关系。
一、加单氧酶——细胞色素P450的重要性哺乳类生物转化过程中Ⅰ相反应的三种类型是最普遍最重要的。
在过去的二十年间,人们对各种类型化合物氧化机理的了解,取得了惊人的进展。
Hayaishi 的“氧化酶”一书对氧代谢的总体方面进行了详尽的讨论。
此后,围绕着氧的活化,氧化酶类的生理功能等机理研究方面研究了许多复杂问题,下面就是近期工作的小结。
大多数哺乳类氧化Ⅰ相反应,都是由细胞色素P450连接主要位于肝脏的加单氧酶,单也存在于肾脏、肺、胃肠道、脾脏和甾体生源器官,如肾上腺皮质、睾丸、卵巢及胎盘。
细胞色素P450实际上是一类涉及多种类型化合物氧化代谢活性体系的均一蛋白质,与这种均一蛋白有关的肝脏混合功能氧化酶。
在这一光谱基质的氧化作用中需要NADPH和分子氧。
通常肝脏的酶固结在膜上,它们出现在当组织消化和差速离心处理所得到的颗粒性的微粒体部分。
肝脏P450系统的颗粒本质和相当的不稳定性,使得难于分离,并在纯净状态下工作。
通过精巧的电子传递链,包括均一蛋白P450,一种类似于细胞色素P450还原酶的黄素蛋白的作用下,基质的氧化作用就发生了,也需要一种磷脂,如卵磷脂。
生成偶氮化合物

1、萘酚及其磺酸(8个)
(1) 1-萘酚
OH
(2) 2-萘酚
OH
(3) G-酸
HO3S OH
(4) R-酸
OH
HO3S
HO3S
SO3H
(7) 二羟酸
OH
HO3S
OH
(8) BON酸
OH
COOH
(5) L-酸
OH
SO3H
(6) NW酸
OH
SO3H
2、萘胺及其磺酸(19个)
(9) 1-萘胺
(10) 2-萘胺
基本原料------ 染料中间体----- 染料
从芳香族原料制得的中间体虽然品种繁多,但 从分子结构看,它们大多数是在芳烃环上含有一个 或多个取代基的芳烃衍生物。重要取代基有:- NH2 、 - N(CH2CH2OH)2 、 - OH 、 - OCH3 、 >C = O 、 - NO2、-Br、-Cl、-SO3Na、-COOH、=N+(CH3)2 等。它们对染料的颜色、溶解度、化学性质和染色 性能均具有十分重要的意义。
SO3H
SO3H
(19) SS-酸
(20) γ-酸
(21) 2D-酸
(22) M-酸
(23) 加买酸
OH NH2 SO3H
SO3H
HO3S
OH
NH2 HO3S
OH
NH2 HO3S SO3H
NH2
OH
HO3S
NH2
OH
(24) J-酸
HO3S
NH2 HO3S
(25) 双J酸
NH
(26) 苯基J酸
SO3H HO3S
(一)酸基碱熔法
芳磺酸在高温下,与氢氧化钠或氢氧化钾共熔, 磺酸基可以转变成羟基。
有机含氮和含磷化合物

第一节 胺 第二节 重氮与偶氮化合物 第三节 脲 第四节 氨基甲酸酯类化合物 第五节 含磷有机化合物
精选课件
第一节 胺
氮分子中的氢原子部分或全部被烃基取代后
的化合物,统称为胺。
许多源于植物的碱性含氮化合物(又称生物碱)具 有很强的生理活性,常被用作药物。
CHOHCHCH3
NO2
②H2O,H+
H2,Ni HO
NH2
( C H 3C O ) 2O
HO
NHCCH3
扑热息痛
O
(Paracetamol)
精选课件
4. 磺酰化
常用的磺酰化试剂是苯磺酰氯和对甲基苯磺酰氯
S2 O Cl 苯 磺 酰 氯
C3H
S2 O Cl
对 甲 基 苯 磺 酰 氯( TsCl )
RN 2HS2 O Cl R2NH R3N
NH2
环己胺
(CH3)2NCHCH2CH3 CH3
二甲(基)仲丁(基)胺
H2N(CH2)6NH2 1,6-己二胺
精选课件
CH2NH2
苄胺
2. 比较复杂的脂肪族胺是以烃作母体,氨基作为取代 基来命名。
NH2 CH2CH2CHCH3
1-苯基-3-氨基丁烷
CH3CH3 CH3CNHH3N CH(CCHH(2C)H 4C2H )43CH
酰基化试剂反应,生成N-取代或N,N-二取代酰胺。 但羧酸的酰化能力较弱。
N H 2
(C H 3C O )2O 或 C H 3C O C l
O N H C C H 3
。
N H 2+C H 3 C O O H1 6 0C
-H 2 O
O N H C C H 3
大学化学-第十章-氧化还原平衡和氧化还原滴定

Ox ne Re d
标准电极电势表
原电池和电极电势 ③可用Eθ比较氧化剂和还原剂的相对强弱。 Eθ↑,对应氧化型的氧化能力↑, Eθ↓,对应还原型的还原能力↓。 ④Eθ是强度性质,与得失电子数,与半反应的方向均无关。
Cl2 2e 2Cl 1 Cl2 e Cl 2 2Cl 2e Cl2
Cr2O72 Fe 2 Cr 3 Fe3
(2) 分别写出氧化剂被还原和还原剂被氧化的半反应
氧化半反应:Fe 2+ Fe3+
还原半反应:Cr2O7
2+
Cr
3+
氧化还原反应 (3) 分别配平两个半反应方程式.
氧化半反应:Fe 2+ - e- Fe3+
还原半反应:Cr2O7 2+ 14 H 6e 2Cr 3+ 7 H 2O
在碱性介质中,在方程式两侧,凡多1个O原子的一侧加
第二节 原电池与电极电势
一、原电池的构造 Cu-Zn原电池装置 正极: Cu2++2e=Cu 还原半反应 负极: Zn-2e=Zn2+ 氧化半反应
( -)Zn(s) Zn (c1 ) Cu (c2 ) Cu ( s )
2+
2+
()
原电池和电极电势 二、原电池符号 1、书写原电池符号的规则 ① 负极“-”在左边,正极“+”在右边,盐桥用“ǁ”表 示 两相界面用“∣ ”分开,同相不同物种用“,”分开 ② 溶液、气体要注明cB,pB 。 ③ 在有气体参加或电极反应的各物种均为离子态时, 采用不活泼的固体导体作为电极材料---惰性电极 用化学语言描述或写出一个电池 反应的原电池表示方法。要求:已知 电池反应会写出原电池符号,同样已 知原电池符号,写出两个电极反应及 电池反应.
2015届高考化学总复习 第十章 第五节高分子化合物 有机合成推断试题(含解析)

一、单项选择题答案:D答案:B3.化学与生产和生活密切相关,下列说法正确的是() A.聚乙烯塑料的老化是因为发生了加成反应B.煤经过气化和液化等物理变化可转化为清洁燃料C.合成纤维、人造纤维和碳纤维都属于有机高分子材料D.利用粮食酿酒经历了淀粉—葡萄糖—乙醇的化学变化过程解析:塑料老化是发生了氧化反应而非加成反应,A错误;煤的气化和液化都是化学变化,B错误;碳纤维不属于有机高分子材料,C错误。
答案:D4.(2013·和田一中摸底考试)花青苷是引起花果呈现颜色的一种花色素,广泛存在于植物中。
它的主要结构在不同pH条件下有以下存在形式:下列有关花青苷说法不正确的是()A.花青苷可作为一种酸碱指示剂B.Ⅰ和Ⅱ中均含有二个苯环C.Ⅰ和Ⅱ中除了葡萄糖基外,所有碳原子可能共平面D.Ⅰ和Ⅱ均能与FeCl3溶液发生显色反应解析:A项,有机物Ⅰ和有机物Ⅱ显色由溶液酸碱性控制,说明它是酸碱指示剂,A项正确;B项,有机物I含两个苯环,有机物Ⅱ含一个苯环,B项错误;C项,苯环上所有原子共面,其他六元环直接相连的原子可能共面,面与面可能共平面,C项正确;D项,有机物Ⅰ和Ⅱ均含有酚羟基,能与氯化铁溶液发生显色反应,D项正确。
答案:B答案:D6.2011年3月15日,CCTV—1在3·15特别行动节目中,曝光了双汇在食品生产中使用“瘦肉精”猪肉,一时间市场哗然。
“瘦肉精”又称克伦特罗,其结构简式如下图。
下列有关“瘦肉精”的说法不正确的是()A.它的分子式为C12H18N2Cl2OB.它含有氨基、氯原子等官能团C.1 mol克伦特罗最多能和3 mol H2发生加成反应D.一定条件下它能发生水解反应、酯化反应、消去反应、氧化反应、加聚反应等解析:由于不含碳碳双键,根据官能团的性质,瘦肉精不能发生加聚反应。
故D错误。
答案:D二、双项选择题7.萤火虫发光原理如下:关于荧光素及氧化荧光素的叙述中,正确的是()A.互为同系物B.均可发生硝化反应C.均可与碳酸氢钠反应D.均最多有10个碳原子共平面解析:同系物应含有相同种类和数目的官能团,荧光素分子中含有羧基,而氧化荧光素分子中含有的是羰基,两者不是同系物,故A项错误;二者均有酚羟基,可与HNO3发生苯环上的取代反应,B项正确;荧光素含有—COOH,可与NaHCO3反应,氧化荧光素酚羟基呈酸性,但酚羟基酸性小于H2CO3,酚羟基不与NaHCO3反应,C项错误;将苯与C2H4的结构联合分析可知最多有10个碳原子共平面,D项正确。
第十章 生物碱

溶剂
选择依据 生物碱的存在状态(游离 、盐 )及溶解醋酸 酒石酸) 浸渍 渗漉或煎煮 酸水提取液(盐)
**
离子交换树脂法 有机溶剂萃取法
总生物碱
2、 盐 游离均易于醇
醇(甲、乙)类溶剂提取法 渗漉 浸渍 回流 醇提取液(盐 游离) 回收 总生物碱
CH3 N
CH3 N
O MeO OH OMe
青风藤碱
(3)苄基苯乙胺类:石蒜碱 (石蒜)
OH HO O O
石蒜碱
N
4. 色氨酸系生物碱 (1) 简单吲哚类:靛青苷(蓼蓝)
O
N H
glc
N H
靛青苷
(2)色胺吲哚类:吴茱萸碱(吴茱萸胺)(吴茱萸)
N H
NH2
N H H3 C
N N
O
吴茱萸碱
(3)半萜吲哚:麦角新碱(麦角菌类)(4)单萜吲哚:
个别小分子固体生物碱有挥发性---麻黄碱 。 升华性 -------咖啡因 、川芎嗪
1.性状
颜色:大多无色。 小檗碱呈黄色、具黄绿色荧光;血 根碱呈红色(共轭体系)。 气味:苦。个别具甜味(甜菜碱)。 旋光性:大多有旋光(不对称碳原子或不对称中心), 且多呈左旋性。活性 - 〉+
2.溶解性
N H
吡咯
N H
四氢吡咯 吲哚
N H
NH N
咪唑
N
吡咯里西啶
N
吲哚里西啶
N
N CH3
H H
莨菪烷
N H
蒎啶
N
吡嗪
N
N N N H
N
吡啶
N
喹喏里西啶
嘌呤类
醛和酮分子中都含有羰基( )官能团,它们都是羰基化合物 醛和酮
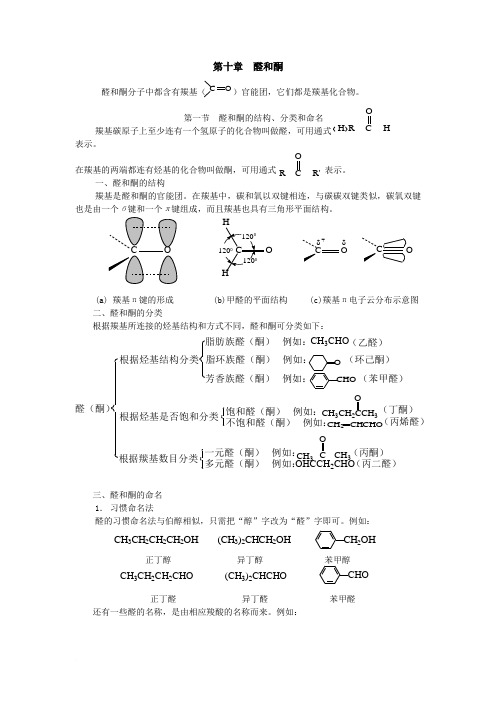
第十章 醛和酮醛和酮分子中都含有羰基( )官能团,它们都是羰基化合物。
第一节 醛和酮的结构、分类和命名羰基碳原子上至少连有一个氢原子的化合物叫做醛,可用通式 表示。
在羰基的两端都连有烃基的化合物叫做酮,可用通式 表示。
一、醛和酮的结构羰基是醛和酮的官能团。
在羰基中,碳和氧以双键相连,与碳碳双键类似,碳氧双键也是由一个б键和一个π键组成,而且羰基也具有三角形平面结构。
(a) 羰基π键的形成 (b)甲醛的平面结构 (c)羰基π电子云分布示意图 二、醛和酮的分类根据羰基所连接的烃基结构和方式不同,醛和酮可分类如下:CH 3CHOOHCCH 2CHO 根据烃基结构分类根据烃基是否饱和分类根据羰基数目分类脂环族醛(酮) 例如:芳香族醛(酮) 例如:一元醛(酮) 例如:多元醛(酮) 例如:醛(酮)(乙醛)(环己酮)(苯甲醛)(丁酮)(丙烯醛)(丙酮)(丙二醛)脂肪族醛(酮) 例如:饱和醛(酮) 例如:不饱和醛(酮) 例如:三、醛和酮的命名1. 习惯命名法醛的习惯命名法与伯醇相似,只需把“醇”字改为“醛”字即可。
例如:正丁醇 异丁醇 苯甲醇正丁醛 异丁醛 苯甲醛还有一些醛的名称,是由相应羧酸的名称而来。
例如:H ____OH R OCHO CH 3CH 2CCH 3OCH 2CHCHO__OC __CH 3CH 3COR R'____O C O C δδ+-OC (CH 3)2CHCH 2OH CH 2OHCH 3CH 2CH 2CH 2OH CH 3CH 2CH 2CHO(CH 3)2CHCHO CHO蚁醛 肉桂醛 水扬醛酮的命名:在羰基所连接的两个烃基名称后再加上“甲酮”两字,“甲”字习惯上可以省略。
脂肪混酮命名时,要把“次序规则”中较优先烃基写在后面。
但芳基和脂基的混酮,要把芳基写在前面。
例如:二甲基(甲)酮(二甲酮) 甲基乙基(甲)酮(甲乙酮) 苯基乙烯基(甲)酮 2.系统命名法 其要点如下:(1) 选取主链(母体) 选择含有羰基的最长碳链作为主链。
考研化学第十章硫化

思考题:
1.生胶和硫化胶在分子结构及性能上有何不同?
2.橡胶的硫化历程分为几个阶段?各阶段的实质 和意义是什么?(作业题)
3.何谓硫化三要素?对硫化且要素控制不当会造 成什么后果?
4.试选择硫化轮胎外胎、布面胶鞋、纯胶管的最 佳硫化介质、硫化设备和硫化工艺方法。(任 选其一制品为作业题)
优点:传热均匀,密度较高,使制品变形 倾向较小。
缺点:热含量不高,导热效率低。 仅限于硫化含有活性温度低于100 ℃超速 促进剂的薄壁浸渍制品。
二、硫化方法
1.室温硫化法
在常温常压下进行,不需硫化设备。如汽 车、建筑用的胶粘剂;运输带的冷接和橡胶制 品修补用的自硫胶浆。
2.冷硫化法
多用于薄膜浸渍制品的硫化。将制品浸入 含2~5%的一氯化硫的溶液中经过数分钟或数 秒钟的浸渍即可完成硫化。
生成含有硫黄和促进剂的活性侧基,是橡胶 分子链形成交联的前驱体。
3.活性侧基之间或与橡胶间的化学反应
形成交联键。活性剂使交联键的数量增加, 交联键中硫原子数减少,硫化胶的性能提高。
4.交联键的继续反应
初始形成的交联网络中,交联键大多是多硫 交联键,继续反应,变成较短的二硫和一硫交联 键。在多硫交联键短化的同时,又增加新的硫黄 交联键,并伴有主链改性、环化等过程。
★混气硫化:在硫化的第一阶段以热空气为介 质.在第二阶段再通入蒸汽作介质。胶鞋硫化 采用该方法。
(3)过热水
优点:既能保持较高的温度,又能赋予较 大的压力,因此常用于高压硫化场合。
缺点:热含量小,导热效率低,且温度不 易掌握均匀。
典型的用途是轮胎硫化时,将过热水充注 于水胎中,以保持内温。
(4)热水
(2)注压机硫化法
是模压硫化的一种进展, 它是通过注射筒将胶料自动注 入模型中。具有成型快速、自 动化程度高,产品致密性高, 硫化周期短等优点,在胶鞋工 业、橡胶零件、密封件生产中 得到了广泛应用。
生物化学与分子生物学-第十章第五节 百草枯和杀虫脒
总目录 下页
退出 返回
四、血和尿中百草枯的测定
• 分光光度法:快速检测 • 气相色谱法:衍生化,百草枯沸点高
,极性强,不具有挥发性 • 高效液相色谱法:极性强的离子型化
合物,最常用 • 毛细管电泳法 • 质谱联用法
总目录 下页
退出 返回
(一)分光光度法
1. 原理
• 尿中百草枯在pH>10条件下,与连二亚硫酸钠 反应,生成蓝色离子化合物,于395nm处测定 吸光度,用标准曲线法定量。
第五节 百草枯和杀虫脒
一、概述
(一)百草枯(paraquat):又称克芜踪、对草快等。
• 结构式
1,1-二甲基-4,4-联吡啶阳离子盐 (1,1’-dimethyl-4,4’-bipyridylium ion)
N+
N+
总目录 下页
退出 返回
• 存在形式:盐酸盐和双硫酸甲酯盐,商品多为
20%水剂或25%水剂二氯化物。
总目录 下页
退出 返回
(二)脒类农药(formamidines):广谱杀虫、杀螨剂。
• 结构通式
H
R1
RNC N
R2
• 分类:杀虫脒(chlordimeform,CDM)、双甲脒
(amitraz) 和单甲脒(mono-formamidine)。
总目录 下页
退出 返回
1. 杀虫脒(氯苯脒,克死螨、杀螟螨)
O O S O-
O N+
Cl-
N+
N+
N+ O
-O S O
O
Cl-
总目录 下页
退出 返回
• 理化性质
– 百草枯盐酸盐为无色、吸湿性晶体。
亚硝化反应

第五节 亚硝化反应
二、典型的亚硝化反应 1 .酚类的亚硝化 在低温下,酚类化合物与亚硝酸可进行亚硝化反应。 比较重要的亚硝化产品有对亚硝基苯酚、 1- 亚硝基 -2- 萘 酚等。 对亚硝基苯酚是制取硫化蓝的重要中间体,也可用于 生产橡胶交联剂、解热镇痛药扑热息痛等。对亚硝基苯酚 是由苯酚与亚硝酸钠在硫酸存在下进行亚硝化反应而得。 其操作是将苯酚溶于0~6℃的冷水中,然后加入亚硝 酸钠、硫酸,约在0℃搅拌反应1h左右,即可得到对亚硝 基苯酚沉淀,经离心过滤后即得到产品。
第五节 亚硝化反应
在叔芳胺的环上引入亚硝基时,主要得到相应的 对位取代产物。例如,N,N-二甲基苯胺盐酸水溶液在 0℃与微过量的NaNO2水溶液搅拌数小时,即可得到对 亚硝基-N,N-二甲基苯胺盐酸盐。它是染料、香料、医 药和印染助剂的重要中间体。
第五节 亚硝化反应
1-亚硝基-2-萘酚是制备1-氨基-2-萘酚-4-磺酸的中 间产物,后者是制取搅拌,使其溶解, 冷却后加亚硝酸钠,过滤,滤液冷却到0℃以下。在搅拌 下,温度不超过0℃,连续滴加10%的盐酸至刚果红试纸变 蓝为止。再搅拌半小时后过滤,滤饼用水洗至氯离子不大 于自来水中的氯离子为止,再用蒸馏水及乙醇洗一次,滤 出结晶,经精制即得产品。
第五节 亚硝化反应
2 .芳仲胺与芳叔胺的亚硝化 芳仲胺进行亚硝化时,一般先生成N-亚硝基衍生物, 然后在酸性介质中发生异构化,分子内重排(费歇尔-赫 普重排)而制得C-亚硝基衍生物。例如,对亚硝基二苯胺 是通过二苯胺的N-亚硝基化合物重排而制取的。 反应是将NaNO2和硫酸水溶液与溶于三氯甲烷中的二苯 胺作用,而后向三氯甲烷中加入甲酸盐酸进行重排,即可 得到对亚硝基二苯胺。对亚硝基二苯胺是制备橡胶防老剂 4010NA和安安蓝染料的中间体。N-亚硝基二苯胺也是一种 精细化学品,在橡胶硫化过程中具有防焦和阻聚作用。
第十章生态系统的物质循环ppt课件

严格执行突发事件上报制度、校外活 动报批 制度等 相关规 章制度 。做到 及时发 现、制 止、汇 报并处 理各类 违纪行 为或突 发事件 。
6.各物质循环过程相互联系,不可分割 水循环对其他物质的循环运动非常重要。
没有水循环,其他物质循环便不能全面有效 地进行,更不能被生物利用而实现其在各物 质库间的运动。反过来,其他物质的循环状 况对水循环也会产生影响。如碳循环局部失 调导致的大气中CO2浓度升高引起的“温室 效应”,影响了水循环过程。
8
严格执行突发事件上报制度、校外活 动报批 制度等 相关规 章制度 。做到 及时发 现、制 止、汇 报并处 理各类 违纪行 为或突 发事件 。
2.物质循环与能量流动不可分割,相 辅相成
能量是生态系统中一切过程的原动 力,也是物质循环运转的驱动力。物质 是组成生物、构造有序世界的原材料, 是生态系统能流的载体。能量的生物固 定、转化和耗散过程是物质由简单的无 机形态变为复杂的有机结合形态,再回 到简单无机形态的循环再生过程。可见, 任何生态系统的存在和发展,都是物质 循环与能量流动同时作用的结果。
1
严格执行突发事件上报制度、校外活 动报批 制度等 相关规 章制度 。做到 及时发 现、制 止、汇 报并处 理各类 违纪行 为或突 发事件 。
第一节 物质循环的一般特点
一、 物质循环的概念
生态系统的物质循环(nutrient cycle)又称生物地球化学循环 (biogeochemical cycle),它是指生态系 统内的各种化学元素及其化合物在生态系统 内部各组成要素之间及其在地球表层生物圈、 水圈、大气圈和岩石圈(包括土壤圈)等各 圈层之间,沿着特定的途径从环境到生物体, 再从生物体到环境,不断地进行着反复循环 变化的过程。
生物化学第五节 物质代谢调节的主要方式

第五节物质代谢调节的主要方式2015-07-07 71910 0为适应内外环境的变化、实现细胞的各种生物学功能,需对代谢进行精细调节,使各种物质的代谢井然有序,相互协调进行。
这是生物体的基本特征,是在生物进化过程中形成的一种适应能力。
代谢调节的复杂程度随进化程度增加而增高。
单细胞生物主要通过细胞内代谢物浓度的变化,对酶的活性及含量进行调节,即所谓原始调节或细胞水平代谢调节。
高等生物不仅细胞水平代谢调节更为精细复杂,还出现了内分泌细胞及内分泌器官,形成了通过激素发挥代谢调节作用的激素水平代谢调节。
高等动物的代谢调节还涉及复杂的神经系统,形成了在中枢神经系统控制下,多种激素相互协调,对机体代谢进行综合调节的所谓整体水平代谢调节。
上述三级代谢调节中,细胞水平代谢调节是基础,激素及神经对代谢的调节需通过细胞水平代谢调节实现。
一、细胞水平的物质代谢调节主要调节关键酶活性(一)各种代谢酶在细胞内区隔分布是物质代谢及其调节的亚细胞结构基础在同一时间,细胞内有多种物质代谢进行。
参与同一代谢途径的酶,相对独立地分布于细胞特定区域或亚细胞结构(表12-2),形成所谓区隔分布,有的甚至结合在一起,形成多酶复合体。
酶的这种区隔分布,能避免不同代谢途径之间彼此干扰,使同一代谢途径中的系列酶促反应能够更顺利地连续进行,既提高了代谢途径的进行速度,也有利于调控。
表12-2 主要代谢途径(多酶体系)在细胞内的分布(二)关键酶活性决定整个代谢途径的速度和方向每条代谢途径由一系列酶促反应组成,其反应速率和方向由其中一个或几个具有调节作用的关键酶活性决定。
这些在代谢过程中具有调节作用的酶称为关键酶( key enzyme),特点包括:①常常催化一条代谢途径的第一步反应或分支点上的反应,速度最慢,其活性能决定整个代谢途径的总速度。
②常催化单向反应或非平衡反应,其活性能决定整个代谢途径的方向。
③酶活性除受底物控制外,还受多种代谢物或效应剂调节。
10-杂环和脂类化合物

CH3(CH2)14COOH 十八碳酸 硬脂酸
十六碳酸
俗名 简写符号 软脂酸(棕榈酸) 16:0
16 10 9
18:0
1 7 8 16
CH3(CH2)5CH=CH(CH2)7COOH
1
俗名:
Δ编码体系命名: 简写符号:
棕榈油酸
Δ 9—十六碳烯酸 16:1Δ9
ω编码体系命名: ω 7—十六碳烯酸 简写符号: 16:1ω 7
(90%)
(2) 加成: H2 / Ni 125 ℃, 100atm
O 呋喃
O 四氢呋喃
S 噻吩
H2 / Pd-C, CH3OH, H2SO4, 3 atm
S 四氢噻吩
H2 / Ni 高温高压 吡咯
四氢吡咯
第三节
六元杂环化合物
六元杂环化合物包括环中有1个杂原子的六元 杂环(如吡啶等);环中有多个杂原子的六元杂环 (如嘧啶等);以及稠杂环(如喹啉、嘌呤等)。
N
杂环
苯稠杂环:
稠杂环
杂稠杂环:
二、命名 命名原则:译音+“口”旁
4
5
3(b)
4 5 1
3 2
4
3
4
5
O
呋喃 furan
3
1
2(a)
5
1
2
N3 S
1 2
S
噻吩 thiophene 吡咯 pirrole
3 1 2
五 元 杂 环
噻唑 thiazole
4
4 5
2
1
5
4 5
N3
O
1 2
咪唑 Imidazole
一、吡啶(C5H5N) 吡啶存在于煤焦油、骨焦油中,其衍生物广泛 存在于自然界。工业上主要从煤焦油的轻油部分提 取吡啶。 吡啶是具有特殊臭味的无色液体,bp115.5℃, 可与水、乙醇、乙醚等混溶。
第十章_香豆素

• 七.荧光反应 香豆素在紫外光下大多显出兰色荧光,在碱 液中荧光增强。香豆素荧光的有无,与分子 中取代基的种类和位置有一定关系。
例:7-OH 香豆素
6-OH导入 8-OH导入 紫外光
兰色荧光
-OH
荧光减弱或消失
绿色
课堂习题
• 1. Gibb‘s反应呈阳性结果的化合物是:
A. O O B. HO OCH3 O O
三.内酯性质和碱水解反应:
香豆素的α-吡喃酮环具有α,β-不饱和内酯性质,在稀碱液 中会逐渐水解生成顺邻羟桂皮酸的盐,而顺邻羟桂皮酸不易游离 存在,其盐的水溶液经酸化即闭环恢复成内酯。这个闭合过程极 易发生,即使在很弱的酸溶液中,如通入CO2也能促使其内酯化 而闭环。
OHO
长时间加热 OH OH-
黄檀内酯
HO
蟛蜞菊内酯
H3C
第三节 理化性质
一.性状:
游离的香豆素多有完好的结晶形状,有一 定的熔点,大多有香味。分子量小的有挥 发性,能随水蒸汽蒸出,具升华性。
香豆素苷无挥发性,也不能升华。
二.溶解性: 游离香豆素---不溶于冷水,溶于沸水,易溶于甲 醇、乙醇、氯仿、乙醚等有机溶剂。 香豆素苷---溶于水、甲醇、乙醇,难溶于氯仿、 乙醚。 根据香豆素的溶解性,在提取分离时可采用系统 溶剂法。
水解
香豆素
MeO
H O O
+
MeO
H O O
+
MeO
O
HO
O
O
O
东茛 菪 内 酯
(三).双键加水反应:
酸接触下可使双键加水,如:黄曲霉素
OMe O O H O H H O O O H + O H O O OMe O
有机化学重要反应

目录目录 (1)第一部分有机化学重要反应和机理 (1)Arbuzov 反应 ..................................................................................................... - 1 - Arndt-Eister 反应 ............................................................................................... - 2 - Baeyer-Villiger 反应........................................................................................... - 2 - Beckmann 重排 .................................................................................................. - 4 - Birch还原........................................................................................................... - 4 - Bouveault---Blanc 还原...................................................................................... - 5 - Bamberger,E.重排 ............................................................................................... - 6 - Berthsen,A.Y 吖啶合成法.................................................................................. - 7 - Bucherer反应...................................................................................................... - 8 - Cannizzaro 反应 ................................................................................................. - 9 - Chichibabin 反应.............................................................................................. - 10 - Claisen 酯缩合反应 ......................................................................................... - 11 - Claisen—Schmidt 反应 .................................................................................... - 12 - Claisen 重排 ..................................................................................................... - 13 - Clemmensen 还原............................................................................................. - 15 - Combes 喹啉合成法 ........................................................................................ - 15 - Cope 消除反应................................................................................................. - 16 - Cope 重排......................................................................................................... - 17 - Curtius 反应...................................................................................................... - 18 - Crigee,R 反应 ................................................................................................... - 19 - Dakin 反应........................................................................................................ - 20 - Elbs 反应 .......................................................................................................... - 21 - Edvhweiler-Clarke 反应 ................................................................................... - 21 - Elbs,K.过硫酸钾氧化法.................................................................................... - 22 - Favorskii 反应 .................................................................................................. - 23 - Favorskii 重排 .................................................................................................. - 24 - Friedel-Crafts 烷基化反应 ............................................................................... - 24 - Friedel-Crafts 酰基化反应 ............................................................................... - 25 - Fries 重排 ......................................................................................................... - 26 - Fischer,O-Hepp,E 重排..................................................................................... - 27 - Gabriel 合成法 ................................................................................................. - 27 -Gattermann 反应............................................................................................... - 28 - Gattermann-Koch 反应..................................................................................... - 29 - Gomberg-Bachmann 反应 ................................................................................ - 29 - Hantzsch 合成法............................................................................................... - 30 - Haworth 反应 ................................................................................................... - 31 - Hell-V olhard-Zelinski 反应 .............................................................................. - 31 - Hinsberg 反应................................................................................................... - 32 - Hofmann 烷基化 ............................................................................................ - 32 - Hofmann重排 ................................................................................................... - 33 - Hofmann 消除反应 ........................................................................................ - 34 - Houben-Hoesch 反应........................................................................................ - 35 - Hunsdieecker 反应 ........................................................................................... - 35 - Kiliani 氯化增碳法 .......................................................................................... - 36 - Knoevenagel 反应 ............................................................................................ - 36 - Koble 反应........................................................................................................ - 37 - Koble-Schmitt 反应.......................................................................................... - 37 - Kolbe,H.Syntbexis of Nitroparsffini 合成........................................................ - 38 - Leuckart 反应 ................................................................................................... - 39 - Lossen 反应 ...................................................................................................... - 40 - Mannich 反应 ................................................................................................... - 41 - Meerwein-Ponndorf 反应 ................................................................................. - 41 - Michael 加成反应 ............................................................................................ - 42 - Martius,C.A. 重排 ............................................................................................ - 42 - Norrish Ⅰ和Ⅱ型裂 ....................................................................................... - 43 - Oppenauer 氧化................................................................................................ - 44 - Orton,K.J.P 重排............................................................................................... - 45 - Paal-Knorr 反应................................................................................................ - 46 - Pschorr 反应 ..................................................................................................... - 46 - Prileschajew,N.反应 .......................................................................................... - 47 - Prins,H.J 反应................................................................................................... - 48 - Pinacol-Pinacolone Rearrangement 重排 ......................................................... - 49 - Perkin,W.H 反应............................................................................................... - 50 - Pictet-Spengler 合成法-异喹啉........................................................................ - 51 - Reformatsky 反应............................................................................................. - 51 - Reimer-Tiemann 反应 ...................................................................................... - 52 - Reppe 合成法 ................................................................................................... - 53 - Robinson 缩环反应 .......................................................................................... - 53 -Rosenmund 还原 .............................................................................................. - 54 - Ruff 递降反应 .................................................................................................. - 54 - Riley ,H.L.氧化法 ............................................................................................. - 54 - Sandmeyer 反应 ............................................................................................... - 56 - Schiemann 反应................................................................................................ - 56 - Schmidt 反应 .................................................................................................... - 57 - Skraup 合成法 .................................................................................................. - 58 - Sommelet-Hauser 反应..................................................................................... - 59 - Stephen 还原-氰还原为醛 ............................................................................... - 60 - Stevens 重排 ..................................................................................................... - 60 - Strecker 氨基酸合成法 .................................................................................... - 61 - Bischler-Napieralski 合成法............................................................................. - 62 - Schmidin,J.乙烯酮合成.................................................................................. - 63 - Tiffeneau-Demjanov 重排 ................................................................................ - 63 - Tischenko,V.反应............................................................................................... - 64 - Thorpe,J.F.缩合 ................................................................................................. - 65 - Tollens,B.缩合................................................................................................... - 65 - Ullmann 反应 ................................................................................................... - 66 - Urech,F.羟腈合成法.......................................................................................... - 67 - Vilsmeier 反应.................................................................................................. - 68 - Van Ekenstein,W.A 重排 .................................................................................. - 68 - Williamson 合成法........................................................................................... - 69 - Wacker 反应 ..................................................................................................... - 69 - Wagner-Meerwein 重排.................................................................................... - 70 - Wittig 反应 ....................................................................................................... - 70 - Wittig-Horner 反应........................................................................................... - 71 - Wolff-Kishner还原和黄鸣龙改进法 ............................................................... - 72 - Wohl 递降反应................................................................................................. - 73 - 第二部分有机化学知识总结.. (75)一碳正离子的总结 ......................................................................................... - 75 - 二立体化学选择性反应.................................................................................. - 75 - 三络合金属氢化物还原.................................................................................. - 75 - 1氢化铝锂(LAH) ............................................................................ - 76 -2硼氢化钠(钾) ................................................................................ - 80 -四金属有机化合物 ......................................................................................... - 82 - 五各类化合物的鉴别方法.............................................................................. - 83 - 六烯烃的氧化反应总结.................................................................................. - 85 -七羧酸衍生物还原成醛酮.............................................................................. - 85 -第一部分有机化学重要反应和机理Arbuzov 反应亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
化合物反应

化合物反应
《化合物反应》
一、定义
化合物反应是指由两种或两种以上的物质引起的化学反应。
它是最基本的化学反应,是有机化学中绝对不可或缺的部分。
二、分类
1、结合反应:包括水合反应、缩合反应、加成反应和酯化反应等;
2、分解反应:包括水解反应、还原反应、氧化反应等;
3、交换反应:包括替换反应、消去反应、环加成反应、环分解反应等;
4、变性反应:包括氧化反应、氧化还原反应等;
5、其他反应:包括真空热处理、精制及溶解等。
三、反应机理
1、结合反应:两个物质之间会发生共价键的形成,从而使反应物变成新的化合物;
2、分解反应:原本的化合物在分解反应中会被分解成不同的原字;
3、交换反应:反应物的两部分结合物在反应过程中互相交换;
4、变性反应:反应物之间的化学性质会发生变化;
5、真空热处理:真空热处理是将处理料放在真空环境中,加热或加压,使温度和压力达到一定值,以达到处理目的。
四、反应条件
1、物质的性质:反应的物质性质对反应的影响很大,反应的物质一般有温度、熔点、沸点、溶解性和稳定性等;
2、反应温度:一般情况下,反应的温度越高,反应速率就越快;
3、溶剂性:溶剂对反应的影响很大,有些反应必须在溶剂中进行;
4、反应时间:选择正确的反应时间也是很重要的,一般反应时间越长,反应就越完全;
5、催化剂:催化剂可以加速反应,改善反应的过程,使反应变得更容易。
学习重点化学化合反应

学习重点化学化合反应学习重点:化学化合反应化学化合反应是化学领域中的重要概念之一。
通过此类反应,两种或更多种不同的物质可以结合形成新的物质。
在学习化学化合反应时,我们需要了解反应的类型、反应的条件以及反应产物等相关知识。
本文将介绍化学化合反应的基本概念和常见类型,并通过实例进行说明,以帮助读者全面理解该主题。
一、化合反应的概念化合反应是指两个或多个反应物结合形成一个或多个新的化合物的过程。
在反应过程中,化学键的断裂和形成是不可避免的。
一种化合反应有时也被称为“合成反应”或“生成反应”。
化合反应是化学变化的一种常见形式,其在生物化学、有机化学、配位化学和无机化学等领域中都有广泛的应用。
化合反应的基本要素包括反应物、反应条件和反应产物。
反应物是指参与反应的化学物质,反应条件则是反应发生时所需要的一些物理条件,如温度、压力和催化剂等。
反应产物是指反应结束后生成的新的化合物。
二、化合反应的类型1. 合成反应合成反应是最常见的化合反应类型之一。
在合成反应中,两种或多种反应物结合生成一个新的化合物。
例如,氢气与氧气反应产生水:2H2 + O2 → 2H2O在此反应中,氢气和氧气结合形成水分子。
2. 齐聚反应齐聚反应是指在反应过程中,两个或多个分子结合形成一个较大的分子。
例如,乙烯与乙烯发生齐聚反应生成聚乙烯:nC2H4 → (C2H4)n这里的 n 表示乙烯分子的重复次数。
3. 氧化还原反应氧化还原反应是指在反应过程中,一种物质被氧化,而另一种物质被还原。
氧化是指物质失去电子,而还原则是指物质获得电子。
氧化还原反应具有广泛的应用,包括腐蚀、电池、电解和铁的锈蚀等。
例如,铁与氧气发生氧化还原反应生成铁(III)氧化物:4Fe + 3O2 → 2Fe2O3在此反应中,铁被氧化成铁(III)离子,氧气则被还原成氧化物离子。
三、化合反应实例1. 氢气和氧气生成水该反应是合成反应的典型例子。
当氢气和氧气以适宜的比例混合并引燃时,会发生剧烈的化合反应,生成水分子和释放大量的能量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十章各类化合物的重要反应
第五节醛、酮的反应
醛、酮的结构醛、酮的物理性质
醛和酮都含有羰基官能团;由于氧的强电负性,使羰基碳氧双键的电子云分布不均匀,易流动的π电子偏向于氧原子,致使羰基碳原子带部分正电荷,氧原子带部分负电荷。
所以羰基碳氧双键是一个极性较强的不饱和键,易发生加成和多种化学反应。
一、羰基的加成反应
由于醛、酮的羰基碳原子电子云密度较低,带部分正电荷,易受富电子(带电子对或负电荷)亲核试剂进攻,发生亲核加成反应。
羰基碳原子的电子云密度越低,所连基团空间位阻越小,越有利于羰基的加成反应。
相反,增加羰基碳原子的电子云密度,与羰基相连基团空间位阻较大时,将不利于反应的进行。
下列醛、酮化合物发生加成反应时的活性顺序为:
1.与氢氰酸的加成反应
醛或甲基酮与氢氰酸加成生成α—羟基腈(氰醇)。
(醛、酮与氢氰酸的加成活性主要受到分子结构的空间位阻影响,醛容易反应,位阻大的酮难以反应。
醛、脂肪族甲基酮和8个碳原子以下的环酮可与HCN发生亲核加成反应。
)
α—羟基腈在酸性溶液中水解生成α—羟基酸。
反应产物比原来的醛或酮增加了一个碳原子,因而成为有机合成上增长碳链的方法之一。
2.与亚硫酸氢钠的加成反应
醛、脂肪族甲基酮和8个碳原子以下的环酮与过量的亚硫酸氢钠饱和溶液作用,生成α—羟基磺酸钠。
α—羟基磺酸钠不溶于饱和亚硫酸氢钠溶液,以白色结晶析出,若与稀酸或稀碱共热,则又分解生成原来的醛或酮。
此反应可用以从混合物中分离提纯醛或甲基酮,也可以鉴别醛和甲基酮。
由于非甲基酮不能与亚硫酸氢钠作用,利用此反应可判断酮的结构。
3.与水的加成反应
醛或酮与水生成胞二醇等水合物。
胞二醇很不稳定,易脱水变为原来的醛、酮。
但甲醛的羰基活性较大,在水中主要以胞二醇形式存在,只是不能把它分离出来。
如果醛、酮的羰基碳上连有吸电子基团,它们加水便可以形成稳定的水合物。
例如:
水合三氯乙醛可用作安眠药和麻醉药;水合茚三酮可用作氨基酸色谱分析的显色剂。
4.与醇的加成反应
醛在微量无水氯化氢的催化作用下与醇起加成反应,生成半缩醛。
半缩醛很不稳定,易分解为原来的醛和醇。
但在无水氯化氢的作用下,半缩醛可进一步与过量的醇发生分子间脱水,生成稳定的缩醛。
缩醛在碱性条件下对氧化剂和还原剂稳定,但在稀酸中则分解为原来的醛和醇。
因此,该反应在有机合成中被用于保护醛基。
在相同的条件下,酮一般不与醇发生加成反应。
5.与格氏试剂的加成反应
醛和酮易与格氏试剂(维克多—格林尼亚)加成反应,反应产物与水作用得到醇。
格氏试剂与甲醛反应得到比格氏试剂多一个碳的伯醇,与其它醛反应得到仲醇,而与酮反应得到叔醇。
6.与氨的衍生物的加成反应
醛、酮分子中的羰基易和氨的衍生物发生亲核加成—脱水(称为加成消除)反应。
反应生成的产物有良好的结晶或特殊的颜色,常用于鉴定羰基的存在。
因此,氨的衍生物称为羰基试剂,常用氨的衍生物有:
羟胺肼苯肼 2,4—二硝基苯肼
这些试剂都含有氨基,可用通式表示。
它们与醛、酮反应的通式为:
具体反应如下:
肟、腙、苯腙、2,4—二硝基苯腙都是白色或黄色的结晶固体,有固定的熔点,易于提纯。
它们在稀酸的作用下,又能分解为原来的羰基化合物。
利用这些性质可以分离和提纯醛、酮,同时也可以用来鉴别醛、酮。
二、α—氢的反应
醛、酮分子中的α—碳原子受羰基的影响,电子云密度降低,从而使α—氢原子变得比较活泼,酸性增加。
在碱催化下,具有α—氢的醛、酮可以发生卤代和缩合反应。
1.卤代和卤仿反应
醛、酮分子中的α—氢易被卤素取代,生成α—卤代醛、酮。
例如:
这类反应可被酸和碱催化。
酸催化时,反应产物主要为一卤代物,二卤代物或三卤代物。
但用碱催化时,卤代反应速度很快,很难停留在一元取代阶段,往往生成多卤代物。
因
此,具有结构的醛、酮与卤素的碱溶液(次卤酸盐溶液)作用时,总是顺利地进行到生成三卤代物。
三卤代物在碱的作用下,进一步分解为卤仿和羧酸盐。
故乙醛和甲基酮与卤素在碱性溶液中反应,称为卤仿反应。
若采用次碘酸钠(碘和氢氧
化钠溶液)与乙醛或甲基酮反应,则反应产物为碘仿(),称为碘仿反应。
碘仿是黄色结晶,常用此反应鉴别乙醛和甲基酮。
由于次卤酸钠(NaXO)是一种弱氧化剂,能将乙
醇或具有结构的仲醇氧化为乙醛或甲基酮,所以用卤仿反应还可以鉴别乙醇
和具有结构的醇。
2.羟醛缩合反应
在稀碱的催化下,含α—氢的醛或酮发生分子间的加成反应,生成β-羟基醛或β-羟基酮,这个反应称为羟醛缩合反应。
b-羟基丁醛
β—羟基醛(或酮)的α—氢原子受羰基和羟基两者的影响而比缩合前更活泼。
在受热或酸作用下很容易脱水,生成α,β—不饱和醛(或酮)。
2—丁烯醛(巴豆醛)
三、氧化反应
1.与强氧化剂的氧化反应
醛、酮都可被强氧化剂如重铬酸钾、高锰酸钾的酸溶液和硝酸等氧化。
醛生成碳原子数目相同的羧酸。
酮长时间加热情况下氧化,发生碳碳键断裂,生成小分子羧酸混合物。
己二酸
2.与弱氧化剂的氧化反应
由于醛的羰基上连有易被氧化的氢原子,而酮没有,所以醛可被弱氧化剂氧化生成羧酸,酮则不能。
常用的弱氧化剂有吐伦(Tollens)试剂、斐林(Fehling)试剂和本尼迪特(Benedict)试剂等。
吐伦试剂是硝酸银的氨溶液。
当它与醛反应时,醛被氧化成羧酸,银离子被还原成单质
银。
如果反应试管非常干净,生成的银可均匀地附着在器壁上,形成光亮的银镜。
因此,这个反应又叫银镜反应。
斐林试剂由A、B两种溶液组成。
斐林试剂A是硫酸铜溶液;斐林试剂B是氢氧化钠和酒石酸钾钠的混合溶液。
由于斐林试剂不稳定,平时需将A,B分开保存,使用时等量混合。
混合后铜离子与酒石酸根形成深蓝色配离子,避免在碱性溶液中生成氢氧化铜沉淀。
当醛与斐林试剂混合加热时,醛被氧化成羧酸盐,而二价铜被还原为一价的氧化亚铜。
羧酸根离子桔红色
本尼迪特试剂与斐林试剂的作用一样,它是由硫酸铜、柠檬酸钠、碳酸钠组成的一种比斐林试剂稳定的混合溶液。
斐林试剂、本尼迪特试剂,只氧化脂肪醛,酮和芳香醛不起反应;吐伦试剂可氧化脂肪醛和芳香醛。
弱氧化剂不氧化重键、羟基和酮。
利用这些性质,即可鉴别酮、脂肪醛和芳香醛,又可以进行一些特殊的有机合成。
3.还原反应
(1)催化氢化在镍、钯、铂(Ni,Pd,Pt)等催化剂存在下,醛、酮可以加氢还原。
醛还原为伯醇。
酮还原为仲醇。
如果分子中有不饱和键,可加氢还原生成饱和醇。
(2)用金属氢化物还原若要保留分子中的碳碳双键,只还原羰基,可用一些金属氢化物如硼氢化钠()、氢化铝锂()或异丙醇铝()等还原剂,它们有较高的选择性。
巴豆醇
(3)克莱门森还原法醛、酮与锌汞齐、浓盐酸一起加热还原时,羰基可被还原为亚甲基,这种还原方法称为克莱门森(Clemmenson)还原法。
例如:
4.歧化反应
没有α-氢原子的醛与浓碱共热,能发生自身氧化还原反应。
即一分子氧化为酸,另一分子还原为醇。
这种分子间还原反应称为歧化反应。
例如:。
