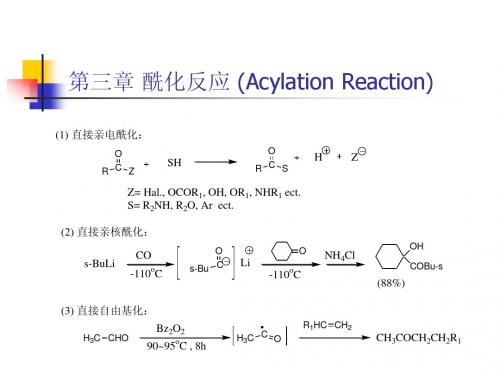
第三章 酰化反应
药物合成反应第三章酰化反应

+ CH3OH
O O C(CH2)3CH3
+ H2O
CH=CH-COOCH3
COOH
对甲苯磺酸
TsOH
+ C12H25OH Xylene
HO
OH
OH
COOC12H25
HO
OH
OH
(c) DCC 二环己基碳二亚胺
R-N=C=N-R
CH3-N=C=N-C(CH3)3 CH3CH2-N=C=N-(CH2)3-NEt2 (CH3)2CH-N=C=N-CH(CH3)2
OH O=C-R
+OH R-C-OC(CH3)3
属于SN1机理
-H+
O
R-C-OC(CH3)3
按SN1机理进
行反应,是烷 氧键断裂
* 3oROH按此反应机理进行酯化。 * 由于R3C+易与碱性较强的水结合,不易与羧酸结合,
故逆向反应比正向反应易进行。所以3oROH的酯化 反应产率很低。
该反应机理也 从同位素方法 中得到了证明
②羧酸的结构
R带吸电子基团-利于进行反应;R带给电子不利于反应 R的体积若庞大,则亲核试剂对羰基的进攻有位阻,不利于反应进行 羰基的a位连有不饱和基和芳基,除诱导效应外,还有共轭效应,使酸性增强
③催化剂 i提高羧酸反应活性
(a)质子酸催化法: 浓硫酸,氯化氢气体,磺酸等
O
H+
R C OH
O R''OH + R C OH R'
O R'' HO C R ' - H+
R'' OH
H O
O
C
第三章 酰化反应 (Acylation Reaction)
RCOOR1
N N N N C O O C 2H 5 CH3 C H COOCH3
R C O O R 1=
C O O C 2H 5 OCH3
(9 9 % )
(9 7 % )
(9 7 % )
4. 酰氯为酰化剂
RCOCl 反应机理: R 1O H RCOCl
N O R H C OR N N COR
o
OAc C 9H 19
HO
C H 2O A c
(6 8 % ) Py
AcO C H 2O A c
HO
C H 2O H
(6 2 % )
(1)羧酸-三氟乙酸混合酸酐
RCOOH (C F 3 C O ) 2 O
O R F 3C C O C O
RCO O CO CF3
C F 3C O O H
OH
H
R F 3C
R 1O
M eO O C
COOMe O O
i- P r O O C
C O O P r -i O O
i-P rO H
T i(O P r-i) 4 70 C , 3h
o
(9 1 % )
M eO O O
C 12H 25
OH Ar
DM AP
O Ar O O
C 12H 25
A r-= 1 -萘 基
O COOMe Ph OH
Ph OCOPh O TM S OCOPh
B u 2 S n O /T o l re flu x
Ph O O S nB u2
PhC O C l r.t., 1 h
TM SCl r.t., 1 ~ 2 h
Ph
O TM S
(9 8 % )
药物合成反应第三章讲解

• 脱除方法:
• 50%氨-甲醇溶液:氨解,时间长,苯甲酰基脱除 • 氢氧化钠-吡啶:酰氨基较稳定 • Bu3SnOMe在二氯乙烷中或三氟化硼-乙醚在湿乙腈中:选择性地脱
除葡萄糖差向异构体羟基上的乙酰基 • DBU或甲氧基镁:苯甲酰基和乙酰基共存时,选择性地脱除乙酰基 • 碳酸钾-甲醇水溶液:仲醇及烯丙醇(100% ) • 氰化钾-乙醇:对酸、碱敏感的物质
O HO C OEt
碳酸乙酯
RCOOH
O Cl S Cl
RCOOH
O Cl P Cl
Cl
RCOOH
O
O
R C O C Cl
O
O
R C O S Cl
O
R CO
O
P Cl
Cl
• 3.1.3 酰卤作酰化剂
无水有机溶剂
RCO2H + SOCl2
RCOCl + SO2 + HCl
去酸剂 RCOCl + R'OH
叔醇的酯化:SN1机理
主要影响因素
• 底物的结构:底物为醇或酚,亲核物种为羟基氧原子。
当氧原子电子云密度降低时反应活性会降低,由此可知, 与烷基醇相比酚及烯丙醇的酰化会困难一些,而难以酰化 的底物就需要较强的酰化剂,比如酚的酰化一般要用酸酐 或酰卤。空间障碍也是一个较大的影响因素,如仲醇的反 应速率低于伯醇,而叔醇在酸催化下会形成碳正离子,所 以叔醇的酯化一般是单分子亲核取代(SN1)机理。
• 酰化剂:在一定的反应条件下,酰化活性顺序一般为
酰卤(Br>Cl)>酸酐>酯>酸>酰胺,这一顺序实际上与离 去基团的离去能力一致。
• 催化剂:
• 3.1.1 羧酸为酰化剂 • 3.1.2 羧酸酯为酰化剂 • 3.1.3 酸酐为酰化剂 • 3.1.4 酰氯为酰化剂 • 3.1.5 酰胺为酰化剂 • 3.1.6 乙烯酮为酰化剂
第三章++酰化反应

RCOCl O R C N HOR'
N
N COR Cl
Cl
N H
Cl
+ RCOOR'
28
H3C
N CH3
CH3 N CH3 OH OBz
OH
OH
TMEDA + BzCl -78oC, 2h
99%
Bu-t OH Cl + Cl Bu-t O O
DMAP AlCl3 reflux
Bu-t O Cl Bu-t O O AlCl3
O R C OR'' OR'
RCOOR' + R''O
RCOOR'' -R'O
MeO O O
C12H25 +
OH DMAP Ar
O Ar O O
C12H25
Ar = 1-Naphtyl 97%
14
为了提高酯的酰化能力,开发了许多酰化能力比较强的活性 酯,以用于合成较为复杂的化合物,如肽、大环内酯等,这 里重点介绍几类活性酯。
NMe2 DMF/POCl3
NMe2 CHNMe2 Cl H2O
NMe2 CHO
2
酰化反应的难易由被酰化物结构和酰化剂(acylating agents) 活性决定 总的来说:
RCH2 > RNH > RO > RNH2 > ROH
RCOX > (RCO)2O > RCOOR', RCOOH > RCONHR'
+ CH3COCH3
92%
20
(5)1-羟基苯并三唑(HOBt)的羧酸酯(温和条件下面反应)
《药物合成反应》-闻韧主编第三章酰化反应-知识点总结

#2.11打卡# 完成学习目标第三章酰化反应Acylation Reaction1 定义:有机物分子中O、N、C原子上导入酰基的反应.2 分类:根据接受酰基原子的不同可分为:氧酰化、氮酰化、碳酰化3 用途:药物本身有酰基活性化合物的必要官能团结构修饰和前体药物羟基、胺基等基团的保护。
酰化机理:加成-消除机理加成阶段反应是否易于进行决定于羰基的活性:若L的电子效应是吸电子的,不仅有利于亲核试剂的进攻,而且使中间体稳定;若是给电子的作用相反。
根据上述的反应机理可以看出,作为被酰化物质来讲,无疑其亲核性越强越容易被酰化。
具有不同结构的被酰化物的亲核能力一般规律为;RCH2->R—NH->R—O->R—NH2>R—OH。
在消除阶段反应是否易于进行主要取决于L的离去倾向:L-碱性越强,越不容易离去,Cl- 是很弱的碱,-OCOR的碱性较强些,OH-、OR-是相当强的碱,NH2-是更强的碱。
RCOCl>(RCO)2O>RCOOH 、RCOOR′ >RCONH2>RCONR2′R: R为吸电子基团利于进行反应;R为给电子基团不利于反应R的体积若庞大,则亲核试剂对羰基的进攻有位阻,不利于反应进行酸碱催化碱催化作用是可以使较弱的亲核试剂H-Nu转化成亲核性较强的亲核试剂Nu-,从而加速反应。
酸催化的作用是它可以使羰基质子化,转化成羰基碳上带有更大正电性、更容易受亲核试剂进攻的基团,从而加速反应进行。
氧原子的酰化反应是一类形成羧酸酯的反应,是羧酸和醇的酯化反应,是羧酸衍生物的醇解反应醇的结构对酰化反应的影响伯醇(苄醇、烯丙醇除外)>仲醇>叔醇1) 羧酸为酰化剂:提高收率:(1)增加反应物浓度(2)不断蒸出反应产物之一(3)共沸除水、添加脱水剂或分子筛除水。
(无水CuSO4,无水Al2(SO4)3,(CF3CO)2O,DCC。
)加快反应速率:(1)提高温度(2)催化剂(降低活化能)催化剂(1)质子酸催化法: 无机酸:浓硫酸,氯化氢气体,有机酸:苯磺酸,对甲苯磺酸等。
第三章 酰化反应

Friedel-Crafts酰化反应
酰卤、酸酐、羧酸、羧酸酯、 烯酮等酰化剂在Lewis酸催化下对 芳烃进行亲电取代而生成芳香酮类 的反应称为Friedel-Crafts酰化反应。 它是制备芳酮的最重要的方法之一。
例:
(CH2)nCOCl
O
+
O
O Zn—Hg
[H]
AlCl 3
(CH2)n n=2 (90%) 五环
(95%)
4 酰卤为酰化剂
N RCOCl + R'OH
RCOOR' + HCl
( 可吸收HCl,催化此反应)
N
R COCl + N
N
OC R
+ R' O H Cl
O + HCl + R C R'
N
4-取代氨基吡啶催化剂
NR2
NR2
R'OH
H
+ RCOX
OR'
N
N
OC
NR2 R
RCOOR' +
N H
O R C X -HX
HNR'R''
RCONR'R''
(SN2)
RCOX>(RCO)2O≥ RCON3> RCOOR'>RCONH2>RCOOH>RCOR'
AgCN/HMPT Me3CCOCl + t—BuOH 800C,10min Me3C COOBu t
(94%)
COCl
COOC(C2H5)3
CH3
RCHCOOEt RCH2COOEt
OR RCH2 C CHCOOEt
药物合成反应第三章酰化反应

在有机合成中的应用
1
酰化反应是有机合成中的一种重要反应类型,可 用于合成各种具有特定结构的化合物。
2
酰化反应可以用于合成羧酸、酯、酰胺等有机化 合物,这些化合物在化学工业、农药、染料等领 域具有广泛的应用。
3
酰化反应在有机合成中还常用于合成复杂化合物 和天然产物的全合成。
在材料科学中的应用
酰化反应在材料科学中也有一定的应用,主要用于合成高分子材料和功能材料。
药物合成反应第三章 酰化反应
目录
CONTENTS
• 酰化反应概述 • 常用酰化试剂 • 酰化反应的应用 • 酰化反应的实验操作与注意事项 • 案例分析
01 酰化反应概述
定义与重要性
定义
酰化反应是一种有机化学反应,涉及 醇或酚与羧酸或其衍生物在催化剂的 作用下,通过酯化或酰胺化形成酯或 酰胺的过程。
羧酸酯
总结词
羧酸酯是一种酰化试剂,可以通过羧酸 与醇的酯化反应制备,其在药物合成中 应用广泛。
VS
详细描述
羧酸酯是羧酸与醇通过酯化反应生成的化 合物,其结构中包含一个羰基和一个酯基 。在酰化反应中,羧酸酯可以与醇或酚反 应生成相应的酯或酚酯,广泛应用于药物 合成中。由于羧酸酯的反应活性较低,通 常需要在酸性或碱性条件下进行反应。
羧酸酯的合成与性质
总结词
羧酸酯的合成通常采用羧酸与醇在酸性或碱性条件下进行酯化反应得到,其性质主要取 决于酯基和羰基的结构。
详细描述
羧酸酯的合成通常采用羧酸与醇在酸性或碱性条件下进行酯化反应得到。在酸性条件下, 羧酸与醇反应生成酯和水;在碱性条件下,羧酸与醇反应生成酯和盐。羧酸酯的性质主 要取决于酯基和羰基的结构,如取代基的性质、空间位阻等都会影响羧酸酯的反应活性。
2011-酰化反应

N O CH3
羧酸三硝基苯酯
R
O C O
O2N NO2
O2 N
O R''OH+ R-C-OH + Cl
O2N O2N NO2
O R-C-OR''
O R C O
O2N NO2
难 于 分 离 ,所 以 三 种 物 质 一 起 加 入
O2N
3. 酸酐(anhydride)为酰化剂
(1)反应通式 (2)反应机理 (3)影响因素
将氮固定在缺电子环上
N N O C N N O N N HN
+ RCOOH
R
C
+ CO2 +
N H
第三节 氮原子上的酰化反应
脂肪胺(aliphatic amine)的N-酰化 芳香胺(aromatic amine)的N-酰化
氨基的保护 (protection of amino group)
氨基的保护(部分自学) 了解羧酸酰胺的合成及脱除方法
O V=K[R'-C-L] 一级反应 O L R-O--C-R' + L H
SN2
' R-OH + R-C-L O RO-C-R ' + HL
R H
O
O V=K[ROH][R'-C-L] 二级反应
酰化剂的反应活性 RCO+ClO4->RCO+BF4->RCO.Hal>(RCO)2O>RCO0H> RCOOR’>RCONHR’ 被酰化物的活性
羟基、胺基等基团的保护
CH3 N
Et HN
H O O OH
N F
N COOH O
抗胆碱药
第三章 酰化反应

ቤተ መጻሕፍቲ ባይዱ
RCOOH
HN-CO 2C2H5 N-CO 2C2H5 Ph 3P
+
RCOO
-
(I)
(I)
R'OH
Ph 3P
+
O-R'
RCOO
-
(II)
- Ph 3PO
R'OOCR
§1.1.1d DEAD/Ph3P
O NH HOCH 2 O N O + NO 2 COOH DEAD/Ph 3P R. T. HO OH p-O2NC 6H4COOCH 2 N O O NH O
+
N
RCOO
-
§2.2 羧酸酯为酰化剂
• 羧酸酯的活性虽不如酰氯、酸酐,但易于制备, 且在反应中不与胺成盐,其反应属BAC2(表示碱催 化下酰氧断裂的双分子反应)机理。 • 没有活化的酯直接与胺反应需在较高的温度下进 行,因此在反应中常以醇钠或其他强碱(如NaNH2、 n-BuLi、LiA1H4、NaH、Na等)作为催化剂脱掉质 子以增加胺的亲核性,采用BBr3等Lewis酸为催化 剂也可提高酰化的收率。
§1.2.1 酰氯为酰化剂
• 酰氯在碱性催化剂(氢氧化钠、碳酸钠、三 乙胺、吡啶等)存在下可使酚羟基酰化
§1.2.1 酰氯为酰化剂
Py ArOH + RCOCl RCOOAr + PyH Cl
+ -
HO
OH C(CH 3)3
(CH3)3COCl/Py
(CH3)3COO (84%)
OH C(CH 3)3
§1 氧原子上的酰化反应
• 醇的O-酰化可得酯,其反应难易取决于醇的亲核 能力及酰化剂的活性。一般情况下伯醇易于反应, 仲醇次之,而叔醇则由于立体位阻较大且在酸性 介质中又易于脱去羟基而形成叔碳正离子,使酯 化按AAl1(表示酸催化下烷氧断裂的单分子反应)历 程而完成。 • 另外伯醇中的苄醇、烯丙醇虽然不是叔醇,但由 于易于脱羟基形成稳定的碳正离子,所以也表现 出与叔醇相类似的性质。
第三章酰化反应-药物合成反应gcz

O
+
H
R C O R'
RCOOR'
+
H
H
H
H
NCN
O
17
第三章 酰化反应
氧原子上的酰化反应(酯的制备)
CH3 OH
O+
CH3
H3C
OH
HO
酰化能力弱,因为可形成分子内氢键
DCC/Et2O R.T.20min
H3C
CH3 O O CH3
OH
CH2OH
OO
+
COOH DCC/DMAP
25℃
O
I
O
CH2 O C
+
C12H25OH
TsOH Xylene
HO
OH
HO
OH
OH
OH
OH n-C11H23
OH CO2H
C3H7-n
TsOH
CH2Cl2 24 h
n-C11H23
OO
n-C3H7 OH
14
第三章 酰化反应
氧原子上的酰化反应(酯的制备)
(2) Lewis酸催化法: (AlCl3、SnCl4、FeCl3、BF3等)
HO
OH H O
OH
OH CO2H
H+-resin HO MeOH, 2h
OH H O
OH
OH CO2Me
AcHN
AcHN
OH
OH
16
第三章 酰化反应
氧原子上的酰化反应(酯的制备)
( 4 ) D C C 二 环 己 基 碳 二 亚 胺 R-N=C=N-R (Dicyclohexylcarbodiimide)
第三章酰化反应

COCH3
②分子内的酰化反应 不饱和脂肪烃和脂环烃通过分子内酰化反也可以制备 不饱和环酮。例如:
COCl BF3/Et2O heat CO
(60%)
③烯硅烷的酰化反应 烯硅烷得酰化反应得定位具有区域专一性,由于受三甲基硅 基的影响,作为亲电试剂得酰基优先攻击硅原子所连的碳原 子而形成烯酮。例如:
得到酰化产物(107)。
X X H2C Y
O
B
HC (105) Y
O R
R
Z + HC
X Y
O Z R
X CH Y
C (106)
C (107)
+
Z
CHXY
(3)影响因素 ①活性亚甲基化合物的影响 活性亚甲基化合物的活性与其所连的两个吸电子基的种 类有关,吸电子基的吸电子能力越强,其α位的氢原子酸 性则越强,越容易发C Cl
O O
AlCl3 /CH2Cl2 0℃
CH3 CH3 (88%)
三、羰基化合物α位的C-酰化反应
羰基化合物α位的氢原子由于受相邻的羰基的影响而显 一定的酸性,α位的C原子比较活泼,可与酰化剂发生C酰化反应生成1,3-二羰基化合物。
1.活性亚甲基化合物的C-酰化 (1)反应通式
(2)反应机理
酰氯在AlCl3作用下生成羧基络合物(99)或酰基正离子 (101),然后(101)对烯烃进行亲电进攻得中间体(102), (102)脱质子得酰化产物不饱和酮(104),同时(102) 也可能与氯负离子作用得中间体β-氯代酮(103),(103) 再经脱氯化氢得产物不饱和酮(104)。
二、烯烃的C-酰化
烯烃与酰氯在AlCl3等Lewis酸催化下也可 以发生C-酰化反应,亦可以把它看成是脂 肪碳原子的Friedel-Crafts反应。 (1)反应通式
第三章-酰化反应

②醇结构的影响
醇作为被酰化物,其影响与前面所讲 的被酰化物活性影响因素一致
(4)应用特点
①羧酸甲酯或乙酯的应用:用高级醇置换低级醇。
OH HO
C CO2CH3
N
Na 110-120℃
CH3
OH C CO2
N
CH3OH
CH3
②活性酯的应用 i. 羧酸硫醇酯:
N
O R CO
N C
N H
O
CN H+
+
N CN H O
R C O-..
O R CO
R' O .. H
O
H +N C N H
(15)
O . R C O-..
例:
R
C
+
O
R'
+
N H
H H+
O R C OR'
CN H
ii. 用来提高醇反应活性的催化剂
N COOEt DEAD
N COOEt
偶氮二羧酸二乙酯;
O Py
EtO P OEt -HCl
Br
O
O
R'OH
R C O P OEt
OEt
RCOOR'
4. 酰氯为酰化剂
(1)反应通式
催化剂:Lewis酸、有机碱
(2)反应机理
①吡啶类碱的催化
吡啶类碱还能中和反应中产生的氯化氢
② Lewis酸催化
O R C Cl + AlCl3
O AlCl3 R C Cl
须用强酰化剂:酰氯、酸酐、活性酯 电子效应
苯环上有给电子基团时,增加酰化反应的活性 苯环上有吸电子基团时,减小酰化反应的活性
药物合成反应(第三版_闻韧)第三章 酰化反应

Organic Reactions for Drug Synthesis
例:抗胆碱药溴美喷酯(宁胃适)的合成
O C OH
HO CH3CH2ONa N CH3
60-80℃,45min
C-OCH2CH3 +
C OH
O C-O N CH3
O CH3Br C OH C-O N CH3 · Br CH3 (77%)
n-C4H9 CH Zn 175℃
2+
R'OH
O RCOR'
n-C4H9 n-C18H37 C COOH + H3C C
CH2 CH3
n-C18H37 C
COO C
n-C7H15 n C18H37 OH/H △ ,6min
+
n-C7H15 n-C4H9 COO C18H37-n + O H3C C CH3
Organic Reactions for Drug Synthesis
叔醇的酯化:SN1机理。
Organic Reactions for Drug Synthesis
SN1
O ' R-C-L
慢
O R-OH + R'-C
O R'-C + L O 快 R'-C-OR
SN2
O ' R-OH + R-C-L O ' + L R-O--C-R H
n-C18H37 C
n-C7H15
Organic Reactions for Drug Synthesis
3、酸酐为酰化剂
•与酸和酯作酰化剂相比,酸酐的酰化活性较强, 而且酰化反应是不可逆的。 •酰化反应过程可以被酸(硫酸等质子酸以及三氟 化硼等Lewis酸)和碱(主要为醋酸钠以及三乙胺 等有机碱)所催化。 •当酸酐难于制备时,也可采用混酸酐法。常用 的混酸酐有磺酸酐、磷酸酐和碳酸酐。
第三章 酰化反应

NH2 + CH3COCl CH3COONa NHCOCH3 99%
40
用作保护基:
NH2 Ac2O NHAc CH3I H3C NAc H2O NHCH3
选择性酰化:
H2N Ac2O AcHN 84% pH4.15 CH2NH2 Ac2O pH11.25 H2N 85% CH2NHAc
O CH2OH O O + I CH2O COOH DCC/DMAP 25 oC O O 96% I
8
2. 羧酸酯(ester)作为酰化剂—酯交换反应
RCOOR' + R''OH RCOOR'' + R'OH
醇解 酸解 酯交换
9
反应机理
酸催化:硫酸、TsOH
碱催化:醇钠
RCOOR' + R''O O R C OR'' OR' RCOOR'' -R'O
10
该反应是可逆反应,采用除去生成的醇以打破平 衡; 适用于活性较小的羧酸以及结构复杂的醇; 常用甲酯或乙酯合成高级酯。
MeO O O
C12H25 +
OH DMAP Ar
O Ar O O
C12H25
Ar = 1-Naphtyl 97%
11
局麻药丁卡因的合成
12
抗胆碱药溴美喷酯的合成
13
为了提高酯的酰化能力,开发了许多酰化能力比较强的活性 酯,以用于合成较为复杂的化合物,如肽、大环内酯等,这 里重点介绍几类活性酯。
20
4. 酰氯(Acid chloride)为酰化剂
第三章 酰化反应

O C O CH2CH2N(C2H5)2 + C2H5OH
(3)反应条件
水容易使酯水解,因此反应需要在无水条件下进 行,还要防止其他酯类在乙醇中重结晶。例:抗胆碱 药溴美喷酯(宁胃适)的合成
HO C OH CH3 COOCH2CH3 + N CH3CH2ONa 60-80℃,45min
C OH
COO N CH3
攻,而且使中间体稳定;若是给电子的作用相反。
根据上述的反应机理可以看出,作为被酰化物质 ( 醇 ) ,
其亲核性越强越容易被酰化。具有不同结构的被酰化物的 亲核能力一般规律为; RCH2 - > R-NH- > R-O - > R-NH2 >R-OH。(难酯化的醇需AlCl3催化)
在消除阶段
反应是否易于进行主要取决于 L的离去倾向。L—碱性 越强,越不容易离去, Cl— 是很弱的碱,—OCOR的碱性 较强些,OH— 、OR—是相当强的碱,NH2—是更强的碱。
O ROH + R' C L R' O C OR + HL
醇的结构对酰化反应的影响 伯醇(苄醇、烯丙醇除外)>仲醇>叔醇
一 、醇的氧酰化 (一) 酰氯为酰化剂
RCOCl + R'OH
RCOOR' + HCl
酰氯常用于空间位阻大的醇,如叔醇的酰化:
(CH3)3COH + C6H5CH=CHCOCl (CH3)3COOCHCH=CHC6H5
醇的结构对酰化反应的影响 立体影响因素:伯醇>仲醇>叔醇、烯丙醇 叔碳正离子倾向与水反应而逆转
电子效应的影响
羟基a位吸电子基团通过诱导效应降低O上电子云
密度,使亲核能力降低
苄醇、烯丙醇由于p-p共轭,使活性降低
药物合成反应第三章酰化反应

O18
CH3C-OC(CH3)3 + H2O
*3 酰基正离子机理
O
O
+
C-OH
C-OH2
CH3
CH3 H2SO4(浓) CH3
CH3
O
+C CH3
CH3
+O
C
CH3
CH3
CH3
CH3
CH3
CH3
属于SN1机理
CH3OH
CH3
OH
C-O+ CCHH33 -H+
CH3
O
C-OCH3 CH3
CH3
CH3 78%
•iii羧酸-多取代苯甲酸混合酸酐
• Yamaguchi酯化
Cl
Cl O
O
Cl
COCl + RCOOH
Cl
CO C R
Cl
Cl
• iv 羧酸-磷酸混合酸酐
• BOP-Cl
DPPA
•其它混合酸酐
• 其它:
O Cl C Cl
O Cl C OEt
O EtO C OEt
碳酸酯
RCOOH
O
O
R C O C Cl
CH2=C=O + ROH
OHR - H
H2C C O
OR H2C C OH
O H3C C OR
二 酚的氧酰化
p-π共 轭 , 羟 基 氧 的 亲 核 性 降 低 , OH 使 酚 羟 基 不 易 被 酰 化 •
-用强酰化剂:酰氯、酸酐、活性酯
OH
+ PhCOCl
Py
O
CH3
OCOPh COCH3
第三章 酰化反应
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
N
RCOOH + N S S N
2,2-二吡啶二硫化物
NO2
Ph3P Ph3P=O Et3N
RCOOH +
O N S C Cl
O N S C R
RCOCl + N SH
吡啶硫酚
Et3N
2-吡啶硫醇酯
优点:对仲、叔醇以及有位阻的伯醇效果较好;缺点: 硫醇酯具有特殊气味及毒性,应用受到限制。
CH3 H3C CH3 CH 3 (CH3)3COH/CH3CN/CuCl2 r.t. , 12min (96%) H3C CH3 COCl N SH H3C
CH3 CO CH3 S N
COOC(CH3)3
b.羧酸吡啶酯
OH HO(CH3)nCOOH I N CH3 (CH2)n O C O N CH3 O X Et3N , 7.5~8h I N CH3 O (CH2)n C O
c.羧酸三硝基苯酯 d. 羧酸异丙烯酯
3. 酸酐为酰化剂 酸酐是一个强酰化剂,反应具有不可逆性。酸酐多用 在反应困难或位阻较大的醇羟基的酰化上。 ①催化剂 酸性催化剂:硫酸、对甲苯磺酸、三氟化硼、氯化锌、 氯化钴 碱性催化剂:羧酸钠、吡啶、三乙胺、喹啉、N、N-二 甲基苯胺,作用:a.除掉氯化氢;b.催化作用。
C2H5
喹诺酮类抗菌药依诺沙星中间体 ③转变成其它基团
CH3 AlCl3/CS2 5℃, 3h CH3 COCH3 CH3COCl
CH(CH3)2
CH(CH3)2
(2)药物结构修饰 )
S OAc COO NHCOCH3 F3C N CH2CH2CH2 N (1) CH2OCOCH2CH2COOH CO HO OH NHCOCHCl2 CH OH O (3) O2N (4) CH CH2OCOC15H31 (2) N CH2CH2OCOC6H13
①催化剂 反应常用硫酸、对甲苯磺酸等质子酸,Lewis酸或醇 钠等进行催化。 例:局麻药丁卡因的合成
COOC2H5 HOCH2CH2N(C2H5)2 C2H5ONa , NHC4H9-n NHC4H9-n COOCH2CH2N(C2H5)2
例:抗胆碱药溴美喷酯(宁胃适)的合成 抗胆碱药溴美喷酯(宁胃适)
醇
V
CH3OH
1
EtOH
0.84
n-C3H7OH
0.84
CH2=CHCH2OH
0.64
PhCH2OH
0.68
异丙醇
0.47
叔丁醇
0.026
(3)酰化剂的活性 活性顺序:α-碳无支链脂肪羧酸 > α-碳有支链脂肪羧 酸 > 芳香羧酸 > 邻位取代芳香羧酸
COOH H C R' COOH R COOH > >
O O O R C Cl + AlCl3
Bu-t OH Cl O DMAP/AlCl3 Cl Bu-t O reflux Cl Bu-t O Bu-t O
R C Cl
R
C
AlCl4
Bu-t O O AlCl3
Bu-t O O
碱催化:有机碱不断除掉反应中释放的氯化氢,而且对 反应有催
a.羧酸-三氟乙酸混合酸酐 适用于立体位阻较大的羧酸的酯化
O O C R +CF3COOH
(CF3CO)2O+RCOOH
O R C
F3C C O
O
H
O
O
COOH
R
羧酸-三氟乙酸混合酸酐的制备 O O
R C
C
OH
F3C C O
+ F3C C OH
F3C C
COOBu -t t-BuOH (CF3CO)2O r.t. , 20min (95%)
O R
O R C N
R' N
N R
C
R ''
N的共轭效应使酰胺酯化作用弱
O C N O R C N N
N
N
将氮固定在缺电子环上
O N N C N N RCOOH R
O N C N
N CO2 N H
二、酚的氧酰化 (用强酰化剂:酰氯、酸酐、活性酯)
p-π共轭,羟基氧的亲核性降低, OH 使酚羟基不易被酰化
H3C
N
C6H5 1) C2H5OH/H2SO4/24h/ COOH 2) HCl
H3C
N
C6H5 HCl COOC2H5
镇痛药盐酸哌替啶(又名度冷丁)
②起保护基作用
O2N (CH3CO)2O Cl N NH C 2H5 O2N NaOH Cl N N COCH3 Cl N NH C2H5 O2N
b.羧酸-磺酸混合酸酐 适用于对酸敏感的醇如叔醇、烯丙醇、丙炔醇的酯化。
O RCOOH + R'SO2Cl RCOCl + R'SO2Cl
O RCOOH TsCl/Py RCOO S O CH3 R1OH RCOOR1 TsOH
R R'
C
O R C
O
SO 2
+
R'SO2OH
c.羧酸-磷酸混合酸酐 d.羧酸-多取代苯甲酸混合物
RCONR1R2
H2 O
改进措施: ① 提高温度 ②不断蒸出生成的水 ③加入脱水剂P2O5、POCl3、PCl3等除水或添加PhH、 Tol、Xyl等添加剂与水形成共沸混合物脱水。 ④催化剂(DCC)
H AcO H AcO H H C C C C C CH2OAc NH2 H OAc O RCOOH DCC/CH2Cl2 r.t. R=PhCH2SCH2 AcO H AcO H H H C C C C C CH2OAc NHCOR H OAc O
Ac 2O
HO
OH
浓H2SO4 r.t.
AcO
OH
(98%)
CH3 COOH CH3 HO
H3C (CF3CO)2O/PhH r.t. H3C
CH3 CO O CH3
H 3C (97%) H 3C
CH CH3 HO
OH
(RCO)2O
A
K2CO3
B
KOH
C
RCOCl
D
CH CH3 RCOO
A
OCOR
②羧酸酯的结构(RCOOR1) 羧酸酯中R基团空间位阻大,则氨解慢;反之,若R位阻 小且有吸电子取代基时,则易氨解。
a.对应羧酸酯RCOOR1的R空间位阻越小,则羧酸酯越活泼。 活性顺序为:
R= -H > -CH3 > -CH2C6H5 > -C2H5 > -C6H5 > -CH(CH3)2 > -C(CH3)3
⑤ 胺的结构 胺类化合物的酰化活性如下: 伯胺> 仲胺;脂肪胺>芳香胺;无空间位阻胺>有空间阻胺
COCl NH CH2NH2
2. 羧酸酯为酰化剂
RCOOR1
R2NH2
RCONHR2
R1OH
①催化剂(强碱如醇钠或Lewis酸)
H2N O N COOH S PhCH2COOCH3 CH2OAc BBr3 r.t., 5h PhCH2COHN O N CH2OAc COOH S
Et3N/DMF r.t., 10min
t-BuOOCCHCH2COOC6F5 Fmoc NH
PhCH2CHCOOH NH2
t-BuOOCCHCH2CONHCHCOOH Fmoc NH CH2Ph
例:镇痛药阿法罗定(安那度尔)的合成
OH CH3 N CH3 ①(C2 H5CO)2O/Py/△ ②HCl(gas)
OCOC2H5 CH3 ·HCl N CH3
4. 酰氯为酰化剂 酰氯是一个活泼的酰化剂,反应能力强,适于位阻 大的醇羟基酰化。由于反应中释放出来的氯化氢需要中 和,所以用酰氯酰化时多在吡啶、三乙胺、N、N-二甲 基苯胺、N、N-二甲氨基吡啶等有机碱或碳酸钠等无机 碱存在的条件下进行。 Lewis酸催化: AlCl3
R
C Cl
(CH3)3COCl/Py 5~10℃
R
C N
O
O
OH C(CH3)3
(CH 3)3CCO
OH C(CH3)3
(84%)
CH3 H3C CH3 COCl
AgCN
CH3 H3C CH3 COOCEt3
+
Et3-C-OH
HMPT
六甲基磷酰胺
5. 酰胺为酰化剂(活性酰胺,适用于对酸、碱不稳定的 化合物)
RCH2COOH > R
NH2 HOOCCH2CH2CHCOOH ROH/HBF4/Na2SO4
NH2 ROOCCH2CH2CHCOOH
(4)催化剂 a、质子酸催化法 无机酸:浓硫酸、高氯酸、硼氟酸等。 有机酸:苯磺酸、对甲苯磺酸等
O R C OH H+ OH R C OH OH R C OH
优点:简单;缺点:对位阻大的酸及叔醇等易脱水
第三章 酰化反应 Acylation Reaction
概 述
1. 定义 定义:在有机化合物分子中的碳、氧、氮等原上引 入酰基的反应称为酰化反应,酰化反应的难易程度 不仅取决于被酰化物的亲核能力,也决定于酰化剂 的活性。
O R C L + 酰化剂 Nu-H 被酰化物 R O C Nu + HL
L: X, OCOR, OH, OR', NHR Nu: R'O(O), R''NH(N), Ar(C)
第一节 氧原子上的酰化反应
一、醇的O-酰化 醇的 -
O ROH + R' C L R' O C OR + HL
是一类形成羧酸酯的反应 是羧酸的酯化反应 是羧酸衍生物的醇解反应 1. 羧酸为酰化剂
