2017年度广东省医疗器械质量监督检验
2017年医疗器械经营质量管理规范

医疗器械经营质量管理规范第一章总则第一条为加强医疗器械经营质量管理,规范医疗器械经营管理行为,保证医疗器械安全、有效,根据《医疗器械监督管理条例》和《医疗器械经营监督管理办法》等法规规章规定,制定本规范。
第二条本规范是医疗器械经营质量管理的基本要求,适用于所有从事医疗器械经营活动的经营者。
医疗器械经营企业(以下简称企业)应当在医疗器械采购、验收、贮存、销售、运输、售后服务等环节采取有效的质量控制措施,保障经营过程中产品的质量安全。
第三条企业应当按照所经营医疗器械的风险类别实行风险管理,并采取相应的质量管理措施。
第四条企业应当诚实守信,依法经营。
禁止任何虚假、欺骗行为。
第二章职责与制度第五条企业法定代表人或者负责人是医疗器械经营质量的主要责任人,全面负责企业日常管理,应当提供必要的条件,保证质量管理机构或者质量管理人员有效履行职责,确保企业按照本规范要求经营医疗器械。
第六条企业质量负责人负责医疗器械质量管理工作,应当独立履行职责,在企业内部对医疗器械质量管理具有裁决权,承担相应的质量管理责任。
第七条企业质量管理机构或者质量管理人员应当履行以下职责:(一)组织制订质量管理制度,指导、监督制度的执行,并对质量管理制度的执行情况进行检查、纠正和持续改进;(二)负责收集与医疗器械经营相关的法律、法规等有关规定,实施动态管理;(三)督促相关部门和岗位人员执行医疗器械的法规规章及本规范;(四)负责对医疗器械供货者、产品、购货者资质的审核;(五)负责不合格医疗器械的确认,对不合格医疗器械的处理过程实施监督;(六)负责医疗器械质量投诉和质量事故的调查、处理及报告;(七)组织验证、校准相关设施设备;(八)组织医疗器械不良事件的收集与报告;(九)负责医疗器械召回的管理;(十)组织对受托运输的承运方运输条件和质量保障能力的审核;(十一)组织或者协助开展质量管理培训;(十二)其他应当由质量管理机构或者质量管理人员履行的职责。
医疗器械质量检测记录表

医疗器械质量检测记录表
1. 引言
本文档为医疗器械的质量检测记录表,用于对医疗器械的质量进行检验和记录。
通过对医疗器械的外观、尺寸、功能性能、安全性能、材料成分和寿命进行测试,以保证医疗器械的质量符合相关标准和要求。
2. 检测项目及标准
3. 检测方法
- 外观检查:对医疗器械的外观进行检查,确保无明显缺陷。
- 尺寸测量:使用相应的测量工具对医疗器械进行尺寸测量,
确保符合标准尺寸。
- 功能性能测试:根据医疗器械的说明书进行功能性能的测试,确保其正常运行。
- 安全性能测试:根据医疗器械的说明书进行安全性能的测试,确保其无安全隐患。
- 材料成分分析:对医疗器械的材料成分进行分析,确保符合
相关要求。
- 寿命测试:根据医疗器械的说明书进行寿命测试,确保其使用寿命符合要求。
4. 检测记录
5. 结论
根据医疗器械质量检测记录表的检测结果,医疗器械的质量符合相关标准和要求,可以正常使用。
6. 参考文献
[1] 医疗器械质量管理要求. GB/T -2016
[2] 医疗器械质量检验检测通则. YY/T 0287-2017
[3] 医疗器械寿命试验指南. YY/T 0644-2014。
广东省医疗器械质量监督检验所三水分中心承检目录(更新至2011.03)

广东省医疗器械质量监督检验所三水中心承检目录(更新至2011.03)有源部分GB 9706.1‐2007 医用电气设备 第一部分:安全通用要求GB/T14710‐2009 医用电器环境要求与试验方法YY/T 1043‐2004 牙科治疗机YY/T 0058‐2004 牙科椅病人椅YY 0055.1‐2009 牙科 光固化机 第1部分:石英钨卤素灯YY 0055.2‐2009 牙科 光固化机 第2部分:发光二极管(LED)灯YY0460‐2009 超声洁牙设备YY/T 1120‐2009 牙科学 口腔灯YY 91057‐1999 医用脚踏开关通用技术条件YY0571‐2005 医用电气设备第2部分:医院电动床安全专用标准GB 12996‐91 电动轮椅车YY/T 0273‐2009 齿科银汞调合器无源部分GB/T14233.1-2008 医用输液、输血、注射器具检验方法 第1部分:化学分析方法GB/T4340.1‐2009 金属材料 维氏硬度试验 第1部分:试验方法YY/T0149-2006 不锈钢医用器械耐腐蚀性能试验方法YY 1045.1‐2009 牙科手机 第1部分:高速气涡轮手机GB/T 13800‐2009 手动轮椅车GB/T 15494‐1995 手动轮椅车强度试验方法YZB/粤0203‐2009 愈佳医学影像存档于传输系统(PACS)YZB/粤0933-2010 金属烤瓷固定修复体YZB/粤0489-2010 YZB/粤0489-2010YZB/粤0387-2010 金属义齿固定修复体 可摘全口义齿YY1027‐2001 齿科藻酸盐印模材料YY 0033‐2000 无菌医疗器具生产管理规范GB/T 16292~16294‐1996 医药工业洁净室(区)悬浮粒子、浮游菌和沉降菌的测试方法直接接触药品的包装材料和容器管理办法YBB 00412004 药品包装材料生产厂房洁净‐室(区)的测试方法GB/T19545.1—2004 单臂操作助行器技术要求和试验方法 第1部分:肘拐杖YZB/粤0725‐2010 金属支架可摘局部义齿GB 50333‐2002 医院洁净手术部建筑技术规范YY/T 0274.1‐1995 牙科洁刮器械 洁治器YY/T 0274.2‐1995 牙科洁刮器械 刮治器YY/T 0275‐1995 银汞合金充填器YY/T 0276‐1995水门汀充填器YY/T 0277‐1995牙根尖挺YY/T 0278‐1995根管充填器YY 0302‐1998高速牙科车针YY 91010‐1999 牙科旋转器械 配合尺寸YY 91011‐1999牙科旋转器械 基本尺寸和标号YY 91014‐1999牙探针YY 91064‐1999牙科旋转器械 钢和硬质合金牙钻技术条件YZB/MEG 004‐2006牙科种植体手术用钻头GB 16930.1‐1997盲人手杖 安全色标记GB/T 14728.1‐2006 双臂操作助行器要求和试验方法 第1部分:框式助行架GB/T 19545.2-2009单臂操作助行器 要求和试验方法 第2部分:腋拐。
医疗器械生产质量管理规范2017

医疗器械生产质量管理规范2017第一章总则第一条为保障医疗器械安全、有效,规范医疗器械生产质量管理,根据《医疗器械监督管理条例》(国务院令第650号)、《医疗器械生产监督管理办法》(国家食品药品监督管理总局令第7号),制定本规范。
第二条医疗器械生产企业(以下简称企业)在医疗器械设计开发、生产、销售和售后服务等过程中应当遵守本规范的要求。
第三条企业应当按照本规范的要求,结合产品特点,建立健全与所生产医疗器械相适应的质量管理体系,并保证其有效运行。
第四条企业应当将风险管理贯穿于设计开发、生产、销售和售后服务等全过程所采取的措施应当与产品存在的风险相适应。
第二章机构与人员第五条企业应当建立与医疗器械生产相适应的管理机构,并有组织机构图,明确各部门的职责和权限,明确质量管理职能。
生产管理部门和质量管理部门负责人不得互相兼任。
第六条企业负责人是医疗器械产品质量的主要责任人,应当履行以下职责:(一)组织制定企业的质量方针和质量目标;(二)确保质量管理体系有效运行所需的人力资源、基础设施和工作环境等;(三)组织实施管理评审,定期对质量管理体系运行情况进行评估,并持续改进;(四)按照法律、法规和规章的要求组织生产第七条企业负责人应当确定一名管理者代表。
管理者代表负责建立、实施并保持质量管理体系,报告质量管理体系的运行情况和改进需求,提高员工满足法规、规章和顾客要求的意识。
第八条技术、生产和质量管理部门的负责人应当熟悉医疗器械相关法律法规,具有质量管理的实践经验,有能力对生产管理和质量管理中的实际问题作出正确的判新和处理。
第九条企业应当配备与生产产品相适应的专业技术人员、管理人员和操作人员,具有相应的质量检验机构或者专职检验人员。
第十条从事影响产品质量工作的人员,应当经过与其岗位要求相适应的培训具有相关理论知识和实际操作技能。
第十一条从事影响产品质量工作的人员,企业应当对其健康进行管理,并建立健康档案。
第三章厂房与设施第十二条厂房与设施应当符合生产要求,生产、行政和辅助区的总体布局应当合理,不得互相妨碍。
医疗设备传导抗扰度测试方法分析和研究

医疗设备传导抗扰度测试方法分析和研究郑毅;宋盟春;李伟松;曾俏;邹明明;余华通【摘要】文章介绍了医疗设备在传导抗扰度的测试标准要求,并分析和研究了测试关注点,以方便医疗设备设计人员和测试工程师在实际工作中参考、改进和完善.【期刊名称】《中国医疗器械信息》【年(卷),期】2017(023)013【总页数】4页(P40-43)【关键词】医疗设备;传导抗扰度;测试标准【作者】郑毅;宋盟春;李伟松;曾俏;邹明明;余华通【作者单位】广东省医疗器械质量监督检验所广东广州 510663;广东省医疗器械质量监督检验所广东广州 510663;广东省医疗器械质量监督检验所广东广州510663;广东省医疗器械质量监督检验所广东广州 510663;广东省医疗器械质量监督检验所广东广州 510663;广东省医疗器械质量监督检验所广东广州 510663【正文语种】中文【中图分类】R197.39医疗器械电磁兼容标准YY 0505-2012《医用电气设备第1-2部分:安全通用要求并列标准:电磁兼容要求和试验》自2014年1月1日开始实施,同时GB/T 18268.1-2010《测量、控制和实验室用的电设备电磁兼容性要求第1部分:通用要求》、GB/T 18268.26-2010《测量、控制和实验室用的电设备电磁兼容性要求第26部分:特殊要求体外诊断(IVD)医疗设备》这两份所对应实验室用医疗器械标准也同步实施。
当前尚无对医疗设备在传导抗扰度测试的参考文献,三份标准分别在基础标准GB/T 17626.6-2008《电磁兼容试验和测量技术射频场感应的传导骚扰抗扰度》做了修改与补充,下面介绍上述三份医疗设备测试标准的作具体要求,分析和研究其测试关注点。
电磁兼容测试标准对比,见表1。
2.1 试验电平与校准2.1.1 试验电平关于试验电平,GB/T17626.6-2008给出了3个试验等级,分别是1V、3V、10V。
YY0505-2012中定义了非生命支持设备在0.15MHz~80MHz,试验电平为3V,一般情况下除了部分手术室设备可以定义为生命支持设备,其余医用电气设备均为非生命设备执行3V电平。
医疗器械监督管理条例(2017修正)

法律修订2000年1月4日中华人民共和国国务院令第276号公布2014年2月12日国务院第39次常务会议修订通过根据2017年5月4日《国务院关于修改〈医疗器械监督管理条例〉的决定》修订正文第一章总则第一条为了保证医疗器械的安全、有效,保障人体健康和生命安全,制定本条例。
第二条在中华人民共和国境内从事医疗器械的研制、生产、经营、使用活动及其监督管理,应当遵守本条例。
第三条国务院食品药品监督管理部门负责全国医疗器械监督管理工作。
国务院有关部门在各自的职责范围内负责与医疗器械有关的监督管理工作。
县级以上地方人民政府食品药品监督管理部门负责本行政区域的医疗器械监督管理工作。
县级以上地方人民政府有关部门在各自的职责范围内负责与医疗器械有关的监督管理工作。
国务院食品药品监督管理部门应当配合国务院有关部门,贯彻实施国家医疗器械产业规划和政策。
第四条国家对医疗器械按照风险程度实行分类管理。
第一类是风险程度低,实行常规管理可以保证其安全、有效的医疗器械。
第二类是具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械。
第三类是具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械。
评价医疗器械风险程度,应当考虑医疗器械的预期目的、结构特征、使用方法等因素。
国务院食品药品监督管理部门负责制定医疗器械的分类规则和分类目录,并根据医疗器械生产、经营、使用情况,及时对医疗器械的风险变化进行分析、评价,对分类目录进行调整。
制定、调整分类目录,应当充分听取医疗器械生产经营企业以及使用单位、行业组织的意见,并参考国际医疗器械分类实践。
医疗器械分类目录应当向社会公布。
第五条医疗器械的研制应当遵循安全、有效和节约的原则。
国家鼓励医疗器械的研究与创新,发挥市场机制的作用,促进医疗器械新技术的推广和应用,推动医疗器械产业的发展。
第六条医疗器械产品应当符合医疗器械强制性国家标准;尚无强制性国家标准的,应当符合医疗器械强制性行业标准。
医疗器械监督管理条例(2017年新修订)

医疗器械
医疗器械,是指直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件(物理方式,非药理方式)
疾病的诊断、预防、监护、治疗或者缓解
损伤的诊断、监护、治疗、缓解或者功能补偿
生理结构或者生理过程的检验、替代、调节或者支持
生命的支持或者维持
三、医疗器械经营质量管理规范
国家食品药品监督管理总局关于施行医疗器械经营质量管理规范的公告(2014年第58号) 为加强医疗器械经营质量管理,规范医疗器械经营管理行为,保证公众用械安全,国家食品药品监督管理总局根据相关法规规章规定,制定了《医疗器械经营质量管理规范》,现予公布,自公布之日起施行。 2014年12月12日
第二章 职责与制度
第五条 企业法定代表人或者负责人是医疗器械经营质量的主要责任人,全面负责企业日常管理,应当提供必要的条件,保证质量管理机构或者质量管理人员有效履行职责,确保企业按照本规范要求经营医疗器械。 第六条 企业质量负责人负责医疗器械质量管理工作,应当独立履行职责,在企业内部对医疗器械质量管理具有裁决权,承担相应的质量管理责任。 第七条 企业质量管理机构或者质量管理人员应当履行以下职责:
3、医疗器械分类
第一类是风险程度低,实行常规管理可以保证其安全、有效的医疗器械。 第二类是具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械。 第三类是具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械。 评价医疗器械风险程度,应当考虑医疗器械的预期目的、结构特征、使用方法等因素。
第十二条 企业应当设置或者配备与经营范围和经营规模相适应的,并符合相关资格要求的质量管理、经营等关键岗位人员。第三类医疗器械经营企业从事质量管理工作的人员应当在职在岗。 第十三条 企业应当配备与经营范围和经营规模相适应的售后服务人员和售后服务条件,也可以约定由生产企业或者第三方提供售后服务支持。售后服务人员应当经过生产企业或者其他第三方的技术培训并取得企业售后服务上岗证。 第十四条 企业应当对质量负责人及各岗位人员进行与其职责和工作内容相关的岗前培训和继续培训,建立培训记录,并经考核合格后方可上岗。培训内容应当包括相关法律法规、医疗器械专业知识及技能、质量管理制度、职责及岗位操作规程等。 第十五条 企业应当建立员工健康档案,质量管理、验收、库房管理等直接接触医疗器械岗位的人员,应当至少每年进行一次健康检查。身体条件不符合相应岗位特定要求的,不得从事相关工作。
关于发布医疗器械临床试验机构条件和备案管理办法的公告(2017年第145号)

国家食品药品监督管理总局国家卫生和计划生育委员会关于发布医疗器械临床试验机构条件和备案管理办法的公告(2017年第145号)2017年11月24日发布根据《中共中央办公厅、国务院办公厅印发〈关于深化审评审批制度改革鼓励药品医疗器械创新的意见〉的通知》(厅字〔2017〕42号)和《国务院关于修改〈医疗器械监督管理条例〉的决定》(中华人民共和国国务院令第680号)规定,医疗器械临床试验机构由资质认定改为备案管理。
国家食品药品监督管理总局会同国家卫生和计划生育委员会制定了《医疗器械临床试验机构条件和备案管理办法》,现予发布,自2018年1月1日起施行。
食品药品监管总局国家卫生计生委2017年11月15日医疗器械临床试验机构条件和备案管理办法第一章总则第一条为了加强和规范医疗器械临床试验机构管理,根据《医疗器械监督管理条例》的规定,制定本办法。
第二条本办法所指的医疗器械临床试验机构备案,是指医疗器械临床试验机构按照本办法规定的条件和要求,将机构概况、专业技术水平、组织管理能力、伦理审查能力等信息提交食品药品监督管理部门进行存档、备查的过程。
第三条本办法适用于在中华人民共和国境内开展医疗器械临床试验的机构备案管理工作。
第二章备案条件第四条医疗器械临床试验机构应当符合医疗器械临床试验质量管理规范的要求,具备开展医疗器械临床试验相应的专业技术水平、组织管理能力、伦理审查能力等以下条件:(一)具有医疗机构执业资格;(二)具有二级甲等以上资质;(三)承担需进行临床试验审批的第三类医疗器械临床试验的,应为三级甲等医疗机构;(四)具有医疗器械临床试验管理部门,配备适宜的管理人员、办公条件,并具有对医疗器械临床试验的组织管理和质量控制能力;(五)具有符合医疗器械临床试验质量管理规范要求的伦理委员会;(六)具有医疗器械临床试验管理制度和标准操作规程;(七)具有与开展相关医疗器械临床试验相适应的诊疗科目,且应与医疗机构执业许可诊疗科目一致;(八)具有能够承担医疗器械临床试验的人员,医疗器械临床试验主要研究者应当具有高级职称,其中开展创新医疗器械产品或需进行临床试验审批的第三类医疗器械产品临床试验的主要研究者应参加过3个以上医疗器械或药物临床试验;(九)已开展相关医疗业务,能够满足医疗器械临床试验所需的受试人群要求等;(十)具有防范和处理医疗器械临床试验中突发事件和严重不良事件的应急机制和处置能力;(十一)国家食品药品监督管理总局、国家卫生和计划生育委员会规定的其他条件。
医疗器械监督管理条例(2017年修正)

医疗器械监督管理条例(2017年修正)医疗器械监督管理条例(2017年修正)第一章总则第一条为了加强医疗器械监督管理,确保医疗器械安全有效和人民群众身体健康,根据《中华人民共和国医疗器械监督管理法》的规定,制定本条例。
第二条医疗器械监督管理的基本原则是:保证人民群众的生命安全和身体健康第一。
第三条本条例适用于医疗器械的生产、经营、使用、委托生产、进口、出口和广告宣传等活动。
第四条国家实行医疗器械分类管理制度。
第二章医疗器械的监督管理第五条市场监督管理部门负责医疗器械的监督管理工作,具体职责包括:(一)制定和组织实施医疗器械监督管理政策、法规和标准;(二)制定和组织实施医疗器械注册、备案、监督检查等制度;(三)组织对医疗器械生产、经营、使用等活动进行监督检查,发现问题及时采取监管措施;(四)组织和开展医疗器械有关的技术评价和质量检验工作;(五)处理医疗器械投诉和不良事件的汇报、调查和处理工作;(六)开展医疗器械监督管理的宣传教育和培训工作;(七)参与国际间医疗器械监督管理活动。
第六条医疗器械的注册、备案和变更由市场监督管理部门负责。
医疗器械注册必须通过相关法定机构的技术评价,并可依法对其进行专项审批。
第七条医疗器械的生产、经营必须取得医疗器械许可证。
市场监督管理部门应当会同有关部门从事医疗器械生产、经营活动的单位制定生产、经营规范,并组织实施。
第八条进口、出口医疗器械必须符合国家技术标准,有关进口、出口医疗器械的检验、检疫工作,由国务院有关部门负责。
第九条医疗器械的广告宣传必须真实、准确,不得含有虚假宣传和误导性内容。
医疗器械广告宣传发布前,须经过市场监督管理部门审查。
第十条医疗器械生产企业在国家明令禁止生产的医疗器械,不得生产、销售。
第十一条医疗器械进口企业应当具备相应的资质,从事医疗器械的进口业务。
第十二条医疗器械生产、经营单位应当建立医疗器械质量安全管理制度,加强质量管理和质量控制,保证医疗器械的质量安全。
医疗器械监督管理条例(2017修订)

医疗器械监督管理条例(2017修订)各位读友大家好,此文档由网络收集而来,欢迎您下载,谢谢医疗器械监督管理条例(XX年1月4日中华人民共和国国务院令第276号公布XX年2月12日国务院第39次常务会议修订通过)第一章总则第一条为了保证医疗器械的安全、有效,保障人体健康和生命安全,制定本条例。
第二条在中华人民共和国境内从事医疗器械的研制、生产、经营、使用活动及其监督管理,应当遵守本条例。
第三条国务院食品药品监督管理部门负责全国医疗器械监督管理工作。
国务院有关部门在各自的职责范围内负责与医疗器械有关的监督管理工作。
县级以上地方人民政府食品药品监督管理部门负责本行政区域的医疗器械监督管理工作。
县级以上地方人民政府有关部门在各自的职责范围内负责与医疗器械有关的监督管理工作。
国务院食品药品监督管理部门应当配合国务院有关部门,贯彻实施国家医疗器械产业规划和政策。
第四条国家对医疗器械按照风险程度实行分类管理。
第一类是风险程度低,实行常规管理可以保证其安全、有效的医疗器械。
第二类是具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械。
第三类是具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械。
评价医疗器械风险程度,应当考虑医疗器械的预期目的、结构特征、使用方法等因素。
国务院食品药品监督管理部门负责制定医疗器械的分类规则和分类目录,并根据医疗器械生产、经营、使用情况,及时对医疗器械的风险变化进行分析、评价,对分类目录进行调整。
制定、调整分类目录,应当充分听取医疗器械生产经营企业以及使用单位、行业组织的意见,并参考国际医疗器械分类实践。
医疗器械分类目录应当向社会公布。
第五条医疗器械的研制应当遵循安全、有效和节约的原则。
国家鼓励医疗器械的研究与创新,发挥市场机制的作用,促进医疗器械新技术的推广和应用,推动医疗器械产业的发展。
第六条医疗器械产品应当符合医疗器械强制性国家标准;尚无强制性国家标准的,应当符合医疗器械强制性行业标准。
医疗器械监督管理条例(2017年修正)

医疗器械监督管理条例(2017年修正)医疗器械监督管理条例(2017年修正)引言第一章总则第一章总则明确了医疗器械监督管理的目标、原则和范围。
目标是维护医疗器械市场秩序、保障人民健康和生命安全。
原则包括科学管理、公开透明、依法监管等。
范围涵盖了医疗器械的生产、经营、使用、进出口等各个环节。
第二章生产和经营第二章主要规定了医疗器械的生产和经营的相关要求。
其中包括生产许可证的申请和审批、生产许可证的变更、生产许可证的撤销等。
还明确了医疗器械经营企业的资质要求、记录管理、备案等事项。
第三章监督检查第三章主要涉及医疗器械监督检查相关内容。
章节中规定了监督检查的对象、程序和方式。
监督检查是确保医疗器械质量和安全的重要手段,对于发现问题、追究责任起着至关重要的作用。
第四章不良事件和召回第四章重点关注医疗器械的不良事件和召回管理。
不良事件是指医疗器械在生产、使用或其他环节中可能导致人身伤害的事件。
医疗器械企业应及时报告不良事件,并配合国家相关部门进行调查。
而对于存在质量问题的医疗器械,必须及时进行召回,以防止风险进一步扩大。
第五章法律责任第五章明确了医疗器械违法行为的法律责任。
针对生产、经营和使用中的违法行为,依法可以追究责任人的法律责任。
医疗器械企业应当规范经营行为,遵守相关法律法规,以确保企业的健康发展。
第六章附则第六章包括了对医疗器械监督管理条例的解释和补充说明。
条例的解释权和补充规定权归国家食品药品监督管理局所有。
还规定了对于条例实施过程中的问题和纠纷的解决方式。
结论医疗器械监督管理条例的修正,为我国医疗器械质量和安全管理提供了更加严格的法律依据。
通过对医疗器械生产和经营、监督检查、不良事件和召回、法律责任等方面进行规范,保障了人民群众的健康和生命安全。
条例的实施离不开各级政府的积极推动和企业的自律。
希望通过条例的修正,能够进一步提升我国医疗器械质量和安全管理的水平,确保人民群众的健康权益。
医疗器械生产监督管理办法(2017年11月7日修正)

医疗器械生产监督管理办法(2014年7月30日国家食品药品监督管理总局令第7号公布根据2017年11月7日国家食品药品监督管理总局局务会议《关于修改部分规章的决定》修正)第一章总则第一条为加强医疗器械生产监督管理,规范医疗器械生产行为,保证医疗器械安全、有效,根据《医疗器械监督管理条例》,制定本办法.第二条在中华人民共和国境内从事医疗器械生产活动及其监督管理,应当遵守本办法.第三条国家食品药品监督管理总局负责全国医疗器械生产监督管理工作。
县级以上食品药品监督管理部门负责本行政区域的医疗器械生产监督管理工作。
上级食品药品监督管理部门负责指导和监督下级食品药品监督管理部门开展医疗器械生产监督管理工作。
第四条国家食品药品监督管理总局制定医疗器械生产质量管理规范并监督实施。
第五条食品药品监督管理部门依法及时公布医疗器械生产许可和备案相关信息.申请人可以查询审批进度和审批结果;公众可以查阅审批结果。
第六条医疗器械生产企业应当对生产的医疗器械质量负责。
委托生产的,委托方对所委托生产的医疗器械质量负责。
第二章生产许可与备案管理第七条从事医疗器械生产,应当具备以下条件:(一)有与生产的医疗器械相适应的生产场地、环境条件、生产设备以及专业技术人员;(二)有对生产的医疗器械进行质量检验的机构或者专职检验人员以及检验设备;(三)有保证医疗器械质量的管理制度;(四)有与生产的医疗器械相适应的售后服务能力;(五)符合产品研制、生产工艺文件规定的要求。
第八条开办第二类、第三类医疗器械生产企业的,应当向所在地省、自治区、直辖市食品药品监督管理部门申请生产许可,并提交以下资料:(一)营业执照复印件;(二)申请企业持有的所生产医疗器械的注册证及产品技术要求复印件;(三)法定代表人、企业负责人身份证明复印件;(四)生产、质量和技术负责人的身份、学历、职称证明复印件;(五)生产管理、质量检验岗位从业人员学历、职称一览表;(六)生产场地的证明文件,有特殊生产环境要求的还应当提交设施、环境的证明文件复印件;(七)主要生产设备和检验设备目录;(八)质量手册和程序文件;(九)工艺流程图;(十)经办人授权证明;(十一)其他证明资料。
广东省医疗器械质量监督检验所医疗器械检测资格认可范围及限制要求

附件
医疗器械检测资格认可范围及限制要求
名称:广东省医疗器械质量监督检验所
(国家食品药品监督管理局广州医疗器械质量监督检验中心)
地址:广州市萝岗区科学城光谱西路1号
名称:广东省医疗器械质量监督检验所
(国家食品药品监督管理局广州医疗器械质量监督检验中心)地址:广东省东莞市东城区樟村工业区(东莞生物性能检验室)
名称:广东省医疗器械质量监督检验所
(国家食品药品监督管理局广州医疗器械质量监督检验中心)机构地址:广东省佛山市三水区乐平工业园东南路2号(三水检验室)
名称:广东省医疗器械质量监督检验所
(国家食品药品监督管理局广州医疗器械质量监督检验中心)
机构地址:深圳市南山区科技园南区高新南一道013赋安科技大楼西侧106室(深圳检验室)
名称:广东省医疗器械质量监督检验所
(国家食品药品监督管理局广州医疗器械质量监督检验中心)机构地址:广东省湛江市霞山区椹川大道60号(湛江检验室)。
医疗器械监督管理条例2017

医疗器械监督管理条例2017 国务院总理李克强日前签署第680号国务院令,公布《国务院关于修改医疗器械监督管理条例的决定》(以下简称《决定》),自公布之日起施行。
下面是求学网范文网小编给大家分享的医疗器械监督管理条例2017,一起来看看吧。
中华人民共和国国务院令第680号现公布《国务院关于修改〈医疗器械监督管理条例〉的决定》,自公布之日起施行。
总理李克强2017年5月4日国务院关于修改《医疗器械监督管理条例》的决定国务院决定对《医疗器械监督管理条例》作如下修改、一、将第十八条修改为、开展医疗器械临床试验,应当按照医疗器械临床试验质量管理规范的要求,在具备相应条件的临床试验机构进行,并向临床试验提出者所在地省、自治区、直辖市人民政府食品药品监督管理部门备案。
接受临床试验备案的食品药品监督管理部门应当将备案情况通报临床试验机构所在地的同级食品药品监督管理部门和卫生计生主管部门。
医疗器械临床试验机构实行备案管理。
医疗器械临床试验机构应当具备的条件及备案管理办法和临床试验质量管理规范,由国务院食品药品监督管理部门会同国务院卫生计生主管部门制定并公布。
二、将第三十四条第一款、第二款合并,作为第一款、医疗器械使用单位应当有与在用医疗器械品种、数量相适应的贮存场所和条件。
医疗器械使用单位应当加强对工作人员的技术培训,按照产品说明书、技术操作规范等要求使用医疗器械。
增加一款,作为第二款、医疗器械使用单位配置大型医用设备,应当符合国务院卫生计生主管部门制定的大型医用设备配置规划,与其功能定位、临床服务需求相适应,具有相应的技术条件、配套设施和具备相应资质、能力的专业技术人员,并经省级以上人民政府卫生计生主管部门批准,取得大型医用设备配置许可证。
增加一款,作为第三款、大型医用设备配置管理办法由国务院卫生计生主管部门会同国务院有关部门制定。
大型医用设备目录由国务院卫生计生主管部门商国务院有关部门提出,报国务院批准后执行。
广东省省级授权产品质量监督检验机构更名总名单
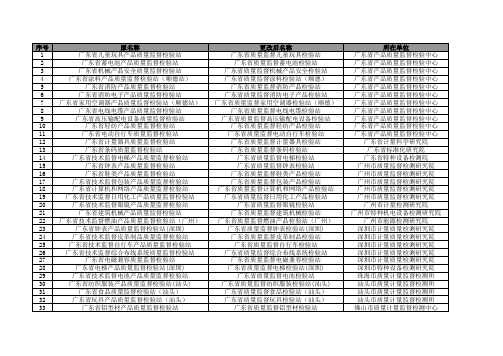
原名称 广东省儿童玩具产品质量监督检验站 广东省蓄电池产品质量监督检验站 广东省机械产品安全质量监督检验站 广东省涂料产品质量监督检验站(顺德站) 广东省消防产品质量监督检验站 广东省消防电子产品质量监督检验站 广东省家用空调器产品质量监督检验站(顺德站) 广东省电线电缆产品质量监督检验站 广东省高压输配电设备质量监督检验站 广东省轻纺产品质量监督检验站 广东省电动自行车质量监督检验站 广东省计量器具质量监督检验站 广东省条码质量监督检验站 广东省技术监督电梯产品质量监督检验站 广东省钟表产品质量监督检验站 广东省鞋类产品质量监督检验站 广东省技术监督包装产品质量监督检验站 广东省计算机和网络产品质量监督检验站 广东省技术监督日用化工产品质量监督检验站 广东省技术监督眼镜产品质量监督检验站 广东省建筑机械产品质量监督检验站 广东省技术监督燃油产品质量监督检验站(广州) 广东省钟表产品质量监督检验站(深圳) 广东省技术监督皮革制品质量监督检验站 广东省技术监督自行车产品质量监督检验站 广东省技术监督综合布线系统质量监督检验站 广东省电磁兼容质量监督检验站 广东省电梯产品质量监督检验站(深圳) 广东省技术监督电池产品质量监督检验站 广东省纺织服装产品质量监督检验站(汕头) 广东省食品质量监督检验站(汕头) 广东省玩具产品质量监督检验站(汕头) 广东省铝型材产品质量监督检验站
34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 检验站 广东省技术监督电光源产品质量监督检验站 广东省质量监督工业气体产品佛山检验站 广东省饲料产品质量监督检验站 广东省塑料管材管件产品质量监督检验站 广东省水暖卫浴产品质量监督检验站 广东省技术监督陶瓷产品质量监督检验站 广东省水泥质量监督检验站韶关站 广东省煤炭质量监督检验站韶关站 广东省技术监督烟花爆竹产品质量监督检验站 广东省加工食品(饮用水)质量监督检验站(河源) 广东省技术监督茶叶产品质量监督检验站 广东省水泥产品质量监督检验站(梅州站) 广东省煤炭产品质量监督检验站(梅州站) 广东省鞋类产品质量监督检验站(惠州) 广东省技术监督通讯终端产品质量监督检验站 广东(惠州)石油产品质量监督检验中心 广东省服装产品质量监督检验站(东莞站) 广东省家具产品质量监督检验站(东莞站) 广东省太阳能产品质量监督检验站 广东省包装产品质量监督检验站(东莞站) 广东省珠宝首饰质量监督检验站 广东省光电产品质量监督检验站 广东省服装产品质量监督检验站(中山站) 广东省技术监督锁具产品质量监督检验站 广东省不锈钢制品质量监督检验站 广东省换气扇质量监督检验站 广东省技术监督洗衣机产品质量监督检验站 广东省质量监督摩托车产品江门检验站 广东省(阳江)小五金产品质量监督检验站 广东省技术监督制糖产品质量监督检验站(湛江站) 广东省海产品质量监督检验站 广东省燃气产品质量监督检验站
医疗器械产品留样检查要点指南2017年版

医疗器械产品留样检查要点指南(2016版)产品留样指生产企业按照规定保存的、用于质量追溯或调查以及产品性能研究的物料、产品样品.产品留样在医疗器械产品质量追溯、不良事件调查中有助于查找问题、明晰事故责任,也可为确认或修改产品技术指标提供数据支持。
本检查指南旨在帮助北京市医疗器械监管人员增强对医疗器械产品留样管理的了解,提高全市医疗器械监管人员对产品留样监督检查水平。
同时,为医疗器械生产企业开展产品留样管理提供参考。
当国家相关法规、标准、检查要求发生变化时,应当重新讨论以确保本检查指南持续符合要求。
一、适用范围本检查指南可作为北京市食品药品监督管理局组织、实施的医疗器械注册质量管理体系现场核查、《医疗器械生产许可证》现场核查、医疗器械生产监督检查等涉及产品留样检查的参考资料。
本检查指南适用于无菌等有微生物指标要求的医疗器械、植入性医疗器械、体外诊断试剂以及其他有留样需求的产品。
二、检查要点(一)产品留样的基本要求生产企业应当根据产品和工艺特点制定留样管理制度,明确留样目的、留样样品、留样比例或数量、留样观察等方面的要求,开展留样观察,并保持相关记录.(二)留样目的生产企业应当根据产品特性、工艺特点、临床应用等,明确产品留样的目的。
留样目的不同,留样量及观察项目也将不同。
常见的留样目的有以下几种:1.用于医疗器械产品质量追溯生产企业可根据产品常见质量问题、临床使用风险以及产品特点明确可追溯项目,如无菌性能、物理性能。
2.用于医疗器械产品原材料质量追溯对于对产品质量有关键影响的原材料,生产企业可将原材料留样,用于成品质量部分性能指标追溯或原材料质量追溯。
3.用于稳定性研究生产企业开发新产品、新工艺或变更产品有效期等指标时,用于考察产品稳定性。
(三)留样样品原则上,应当选取成品留样.考虑部分医疗器械产品成本、产量等因素,生产企业可结合留样目的、留样检查项目等因素,采取其他留样方式,如原材料留样、产品替代物留样等方式。
《医疗器械生产监督管理办法》新2022旧2017详细分析

强信息化建设,保证信息衔接。
省、自治区、直辖市药品监督管理部门负责本行政区域医疗器械生产监督管理信息化建设和管理工作,按照国家药品监督管理局的要求统筹推进医疗器械生产监督管理信息共享。
第五条食品药品监督管理部门依法及时公布医疗器械生产许可和备案相关信息。
申请人可以查询审批进度和审批结果;公众可以查阅审批结果。
第八条药品监督管理部门依法及时公开医疗器械生产许可、备案、监督检查、行政处罚等信息,方便公众查询,接受社会监督。
明确信息公开的范畴第二章生产许可与备案管理第二章生产许可与备案管理第七条从事医疗器械生产,应当具备以下条件:(一)有与生产的医疗器械相适应的生产场地、环境条件、生产设备以及专业技术人员;(二)有对生产的医疗器械进行质量检验的机构或者专职检验人员以及检验设备;(三)有保证医疗器械质量的管理制度;(四)有与生产的医疗器械相适应的售后服务能力;(五)符合产品研制、生产工艺文件规定的要求。
第九条从事医疗器械生产活动,应当具备下列条件:(一)有与生产的医疗器械相适应的生产场地、环境条件、生产设备以及专业技术人员;(二)有能对生产的医疗器械进行质量检验的机构或者专职检验人员以及检验设备;(三)有保证医疗器械质量的管理制度;(四)有与生产的医疗器械相适应的售后服务能力;(五)符合产品研制、生产工艺文件规定的要求。
第八条开办第二类、第三类医疗器械生产企业的,应当向所在地省、自治区、直辖市食品药品监督管理部门申请生产许可,并提交以下资料:(一)营业执照复印件;(二)申请企业持有的所生产医疗器械的注册证及产品技术要求复印件;(三)法定代表人、企业负责人身份证明复印件;(四)生产、质量和技术负责人的身份、学历、职称证明复印件;(五)生产管理、质量检验岗位从业人员学历、职称一览表;(六)生产场地的证明文件,有特殊生产环境要求的还应当提交设施、环境的证明文件复印件;(七)主要生产设备和检验设备目录;(八)质量手册和程序文件;(九)工艺流程图;(十)经办人授权证明;(十一)其他证明资料。
局组织专家组对广州医疗器械质量监督检验中心医疗器械检测
2
的外观
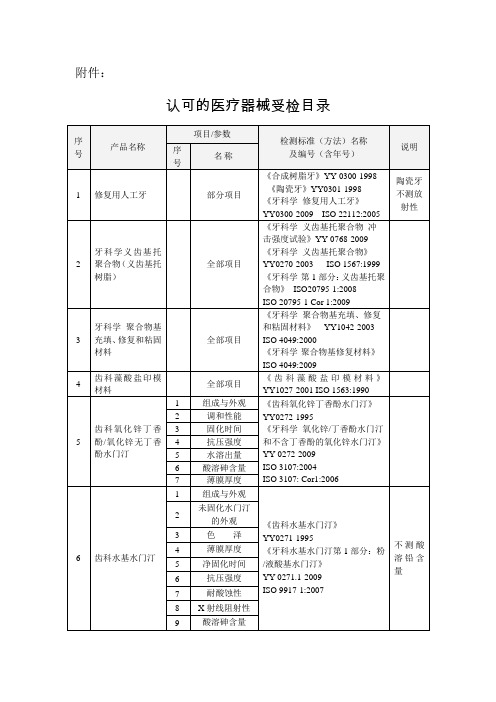
《齿科水基水门汀》
3 4 6 齿科水基水门汀 5
色泽 薄膜厚度 净固化时间
YY0271-1995 《牙科水基水门汀第 1 部分:粉 /液酸基水门汀》
不测酸 溶铅含 量
6
抗压强度 YY 0271.1-2009
7
耐酸蚀性 ISO 9917-1:2007
8 X 射线阻射性
9
酸溶砷含量
序
项目/参数
附件:
认可的医疗器械受检目录
序
项目/参数
号
产品名称
序
名称
号
检测标准(方法)名称 及编号(含年号)
说明
1 修复用人工牙
部分项目
《合成树脂牙》YY 0300-1998 《陶瓷牙》YY0301-1998
《牙科学 修复用人工牙》
YY0300-2009 ISO 22112:2005
陶瓷牙 不测放
射性
《牙科学 义齿基托聚合物 冲
含量
YZB/PULPD 006-2006
清除牙本质碎 《根管润滑剂》YZB/赣 001-2008 10 屑和玷污层 《次氯酸钠根管冲洗液》
11
密度
表面处理剂的 《一组分自酸蚀光固化粘接剂》
18
pH 值
YZB/JP 002-2010
19
溶出物
20
工作时间
21 吸水值和溶解值
22
强热残渣
23
屈折率
说明
序
项目/参数
号
产品名称
序
名称
号
检测标准(方法)名称 及编号(含年号)
说明
24
光固化性
含过氧化物牙科 33 材料
过氧化物含量 《牙齿漂白材料 过氧化物含量 的测定方法 的测定方法》YY/T 0632-2008
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
267.64 结余
13
86.99
一般公共预算财政拨款 6
267.64
14
政府性基金预算财政拨
款
7
15
总计
8 10196.46
总计
16 10196.46
注:本表反映部门本年度一般公共预算财政拨款和政府性基金预算财政拨款的总收 支和年末结转结余情况
五、一般公共预算财政拨款支出决算表
(二)部门决算单位构成 广东省医疗器械质量监督检验所
第二部分
2017 年度广东省医疗器械质量监督检验所 决算表
一、收入支出决算总表
部门:广东省医疗器械质量监督检验所
收入
支出
公开 01 表 单位:万元
项目
栏次 一、财政拨款收入
行 决算数 次
1
项目
行
次
栏次
1
9928.81 一、医疗卫生与计划生育支出 11
决算情况说明 第四部分 名词解释
第一部分
2017 年度广东省医疗器械质量监督检验所 部门决算基本情况说明
一、部门基本情况 (一)部门主要职责 根据《印发广东省医疗器械质量监督检验所主要职责内
设机构和人员编制规定的通知》(粤食药监人〔2014〕29 号) 设立广东省医疗器械质量监督检验所。主要职责包括:
2017 年度广东省医疗器械质量监督检验 所部门决算报告
目录
第一部分 2017 年广东省医疗器械质量监督检验所部门决 算基本情况说明
一、部门主要职责 二、部门决算单位构成 第二部分 2017 年度广东省医疗器械质量监督检验所部门
决算表 一、收入支出决算总表 二、收入决算表 三、支出决算表 四、财政拨款收入支出决算总表 五、一般公共预算财政拨款支出决算表 六、一般公共预算财政拨款基本支出决算表 七、一般公共预算财政“三公”经费支出决算表 八、政府性基金预算财政拨款收入支出决算表 第三部分 2017 年度广东省医疗器械质量监督检验所部门
其他食品和药品监督 管理事务支出
8740.48
注:本表反映部门本年度取得的各项收入情况
80.70 95.27
9652.85
7223.48
9652.85 1436.95 2149.52 6066.38
7223.48 4549.38
2674.10
32.57 32.57 32.57
三、支出决算总表
部门:广东省医疗器械质量监督检验所
二、事业收入 三、经营收入 四、其他收入
2
7223.48 二、科学技术支出
12
3
三、社会保障和就业支出
13
4
32.57 四、其他支出
14
ห้องสมุดไป่ตู้本年收入合计
7
17184.87
本年支出合计
15
用事业基金弥补收支差额 8
结余分配
16
年初结转和结余
9
1691.62 年末结转和结余
17
合计
10
18876.48
合计
18
1
栏次
2
一、一般公共预算财政拨款 1 9928.81 一、科学技术支出
9
143.48
二、政府性基金预算财政拨
2
款
3
二、社会保障和就业支
10
出
三、医疗卫生与计划生
育支出
11
197.92 9768.07
本年收入合计
4 9928.81
本年支出合计
12 10109.46
年初财政拨款结转和结余 5
年末财政拨款结转和
承担全国医用体外循环、齿科、消毒三大专业设备类医 疗器械产品及全省医疗器械、制药机械的质量监督检验;承 担有关医疗器械类新产品质量鉴定检验和质量技术监督部 门安排的有关专业检验方法的验证或鉴定以及质量仲裁检 验、委托检验;承担国家、省下达的产品注册证发放质量检 验;承担出入境检验检疫部门委托的医疗器械产品进出口的 检验;承担质检行政部门委托的医疗器械强制认证检测;承 担医疗器械国家标准、行业标准以及地方标准的制订、修订 和宣贯等,同时开展医疗器械行业相关科研工作。
20805
行政事业单位离退休
2080502 2080599
事业单位离退休 其他行政事业单位离 退休支出
210
医疗卫生与计划生育支出
21010
食品和药品监督管理事 务
2101001
行政运行
2101015
医疗器械事务
2101099
其他食品和药品监督 管理事务支出
注:本表反映部门本年度各项支出情况
1 12077.74
3 9049.55 146.86 133.31 129.93
3.39 4.20 4.20 9.35 9.35
8902.69 8902.69
2149.52 6753.17
四、财政拨款收入支出决算总表
部门:广东省医疗器械质量监督检验所
公开 04 表 单位:万元
收入
支出
项目
行 决算数
次
项目
行 决算数
次
栏次
事 业 收 入 其他收入
栏次
1
2
4
7
合计
206
科学技术支出
17184.87 100.00
9928.81 100.00
7223.48
32.57
20603
应用研究
100.00
100.00
2060302
社会公益研究
100.00
100.00
208
社会保障和就业支出
175.97
175.97
20805
行政事业单位离退休
公开 03 表 单位:万元
科目编码
科目名称
本年支出合计 基本支出 项目支出
类款项
栏次 合计
206
科学技术支出
20603 2060302
应用研究 社会公益研究
20060303
高技术研究
20604
技术研究与开发
2060403
产业技术研究与开发
20605
科技条件与服务
2060502
技术创新服务体系
208
社会保障和就业支出
注:本表反映部门本年度的总收支和年末结转结余情况
决算数 2
11732.96 146.86 197.92
12077.74 3608.09 3190.66
18876.48
二、收入决算总表
部门:广东省医疗器械质量监督检验所
功能分类 科目编码
项目 科目名称
本年收入合计
财政拨款收入
公开 02 表 单位:万元
175.97
175.97
2080502 2080599
事业单位离退休
其他行政事业单位离 退休支出
80.70 95.27
医疗卫生与计划生育
210
16908.90
支出
21010 2101001
食品和药品监督管理 事务
行政运行
16908.90 6018.90
2101015
医疗器械事务
2149.52
2101099
146.86 133.31 129.93
3.39 4.20 4.20 9.35 9.35 197.92 197.9 80.70 117.22
11732.96
11732.96 2830.27 2149.52 6753.17
2 3028.19
197.9 197.9 80.70 117.22 2830.27 2830.27 2830.27
