共振论
有机化学共振论全解

Endo-产物
Exo-产物
中间体与过渡态
动力学稳定与热力学稳定
(动力学稳定、热力学稳定)
Bu-t t-Bu Bu-t
Bu-t
(动力学稳定,热力学不稳定)
OH R OR'
(动力学不稳定,热力学稳定)
一个反应研究的故事
1.2共振论
1 、共振论(Resonance Structure):For each σ bonding pattern, there are often several ways in which and nonbonding electrons can be distributed. These different ways are called resonance structures. (不同的共振式像是字母,和在一起才是一个单词)
(3)不带电荷的的共振结构比具有分离电荷的共振结构稳定 。
(4)对于带有电荷的共振结构来说,负电荷处在电负性强的原子上,正电荷处在电负性弱 的原子上更稳定。
(以上规则的重要性依次降低)
请判断那个共振结构更稳定:
.. + M e OC H 3
+
M e OC H 2
(规则2 > 规则4)
+-
-+
M e 2 C O M e 2 C O M e 2 C O
(1)第一周期元素(B,C,N,O)的价电子数绝不可以超过8。
+
H 3 COH XH 3 COH
(2)所有原子都具有完整价电子层的共振结构比其中有原子具有不完整价电子层的共振结构稳定。如 果共振结构中具有缺电子原子,那这个缺电子原子应该是电正性原子(C,B), 而不应该是电 负性原子(N,O,卤素)。
共振论

C
C
C
4种共振杂化体,3种等价共振杂化体而稳定
共振论的应用
共振论可以解释: 分子或离子的稳定性大小 键长,偶极距 酸性,碱性 亲电或亲核反应位置 特别在杂环化学中威力巨大
共振论的不足ຫໍສະໝຸດ 和苯一样具有2个等价共振杂化体 但事实表明很不稳定
共振论意义
Pauling说:
共振论对共轭分子的计算一般 与实验相符,但比定量计算更重要 的是,应用简单的化学论证工作可 以预言可能性,除共振论外,还无 一个更简单的方法。
共振发生的必要条件:
(1)能量近似; (2)配对电子数相等; (3)构型相同
共振论要点:
1.当一个分子、离子或自由基按价键规 则写出一个以上 Lewis结构式时,则真实的 分子结构就是这些结构的共振杂化体,它不 同程度地表现出这些结构的所有性质,它们 的区别只是键或电子的分布不同,而原子排 列序不变。 2. 分子、离子或自由基之有共振者较之 没有共振的来的稳定。参加共振的结构数目 越多,则杂化体就越稳定,尤其是结构相同 的式子参加共振,得到的杂化体十分稳定。
共振论
Resonance Theory
共振论概念
1932年Pauling说:
对于许多分子能够指定单个的价键结构来 满意地说明该物质的性质。然而,对于另外 一些分子如O3却不是这样。已经发现,对于 这些分子可以用一个以上的价键结构来作出 满意地描述。这个观念在结构化学中叫共振 论。
1954年荣获诺贝尔奖
3.在各个共振结构中,能量最低而结构 相近的式子,越稳定,所占的几率最 多,对杂化体的贡献大。 4.真实分子本身的能量一定比任何一个 共振结构的能量低,这个能量差叫 共振能。
写共振式时应遵循以下原则:
1. 符合价键结构要求 CH2
共振论

共振论内容补充共振论最早由美国科学家Linus Pauling (1954年Nobel 化学奖得主)提出,他在1931-1933年间发表了与之相关的7篇研究论文。
针对经典价键理论,共价键都是电子定域在两个成键原子之间的,这种键称为定域键。
若电子可流动,经典价键结构就难以正确表示它的结构状况。
电子可流动的键称为离域键,如苯。
共振论就是设法用多个价键结构来表示有离域键的分子的结构。
共振概念当一个分子、离子或游离基按价键结构规则可以写出一个以上的Lewis 结构式时,真正的结构用一个Lewis 结构表示不确切妥当,要用几个Lewis 结构表示,这些Lewis 结构称为共振结构(常常称为极限结构或参与结构)。
真正的结构是这些共振结构的共振杂化体(hybrid ),如CO 32-可写出3个结构。
O OO O OO O OO I II III共振符号真实的CO 32-结构既不是一会I ,一会II ,一会III ,也不是1/3 I ,1/3 II ,1/3 III 。
真实的CO 32-结构只有一个,用三个Lewis 结构式从三个侧面表示真正的CO 32-结构。
共振结构如何写1.必须符合Lewis结构(8电子)H C OHH H H COHHH C外层10电子2.原子位置不变(只是电子移动)H2C CCH2HCH2CH2CHH2C CH2HC正确键角扭小3.相同电子对数正确CH2CH CH2H2C CH CH2CH2CH CH2能量太高共振使分子稳定1.真正分子的能量低于各个个别共振结构。
2.共振结构对共振杂化体(真正分子)的稳定性有贡献,相同共振结构贡献一样。
3.较稳定共振结构对共振杂化体贡献大。
也就是真正结构更像较稳定结构。
各共振结构贡献的大小1.共价键数多的共振结构贡献大(稳定)CH2CH CH CH2CH2CH CH CH2大2.较稳定的价电子结构(完整八隅体)贡献大CH2O CH3CH2O CH3大3.电荷分离不稳定,电荷不分离稳定CH2CH Cl CH2CH Cl大4.负电荷在电负性大的原子上稳定CH2CH OCH2CH O大共振论在解释有离域键存在的有机反应时是很有用的。
[分享]共振论
![[分享]共振论](https://img.taocdn.com/s3/m/b469be187dd184254b35eefdc8d376eeaeaa17c4.png)
共振论存在着电子离域的体系包括分子、离子、自由基,用经典的路易斯结构式不能完全、准确地表示出这个体系的真实结构和性质。
例如,1,3-丁二烯用CH2=CH-CH=CH2不能描述出其体系内电子云平均化,C-C有部分双键的性质,C=C比正常C=C键长等。
为了解决用经典的路易斯结构式表达复杂的电子离域体系的矛盾,鲍林在1931-1933年间提出了“共振论”。
共振论是用经典的结构式表达电子离域体系,是价键理论的延伸。
在有机化学中经常被使用,比较方便地解决了电子离域体系的表示,但有它的局限性。
一、共振论的基本概念对于电子离域体系的化学物种,不能用一个经典结构式表示清楚其结构,可用几个可能的经典结构式表示,真实物种是这几个可能的经典结构的叠加——共振杂化体。
表示离域体系的可能的经典结构称做极限结构或共振结构,共振结构的叠加得到共振杂化体,共振杂化体才能较确切地代表真实物种的结构。
1,3-丁二烯可用一系列共振结构表示:每个式子叫共振结构式或共振极限结构式,“<—>”双箭头符号表示共振结构之间的叠加或共振;合起来表示真实的1,3-丁二烯。
表示共振结构的叠加关系,不同于互变异构体间表示互变关系。
共振杂化体是一单一物种,只有一个结构。
极限结构式表示电子离域的极限度。
一个物种的极限结构式越多,电子离域的范围越大,体系能量越低,物种越稳定。
任何一个极限结构的能量都高于共振杂化体的能量,真实物种与最低能量的极限结构(最稳定的极限结构)的能量差称为共振能。
它是由电子离域而获得的稳定化能,与共轭能是一致的。
每个极限结构对其共振杂体的贡献是不相等的。
极限结构越稳定,对共振杂化体的贡献越大。
相同的极限结构贡献相等。
例如,1,3-丁二烯的共轭能为14kJ·mol-1,可用下列极限结构表示:CH2=CH-CH=CH2是最稳定的极限结构,对杂化体贡献最大,它与真实分子的能量差为共振能;后面几个极限结构是不稳定的,能量较高,对共振杂化体的贡献小,有时可以不考虑;和相同,对共振杂化体的贡献相等。
《芳香烃》苯环的共振论

《芳香烃》苯环的共振论在有机化学的广袤领域中,芳香烃是一类极其重要的化合物,而苯环更是其中的核心结构。
要深入理解苯环的性质和反应,共振论是一个非常关键的概念。
首先,咱们来聊聊什么是共振论。
简单来说,共振论是一种用来描述分子结构和性质的理论工具。
它认为某些分子或离子的真实结构不能用单一的价键结构来准确表示,而是多个价键结构之间的共振杂化体。
苯环就是一个典型的例子。
如果按照传统的价键理论,苯环应该是由交替的单双键组成。
但实验事实却表明,苯环中的所有碳碳键长度完全相等,介于单键和双键之间。
这可就奇怪了,怎么解释呢?这时候共振论就派上用场了。
根据共振论,苯环可以用两种等价的凯库勒式来表示,也就是我们常见的单双键交替的结构。
但要注意,这并不是说苯环在这两种结构之间来回切换,而是说苯环的真实结构是这两种结构的共振杂化体。
那共振杂化体到底是个啥呢?想象一下,苯环的真实结构就像是这两种凯库勒式的“平均态”。
它既不是单纯的这种结构,也不是单纯的那种结构,而是融合了两者的特点,形成了一种独特的、稳定的结构。
这种共振结构使得苯环具有了一些特殊的性质。
比如说,苯环的稳定性就比一般的不饱和烃要高得多。
这是因为共振能的存在,共振能就像是给苯环加了一层“保护罩”,让它不容易发生加成反应,而更倾向于发生取代反应。
再来说说共振论在解释苯环的化学反应中的作用。
当苯环发生取代反应时,共振论可以帮助我们预测反应的位点和产物的分布。
因为不同的共振结构中,各个碳原子上的电子云密度是有所不同的,电子云密度高的地方就更容易发生亲电取代反应。
举个例子,当苯环与溴发生亲电取代反应时,溴正离子会进攻苯环上电子云密度较高的位置。
通过分析苯环的共振结构,我们可以发现,苯环上的邻位和对位的电子云密度相对较高,所以溴更容易取代这些位置上的氢原子,生成邻溴苯和对溴苯。
但是,共振论也不是完美无缺的。
它只是一种理论模型,有一定的局限性。
比如,共振论并不能给出分子结构的精确描述,只是一种近似的表示方法。
共振论的基本概念

共振论的基本概念★★某些分子、离子或自由基不能用某个单一的结构来解释其某种性质(能量值、键长、化学性能)时,我们就用两个或两个以上的结构式来代替通常的单一结构式,这个过程叫共振。
用共振符号双向箭头表示。
例如:甲酸根离子HCOO就不能用单一的结构式来表示。
因为在上式中有C =O双键和C-O单键两种键,那么C-O单键键长应为143pm,C=O双键键长应为120pm,而实际测得甲酸根离子中的两个碳氧键键长都是126pm,即表明甲酸根离子中没有真正的C -O和C=O。
所以只能用下面两个共振式来表示。
其意义是C-O键介于双键和单键之间的中间状态,负电荷被两个氧承担。
这些组合结构叫共振杂化体(resonance hybrid)或简称杂化体,也就是说Ⅰ和Ⅱ综合称共振杂化体,每个参与杂化的结构叫共振结构式(resonance structures)或极限结构式,也就是说Ⅰ和Ⅱ互称共振结构式。
但并不是说,甲酸根离子一会是极限结构式Ⅰ,一会是极限结构式Ⅱ,也不是说一半是Ⅰ,一半是Ⅱ,而是介于Ⅰ和Ⅱ之间,Ⅰ和Ⅱ都不能表示其真实结构,不能单独存在、独立表示,只能参与共振杂化体。
L.Pauling的学生芝加哥大学的G.W.Wheland教授所作的生物杂化体的比喻是有启发性的。
如把骡子看作是马和驴杂交后生下的动物,是生物杂化体。
这并不是说骡子是几分之几的马和几分之几的驴,也不能说骡子有时候是马,有时候是驴,只能说骡子是与马和驴都有关系的动物。
因而可用两种熟知的动物马和驴来很好地说明骡子。
加利福尼亚工艺学院的J.D.Roberts教授的比喻就更恰当了,在中世纪,欧洲有一个旅行者从印度回来,他把犀牛描绘成龙和独角兽的生物杂化体,用两种熟知的、但完全是想像中的动物来很好地描绘一种真实的动物。
再如:1,3-丁二烯CH=CH—CH=CH,分子中C=C双键的键长不是134pm,而是137pm,C-C单键的键长不是154pm,而是148pm,说明分子中不存在纯粹的单双键,所以不能用一个结构式表示,而应该用共振杂化体表示。
共振论的基本概念

共振论的基本概念
哎呀,这“共振论”可真是个让人头疼的家伙呢!我一个小学生(初中生)来给您讲讲啥是共振论,您可得认真听呀!
您想想看,我们在学校里学的那些知识,是不是有时候就像一个个小拼图?而共振论呢,就像是一块特别复杂、特别神秘的拼图。
咱先来说说啥是共振。
就好像在一个大操场上,好多同学一起跳绳。
一个同学跳得快,一个同学跳得慢,但是他们的节奏有时候会碰到一块儿,产生一种很特别的“合力”,这就是共振啦!那共振论又是啥呢?
比如说,有一种化学分子,它的结构不是那么简单能说清楚的。
就像是一个人,有时候很温柔,有时候又很调皮,你不能简单地说他就是温柔或者调皮,他是两种样子都有。
化学分子也这样!它可能有好几种看起来都有点对的结构,就像一个人有好多面的性格。
我们不能只说这个分子就是这一种结构,也不能只说就是那一种结构。
这时候,共振论就来帮忙啦!它告诉我们,这个分子的真实结构呀,其实是这几种可能的结构一起“共振”出来的。
举个例子吧,苯分子。
要是按照平常的想法,它的结构好像有点怪。
但是用共振论来看,它就像是几个不同的“姿势”同时存在,然后一起构成了苯分子真正的样子。
这难道不神奇吗?就好像变魔术一样!
您再想想,如果没有共振论,我们得多迷糊呀!化学世界不就变得乱糟糟,没法理解啦?
所以说呀,共振论虽然有点难理解,但它真的是化学世界里的一个神奇宝贝,能帮我们看清那些复杂分子的真面目!
我的观点就是:共振论虽然复杂,但它真的超级重要,是我们探索化学奥秘的好帮手!。
共振论的解释

共振论的解释
共振论是一种科学理论,用于解释物体或系统在特定条件下发生共振现象的原理和机制。
共振是指当一个物体或系统受到外界激励时,其振动频率与外界激励频率相匹配,从而引发物体或系统的强烈振动现象。
共振论的基本概念和原理可以应用于各个领域,如力学、电磁学、声学、光学等。
在物理学中,共振论解释了许多自然现象,例如音乐乐器的共鸣、桥梁的摇摆、地震波的传播等。
共振现象的发生需要满足两个条件:一是外界激励具有特定的频率,与物体或系统的固有频率相匹配;二是物体或系统具有一定的阻尼,使其能够吸收和释放能量。
当这两个条件同时满足时,共振现象就会发生。
共振论的核心原理是能量的传递和积累。
当外界激励频率与物体或系统的固有频率相匹配时,能量会以最高效率地从外界传递到物体或系统内部。
对于机械振动而言,共振会导致振幅的增大,甚至引发破坏性振动。
对于电磁振动而言,共振会导致电流或电压的增强,产生共振峰。
共振论还涉及共振频率、共振宽度和共振峰等概念。
共振频率是指物体或系统的固有频率,共振宽度是指共振现象发生的频率范围,共振峰则是共振现象在频谱上对应的高峰。
共振论的应用广泛。
在工程领域,共振论被用于设计和优化结构,以避免共振引起的破坏性振动。
在音乐领域,共振论解释了乐器的共鸣现象,为制造乐器提供了理论依据。
在电子学中,共振论用于设计滤波器和放大器等电路。
此外,共振论还在生物学、化学等领域有重要应用,例如核磁共振技术在医学诊断中的应用。
共振论是一种重要的科学理论,通过解释共振现象的原理和机制,为我们理解和应用自然界中的许多现象提供了有力的工具。
共振论的解释

共振论的解释共振论是一种理论模型,它涉及了物理学、化学、生物学、社会学等多个领域,用于解释同类事物之间的互动和相互作用。
它最早由美国物理学家爱德华·罗特提出,后来又被运用到社会科学领域。
那么,什么是共振论呢?一、共振论的基本概念共振论认为,当同一系统内的两个或多个要素超过一定比例并且与彼此相遇时,这些要素会相互作用并彼此影响。
这种互动是非线性的,这意味着它不是简单的加法或减法。
相反,它是一种能够引发整体系统变化的现象。
二、共振论的应用共振论的应用广泛,涵盖了物理学、化学、生物学、心理学、社会学等多个领域。
在物理学中,共振现象是研究声波、电磁波、机械振动等的重要方法。
例如,有时候我们站在桥上,能够感受到桥上的震动,这就是由车辆震动引起的桥梁共振。
在生物学中,共振现象在身体和大脑中都有应用。
例如,一些研究表明,脑电波会共振而不是通过单独神经元之间的化学信号传递。
此外,许多人相信,瑜伽、冥想、音乐等练习能够帮助人们从生理、心理和情绪层面上实现共振。
在社会学中,共振现象在团队协作、家庭关系和政治运动等方面也有应用。
例如,团队成员之间的工作效率可能会因为共享目标而加强,而一个政治运动的成功也可能是由于数以万计的人共同点燃了变革的火焰。
三、共振论的意义共振论的意义在于它让我们更加深入地理解宇宙和我们自身的真正本质。
无论我们是在研究生物、心理、社会学还是物理学,都需要考虑到它。
共振论也为我们提供了解决问题的工具。
例如,在组织或公司中,了解共振的原理有助于我们更好地协调和管理不同的个体,实现更好的团队效能。
综上所述,共振论是一种重要的理论模型,它具有广泛的应用范围并对我们了解世界和解决问题具有重大意义。
第二章 共振论

萘 3.683β
3
联苯 4.383β
4
蒽 5.316β
4
菲 5.444β
5
共振论简介
2.等价的共振式对杂化体的贡献是相等的 。由等价共振式所组成的体系具有巨大的稳定 性。
共振论简介
3.较稳定的结构式对杂化体的贡献较大。
稳定
稳定 不稳定 不稳定 不稳定
共振论简介
4.共价键数目越多的共振式越稳定。
价键理论 有单双键之分,键长不 同,应为不规则形状。
实验结果 正六角无单双键之分, 键长完全一致。
1.54 A 1.34 A
1.39 A 1.39 A
共振论简介
理论:邻二取代产物应该有两个
Br
Br
Br
Br
实际:邻二取代产物只有一个
Br Br
共振论简介
理论 含有三个双键,应该稳定性比较差;
△H = 3×119.3= 357.9 kJ/mol 实际
共振论简介
4. 芳环上亲电取代反应的定位
取代反应是一个竞争过程,可以从中间体稳定 性判断反应的方向。
对于第一类定位基,邻对位取代的中间体共振 结构多,稳定性高,邻对位产物占优。
共振论简介
例1 苯酚进行亲电取代
OH E
OH
E H
邻、对位取代中间体 极限式更多,稳定性好。
OH
E H
OH
E H
OH
E H
CH2 OH 6e CH2 CH=CH CH2 10个
CH2 CH=O
CH2=CH O
CH2 CH CH=CH2
CH2 CH=CH CH2
共振论还认为:
由等价共振式构成的体系,稳定性高 稳定的共振式越多,其共振杂化体越稳定
共振论

+ –
–
⑥CH2–CH=CH–CH2
+
–
+
共振论的2个概念: 共振论的2个概念: 极限式——能够用经典价键结构写出来的构造式 极限式 能够用经典价键结构写出来的构造式 共振杂化体——真实物质的结构式,由各种极限式 真实物质的结构式, 共振杂化体 真实物质的结构式 共振杂化而成。 的共振杂化而成。
真实的结构与极限 式之间是什么关系? 式之间是什么关系?
G
+ CH2
-
G为吸电子基团,不稳 为吸电子基团, 为吸电子基团 G为给电子基团,不稳 为给电子基团, 为给电子基团
H
G
CH2 .. O
. C H2 .
G为吸电子基团,稳定 为吸电子基团, 为吸电子基团
H
共轭效应无 论对于C+还 论对于 共轭 p-π共轭 是C-, 都是稳 定因素
H
+
CH
C
H
H H
H C
?
共轭体系极限式的书写 原则,以丁二烯为例: 原则,以丁二烯为例:
CH2—CH—CH—CH2
( (1)各原子位置不变; 2)自由单电子数不能变; )各原子位置不变; )自由单电子数不能变; (3)离域的电子可任意组合。 )离域的电子可任意组合。 – + · · 2 ①CH2=CH–CH=CH2 ②CH2=CH–CH–CH CH2=C=CH–CH3 + – – + ③CH2=CH–CH–CH2 ④CH2–CH–CH=CH2 ⑤CH2–CH–CH=CH2 ⑦CH2–CH=CH–CH2 真实的丁二烯是这7种 真实的丁二烯是这 种 极限式的共振杂化体 极限式的共振杂化体
ΦA
成键轨道 Ψ1= c1ΦA + c2ΦB
共振论简介
在室温时,环己烷的椅式构象可通过C-C键的转动(而不经 过碳碳键的断裂),由一种椅式构象变为另一种椅式构象,在 互相转变中,原来的a键变成了e键,而原来的e键变成了a键。
⑶.在所有极限式中,未共用电子数必须相等
目前,国内外对共振论的看法不一致。
第五章
脂 环 烃 (Alicyclic hydrocarbons)
教学目的和要求
加 油
1.掌握脂环烃的命名、化学性质、顺反异构现象。 2.了解环的大小与化学性质之间的关系。 3.掌握环己烷及衍生物的构象。
!
第一节 脂环烃的分类命名和异构现象
H2 Ni 80℃ CH3CH2CH3
H2 Ni CH3CH2CH2CH3 200℃
在Ni催化剂作用下进行催化加氢,乙烯在40℃发生 反应;环丙烷在80℃时发生反应,产生丙烷;环丁烷在 200℃时发生反应,产生正丁烷;环己烷和环庚烷300℃ 时不发生反应。
(2) 与卤素反应
(3) 与卤化氢反应
环丙烷的烷基衍生物与HX加成时, 符合马氏规则,氢原子加在含氢较多的 碳原子上,X 负离子加在含氢较少的碳 原子上。
稳定性: 反 式 顺 式
小结:
1.环己烷有两种极限构象(椅式和船式),椅式为
优势构象。
2.一元取代基主要以e键和环相连。 3.多元取代环己烷最稳定的构象是e键上取代基最
多的构象。
4.环上有不同取代基时,大的取代基在e键上构象
最稳定。
【理论化学机理】共振论的基本原理及其在有机化学中的应用
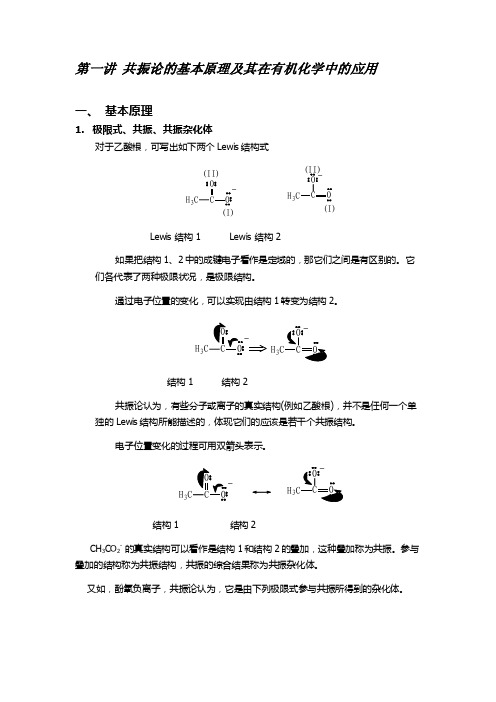
第一讲 共振论的基本原理及其在有机化学中的应用一、 基本原理1. 极限式、共振、共振杂化体对于乙酸根,可写出如下两个Lewis 结构式H 3(I)(II)H 3O (I)(II)Lewis 结构1 Lewis 结构2如果把结构1、2中的成键电子看作是定域的,那它们之间是有区别的。
它们各代表了两种极限状况,是极限结构。
通过电子位置的变化,可以实现由结构1转变为结构2。
H 3结构1 结构2共振论认为,有些分子或离子的真实结构(例如乙酸根),并不是任何一个单独的Lewis 结构所能描述的,体现它们的应该是若干个共振结构。
电子位置变化的过程可用双箭头表示。
H 3H 3结构1 结构2CH 3CO 2- 的真实结构可以看作是结构1和结构2的叠加,这种叠加称为共振。
参与叠加的结构称为共振结构,共振的综合结果称为共振杂化体。
又如,酚氧负离子,共振论认为,它是由下列极限式参与共振所得到的杂化体。
2. 共振结构式的书写规则(1) 只允许合理的Lewis 结构。
(2) 电子位置变,原子的位置不变。
离域所涉及到的电子一般为π电子,或为非键电子对以及容易离域到P 轨道上的电子。
(3) 要求有关的原子必须共平面。
亦即,有关原子为SP 2或SP 杂化(有关原子指的是电子位置变化所涉及到的原子)。
(4) 从一个共振结构变化到另一个共振结构,不配对的电子数保持不变。
例如,重氮甲烷CH 2N 2CHH -C H NN两个极限式的不配对的电子数为0,是允许的。
H-第一个极限式的不配对电子数为0,第二个极限式的不配对电子数为2,是不允许的。
3. 极限式对共振杂化体的贡献共振是稳定因素。
共振杂化体的能量低于任一参与共振的极限式。
但并不是所有的共振结构对描述共振杂化体的贡献是等同的。
(1) 含完整八隅体的结构比在价电子层上少于8个电子的结构更稳定,贡献更大。
(2) 共价键的数目愈多,该共振结构愈稳定。
(3) 结构中电荷分离数目愈大,愈不稳定。
第三课时 路易斯结构式、共振论、等电子体、分子间作用力和氢键

所以,稳定性Ⅰ>Ⅱ>Ⅲ
竞赛真题演练
(中国化学会第21届全国高中学生化学竞赛(省级赛区)试题)
羟胺和用同位素标记氮原子(N﹡)的亚 硝酸在不同介质中发生反应,方程式如下: NH2OH+HN﹡O2→ A+H2O NH2OH+HN﹡O2→ B+H2O A、B脱水都能形成N2O,由A得到N﹡NO 和NN﹡O,而由B只得到NN﹡O。 请分别写出A和B的路易斯结构式。
CH3 CH3
C
-
È ¨ O Î ¶À
+
练习:说明各共振式在下列共振杂化体结构中的贡献。
H3C
C A
N
H3C
C B
+ N
H3C
+ C C
N
-
贡献: A>B>C
讨论:A共价键数目多,没有电荷分离;B违反电负性
规则 ;C不符合八隅体规则
2.6
等电子体
等电子体原理:具有相同的通式——AXm,
价电子总数相等的分子或离子具有相同的结构特征。
O
-
O C O-
or
O
C
O
-
or
O
O-
C
OO
而共振论将CO32-的真实结构表示为:
OO C O
-
O
C i (i )
OO
-
O-
C
OO
(i)
(ii) i
上式的意思是:CO32-的真实结构是上述三个共 振结构式(基本式、极限式、参与结构式等)的共振杂 化体。
必须十分明确地指出:真正的杂化体或中介体 是一个单一的物质,决不是几个极限式的混合 物。共振论一再强调在任何时候,共振杂化体 都是一个单独的物质,只能有一个结构。 根据共振论,烯丙基,成键数 - 孤电子对数法书写路易斯结构 简单明了 ,但对于复杂分子 ,应用此法往往无从下手 ,且易出 错。这时分步法显示出更大的优越性。下面以氯酸根离子为例 详细介绍此方法。
有机化学机理理论

第一讲 共振论的基本原理及其在有机化学中的应用一、 基本原理1. 极限式、共振、共振杂化体对于乙酸根,可写出如下两个Lewis 结构式CO OH 3C -(I )(I I )C O H 3C O -(I )(I I )Lewis 结构1 Lewis 结构2如果把结构1、2中的成键电子看作是定域的,那它们之间是有区别的。
它们各代表了两种极限状况,是极限结构。
通过电子位置的变化,可以实现由结构1转变为结构2。
-C O H 3C O COH 3结构1 结构2共振论认为,有些分子或离子的真实结构(例如乙酸根),并不是任何一个单独的Lewis 结构所能描述的,体现它们的应该是若干个共振结构。
电子位置变化的过程可用双箭头表示。
COH 3C O H 3CO-结构1结构2CH 3CO 2- 的真实结构可以看作是结构1和结构2的叠加,这种叠加称为共振。
参与叠加的结构称为共振结构,共振的综合结果称为共振杂化体。
又如,酚氧负离子,共振论认为,它是由下列极限式参与共振所得到的杂化体。
2. 共振结构式的书写规则(1) 只允许合理的Lewis 结构。
(2) 电子位置变,原子的位置不变。
离域所涉及到的电子一般为π电子,或为非 键电子对以及容易离域到P 轨道上的电子。
(3) 要求有关的原子必须共平面。
亦即,有关原子为SP 2或SP 杂化(有关原子指的 是电子位置变化所涉及到的原子)。
(4) 从一个共振结构变化到另一个共振结构,不配对的电子数保持不变。
例如,重氮甲烷CH 2N 2C HH-C HN N两个极限式的不配对的电子数为0,是允许的。
+C HHN N -第一个极限式的不配对电子数为0,第二个极限式的不配对电子数为2,是不允许的。
3. 极限式对共振杂化体的贡献共振是稳定因素。
共振杂化体的能量低于任一参与共振的极限式。
但并不是所有的共振结构对描述共振杂化体的贡献是等同的。
(1) 含完整八隅体的结构比在价电子层上少于8个电子的结构更稳定,贡献更大。
共振论

第一章基础知识补充1.1 共振论一.定义:共振论是一种用经典结构式来描述具有离域大π键分子结构的理论。
二.背景:化学键包括离子键、金属键和共价键三大类,其中离子建和金属键的作用力本质很清楚是静电作用,但共价键的本质则比较复杂。
现代化学中描述共价键的理论主要有价键理论和分子轨道理论,其中价键理论是先发展和建立的理论,而分子轨道理论是1932年美国化学家马里肯(Mulliken)提出和建立的。
有机化学这个概念是瑞典著名化学家贝采利乌斯于1806年提出的,早期的化学家认为有机物只能存在于有生命的生物体内,在实验室内不能合成有机物,这就是早期的“生命力学说”。
按照生命力学说观点,由于生命现象的复杂性,有机物的结构几乎是不可知的。
1928年,贝采利乌斯的学生,德国化学家维勒加热无机物氰酸铵得到了有机物尿素,从而打破了生命力学说,人们终于认识到有机化学和无机化学没有严格的界限,那有机物的结构就和无机物的结构一样是可以了解的。
早期的有机化学当然是从属于无机化学的,所以化学家对有机物结构的认识也必然深深地打上无机化学的烙印。
化学家先用二元论解释有机物的结构,即有机物也像无机物一样靠带正负电荷的两部分互相结合在一起,在反应中起反应的基团和未反应的基团带不同的电荷。
但是像Cl原子取代H 这样的反应用二元论不好解释。
1852年,法国的化学家日拉尔提出了类型学说,认为有机物的结构可以看作是无机物水、氢、氯化氢和氨这四种母体的衍生物,例如乙醇就是水型的,可以看作水的H原子被乙基取代的产物;丙酮则被看成氢型的,即H原子分别被甲基和乙酰基取代。
这种学说今天看来当然很幼稚,不过在当时那种朦胧的世界里能有这种认识也算是一种进步。
后来凯库勒发现C是4价的,很多有机物不属于这4种类型,就建议增加了CH4型母体,丰富了类型学说。
1858年,凯库勒指出碳是4价的,碳原子之间可以互相成键,还能成环;1861年,俄国的化学家布特列洛夫指出有机物存在着骨架异构和位置异构;1865年,凯库勒提出了苯环的结构;1874年,凯库勒的学生荷兰人范特霍夫指出C的4价不是平面型,而是伸向四面体的4个顶点,从此建立了立体化学概念。
共振论(精)

2’
有二个等价的 较稳定的共振 式(更稳定)
关于共振式数目与结构的稳定性 共振论认为:稳定的共振式数目越多,其杂化体越稳定
例:用共振论解释羧基的羰基氧的碱性比羟基氧强
OH R C OH O R C OH O H or R C OH OH
稳定 有两个完全等价的共振式
比较相应共轭 碱的稳定性化合物2的a氢酸性比1强,试用共振论方法解释。
H 2C CH CH2 H2C CH CH2 H2 C CH CH2
烯丙基自由基
未成对电子数不相等 未成对电子数不相等
H2 C
CH
CH2CH3
H2 C
CH CH2CH3
H2 C
CH
CH2CH3
1-丁烯
H2 C CH CH2CH3 H2C CH2 CHCH3
未成对电子数不相等
原子排列不同
关于共振式和对杂化体的贡献
共振论认为: 共振式越稳定 对共振杂化体 的贡献越大
例 1:1-丁烯的共振式
H2C CH CH2CH3 H2C CH CH2CH3 H2C CH CH2CH3
共振论对共振式稳定性的一些规定
a. 共价键数目最多的共振式最稳定 b. 共振式的正负电荷越分散越稳定 c. 具有完整的价电子层的共振式较稳定 d. 负电荷在电负性大的原子上的共振式较稳定
提示: 共振式之间只是电 子排列不同 共振杂化体不是共 振式混合物
H2C CH
14
CH2
H2C
CH
14
CH2
共振杂化体也不是 互变平衡体系
共振论对共振式的画法的一些规定
参与共振的原子应有p轨道(共轭体系) 所有共振式的原子排列相同 所有共振式均符合Lewis结构式 所有共振式具有相等的未成对电子数
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
而共振论将CO32-的真实结构表示为:
上式的意思是:CO32-的真实结构是上述三个 共振结构式(经典结构式)的共振杂化体 共振论认为:不能用经典结构式圆满表示的分子,其真实 结构是由多种可能的经典极限式叠加(共振杂化)而成的。
共振论的基本思想
当一个分子、离子或自由基的结构可用一个以上不同电子排
CH2
CH2
CH CH (3)
CH2
③ 相邻原子带相同电荷的共振极限结构式不稳定。
O N
+ +
OE H
+ OO N E + H
正电荷相邻, 特别不稳定
共振杂化体能量高,不稳定,不易生成!
④ 负电荷在电负性较大的原子上的结构较稳定。
ÀÀ CH3 CH3 CH3 CH3
C
+
O
-
± È
C
-
È ¨ ¶À O Î
+
⑤ 满足八隅体电子构型的要求者,能量低, 稳定。反之则能量高,不稳定。
ÀÀ CH2=CH ± È CH2-CH
+
CH=CH2
CH-CH2
-
È ¨ Î ¶ À
CH2-CH
+
+ CH-CH2 中C 外层电子只有6个。
总之:
共振式之间,共价键多的结构是稳定
的; 共振结构式越多,其中结构稳定的越 多,其真实分子(共振杂化体)越稳定。
---使原子核的相对位置和电子对的数目保持不 变而改变电子对(一般指P电子)的排列,就能 写出不同的价键结构共振式:
CH2-CH=CH2
+
CH2=CH-CH2
+
2 书写共振式遵循的基本规则
①必须符合经典结构式的书写规则,符合价 键理论和Lewis结构理论。
H H C O H H H H
H C O H
共 振 论
-------即离域体系可以用几个经典结构的叠加来描述 1 共振论的基本概念 2 书写极限结构式遵循的基本原则 3 共振极限结构式能量标准 4 共振论的应用
1 共振论的基本概念
共振论是鲍林于20世纪30年代提出的。用以弥补经 典价键理论一个价键结构式对应一个分子结构的不足。
例如:CO32-中的三个碳氧键是等同的,键长 均为0.128nm。 但是价键式却只能表示为:
4 共振论的应用
比如:解释结构与性质间的关系
例1:1,3-丁二烯分子中的键长平均化的趋势是由于存在下列共振:
CH2=CH-CH=CH 2
+Leabharlann CH2-CH=CH-CH 2
-
-
CH2-CH=CH-CH 2
+
例2: 1,3-丁二烯既可以进行1,2-加成,又可以进行1,4-加成,是由 于反应的活性中间体存在下列共振:
-
碳原子成了5价!
②各共振极限结构式中所有共振式的原子排列相同。
CH3 CH O
CH2 CH O H
同一化合物的不同共振结构只是电子排布的 变化,原子核位置不变。
③ 同一化合物的所有的极限结构式中,配对的或 不配对的电子数目应保持一致。
④ 参与共振的原子应有p轨道。
3 极限结构的稳定性的判断
------共振极限结构式能量标准
CH 3CH-CH=CH 2
1 2 3 4
+
CH 3CH=CH-CH 2
1 2 3 4
+
共振论小结
共振式的写法,共振式的稳定性比较,共振式对杂化体的贡 献。 共振论是一种理论,共振式是理论上存在的,无法测得。 共振论引入了一些人为规定,对某些化学现象尚不能给出满 意的解释。
共振、共轭与离域的涵义是相同的! 它们是对一个问 题的不同表述方法,在有机化学中它们都很重要。
列的经典结构式(共振式)表达时,就存在着共振。
这些共振式均不是这一分子、离子或自由基的真实结构,其 真实结构为所有共振式的杂化体。
提示:
H2C CH CH2 H2C CH CH2
14
14
共振式之间只是电 子排列不同 共振杂化体不是共 振式混合物 共振杂化体也不是 互变平衡体系
共振式的写法
① 参加共振的经典结构式越多,分子越稳定; 共价键的数目越多,能量越低。
ÀÀ CH2=CH
CH=CH2
± È
CH2-CH
+
CH-CH2
-
Î È ¶ ¨À
②正负电荷没有分离的比分离的共振结构式稳定, 正负电荷分离越远越不稳定,因为分离电荷需能量。
CH2
CH CH (1)
CH2
CH2
CH CH (2)
