有机化学-共振论PPT课件
合集下载
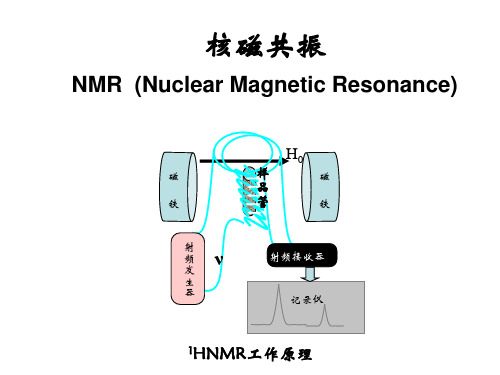
有机化学教学课件:核磁共振
1)峰的化学位移值(δ值)--各类型H所处的化学环 境; 2) 峰的裂分数目或偶合常数--相邻H核的数目; 3)峰的面积--H的相对数目。
例1.分子式为C3H6O的某化合物的核磁共振谱如下,试确定其结构。
O CH3CCH3
计算 不饱和度;谱图上只有一个单峰,说明分子中所有氢核 的化学环境完全相同。结合分子式可断定该化合物
等位氢种类
1
2
CH3CH2OH
3
CH3
H
CC
Cl
H
3
有几组峰,则表示样品中有几种不同类型的质子。 每一组峰的强度(面积),与质子的数目成正比。 各个阶梯的(积分)高度比表示不同化学位移的质子数之比。
一个化合物究竟有几组吸收峰,取决于分 子中H核的类型,有几种不同类型的H核,就有 几组吸收峰。
CH3 CH2 O H ab c
1)峰的裂分数目符合n+1规律 2)各峰强度比符合二项式(a+b)n展开系 数之比
➢偶合常数 J
自旋-自旋偶合裂分后,两峰之间的距离,即两峰的
频率差:
2.偶V的合a-强常V弱数b (。。J)单位:HZ 。J的大小反映核自旋相互干扰
Jab
Jab
偶合常数与化学键性质有关,与外加磁场强度、使用仪器 的频率无关。数值依 赖于偶合氢原子的结构关系。
注 意:
❖ 非邻位碳上的氢,不发生自旋裂分,J值趋于零。
O
CH3CH2CCH3 ab c
Ha与Hc, Hb与Hc 均不发生偶合
❖ 等位H核之间不发生自旋裂分。如CH3CH3; BrCH2CH2Br只有一个单峰。
四. 1H-NMR 的谱图解析
参数:
化学位移 裂分数目或偶合常数 峰的积分面积/高度
例1.分子式为C3H6O的某化合物的核磁共振谱如下,试确定其结构。
O CH3CCH3
计算 不饱和度;谱图上只有一个单峰,说明分子中所有氢核 的化学环境完全相同。结合分子式可断定该化合物
等位氢种类
1
2
CH3CH2OH
3
CH3
H
CC
Cl
H
3
有几组峰,则表示样品中有几种不同类型的质子。 每一组峰的强度(面积),与质子的数目成正比。 各个阶梯的(积分)高度比表示不同化学位移的质子数之比。
一个化合物究竟有几组吸收峰,取决于分 子中H核的类型,有几种不同类型的H核,就有 几组吸收峰。
CH3 CH2 O H ab c
1)峰的裂分数目符合n+1规律 2)各峰强度比符合二项式(a+b)n展开系 数之比
➢偶合常数 J
自旋-自旋偶合裂分后,两峰之间的距离,即两峰的
频率差:
2.偶V的合a-强常V弱数b (。。J)单位:HZ 。J的大小反映核自旋相互干扰
Jab
Jab
偶合常数与化学键性质有关,与外加磁场强度、使用仪器 的频率无关。数值依 赖于偶合氢原子的结构关系。
注 意:
❖ 非邻位碳上的氢,不发生自旋裂分,J值趋于零。
O
CH3CH2CCH3 ab c
Ha与Hc, Hb与Hc 均不发生偶合
❖ 等位H核之间不发生自旋裂分。如CH3CH3; BrCH2CH2Br只有一个单峰。
四. 1H-NMR 的谱图解析
参数:
化学位移 裂分数目或偶合常数 峰的积分面积/高度
有机化学-核磁共振ppt课件

E=hγH0 /2 称为核磁共振基本关系式. 其中γ磁旋比;H0 外加磁场强度。
(乙) 核磁共振的条件
当用频率为ν的电磁波照射处于磁场的样品时,如果能量差 E=hγHo /2 ,这样就产生了核磁共振吸收,用仪器记录下来的 信号就是核磁共振谱(化学位移(Chemical shift) 由于化学环境(结构)不同所引起的 NMR 信号位置变化。 化学位移是由核外电子的屏蔽而引起的.
(丙)影响化学位移的因素
1.屏蔽效应:在外磁场下,核外电子使原子核所感受到的有效磁场 强度降低,屏蔽效应使δ 值变小;去屏蔽效应使δ 值变大。 2.电负性: Y-H中Y的电负性大的原子或取代基,降低氢原子周围 的电子云密度,减小屏蔽效应(去屏蔽效应),化学位移增大 靠近低场出峰。 3.氢键:氢键有去屏蔽效应,使质子的δ值显著增大。 此外,结构的各向异性、Vander Waals效应、质子交换、温度、 溶剂及溶液浓度等也对化学位移有影响。
CH2Br b
«å Ë · ¨2H£ £ ©
Jab
Jab
Jab
åµ · ÄÁ Ñ· Ö
峰强度 1 : 2 :1 1 :1
1,1,2-三溴乙烷的NMR
(乙) 偶合常数*反映两核之间自旋偶合作用大小的量度,用J(Hz)
表示。
(丙) 磁等性质子和磁不等性质子*
化学等价核:化学位移δ相同的核。 磁等价核: δ 值相同,而且组内任一核对组外某一磁性核的偶 合常数也相同。 磁不等价核:化学等价,但对组外磁性核的偶合常数不同。
(甲) 原子核的自旋
1H核带一个正电荷,像电子那样自
旋而产生磁矩(像极小的磁铁)
+
当无外加磁场时,样品中的磁性核任意取向。
在外加磁场(Ho)中,质子自旋所产生的磁矩有两种取 向:与Ho同向(α态)或反向( β态),对应于两个自旋 态,出现能量差: E=hγHo /2 ,核从α态跃迁到β态, 这种质子自旋改变就产生了核磁共振。
(乙) 核磁共振的条件
当用频率为ν的电磁波照射处于磁场的样品时,如果能量差 E=hγHo /2 ,这样就产生了核磁共振吸收,用仪器记录下来的 信号就是核磁共振谱(化学位移(Chemical shift) 由于化学环境(结构)不同所引起的 NMR 信号位置变化。 化学位移是由核外电子的屏蔽而引起的.
(丙)影响化学位移的因素
1.屏蔽效应:在外磁场下,核外电子使原子核所感受到的有效磁场 强度降低,屏蔽效应使δ 值变小;去屏蔽效应使δ 值变大。 2.电负性: Y-H中Y的电负性大的原子或取代基,降低氢原子周围 的电子云密度,减小屏蔽效应(去屏蔽效应),化学位移增大 靠近低场出峰。 3.氢键:氢键有去屏蔽效应,使质子的δ值显著增大。 此外,结构的各向异性、Vander Waals效应、质子交换、温度、 溶剂及溶液浓度等也对化学位移有影响。
CH2Br b
«å Ë · ¨2H£ £ ©
Jab
Jab
Jab
åµ · ÄÁ Ñ· Ö
峰强度 1 : 2 :1 1 :1
1,1,2-三溴乙烷的NMR
(乙) 偶合常数*反映两核之间自旋偶合作用大小的量度,用J(Hz)
表示。
(丙) 磁等性质子和磁不等性质子*
化学等价核:化学位移δ相同的核。 磁等价核: δ 值相同,而且组内任一核对组外某一磁性核的偶 合常数也相同。 磁不等价核:化学等价,但对组外磁性核的偶合常数不同。
(甲) 原子核的自旋
1H核带一个正电荷,像电子那样自
旋而产生磁矩(像极小的磁铁)
+
当无外加磁场时,样品中的磁性核任意取向。
在外加磁场(Ho)中,质子自旋所产生的磁矩有两种取 向:与Ho同向(α态)或反向( β态),对应于两个自旋 态,出现能量差: E=hγHo /2 ,核从α态跃迁到β态, 这种质子自旋改变就产生了核磁共振。
共振论的应用PPT课件

的共轭碱:
O C
OH
O C O + H+
ROH
OH
RO - + H+
+ H+ O
精选ppt课件最新
19
用共振论考察共轭碱的稳定性:
O C
O
O C
O
O
O
O
O
RO 无共振
精选ppt课件最新
20
醇的共轭碱无共振效应,故稳定性最小,所 以起其酸最弱;酚的共轭碱和羧酸的共轭碱进 行比较,酚的负电荷在电负性较小的碳上,而 羧酸根的负电荷在电负性较大的氧上。前者稳 定性小,而且羧酸根是等价共振,非常稳定。
解:(i)中C*是SP3杂化,即不是共轭体系,所 以不满足Hückle规则特点:①无芳香性。
精选ppt课件最新
12
(ii)
(iii)
C
C
C
(ii)(iii) 有芳香性
(iv¨)
NCH3
NCH 3
C NCH 3
电子数为6,环多共轭体系,故有芳香性。
精选ppt课件最新
13
(2)预测反应的主要产物
例1 解释芳香族亲电取代反应的主要产物。例 如为什么说羟基是邻、对位定位基?
精选ppt课件最新
17
(3)比较化合物酸碱性强弱
例1 为什么说酸、酚、醇的酸性依次减小? 用共振理论解释。
衡量酸性强、弱大小,往往用酸的共轭 碱的稳定性大小来说明。
H B
酸
B -+H +
共轭碱
精选ppt课件最新
18
酸的共轭碱B-,B-越稳定则不易结合质子, 酸性越强;B-越不稳定,越易结合质子,酸 性越弱。羧酸、酚、醇给出质子后形成下面
O C
OH
O C O + H+
ROH
OH
RO - + H+
+ H+ O
精选ppt课件最新
19
用共振论考察共轭碱的稳定性:
O C
O
O C
O
O
O
O
O
RO 无共振
精选ppt课件最新
20
醇的共轭碱无共振效应,故稳定性最小,所 以起其酸最弱;酚的共轭碱和羧酸的共轭碱进 行比较,酚的负电荷在电负性较小的碳上,而 羧酸根的负电荷在电负性较大的氧上。前者稳 定性小,而且羧酸根是等价共振,非常稳定。
解:(i)中C*是SP3杂化,即不是共轭体系,所 以不满足Hückle规则特点:①无芳香性。
精选ppt课件最新
12
(ii)
(iii)
C
C
C
(ii)(iii) 有芳香性
(iv¨)
NCH3
NCH 3
C NCH 3
电子数为6,环多共轭体系,故有芳香性。
精选ppt课件最新
13
(2)预测反应的主要产物
例1 解释芳香族亲电取代反应的主要产物。例 如为什么说羟基是邻、对位定位基?
精选ppt课件最新
17
(3)比较化合物酸碱性强弱
例1 为什么说酸、酚、醇的酸性依次减小? 用共振理论解释。
衡量酸性强、弱大小,往往用酸的共轭 碱的稳定性大小来说明。
H B
酸
B -+H +
共轭碱
精选ppt课件最新
18
酸的共轭碱B-,B-越稳定则不易结合质子, 酸性越强;B-越不稳定,越易结合质子,酸 性越弱。羧酸、酚、醇给出质子后形成下面
第一章共振轮ppt课件

? N-O 键成长122pm
N=O 键成长122pm
(一)共振论
1931年美国化学家鲍林(L. Pauling)提出,是经典价 键理论的补充和发展。
2020/4/28
.
The Nobel Prize in Chemistry 1954
由于他对化学键本质的研究, 把它应用到复杂物质结构的解释做出了卓越贡献
量子力学诞生后,他利用量子力学方法开展物理与化学 的微观方面研究。包括分子原子运动和化学键性质等,取得 了很大成功。他从30年代初就提出的关于计算原子电负性的 公式和杂化轨道理论。
40年代中期以后,在研究生物大分子方面,有关于确定 肽键和蛋白质分子的螺旋体二级结构等方面的出色成就,打 开了通往分子奥秘大门的通道,阐明了原子间相互作用的规 律和不同形式化学键的本质。
获得1974年度美国国家科学奖章和苏联1977年度罗蒙诺索 夫金质奖章等多种奖章。
著有《量子力学导论》(1935)和《化学键的本质》 (1939)等书。
.
鲍林1901年2月28日生于美国俄勒冈州。1922~1925年在加 利福尼亚理工学院学习,获得博士学位。1926-27去欧洲,在索未 菲实验室里工作一年。然后又到玻尔实验室工作了半年,还到过 薛定谔和德拜实验室。这些学术研究,使鲍林对量子力学有了极 为深刻的了解,坚定了他用量子力学方法解决化学键问题的信心。 1930年,鲍林再一次去欧洲,到布拉格实验室学习有关射线的技 术,后来又到慕尼黑学习电子衍射方面的技术,回国后,被加州 理工学院聘为教授。 1949年担任美国化学会会长。
2020/4/28
.
此外,他还把价键理论进一步扩展到金属和金属络合物方 面,并且阐明和发展了有关原子核结构和裂变过程本质的理论。
第四讲_共振及派键

(2)丁二烯分子式H2C=CH-CH=CH2。 4个碳原子均有3个配位原子相邻,故均取sp2杂化,形 成3个s键,所有原子处于同一个平面。每个碳原子有 一个未参与杂化的p轨道,垂直于分子平面,每个p轨 道里有一个电子。按照上面分析苯分子的结构的模式 ,丁二烯分子里有一个4轨道4电子的p-p大键。
丁二烯分子里的p-p大Π 键
子间力的能量只达n~n·10kJ/mol的数量级,比化学键弱
得多。相对于化学键,大多数分子间力又是短程作用力, 只有当分子或基团(为简捷起见下面统称“分子”)距离 很近时才显现出来。范德华力和氢键是两类最常见的分 子间力,分别介绍如下。
• 一、范德华力 • 范德华力普遍地存在于固、液、气态任何微粒之间。 • 微粒相离稍远,就可忽略; • 范德华力没有方向性和饱和性,不受微粒之间的方向与个数的
2、类型
离域π键可用符号
Π
m
n 表示,其中n表示相互平
行的P轨道数目,m表示离域π键中电子的数目,根
据n和m的大小关系,离域π键可分为三种类型。
①正常离域π键,m=n,即参加共轭的P轨道数目与P
电子数相等。如:苯Π
6 6
②多电子离域π键,m﹥n,P电子数大于P轨道数(但
小于2倍P轨道数)
双键邻接带有孤对电子的O,N,P,Cl,S等原子时 ,常形成多电子离域大π键。
看资料p22:8种等电子体类型,并记住
2008年北京市高中学生化学竞赛试卷(高中二年级) 2008年4月20日下午2:00—4:30 北 京
第二题(共6分)等电子体指的是含有相同电子数的分子 或离子。按下列要求写出几个与N2分子互为等电子体的 物质的化学式。 (1)一种AB型分子,它是一种很有用的还原剂 (2)AB-型离子,它是一种重要的配位体 (3)A2B2型分子
理论有机化学 第三章 共振论简介

对于第一类定位基,邻对位取代的中间体共振 结构多,稳定性高,邻对位产物占优。
共 振 论 简 介
OH E OH E H
OH E E H
OH E E H E H E H E H OH OH
OH E H
OH E H
OH E H
OH
OH E H
OH
E H
OH OH
共 振 论 简 介
N02 E N02 E H N02 E H N02 E H
地结构是这些共振结构式的杂化体。这些共
振杂化体仅仅是纸面上的非真实结构。
共 振 论 简 介
解决了苯环结构的四个问题
共 振 论 简 介
O O C O O
O C O O
O C O
碳酸根的共振结构
共 振 论 简 介
2. 在写共振式时只允许电子的移动,原子 核的位置不能变。
CH2 CH2=CHCH2
共振
共 振 论 简 介
练习:写出对硝基苯酚负离子的 合理共振结构式
O
NO2
共 振 论 简 介
§2 共振论的应用
1.定性判断分子稳定性 依据:能写出的共振式越多,真实分子越稳定。
分子 离域能
共振结构
苯 2β 2
奥 3.36β 2
萘 3.683β 3
联苯 4.383β 4
蒽 5.316β 4
菲 5.444β 5
Br2 Br Br
实际:主要发生取代反应
Br2 Br
共 振 论 简 介
理论:二取代产物应该有两个
Br Br
实际:二取代产物只有一个
Br Br
Br Br
共 振 论 简 介
用传统的价键理论不能解释……
共 振 论 简 介
共 振 论 简 介
OH E OH E H
OH E E H
OH E E H E H E H E H OH OH
OH E H
OH E H
OH E H
OH
OH E H
OH
E H
OH OH
共 振 论 简 介
N02 E N02 E H N02 E H N02 E H
地结构是这些共振结构式的杂化体。这些共
振杂化体仅仅是纸面上的非真实结构。
共 振 论 简 介
解决了苯环结构的四个问题
共 振 论 简 介
O O C O O
O C O O
O C O
碳酸根的共振结构
共 振 论 简 介
2. 在写共振式时只允许电子的移动,原子 核的位置不能变。
CH2 CH2=CHCH2
共振
共 振 论 简 介
练习:写出对硝基苯酚负离子的 合理共振结构式
O
NO2
共 振 论 简 介
§2 共振论的应用
1.定性判断分子稳定性 依据:能写出的共振式越多,真实分子越稳定。
分子 离域能
共振结构
苯 2β 2
奥 3.36β 2
萘 3.683β 3
联苯 4.383β 4
蒽 5.316β 4
菲 5.444β 5
Br2 Br Br
实际:主要发生取代反应
Br2 Br
共 振 论 简 介
理论:二取代产物应该有两个
Br Br
实际:二取代产物只有一个
Br Br
Br Br
共 振 论 简 介
用传统的价键理论不能解释……
共 振 论 简 介
共振理论 ppt课件
(1)与(2)为非对映体; (1)与(3)为对映体; (1)与(4)为非对映体; (2)与(4)为同一化合物 的不同构象。
化合物A,C16H14,能吸收1mol氢,使Br2/CCl4溶 液褪色,与KMnO4酸性溶液作用生成苯二甲酸, 该酸只有一种单溴代产物,给出A的结构
由Newmann投影式转换为Fishcher投影式:
当Newmann投影式竖键垂直向上时,则前方向上的原子放 在Fishcher投影式竖线的上方;当Newmann投影式竖键垂直 向下时,则前方向下的原子放在Fishcher投影式竖线的下方 。
共轭效应
共扼体系的类别很多,但不管哪类共扼体系在分子几何结构上都呈现出 一定程度的键长平均化,共扼程度越高,双键和单键的键长就越接近。
因此,共扼体系中共扼效应的方向可以根据电子云密度平均化趋势来判 定,即电子云密度的平均化趋势就是共扼体系中共扼效应方向的判据。
使用方法: 先找出共扼体系中相对富电子处和相对缺电子处(可根据共轭的单位
由Fishcher投影式转换为Newmann投影式:
当Newmann投影式竖键垂直向上时,则前方向上的原子放 在Fishcher投影式竖线的上方;当Newmann投影式竖键垂直 向下时,则前方向下的原子放在Fishcher投影式竖线的下方 。
反过来理解即可。
应用:判断构象间的相互关系
最简便的方法就ቤተ መጻሕፍቲ ባይዱ对手性碳原子构型进行 R/S 标记
与杂化2pz轨道和C的2pz轨道成π键)
注意:双键是平面的,三键是线型的。若整体共轭,需要三键旋转到一 定角度保证p轨道平行才行。
某开链烃为(A)的分子式为C6H12,具有旋光性,加氢 后生成相应的饱和烃(B)。(A)与溴化氢反应生成 C6H13Br 。试写出 (A) 、(B)可能的构造式和各步反应 式,并指出(B)有无旋光性。
化合物A,C16H14,能吸收1mol氢,使Br2/CCl4溶 液褪色,与KMnO4酸性溶液作用生成苯二甲酸, 该酸只有一种单溴代产物,给出A的结构
由Newmann投影式转换为Fishcher投影式:
当Newmann投影式竖键垂直向上时,则前方向上的原子放 在Fishcher投影式竖线的上方;当Newmann投影式竖键垂直 向下时,则前方向下的原子放在Fishcher投影式竖线的下方 。
共轭效应
共扼体系的类别很多,但不管哪类共扼体系在分子几何结构上都呈现出 一定程度的键长平均化,共扼程度越高,双键和单键的键长就越接近。
因此,共扼体系中共扼效应的方向可以根据电子云密度平均化趋势来判 定,即电子云密度的平均化趋势就是共扼体系中共扼效应方向的判据。
使用方法: 先找出共扼体系中相对富电子处和相对缺电子处(可根据共轭的单位
由Fishcher投影式转换为Newmann投影式:
当Newmann投影式竖键垂直向上时,则前方向上的原子放 在Fishcher投影式竖线的上方;当Newmann投影式竖键垂直 向下时,则前方向下的原子放在Fishcher投影式竖线的下方 。
反过来理解即可。
应用:判断构象间的相互关系
最简便的方法就ቤተ መጻሕፍቲ ባይዱ对手性碳原子构型进行 R/S 标记
与杂化2pz轨道和C的2pz轨道成π键)
注意:双键是平面的,三键是线型的。若整体共轭,需要三键旋转到一 定角度保证p轨道平行才行。
某开链烃为(A)的分子式为C6H12,具有旋光性,加氢 后生成相应的饱和烃(B)。(A)与溴化氢反应生成 C6H13Br 。试写出 (A) 、(B)可能的构造式和各步反应 式,并指出(B)有无旋光性。
共轭体系、共轭效应、共振论【优质PPT】

例:
CH2=CH2 + H2
CH3-CH3 + Q
ΔH=137.2KJ/mol
CH2=CH-CH=CH2 + 2H2 CH3-CH2-CH2-CH3 + Q
ΔH=238.9KJ/mol
2021/5/27
20
假定CH2=CH-CH=CH2分子不共轭,与 H2 反应时所放出的能量为:
137.2×2 = 274 . 4 KJ/mol
2-
CO3
O
OC -
O
-O
O-
C
O
O-
OC
O-
2021/5/27
35
2-
CO3
杂化体
O
OC -
O
-O
O-
C
O
O-
OC
O-
极限式(共振结构式)
共振
2021/5/27
36
注意:
1)杂化体不是极限式的混合物,也不是他们的 互变平衡体系,是一个单一物质。
2)实际的极限式不存在
3)极限式代表着电子离域的限度,其越多,电 子离域可能性越大,体系能量越低。
两者之差 —— 共轭能:
274.4 - 238.9 = 35.5 KJ/mol
2021/5/27
21
结论: 共轭效应的存在,使体系稳定性增大。
共轭链越长,共轭能越大,体系越稳定。
2021/5/27
22
. 应用1: 可解释C+、C 、烯烃的稳定性
例1:解释烷基游离基的稳定性:
3ºR. >2ºR. >1ºR. >CH3.
H3C
+ C
.. Cl
H
共振论_01

判断下列基团Y相对于 是吸电基还是给电基? 判断下列基团 相对于C=C-Y是吸电基还是给电基? 相对于 是吸电基还是给电基
Y -CH3,-CH2-R -CF3,-CHX2 -X -OH,-OR -NH2,-NHR,-NR2 -N+R3 -CN -NO2 -CHO,-COOH,-COOR 诱导效应 + 共轭效应 + + + + 总电效应 + + + -
+ [ H 2 C = O. H ] . 1 .. + H 2 C - O. H ] [ . 2
共振式2中C没满足八隅体结构 3.如都有完整的价电子层结构,但带电荷,则负电荷在负性 较强的原子上,正电荷在负性较弱的原子上稳定。 4.一个分子的极限结构式越多越稳定。
共振论对1,3-丁二烯键长平均化解释如下:
CH2= CH-CH=CH2 (1) + _ CH -CH-CH CH2 2 (4) = + _ CH2=CH CH-CH 2 (7)
_ CH -CH CH-+ 2 CH 2 = (2) _ + CH -CH-CH=CH 2 2 (5 )
_ + CH -CH=CH- 2 CH 2 3) ( _ + CH =CH CH CH 2 6) - 2 (
6共轭效应 共轭效应 在单双键交替出现的共轭分子中,P电子的运动范围不在局限在两个碳 原子之间,而是扩充到四个碳原子之间,这种现象称为离域现象 离域现象。 离域现象 当一个原子受到外界试剂的影响,其他原子马上受到影响,不管共轭体 系多大,作用一致,这种作用为共轭效应 共轭效应。 共轭效应 共轭使电子云分布平均化,体系的能量降低,分子或离子的稳定性增强 。 离域有以下几种情况: π-π共轭: C=C-C=C, p-π共轭: HO-C=C, NH2-C=C, X-C=C, RO-C=C, C=C-C+, C=C-C.; p-p共轭:HO-C+, HO-C.. NH2-C+, NH2-C., X-C+, RO-C+; σ-π共轭: CH3-CH=CH2; σ-p共轭: CH3-C+, CH3-C.; 共轭作用由强到弱:π-π共轭> p-π共轭> p-p共轭>σ-π共轭σ-p共轭 氢化热的概念; 氢化热 烯烃稳定性规律:双键上电子云密度越低(越分散),烯烃越稳定。
大学有机化学核磁共振氢谱ppt课件

大学有机化学核磁共振氢谱
6
大学有机化学核磁共振氢谱
7
大学有机化学核磁共振氢谱
8
核磁共振条件
(1) 核有自旋(磁性核);
(2) 外磁场, 能级裂分;
(3) 照射频率与外磁场的关系:
2
H0
核——原子核自旋 I≠0
磁——外加磁场H0 诱导产生自旋能级分裂
共振——1= 0 能级跃迁
大学有机化学核磁共振氢谱
吸收峰的峰面积,可用自动积分仪对峰面积进行自 动积分,画出一个阶梯式的积分曲线。
峰面积的大小与质子数目成正比。 峰面积高度之比 = 质子个数之比。
4cm(2H)
2cm(1H)
8cm(4H)
14cm(7H)
大学有机化学核磁共振氢谱
25
五、自旋偶合与自旋裂分
高分辨率核磁共振谱仪测定CH3CH2―I 或 CH3CH2OH时,CH3―和―CH2―的共振吸 收峰都不是单峰,而是多重峰。
低 场
屏 蔽 效 应 , 共 振 信 号 移 向 高 场 H 0 高 场
去 屏 蔽 效 应 , 共 振 信 号 移 向 低 场
因此,H核磁共振的条件是:
2H实2H( 01)
大学有机化学核磁共振氢谱
14
2. 化学位移的表示方法
化学位移的差别约为百万分之十,精确测量十分
困难,现采用相对数值。以四甲基硅(TMS)为标准 物质,规定它的化学位移为零,然后,根据其它吸收
大学有机化学核磁共振氢谱
3
一、基本原理
1. 原子核的自旋 核象电子一样,也有自旋现象,从而有自旋角动量。
旋进轨道
自旋轴 自旋的质子
核的自旋角动量(ρ) 是量子化的,不能任 意取值,可用自旋量 子数(I)来描述。
有机化学课件-核磁

共振公式:
2
B0
裸露的氢核: B0 =1.4092T时, = 60MHZ
但还受到核周围的电子环境的影响,使不同种类的 氢原子所吸收电磁波的的频率稍有不同,即谱线位置 不同。
3.1 化学位移的产生
屏蔽作用,使氢核实际受 到的外磁场作用减小。
屏蔽作用对磁场强度的影 响程度用屏蔽常数σ表示 。
HH核核
优点:1 单一尖峰;2 不干扰样品信号;3 与样品不反应、不缔 合;4 易溶于有机溶剂,沸点低(27.2℃),易回收。
缺点:不溶于重水,用重水测定时用DSS(2,2-二甲基-2-硅代戊磺 酸钠盐)(0.5~2.5ppm 有干扰)。
用位移常数δ值表示化学位移
化学位移值用位移常数δ值表示,δ值的定义:
•原子核总是不停地按一定频率绕着自身的
轴发生自旋 ( Spin )
•原子核的质子带正电荷,其自旋产生的磁 场称为核磁。
进入主磁场前后质子的核磁状态
前
后
1.1 核磁共振波谱的产生
伊西多·拉比 (Isidor Rabi) 美国,1944年 诺贝尔物理学奖获得者
核磁共振现象(Proton magnetic resonance):因原子核自旋 产生磁矩,当核磁矩处于静止的外磁场中时产生核进动和能级 分裂,在交变磁场作用下,自旋核会吸收特定频率的电磁波, 从较低的能级跃迁到较高能级(核的自旋也存在不同的能级, 要发生核磁共振,原子核磁矩不为零)。
核磁共振谱图的表示方法:
可 知 不 同 种 类 氢 的 比 例
各 峰 的 相 对 面 积 比 较
纵 坐 标 是 峰 强 度
8.0
4.0
3H 2H
3.0
2.0
1.0 ppm 0
有机化学-共振论ppt课件

可编辑课件 (规则2 ,规则3) (规则4)
5
4. 如何画共振结构?
可编辑课件
6
如何画共振结构?
可编辑课件
7
如何画共振结构?
可编辑课件
8
如何画共振结构?
可编辑课件
9
如何画共振结构?
可编辑课件
10
如何画共振结构?
可编辑课件
11
如何画共振结构?
可编辑课件
12
如何画共振结构?
可编辑课件
13
可编辑课件
2
1.2共振论
1 、共振论(Resonance Structure):For each σ bonding pattern, there are often several ways in which and nonbonding electrons can be distributed. These different ways are called resonance structures. (不同的共振式像是字母,和在一起才是一个单词)
OH ╳
4
OO 3
OH OO
+
0.4% Ru(dcbp)2(H2O)2(ClO)4 ╳
Base
OO
配合物1d催化的β- 二酮与醇的反应的催化机理:
2+
N Cl Cl
N
N Cl
OH2
Ru
. (ClO4)2- +
OH2
N Cl
OO 2a
1d
OH
OO
H+
+
5a
N Cl
N
O
Cl Cl Ru
(1)第一周期元素(B,C,N,O)的价电子数绝不可以超过8。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1 、共振论
1.1.形式电荷
基本元素的形式电荷如图表1:
.
1
电正性、缺电子性、亲电性的区别
1、电正性或电负性是元素本身的性质,与元素的成键方式没有关系。吸引电子能力的 大小确定的。
2、缺电子性是指原子的价电子没有达到8电子结构时的性质。 3、亲电性: 原子有空轨道并且能量低。(可以与亲核试剂反应)
(1)第一周期元素(B,C,N,O)的价电子数绝不可以超过8。
+
H 3 COH XH 3 COH
(2)所有原子都具有完整价电子层的共振结构比其中有原子具有不完整价电子层的共振结构稳定。如 果共振结构中具有缺电子原子,那这个缺电子原子应该是电正性原子(C,B), 而不应该是电 负性原子(N,O,卤素)。
(4)所有共振式都必须有相等的未成对电子数。
C H 2 C H 2
. C H C H 2
. C H C H 2
. C H 2 . X C H 2
C H 2 C H 2 .. C H 2 C H 2
(不等价的共振结构对杂化体的贡献是不同的,越稳定的共振结构对杂化体的贡献越大)
.
4
3.共振结构的稳定性规则
电正性、缺电子、亲电性、形式电荷等性质都是互相独立的 与化学反应性没有必然的关系!
例如:
CH3+, NH4+ (形式电荷都是+1价的,C是缺电子的而N不是) .CH3, BF3 (都具有缺电子性,但都没有形式电荷) B具有电正性,N具有电负性,BH4-,NH4+ 都是富电子原子。 CH3+,CH3I,H2C=O (C 都具有亲电性,但只有CH3+ 中的C 是缺电子原子) MeO+=CH2 中的O 原子具有形式正电荷,但C原子具有亲电性
热力学和动力学
有机化合物的反应能量和速率对反应机理有重要的影响。一个化学反应是否自发的 进行、反应速度的快慢、是否是可逆反应等都与反应式的能量及其反应速率有关。
1.自由能(△G) 反应式的自由能与焓和熵有关。△G=△Ho-T△So 从关系式可以看出自由能与反应 所处环境的温度有关的。(实际研究中常以△H代替△G )
.
(规则2 ,规则3) (规则4)
5
4. 如何画共振结构?
.
6
如何画共振结构?
.
7
如何画共振结构?
.
8
如何画共振结构?
.
9
如何画共振结构?
.
10
如何画共振结构?
.
11
如何画共振结构?
.
12
如何画共振结构?
.
13
如何画共振结构?
.
14
请判断哪一个共振结构稳定?
.
15
两个特例
.
16
(2)Endo-产物是动力学产物,exo-产物为热力学产物。两种产物是同时存在的。
Endo-产物
Exo-产物
.
21
中间体与过渡态
.
22
动力学稳定与热力学稳定
(动力学稳定、热力学稳定)
Bu-t t-Bu Bu-t
Bu-t
(动力学稳定,热力学不稳定)
OH R OR'
(动力学不稳定,热力学稳定)
.
23
一个反应研究的故事
OH +
OO
0.4% mol Ru(dcbp)2(H2O)(OTf)2 10 bar H2, 12h
OO
Yield: 95% Solvent Free!
[Ru(dcbp)2(H2O)](OTf)2:
N N
OH2
Ru
N N
OH2
. (OTf)2
.
24
O R1
O +
R2
AuCl3/AgOTf Solvent
.
3
2.共振式的书写规则:
(1)共振式间用连Fra bibliotek。(2)书写共振式时,只允许电子移动,而原子核的位置不动。
C H 2 C H 2
+
C H C H 2
+
C H C H 2
+
C H 2 C H C H 2
+
X C H 2 C C H 3
(3)所有共振式,都必须符合Lewis结构。
+
H 3 COH XH 3 COH
O R1
O R2
J. Am. Chem. Soc. 2004, 126, 6884-6885 J. Org. Chem. 2005, 70, 5752-5755 Org. Lett., 2005, 7, 673-675
OO
R1
R2 +
OO
CuBr/CoCl2 R1
R2
Solvent
J. Am. Chem. Soc. 2006, 128, 56-57 J. Am. Chem. Soc. 2006, 128, 1798
反应的快慢由活化能( △G *)决定,与反应的自由能( △G )无关
.
18
活化能(△G*)
活化能
过渡态
汽 油 +O 2 2 5o CC O 2+H 2 O
O +H2O
.
OH OH
19
可逆反应与反应平衡
(1)当正反应与逆反应的速度相等时,反应达到平衡。 (2)达到平衡的反应是可逆反应。(K > 103 则视为不可逆,
某种产物脱离反应体系则反应不可逆) (3)反应达到平衡时,反应物与产物、不同产物的比例是由不同
化合物的自由能决定的。
.
20
动力学产物和热力学产物
(1)下面是呋喃与丁烯二酸酐的反应,可生成两种产物。一种为endo-产物,另种 为exo-产物。当温度比较低时,生成能量高的endo-产物;当温度高时,易生成 能量比较低的exo-产物。
.
2
1.2共振论
1 、共振论(Resonance Structure):For each σ bonding pattern, there are often several ways in which and nonbonding electrons can be distributed. These different ways are called resonance structures. (不同的共振式像是字母,和在一起才是一个单词)
反应物的G
生成物的G
.
17
活化能(△G*)
(1)过渡态与反应物之间的能量差是形成过渡态所必须的最低能 量,也是使该反应进行所需的最低能量,叫活化能。 (2)反应中能垒的高度即活化能的大小决定了一个反应的速度。 每一个反应都有它特有的活化能数值。 (3)通常活化能越小,反应越容易进行,反应速率也越快。
(3)不带电荷的的共振结构比具有分离电荷的共振结构稳定 。
(4)对于带有电荷的共振结构来说,负电荷处在电负性强的原子上,正电荷处在电负性弱 的原子上更稳定。
(以上规则的重要性依次降低)
请判断那个共振结构更稳定:
.. + M e OC H 3
+
M e OC H 2
(规则2 > 规则4)
+-
-+
M e 2 C O M e 2 C O M e 2 C O
1.1.形式电荷
基本元素的形式电荷如图表1:
.
1
电正性、缺电子性、亲电性的区别
1、电正性或电负性是元素本身的性质,与元素的成键方式没有关系。吸引电子能力的 大小确定的。
2、缺电子性是指原子的价电子没有达到8电子结构时的性质。 3、亲电性: 原子有空轨道并且能量低。(可以与亲核试剂反应)
(1)第一周期元素(B,C,N,O)的价电子数绝不可以超过8。
+
H 3 COH XH 3 COH
(2)所有原子都具有完整价电子层的共振结构比其中有原子具有不完整价电子层的共振结构稳定。如 果共振结构中具有缺电子原子,那这个缺电子原子应该是电正性原子(C,B), 而不应该是电 负性原子(N,O,卤素)。
(4)所有共振式都必须有相等的未成对电子数。
C H 2 C H 2
. C H C H 2
. C H C H 2
. C H 2 . X C H 2
C H 2 C H 2 .. C H 2 C H 2
(不等价的共振结构对杂化体的贡献是不同的,越稳定的共振结构对杂化体的贡献越大)
.
4
3.共振结构的稳定性规则
电正性、缺电子、亲电性、形式电荷等性质都是互相独立的 与化学反应性没有必然的关系!
例如:
CH3+, NH4+ (形式电荷都是+1价的,C是缺电子的而N不是) .CH3, BF3 (都具有缺电子性,但都没有形式电荷) B具有电正性,N具有电负性,BH4-,NH4+ 都是富电子原子。 CH3+,CH3I,H2C=O (C 都具有亲电性,但只有CH3+ 中的C 是缺电子原子) MeO+=CH2 中的O 原子具有形式正电荷,但C原子具有亲电性
热力学和动力学
有机化合物的反应能量和速率对反应机理有重要的影响。一个化学反应是否自发的 进行、反应速度的快慢、是否是可逆反应等都与反应式的能量及其反应速率有关。
1.自由能(△G) 反应式的自由能与焓和熵有关。△G=△Ho-T△So 从关系式可以看出自由能与反应 所处环境的温度有关的。(实际研究中常以△H代替△G )
.
(规则2 ,规则3) (规则4)
5
4. 如何画共振结构?
.
6
如何画共振结构?
.
7
如何画共振结构?
.
8
如何画共振结构?
.
9
如何画共振结构?
.
10
如何画共振结构?
.
11
如何画共振结构?
.
12
如何画共振结构?
.
13
如何画共振结构?
.
14
请判断哪一个共振结构稳定?
.
15
两个特例
.
16
(2)Endo-产物是动力学产物,exo-产物为热力学产物。两种产物是同时存在的。
Endo-产物
Exo-产物
.
21
中间体与过渡态
.
22
动力学稳定与热力学稳定
(动力学稳定、热力学稳定)
Bu-t t-Bu Bu-t
Bu-t
(动力学稳定,热力学不稳定)
OH R OR'
(动力学不稳定,热力学稳定)
.
23
一个反应研究的故事
OH +
OO
0.4% mol Ru(dcbp)2(H2O)(OTf)2 10 bar H2, 12h
OO
Yield: 95% Solvent Free!
[Ru(dcbp)2(H2O)](OTf)2:
N N
OH2
Ru
N N
OH2
. (OTf)2
.
24
O R1
O +
R2
AuCl3/AgOTf Solvent
.
3
2.共振式的书写规则:
(1)共振式间用连Fra bibliotek。(2)书写共振式时,只允许电子移动,而原子核的位置不动。
C H 2 C H 2
+
C H C H 2
+
C H C H 2
+
C H 2 C H C H 2
+
X C H 2 C C H 3
(3)所有共振式,都必须符合Lewis结构。
+
H 3 COH XH 3 COH
O R1
O R2
J. Am. Chem. Soc. 2004, 126, 6884-6885 J. Org. Chem. 2005, 70, 5752-5755 Org. Lett., 2005, 7, 673-675
OO
R1
R2 +
OO
CuBr/CoCl2 R1
R2
Solvent
J. Am. Chem. Soc. 2006, 128, 56-57 J. Am. Chem. Soc. 2006, 128, 1798
反应的快慢由活化能( △G *)决定,与反应的自由能( △G )无关
.
18
活化能(△G*)
活化能
过渡态
汽 油 +O 2 2 5o CC O 2+H 2 O
O +H2O
.
OH OH
19
可逆反应与反应平衡
(1)当正反应与逆反应的速度相等时,反应达到平衡。 (2)达到平衡的反应是可逆反应。(K > 103 则视为不可逆,
某种产物脱离反应体系则反应不可逆) (3)反应达到平衡时,反应物与产物、不同产物的比例是由不同
化合物的自由能决定的。
.
20
动力学产物和热力学产物
(1)下面是呋喃与丁烯二酸酐的反应,可生成两种产物。一种为endo-产物,另种 为exo-产物。当温度比较低时,生成能量高的endo-产物;当温度高时,易生成 能量比较低的exo-产物。
.
2
1.2共振论
1 、共振论(Resonance Structure):For each σ bonding pattern, there are often several ways in which and nonbonding electrons can be distributed. These different ways are called resonance structures. (不同的共振式像是字母,和在一起才是一个单词)
反应物的G
生成物的G
.
17
活化能(△G*)
(1)过渡态与反应物之间的能量差是形成过渡态所必须的最低能 量,也是使该反应进行所需的最低能量,叫活化能。 (2)反应中能垒的高度即活化能的大小决定了一个反应的速度。 每一个反应都有它特有的活化能数值。 (3)通常活化能越小,反应越容易进行,反应速率也越快。
(3)不带电荷的的共振结构比具有分离电荷的共振结构稳定 。
(4)对于带有电荷的共振结构来说,负电荷处在电负性强的原子上,正电荷处在电负性弱 的原子上更稳定。
(以上规则的重要性依次降低)
请判断那个共振结构更稳定:
.. + M e OC H 3
+
M e OC H 2
(规则2 > 规则4)
+-
-+
M e 2 C O M e 2 C O M e 2 C O
