结构化学第六章..
结构化学-6

第一节 休克尔分子轨道法
第一节 休克尔分子轨道法
(4)离域能 △E= E小-E大 E大=2E1+2E2
第一节 休克尔分子轨道法
第一节 休克尔分子轨道法
第一节 休克尔分子轨道法
第一节 休克尔分子轨道法
第一节 休克尔分子轨道法 2.环状化合物(苯)
(1)久期行列式
(2)波函数和能级
第一节 休克尔分子轨道法
共振能判断: 定义为π电子总能量 与参考结构总能量之差: RE = E π- ER
第四节 共轭分子其它性质
E π——π电子的总能量 ER——E π中的定域部分 RE——离域部分 RE>0,为芳香性 RE ≈0 为非芳香性 RE<0,为反芳香性
第四节 共轭分子其它性质
第四节 共轭分子其它性质
第四节 共轭分子其它性质
石墨的离域 π键
在石墨中,碳原子排列成层 状结构,在一个平面层片上碳原 子排列成正六角形,碳原子就分 布在各六角环的顶点上,彼此间 的距离是143pm。由许多这样的 相互平行的层片构成。相邻两层 间的距离是335pm 。
第二节 大键形成条件和共轭效应
对每个碳原子来说,原子轨道sp2杂化后, 它的四个电子只有三个与它在同一平面层内的 另外三个碳原子形成共价键(σ键), 剩余一个轨道和一个电子形成大π键。在 层与层之间,由于距离较远,它们不是以化学 键联结,而是以较弱的分子间引力相联结。
Sij = 1 (当i = j)
Sij = 0 (当 i ≠ j)
第一节 休克尔分子轨道法
(2)4个 π 电子进入两个成键轨道, 比原单个p轨道能量低,更加稳定:
-1.62β
-0.62β α
0.62β 1.62β
第一节 休克尔分子轨道法
结构化学课件第六章

显然,同前述结果一致
6.2 配体的群轨道
利用Oh群特征标表可知,
6L 6,0,0,2,2
A1g Eg T1u
令 x,y,z 正向的L是σ 1、σ 2、σ 3 ,负向为σ 4、σ 5、σ 6
A1g
1 6
1
2
3
4
5
6
Eg
1 2
1
4F 4Cl 4Br 4NH3 4F
为193,2F 227pm 为230,2Cl 295pm 为240,2Br 318pm 为207, 2NH3 262pm 为208, 2F 195pm
L'
L
L
Cu
L
L
L'
各种对称性场中 d 能级分裂
配
d d 位 场对称性
x2-y2
z2 dxy
dyz
dxz
注
数
2 直 线 形 - 0.628 3 正 三 角 形 0.545 4 正四面体形 - 0.267 4 平面正方形 1.228 6 正八面体形 0.600 5 三角双锥形 - 0.082 5 四 方 锥 形 0.914 7 五角双锥形 0.282
1.028 - 0.628 0.114 - 0.321 0.546 - 0.386 - 0.267 0.178 0.178 - 0.428 0.228 - 0.514 0.600 - 0.400 - 0.400 0.707 - 0.082 - 0.272 0.086 - 0.086 - 0.457 0.493 0.282 - 0.528
1
3
结构化学_第6章_4

0.0
d2
△o
- 0.4
稳定化能(LFSE)= 0.8 △o
Pt
Pt
0.6
E (△o)
0.0
d3
△o
- 0.4
稳定化能(LFSE)= 1.2 △o
Pt
Pt
0.6
E (△o)
0.0
d4
△o
- 0.4
Pt
Pt
p198 line 3
自旋平行分占两个轨道的电子被挤到同一轨道上自旋相反, 这两种状态间的能量差,称为成对能。
Pt
Pt
配合物中金属原子d电子填入分裂后的d轨道后,若不考 虑成对能,只考虑分裂能,则能量降低的总值称为配合 物稳定化能(LFSE)
Pt
Pt
弱场
0.6
E (△o)
d z2
d x2 y 2
高自旋配合物 [Fe(H2O)6]3+ [FeF6]3-
0.0
△0 < P
d xy
d xz
d yz
-0.4
八面体场中 d 电子排布 未成对电子数 实测磁矩/B.M 自旋状态
例2 例3
Pt
Pt
Cu2+水溶液呈浅蓝色,当加入NH3后呈深蓝色
[Cu(H2O)4]2++4 NH3→[Cu(NH3)4]2++4 H2O
Cu2+水溶液吸收红光呈浅蓝色,加入 NH3后配体由H2O变为NH3,△增大,使 吸收峰波长变短,吸收橙色,变为深蓝色。
10 ↑↓ ↑↓ ↑↓
↑↓ ↑↓
-5P
↑↓ ↑↓ ↑↓
↑↓ ↑↓
-3P
表6.2.3 不同d电子组态的LFSE数值(Δo )
结构化学第六章配位化合物结构

结构化学第六章配位化合物结构6001试述正八而体场中,中心离子d轨道的分裂方式6002试用分子轨逍理论阐明X , NH3和CN-的配体场强弱的次序。
6003按配位场理论,在Oh场中没有高低自旋络合物之分的组态是:----------- ()(A)d3 (B)d4 (C) d5 (D) d6 (E) d76004凡是中心离子电子组态为d6的八而体络合物,苴LFSE都是相等的,这一说法是否正确?6005络合物的中心离子的d轨道在正方形场中,将分裂成几个能级:-------------- ()(A) 2 (B)3 (C)4 (D)56006Fe(CN)63-的LFSE= ________________ 「6007凡是在弱场配位体作用下,中心离子d电子一立取高自旋态:凡是在强场配位体作用下,中心离子d电子一立取低自旋态。
这一结论是否正确?6008Fc(CN)6#中,CN-是强场配位体,FJ+的电子排布为心,故LFSE为________________ 。
6009尖晶石的一般表示式为AB2O4,其中氧离子为密堆积,当金属离子A占据正四而体门空隙时,称为正常尖晶石,而当A占据Oh空隙时,称为反尖晶石,试从晶体场稳左化能计算说明NiAl2O4晶体是什么型尖晶石结构(Ni?+为於结构)。
6010在Fe(CN)64-中的F2+离子半径比Fe(H2O)62+中的F2+离子半径大还是小?为什么?6011 作图证明CO是个强配位体。
6012CoFf啲成对能为21? 000cm1,分裂能为13? 000cnr1,试写出:(l)d电子排布⑵LFSE值(3)电子自旋角动捲⑷ 磁矩6013已知ML6络合物中(M%为的,>1,尸20? 000 cm-1, P= 25? 000 cm1,它的LFSE 绝对值等于多少? ----------------------- ()(A)0 (B) 25? 000 cnr1 (C) 54? 000 cnr1 (D) 8000 cnr16014四角方锥可认为是正八而体从z方向拉长,且下端没有配体L的情况。
结构化学第六章

第六章配位化合物的结构和性质
一.基本概念:
1.配合物、中心原子、配体、单核配合物、多核配合物
2.电价配合物、共价配合物、高自旋配合物和低自旋配合物
3.分子磁矩与未成对电子数的关系
4.晶体场、分裂能、成对能、光谱化学序、强场、弱场、晶体场稳定化能5.姜太勒效应和络合物畸变
6. M中σ型轨道和π型轨道
7. M-L之间的σ键及能级次序
8.羰基配合物中的σ-π键
9.π络合物中的σ-π键
10.电子规则和9n-l规则
二.基本计算和应用:
1.VBT与CFT理论对配合物的结构与性质的解释
2.d电子的排布、影响分裂能的因素
3.稳定化能的计算及应用
4.姜太勒效应
5.过渡金属络合物的颜色
6.络合物的几何构型
7.用分子轨道理论说明配合物的成键情况
8.σ-π型配键
三.重点内容
1.晶体场理论,d电子的排布、影响分裂能的因素,稳定化能的计算及应用2.配位场理论,八面体场的分裂,配位场稳定化能及对化合物性质的影响3.姜太勒效应
4.σ-π型配键及配位化合物的结构
四.自学引导
1.由静电作用模型引出晶体场理论,通过d电子轨道分裂引出分裂能、稳定化能及对配合物的结构与性质的解释
2.由分子轨道理论引出配位场理论,通过八面体场的分裂引出配位场稳定化能、姜太勒效应及对化合物性质的解释
3.通过σ-π型配键引出对过渡金属的配位化合物的结构、性质的解释。
五.作业
6.3,6.4,6.5,6.7,6.12,6.14,6.15,6.20, 6.23。
结构化学第6章

(Rx,Ry,Rz) (xy,yz,xz) (x,y,z)
3 0
-1 0
1 2
-1 (2)
6
6 0
8
① 中心原子AO对称性分类,九个AO分属
d: xy, yz, xz —— T2 g d: x2-y2, Z2—— Eg P: x, y, z—— T1u S: —— Ag
2
大多数 6 配位的化合物为八面体结构,Oh 对称性
正八面体 Fe(CN)64 Co(NH3)63+
V(H2O)62+
Oh 对称
性
3
中心离子:价电子层为9个AO,离子在座标轴原点,
则: 4S
4Px, 4Py, 4 Pz
3dx2-y2, 3dz2
在坐标轴 x, y, z方向——σ对称性
在非座标轴方向,夹在两轴间,
-0.8 -1.2
-0.6 0
-0.4
-0.8 -1.2
d1
d2
d3
d8
d9
d10
38
△ P,弱场, HS
>P,强场, LS △ P,弱场, HS 1. 强场轨道能比弱场降低,d4=d7= Δ,d5= d6= 2Δ 2. d6构型最倾向于低自旋 d5半充满。
3. 强, 弱场 d1-d3, d8-d10 构型相同 d4-d7 构型不同
6-2 配位场理论
1
6-2 配位场理论
6-2-1 八面体络合物的MO轨道
杂化轨道理论能说明络合物分子立体构型,
晶体场理论能说明络合物的颜色,磁性;
但不能解释光谱化学序列,羰基络合物,有机烯络合物等;
而且中心离子与配位体间有电子云的重迭,能组成 MO ,
《结构化学第六章》
产生磁性的原因: 物质具有不同的磁性,首先是源于物质内部的电子组
态,即电子在原子轨道和分子轨道上的排布情况;其次是 源于化学成分、晶体结构、晶粒组织和内应力等因素,这 些因素引起磁矩排列的情况不同。
.
物质的磁结构分类:
.
6.6.2 顺磁共振
顺磁共振是研究具有未成对电子的物质,如配合物、 自由基和含有奇数电子的分子等顺次性物质结构的一种重 要方法,它又称为电子顺磁共振(EPR)或电子自旋共振 (ESR)。 原理:
.
三种成键方式(自由基反应):
6.5.3 簇合物的催化性能(自学)
.
6.6 物质的磁性和磁共振
磁性是普遍存在的一种物质属性,任何一种物质材料 都有磁性,只不过表现形式和程度有所不同。物质的磁性 常用磁化率х或磁矩μ表示。磁化率是在外磁场H中物质 磁化强度M和磁场强度H的比值:
M/H
Χ是一个无量纲的量。
因子是为了使δ得到一个便于表达的数值。
对于扫频仪器,δ可以如下表达成
Δ是i 无量v纲 v参的,1由0于6 乘10v6因i v子参v,参所以1单0位6为ppm。
.
影响化学位移的因素: (1)核外电子分布 (2)抗磁各向异性效应 (3)溶剂效应和氢键的影响
.
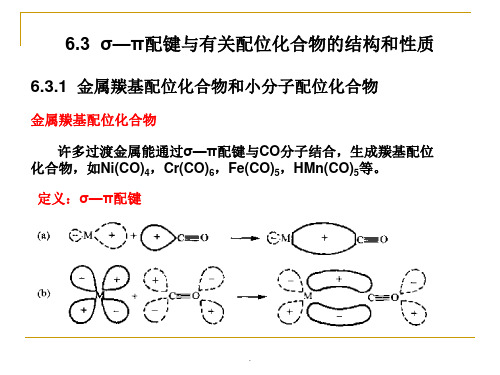
3.磷、砷、锑、铋的三价化合物,如PF3、PCl3、AsCl3、 SbCl3、PR3等也可作为配位体形成σ—π配键。P、As等原子除 有一孤对电子可以作为电子对的供给者,与M形成σ键外,它还 有空的d轨道可和M形成反馈π键,使配位化合物稳定存在,例如 Pd(PF3)4、HCo(PF3)4、Ni(PF3)4、(R3P)4Mo(CO)2等。
.
6.3.2 不饱和烃配位化合物
以不饱和烃为配位体,通过σ—π配键与过渡金属形成的 配位化合物,在石油化工中占有重要地位。
结构化学_第6章_5

↑↓ ↑
10 ↑↓ ↑↓ ↑↓
↑↓ ↑↓
-5P
↑↓ ↑↓ ↑↓
↑↓ ↑↓
LFSE
0 0.4Δo 0.8Δo 1.2Δo 1.6Δo-P 2.0Δo-2P 2.4Δo-3P 1.8Δo-3P 1.2Δo-3P 0.6Δo-3P -3P
表6.2.3 不同d电子组态的LFSE数值(Δo )
若不考虑成对能 ,即可定性解释有关规律(198)
主讲:
配合物中金属原子d电子填入分裂后的d轨道后,若不考 虑成对能,只考虑分裂能,则能量降低的总值称为配合 物稳定化能(LFSE)
主讲:
E (△o) 0.6 0.0 -0.4
弱场
d z2
dx2y2
高自旋配合物 [Fe(H2O)6]3+
[FeF6]3-
△0 < P
dxy
dxz
d yz
主讲:
E (△o) 0.6 0.0 -0.4
向于尽可能多地占据轨道,
形成HS型配位化合物
强配体场下,P < o,电子倾向
于尽可能少地占据轨道,形成
LS型配位化合物
主讲:
表6.2.3 不同d电子组态的能变 (p198)
dn
(HS)弱场
LS(强场)
t2g
e*g
LFSE
t2g
e*g
0
0
1↑
0.4Δo
↑
2 ↑↑
0.8Δo
↑↑
3 ↑↑↑
1.2Δo
↑↑↑
主讲:
6.2 配位场理论
6
主讲:
p197
6.2.3 配位场稳定化能与配合物性质
主讲:
0.6 E (△o)
0.0
《结构化学》第六章 金属的结构和性质

6.2 金属单质的晶体结构
金属单质晶体结构比较简单, 这与金属键密切相关: 由 于金属键没有方向性和饱和性,大多数金属元素按照等径 圆球密堆积的几何方式构成金属单质晶体,主要有立方面 心最密堆积、六方最密堆积和立方体心密堆积三种类型.
6.2.1 等径圆球最密堆积与A1、A3型结构
等径圆球以最密集的方式排成一列(密置列),进 而并置成一层(密置层),再叠成两层(密置双层), 都只有一种方式:
非最密堆积方式中最重要的是立方体心堆积A2 , 还有A4和少数的A6、A7、A10、A11、A12等.
A2 立方体心密堆积
布鲁塞尔的原子球博物馆 9个直径18米的球形展厅构成一个立方体心模型
A4 金刚石型结构
A4中原子以四面体键相连. 晶胞中虽然都是同种原子, 但所处的环境不同(球棍图中用两色颜色来区分). 一个浅蓝 色球与一个深蓝色球共同构成一个结构基元.
A1最密堆积形成立方面心(cF)晶胞
ABCABC……堆积怎么会形成立方面心晶胞? 请来个逆向思维:
取一个立方面心晶胞:
体对角线垂直方向就是密置层, 将它们设成3种色彩:
从逆向思维你已明白, 立方面心晶胞确实满足 ABCABC……堆积。
那么, 再把思路正过来: ABCABC……堆积形成立 方面心晶胞也容易理解吧?
晶胞 六方P
四、 金刚石型晶体(A4型)
C原子的配位数为4, 2套等同点 结构基元:2个C 空间点阵型式:立方F 每个晶胞中有8个C原子, 其坐标分别为:
(0,0,0), (1/2,1/2,0),
(1/2,0,1/2),(0,1/2,1/2),
(1/4,1/4,1/4),(1/4,3/4,3/4),
(为看得清楚,绿 球和蓝球层各有3 个球未画出)
结构化学第6章..

△ = 20300 cm-1
改变配体同样的方法测定可得到不同配体的分裂能
-----光谱化学序列
常见的分裂能见下表 某 些 八 面 体 配 合 物 的 △ 值 ( 波 数
) 构型
3d1 3d2 3d3 4d3 3d4 3d5 3d6 4d6 5d6 3d7 3d8 3d9
中央 离子 Ti3+ V3+ Cr3+ Mo3+ Cr2+ Mn2+ Fe 2+ Rh3+ Ir3+ Co2+ Ni2+ Cu2+
二、d轨道的能级分裂
d轨道角度分布图: y
- + + - -
z
+ - -
z
+ -
x
+
y
+
x
dxy
z
+
- + -
dyz
y -
dxz
+ - + x
x
d z2
d
x2 y2
(1)d轨道能级的分裂
配体所形成的负电场对中心d电子起作用,消除d 轨道的简并。这种现象叫d轨道的能级在配位场中 发生了分裂。 分裂的根源:(1)d轨道具有明显的角度分布。(2)d轨 道所在的配位场不是球形对称的。
而由原dxy上的一对电子占据轨道相当于电子由crco的空轨道这样的键叫反馈键反馈键在crco中既有配键又有反馈键这两种键合在一起称为键亦称电子授受键电子授受配键中心金属和配位体之间配键和反馈键的形成是同时进行的而且配键的形成增加了中心原子的负电荷对反馈键的形成更加有利反馈键的形成则可减少中心原子的负电荷对配键的形成更加有利
(2) 对同一的配体, 分裂能随金属原子的不同而异:
结构化学-第六章

NH2
C
C
O
OO
O
EDTA4-乙二胺四乙酸根
乙二胺en
2020/5/8
5
二. 配位化合物结构理论
价键理论――晶体场理论――分子轨道理论――配位场理论 杂化轨道 静电作用模型 MOT处理配键 配位化合物的
VBT理论T ① 共价配键和d-s-p杂化轨道(低自旋化合物)
A: 当中心离子M固定时, 值随配体而改变
2020/5/8
19
CO≈CN–NO2– 邻蒽菲联吡啶SO32–乙二胺(en)NH3 吡啶 EDTA H2O F–OH– Cl– Br–I–
大者为强场配位体, 小者为弱场配位体。由于通常由光谱 实验确定,故称这个顺序为光谱化学序列(也称配位场强 度序列)。
2020/5/8
12
① 正八面体场
6个配位体,沿x,y,z轴接近金属原子。dz2,dx2- y2与配体的斥 力大,轨道能量上升多;dxy,dxz,dyz与配体的斥力小,轨道 能量上升少 。
接近方式如图:
z
z
z
y
x
y
x
dxz z
dyz
dxy
y
y
x
x
x
dx2-y2
dz2
2020/5/8
13
d轨道分裂为:
❖ 配位体:含有电子的烯、炔、芳香烃,与过渡金属形成配 位化合物
❖ n配位体:一个配体与n个金属原子配位
❖ n配位体:一个配体的 n个配位点与同一个金属原子配位
2020/5/8
4
H
H3C
C
CH3
C
C
O
O
乙酰丙酮
N
N
N
O
结构化学第六章课件

明矾晶体
CHENLI
4
6.1.1 配位体
1.单啮配位体——只有一个配位点的配位体叫单啮配位体,如NH3。
2.非螯合多啮配位体——配位体有多个配位点,但由于配位体本身 几何形状的限制。同一配位体的几个配位点不能直接与同一个金属 离子配位,如PO43-、CO32-等。
3.螯合配位体——一个配位体中的几个配位点能直接和同一个金属 离子配位,称为螯合配位体。
LI
5
4. π键配位体——含有π电子的烯烃、炔烃、芳香烃等类不饱和 烃分子也可作为配位体。这类配位体有露在分子骨架外部的成键 的π电子和空的反键轨道存在。
6.1.2配位化合物结构理论的发展
1.价键理论 配位化合物的价键理论是根据配位化合物的性质,按杂化轨道理论 用和电价配键解释配位化合物中金属离子和配位体间的结合力。 (见下页图)
强场配位体C扩HEN大LIΔ0
14
若只看配位体L中直接配位的单个原子,Δ0值随原子序数增大而 减少,次序为
C N O F S C B l Ir
CHENLI
15
(2)对一定的配位体,Δ0值随M不同而异,其大小次序为
P 4 t I3 r P4 d M 3 o R3 u C 3 oC 3 r F 3 e V 2 C 2 o N 2 iM 2 n
CHENLI
6
杂化轨道和配位化合物的结构
CHENLI
7
2.晶体场理论——是静电作用模型,把中心离子(M)配位体(L) 的相互作用看作类似离子晶体中正负离子的静电作用。当L接近M 时,M中的d轨道受到L负电荷的静电干扰作用,使原来能级简并的 d轨道发生分裂。按微扰理论可计算分裂能的大小,因计算较繁, 定性地将配位体看作按一定对称性排布的点电荷与M的d电子云产 生排斥作用。由于d轨道分布的特点,在晶体场中原来5个能级简并 的d轨道能级发生分裂,引起电子排布及其他一系列性质的变化。
结构化学 第六章-1

一频率v处发生共振; 若扫场, 应在同一磁感强度B处发生
共振。但实验发现, 同一种核的共振频率随化学环境而发 生变化。
原因:分子中的核不是裸核,核外电子云在外磁场B中感
应出一个大小与外磁场成正比而方向相反的微弱磁场 B, 作用在核上的有效磁感强度Beff不等于B, 而是
e是玻尔磁子,g是无量纲因子,称为g因子,自由电子
的g因子ge=2.0023。 自旋磁矩在磁场方向的分量:
sz gms e
1 1 ms , 2 2
在磁场中,自旋磁矩与外 磁场作用,不同方向的磁 矩有不同的能量:
S N S N
E B SZ B gmS e B
峰,-CHO质子峰分裂为四重峰。这是由于分子中距离 相近的质子之间核自旋相互作用的结果,称为自旋耦合。
自旋-自旋耦合使核磁共振信号分裂为多重峰 ——自旋
分裂。
=1.7的CH3峰分裂成三重峰, 3个小峰强度之比为1:2:1,峰 间距离为7Hz; =3.4的CH2峰分裂成四重峰,4个小峰强度 比1:3:3:1,峰间距离7Hz。
B
(3)氢键的影响
溶液中溶剂与溶质可以生成氢键,氢键的形成降低了核 外电子云密度,使增大。
羟基氢 信号移 向低场
4. 核的自旋-自旋耦合作用
具有一定化学位移的质子峰并不一定是单峰,往往会分 裂为数个峰,例如乙醛中有- CH3和-CHO两种质子,
只应有两个单峰,但实际上,- CH3 质子峰分裂为二重
当B=1.4092 T时 v=60×106 Hz =60 MHz
扫频式
扫场式。多数仪器采用扫场式。
1H的核磁矩大,核磁能级分裂大,吸收信号强。1H的天然
第6章 前线分子轨道理论

C2H4+C2H4 → 环丁烯 C2H4的HOMO:π2p
C2H4的LUMO:π*2p HOMO-LUMO对称性不匹配,反应不能发生。
C2H4*: (π2p)2(π*2p)0 → (π2p)1(π*2p)1 C2H4*的HOMO:π*2p
C2H4的LUMO:π*2p 在光照条件下,2+2环加成反应C2H4+C2H4 → 环丁烯可顺利发生。
电负性:Ni 1.8, H 2.15, C 2.6
催化剂镍起了传递电子桥梁作用
Ni的dxz与H2的σ*1s对称性匹配,镍的d电子可流向H2 的σ*1s,从而使H2键削弱,使H2拆开变成2H,吸附在镍 上,成为一种过渡状态。 过渡状态的HOMO仍和C2H4的π*2p(LUMO)对称性匹配, 继而又将电子传递到C2H4的π*2p,削弱C2H4的π键,使 H原子加到C2H4上,加成反应得以顺利进行。 镍上的电子可由对称性匹配的H2的σ1s流到镍的空d 轨道(如dz2)上而得到补充。
1 前线轨道理论
(1) 理论基本要点 进行化学反应时,起决定作用的轨道是前线轨道。 FO对称性必须匹配,HOMO与LUMO必须按照正正或负 负同号重叠,以产生净有效重叠。 互相起作用的HOMO和LUMO,要求能量比较接近。 动方向还应从分子中电负性小的元素移向另一分子的 电负性大的元素,以满足化合条件。
C4H6 ψ2
C2H4+C4H6 → 环已烯
HOMO
LUMO
ψ3
C2H4
HOMO-LUMO对称性匹配,无需光照激发,加热 条件下反应即可发生。
(2) 前线轨道理论应用实例 乙烯加氢反应及镍的催化作用
HOMO
HOMO
C2H4 + H2 = C2H6
LUMO
LUMO
结构化学课件6第六章 配位化合物的结构和性质

八面体场,d轨道分裂成 eg 轨道(dz2 ,dx2-y2), t2g 轨道(dxy ,dxz ,dyz)。 将eg和t2g这两组轨道间的能量差用△o或10Dq来表 示, △o或10 Dq称为分裂能, 根据重心守恒原理, 则
2E(eg)+3E(t2g)=0 E(eg)-E(t2g)=△o 由此解得 E(eg)=0.6△o = 6Dq E(t2g)=-0.4△o =-4Dq
H2[HgI4]
K2[SiF6] K2[Co(SO4)2] [Ag(NH3)2]Cl [CrCl2(NH3)4]· 2H2O Cl· K[PtCl3NH3] [Co(NH3)5H20]Cl3
[Pt(NO2)(NH3)(NH2OH)(Py)]Cl
四碘合汞(ll)酸
六氟合硅(IV)酸钾 二硫酸根合钴(II)酸钾 氯化二氨合银(I) 二水合一氯化二氯四氨合铬(III) 三氯一氨合铂(II)酸钾 三氯五氨一水合钴(III)
K3[Fe(CN)6]
Fe3+:
3d5
µ =2.40
n=1
配合物的空间构型
配合物分子或离子的空间构型与配位数的 多少密切相关。 配位数
4 2 6 4 4 6 2
空间构型 直线形
四面体 平面正方形 八面体
NiCl 2 4
Ni(CN ) 2 4
例
Ag(NH3 ) 2
Fe(CN) 3 6
空间构型 例
[BeX4]2-四面体
Ni2+形成配位数为4的配合物时,既有四面体构型,也有平面正 方形构型的,前者,Ni2+采用的是dsp2杂化,后者,Ni2+采用的 是sp3 杂化。
四 配 位 的 配 平面正方形,μ=0 合 物
四面体,μ=2.83B.M.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二、d轨道的能级分裂
配体所形成的负电场对中心d电子起作用,消除d轨道的简并。
分裂的根源:(1)d轨道具有明显的角度分布。
(2)d轨道所在的配位场不是球形对称的。
1、正八面体配位场(Oh):
在正八面体配合物中,金属离子位于八面体中心,六 个配位体分别沿着三个坐标轴正负方向接近中央离子。
z y 3 2 4 5 6 1 x
四碘合汞(ll)酸 六氟合硅(IV)酸钾 二硫酸根合钴(II)酸钾 氯化二氨合银(I) 二水合一氯化二氯四氨合铬 (III) 三氯一氨合铂(II)酸钾 三氯五氨一水合钴(III) 四硫氰根· 二氨合铬(Ⅲ)酸铵
五、配合物和配体的分类
MLn 称单核配合物
中心原子(离子)M: MmLn 称多核配合物
M—M 称原子簇合物
配位数 5--三角双锥或四方锥形
配位数 6--八面体或三棱柱
表6.1
配位化合物 配位数 [Hg(NH3)2]2+ [Au(CN)2] [CuCN3]2Ni(CO)4 [Zn(NH3)4]2 [Ni(CN)4]2[PtCl4]2Os(CO)5
-
若干配位化合物所采取的几何构型
几何构型 直线型 直线型 平面三角形 四面体 四面体 平面正方形 平面正方形 三角双锥 对称性 配位化合物 配位数 几何构型 对称性 Dh Dh D3h Td Td D4h D4h D3h [Ni(CN)5]3[SbF5]2[CoF6]3- [Fe(CN)6]3Cr(CO)6 [ZrF7]3Re(S2C2Ph2)3 [Mo(CN)8]45 5 6 6 6 7 6 8 三角双锥 四方锥 八面体 八面体 八面体 五角双锥 三棱柱 十二面体 D3h C4v Oh Oh Oh D5h D3h D2d
配位离子的电子组态和几何构型
配位离子 3d
4s
4p
5s
杂化轨道 d2sp3 d2sp3 d2sp3 dsp2 — —
几何形状 八面体 八面体 八面体 平面四方 八面体
Fe(CN)64Co(NH3)63
+
Co(CN)64-
Ni(CN)42FeF63Ni(NH3)62+
八面体
§6. 1.3 配位化合物的晶体场理论 一、晶体场理论(Bethe和Van Vlek)的要点
内界 外界
[Cu(NH3)4]
中心原子 配位原子 配体
SO4
配位数
常见的有2、4、6、8
多啮配体 单啮配体
三、配合物的特点
1. 中 心 原子 M 通 常是 过 渡金属元素的原子 (或离子),具有空 的价轨道。 2. 配位体L则有一对或一对以上孤对电子。
3. M和L之间通过配位键结合,成为带电的配位离子, 配位离子与异性电荷的离子结合,形成配位化合物。 有时中心原子和配位体直接结合成不带电的中性配 位化合物分子。
中心离子的 9 个 价轨道在 Oh 场中分分 属三种不可约表示 (从Oh 点群的特征标 表可查得。)
z
z
z
a1g
y
+ + + +
t1u
y
z
+
+ +
s
x
+ +
y
x
+
y
pz
x
x
-
z
z
eg
+
z
z
y
+
y
+
+
+
x
-
-
y
x
-
x
-
y
+
x
+
px
d z2
z
+
z
++
y
-
x
-
+
-
y
z
y
+
z
+
+
x
y
d x 2 - y2
-
有未成对电子 顺磁性
n(n 2)e
[Fe(H2O)6]2+
=4.9B
=0
n=4 n=0
高自旋
低自旋 配合物结构
[Fe(CN)6]4实验磁矩
未成对电子数
七、 配位化合物的结构
• 几何结构
• 与中心原子的配位数有一定关系,一定的配 位数有其固定的几何构型。
配位数 2--直线形 配位数 3--三角形或T型 配位数 4--正四面体或平面正方形
t2
d
d x2 - y 2
d xy
d z2
e
四面体场 球对称场
t2 g
八面体场
d xz , d yz
正方形场
各种配位场中金属d轨道能级的分裂情况
二、配位体场中d 电子的排布
在自由的过渡金属离子中,五个轨道是简并的, 所以电子在轨道排布时,只能得到一种使体系能量最 低的排布方式; 而在分裂后的能级上填充电子时,电 子的排布方式不只一种。 例如: d 7 电子排布方式: 或
晶体场理论是静电作用模型,把中心离子和配体的相 互作用看作类似离子晶体中正负离子的点电荷静电 作用。中心离子处在配体所组成的场(晶体场)中。
由于d轨道的对称性不同,当L接近M时, 简并的d轨道将发
生能级分裂。由于配体场的对称性不同,发生的能级分裂 也不同。 能级的分裂,引起电子重新排布不同,获得晶体场稳定化能 (CFSE),使配合物的总能量下降
5 1 x 6
2
y
电子轨道等)
将 6 个配体型轨道进行线性组合,可组合出 6 个独立
的与中心离子轨道轨道对称性匹配的群轨道。它们分属的
不可约表示为:a1g+t1u+eg
ns……………… a1g npx.npy,npz… ….t1u (n-1)dx2-y2 , dz2 ..eg dxy, dxz, dyz…… t2g
图 6-1 正八面体及其坐标
d 轨道能级分裂情况:
eg
(d x 2 - y 2 , d z 2 )
Es
自由离子d轨道 球形场
t2g
(d xy , d xz , d yz )
八面体场
10Dq 分裂能 Δ0
分裂能(△o):1个电子从较低能量d轨道跃 迁到较高能量d轨道所需的能量。
则有
E(eg)-E(t2g)=10Dq
四、配位化合物的命名 外界
简单离子 OH-
命名
某化某 氢氧化某
复杂阴离子
内界的命名顺序为:
某酸某
配位体数—>配位体名称—>合—>中心离子(氧化数) •先离子,后中性; •配位原子字母靠前(原子数目少靠前,非配位原子的符号) •先无机后有机
H2[HgI4] K2[SiF6] K2[Co(SO4)2] [Ag(NH3)2]Cl [CrCl2(NH3)4]· Cl· 2H2O K[PtNH3Cl3] [Co(NH3)5H2O]Cl3 (NH4)2[Cr(NH3)2(SCN)4]
3、平面正方形
在平面正方形配合物中,四个配位体沿±x、 ±y方向与中央离子接近
d(x2-y2) dxy
平面正方形中的d(x2-y2)和dxy轨道
dz2
dx2-dy2
dxy
dxz
dyz
d x2 - y 2
d
d xy
d z2 d xz , d yz
球对称场
正方形场
在正方形场中轨道能级的分裂图
eg
化学键理论研究: ①价键理论(VBT)30’s Pauling 杂化轨道思想
②晶体场理论(CFT)
离子型配合物
中心离子
静电作用
配位体
③分子轨道理论(MOT) 核
轨道作用
配位体
6.1.2 配位化合物的结构理论
一、价键理论(VBT)
Pauling 在 20世纪 30年代初提出的配合物价键
理论,他认为核与配体之间的化学键按杂化轨道
配合物的分子轨道理论与晶体场理论不同,考虑 了原子轨道的重叠即共价键的形成,认为:对称性一
致的原子轨道线性组合成配合物的分子轨道 --- 离域
分子轨道。 分子轨道形成过程:
(1) 找出组成配合物分子的各个原子轨道,并按照对称性分类 (2) 根据对称性匹配原则,由原子轨道线性组合成分子轨道, 按分子轨道能级高低构成轨道能级图
2、正四面体(Td):
立方体的中心是金属离子,八个角上每隔一个角上放一 个配位体,即可得正四面体配合物。
d(x2-y2)
dxy
x
x
y
y
可见
配体受dx2-y2,dz2的排斥力小,受dxy,dyz,dzx的排斥 力相对大。在四面体场中d轨道也分裂成两组:
一组 : 二组 :
d ,d ,d d ,d
xy yz x2 - y2 z2
xz
能量较高 记为t 2 能量较低 记为e
可以证明 在其它条件相同时
配体相同及与中心 离子距离相同
4 t o 9
t2
4 t o 9
Es 自由离子d 轨道 球形场
e
四面体场
Td场中d轨道能级的分裂图 可见
在四面体场中,d轨道分裂结果是:相对Es而言,
t2 轨道能量上升了 1.78Dq ,而 e 轨道下降了 2.67Dq 。
(3) 电子遵循能量最低原理、泡利原理、洪特规则逐一填入分
子轨道
一、 ML6八面体配合物的分子轨道 1、 配键的形成 中心金属:ns, npx , npy , pz , (n1)dx2-y2 , dxy ,dxz , dyz 9 个价轨道
3 z 4
6个L:每个至少有 1 个型轨道,
共有 6 个 轨道(一般是配体孤对
