安徽农业大学分析化学(1)答案
安徽大学分析化学2020-2021期末试卷

安徽大学2020-2021学年第一学期分析化学期末考试试卷(B卷)I选择题(15小题×1分=15分)1.分析化学就其性质而言.是一门的科学.A.获取物质的物理性质B.获取物质的化学性质C.获取物质的化学组成与结构信息D.获取物质的性质信息2.以下各项措施中,不能减少系统误差的是.A.进行仪器校准B.做对照试验C.增加平行测定次数D.做空白实验3.等体积混合pH=2.00的HCl和pH=11.00的NaOH溶液所得的溶液pH为.A.2.35B.3.35C.4.35D.5.354.现有50.00mL的某二元酸H2B(已知c(H2B)=0.1000moL/L).用0.1000mol/L NaOH溶液滴定.在加入25.00mL NaOH 溶液后,pH=4.80;加入50.00mL NaOH溶液(即在第一化学计量点)后,pH=7.15,则p K a=.2A.4.8B.9.5C.7.2D.6.05.用0.1000mol/L HCl滴定等浓度的NH3溶液至化学计量点时的质子平衡式为.A.[H+]=[OH–]+[NH3]B.[NH4+]+[H+]=[OH–]C.[H+]=[OH–]+[Cl–]D.[H+]+[NH4+]=[OH–]+[Cl–]6.在pH=5的EDTA缓冲溶液中,以0.02000mol/L EDTA滴定同浓度Pb2+,化学计量点时,pY=.(已知pH=5时lgαY(H)=6.4,lg K PbY=1.80)A.6.8B.7.2C.10.0D.13.27.(1)用0.02mol/L的KMnO4溶液滴定0.02mol/L的Fe2+溶液;(2)用0.02mol/L的KMnO4溶液滴定0.02mol/L 的Fe2+溶液.上述两种情况下其滴定突跃为.A.一样大B.(1)>(2)C.(1)<(2)D.无法判断8.以下银量法需要采用返滴定方式测定的是.A.Mohr法测定Cl–B.吸附指示剂法测定Cl–C.Volhard法测定Cl–D.Mohr法测定Br–9.Mohr法测定Cl–含量时,要求介质的pH值在6.5∼10范围内,若pH超出范围,则会.A.AgCl沉淀不完全B.AgCl吸附Cl–增强C.Ag2CrO4沉淀不易形成D.AgCl沉淀易胶溶10.Ag2CrO4室温下包和溶解度为1.32×10−4mol/L,则其K sp=.A.1.7×10−8B.9.2×10−12C.3.5×10−8D.2.3×10−1211.下列要求中,不属于重量分析对称量形式的要求的是.A.相对摩尔质量要大B.沉淀颗粒要大C.性质稳定D.组成要与化学式完全符合12.相同质量的Fe3+和Cd2+(摩尔质量分别为55.85和112.4),各用显色剂在同样体积溶液中显色,用吸光光度法测定,前者用2cm比色皿,后者用1cm比色皿,测得的吸光度相同,则两有色化合物的摩尔吸光系数:.A.基本相同B.Fe3+约为Cd2+的两倍C.Cd2+约为Fe3+的两倍D.Cd2+约为Fe3+的四倍13.电极电势对判断氧化还原反应的性质非常重要,但它不能判断.A.氧化还原反应的完全程度B.氧化还原能力的大小C.氧化还原反应的方向D.氧化还原反应的反应速率14.水溶液中的Ni2+之所以能被丁二酮肟-CHCl3萃取,是因为在萃取过程中发生下述何种变化?A.Ni2+形成了离子缔合物B.溶液酸度降低了C.Ni2+形成的产物质量增大了D.Ni2+形成的产物中引入了疏水基团15.对于难溶电解质MA,其溶度积为K sp,M和A在溶液中均存在副反应,若其副反应系数分别为αM和αA,则其溶解度可表述为.A.√K spαM B.√K spαA C.√K spαMαA D.√K spαMαAII填空题(20空×1分=20分)16.选择酸碱指示剂的原则是使其变色点的pH处于滴定的范围内,所以指示剂的p K a越接近的pH值,结果就越准确.17.Na2C2O4水溶液的质子平衡式为.18.由于利用化学反应不相同,滴定分析法可分为,,,等四种滴定分析方法;滴定分析法适用于含量组分的测定.19.金属离子与EDTA的绝对稳定常数越大,测定时允许的溶液pH值就越;一般情况下,能准确滴定单一离子M的判别式为.20.在1mol/L H2SO4溶液中,用0.1000mol/L Ce4+标准溶液滴定0.1000mol/L Fe2+时,该滴定的电位突跃范围为到.化学计量点时,电极电位为.已知φ⊖Ce4+/Ce3+=1.44V,φ⊖Fe3+/Fe2+=0.68V.21.KMnO4在强酸介质下被还原为,在强碱性介质中被还原为.III简答题(5小题×6分=30分)22.为什么评价定量分析结果的优劣从精密度和准确度两个方面来衡量?两者是什么关系?如何保证分析方法的准确度?23.在滴定分析中常常使用基准物质,何为基准物质?作为基准物质须符合哪些标准?24.滴定分析对化学反应有哪些要求?25.AgCl沉淀在HCl中的溶解度随HCl的浓度增大时先减小随后又增大,最后超过其在纯水中的溶解度,这是为什么?26.分光光度法是一种重要的定量分析方法,合理选择参比溶液,是准确定量分析的前提.试简要说明,在测量吸光度时,如何选择参比溶液?IV计算题(4小题×10分=40分)27.计算下列各溶液的pH:(1)0.10mol/L NH4Cl;(2)1×10−4mol/L NaCN.已知NH3的K b=1.8×10−5,HCN的K a=6.2×10−10.28.计算CaC2O4:(1)在水中的溶解度;(2)在0.010mol/L(NH4)2C2O4溶液中的溶解度.已知K CaC2O4=2.0×10−9.29.在pH=10.00的氨性缓冲溶液中,以铬黑T(EBT)为指示剂,用0.0200mol/L EDTA滴定同浓度的Zn2+,计算终点误差.已知lg K ZnY=16.5,pH=10.00时,lgαY(H)=0.45,lgαZn(NH3)=5.0,lgαZn(OH)=2.4,pZn ep(EBT)=12.2.30.浓度为25.5µg/50mL的Cu2+溶液,用双环己酮草酰二腙光度法进行测量,于波长600nm处,用2cm吸收池进行测定,测得T=50.5%,求摩尔吸光系数ε和Sandel灵敏度S.已知M Cu=63.5g/mol.。
分析化学试题与参考答案

分析化学试题与参考答案一、单选题(共64题,每题1分,共64分)1.下列因素中,可以使配位滴定的突跃范围变小的是()。
A、增大金属离子的浓度B、增大EDTA的浓度C、增大溶液中H+的浓度D、增大指示剂的浓正确答案:C2.某酸碱指示剂在pH≤4.0时呈红色,pH≥6.0时呈黄色,此弱酸型指示剂常数为()。
A、1.0×10-4B、1.0×10-6C、1.0×105D、1.0×10-5正确答案:D3.用KMnO4法滴定Na2C2O4时,被滴溶液要加热至75.C~85.C,目的是()。
A、赶去氧气,防止诱导反应的发生B、防止指示剂的封闭C、使指示剂变色敏锐D、加快滴定反应的速度正确答案:D4.某基准物A的摩尔质量为500g/mol,用于标定0.1mol/L的B溶液,设标定反应为:A+2B==P,则每份基准物的称取量应为()克。
A、0.1~0.2B、0.2~0.5C、0.5~1.0D、1.0~1.6正确答案:C5.在相同条件下测得标准溶液的吸光度为As,被测液的吸光度为Ax,且2As=3Ax,则被测液的浓度Cx=()。
A、31CsB、32CsC、23CsD、Cs正确答案:B6.高锰酸钾法测定H2O2含量时,调节酸度时应选用()。
A、HAcB、HClC、HNO3D、H2SO4正确答案:D7.分别用K2Cr2O7和KMnO4标准溶液滴定同浓度的亚铁盐溶液,滴定进行到()时,两滴定体系的电极电位相等。
A、滴定至50%B、滴定至100%C、滴定至100.1%D、滴定至150%正确答案:A8.分别用浓度CNaOH=0.1000mol/L和C(KMnO4)=0.02000mol/L的两种标准溶液滴定质量相同的KHC2O4·H2C2O4·2H2O时,消耗两种标准溶液的体积关系为()。
A、4VNaOH=3VKMnO4B、VNaOH=5VKMnO4C、VNaOH=VKMnO4D、3VNaOH=4VKMnO4正确答案:A9.某学生用某一分析天平称取一个试样,若称量总的绝对误差为±0.3mg,则当滴定分析的相对误差要求不大于0.2%时,至少称取试样()才不影响滴定分析的准确度。
分析化学智慧树知到答案2024年安徽中医药大学

分析化学安徽中医药大学智慧树知到答案2024年第一章测试1.分析化学的任务有()A:形态分析 B:定量分析 C:结构分析 D:定性分析答案:ABCD2.下列属于常量分析的是()A:量取的体积为15.26 ml B:测定某样品的含量为35.67% C:称取的质量为0.5823 g D:大气中某污染物浓度为5.6 ppm答案:ABC3.下列属于化学分析法的是()A:滴定分析法 B:光谱分析法 C:重量分析法 D:电化学分析法答案:AC4.分析化学是研究物质的组成、含量、结构和形态等化学信息的分析方法及相关理论的一门科学。
()A:错 B:对答案:B5.以物质的化学反应及其计量关系为基础的分析方法称为化学分析法。
()A:错 B:对答案:B第二章测试1.指出下列各种误差中不属于系统误差的是()A:试剂不纯B:容量瓶与移液管未经过校准C:法码受腐蚀D:滴定时不慎从锥形瓶中溅出一滴溶液答案:D2.在滴定分析中滴定管未经校正属()A:仪器误差B:试剂误差C:操作误差D:方法误差答案:A3.在以下各项措施中,可以消除分析测试中的系统误差的是()A:进行仪器校正B:增加平行测定次数C:增大滴定消耗体积D:增加称样量答案:A4.不管什么物质,称量的绝对误差相等时,它们的相对误差也相同。
()A:对 B:错答案:B5.偶然误差和系统误差均无法消除,但可通过反复多次测量减小这两种误差。
()A:错 B:对答案:A6.准确度与精密度的关系是()A:精密度高,准确度一定高B:准确度高要求精密度一定高C:准确度高,精密度不一定高D:精密度是保证准确度的充分条件答案:B7.从精密度好就可以断定分析结果可靠的前提是()A:系统误差小B:偶然误差小C:相对偏差小D:平均偏差小答案:A8.分析天平每次读数误差为±0.0001 g,在一次称量中需读数2次,为使称量的相对误差要求≤0.1%,则称取的质量至少为()A:0.2000 gB:0.1000 gC:0.0200 gD:1.0000 g答案:A9.精密度是指相同条件下,平行测量的各测量值之间相互接近的程度。
《分析化学》习题参考答案-滴定部分

(2)0.1248 > 0.1238,结果偏高
(3)HCl浓度比真实浓度低,需要消耗更多的HCl,结果偏低
(4)相同质量的碳酸氢钠比碳酸钠消耗的盐酸少,导致消耗盐酸体积减小,盐酸浓度测定值偏高
4、写出下列各体系的质子条件式。
解:(1)NH4H2PO4:
[H+]+[H3PO4]=[OH-]+[HPO42-]+2[PO43-]+[NH3]
终点误差计算略,计算结果相等均为0.03%。
7、解:酚酞做指示剂,消耗盐酸12.00mL,说明试样中有Na3PO4。
Na3PO4+HCl = Na2HPO4+NaCl
8、解:
9、解:只简单提示思路,尿素分子式为CO(NH2)2;每分子尿素能产生2分子能被吸收滴定的NH3。因此滴定剂HCl物质的量为尿素物质的量2倍。
解:①
②
③
④
8、在用氯丁二烯氯化生产二氯丁二烯时,产品中总有少量的三氯丁二烯杂质存在。分析表明,杂质的平均含量为1.60%。改变反应条件进行试生产,取样测定,共取6次,测定杂质含量分别为:1.46%、1.62%、1.37%、1.71%、1.52%及1.40%。问改变反应条件后,产品中杂质百分含量与改变前相比,有明显差别吗?(α=0.05时)
解:HCl+NaOH==NaCl+H2O 2HCl+CaO==CaCl2+H2O
9、解:CaCO3~ 2HCl
10、二元弱酸H2A,已知pH=1.92时,δH2A=δHA-;pH=6.22时,δHA-=δA2-。计算:①H2A的pKa1和pKa2②HA-溶液的pH。
解:①pKa1=1.92,pKa2=6.22
大一分析化学题库及答案

大一分析化学题库及答案引言大一分析化学是大学化学系的一门基础课程,针对化学专业的学生。
此课程主要介绍化学分析的基本原理、方法和技术,培养学生的实验操作能力和问题解决能力。
为了帮助大一化学专业的学生更好地理解和掌握分析化学的知识,下面提供一个大一分析化学题库及其答案。
一、酸碱中和反应题目1. pH值的计算题计算以下溶液的pH值:a)0.01 M的盐酸溶液b)0.05 M的氢氧化钠溶液c)0.001 M的氢氟酸溶液答案:a)pH = -log(0.01) ≈ 2b)pH = 14 + log(0.05) ≈ 12.3c)pH = -log(0.001) ≈ 32. 酸碱反应方程式配平题配平以下酸碱反应方程式:a)HNO3 + KOH → KNO3 + H2Ob)H2SO4 + Mg(OH)2 → MgSO4 + H2O答案:a)2HNO3 + 2KOH → KNO3 + H2Ob)H2SO4 + 2Mg(OH)2 → MgSO4 + 2H2O二、底物与产物的量题目1. 底物的量与产物的量之间的关系题对于以下反应:2A + 3B → 4C + 2D当A的量为0.1 mol,B的量为0.2 mol时,求产物C和D的量。
答案:根据反应方程式的系数,我们可以得知,当2 mol A和3 mol B参与反应时,会产生4 mol C和2 mol D。
因此,当A的量为0.1 mol,B的量为0.2 mol时,产物C的量为0.1 mol × (4 mol C / 2 mol A) = 0.2 mol,产物D的量为0.1 mol × (2mol D / 2 mol A) = 0.1 mol。
2. 底物的浓度、体积与产物的量之间的关系题对于以下反应:2X + 3Y → 4Z + 2W当X的浓度为0.2 mol/L,Y的体积为100 mL时,产物Z的量为0.1 mol。
求W的量。
答案:首先将Y的体积转换为摩尔数,1 L = 1000 mL,所以Y的体积为100 mL = 0.1 L。
分析化学(第六版)课后参考答案-1

分析化学(第六版)课后参考答案(待大家修正完善)目录2 误差及分析数据的统计处理思考题 (1)习题 (3)3滴定分析思考题 (7)习题 (9)4酸碱滴定法思考题 (14)习题 (17)5配位滴定法思考题 (47)习题 (51)6氧化还原滴定法思考题 (56)习题 (61)7重量分析法和沉淀滴定法思考题 (76)习题 (80)8 电位分析法思考题 (87)习题 (91)9 吸光光度法思考题 (98)习题 (101)10 原子吸收光谱法思考题…………………………………………………………………………习题……………………………………………………………………………11气相色谱法和高效液相色谱法思考题 (109)习题 (123)12 波谱分析法简介思考题…………………………………………………………………………习题…………………………………………………………………………13 分析化学中的分离与富集方法思考题 (129)习题 (134)14 定量分析生物的一般步骤思考题 (137)第二章:误差及分析数据的统计处理思考题1.正确理解准确度和精密度,误差和偏差的概念。
答:准确度是测定平均值与真值接近的程度,常用误差大小来表示,误差越小,准确度越高。
精密度是指在确定条件下,将测试方法实施多次,所得结果之间的一致程度。
精密度的大小常用偏差来表示。
误差是指测定值与真值之差,其大小可用绝对误差和相对误差来表示。
偏差是指个别测定结果与几次测定结果的平均值之间的差别,其大小可用绝对偏差和相对偏差表示,也可以用标准偏差表示。
2.下列情况分别引起什么误差?如果是系统误差,应如何消除?(1)砝码被腐蚀;(2)天平两臂不等长;(3)容量瓶和吸管不配套;(4)重量分析中杂质被共沉淀;(5)天平称量时最后一位读数估计不准;(6)以含量为99%的邻苯二甲酸氢钾作基准物标定碱溶液。
答:(1)引起系统误差,校正砝码;(2)引起系统误差,校正仪器;(3)引起系统误差,校正仪器;(4)引起系统误差,做对照试验;(5)引起偶然误差;(6)引起系统误差,做对照试验或提纯试剂。
兰大分析化学课程专业答案

1.电子能级间隔越小,跃迁时吸收的光子的( )能量越大波长越长波数越大频率越高本题分值: 4.0用户得分: 0.0用户解答:能量越大标准答案:波长越长2.当分子中含有1个溴原子时,由同位素提供的M和M+2峰强度比( )4:12:11:13:1本题分值: 4.0用户得分: 0.0用户解答: 4:1标准答案: 1:13.某二元酸H2A的pK a1=1.2,pK a2=4.2。
欲使HA-为主要存在形式,则需要将溶液pH控制在( )小于1.21.2~4.2大于1.2大于5.2本题分值: 4.0用户得分: 4.0用户解答: 1.2~4.2标准答案: 1.2~4.24.下列样品不能用冰醋酸-高氯酸体系滴定的是( )苯酚水杨酸钠磺胺嘧啶邻苯二甲酸氢甲本题分值: 4.0用户得分: 0.0用户解答:水杨酸钠标准答案:苯酚5.αM(L)=1表示( )M与L没有副反应M与L的副反应相当严重。
M的副反应较小[M]=[L]本题分值: 4.0用户得分: 0.0用户解答: M与L的副反应相当严重。
标准答案: M与L没有副反应6.在定量分析中,精密度与准确度之间的关系是( )精密度高,准确度必然高准确度高,精密度必然高精密度是保证准确度的前提准确度是保证精密度的前提本题分值: 4.0用户得分: 0.0用户解答:准确度高,精密度必然高标准答案:精密度是保证准确度的前提7.用纯水将下列溶液稀释10倍,其中pH变化最小的是( )1.0 mol/L NH3.H2O溶液1.0 mol/L HAc溶液1.0 mol/L HCl溶液1.0mol/L HAc + 1.0 mol/L NaAc本题分值: 4.0用户得分: 0.0用户解答: 1.0 mol/L HCl溶液标准答案: 1.0mol/L HAc + 1.0 mol/L NaAc8.配制Na2S2O3时,加入少量Na2CO3的目的是( )作抗氧剂增强Na2S2O3的还原性中和Na2S2O3溶液的酸性防止嗜硫细菌生长和Na2S2O3分解本题分值: 4.0用户得分: 0.0用户解答:作抗氧剂标准答案:防止嗜硫细菌生长和Na2S2O3分解9.色谱法中,常用的定性参数是( )保留值峰高峰宽分配比本题分值: 4.0用户得分: 4.0用户解答:保留值标准答案:保留值10.在pH=0.5时,银量法测定CaCl2中的Cl−合适的指示剂是( )K2CrO4铁铵矾荧光黄溴甲酚绿本题分值: 4.0用户得分: 0.0用户解答:荧光黄标准答案:铁铵矾二多选题1.EDTA与被测离子的反应,如下情况时,可采用返滴定法( )反应速度快缺乏变色敏锐的指示剂反应可趋于完全,反应速度慢生成的配合物不稳定符合滴定分析的要求,且有合适的指示剂某种指示剂对被测离子有封闭现象。
(完整版)分析化学各章节习题(含答案)

第一章误差与数据处理1-1 下列说法中,哪些是正确的?(1)做平行测定的目的是减小系统误差对测定结果的影响。
(2)随机误差影响精密度,对准确度无影响。
(3)测定结果精密度高,准确度不一定高。
(4)只要多做几次平行测定,就可避免随机误差对测定结果的影响。
1-2 下列情况,将造成哪类误差?如何改进?(1)天平两臂不等长(2)测定天然水硬度时,所用蒸馏水中含Ca2+。
1-3填空(1)若只作两次平行测定,则精密度应用表示。
(2)对照试验的目的是,空白试验的目的是。
(3)F检验的目的是。
(4)为检验测定结果与标准值间是否存在显著性差异,应用检验。
(5)对一样品做六次平行测定,已知d1~d5分别为0、+0.0003、-0.0002、-0.0001、+0.0002,则d6为。
1-4用氧化还原滴定法测定纯品FeSO4·7H2O中铁的质量分数,4次平行测定结果分别为20.10%,20.03%,20.04%,20.05%。
计算测定结果的平均值、绝对误差、相对误差、平均偏差、相对平均偏差、标准偏差及变异系数。
1-5有一铜矿样品,w(Cu) 经过两次平行测定,分别为24.87%和24.93%,而实际w(Cu)为25.05%,计算分析结果的相对误差和相对相差。
1-6某试样5次测定结果为:12.42%,12.34%,12.38%,12.33%,12.47%。
用Q值检验法和4d检验法分别判断数据12.47%是否应舍弃?(P = 0.95)1-7某分析人员测定试样中Cl的质量分数,结果如下:21.64%,21.62%,21.66%,21.58%。
已知标准值为21.42%,问置信度为0.95时,分析结果中是否存在系统误差?1-8 在不同温度下测定某试样的结果如下:10℃::96.5%,95.8%,97.1%,96.0%37℃:94.2%,93.0%,95.0%,93.0%,94.5%试比较两组数据是否有显著性差异?(P = 0.95)温度对测定是否有影响?1-9某试样中待测组分的质量分数经4次测定,结果为30.49%,30.52%,30.60%,30.12%。
安徽农业大学分析化学(1)答案

27 单色器
28 吸收池 29 检测器
30 显示器
第 2 页,共 4 页
四、计算题(共 4 题,每题 10 分,共 40 分)
得分 评阅人 1、
ω = 0.6015 + 0.6014 + 0.6018 + 0.6017 + 0.6013 = 0.0.6015......(4分) 5
d = 0 + 0.0001+ 0.0003 + 0.0002 × 2 = 0.00016(0.0002) .....(.. 3分) 5
ω ( H 3 PO 4 )=( cV) NaOH ⋅ M ( H 3 PO 4 ) × m s × 1000
250 .0 ....(. 4分) 25 .00
= 0 .09000 × 20 .20 × 97 .995 = 0.8908 .....(. 3分) 2 .0000 × 1000
第 3 页,共 4 页
第 4 页,共 4 页
提示:请按答案序号将答案填写在对应的表格中,否则无效。
序号
答案
1 4.0
2 8.3
3 纯度高
4 组成恒定
5 性质稳定
6 摩尔质量较大
7 系统误差
8 偶然误差
9 55.6
10 1.00
11 〉
12 酸式色、碱式色颜色不同
13 pH = pKHIn±1 14 氧化态、还原态颜色不同
15 ϕ = ϕo ± 0.0592 n
序号40165208317lgk纯度高18108组成恒定19性质稳定20摩尔质量较大21自身指示剂系统误差22特殊专属指示剂偶然误差23氧化还原指示剂55624mol1lcm11010025lgt1126光源12酸式色碱式色颜色不同27单色器13phpkhin28吸收池14氧化态还原态颜色不同29检测器1530显示器四计算题共4题每题10分共40得分评阅人得分评阅人甲基红为指示剂h10000000972020090002501000cvpo得分评阅人1000200030004001000edtamgpomgnhpo得分评阅人51996300001000
分析化学 第1章 绪论 习题答案

第1章 绪论第一章 概论3.基准试剂主体含量大于99.9%;高纯试剂杂质含量少;专用试剂指在某一特殊应用中无干扰,如光谱纯、色谱纯。
6.标定c (NaOH)=0.05mol ·L -1时,草酸m =0.05×0.025×63=0.08g称量误差r 0.00020.25%0.1%0.08E ==> 而m (邻)=0.05×0.025×204=0.26gr 0.00020.1%0.26E =< ∴选邻苯二甲酸氢钾好。
若c (NaOH)=0.2mol ·L -1,两种基准物都可称小样,都可以。
8.H 2C 2O 4·2H 2O 会失水,使标定的NaOH 结果偏低;测定有机酸的摩尔质量则偏高。
10.Na 2B 4O 7·10H 2O 、B 、B 2O 3和NaBO 2·4H 2O 与H + 的物质的量之比分别是1∶2、2∶1、1∶1和2∶1。
1.1 30.0mL 0.150mol ·L -1的HCl 溶液和20.0mL 0.150mol ·L -1的Ba(OH)2溶液相混合,所得溶液是酸性、中性、还是碱性?计算过量反应物的浓度。
答案:12L 0.015m ol 230.0)(20.030.00.15020.00.1502)过)((Ba(OH)-⋅=⨯+⨯-⨯⨯=量c1.2 称取纯金属锌0.3250g ,溶于HCl 后,稀释到250mL 容量瓶中,计算c (Zn 2+)。
答案:132L 0.01988m ol 250.065.39100.3250)(Zn -+⋅=⨯⨯=⋅=V M m c1.3 欲配制Na 2C 2O 4溶液用于标定KMnO 4溶液(在酸性介质中),已知14L 0.10mol KMnO 51-⋅≈⎪⎭⎫⎝⎛c ,若要使标定时两种溶液消耗的体积相近,问应配制多大浓度(c )的Na 2C 2O 4溶液?要配制100mL 溶液,应称取Na 2C 2O 4多少克? 答案:O 8H 10CO 2Mn 16HO 5C 2MnO 2222424++=++++--⎪⎭⎫⎝⎛=⎪⎭⎫ ⎝⎛4224O C Na 21KMnO 51n n()()42242244O C Na O C Na 21KMnO KMnO 51V c V c ⋅⎪⎭⎫⎝⎛=⋅⎪⎭⎫ ⎝⎛ 若:)O C Na ()KMnO (4224V V ≈ 则:14422L 0.050mol KMnO 5121)O C (Na -⋅=⎪⎭⎫⎝⎛=c c g 67.00.134********.0)O C Na (3422=⨯⨯⨯=-m1.4 用KMnO 4法间接测定石灰石中CaO 的含量(见例1.6),若试样中CaO 含量约为40%,为使滴定时消耗0.020mol ·L -1 KMnO 4溶液约30mL ,问应称取试样多少克? 答案:()g21.0 %10010208.5630020.05%40 %10010CaO 21KMnO KMnO 51CaO)(3344=⨯⨯⨯⨯⨯=⨯⨯⎪⎭⎫ ⎝⎛⋅⋅⎪⎭⎫ ⎝⎛=s s s m m m M V c w1.5 某铁厂化验室常需要分析铁矿中铁的含量。
安徽农业大学有机化学(1)答案
得分 评阅人 四:完成反应式(共 20 空,每空 1 分,共 20 分)
1.
2.
3.
、
4.
、
5.
、
6.
7.
、
8.
、
、
9. D-葡萄糖 、 D-果糖
第2页共4页
10. 得分 评阅人
1.
、
、
五:完成下列转化(无机试剂任选,共 3 小题,每小
学号: 线
安徽农业大学
《 有机化学Ⅱ 》试卷(1 卷) 答题纸及参考答案
考试形式: 闭卷笔试, 2 小时 适用专业:农学,园艺等专业
题号 一 二 三 四 五 六 七 总分 得分
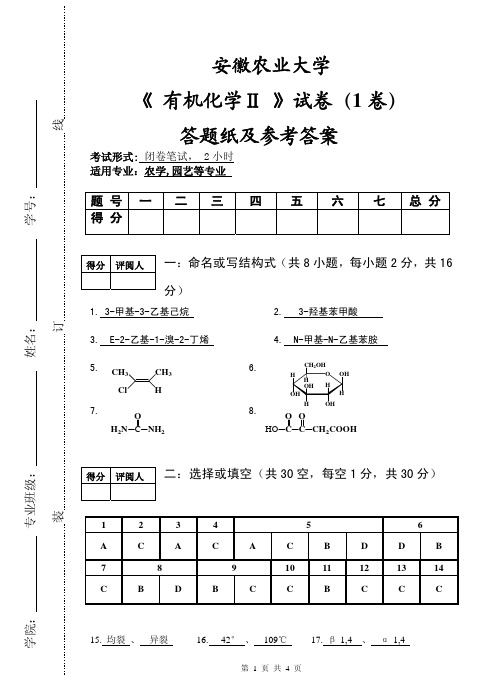
得分 评阅人 一:命名或写结构式(共 8 小题,每小题 2 分,共 16
分)
1. 3-甲基-3-乙基己烷
2. 3-羟基苯甲酸
3. E-2-乙基-1-溴-2-丁烯
4. N-甲基-N-乙基苯胺
5. CH3
CH3
Cl
H
7.
O H2N C NH2
6.
CH2OHHO OH源自HOH HOH
H
8.
H
OH
OO
HO C C CH2COOH
得分 评阅人 二:选择或填空(共 30 空,每空 1 分,共 30 分)
姓名: 订
专业班级: 装
1
2
3
4
题 3 分,共 9 分)
2.
3.
得分 评阅人 1.
六:用简明的化学方法鉴别下列各组化合物(共 3 小 题,每小题 3 分,共 9 分)
2.
3.
第3页共4页
得分 评阅人 七:推导结构式(每一结构式 1 分,共 6 分)
安徽师范大学《分析化学》本科试卷及答案

(3)稳定
(1)
c 时,
4c 时
T = ───── = 75%
100 lgT = 4×lg0.75 T = 32%
T = 0.32
A = 0.49
c 0.4343 0.01 2.7% c 0 . 32 lg 0 . 32 (2)
19. 5 分
w Vc
20. 5 分
0.05000 22.14 176.1 98.1% 0.1988 1000
10 分 称取某含铅锌镁试样 0.4080g, 溶于酸后,加入酒石酸,用氨水调至碱性,加入 KCN, 滴 定时耗去 0.02060mol/L EDTA 42.20mL。 然后加入二巯基丙醇置换 PbY,再滴定时耗去 2+ 0.00765mol/L Mg 标液 19.30mL。最后加入甲醛, 又消耗 0.02060mol/L EDTA 28.60mL 计算 试样中铅、锌、镁质量分数。 [Ar(Pb)=207.2, Ar(Zn)=65.38, Ar(Mg)=24.31]
专业课考研复习资料(最新版)
(知识点汇总-考研重点集合-精准预测再现)
封
面
安徽师范大学 化学分析-考试卷 1
一、选择题 ( 共 9 题 18 分 ) 1. 反 应 2A++ 3B4+ → 2A4++3B2+ 到 达 化 学 计 量 点 时 电 位 是 ---------------------------( ) (A) [ (A) + (B)]/2 (B) [2 (A)+ 3 (B)]/5 (C) [3 (A)+ 2 (B)]/5 (D) 6[ (A) (B)]/0.059 2. 用 K2Cr2O7 滴 定 Fe2+, 在 化 学 计 量 点 时 , 有 关 离 子 浓 度 的 关 系 是 -------------------( ) 3+ 3+ 2+ 2(A) [Fe ] = [Cr ], [Fe ] = [Cr2O7 ] 3+ 3+ 2+ (B) 3[Fe ] = [Cr ], [Fe ] = 6[Cr2O72-] 23+ 3+ 2+ (C) [Fe ] = 3[Cr ], [Fe ] = 6[Cr2O7 ] 3+ 3+ 2+ (D) [Fe ] = 3[Cr ], 6[Fe ] = [Cr2O72-] ) 等 于 3. 对 Ox-Red 电 对 , 25 ℃ 时 条 件 电 位 ( --------------------------------------( ) (A) (B) (C) (D)
分析化学习题解答

分析化学部分答案(第6版)武汉大学高等教育出版社目录C ontent第1章绪论 (3)第2章分析试样的采集与制备 (9)第3章分析化学中的误差及数据处理 (12)第4章分析化学中的质量保证与质量控制 (22)第5章酸碱滴定法 (22)第6章配位滴定法 (41)第7章氧化还原滴定法 (59)第8章沉淀滴定法和滴定分析小结 (76)第9章重量分析法 (78)第10章吸光光度法 (94)第11章分析化学中常用的分离富集方法 (100)注:答案源于网络,不能保证答案的正确性,可借之,阅之,切不可信之,抄之。
第1章 绪论 习题【1-1】称取纯金属锌0.3250g ,溶于HCl 后,定量转移并稀释到250mL 容量瓶中,定容,摇匀。
计算Zn 2+溶液的浓度。
解:已知M Zn =65.39g ·mol -1。
根据溶质Zn 2+物质的量和溶液的体积可以计算Zn 2+溶液的浓度:211Zn 0.3250mol L 0.01988mol L 65.390.250c +--=⋅=⋅⨯【1-2】有0.0982mol/L 的H 2SO 4溶液480mL ,现欲使其浓度增至0.1000mol/L 。
问应加入0.5000mol/L H 2SO 4的溶液多少毫升?解:设应加入0.5000mol/L H 2SO 4的溶液V mL ,稀释前后溶质的质量分数不变,所以 即 解得V =2.16mL 。
【1-3】在500mL 溶液中,含有9.21g K 4Fe(CN)6。
计算该溶液的浓度及在以下反应中对Zn2+的滴定度:3Zn 2+ + 2[Fe(CN)6]4- + 2K + = K 2Zn 3[Fe(CN)6]2解:(1)已知46K Fe(CN)M =368.35g ·mol-1,46K Fe(CN)溶液的物质的量浓度464646K Fe(CN)-1-1K Fe(CN)K Fe(CN)9.21=mol L =0.0500mol L 368.350.500m c M V =⋅⋅⋅(2)滴定度是指单位体积的滴定剂46K Fe(CN)溶液相当于被测物质Zn 2+的质量,根据46K Fe(CN)与被滴定的Zn 2+物质的量之间的关系,可计算出46K Fe(CN)对Zn 2+的滴定度。
分析化学上册总答案

第2章2、为了了解磷肥对水稻生长的影响,若果从某稻田中取一小铲泥样进行测定,试问由此试样所得分析结果有无意义?为什么?答:无意义,这样的分析结果没有代表性。
了解磷肥对水稻生长的影响因素需要对土壤进行分析,土壤的分析内容十分丰富,包括成分分析,肥力分析和污染物分析等。
土壤的组成具有不均匀性,且影响因素十分复杂,为了采得具有代表性的试样,必须多方面考虑。
比如:采样点的布设,采样时间,采样深度,采样量等。
5、已知铝锌矿的K=0.1,a=2。
(1)采取的原始试样最大颗粒直径为30mm,问最少应采取多少千克试样才具有代表性?(2)将原始试样破碎并通过直径为3.36mm的筛孔,再用四分法进行缩分,最多应缩分几次?(3)如果要求最后所得分析试样不超过100克,问试样通过筛孔的直径应为多少毫米?解:(1)K=0.1 a=2 m =Kd a=0.1×(30)2=0.1×900=90kg(2) K=0.1 a=2 m= Kd a=0.1×(3.36)2=1.13kg(90/2n)<1.13 n=6.33故最少缩分6次。
(3) Kd2≧0.1 d=1mm第4章2.指出下列情况下,各会引起哪种误差?如果是系统误差,应该采取什么方法减免?(1)电子天平未经校准;(2)容量瓶何以业管部配套;(3)试剂中含有微量的被测组分;(4)天平的零点有微小波动;(5)滴定时从锥形瓶中溅出一滴溶液;。
(6)标定HCl溶液用的NaOH标准溶液中吸收了CO2答:(1)系统误差中的仪器误差。
减免的方法:校准仪器或更换仪器。
(2)系统误差中的仪器误差。
减免的方法:校准仪器或更换仪器。
(3)系统误差中的试剂误差。
减免的方法:做空白实验。
(4)随机误差。
(5)过失误差。
(6)系统误差中的试剂误差。
减免的方法:做空白实验。
8.下列数据中包括极为有效数字?=4.74 (6)pH=10.00 (1)0.0083 (2)27.160 (3)700.0 (4)7.80 (5) pKa答:(1)2 (2)5 (3)4 (4)3 (5)2 (6)210两位分析者同时测定某一合金中铬的质量分数,每次称取试样均为2.00g,分别报告结果如下:甲:1.02%,1.03%;乙:1.018%,1.024%。
安农大分析化学试卷加答案

B、 基准物质必须满足的条件是 3 、 4 、 5 、 6 。 C、误差按其来源和性质的不同,可分为 7 和 8 。 D、将 55.55 修约为三位有效数字,结果为 9 ;已知c(H+)=0.10 mol·L-1,
则其pH= 10 。 E、Na2C2O4水溶液的pH值 11 (填>、=、<) 7。 F、酸碱指示剂必须满足的条件是 12 ,其理论变色范围是 13 ;
A
D
A
C
C
AD
D
C
B
专业班级: 装
学院:
第 1 页,共 4 页
得分 评阅人 三、填空题(共 30 空,每空 1 分,共 30 分)
提示:请按答案序号将答案填写在对应的表格中,否则无效。
序号
答案
1 4.0
2 8.3
3 纯度高
4 组成恒定
5 性质稳定
6 摩尔质量较大
7 系统误差
8 偶然误差
9 55.6
C、 无要求
D、 在允许误差范围内
3、 浓度为 0.10 mol·L-1的酸碱滴定曲线中,其pH突跃范围是 6.3~4.3,则该
滴定的类型为
A、酸滴定碱
B、氧化剂滴定还原剂
C、碱滴定酸
D、还原剂滴定氧化剂
4、 HCl不能直接准确滴定NaAc(已知Ka(HAc) = 1.8×10-5),主要是因为
大一分析化学试题答案

大一分析化学试题答案分析化学包括化学分析和仪器分析两大部分。
分析化学是化学表征与测量的科学,进入二十一世纪,分析化学已渗透到等诸多领域,分析化学的水平高低已成为衡量国家科学技术水平的重要标志,分析化学在推进人们弄清环境和生命有关的化学问题中起着关键作用。
以下是大一分析化学试题答案,欢迎阅读。
一. 选择(40分)1.定量分析结果的标准偏差代表的是( C )。
A. 分析结果的准确度B. 分析结果的精密度和准确度C. 分析结果的精密度D. 平均值的绝对误差2.下列哪种情况应采用返滴定法( C )。
A. 用AgNO3标准溶液测定NaCl试样含量B. 用HCl标准溶液测定Na2CO3试样含量C. 用EDTA标准溶液测定Al3+试样含量D. 用Na2S2O3标准溶液测定K2Cr2O7试样含量3.下列各项叙述中不是滴定分析对化学反应要求的是( D )。
A. 反应必须有确定的化学计量关系B. 反应必须完全C. 反应速度要快D. 反应物的摩尔质量要大4.下列叙述中错误的是( B )。
A. K2CrO4指示剂法,在溶液pH=12时,用AgNO3标准溶液滴定含Cl-试样,会产生正误差B. 共沉淀、后沉淀和均匀沉淀都会使测定结果产生正误差C. 偶然误差可通过增加测定次数减小D. 在消除系统误差后,精密度高的结果,其准确度一定高5.重量分析法测定0.5126 g Pb3O4试样时,用盐酸溶解样品,最后获得0.4657 g PbSO4沉淀,则样品中Pb的百分含量为( C )。
(已知Pb3O4=685.6,PbSO4=303.26,Pb=207.2)。
A. 82.4%B. 93.1%C. 62.07%D. 90.8%6.用含少量NaHCO3的基准Na2CO3标定盐酸溶液时(指示剂变色点为pH5.1),结果将( D )。
A. 偏低B. 不确定C. 无误差D. 偏高分析:m不变,但消耗盐酸的V减小,由m/M =CV,则C增大7.碘量法测定漂**中有效氯时,其主要成分CaCl(OCl)与Na2S2O3的物质的量比为( B )A. 2:1B. 1: 2C. 1: 1D. 3: 18.磷酸的'pKa1=2.12,pKa2=7.21,pKa3=12.66。
分析化学1B学习通课后章节答案期末考试题库2023年

分析化学1B学习通课后章节答案期末考试题库2023年1.8、0.1mol·L-1NaOH滴定0.1mol·L-1HAC溶液,指示剂应选择参考答案:C酚酞2.以下溶液稀释10倍时,pH改变最大的是 ( )参考答案:(D) 0.1mol/L HCl3.欲配制pH=5.1的缓冲溶液,最好选择 ( )参考答案:(C) 六次甲基四胺(pKb = 8.85)4.某一NaOH和Na2CO3混合液,用HCl溶液滴定,以酚酞为指示剂,耗去HClV1(mL), 继以甲基橙为指示剂继续滴定,又耗去HCl V2(mL),则V1与V2的关系是 ( )参考答案:(D) V1> V25.(已知H3PO4的解离常数pKa1 = 2.12, pKa2 = 7.20, pKa3 = 12.36)参考答案:(C) 9.786.下列数据中有效数字为四位的是 ( ) 。
参考答案:D 0.60007.下列哪种情况应采用返滴定法。
参考答案:C 用 EDTA 标准溶液测定 Al3+ 试样含量8.(4)只要准确度高,不必考虑精密度参考答案:A 1,39.将甲基橙指示剂加到一无色水溶液中,溶液呈黄色,该溶液的酸碱性为 ( )参考答案:(D) 不能确定其酸碱性10.水溶液呈中性是指 ( )参考答案:[H+] = [OH-]11.用50 mL滴定管滴定,终点时正好消耗23 mL滴定剂,正确的记录应为()。
参考答案:C 23.00 mL12.用0.10mol·L-1 NaOH滴定0.10mol·L-1的pKa=4.0的弱酸,其pH突跃是7.0-9.7,用同浓度的NaOH滴定pKa=3.0的弱酸时,其突跃范围是()。
参考答案:B 6.0~9.713.它与金属离子形成配合物显红色,则使用该指示剂的酸度范围是。
参考答案:B pH =6.3~11.614.下列盐的水溶液缓冲作用最强的是 ( )参考答案:(C) Na2B4O7·10H2O15.(已知H3PO4的解离常数pKa1 = 2.12,pKa2 = 7.20,pKa3 = 12.36)参考答案:A. 4.6616.配位滴定中,EDTA 与大部分金属离子形成螯合物时,其螯合比一般为参考答案:A 1:117.试样用量为0.1 ~ 10 mg的分析称为参考答案:微量分析18.将酚酞指示剂加到某无色溶液中,溶液仍无色,表明溶液酸碱性为 ( )参考答案:(D) 不能确定其酸碱性19.在下列各组酸碱组分中,属于共轭酸碱对的是参考答案:HCN- CN-20.在400 mL水中加入6.2 g NH4Cl(忽略其体积变化)和45 mL 1.0 mol/L NaOH溶液, 此混合溶液的pH是多少?参考答案:9.06。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
ω ( H 3 PO 4 )
=
( cV
) NaOH ⋅ M ( H 3 PO 4 ) × m s × 1000
250 .0 ....(. 4分) 25 .00
= 0 .09000 × 20 .20 × 97 .995 = 0.8908 .....(. 3分) 2 .0000 × 1000
第 3 页,共 4 页
1 2 3 4 5 6 7 8 9 10
√
×
√
×
×
×× ×
×
√
得分 评阅人
二、选择题(共 10 小题,每小题 2 分,共 20 分。将 正确答案的选项字母填于对应表格内。单选题)
1 2 3 4 5 6 7 8 9 10
A
D
A
C
C
AD
D
C
B
专业班级: 装
学院:
第 1 页,共 4 页
得分 评阅人 三、填空题(共 30 空,每空 1 分,共 30 分)
27 单色器
28 吸收池 29 检测器
30 显示器
第 2 页,共 4 页
四、计算题(共 4 题,每题 10 分,共 40 分)
得分 评阅人 1、
ω = 0.6015 + 0.6014 + 0.6018 + 0.6017 + 0.6013 = 0.0.6015......(4分) 5
d = 0 + 0.0001+ 0.0003 + 0.0002 × 2 = 0.00016(0.0002) .....(.. 3分) 5
dr = d ×100% = 0.027%(0.03%)..............................................(.. 3分) ω
得分 评阅人 2、
甲基红为指示剂H3PO4+NaOH=NaH2PO4+H2O n(H3PO4) = n(NaOH)………………………………….(3 分)
学号: 线
姓名: 订
安徽农业大学 《 分析化学Ⅱ 》试卷(1 卷)
答题纸及参考答案
考试形式: 闭卷笔试,2 小时 适用专业: 农学,园艺等专业
说明:1、答案请按题号顺序写在本答题卡上,写在试卷上无效。 2、试卷与答题卡同时交上,并分开放好。
题号 一 二 三 1
得分
四 23
总分 4
得分 评阅人
一、是非题(共 10 小题,每小题 1 分,共 10 分。正 确的打√,错误的打×。)
=
0.01000× 40.00× 30.97 0.2000 ×1000
=
0.06194LLLLLLLLL
(3分)
得分 评阅人 4、
6I- + Cr2O72- + 14H+ = 3I2 + 2Cr3+ + 7H2O
I2 + 2S2O32- = 2I- + S4O62∴Cr2O72- ~ 3I2 ~ 6S2O32- ~ 2Cr
第 4 页,共 4 页
得分 评阅人 3、
P → PO43− → MgNH4 PO4 → Mg 2+ → EDTA........) = (cV )EDTA ⋅ M (P) ....................................................(.. 4分) ms ×1000
序号
答案
16 5.20
17 lgKf′= lgKf-lgαY(H)-lgαM(L) 18 c·K ≥10 -8
19
cM Kf,MY′
≥
6
10
20 ϕθ1 — ϕθ2 ≥0.4v
21 自身指示剂
22 特殊(专属)指示剂
23 氧化还原指示剂 24 mol-1·L·cm-1
25 A= - lgT
26 光源
提示:请按答案序号将答案填写在对应的表格中,否则无效。
序号
答案
1 4.0
2 8.3
3 纯度高
4 组成恒定
5 性质稳定
6 摩尔质量较大
7 系统误差
8 偶然误差
9 55.6
10 1.00
11 〉
12 酸式色、碱式色颜色不同
13 pH = pKHIn±1 14 氧化态、还原态颜色不同
15 ϕ = ϕo ± 0.0592 n
…. …. ….….(3 分)
ω (Cr)
=
n(S
O 2−
23
)M
(Cr )
......................................(.. 4分)
3ms
= 0.1000 × 30.00 × 51.996 3×1000 × 0.5000
= 0.1040........................................................(.. 3分)
