有机化学反应的总结
化学有机化学重要反应机理总结

化学有机化学重要反应机理总结一、加成反应(Addition Reactions)1. 羰基加成反应(Carbonyl Addition Reactions)羰基化合物是有机化学中最常见的官能团之一,其重要的加成反应包括以下几种机理:a) 醛、酮的加成反应:醛、酮与亲核试剂(如Grignard试剂、氰化物等)发生加成反应,形成相应醇或醇酮产物。
b) 羰基氧化性加成反应:醛、酮被氧化剂(如过氧化氢、氯化亚铜等)氧化,发生加成反应生成酮酸类产物。
c) 羰基的羧酸衍化反应:醛、酮通过偶联反应与二元N-氯酰亚胺形成羧酸产物。
2. 烯烃的加成反应(Alkene Addition Reactions)烯烃作为另一种重要的有机官能团,也可以发生多种加成反应,包括以下几种机理:a) 烯烃与溴水的加成反应:烯烃与溴水加成生成溴代醇产物,其中水攻击烯烃双键。
b) 烯烃与氢卤酸的加成反应:烯烃与氢卤酸发生加成,生成相应卤代烷产物。
c) 烯烃与水的加成反应:烯烃与水加成生成醇产物,通常需要酸性催化剂存在。
3. 炔烃的加成反应(Alkyne Addition Reactions)炔烃是另一类重要的亲电烯烃,其加成反应机理包括以下几种:a) 炔烃与氢卤酸的加成反应:炔烃与氢卤酸反应生成相应的卤代炔烃产物。
b) 炔烃的亲电型加成反应:炔烃与亲电试剂如卤代烷、单质溴反应,形成相应加成产物。
c) 炔烃的亲核型加成反应:炔烃与亲核试剂如氨、一元胺等反应,形成相应加成产物。
二、消除反应(Elimination Reactions)1. 酸性条件下的β-消除反应(Acidic β-Elimination)酸性条件下的β-消除反应主要是在具有酸性质的化合物中发生,一般包括以下几种机理:a) 酸催化的醇脱水反应:醇在酸性条件下发生脱水反应,生成相应的烯烃醚类产物。
b) 酸催化的脱卤反应:卤代烷在酸性条件下发生脱卤反应,生成相应的烯烃产物。
2. 碱性条件下的β-消除反应(Basic β-Elimination)碱性条件下的β-消除反应主要是在碱性质的化合物中发生,包括以下几种机理:a) 钠乙醇合成反应:醇与钠反应生成相应的醇盐,经过酸性条件下水解,生成烯醇产物。
有机化学方程式最全总结

有机反应方程式总结(一)烷烃1.甲烷与氯气在光照条件下反应生成氯仿:2.烷烃燃烧通式:(二)烯烃1.乙烯的制取:2.乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应:3.乙烯与溴的四氯化碳溶液反应:4.乙烯的催化加氢:5.乙烯的加聚反应:6. 1,3-丁二烯与溴(1:1)的反应:1,4加成:1,2加成:7.丙烯加聚:8. 2-甲基-1,3-丁二烯加聚:9.丙烯与氯气加热条件下反应(α-H的取代):(三)炔烃1.乙炔的制取:2.乙炔与足量溴的四氯化碳溶液反应:3.乙炔制聚氯乙烯:(四)芳香烃1.甲苯与酸性KMnO4溶液反应:2.苯的催化加氢:3.苯与液溴催化反应:4.苯的硝化反应:5.苯的磺化反应:6.甲苯与浓硝酸、浓硫酸的混合酸加热时获得三硝基甲苯:(五)、卤代烃1.溴乙烷在氢氧化钠水溶液中加热反应:2.溴乙烷在氢氧化钠醇溶液中加热反应:3. 2-甲基-2-溴丁烷消去溴化氢:4. 溴乙烷制备丙酸:(六)、醇类1.乙醇与钠反应:2.乙醇的催化氧化:3.乙醇制乙烯:4.乙醇制乙醚:5.乙醇和浓的氢溴酸加热反应制溴乙烷:(七)、酚类1.苯酚与氢氧化钠溶液反应:2.苯酚钠与CO2反应:3.苯酚与溴水反应:4.制备酚醛树脂:(八)、醛类1.乙醛的催化加氢:2.乙醛的催化氧化:3.乙醛与银氨溶液反应:4.乙醛与新制氢氧化铜反应:5.乙醛与HCN溶液反应:(九)、羧酸1.乙酸与乙醇发生酯化反应:2.乙酸与氨气加热条件下发生反应:3.乙酸发生还原反应生成乙醇:4.乙酸与氯气催化剂条件下反应(α-H被取代):5.两分子乳酸脱去两分子水:(十)、酯类1.乙酸乙酯与H2O混合加入稀硫酸水解:2.乙酸乙酯碱性水解:3.油脂的皂化反应(以硬脂酸甘油酯为例) :(十一)、高分子化合物1.苯乙烯合成聚苯乙烯:2.异戊二烯合成聚异戊二烯(天然橡胶):3.甲基丙烯酸甲酯合成聚甲基丙烯酸甲酯(有机玻璃):4.己二酸与己二胺脱水缩合合成纤维聚酰胺-66(尼龙-66):5.乳酸合成聚乳酸6.两分子乳酸成环。
有机化学反应类型总结

有机化学反应类型总结是有机化学领域中最为重要的研究内容之一。
通过,化学家们可以合成新的有机化合物,改变化合物的结构和性质,深入研究有机化合物的各种特性。
本文将对常见的类型进行总结和介绍。
一、取代反应取代反应是有机化学中最基本的反应类型之一。
它发生在有机分子中的一个原子或基团被另一个原子或基团所代替的过程中。
常见的取代反应包括烷基取代、芳香族取代和酰基取代等。
在取代反应中,官能团的性质通常会发生变化,从而使得有机分子的性质也发生相应的改变。
二、加成反应加成反应是指两个或多个分子结合形成一个较大的分子的反应类型。
它通常涉及到有机分子中的双键、三键或其他高度不饱和键的断裂和形成。
加成反应的例子包括烯烃的加成、炔烃的加成和羰基化合物的加成等。
通过加成反应,化学家可以合成出各种各样的有机分子,从而为有机合成提供了广阔的空间。
三、消除反应消除反应是指有机化合物中的一个原子或基团被消除出去,形成新的双键或三键的反应类型。
它通常发生在分子中的邻位或对位上,由于消除反应的进行,有机分子的结构和性质会发生改变。
消除反应的例子包括醇的脱水、脱卤代反应和羟基的消除等。
消除反应在有机合成中也起到了重要的作用,能够合成一些具有特殊结构和性质的有机分子。
四、重排反应重排反应是指有机化合物中化学键的重新排列,形成新的键或断裂原有键的反应类型。
重排反应通常发生在有机分子中的官能团或取代基团周围的各个位置上,由于重排反应的进行,有机分子的结构和性质发生了显著的改变。
常见的重排反应包括烷基重排、芳香族重排和脱氢重排等。
通过重排反应,化学家们可以探索有机分子的结构和反应机理,为有机合成提供了新的思路和方法。
五、环化反应环化反应是指有机分子中的合成反应中形成环状结构的反应类型。
通过环化反应,化学家们可以合成出各种各样的环状有机分子,从而研究和探索有机分子的不同结构和性质。
常见的环化反应包括碳碳键的环化反应、羰基的环化反应和杂环的环化反应等。
有机化学反应总结

一、烷、烯、炔一、烷烃、烯烃、炔烃的结构特征1、烷烃包括开链烷烃和环状烷烃,通式分别为C n H2n+2和C n H2n。
C-C和C-H都是单键。
2、烯烃的结构,烯烃具有一个不饱和度,与单环烷烃是同分异构体。
3、炔烃的结构,炔烃具有两个不饱和度。
二、烷烃、烯烃、炔烃的重要反应1、烷烃:自由基反应机理的卤化取代反应:链的引发、链的增长和链的终止。
注意:a、反应活性:F2、Cl2、Br2、I2,选择性:Br2、Cl2。
b、自由基的稳定性三级、二级、一级、甲基。
所以卤化反应有选择性。
选择性顺序为:叔氢、仲氢、伯氢。
(1)、与X2和HX可发生1,2-和1,4-加成,后者又称为共轭加成。
1,2-加成是速率控制的反应,1,4-加成是平衡控制的反应。
(2)、D-A反应特点:反应是经环状过渡态进行的协同成环反应,具有立体选择性。
而且是反应是可逆的。
在较高温度下,产物经逆反应生成共轭二烯烃和相应的不饱和亲二烯烃。
富电子的共轭二烯和缺电子的亲二烯体有利于正常的D-A反应的进行。
当烯烃双键上连有吸电子的取代基时是有利于反应的进行。
而且在反应完成时,主要生成内型加成产物。
二、芳烃与芳香杂环化合物一、苯的结构、休克尔规则与芳香性1、苯的结构2、休克尔规则与芳香性(1)芳香性的特点a、具有较大的C/H比b、键长趋于平均化c、具有特殊的稳定性的d、难加成e、易取代f、难氧化(2)非苯系芳香性体系要满足休克尔规则要点:a、单环的化合物具有共轭的离域体系b、共平面或近似于平面c、共轭的π电子数符合4n+2规则,n值必须为整数。
3、具有一个杂原子的五元环、六元环芳香杂环呋喃、吡咯、噻吩和吡啶。
一般说来,杂原子与碳原子的电负性愈接近,其相应的五元芳香的杂环的芳香性愈强。
其共轭能力也愈大。
二、芳环上的取代反应1、苯环上的亲电取代反应芳环上的亲电取代反应主要包括卤化、磺化、消化和付-克反应。
反应通式可表示为:2、苯环上的亲核取代反应由于在芳环中π电子云密度相对较大,亲核试剂难于向芳环进攻,发生相应的亲核取代反应。
高中有机化学反应类型的总结

高中有机化学反应类型的总结1、取代反应(1)能发生取代反应的官能团有:醇羟基(-OH)、卤原子(-X)、羧基(-COOH)、酯基(-COO-)、肽键(-CONH-)等。
(2)能发生取代反应的有机物种类如下图所示:2、加成反应1.能发生加成反应的官能团:双键、三键、苯环、羰基(醛、酮)等。
2.加成反应有两个特点:①反应发生在不饱和的键上,不饱和键中不稳定的共价键断裂,然后不饱和原子与其它原子或原子团以共价键结合。
②加成反应后生成物只有一种(不同于取代反应)。
说明:1.羧基和酯基中的碳氧双键不能发生加成反应。
2.醛、酮的羰基只能与H2发生加成反应。
3.共轭二烯有两种不同的加成形式。
3、消去反应(1)能发生消去反应的物质:醇、卤代烃;能发生消去反应的官能团有:醇羟基、卤素原子。
(2)反应机理:相邻消去发生消去反应,必须是与羟基或卤素原子直接相连的碳原子的邻位碳上必须有氢原子,否则不能发生消去反应。
如CH3OH,没有邻位碳原子,不能发生消去反应。
4、聚合反应(1)加聚反应:烯烃加聚的基本规律:(2)缩聚反应:(1)二元羧酸和二元醇的缩聚,如合成聚酯纤维:(2)醇酸的酯化缩聚:此类反应若单体为一种,则通式为:若有两种或两种以上的单体,则通式为:(3)氨基与羧基的缩聚(1)氨基酸的缩聚,如合成聚酰胺6:(2)二元羧酸和二元胺的缩聚:5、氧化反应与还原反应1.氧化反应就是有机物分子里“加氧”或“去氢”的反应。
能发生氧化反应的物质和官能团:烯(碳碳双键)、醇、酚、苯的同系物、含醛基的物质等。
烯(碳碳双键)、炔(碳碳叁键)、苯的同系物的氧化反应都主要指的是它们能够使酸性高锰酸钾溶液褪色,被酸性高锰酸钾溶液所氧化。
含醛基的物质(包括醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等)的氧化反应,指银镜反应及这些物质与新制氢氧化铜悬浊液的反应。
要注意把握这类反应中官能团的变化及化学方程式的基本形式2.还原反应是有机物分子里“加氢”或“去氧”的反应,其中加氢反应又属加成反应。
有机化学反应类型分类总结

有机化学反应类型分类总结1.添加反应:添加反应是将两个或多个反应物加在一起,形成一个产物的反应。
常见的添加反应包括加成反应、加氢反应和加氨反应。
-加成反应:加成反应是通过在双键上添加一个原子团,将互相共享的双电子转化为一对孤立的电子,从而形成单键。
常见的加成反应包括氢化反应、氯化反应和溴化反应。
-加氢反应:加氢反应是指将氢气与一个不饱和化合物反应,生成饱和化合物的反应。
常见的加氢反应包括烯烃加氢、酮烯加氢和醛烯加氢。
-加氨反应:加氨反应是指将氨或其衍生物与一个化合物反应,生成含有氨基的产物的反应。
常见的加氨反应包括亲电加成反应、核磁加成反应和亲核加成反应。
2.消除反应:消除反应是指有机化合物中的一些官能团进行脱离,生成一个小分子(如水、氨、甲醇等)的反应。
常见的消除反应包括脱水反应、脱氨反应和脱卤反应。
-脱水反应:脱水反应是指有机化合物中的羟基(-OH)被脱除,生成一个水分子的反应。
常见的脱水反应包括醇脱水、酸脱水和酮脱水。
-脱氨反应:脱氨反应是指有机化合物中的氨基(-NH2)被脱除,生成一个氨分子的反应。
常见的脱氨反应包括酰胺脱氨、亚胺脱氨和胺脱氨。
-脱卤反应:脱卤反应是指有机化合物中的卤原子(如氯、溴等)被脱除,生成一个卤化氢分子的反应。
常见的脱卤反应包括亲电脱卤、自由基脱卤和亲核脱卤。
3.取代反应:取代反应是指有机化合物中的一个官能团被另一个官能团所取代的反应。
常见的取代反应包括亲电取代、自由基取代和亲核取代。
-亲电取代:亲电取代是指亲电试剂与有机化合物中的亲电中心发生取代反应。
常见的亲电取代包括酰基取代、硫酰基取代和亲电芳香取代。
-自由基取代:自由基取代是指自由基试剂与有机化合物中的自由基发生取代反应。
常见的自由基取代包括卤代烷取代、醇取代和醚取代。
-亲核取代:亲核取代是指亲核试剂与有机化合物中的亲核中心发生取代反应。
常见的亲核取代包括取代基取代、氨取代和烷基取代。
4.重排反应:重排反应是指一个有机化合物中的原子或原团重新排列形成新的化学键的反应。
有机化学反应类型总结

有机化学反应类型总结
有机化学反应类型总结:
1、加成反应:两个有机物之间直接发生化学键形成新的化合物的反应;
2、氧化还原反应:一种物质在受到氧化剂作用后转变为其他物质,而另一种物质则在受到还原剂作用后发生变化的反应;
3、活性碳反应:活性碳作为亲核试剂将有机物中的某些部分分子或原子抽出来的反应;
4、环化反应:将烷基单键两端的原子重新排列成直环状结构的反应;
5、多变性反应:有机物分子中的某些原子或分子结构经过改变而引起衍生物出现的反应;
6、偶联反应:两个有机物之间发生化学键,使原来的物质发生变化的反应;
7、代换反应:有机物中的某些原子或分子结构被其他原子或分子结构所代换而发生变化的反应;
8、水解反应:有机物结构内部的键被水分解而发生变化的反应。
高考化学有机反应类型总结

高考化学有机反应类型总结
高考化学中的有机反应类型是化学考试中的重要考点,也是学生需要掌握的重要知识点。
以下是对高考化学有机反应类型的总结:
一、取代反应
取代反应是有机化学中最常见的反应类型之一,它涉及到有机物分子中的原子或基团被其他原子或基团所取代。
例如,甲烷与氯气在光照条件下发生取代反应,生成氯代甲烷和氯化氢。
二、加成反应
加成反应是烯烃和炔烃与氢气、卤素或卤化氢等发生反应,生成饱和烃或卤代烃的反应。
例如,乙烯与氢气发生加成反应,生成乙烷。
三、消去反应
消去反应是有机化学中另一种常见的反应类型,它涉及到有机物分子中的羟基或卤素原子与相邻的碳原子上的氢原子结合,生成不饱和键的反应。
例如,乙醇发生消去反应,生成乙烯。
四、酯化反应
酯化反应是有机酸和醇发生反应,生成酯和水的反应。
例如,乙酸和乙醇发生酯化反应,生成乙酸乙酯和水。
五、水解反应
水解反应是有机酸或酯等在水中发生分解的反应。
例如,乙酸乙酯在酸性条件下发生水解反应,生成乙酸和乙醇。
六、氧化还原反应
氧化还原反应是有机化学中涉及电子转移的反应,包括氧化和还原两个过程。
例如,烯烃与臭氧发生氧化还原反应,生成醛或酮。
以上是对高考化学有机反应类型的总结,学生需要掌握每种反应类型的概念、原理和实例,以便能够正确理解和应用这些知识。
同时,学生还需要注意不同反应类型之间的联系和区别,以便能够更好地掌握有机化学的知识体系。
大学有机化学反应方程式总结(较全)
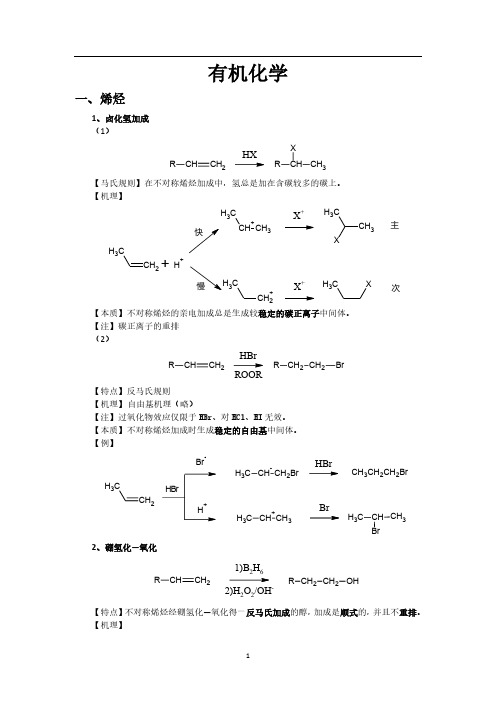
有机化学一、烯烃1、卤化氢加成 (1)CHCH 2RHXCH CH 3RX 【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。
【机理】CH 2CH 3CH +CH 3CH 3X +CH 3CH 3X+H +CH 2+C3X +CH 3X主次【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。
【注】碳正离子的重排 (2)CHCH 2RCH 2CH 2R BrHBrROOR【特点】反马氏规则 【机理】 自由基机理(略)【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。
【本质】不对称烯烃加成时生成稳定的自由基中间体。
【例】CH 2CH3BrCH CH 2BrC H 3CH +CH 3C H 3HBrBrCH 3CH 2CH 2BrCH BrCH 3C H 32、硼氢化—氧化CHCH 2R CH 2CH 2R OH1)B 2H 62)H 2O 2/OH-【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。
【机理】CH2CH 33H 323H 32CH CH 2CH 3HBH 2CH CH=CH (CH 3CH 2CH 2)3-B-H 3CH 2CH 2C22CH 3CH 2B OCH2CH 2CH 3H 3CH 2CH 2CCH 2CH 2CH 3+OH -OHB-OCH 2CH 2CH 3CH 2CH 2CH 3H 3CH 2CH 2OBOCH 2CH 2CH 3CH 2CH 2CH 3OCH 2CH 2CH 3HOO -B(OCH 2CH 2CH 3)3B(OCH 2CH 2CH 3)3+3NaOH3NaOH3HOCH 2CH 2CH 33+Na 3BO 32【例】CH 31)BH 32)H 2O 2/OH-CH 3HH OH 3、X 2加成C CBr/CCl CC BrBr 【机理】CC CC Br BrC CBr +CC Br OH 2+-H +CC Br OH【注】通过机理可以看出,反应先形成三元环的溴鎓正离子,然后亲和试剂进攻从背面进攻,不难看出是反式加成。
有机化学实验总结(五篇范文)

有机化学实验总结(五篇范文)第一篇:有机化学实验总结有机化学实验总结转眼间,短短五周的实验课已经结束了。
现在回想起来,在有机化学实验课上,真的收获了很多。
这些收获也不仅仅是学会了一些基本的化学实验操作,对很多反应和有机物的性质有了更深的理解,更重要的是学会了严谨,学会了提前准备,学会了思考……这些都将在我以后的学习和生活中有很重要的意义。
最重要的一点是严谨,做实验时要做到一丝不苟。
还记得第一次进入实验室看到的情景,整齐的仪器、药品摆放,一尘不染的桌面,还有处理的器材……我深深意识在这个实验室里是不容许有一点马虎的。
做有机实验是要严格按照标准操作来的。
蒸馏、过滤、萃取、干燥……每一个地方都要足够细心,足够严谨,很多时候会做得慢,如果有时候追求速度,就很容易出现反应进行不充分、生成物产率低的情况。
还记得第一次做酯化反应实验时,由于没有注意控制水位,导致无法分析反应是否已经达到限度,加热了很长时间,还没能准确测出生成的水量。
我深深体会到了做有机实验时是一点也马虎不得的。
任何一个失误都有可能对实验结果造成很大的影响。
当然做有机实验时也需要足够的耐心。
还记得做呋喃甲酸和呋喃甲醇合成实验的时候,总共用了三十分钟搅拌反应物,萃取又做了三次,还有每次蒸馏的时候都要时刻注意温度的变化和烧瓶里的变化,不能走神。
这些过程都需要足够的耐心。
当看到自己制备的晶体长的很“好看”时,当得到的产物量“很足”的时候,觉得一切等待都是值得的。
还有很多实验操作是需要慢工出细活的,如果没有足够的耐心,很难做出理想的实验结果。
做有机实验时要提前准备,事先有预习是非常重要的,如果预习了,就会对这个实验有一个初步的了解,知道了实验的一些具体步骤,要准备哪些药品和器材,实验过程中又要注意一些什么问题,只有预习好了,在做实验时才能够得心应手。
当然,在预习中,我们也可能会发现一些问题,有一些不懂的地方,而这些我们都可以把它们标记下来,在老师讲解的时候认真搞懂,或者是带着疑惑去实验探究,这对加深知识点的理解是很有帮助的。
有机化学反应方程式总结氧化还原反应

有机化学反应方程式总结氧化还原反应氧化还原反应是有机化学中最常见的一类反应,也是有机合成和有机化工中重要的反应类型之一。
本文将总结常见的有机化学反应方程式,包括氧化反应和还原反应。
一、氧化反应1. 高价态氧化反应氧可以以不同的氧化态参与反应,其中最常见的是氧气(O2)和过氧化氢(H2O2)。
以下是一些常见的高价态氧化反应方程式:1) 醇氧化反应:醇+ [O] → 醛 + H2O2) 全氧氧化反应:碳氢化合物+ O2 → CO2 + H2O3) 羧酸氧化反应:羧酸+ O2 → 一般产物 + H2O2. 过氧化物氧化反应过氧化物是一类含有氧氧单键(O-O)的化合物,可以在氧化反应中作为氧化剂。
以下是一些常见的过氧化物氧化反应方程式:1) 过氧化氢氧化反应:过氧化氢 + 2H+ + 2e- → 2H2O2) 过氧化苯酚氧化反应:过氧化苯酚+ [O] → 苯醌 + H2O3) 过氧化乙酸氧化反应:过氧化乙酸+ [O] → 乙酸 + CO2 + H2O二、还原反应还原反应是氧化反应的逆过程,即被氧化物失去氧原子或获得氢原子。
以下是一些常见的有机化学还原反应方程式:1. 还原脱氧反应还原脱氧反应是有机化合物中含氧原子的官能团被还原为碳-碳键。
以下是一些常见的还原脱氧反应方程式:1) 脂肪酸还原脱氧反应:脂肪酸+ LiAlH4 → 醇 + Al(OH)32) 酮还原脱氧反应:酮+ NaBH4 → 醇3) 羧酸还原脱氧反应:羧酸+ LiAlH4 → 醇 + Al(OH)32. 氢化还原反应氢化还原反应是有机化合物中含氧或含氮官能团被还原为相应的醇或胺。
以下是一些常见的氢化还原反应方程式:1) 酮氢化反应:酮+ NaBH4 → 醇2) 醛氢化反应:醛+ NaBH4 → 醇3) 羧酸酯氢化反应:羧酸酯+ LiAlH4 → 醇结论:本文总结了有机化学中的氧化还原反应方程式,包括氧化反应和还原反应。
通过对这些反应方程式的了解,我们可以更好地理解氧化还原反应的原理和应用,为有机化学合成和化工工艺的设计提供指导。
有机化学反应总结

二、按反应物和产物的结构关系分类
加成反应:两个或多个分子相互作用,生成一个加成产物的反应称为加成反应。 取代反应:有机化合物分子中的某个原子或基团被其它原子或基团所置换的反应称为取代 反应。 重排反应:当化学键的断裂和形成发生在同一分子中时,会引起组成分子的原子的配置方 式发生改变,从而形成组成相同,结构不同的新分子,这种反应称为重排反应。 消除反应: 在一个有机分子中消去两个原子或基团的反应称为消除反应。可以根据两个消 去基团的相对位置将其分类。若两个消去基团连在同一个碳原子上,称为 1,1-消除或α-消除; 两 个消去基团连在两个相邻的碳原子上,则称为 1,2-消除或β-消除;两个消去基团连在 1,3 位碳原 子上,则称为 1,3-消除或γ-消除。其余类推。 氧化还原反应:有机化学中的氧化和还原是指有机化合物分子中碳原子和其它原子的氧化 和还原,可根据氧化数的变化来确定。氧化数升高为氧化,氧化数降低为还原。氧化和还原总 是同时发生的,由于有机反应的属性是根据底物的变化来确定的,因此常常将有机分子中碳原 子氧化数升高的反应为氧化反应,碳原子氧化数降低的反应为还原反应。有机反应中,多数氧 化反应表现为分子中氧的增加或氢的减少,多数还原反应表现为分子中氧的减少或氢的增加。 缩合反应:将分子间或分子内不相连的两个碳原子连接起来的反应统称为缩合反应。在缩
有机化学反应总结
有机化学反应总结
有机反应:在一定的条件下,有机化合物分子中的成键电子发生重新分布,原有的键断裂, 新的键形成,从而使原分子中原子间的组合发生了变化,新的分子产生。这种变化过程称为有 机反应(organic reaction) 。 一级反应:在动力学上,将反应速率只取决于一种化合物浓度的反应称为一级反应。 二级反应:在动力学上,将反应速率取决于两种化合物浓度的反应称为二级反应。
完全有机化学反应类型小结

完全有机化学反应类型小结有机化学是研究碳及其化合物的学科,其中反应种类繁多。
本文将通过对一些主要的有机化学反应类型的小结,帮助读者了解这些反应的特点和应用。
1. 双键反应双键反应是有机化学中最常见的反应类型之一。
其中,加成反应是通过将两个单体分子的双键上的原子或基团相互连接而形成新的化学键。
典型的加成反应包括烯烃和氢气的加成反应、烯烃和卤素的加成反应以及烯烃和醇的加成反应等。
此外,还有补充反应,即通过在双键上添加一个原子或基团来形成新的化学键。
如醛与水的补充反应、烯烃与氨的补充反应等。
2. 消除反应消除反应是通过将化合物中的两个官能团(通常是氢和卤素或其他官能团)排除,从而形成双键或三键。
典型的消除反应包括醇的脱水反应、醇的脱卤反应和醇的脱酸反应等。
消除反应是有机合成中常用的反应类型之一,可产生新的双键或三键,为合成目标化合物提供重要的途径。
3. 取代反应取代反应是有机化学中另一个重要的反应类型。
在取代反应中,一个官能团被另一个官能团取代。
典型的取代反应有卤代烃的取代反应、醇的取代反应和羧酸的取代反应等。
取代反应是有机合成中广泛应用的反应类型之一,通过合适的取代反应可以合成各种有机化合物。
4. 氧化还原反应氧化还原反应是有机化学中一种重要的反应类型,涉及电子的转移。
在氧化还原反应中,一个物种失去电子被氧化,而另一个物种获得电子被还原。
有机化学中的氧化还原反应通常涉及有机化合物的氧化和还原。
典型的氧化还原反应有醇的氧化、醛的还原以及烯烃的不对称还原反应等。
氧化还原反应在有机合成中具有广泛的应用,可以用于构建碳碳和碳氧化合物的新键。
5. 缩合反应缩合反应是通过两个或多个分子反应形成一个较大的分子。
典型的缩合反应包括醛的缩合反应、酮的缩合反应以及酯的缩合反应等。
缩合反应是一种重要的反应类型,在有机合成中有着广泛的应用。
总结:有机化学反应类型繁多,每种反应都具有独特的特点和应用。
本文对双键反应、消除反应、取代反应、氧化还原反应和缩合反应进行了小结。
有机化学反应知识点总结

有机化学反应知识点总结1.烷烃●氧化●自动氧化●燃烧●异构化●热裂●卤化自由基反应●硝化●磺化氯磺化2.环烷烃●与卤素●自由基取代●加成离子型●与HX●催化加氢●不被氧化3.烯烃●催化氢化顺式加成●亲电加成●卤素环鎓离子中间体反式加成●次卤酸环鎓离子中间体马氏规则●氢卤酸碳正离子中间体(顺反加成,重排)马氏规则反马氏规则●硫酸,水,有机酸,醇,酚碳正离子●硼氢化四中心过渡态→顺式加成 B进攻小空阻→反马氏●氧化(H2O2/OH-/H2O)→醇●还原→烷烃●羟汞化-脱汞Hg(OCOCH3)2,NaBH4 马氏规则●自由基加成HBr 过氧化物 hv●氧化●环氧化-开环→反式邻二醇有机过酸酸/碱●高锰酸钾●稀、冷→顺式邻二醇●酸/碱、加热→氧化裂解●四氧化锇→顺式邻二醇●臭氧化-水解●O3●水解●还原水解→醛/酮Zn/H2O;CH3SCH3;H2/Pd;LiAlH4;NaBH4●α-H卤化自由基取代烯丙位自由基稳定●X2 500-600℃/hv●NBS/NCS●与卡宾反应●单线态卡宾●三线态卡宾●类卡宾●加聚反应4.炔烃●末端炔氢酸性●NaNH2/NH3(i)得到亲核试剂: RX C=O●[Ag(NH3)2]+HCl HNO3 CN-/H2O 还原提纯●[Cu(NH3)2]+●亲电加成●卤素反式(环正离子中间体),马氏规则●HX顺/反式(碳正离子中间体),两侧均为R时反式;马氏规则●H2O马氏规则,烯醇式互变酮式●H2SO4 H3PO4催化碳正离子中间体●Hg2+/H+催化汞鎓离子中间体●硼氢化●氧化H2O2/OH-顺式水合,反马氏●还原●自由基加成过氧化物(链引发剂)●亲核加成端炔C,碳负离子中间体●HCN●活泼氢-OH,-SH,-NH2,=NH,-CONH2,-COOH●还原●催化加氢●强还原剂Pd,Pt,Ni●弱还原剂顺式加成●Lindlar催化剂(Pd-CaCO3-PbO)●Pd-BaSO4,吡啶●碱金属与液氨反式加成●氢化锂铝反式加成●氧化→-COOH●KMnO4●O3/H2O2/Hg2+●聚合●链●环三聚成苯 #5.共轭烯烃●亲电加成●1,2-加成动力学●1,4-加成热力学●Diels-Alder反应周环反应,Δ,可逆给电子基双烯体+吸电子基亲双烯体优亲双烯体顺反构型保持内型产物优先产物取代基邻对位优●聚合反应6.苯●亲电取代定位效应:给诱,吸诱,给共,吸共,卤素加成-消除机理●硝化反应HNO3/H2SO4=1:2●卤化反应X2/Lewis酸 F2,I2特殊反应●磺化反应浓硫酸,发烟硫酸弱酸恢复●Friedel-Crafts反应●傅-克烷基化碳正离子重排多烷基化可逆●RX/AlCl3●RCH=CH2/H+●ROH/HF●傅-克酰基化不可逆,无重排,无多元●RCOCL/AlCl3●(RCO)2O/AlCl3●RCOOH/H2SO4●Blanc氯甲基化HCHO/HCl/无水ZnCl2●Gattermann-Koch反应→芳醛Lewis酸,加压CuCl,CO/HCl(1:1)●还原反应●催化氢化H2,Pt Pd Ni Ru Rb●Birch还原Na/NH3(l)/CH3CH2OH●加成反应3Cl3 Δ/P/hv●氧化反应不为高锰酸钾、重铬酸钾所氧化●O2/V2O5/Δ→顺丁烯二酸酐●苯甲位性质●碳负离子反应●碳正离子反应●SN1取代●SN2取代●自由基反应X2/hv NBS/过氧化物●侧链氧化●强氧化(KMnO4,K2Cr2O7,HNO3)→-COOH含α-H的苯环侧链●温和氧化●Etard反应ArCH3 (CrO2Cl2)→ArCHO●Kornblum反应ArCH2X (DMSO,NaHCO3)→ArCHO●卤苯●与金属有机化合物●芳香亲核取代NaNH2/NH3(l) 苯炔中间体机理(消除-加成机理)●邻对位被吸电子基取代卤苯,卤素易亲核取代7.稠环芳烃●萘●亲电取代●硝化●卤代●磺化●低温α-位动力学●高温β-位热力学●酰基化●CS2溶剂→α-位●C6H5NO2溶剂→β-位●氧化●CrO3/HOAc●O2/V2O5/Δ●H2O2●催化氢化●一取代萘亲电取代定位●蒽、菲活泼,9.10位●亲电取代●催化氢化●氧化→醌8.卤代烃●亲核取代机理:Sn1;Sn2 反应活性●水解→醇●碱●水(溶剂解)●醇解→醚●碱●醇(溶剂解)●氨解●NaHS●NaSR●NaCN延长碳链●RC≡CNa●AgNO3鉴别卤代烃●-CH(COOEt)2●NaX'●β-消除区域选择性(Zaitev规则)立体选择性(反式共平面)机理:E1;E2 反应活性●与金属反应●Mg→格氏试剂●格氏试剂亲核取代偶联反应●格氏试剂与活泼氢反应●H2O●HX●HOR'●HC≡CR'●NH3●R'COOH●格氏试剂与醛、酮反应●格氏试剂与酯反应●格氏试剂与环氧乙烷反应●格氏试剂与CO2反应●格氏试剂与O2反应●NaWurtz反应●Li→有机锂→二烷基铜锂●亲核偶联●与活泼氢●与CO2、O2●还原反应●LiAlH4保留双键●NaBH4保留双键●Zn/HCl●HI●催化氢化●Na/NH3保留双键及构型●氧化反应●DMSO(二甲基亚砜)→R-CHO9.醇●醇羟基上的H 酸性●电离●与碱金属→亲核试剂●与氢氧化钠→亲核试剂●醇羟基上的O●碱性●亲核性——酯化反应●与有机酸加成-消除机理碳正离子机理酰基正离子机理●与含氧无机酸●硝酸●亚硝酸●硫酸●与羧酸衍生物●酰卤●酸酐●胺/氨●酯酯交换●亲核取代●HX机理:SN1,SN2 Lucas试剂及应用邻基参与效应●PX3,PX5重排●SOCl2不重拍●→构型保持●+吡啶→构型翻转●分子间脱水(H2SO4/140℃)低温利SN1●β-消除(H2SO4或HPO3/180℃)分子内脱水,高温利E1●氧化有α-H者●KMnO4/MnO2●稀、冷、中性KMnO4→不反应●酸性/Δ KMnO4●1°R-OH→羧酸●2°R-OH→酮●3°R-OH→裂解成酮●新制MnO2→醛(不饱和键保留)●铬酸●强氧化●Na2Cr2O7+H2SO41°R-OH→羧酸 2°R-OH→酮●温和氧化→醛不饱和键保留●Sareett试剂(CrO3+吡啶)●Jones试剂(CrO3+稀H2SO4)●PCC试剂(CrO3+HCl+吡啶)●硝酸●1°ROH→羧酸●2°ROH,3°ROH→浓硝酸,裂解●环醇→二元酸●Oppenauer氧化Al[OC(CH3)3]3→选择性醇/酮H交换●Pfitzner-Moffatt试剂氧化→醛二甲亚砜+二环己基碳二亚胺●脱氢Cu或CuCrO4或Pd/300℃●多元醇特殊性质●邻二醇●络合金属离子(Cu2+)●氧化邻二醇→断裂为二羰基化合物●H5IO6●Pb(OAc)4/CH3COOH或C6H6●NaIO4●频哪醇重排10.酚●酚羟基●酸性●NaOH●碱性极弱●亲核性较低●酯化催化剂:碱,质子酸●酰卤●酸酐●醚化●Williamson醚合成●RX●CH3OSO2OCH3●CH2NO2●Clainsen重排芳香,脂肪●Fires重排●芳环上亲电取代●卤化●多卤代●单卤代降低温度小极性或非极性溶剂酸性条件次氯酸叔丁酯●磺化●硝化亚硝化●Friedel-Crafts反应●烷基化●酰基化●Reimer-Tiemann反应→邻对位甲酰化(苯甲醛)CHCl3/NaOH/60℃●Kolbe-Schmitt反应→邻对位羧酸NaOH—CO2(高压)—H+●羟甲基化反应→邻对位羟甲基化HCHO/H+●偶联反应→对位偶氮苯ArN2+X-11.醚●自动氧化自由基反应●碱性→佯盐●亲核取代 HIC-O键断裂顺序●Claisen重排●烯基型醚稀酸→醛/酮●1,2-环氧乙烷开环●酸性 SN2机理,SN1区位选择性Nu-多取代C 构型翻转●碱性 SN2机理Nu-小空阻C 构型翻转●冠醚12.醛&酮●羰基亲核加成●含氧亲核试剂●H2O→偕二醇●ROH→半缩醛(酮)→缩醛(酮) [碱与氧化剂稳定,酸不稳定→恢复羰基]催化剂:对甲苯磺酸,HCl●含硫亲核试剂●NaHSO3(过量、饱和)醛脂肪族甲基酮 C8以下环酮●RSH→缩硫醛(酮)H2/NaneyNi→二甲基●Schiff试剂(品红+SO2)●含碳亲核试剂●HCN→α-羟基腈醛脂肪族甲基酮 C8以下环酮●炔化物→α-炔基醇●金属有机化合物→醇一次加成●Witting试剂(磷Ylide)→烯烃●含氮亲核试剂●胺●一级胺→亚胺●二级胺→烯胺●氨●胺衍生物●α-H反应酸性烯醇化→烯醇盐(区位选择)●α-H卤化●酸催化●碱催化●卤仿反应α-甲基酮,α-甲基醇●烷基化 RX●酮(仲胺参与)●醛(亚胺参与)●羟醛缩合(Aldol反应)酸催化碱催化自身缩合定向缩合●Michael加成(1,4-加成)含α-H的醛/酮+α-不饱和醛/酮●Perkin缩合芳香醛+酸酐(酸酐对应盐/Δ)→反式β-芳基-α-不饱和羧酸●Mannich反应含α-H的酮+甲醛+胺●氧化●一般氧化高锰酸钾、重铬酸钾、铬酸、过酸、过氧化氢、氧化银、溴…●醛→羧酸●酮 Null●特殊●醛●自氧化自由基●Fehling试剂(新制氢氧化铜络合物)→羧酸盐+砖红色氧化亚铜醛、α-羟基酮、α-醛酮芳香醛不反应●Tollens试剂(银氨离子)→羧酸盐+银镜●酮●Baeyer-Villiger氧化重排(过酸)迁移顺序●还原●→-C-OH●催化氢化顺式,小空阻侧●氢化金属化合物●LiAlH4C=C、C≡C保留●NaBH4C=C、C≡C保留●B2H6C=O>C=C●Meerwein-Pronndorf-Verley还原(异丙醇铝/异丙醇)C=C、C≡C保留●活泼金属●单分子还原●双分子还原[Mg/苯,Na/NH3(l)]→频哪醇孤立C=C不还原,共轭时优先还原●→-CH2●Clenmmensen还原 Zn-Hg/浓HCl●Wolff-Kishner还原●Wolff-Kishner-黄鸣龙还原C=C、C≡C保留●歧化 Cannizzaro反应(浓OH-)分子间自身,交叉,定向(甲醛总被氧化)分子内●安息香缩合苯甲醛+CN-●Darzen反应酮+XCH2COOR'→环氧化酯→(OH-/H2O,H3O/Δ)多一个碳的醛●聚合反应●不饱和醛、酮●烯酮●羰基的加成(活泼H)互变●格氏试剂●聚合体反应●β-丙内酯开环●酸性中性●碱性,强酸性●α,β-不饱和醛酮●加成反应●1,4-加成氨及其衍生物HX H2SO4 HCN H2O ROH 二烷基铜锂格氏试剂与酮Michael加成●1,2-加成RNa RLi 格氏试剂与醛●3,4-加成X2 H2O●还原●醌●对苯醌●加成●1,2-加成●氮亲核试剂●格氏试剂●1,4-加成HCN,HX,CH3OH,胺●还原●Diiels-Alder反应●羟基取代醛酮●α-OH取代●互变●氧化●与苯肼反应●与H5IO6反应●β-OH取代●脱水●γ/δ-OH取代●分子内亲核取代→环状半缩醛13.羧酸●酸性NaOH,KOH,Na2CO3,NH3·H2O●酰基碳上的亲核取代——酰化●酯化 ROH RX加成-消除碳正离子中间体酰基正离子中间体●与无机酰卤SOCl2 PCl3 PCl5●与氨或胺亦可酸碱反应●氨→互变成腈●胺→脱水缩合●与金属有机化合物●格氏试剂→羧酸镁盐无意义●有机锂→酮●还原●催化氢化●LiAlH4●BH3●脱羧自由基●Kolbe法电解●Hunsdicker反应→R-BrRCOOAg+Br2 (CCl4/Δ)●Cristal反应→R-BrHgO+Br2●Kochi反应●二元羧酸脱水与脱羧Blanc规则●α-H的反应 Hell-Volhard-Zelinsky反应PBr3 一、二、三卤代●不饱和羧酸●α,β-不饱和●1,4-亲核加成●Diels-Alder反应14.取代羧酸●卤代酸●α-X●亲核取代NaOH/H2O,NH3,NaCN/H+●β-X●卤代烃消除●γ,δ,ε -X●内酯化●醇酸●酸性●脱水●α- →半交酯→交酯●β- →消除成烯(共轭)●γ,δ - →内酯(分子内)●>ε- →聚酯(分子间)●与醛反应(亲核加成)●α-醇酸与金属离子→螯合物●降解脱羧,成酮●α-醇酸●稀H2SO4●浓H2SO4●β-醇酸●酚酸●羰基酸●乙醛酸水合●丙酮酸降解●乙酰乙酸●4-戊酮酸●氨基酸●两性与等电点●脱羧●脱水缩合●显色反应●β-酮酸酯●酸性●酮式与烯醇式互变●分解●酮式分解→酯水解稀碱●酸式分解→亲核加成-消除,脱羧浓碱●作为亲核试剂●烃化●酰化●Knoevenagel反应弱碱催化●Micheal加成●乙酰乙酸乙酯合成法●丙二酸二乙酯合成法15.羧酸衍生物●酰基碳上的亲核取代反应性:I>Br>Cl>-OCOOR>-OR>-OH>-NH2>-NHR●水解→羧酸酸性,碱性酰卤>酸酐>酯,易酰胺难●酯水解的机理●亲核加成-消除●碳正离子●酰基正离子●腈→酰胺→羧酸●醇解→酯酰卤>酸酐,易酯>酰胺>腈,难●酯交换反应及应用●氨解→酰胺均易●酸解●与金属有机化合物反应●酰卤●格氏试剂,有机锂→少量得酮,过量得3°ROH●二烷基铜锂→酮●有机镉化物→酮●酯,腈格氏试剂,有机锂→少量得酮,过量得3°ROH●酰胺NH2活泼氢先反应,浪费●酸酐→酮→醇浪费●还原●催化氢化●酰卤●强烈还原——H2/Pd→RCH2OH●温和还原Rosenmund还原——H2/Pd-BaSO4/硫/喹啉→RCHO●酸酐 ..H2/Pd●酯 CuO·CuCrO4,200-300℃,10-30MPa苯环不受影响●酰胺 H2/CuCr氧化物/高温高压●腈 H2/Ni/NH3(l)/高温高压●金属氢化物●酰卤,酸酐,酯→RCH2OH●LiAlH4/乙醚●LiBH4/THF●NaBH4/THF●酰胺 LiAlH4/乙醚●1°→RCH2NH2●2°→RCH2NHR'●3°●氧化剂过量→RCH2CR'R''●氧化剂不过量→RCHO●腈→RCH2NH2LiAlH4●特殊●二元环酐(NaBH4)→内酯●酰卤[ AlLi(t-BuO)3H ]→醛●酯的特殊还原——Bouveault-Blanc还原(Na/ROH)→醛+醇●酰卤专属反应●α-H卤代X2/H+●酯的专属反应●Claisen酯缩合→β-羰基酯C2H5ONa/C2H5OH●混合酯缩合●Dieckmann反应二酸酯(Na/甲苯/C2H5OH)→β-羰基酯环五、六元环稳定●酮酯缩合●酮醇缩合 2酯→β-羟基酮Na/N2,Ph-CH3,Δ●热裂→羧酸+烯400-500℃●Reformatsky反应β-卤代酸酯+醛/酮(Zn)→β-羟基酸酯●酰胺专属性质●酸碱性●脱水→腈P2O5或SOCl2或Δ●Hofmann降级→胺X2/NaOH→NaXO●Gabriel合成法亚酰胺制备伯胺●腈专属反应●水解→酰胺→羧酸●Ritter反应16.有机含氮化合物●胺●脂肪胺●碱性碱性判断分离纯化●酸性LDA制备●亲核性●烷基化(Hofmann烷基化) R-XSN2●酰基化(伯胺,仲胺)●羧酸衍生物——酰卤,酸酐,酯保护氨基,结构鉴定●磺酰氯 Hinsberg反应鉴别结构,分离纯化●亚硝化●叔胺→N-亚硝铵盐●仲胺→N-亚硝胺●伯胺→重氮盐→碳正离子●取代●消除●重排●Tiffeneau-Demjanov重排类似频哪醇●与醛/酮反应●伯胺→亚胺●仲胺→烯胺●还原性●伯胺→亚硝基化合物→硝基化合物●仲胺→羟胺●叔胺→氧化胺●Cope消除β-H的氧化胺Δ→烯烃+羟胺●芳香胺●极弱碱性●芳香亲核取代活化,邻对位改变活性→铵盐改变定位→酰化●卤化→三卤代无cat.●磺化,硝化,酰基化注意N上的H竞争反应●重氮化NaNO2,H+,H2O,0-5℃●伯芳胺→芳香重氮盐●仲芳胺→N-R基-N-亚硝基苯胺●叔芳胺→对亚硝基苯胺●还原性●氨基氧化●1°→硝基化合物●2°→羟胺●3°→氧化胺●苯环氧化复杂醌式结构●MnO2/H2SO4/10℃→醌●季铵盐与季铵碱●制备●Hofmann烷基化●Ag2O/H2O●Hofmann消除Hofmann规则●硝基化合物●脂肪族●还原反应→-NH2●酸性还原系统 Fe/Zn/Sn+HCl●催化氢化●酸性α-H●Henry反应碳负离子与羰基化合物缩合●与亚硝酸反应●1°→硝肟酸+NaOH→红色溶液●2°→假硝醇+NaOH→蓝色溶液●3° null●芳香族●还原→→-NH2●酸性系统→-NH2●中性系统→-NHOHNH4Cl,CH3CH2OH●碱性系统→氧化偶氮苯,偶氮苯,氢化偶氮苯Zn/NaOH●催化氢化●亲电取代钝化,间位定位●亲核取代卤苯亲核取代●重氮化合物●重氮甲烷●碱性●与含活泼氢者反应●亲核性●与醛/酮反应●与酰卤反应 Arndt-Eister合成法●亲电反应●1,3-偶极环加成反应→环丙烷及其衍生物●生成卡宾●芳香族●酸性●亲核取代反应●被OH取代PhN2+SO4H- H2O H+/Δ●被卤素取代●F Schiemann反应●Cl Br●Olah反应●Sandmeger反应CuX●Gattermann反应Cu●IKI/Δ●被CN取代●Sandmeger反应CuCN+KCN●Gattermann反应Cu+KCN●被硝基取代●Gattermann反应NaNO2+H2O+Cu●被H取代●H2PO3+H2O●HCHO+NaOH●还原反应●偶联反应活泼芳环●二烷基芳胺●芳香伯胺、仲胺●酚●偶氮化合物●芳香族●异构化●弱碱性●联苯胺重排●氧化→氧化偶氮苯→对羟基偶氮苯过氧酸 H+●脂肪族●叠氮化合物●还原→-NH3●Curtius重排酰胺叠氮→胺(少一个C)●Schmidt重排●氮烯17.杂环化合物●五元杂环●一个杂原子——吡咯、呋喃、噻吩●芳香性●亲电取代α-位吡咯>呋喃>噻吩●卤代●Br2 Cl2→多卤代●SO2Cl/Et2O/0℃,Br2/环二乙醚/0℃,Br2/AcOH,NBS,NCS→一卤代●噻吩+I2/HgO/苯/0℃→一碘代●磺化吡啶三氧化硫噻吩可直接磺化●硝化乙酰基硝酸酯●偶联芳香重氮盐●傅-克酰基化●傅-克烷基化→混合物●加成●催化加氢●Diels-Alder反应●吡咯特有性质●极弱碱性●酸性与碱反应得N+●N+作为亲核试剂RX, RCOX, CO2/H2O●瑞默尔-悌曼反应→α-醛CHCl3/NaOH●衍生物α-呋喃甲醛●醛●催化加氢●氧化●无α-H的醛●康尼扎罗●安息香缩合●交叉羟醛缩合●Perkin反应●一个杂原子的苯并杂环——吲哚,异吲哚●亲电取代3-位●2个杂原子●咪唑●酸性强于吡咯●碱性强于吡咯●六元杂环●一个杂原子——吡啶●碱性●亲核性N●CH3I●RX●酰卤●SO3●亲电取代β-位●卤代200℃●硝化HNO3/H2SO4/KNO3/300℃●磺化发烟H2SO4/HgSO4/230℃●亲核取代α-位●Chichibabin反应NaNH2/NH3●C6H5Li●3,4-卤代吡啶+氨水/160℃→4-取代●氧化●较苯难氧化●被过氧化物氧化产物取代定位γ-●还原●催化氢化●Na/C2H5OH●侧链α-H缩合反应●芳香醛●CH3I●一个杂原子的苯并杂环——喹啉,异喹啉●亲电取代苯环5,8-位●亲核取代●喹啉 2(主),4-位●异喹啉 1位●氧化还原●侧链α-H18.周环反应●电环化反应●4n●基态Δ→顺旋●激发态hν→对旋●4n+2●基态Δ→对旋●激发态hν→顺旋●环加成反应基态Δ●Diels-Alder反应●1,3-偶极环加成反应●σ迁移反应●[1,j]●H迁移●基态●同面5 9 13(4n+1C)●异面3 7 11 (4n-1C)●激发态●同面 4n-1●异面4n+1●C迁移●基态●构型保持●同面4n+1●异面4n-1●构型翻转●同面4n-1●异面4n+1●激发态●构型保持●同面4n-1●异面4n+1●构型翻转●同面4n+1●异面4n-1 ●[i,j]●[3,3]σ迁移●cope重排●claisen重排。
常见有机化学反应方程式总结

常见有机化学反应方程式总结有机化学是研究碳和其它元素之间的化学反应的科学领域。
有机化学反应方程式描述了有机化合物之间发生的化学变化,是有机化学研究的基本工具。
下面是一些常见的有机化学反应方程式的总结:1. 取代反应(Substitution reactions):-卤素代替反应:R-X+Y→R-Y+X-核磁代替反应:R-H+X→R-X+H2. 加成反应(Addition reactions):-单一加成反应:R=CH2+X-Y→R-CH2-X-Y-烯烃加成反应:R=CH2+H-CH=CH2→R-CH2-CH-CH33. 消除反应(Elimination reactions):-水解反应:R-X+H2O→R-OH+HX-甲醇酯化反应:R-COOH+CH3OH→R-CO-O-CH34. 氧化反应(Oxidation reactions):-伯醇氧化反应:R-CH2-CH2-CH2-OH→R-CH2-CH=CH2-OH-异醛氧化反应:R-CHO+[O]→R-COOH5. 还原反应(Reduction reactions):-烯烃还原反应:R-CH=CH-R→R-CH2-CH2-R-酮还原反应:R-CO-R→R-CH2-R6. 缩合反应(Condensation reactions):-酯缩合反应:R-COOH+R'-COOH→R-COO-R'+H2O-罗宾逊缩合反应:R-CHO+R'-COOH→R-CH=CH-CO-R'7. 加氢反应(Hydrogenation reactions):-炔烃加氢反应:R-CH=CH-R+H2→R-CH2-CH2-R8. 多聚反应(Polymerization reactions):-乙烯聚合反应:nCH2=CH2→-(-CH2-CH2-)n-9. 光化学反应(Photochemical reactions):-阳光下的氯代烃分解反应:R-CH2-Cl→R-CH2•+Cl•10. 还原消除反应(Reductive elimination reactions):-醇酸脱水反应:R-COOH→R-CO•+H2O以上仅是有机化学反应方程式的一小部分,还有许多其他种类的反应。
有机化学反应方程式总结

有机化学反应方程式总结一. 取代反应1.CH4 + Cl2—1:1光照C2H6 + Cl2-1:1光照2. C6H6 + Br2—铁屑3. C2H5OH + HBr--加热4. C6H6+ HNO3--H2SO4 水浴加热7. C2H5Cl + H2O—NaOH8. CH3COOC2H5 + H2O--无机酸8. CH3COOC2H5 + H2O—碱9. (C17H35COO)3C3H5 + 3NaOH →皂化反应二. 加成反应10. CH2=CH2 + H2→Ni加热13. CH2=CH2 + HCl--催化剂,加热14. C2H2 + HCl 1:1--催化剂,加热C2H2 + 2H2-- Ni,加热16. CH2=CH-CH=CH2 + Br2 1,2加成17. CH2=CH-CH=CH2 + Br2 1,4加成18. CH2=CH-CH=CH2 + 2Br2 1,2,3,4加成19. CH3CHO + H2 –Ni20. CH2OH-(CHOH)4-CHO(葡萄糖) + H2 --Ni21. C6H6 + 3H2—Ni23. CH2=CH2 + H2O三. 消去反应24. CH3CH2OH-- 浓H2SO4 ,170℃25. CH3CH2Br + NaOH--醇,加热四. 酯化反应(亦是取代反应)26. CH3COOH + CH3CH2OH-- 浓H2SO4,加热27. C3H5(OH)3 + 3HNO3 --浓H2SO4五. 水解(卤代烃、酯、油脂的水解见上,亦是取代反应)32. CH3CH2ONa + H2O33. C6H5ONa + H2O36. 2(C6H10O5)n(淀粉) + nH2O --H2SO4,加热38. C12H22O11 (蔗糖) + H2O --H2SO439. C12H22O11(麦芽糖)+ H2O -六. 氧化反应41. 2C2H5OH + O2 --Cu或Ag43. 2CH3CHO + O2 →2CH3COOH47. CH3CHO + 2[Ag(NH3)2]OH→48. CH3CHO + 2Cu(OH)2 加热→49.CH2OH(CHOH)4CHO(葡萄糖)+2[Ag(NH3)2]OH→50.CH2OH(CHOH)4CHO+2Cu(OH)2--加热→57. HCHO + 4[Ag(NH3)2]OH →58. HCHO + 4Cu(OH)2 加热→七. 还原反应59. CH3COCH3 + H2 --Ni →60. HCHO + H2 --Ni →61. C6H5CH=CH2 + 4H2 --Ni →八. 加聚反应62. nCH2=CH2 →63. nCH3-CH=CH2 →64. nCH2=CHX →69. nCH2=CH-CH=CH2 →72. nCH2=CH2 + nCH3-CH=CH2 →九. 缩聚反应73. C6H5OH + HCHO---浓HCl,加热→74. HOOC- -COOH + HO-CH2CH2-OH →十. 其他(一)有机物跟钠的反应75. CH3CH2OH + Na76. C6H5OH + Na77. CH3COOH + Na(二)炭化78. C12H22O11 --浓H2SO4 →12C + 11H2O(三)分子间脱水79. 2C2H5OH-- 浓H2SO4,140℃(四)氨基酸的两性。
大学课程-有机化学反应总结

CH3 CH2CHCH3
2、与HX/X2加成时,在含氢最多与含氢最少的位置断键
CH3
+ BHrB2r
CCHH3C3HCCHHB2CrCH3H2CH2Br
Br
CH3
+ HBr
CH3CHCH2CH3
Br
H+总是加在含氢多的碳原子上(马氏规则)
3、取代反应
Cl2 / hv Cl
4、环烷烃常温下与不与高锰酸钾、臭氧反应。
500~6000
CH2CH=CH2 + HCl
Cl
8、烯烃环氧化
CH3 H
CH3 H
CH3CO3H
O
CH3 H
CC
CH3 H
9、烯烃被KMnO4氧化
冷稀,中性或碱性KMnO4
CH3 C2H5
H CH3
KMnO4
10、 烯烃臭氧化
CH3 C2H5
HO
H CH3
OH
O
CH3CCH2CH3 + CH3COOH
COCH2CH3 Zn - Hg
HCl
CH2CH2CH3
6、氯甲基化反应
HCHO,HCl(浓) ZnCl2 60 oC
CH2Cl
7、侧链烃基的氧化
CH3
CH3
KMnO4 H+
COOH COOH
COOH COOH
多环芳烃
4、傅-克酰基化反应
O
+ CH3C
Cl
乙酰氯
AlCl3
O
CH3 + HCl 苯乙酮 97%
O
+ CH3C O AlCl3
CH3C
O CH(CH3)2
5、合+ C成H直3CH链2C烷H2基Cl 苯AlC乙l3酸酐
有机化学反应归纳总结

3、有机化学反应归纳总结
(1)取代反应:有机物分子中的某些原子或原子团被其它原子或原子团所代替的反应。
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
(2)加成反应:有机物分子中未饱和的碳原子跟其它原子或原子团直接结合生成一种新物质的反应。
(3)加聚反应:由不饱和的单体聚合生成高分子化合物的反应
(聚乙烯)
(聚丙烯)
(聚丙烯腈)
(4)氧化反应:有机物燃烧或得氧失氢的反应。
①烃和含碳、氢、氧元素的化合物的燃烧(完全燃烧生成水和二氧化碳,不完全燃烧还会有CO或碳单质和水生成。
)
②烯烃、炔烃、二烯烃等不饱和烃及苯的同系物与酸性KMnO4溶液的反应。
③苯酚在空气中变色反应。
④乙烯的催化氧化
⑤醇的催化氧化
⑥醇的催化氧化
⑦醛的银镜反应和菲林反应
(5)还原反应:有机物失氧得氢的反应。
(与H2加成反应均为还原反应)
(6)消去反应:有机物在一定条件下从一个分子中脱去一个小分子(如H2O、HX、NH3等)生成不饱和化合物的反应。
CH3Cl、CH3OH 、、这些物质不能发生消去反应。
(7)裂化反应:在一定温度下把分子量大、沸点高的长链烃断裂为分子量小,沸点低的短链烃的反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有机化学一、烯烃1、卤化氢加成 (1)CHCH 2RHXCH CH 3RX【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。
【机理】CH 2CH 3CH +CH 3CH 3X +CH 3CH 3+H +CH 2+C3X +CH 3X主次【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。
【注】碳正离子的重排 (2)CHCH 2RCH 2CH 2R BrHBrROOR【特点】反马氏规则 【机理】 自由基机理(略)【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。
【本质】不对称烯烃加成时生成稳定的自由基中间体。
【例】CH 2CH3BrCH CH 2BrC H 3CH +CH 3C H 3HBrBrCH 3CH 2CH 2BrCH CH 3C H 32、硼氢化—氧化CHCH 2R CH 2CH 2R OH1)B 2H 62)H 2O 2/OH-【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。
【机理】2CH33H323H32CH CH2CH32CH CH=CH(CH3CH2CH2)3-H3CH2CH2C22CH3CH2OCH2CH2CH33CH2CH2C2CH2CH3+O H-OHB-OCH2CH2CH3CH2CH2CH3H3CH2CH2B OCH2CH2CH3CH2CH2CH32CH2CH3HOO-B(OCH2CH2CH3)3B(OCH2CH2CH3)3+3NaOH3NaOH3HOCH2CH2CH33+Na3BO32【例】CH31)BH32)H2O2/OH-CH3HHOH3、X2加成C CBr/CClC CBrBr【机理】CCC CBrBrCBr+C CBrOH2+-H+C CBrOH【注】通过机理可以看出,反应先形成三元环的溴鎓正离子,然后亲和试剂进攻从背面进攻,不难看出是反式加成。
不对称的烯烃,亲核试剂进攻主要取决于空间效应。
【特点】反式加成 4、烯烃的氧化1)稀冷高锰酸钾氧化成邻二醇。
3H 33H3稀冷KMnO 433Mn O OO H 2O 3H 33H 3 2)热浓酸性高锰酸钾氧化C C R R 21KMnO 4H +CRR 1O +R 2CO3)臭氧氧化C C H R R 2R 1CRR 1O +R 2CO1)O 32)Zn/H 2O4)过氧酸氧化C C RR 21ROOOH21C C HR R 2R121Ag+O 25、烯烃的复分解反应CH 2RCH 2R 1+催化剂C H 2CH 2RR 1【例】OH 22C 6H 5OC 6H 5+C H 2CH 26、共轭二烯烃 1)卤化氢加成CHCH 2HXCH 3XCH 23X高温1,4加成为主低温1,2加成为主2)狄尔斯-阿德尔(Diels-Alder )反应【描述】共轭二烯烃和烯烃在加热的条件下很容易生成环状的1,4加成产物。
【例】CH 2CH 2+O O苯∆O OCH 2CH 2+苯∆CHO2CHO二、脂环烃1、环丙烷的化学反应【描述】三元环由于张力而不稳定,易发生加成反应开环,类似碳碳双键。
H /Ni CH 2CH 2CH 2CH 2CH 2CH 2CH 2CH 2CH 2CH 2CH 2CH 2H【特点】环烷烃都有抗氧化性,可用于区分不饱和化合物。
【注】遵循马氏规则 【例】CH 3CH 2CH CH 2CH 32、环烷烃制备1)武兹(Wurtz )反应【描述】通过碱金属脱去卤素,制备环烷烃。
【例】C C XX C 2H 5OHCC2XCH 2X 双键的保护2)卡宾①卡宾的生成A 、多卤代物的α消除X 3CH+-C X+X-+HYB 、由某些双键化合物的分解CO H 2C :N 2H 2C :Cl 2H 2C :Cl-C H 2CO C H2N +Cl2C++++CO 2②卡宾与烯烃的加成反应【特点】顺式加成,构型保持 【例】Cl CH/NaOH相转移催化剂Cl Cl CH3CH 3Br CH/KOC(CH )3HOC(CH 3)33H 3③类卡宾【描述】类卡宾是一类在反应中能起到卡宾作用的非卡宾类化合物,最常用的类卡宾是ICH 2ZnI 。
CH2I2Cu(Zn)ICH2ZnI+制备【特点】顺式加成,构型保持【例】CH I3CH3CH I3H3三、炔烃1、还原成烯烃1)、顺式加成R2R1R1R2Cat=[Pb/BaSO4,Pb/CaCO3,Ni3B...] (CH3COO)2NiNaBH4Ni3BH2Cat2)、反式加成R2R1H2CatR12Cat=[Na/ 液氨...]2、亲电加成1)、加X2R2R1Br2R2R1BrBr【机理】中间体Br+R2R1【特点】反式加成2)、加HXCHR2HBrC CH3BrCH3RR HBrR Br(一摩尔的卤化氢主要为反式加成)3)、加H 2OCHRH 2OHgSO 4/H 2SO4O3RCH R重排【机理】CH RC+Hg+RHg2+H 2OR Hg +OH 2+-H+R Hg +H R Hg +HH +O 3R重排【特点】炔烃水合符合马式规则。
【注】只有乙炔水合生成乙醛,其他炔烃都生成相应的酮。
3、亲核加成1)、H 3CH CH+OCH 3Zn(CH 3COO)CH 2CH OCCH 3OCH 3OH+CH 3COOCH 3HCHO H+2维尼纶合成纤维就是用聚乙烯醇甲酯2)、C H CH+HCNNH 4Cl,CuCl 2aqCH 2CNN CH 3C H 3H 3CH 3CNCH 2CN2CH人造羊毛3)、CH CH+C 2H 5OH碱150℃~180℃/压力CH 2CH OC 2H 54、聚合CH CH2Cu 2Cl 2NH 4Cl CH 2CH C CHC H CH3Cu 2Cl 2NH 4ClCH 2CH CHCH2C H CH3金属羰基化合物CH CH3Ni(CN)25、端炔的鉴别C CH R CC -RAgC CH R C C -R CuCu(NH )+Ag(NH )+白色红色【注】干燥的炔银和炔铜受热或震动时易发生爆炸,实验完毕,应立即加浓硫酸把炔化物分解。
6、炔基负离子CC -RNa+1°烷基(2)H 2OR -L(L=X,OTs)R 1:(1)OR 1R 1R 2O(1)(2)H 2OC CR R 1CCRCH 2R 1OHCCRC R 1OH2【例】C H CH NaNH C H C -Na+CH 3C H 3OH OCH COHCH 33H Pb/BaSO 43CH 2CH 3OHAl O 3C2CH 2三、芳烃1、苯的亲电取代反应 1)卤代+FeBr 3Br+BrH Br22)硝化+NO 2+H 2OHNO 3浓H 2SO 4浓3)磺化+SO 3H+H 2OH 2SO( 7%SO 3 )SO 3HH +4)傅-克(Friedel-Crafts )反应①傅-克烷基化反应+RClAlCl 3R【机理】RCl+AlCl 3AlCl 4++R CH 2+RCH 2++HR++HR+++AlCl 4+R++HClAlCl 3【注】碳正离子的重排,苯环上带有第二类定位基不能进行傅-克反应。
【例】+CH 3ClAlCl 3CH 3CH3+CH 3ClH 3CH 3AlCl 3CH 3CH 3CH3CH 2Cl 2+2AlCl3CH 1Cl 3+3AlCl3②傅-克酰基化反应+R Cl AlCl3OR+OO ORRAlCl3OR+RCOOH 【例】CH3CH2COClAlCl3CH3OZn-HgHCl浓CH3+OOAlCl3COOHO2、苯环上取代反应的定位效应1)第一类定位基,邻对位定位基,常见的有:NR2NHR NH2OH HN C ROOR C ROOR Ar X(F,Cl,Br,I)2)第二类定位基,间位定位基,常见的有:NR3NO2CF3Cl3COOH OROCN SO3H CHOCOR【注】第一类定位基除卤素外,均使苯环活化。
第二类定位基使苯环钝化。
卤素比较特殊,为弱钝化的第一类定位基。
3、苯的侧链卤代CH3Feh CH3ClCH3+CH2Cl CH3NBSCH2Br【机理】自由基机理4、苯的侧链氧化1)用高锰酸钾氧化时,产物为酸。
【描述】苯环不易被氧化,当其烷基侧链上有α氢的时候,则该链可被高锰酸钾等强氧化剂氧化,不论烷基侧链多长。
结果都是被氧化成苯甲酸。
CHKMnOH+COOH【例】C CH3CH3C H3CH3KMnOHCCH3CH3CH3COOH2)用CrO3+Ac2O为氧化剂时,产物为醛。
【例】CH3NO2CrO/Ac OCH(OAc)NO2CHONO23)用MnO2为氧化剂时,产物为醛或酮。
CH 3MnO H 2SO 4CHOCH 2CH 3MnO H 2SO 4CH 3O5、萘αβ【特点】萘的亲电取代反应,主要发生在α位,因为进攻α位,形成的共振杂化体较稳定,反应速度快。
【例】HNO 3H 2SO 4NO2Br 2CCl 4BrH2SO4SO3HSO3HCH3HNO3HOAcCH32CH3HNO3HOAcCH3NO2NO2HNO3H2SO4NO2NO2NO22+四、卤代烃1、取代反应(1)水解R XOH-R OHR X R SHSH-(2)醇解RXR OR 1R 1ONaRXR SR 1R 1SNa(3)氰解RR S R1CN -C 2H 5OH(4)氨解RX RNH 2NH 3RXNH 3R 3N(5)酸解RXR1COOR R 1COO -(6)与炔钠反应R X+R 1C C-C CR R 1(7)卤素交换反应RXNaI丙酮R I2、消除反应 (1)脱卤化氢 ①β-消除CH CH 2RClHαβNaOH乙醇RCHCH 2【注】当有多种β-H 时,其消除方向遵循萨伊切夫规律,即卤原子总是优先与含氢较少的β碳上的氢一起消除。
【例】CH 3CH 3BrKOH乙醇CH 3CH 3CH 2CH 3+81%19%CH 3CH 3BrCH 2KOH乙醇CH 3CH 3CH 2C C R1RClH Cl HKOH乙醇CCRR1②α-消除C HCl ClNaOHCCl 2(2)脱卤素C C R R1R3R2Zn,∆乙醇3R 2R R1RCH 2Br 2BrZn ∆R3、与活泼金属反应 (1)与金属镁反应RX+Mg无水乙醚RMgX(格式试剂)(2)与金属钠反应 武兹(Wurtz )反应2RXNaRR(3)与金属锂反应RX+Li无水乙醚RLi2RLi+CuI无水乙醚R 2CuLi2+LiX+LiI【注】二烷基铜锂主要是与卤代烃偶联成烷烃2R1XRR 14、还原反应RX+Zn+HClRH5、氯甲基化+CH OH+ClH ZnCl 2CH 3Cl五、醇1、卢卡斯(Lucas )试剂无水氯化锌与浓盐酸的很合溶液叫卢卡斯试剂,用于鉴别伯、仲、叔醇Lucas 试剂很快反应反应很慢反应很快立即混浊几分钟内混浊长时间不出现混浊叔醇仲醇伯醇2、把羟基变成卤基(1)、醇与卤化磷(PX 5、PX 3)R OHPX 3RX(2)、醇与亚硫酰氯(SOCl 2)R OHRCl SOCl 23、醇的氧化(1)沙瑞特(Sarret )试剂ROH CrO 3(C 5H 5N)2RO【注】沙瑞特试剂,是CrO 3和吡啶的络合物。
