药品持续稳定性考察计划表
稳定性考察方案

稳定性考察方案制定人:日期:审核人:日期:批准人:日期:北京远策药业有限公司目录一、目的二、范围三、职责四、产品介绍五、药品稳定性考察信息表和检测方法依据六、具体方案1.产品批量的选择2.考察条件、时间3.样品测试时限的要求七、稳定性考察报告1.考察报告内容的要求2.偏差处理3.报告的时限要求4.报告程序5.记录管理要求6.档案保存期限一、目的药品的稳定性是指原料药及其制剂保持其物理、化学、生物学和微生物学性质的能力。
稳定性试验的目的是考察原料药、中间产品或制剂的性质在温度、湿度、光线等条件的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件和有效期的确定提供科学依据,以保障临床用药的安全有效。
并且通过持续稳定性考察可以监测在有效期内药品的质量,并确定药品可以或预期可以在标示的贮存条件下,符合质量标准的各项要求。
二、范围适用于公司所有成品及原液的考察。
药品稳定性考察包括:加速试验和长期(持续)稳定性试验。
长期(持续)稳定性考察主要针对市售包装产品,但也需兼顾待包装产品。
例如,当待包装产品在完成包装前,还需要长期贮存时,应当在相应环境条件下,评估其对包装后产品稳定性的影响。
此外,还应考虑到对贮存时间较长的中间产品进行考察。
加速试验主要针对批量放大及上市后变更(如生产设备变更、原辅料变更、工艺调整等)时生产的产品的稳定性试验。
三、职责质量保证部负责药品稳定性考察方案的起草、审核、实施过程的监督、数据的收集与报告的撰写;质量控制部:负责药品稳定性考察的检验工作;质量受权人:负责药品稳定性考察方案及报告的批准。
四、产品介绍:将本年度需要做稳定性考察产品的信息如:产品名称、批号、规格、包装规格、考察数量、生产日期、有效期等详细信息填入《药品稳定性考察信息表》。
如有你有帮助,请购买下载,谢谢!五、药品稳定性考察信息表和检测方法依据表一:药品持续稳定性考察信息表其中:“无菌”检查分别在0月、12月、24月、36月。
GMP药品持续稳定性考察程序(含表格)

文件制修订记录1.0目的:考察原料或产品的性质在温度、湿度、光线等条件的影响下随时间变化的规律,为产品生产、包装、贮存、运输条件和有效期的确定提供科学依据,以保障产品质量。
2.0范围:适用于本公司在研新药的小试、中试,首次商业生产的新产品;经批准进行的有关工艺改进;重要原辅料变更;以及产品包装材料的变更等情况下对产品质量进行的稳定性考察。
3.0职责:本文件由化验室负责起草,化验室主任审核,生产负责人批准,化验室负责实施。
4.0作业内容:4.1稳定性考察原则研发阶段:应进行全面的稳定性实验,以得到注册所需所有数据。
此数据用于证明环境因素对产品特性的影响,以确定包装、储存条件、复验周期和有效期。
已上市阶段:产品上市后,应进行适当的持续稳定性考察,监测已上市产品的稳定性。
4.2稳定性考察分类a.影响因素实验b.加速稳定性实验c.长期稳定性实验d.持续稳定性实验:公司根据法规的要求,同时开展中间产品放置时间稳定性实验。
批量放大及上市后变更(如生产设备变更,原辅料变更,工艺调整等)稳定性实验、以及特殊目的稳定性实验,例如对偏差调查等的支持性实验。
4.3影响因素实验影响因素实验目的是考察制剂处方的合理性与生产工艺及包装条件,供试品用1批进行,将供试品脱去外包装,置适宜的开口容器中进行高温实验、高湿度实验、强光照射实验。
4.3.1高温实验供试品置密封洁净容器中,在60℃条件下放置10天,于第5天和第10天取样,按稳定性重点考察工程进行检测。
如供试品发生显著变化,则在40℃下同法进行实验。
如60℃无显著变化,则不必进行40℃实验。
4.3.2高湿实验供试品置恒温密闭容器中,于25℃,相对湿度为90%±5%条件下放置10天,在第5天和第10天取样,按稳定性重点考察工程进行检测。
检测工程应包括吸湿增重项。
若吸湿增重5%以上,则应在25℃,RH75%±5%下同法进行实验;若吸湿增重5%以下,且其他考察工程符合要求,则不再进行此项实验。
药品稳定性考察方案

药品稳定性考察方案1.考察目的药品的稳定性是指原料药及其制剂保持其物理、化学、生物学和微生物学性质的能力。
考察药物制剂在温度、湿度、光线的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件提供科学依据,同时通过试验建立药品的有效期。
2.考察范围适用于公司所有成品及原液的考察。
药品稳定性考察包括:加速试验和长期(持续)稳定性试验。
长期(持续)稳定性考察主要针对市售包装产品,但也需兼顾待包装产品。
例如,当待包装产品在完成包装前,还需要长期贮存时,应当在相应环境条件下,评估其对包装后产品稳定性的影响。
此外,还应考虑到对贮存时间较长的中间产品进行考察。
加速试验主要针对批量放大及上市后变更(如生产设备变更、原辅料变更、工艺调整等)时生产的产品的稳定性试验。
3.考察依据依据《中国药典》2010版二部附录中《原料药与药物制剂稳定性试验指导原则》进行确认。
4.职责质保部部长负责稳定性考察方案与报告的起草。
质控部人员按照该方案完成实验并报告检验结果。
质保部部长负责检验结果的汇总。
质保部部长负责稳定性考察方案、检验结果、报告的审核。
质量授权人负责稳定性考察方案及报告的批准。
5.产品介绍(将做稳定性考察产品的介绍填在附表)内容:产品名称、代码、考察方法、批号、规格、包装规格、考察数量、生产数量、有效期至6.考察方法6.1加速试验此项实验在加速条件下进行,目的是通过加速药物制剂的化学或物理变化,探讨药物制剂的稳定性,为药品审评、包装、运输及贮存提供必要的资料。
6.1.1供试品要求3批,按市售包装,在温度40℃±2℃、相对湿度75%±5%的条件下放置6个月。
所用设备应能控制温度±2℃,相对湿度±5%,并能对真实温度与湿度进行监测。
在试验期间第1个月、2个月、3个月、6个月末取样一次,按稳定性重点考察项目检测。
6.1.2在上述条件下,如6个月内供试品经检测不符合制订的质量标准,则应在中间条件下即在温度30℃±2℃,相对湿度65%±5%的情况下进行加速试验,时间仍为6个月。
药品稳定性考察方案

药品稳定性考察方案简介药品稳定性考察是指对药物在一定条件下的物理、化学和微生物变化进行评估的过程。
药品稳定性的考察是制药行业中非常重要的一步,能够确保药品在保存期间能够保持其质量和有效性,从而保证患者的安全和药物的疗效。
本文档将介绍药品稳定性考察的方案,包括稳定性研究的目的、研究方法、评估指标等方面的内容。
目的药品稳定性考察的主要目的是评估药物在一定条件下的稳定性,并确定药物的保存期限。
通过稳定性考察,可以有效预测药物品质的变化情况,并为制药企业提供稳定性数据和保存期限的依据。
研究方法稳定性考察可以分为长期稳定性研究和加速稳定性研究两种方法。
长期稳定性研究长期稳定性研究是指在常温、湿度和光照条件下对药物进行一定时间的保存,并经过一定时间间隔进行质量评估。
长期稳定性研究的时间范围通常在2-5年之间,取决于药品的性质和预期的保存期限。
加速稳定性研究加速稳定性研究是通过模拟加速条件,如高温、高湿、光照等,来快速评估药品在一定时间内的质量变化情况。
加速稳定性研究的时间范围通常在3-6个月之间,结果可以用于预测药物在长期储存条件下的稳定性。
评估指标在药品稳定性考察中,有一些常用的评估指标可以用于评估药物的稳定性。
物理稳定性物理稳定性是指药物在保存期间物理性质的变化情况。
包括药物外观、颜色、溶解性、凝胶形成、重金属析出等指标。
这些指标可以通过目测、光谱法、显微镜等方法进行评估。
化学稳定性化学稳定性是指药物在保存期间化学性质的变化情况。
包括主要成分的含量变化、杂质的生成、药物分解等指标。
这些指标可以通过色谱法、质谱法、紫外分光光度法等方法进行评估。
微生物稳定性微生物稳定性是指药物在保存期间微生物附着和生长情况。
微生物的附着和生长可能导致药物的变质和污染。
这些指标可以通过菌落计数方法、微生物染色法等方法进行评估。
结论药品稳定性考察方案对于保证药物的质量和有效性具有重要的作用。
通过稳定性考察,可以有效预测药品在保存期间的变化情况,并为制药企业提供稳定性数据和保存期限的依据。
布洛芬片持续稳定性考察方案

布洛芬片持续稳定性考察方案文件编号:WDX-C6ι-00********有限公司质量部产品持续稳定性考察计划为考察我公司所有生产的布洛芬片的质量稳定性,决定对其进行持续稳定性考察试验,为确保患者能够安全、有效的用药和对品种有效期确定等提供有效的数据。
1产品概述通用名称:布洛芬片汉语拼音:BuIuOfe n Pia n英文名:IbUPrOfe n TabIetS【性状】本品为糖衣片,除去糖衣后显白色【剂型】片剂【包装规格】药用高密度聚乙烯塑料瓶包装,100片/瓶;铝塑包装,12片/板/盒。
【有效期】三年。
【类别】解热镇痛、非甾体抗炎药。
【贮藏】密封保存。
【执行标准】《中国药典》2015年版。
【批准文号】国药准字H37020869。
【适应症】用于缓解轻至中度疼痛如头痛、关节痛、偏头痛、牙痛、肌肉痛、神经痛、痛经。
也可用于普通感冒或流行性感冒引起的发热。
2、考察计划3、样品包装与贮存要求3.1包装要求市售包装3.2贮存要求存放在稳定性试验箱内,温度25 ± 2 C,相对湿度:60%± 10%4、检测项目要求5、检测时间要求5.1.样品测试时间要求分别于O月、3月、6月、9月、12月、18月、24月、36月、48月进行考察5.2.样品测试时限要求样品贮存管理人员应在理论检测日的前两天的早上将样品取出交于检测人员,检测人员应在样品理论检测日后两天完成样品的所有检验工作。
理论检测日期为产品生产日期加时间间隔。
样品贮存人员应提前一个月制定稳定性考察样品检测计划,经QC主管批准后,交检验人员准备。
6异常处理要求6.1.贮存环境异常情况6.1.1设备及设施故障用于保证稳定性样品贮存的设备发生故障时,样品贮存管理人员应立即通知设备管理和维修人员到现场确认,制定设备维修方案,明确设备维修时间,并给设备贴“设备故障”状态标识。
确认设备无法在短时间内修复时,应采取以下应急措施:(1)启动备用设备(2)委托具备贮存条件的企业临时为我公司贮存样品。
中药饮片稳定性考察计划.

中药饮片质量稳定性考察计划起草:日期:审核:日期:批准:日期:中药饮片质量稳定性考察计划一、概述药品的稳定性是指原料药及制剂保持其物理、化学、生物学和微生物学性质的能力。
中药饮片稳定性研究目的是考察饮片性质在中国药典等法规规定的温度、湿度等储存条件的下随时间变化的规律,为中药饮片的生产、包装、贮存、运输条件和有效期的确定提供科学依据,以保障中药饮片的安全有效。
根据《稳定性试验考察管理制度》,结合2012年生产炮制类别和品种以及2010版GMP规定,本计划选取净制、切制、炮炙三种炮制类别的每个生产品种的一批产品作为中药饮片的稳定性考察对象,本计划中包括净制、切制、炮炙(炒、煅)的工艺流程图,试验方案、检验方法和检验周期及试验频次、考查项目、稳定性的评价以及对本计划执行过程中的记录和报告等内容。
如在生产过程中,有新增的炮制方法,则应根据生产炮制方法和品种制定补充计划,确保每一种炮制方法和每一生产品种都进行稳定性考察。
二、2013年中药饮片持续稳定性考察计划1继续完成2011-2012年正在进行的批次的稳定性考察,共计111批。
见表1、表2。
22013年样品选取2.1如生产品种为之前已生产过的产品,则选取一批作为稳定性考察样品。
2.2如生产品种为之前未生产的产品,则应选取三批作为稳定性考察样品,为确定贮存期积累稳定性数据。
2.32013年如有工艺验证批次,则应选取验证批次进行加速和长期稳定性考察。
2.4下列情况下,持续稳定性考察中应当额外增加批次数:如重大变更或生产和包装有重大偏差的药品应当列入持续稳定性考察。
此外,重新加工、返工或回收的批次,也应列入考察,除非已经过验证和持续稳定性考察。
2.5如待包装产品的贮存时间进行考察的,至少选取3批中间产品或待包装产品产品进行指定包装条件下放置时间的研究。
3取样量和取样计划3.1稳定性样品的取样量至少为持续稳定性考察周期的检验项目所需检验量的1.5倍量。
3.2取样计划原则上每年选取前三批作为稳定性考察对象;如有2.4项所列情况,则选取该批产品。
GMP药品稳定性考察管理程序(含表格)
文件制修订记录一、目的在有效期内监控已上市药品的质量,以发现药品与生产相关的稳定性问题(如杂质含量等的变化),并确定药品能够在标示的贮存条件下,符合质量标准的各项要求。
二、范围:适用于公司产品、新产品和合同加工产品的持续稳定性考察、由其他原因引起公司产品和合同加工产品需要进行的稳定性考察。
三、责任:质量部相关人员对其实施负责。
四、内容:1.0质量部设专人负责产品持续稳定性考察,对公司生产的每个品种的每个批号药品,按规定数量留样,填写留样登记台账(即留样样品观察记录),并及时做好持续稳定性考察记录。
2.0产品持续稳定性考察的分类:2.1为公司新产品以及合同加工产品确定有效期与贮存运输条件提供科学数据所进行的稳定性考察;2.2为监控公司产品以及合同加工产品在有效期内质量所进行的持续稳定性考察;2.3由其他原因引起公司产品和合同加工产品需要进行的稳定性考察。
2.3.1重大变更或生产和包装有重大偏差的药品;2.3.2任何采用非常规工艺重新加工、返工、或有回收操作的批次;2.3.3改变主要物料供应商时所作验证的批次。
3.0产品稳定性考察样品批次的规定:3.1为公司新产品以及合同加工产品确定有效期与贮存运输条件提供科学数据所进行的稳定性考察,这种情况的稳定性考察需要连续试制的三批样品;3.2公司新产品和合同加工产品正常批量生产的最初三批产品应列入持续稳定性考察计划,以进一步确认有效期。
3.3为监控公司产品以及合同加工产品在有效期内质量所进行的持续稳定性考察批次按产品不同品种、不同规格、不同内包装形式每年考察一批,除当年没有生产外。
所考察批次采取随机抽取的方式。
3.4重大变更或生产和包装有重大偏差的药品批次3.4.1任何采用非常规工艺重新加工、返工、或有回收操作的批次,均需做持续稳定性考察。
3.4.2改变主要物料供应商时所作验证的批次,均需做持续稳定性考察。
4.0持续稳定性考察样品留样量:4.1持续稳定性考察样品留样量,由质量部根据不同品种包装规格及检验用量的不同要求制定,不得随意变更。
药品持续稳定性考察管理规程(含表格)

药品持续稳定性考察管理规程(ISO9001-2015/GMP)1.0总则1.1制订本规程的目的是考察原料或产品的性质在温度、湿度、光线等条件的影响下随时间变化的规律,为产品生产、包装、贮存、运输条件和有效期的确定提供科学依据,以保障产品质量。
1.2范围:本标准适用于本公司在研新药的小试、中试,首次商业生产的新产品;经批准进行的有关工艺改进;重要原辅料变更;以及产品包装材料的变更等情况下对产品质量进行的稳定性考察。
1.3责任:本文件由化验室负责起草,化验室主任审核,生产负责人批准,化验室负责本规程的实施。
1.4稳定性考察原则研发阶段:应进行全面的稳定性试验,以得到注册所需所有数据。
此数据用于证明环境因素对产品特性的影响,以确定包装、储存条件、复验周期和有效期。
已上市阶段:产品上市后,应进行适当的持续稳定性考察,监测已上市产品的稳定性。
2.0稳定性考察分类a.影响因素试验b.加速稳定性试验c.长期稳定性试验d.持续稳定性试验:公司根据法规的要求,同时开展中间产品放置时间稳定性试验。
批量放大及上市后变更(如生产设备变更,原辅料变更,工艺调整等)稳定性试验、以及特殊目的稳定性试验,例如对偏差调查等的支持性试验。
3.0影响因素试验影响因素试验目的是考察制剂处方的合理性与生产工艺及包装条件,供试品用1批进行,将供试品脱去外包装,置适宜的开口容器中进行高温试验、高湿度试验、强光照射试验。
3.1.高温试验供试品置密封洁净容器中,在60℃条件下放置10天,于第5天和第10天取样,按稳定性重点考察项目进行检测。
如供试品发生显著变化,则在40℃下同法进行试验。
如60℃无显著变化,则不必进行40℃试验。
3.2.高湿试验供试品置恒温密闭容器中,于25℃,相对湿度为90%±5%条件下放置10天,在第5天和第10天取样,按稳定性重点考察项目进行检测。
检测项目应包括吸湿增重项。
若吸湿增重5%以上,则应在25℃,RH75%±5%下同法进行试验;若吸湿增重5%以下,且其他考察项目符合要求,则不再进行此项试验。
表格类模板-稳定性考察范本

稳定性考察范本一、目的:为公司新产品以及合同加工产品确定有效期和贮存运输条件提供科学依据;对公司产品以及合同加工产品进行持续稳定性考察,以监控在有效期内药品的质量;由其他原因引起公司产品和合同加工产品需要进行的稳定性考察。
二、适用范围:适用于公司新产品和合同加工产品的投产稳定性考察、公司产品和合同加工产品的持续稳定性考察、由其他原因引起公司产品和合同加工产品需要进行的稳定性考察。
三、责任:质量保证部、质量检验部。
四、内容:1.产品稳定性考察的一般规定1.1产品稳定性考察分类1.1.1为公司新产品以及合同加工产品确定有效期与贮存运输条件提供科学数据所进行的稳定性考察;1.1.2为监控公司产品以及合同加工产品在有效期内质量所进行的持续稳定性考察;1.1.3由其他原因引起公司产品和合同加工产品需要进行的稳定性考察。
1.1.3.1重大变更或生产和包装有重大偏差的药品;1.1.3.2任何采用非常规工艺重新加工、返工、或有回收操作的批次;1.1.3.3改变主要物料供应商时所作验证的批次。
1.2产品稳定性考察样品批次的规定1.2.1为公司新产品以及合同加工产品确定有效期与贮存运输条件提供科学数据所进行的稳定性考察,这种情况的稳定性考察需要连续试制的三批样品;1.2.2公司新产品和合同加工产品正常批量生产的最初三批产品应列入持续稳定性考察计划,以进一步确认有效期。
1.2.3为监控公司产品以及合同加工产品在有效期内质量所进行的持续稳定性考察批次按产品不同规格每年考察一批,除当年没有生产外。
所考察批次采取随机抽取的方式;1.2.4重大变更或生产和包装有重大偏差的药品批次;1.2.5任何采用非常规工艺重新加工、返工、或有回收操作的批次;1.2.6改变主要物料供应商时所作验证的批次。
1.2.7有效期短的原料药,在进行稳定性考察时应适当增加检验频次。
1.3关键人员,尤其是质量受权人,应了解持续稳定性考察的结果。
应保存持续稳定性考察的结果以供药品监督管理部门审查。
持续稳定性考察计划
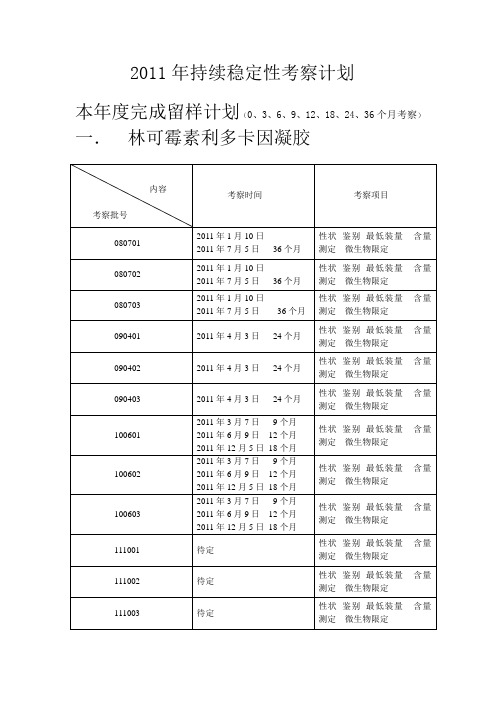
性状鉴别最低装量含量测定微生物限定
性状鉴别最低装量含量测定微生物限定
性状鉴别最低装量含量测定微生物限定
性状鉴别最低装量含量测定微生物限定
性状鉴别最低装量含量测定微生物限定
性状鉴别最低装量含量测定微生物限定
待定
性状鉴别最低装量含量测定微生物限定
待定
性状鉴别最低装量含量测定微生物限定
080703
2011年1月10日
2011年7月5日36个月
性状鉴别最低装量含量测定微生物限定
090401
2011年4月3日24个月
性状鉴别最低装量含量测定微生物限定
090402
2011年4月3日24个月
性状鉴别最低装量含量测定微生物限定
090403
2011年4月3日24个月
性状鉴别最低装量含量测定微生物限定
待定
性状鉴别最低装量含量测定微生物限定
100601
2011年3月7日9个月
2011年6月9日12个月
2011年12月5日18个月
性状鉴别最低装量含量测定微生物限定
100602
2011年3月7日2月5日18个月
性状鉴别最低装量含量测定微生物限定
100603
2011年3月7日9个月
2011年6月9日12个月
2011年12月5日18个月
性状鉴别最低装量含量测定微生物限定
111001
待定
性状鉴别最低装量含量测定微生物限定
111002
待定
性状鉴别最低装量含量测定微生物限定
111003
待定
性状鉴别最低装量含量测定微生物限定
二.咪康唑氯倍他索乳膏
内容
考察批号
中药饮片稳定性考察计划.

中药饮片质量稳定性考察计划起草:日期:审核:日期:批准:日期:中药饮片质量稳定性考察计划一、概述药品的稳定性是指原料药及制剂保持其物理、化学、生物学和微生物学性质的能力。
中药饮片稳定性研究目的是考察饮片性质在中国药典等法规规定的温度、湿度等储存条件的下随时间变化的规律,为中药饮片的生产、包装、贮存、运输条件和有效期的确定提供科学依据,以保障中药饮片的安全有效。
根据《稳定性试验考察管理制度》,结合2012年生产炮制类别和品种以及2010版GMP规定,本计划选取净制、切制、炮炙三种炮制类别的每个生产品种的一批产品作为中药饮片的稳定性考察对象,本计划中包括净制、切制、炮炙(炒、煅)的工艺流程图,试验方案、检验方法和检验周期及试验频次、考查项目、稳定性的评价以及对本计划执行过程中的记录和报告等内容。
如在生产过程中,有新增的炮制方法,则应根据生产炮制方法和品种制定补充计划,确保每一种炮制方法和每一生产品种都进行稳定性考察。
二、2013年中药饮片持续稳定性考察计划1继续完成2011-2012年正在进行的批次的稳定性考察,共计111批。
见表1、表2。
22013年样品选取2.1如生产品种为之前已生产过的产品,则选取一批作为稳定性考察样品。
2.2如生产品种为之前未生产的产品,则应选取三批作为稳定性考察样品,为确定贮存期积累稳定性数据。
2.32013年如有工艺验证批次,则应选取验证批次进行加速和长期稳定性考察。
2.4下列情况下,持续稳定性考察中应当额外增加批次数:如重大变更或生产和包装有重大偏差的药品应当列入持续稳定性考察。
此外,重新加工、返工或回收的批次,也应列入考察,除非已经过验证和持续稳定性考察。
2.5如待包装产品的贮存时间进行考察的,至少选取3批中间产品或待包装产品产品进行指定包装条件下放置时间的研究。
3取样量和取样计划3.1稳定性样品的取样量至少为持续稳定性考察周期的检验项目所需检验量的1.5倍量。
3.2取样计划原则上每年选取前三批作为稳定性考察对象;如有2.4项所列情况,则选取该批产品。
中药饮片稳定性考察计划.

中药饮片质量稳定性考察计划起草:日期:审核:日期:批准:日期:中药饮片质量稳定性考察计划一、概述药品的稳定性是指原料药及制剂保持其物理、化学、生物学和微生物学性质的能力。
中药饮片稳定性研究目的是考察饮片性质在中国药典等法规规定的温度、湿度等储存条件的下随时间变化的规律,为中药饮片的生产、包装、贮存、运输条件和有效期的确定提供科学依据,以保障中药饮片的安全有效。
根据《稳定性试验考察管理制度》,结合2012年生产炮制类别和品种以及2010版GMP规定,本计划选取净制、切制、炮炙三种炮制类别的每个生产品种的一批产品作为中药饮片的稳定性考察对象,本计划中包括净制、切制、炮炙(炒、煅)的工艺流程图,试验方案、检验方法和检验周期及试验频次、考查项目、稳定性的评价以及对本计划执行过程中的记录和报告等内容。
如在生产过程中,有新增的炮制方法,则应根据生产炮制方法和品种制定补充计划,确保每一种炮制方法和每一生产品种都进行稳定性考察。
二、2013年中药饮片持续稳定性考察计划1继续完成2011-2012年正在进行的批次的稳定性考察,共计111批。
见表1、表2。
22013年样品选取2.1如生产品种为之前已生产过的产品,则选取一批作为稳定性考察样品。
2.2如生产品种为之前未生产的产品,则应选取三批作为稳定性考察样品,为确定贮存期积累稳定性数据。
2.32013年如有工艺验证批次,则应选取验证批次进行加速和长期稳定性考察。
2.4下列情况下,持续稳定性考察中应当额外增加批次数:如重大变更或生产和包装有重大偏差的药品应当列入持续稳定性考察。
此外,重新加工、返工或回收的批次,也应列入考察,除非已经过验证和持续稳定性考察。
2.5如待包装产品的贮存时间进行考察的,至少选取3批中间产品或待包装产品产品进行指定包装条件下放置时间的研究。
3取样量和取样计划3.1稳定性样品的取样量至少为持续稳定性考察周期的检验项目所需检验量的1.5倍量。
3.2取样计划原则上每年选取前三批作为稳定性考察对象;如有2.4项所列情况,则选取该批产品。
中药饮片稳定性考察计划

中药饮片质量稳定性考察计划起草:日期:审核:日期:批准:日期:中药饮片质量稳定性考察计划一、概述药品的稳定性是指原料药及制剂保持其物理、化学、生物学和微生物学性质的能力。
中药饮片稳定性研究目的是考察饮片性质在中国药典等法规规定的温度、湿度等储存条件的下随时间变化的规律,为中药饮片的生产、包装、贮存、运输条件和有效期的确定提供科学依据,以保障中药饮片的安全有效。
根据《稳定性试验考察管理制度》,结合2012年生产炮制类别和品种以及2010版GMP规定,本计划选取净制、切制、炮炙三种炮制类别的每个生产品种的一批产品作为中药饮片的稳定性考察对象,本计划中包括净制、切制、炮炙(炒、煅)的工艺流程图,试验方案、检验方法和检验周期及试验频次、考查项目、稳定性的评价以及对本计划执行过程中的记录和报告等内容。
如在生产过程中,有新增的炮制方法,则应根据生产炮制方法和品种制定补充计划,确保每一种炮制方法和每一生产品种都进行稳定性考察。
二、2013年中药饮片持续稳定性考察计划1 继续完成2011-2012年正在进行的批次的稳定性考察,共计111批。
见表1、表2。
2 2013年样品选取2.1 如生产品种为之前已生产过的产品,则选取一批作为稳定性考察样品。
2.2 如生产品种为之前未生产的产品,则应选取三批作为稳定性考察样品,为确定贮存期积累稳定性数据。
2.3 2013年如有工艺验证批次,则应选取验证批次进行加速和长期稳定性考察。
2.4 下列情况下,持续稳定性考察中应当额外增加批次数:如重大变更或生产和包装有重大偏差的药品应当列入持续稳定性考察。
此外,重新加工、返工或回收的批次,也应列入考察,除非已经过验证和持续稳定性考察。
2.5 如待包装产品的贮存时间进行考察的,至少选取3批中间产品或待包装产品产品进行指定包装条件下放置时间的研究。
3 取样量和取样计划3.1 稳定性样品的取样量至少为持续稳定性考察周期的检验项目所需检验量的1.5倍量。
