化学平衡图像的解题方法
化学反应速率和化学平衡图像详细解题技巧

2021/3/11
1
1、化学反应速率图象分析
(1)看起点和终点
分清反应物和生成物,浓度减小的是反应物,浓
度增大的是生成物,生成物多数是以原点为起点。
看下图:
物质的量
写反应方程式
2.0
1.5
C
1.0
A
2 A + 1B = 3 C 0.5
B
反应20速21/3/率11 之比=反应方程式的系数之比
练 2、如图所示,图中a曲线表示X(g) +Y(g) 2Z(g)+ W(s)+ Q的反应过程,若使a曲线变为
习:b曲线,可采取的措施是( A.D)
A. 加入催化剂
Z%
B. 增大Y的浓度 C. 降低温度
D. 增大体系压强
b
a
0 2021/3/11
t
13
个人观点供参考,欢迎讨论
500C
平衡则
速率快。 0 2021/3/11
t1
t2 时间
11
方法归纳:
1)分析图像:
一看面:即看清坐标所代表的量的意义。
二看线:看准线的走向变化趋势,增减性及量的变
化。
(需作辅助线、等温线、等压线等)
三看点:弄懂曲线上点的意义,特别是一些特殊点。
(如起点、交点、转折点、极值点是否过原点等。)
2)联想规律:即联想外界条件对化学反应速率和 化学平衡的影 响规律。 3)作2021出/3/11判断:依据题意仔细分析,作出正确定12 判
时间
2
1、化学反应速率图象分析 (2). 看变化趋势 分清正反应和逆反应; 分清
“突变”和“渐变”
V
V正 V逆
化学平衡图像解题方法

500 C
o
t
0
700 C
o
C%
(A)
0
v
P
V
正
逆
V
(B)
0
T
v
V
正
逆
V
(C)
0
P
10 C
o
100 C
o
A
转
化
率
(D)
1.下图表示外界条件(温度、压强)的变化对下列反应的影响,图中Y轴是指 A(s) + B(g) 2C(g) A. 平衡混合气体中C的体积分数 B. 平衡混合气体中B的体积分数 C. B的转化率 D. A的转化率
2.右图表示800 ℃时,A、B、C三种气体在密闭容器中反应时各物质浓度随时间变化的情况,由图分析可得出的正确结论是: (1)前2min内A的平均消耗 的速率是_____________。 (2)反应的化学方程式是: _______________________ (3)8min后,若将容器的体 积缩小一半,c(A)将________ c(B)将________c(C)将_______ (填增大、减小、不变); 平衡将向________反应方向移动;达到新的平衡时混合气体的相对平均分子质量___________ , A的转化率_________。 (填增大、减小、不变)
B
t
0
B%
T2 P2
T1 P1
T1 P2
解题原则:定一议二
T1不变,P2>P1
P2不变,T1>T2
题型3:根据图像特征判断物质的状态和反应特征
例3:反应A2 + B2 2AB ,在不同温度和压强改变的条件下产物AB的生成情况如下图所示,a为500℃ ,b为300℃ 的情况,c为反应在300℃ 时,从时间t3开始向容器中加压的情况,则下列叙述正确的是( )
化学平衡图象解题技巧

化学平衡图象解题技巧作者:姚秀梅来源:《中学生数理化·教研版》2010年第01期有关化学反应速率和化学平衡的函数图象题,是从化学量的函数关系的角度考查对此内容的理解和应用能力.考查的图象主要有三类:第一类是化学平衡建立过程中有关量随时间变化的图象;第二类是平衡移动原理应用的图象;第三类是反应物或生成物物质的量(或浓度或质量分数)与时间关系的图象.一、知识规律1.对有气体参加的可逆反应,温度、压强、反应物浓度,三个条件中的任意一个物理量增大,则反应速率一定加快,到达平衡所需的时间缩短;但化学平衡的移动方向,需要根据“勒夏特列原理”具体分析得到.2.使用催化剂,能同等程度地改变正、逆反应速率,改变到达平衡所需时间,但不影响化学平衡移动.3.平衡向正反应方向移动,生成物的物质的量一定增加,但生成物的浓度、质量分数以及反应物的转化率不定增加.二、方法指导1.看图象:看图象要五看.一看面,即看清横坐标和纵坐标所代表的物理量;二看线,即看线的走向、变化趋势;三看点,即看曲线的起点、终点、交点、拐点、极值点等;四看是否要作辅助线,如等温线、等压线;五看量,即定量图象中有关量的多少.2.想规律:联想外界条件对化学反应速率和化学平衡的影响规律.3.作判断:结合题中给定的化学反应和图象中的相关信息,根据有关知识规律分析作出判断.三、解题规律1.“定一议二”原则在化学平衡图象中,包括纵坐标、横坐标和曲线所表示的三个量,确定横坐标所示的量后,讨论纵坐标与曲线的关系或确定纵坐标所示的量后,讨论横坐标与曲线的关系.2.“先拐先平,数值大”原则在化学平衡图象中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高或压强较大.四、典型例题例1 图1是某合成氨反应时的反应速率随时间的变化曲线.(1)t0时反应从哪方开始?向哪个方向进行?(2)t1、t2、t3时刻分别改变了什么条件?平衡移动的方向怎样?解析:(1)由图象可知t0时,v正>v逆≠0,反应应从两个方向同时开始,向正反应方向进行.(2)从图象可知t1时,v正>v逆,且v逆与原平衡线相连且都比原平衡大,应为通入N2或H2引起.平衡向正反应方向移动.t2时,v逆>v正.v正与原平衡线相接,且都大于原平衡改变的条件应为通入NH3,且平衡向逆反应方向移动.而t3时,v逆>v正,都比原平衡小,且与原平衡不相连,则改变的条件应为降低压强,逆反应方向移动.答案:(1)从两个方向同时开始.向正反应方向进行.(2)t1时通人N2或H2,向正反应方向移动.t2时通入NH3向逆反应方向移动,t3时降低压强,向逆反应方向移动.例2 反应L(s)+aG(g)bR(g)达到平衡时,温度和压强对该反应的影响如图2.P1>P2,x轴表示温度,y轴表示平衡混合气中G的体积分数.有下列判断:①该反应是放热反应;②该反应是吸热反应;③a>b;④aA.①③B.①④C.②③D.②④解析:根据平衡图象判断的原则:由压强的变化情况判断化学计量数的关系;由温度的变化情况判断反应吸热还是放热,采用的方法是“定一动一”,即定下温度由压强的变化情况判断化学计量数的关系或定下压强由温度的变化情况判断反应是吸热还是放热.从图象上可看出:随着温度的升高,G的体积分数减小,说明平衡向正反应方向移动,正反应吸热;当增大压强时,G的体积分数增大,说明平衡向逆反应方向移动,左边气体化学计量数之和小于右边,即a答案。
化学平衡图像的基本类型和分析方法

化学平衡图像的基本类型和分析方法一、化学平衡图像的基本类型1、速率—时间图(v-t图像)此类图像定性地揭示了v(正)、v(逆)随时间而变化的规律,体现了平衡的“动、等、定、变”等基本特征以及平衡移动(“变”)方向等。
←2NH3(g)中先补充N2和H2,如像平衡体系N2(g)+3H2(g)−→一段时间后又升高温度,其v-t图像如图2-30所示。
2、浓度—时间图(c-t图像)此类图像能说明各平衡体系组分(或某一成分)含量在反应过程中的变化情况。
←AB从开始至达到平衡以后的c-t变化关系如图2-31所示。
此类如A+B−→图像要注意各物质曲线的折点(达平衡)时刻相同,各物质浓度变化的内在联系及比例符合化学方程式中的化学计量数关系。
如果达到平衡后再改变条件,平衡发生移动,则依据平衡移动带来的浓度变化可以画出相应的c-t图像,依据c-t图像中浓度变化可以判断所变的条件。
如图2-32中,10min——15min内,c(SO2)、c(O2)减小的速率和c(SO3)增大的速率明显加快,可能的原因是加了催化剂或缩小了容器体积(增大了压强)或升高了温度;15min-20min内处于平衡状态;第20min时c(O2)“直线”增大后再慢慢减小,c(SO2)和c(SO3)分别在原起点上慢慢减小和增大,由此判断,第20min时的条件变化应是加入了氧气。
3、含量-时间-温度(压强)图此类图像表示的是不同的温度或压强下反应物或生成物的物质的量(体积)分数的变化过程,包含达到平衡所需的时间和不同温度(压强)下的平衡状态的物质的量分数比较等信息,由图像可以判断T1、T2或P1、P2的大小,再判断反应的∆H或气体物质的化学计量数关系(是吸热反应还是放热反应,或者是气体体积增大的含有缩小的反应)。
对←cC(g),常见此于反应aA(g)+bB(g) −→类图像如图2-33所示。
4、恒压(温)线该类图的纵坐标为物质的平衡浓度(c)或反应物的转化率(α),横坐标为温度(T)或压强(P),常见类型有如图2-34所示两种:5、其他类型如图2-37所示是其他条件不变时,某反应物的最大(平衡)转化率(α)与温度)T)的关系曲线,图中标出的a、b、c、d四个点种,表示v(正)>v(逆)的点是c,表示v(正)<v(逆)的点是a,而b、d点表示v(正)= v(逆)。
高二化学 【化学平衡图像专题】

高二化学化学平衡图像专题1.图像问题解题步骤(1)看懂图像:①看面(即弄清纵坐标与横坐标的意义);②看线(即弄清线的走向和变化趋势);③看点(即弄清起点、拐点、交点、终点的意义);④看是否要作辅助线(如等温线、等压线);⑤看定量图像中有关量的多少。
(2)联想规律:联想外界条件的改变对化学反应速率和化学平衡的影响规律。
(3)作出判断:根据图像中表现的关系与所学规律相对比,作出符合题目要求的判断。
2.原则 (1)“定一议二”原则在化学平衡图像中,包括纵坐标、横坐标和曲线所表示的三个量,确定横坐标所示的量后,讨论纵坐标与曲线的关系或确定纵坐标所示的量后,讨论横坐标与曲线的关系。
(2)“先拐先平,数值大”原则在化学平衡图像中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高或表示的压强较大。
1. 以速率—时间图像计算平衡浓度例1.在容积固定为2L的密闭容器中,充入X、Y气体各2mol,发生可逆反应:X(g)+2Y(g)⇌2Z(g),并达平衡,以Y表示的反应速度v正、v逆与时间t的关系如图所示,则Y的变化浓度表达式正确的是(式中S是对应区域的面积)()A.2−SaobB.SaobC.SdobD.1−Saob练习1. I2在KI溶液中存在下列平衡:I2(aq)+I−(aq)=I−3(aq)某I2、KI混合溶液中, I−3的物质的量浓度c(I−3)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是()A. 反应I2 (aq)+I−(aq)═I−3 (aq)的△H>0B. 状态A 与状态B 相比,状态A 的c (I 2)大C. 若反应进行到状态D 时,一定有v 正>v 逆D. 若温度为T 1、T 2,反应的平衡常数分别为K 1、K 2,则K 1>K 22. 以速率-时间图像描述化学平衡移动的本质 例2. 反应A(g)+B(g) C(g);△H<0已达平衡,升高温度,平衡逆向移动,当反应一段时间后反应又达平衡,则速率对时间的曲线为3.以物质的量(浓度)—时间图像描述可逆反应达平衡的过程 例3. 如图表示反应X (g )⇌4Y (g )+Z (g )△H <0,在某温度时X 的浓度随时间变化的曲线,下列有关该反应的描述正确的是( )A. X 的平衡转化率为85%B. 第6 min 后,反应就终止了C. 若升高温度,X 的平衡转化率将大于85%D. 若降低温度,v 正减小,v 逆增大练习 500℃、20MPa 时,将H 2和N 2置于一容积为2L 的密闭容器中发生反应。
化学平衡图像讲解
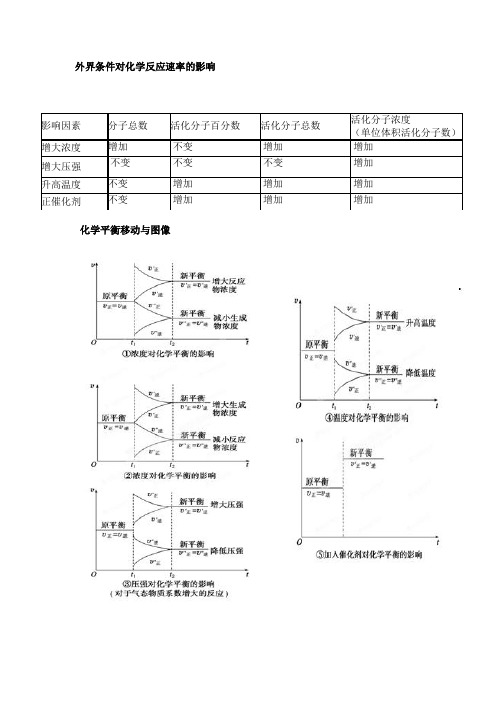
外界条件对化学反应速率的影响化学平衡移动与图像影响因素分子总数活化分子百分数活化分子总数活化分子浓度(单位体积活化分子数)增大浓度增加不变增加增加增大压强不变不变不变增加升高温度不变增加增加增加正催化剂不变增加增加增加总结:①只要增大浓度、增大压强、升高温度,新平衡都在原平衡的上方,v′正=v′逆>v正=v逆;只要减小浓度、降低压强、降低温度,新平衡都在原平衡下方,v″正=v″逆<v正=v逆。
②只要是浓度改变,一个速率一定是在原平衡的基础上改变;两个速率同时增大或减小(中间断开)一定是压强或温度改变。
③加入催化剂能同等程度地增大正、逆反应速率,平衡不移动。
速率和平衡图像分析:⑴分析反应速度图像:①看起点:分清反应物和生成物,浓度减小的是反应物,浓度增大的是生成物,生成物多数以原点为起点。
②看变化趋势:分清正反应和逆反应,分清放热反应和吸热反应。
升高温度时,△V吸热>△V放热。
③看终点:分清消耗浓度和增生浓度。
反应物的消耗浓度与生成物的增生浓度之比等于反应方程式中各物质的计量数之比。
④对于时间——速度图像,看清曲线是连续的,还是跳跃的。
分清“渐变”和“突变”、“大变”和“小变”。
增大反应物浓度V正突变,V逆渐变。
升高温度,V吸热大增,V放热小增。
⑵化学平衡图像问题的解答方法:①三步分析法:一看反应速率是增大还是减小;二看△V正、△V逆的相对大小;三看化学平衡移动的方向。
②四要素分析法:看曲线的起点;看曲线的变化趋势;看曲线的转折点;看曲线的终点。
③先拐先平:对于可逆反应mA(g) + nB(g) pC(g) + qD(g) ,在转化率-时间曲线中,先出现拐点的曲线先达到平衡。
它所代表的温度高、压强大。
这时如果转化率也较高,则反应中m+n>p+q。
若转化率降低,则表示m+n<p+q。
④定一议二:图像中有三个量时,先确定一个量不变,再讨论另外两个量的关系。
化学反应速率化学反应进行的快慢程度,用单位时间反应物浓度的减少或生成物浓度的增加来表示。
关注化学平衡图像题解题方法提高学生能力

关注化学平衡图像题解题方法提高学生能力作者:郭志诚来源:《成才之路》 2013年第15期甘肃通渭●郭志诚有关化学平衡的知识是高考考查的重点知识之一,其中的图像题是化学平衡中的常见题型,图像因为具有直观、简洁、明了的特点,在化学教学和命题中得到了普遍的应用,同时它又是化学平衡的重点、难点。
通过多种图像对化学反应速率和化学平衡有关知识的考查题目往往灵活多变并且涉及内容多且要求高,让学生掌握常见的平衡解题的一些方法,能提高学生的解题能力,起到事半功倍的效果。
一、图像题的解题关键遇到图像曲线的题目时首先是看图,通过观察图像中横坐标、纵坐标的含义;搞清特殊点的意义,比如坐标轴的“0”点,曲线的起点、终点、拐点、交叉点等,用以分析其特点和变化趋势。
然后是识图,结合题中给定的化学反应和数据,进行提取和挖掘隐含信息。
最后是用图,运用勒沙特列原理进行推理和判断解答问题。
二、化学平衡图像主要应用题①分析反应条件对反应速率及平衡的影响;②由反应判断图像正误;③由图像判断反应特征(确定反应中各物质化学计量数或气体物质化学计量数的变化关系);④由反应和图像判断图像中坐标或曲线的化学意义;⑤由图像判断指定意义的化学反应;⑥由反应和图像判断符合图像变化的外界条件等。
三、图像题的类型(1)速率———时间图。
特点:反应速率v作纵坐标,时间t作横坐标,即v———t图像。
定性地揭示了V 正、V 逆随时间(含条件改变对速率的影响)变化的规律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向。
当条件改变时,判断平衡移动的方法是:看v 正、v 逆的高低判断平衡移动的方向,若v 正>v 逆,平衡正向移动;v 正<v 逆,平衡逆向移动。
再看v 正、v 逆的连续或跳跃,如果v 正、v 逆有一个连续,有一个突变,那么一般是因为改变浓度条件而引起的;如果v 正、v逆同时有突变,则可能是温度、压强或催化剂等条件改变而引起的。
如图1,增大反应物浓度时,v 正突变,v 逆连续,且v 正>v 逆,所以平衡正向移动;减小生成物浓度时v 逆突变,但v 正>v 逆,所以平衡正向移动。
常见的化学平衡图像分析讲解

1、V-t 图像
例1 下图是可逆反应 A+2B 而变化的情况。
2C+3D ,随外界条件改变
反
v正
应
速 v正
v逆
率
v正
v逆 v逆
0
降温
加压
时间
由图可推断: ⑴正反应是 吸热 反应,(填放热或吸热)
⑵若A、B是气体,则 C的状态是 气体 , D的状态是 液体或固。体
2、物质的量(或浓度)-时间图像(n或c-t图)
B. 升高温度
C. 增大Z的浓度
D. 增大X的浓度
浓度
Z
Z
X
X t1 t2 t3
时间
3、速率-温度(V-T) 图像或速率 -压强(V-P) 图像
例4.可逆反应 mA(g) + nB(g)
pC(g) +qD(g)
V
V
V(正)
平衡点
V(逆)
平衡V点(正)
V(逆)
T
正反应是 吸热 反应
(放热、吸热)
P
m + n > p +q ( > = < )
C%
V
v正
a a
A.
b
B.
v逆
b
0
t
0
t
A%
V
v正
ab C.
0
a
b
v逆
D.
t
0
t
[小结:解题关键 ]
(1)判断反应物和生成物
(2)确定方程式中各物质前的计量数
(3)按要求作答
例3 在密闭容器中,反应 X(g)+Y(g) Z(g) (正反应
为放热反应)在 t1时达到平衡, t2时由于条件改变平衡破
化学平衡图像、合成氨

化学平衡图像专题知识点1:化学平衡图像题解题方法指导(1)看懂图像:①看轴:即弄清纵坐标与横坐标的意义;②看线:即弄清线的走向和变化趋势;③看点:即弄清起点、拐点、交点、终点的意义;④看是否要作辅助线:如等温线、等压线、平衡线等;⑤看量的变化:如浓度变化、温度变化、转化率变化、物质的量的变化等。
(2)联想规律:联想外界条件的改变对化学反应速率和化学平衡的影响规律。
即利用平衡移动原理,分析可逆反应的特征:吸热还是放热,气体化学计量数增大、减小还是不变,有无固体或纯液体参加或生成等。
(3)“先拐先平,数值大”原则:在化学平衡图像中,先出现拐点的反应则先达到平衡,该先出现拐点的曲线对应的反应可能温度_____、压强____、浓度____或使用了___________。
(4)“定一议二”原则:勒夏特列原理只适用于一个条件的改变,所以图像中有三个变量时,先固定一个量,再讨论另外两个量的关系。
例如:mA(g)+nB(s) ⇌pC(g)+qD(g)左图:表示T2 T1,正反应是反应右图:表示P2 P1,正反应是气体物质的量增多的反应,即m+n p+q知识点2:化学平衡图像常见类型及分类解析1、浓度—时间图像(c-t图像)此类图象能说明各平衡体系组分(或某一成分)在反应过程中的变化情况.解题时要注意各物质曲线的折点(达平衡时刻),各物质浓度变化的内在联系及比例符合化学方程式中化学计量数关系等情况.例:图2表示800℃时A、B、C三种气体物质的浓度随时间的变化情况,t1是到达平衡状态的时间.试回答:(1)该反应的反应物是________________;(2)反应物的转化率是______________;(3)该反应的化学方程式为_____________________________.2.速率—时间图像(v-t图像)解题技巧:分清正逆反应速率及二者的相对大小,分清“突变”和“渐变”;正确判断化学平衡的移动方向;熟记浓度、温度、压强、催化剂等对化学平衡移动的影响规律。
化学反应速率、化学平衡的图像分析

B.T1>T2,p1<p2,a+b<c,正反应为吸热反应
C.T1<T2,p1>p2,a+b<c,正反应为吸热反应
D.T1>T2,p1>p2,a+b>c,正反应为放热反应
化学
首页
上一页
下一页
末页
热点专题课 化学反应速率、化学平衡的图像分析 结束
[解析] 解答该题要综合运用“定一议二”和“先拐先
平”。由(T1,p1)和(T1,p2)两条曲线可以看出:①温度(T1)相 同,但压强为p2时先出现“拐点”,达到平衡所需的时间短,即 反应速率大,所以p2>p1;②压强较大(即压强为p2)时对应的w(B) 较大,说明增大压强平衡逆向移动,则a+b<c。由(T1,p2)和 (T2,p2)两条曲线可以看出:①压强(p2)相同,但温度为T1时先出 现“拐点”,达到平衡所需的时间短,即反应速率大,所以
入一体积为 1 L 的恒温密闭容器中,反应物浓度随时间变化
关系如图所示,回答下列问题:
化学
首页
上一页
下一页
末页
热点专题课 化学反应速率、化学平衡的图像分析 结束
题组一 1 题组二 2 题组三 3 题组四 4 5 题组五 6 7
(1)图中共有两条曲线 X 和 Y,其中曲线______表示 NO2 浓度 随时间的变化;a、b、c、d 四个点中,表示化学反应处于平衡
热点专题课 化学反应速率、化学平衡的图像分析 结束
热点专题课
化学反应速率、化学平衡的图像分析
一、解答化学反应速率、化学平衡图像题的一般原则方法
(1)看图像:一看轴,即纵、横坐标的意义;二即线的走向和变 化趋势;三看线,看点:即起点、拐点、交点、终点;四看辅助线, 即等温线、等压线、平衡线等;五看量的变化,如浓度变化、温度 变化、转化率变化、物质的量的变化等。
高中化学 平衡常见图像分析学法指导

平衡常见图像分析化学平衡图像询问题的综合性强,思维难度大,是很多同学感到困难的题型之一。
化学平衡图像题的特征是以图像的方式将一些相关量之间的关系通过形象直观的曲线表示出来,把习题中的化学原理抽象为数学询问题,旨在考察同学对曲线的数学意义和化学意义之间对应关系的分析、理解和运用才能。
一、化学平衡常见图像及其分析图像I:图像分析:〔1〕假设a、b无断点,那么平衡挪动确信是转变某一物质的浓度导致。
〔2〕假设a、b有断点,那么平衡挪动可能是由于以下缘由所导致:①同时不同程度地转变反响物〔或生成物〕的浓度;②转变反响体系的压强;③转变反响体系的温度。
〔3〕假设平衡无挪动,那么可能是由于以下缘由所导致:①反响前后气体分子个数不变;②使用了催化剂。
〔4〕假设在的上方,即平衡向正反响方向挪动;假设在的上方,即平衡向逆反响方向挪动。
图像II:图像分析:〔1〕由曲线的拐点作垂直于时间轴〔t线〕的垂线,其交点即为该条件下到达平衡的时间。
〔2〕由到达平衡的时间长短,推断与、与的相对大小〔关于此图像:、〕。
〔3〕由两平衡时,不同p、T下的量的变化可推断纵坐标y代表的物理量。
图像III:图像分析:〔1〕固定温度T〔或压强p〕,即作横坐标轴的垂线,观看分析图中所示各物理量随压强p〔或温度T〕的变化结果。
〔2〕关键是精确推断所作垂线与原温度〔或压强〕曲线的交点的纵坐标。
〔3〕y能够是某物质的质量分数、转化率、浓度、浓度比值、体积分数、物质的量分数等。
图像IV:图像分析:〔1〕温度为点为化学平衡点。
〔2〕温度段是随温度〔T〕上升,反响速率加快,产物的浓度增大或反响物的转化率增大。
〔3〕温度段是随温度上升平衡向吸热反响方向挪动的结果。
二、解答化学平衡图像询问题的技巧在解答化学平衡图像询问题时,要留意技巧性方法的应用。
1、“先拐先平,数值大”:在含量—时间曲线中,先毁灭拐点的,那么先到达化学平衡状态,说明该曲线的温度较高或压强较大;2、“定一议二”:在含量—温度〔或压强〕曲线中,图像中有三个变量,先确定一个量不变,再争辩另外两个量的关系〔由于化学平衡挪动原理只适用于外界“单要素”的转变,导致的平衡挪动的分析〕,即确定横坐标所示的量后,争辩纵坐标与曲线的关系或确定纵坐标所示的量后〔通常作一条横坐标的垂线〕,争辩横坐标与曲线的关系。
化学平衡图像题的解题方法和技巧

化学平衡图像题的解题方法和技巧化学平衡图像题是高考中一个重点,也是一个难点。
在高考中,出现某些涉及化学平衡图像试题,可以直接考查学生对观察能力结果的初步加工能力。
解图像题离不开识图、析图和解答。
识图是解题的基础,析图是关键,解答是目的。
而由于曲线和图形都包含着大量的信息,而这些信息往往是隐含的,学生必须对观察结果进行加工,才能总结出其中反映出的规律,提取出与考题有关的信息。
下面分类归纳各类图像题的解题方法和技巧。
1.速率~时间图这类图像定性地揭示了反应过程中v(正)、v(逆)随时间(含条件改变对化学反应速率的影响)而变化的规律,体现了平衡的“逆、动、等、定、变、同”的基本特征,以及平衡移动的方向。
解这一类题常分三步:①看起点首先要分清反应物和生成物,从起点应能看出起始加入是只有反应物、还是生成物,还是都有。
浓度减小的是反应物,浓度增大的是生成物,生成物多数以原点为起点。
②看变化趋势要看清逐渐增大或逐渐减小的分别是正反应速率,还是逆反应速率;曲线是连续的,还是跳跃的,分清“渐变”和“突变”、“大变”和“小变”、“变大”和“变小”、变化后是否仍然相等等情况;⑴浓度的影响增大反应物浓度,v(正)突变,v(逆)渐变;⑵温度的影响对于可逆反应,改变温度时,吸热反应的速率受到的影响程度大:升高温度,v(吸)大增,v(放)小增;降低温度,v(吸)大减,v(放)小减;⑶压强的影响 a.对于体积可变的气体反应体系,方程式中气态物质化学计量数大的一侧,其反应速率受压强的影响程度大。
增大压强,v(正)、v(逆)都增大,气体体积之和(系数和)大的一侧增加倍数大于气体体积之和小的一侧增加的倍数;减小压强,v(正)、v(逆)都减小,气体体积之和大的一侧减小的倍数大于气体体积之和小的一侧减小的倍数。
b.对于体积不变的气体反应体系,改变压强时,正、逆反应速率会同等程度的改变。
⑷催化剂的影响使用正(负)催化剂,v(正)、v(逆)都增大(减小)且改变量相等。
化学平衡图像的解题技巧

化学平衡图像的解题技巧一、考点知识网络建构1.解化学平衡图像题三步曲1看懂图像:看图像要五看;一看面,即看清横坐标和纵坐标;二看线,即看线的走向、变化趋势;三看点,即看曲线的起点、终点、交点、拐点、原点、极值点等;四看要不要作辅助线、如等温线、等压线;五看定量图像中有关量的多少;2联想规律:联想外界条件对化学反应速率和化学平衡的影响规律;3推理判断:结合题中给定的化学反应和图像中的相关信息,根据有关知识规律分析作出判断;2二个原则1先拐先平;例如,在转化率一时间图上,先出现拐点的曲线先达到平衡,此时逆向推理可得该变化的温度高、浓度大、压强高;2定一论二;当图象中有三个量时,先确定一个量不变再讨论另外两个量的关系3.有关化学平衡图像的知识规律1对有气体参加的可逆反应,在温度相同的情况下,压强越大,到达平衡所需的时间越短;在压强相同情况下,温度越高,到达平衡所需的时间越短;2使用催化剂,能同等程度地改变正、逆反应速率,改变到达平衡所需时间,但不影响化学平衡移动;3同一反应中,末达平衡前,同一段时间间隔内,高温时其他条件相同生成物含量总比低温时生成物含量大;高压时其他条件相同生成物的含量总比低压时生成物的含量大;4平衡向正反应方向移动,生成物的物质的量增加,但生成物的浓度、质量分数以及反应物的转化率不一定增加;4.解答图像类题目的注意事项1注意物质的转化率与其百分数相反;2注意图像的形状和走向是否符合给定反应;3注意图像是否过愿点;4注意坐标格的数据,也可由它判断反应物或生成物在方程式里的系数,或据此求反应速率;5注意抓两个变量间的关系,判断图像正确与否,可加辅助线,常在横坐标上画垂直线为辅助线来判断图像是否合理;二、常见的平衡图像例析1. 以v-t图像描述化学平衡移动的本质例1已知合成氨的反应为:在一定条件下达到化学平衡,现升高温度使平衡发生移动,下列图像中能正确描述正、逆反应速率v变化的是2. 以物质的量浓度-时间nc-t图像描述可逆反应达平衡的过程例2在一定温度下,容器内某一反应中M、N的物质的量n随反应时间t变化的曲线如图所示,下列表述中正确的是A. 反应的化学方程式为2M NB.C、D.3.由化学反应方程式的特点,根据平衡移动原理,判断有关图像的正误,即平衡移动原理的应用;例3反应X气+3Y气2Z气+热量,在不同温度、不同压强p1>p2下,达到平衡时,混合气体中Z的质量分数随温度变化的曲线应为;4. 以物质的量转化率-时间nR-t图像描述温度或压强对平衡移动的影响例4 2000年北京测试题已知某可逆反应aA气+bB气cC气+Q 在密闭容器中进行,在不同温度T1和T2及压强p1和p2下,混合气中B的质量分数w B与反应时间t的关系如图4所示;下列判断正确的是;<T2, P1<P2, a+b >c, Q<0>T2, P1<P2, a+b <c, Q<0C. T1<T2, P1>P2, a+b <c, Q<0D. T1>T2, P1>P2, a+b >c, Q>05. 以转化率体积分数-压强、温度R-p、T图像判断平衡状态例5 如图,条件一定时,反应2正反应为放热中NO的与T变化关系曲线图,图中有a、b、c、d4个点,其中表示未达到平衡状态,且的点是A. aB. bC. cD. d6. 根据R质量分数w、体积分数-p、T图像判断反应特征例6 已知反应,A的转化率与p、T的关系如图,根据图示可以得出的正确结论是A. 正反应吸热,B. 正反应吸热,. 正反应放热,7. 由v-pT图像描述平衡移动时正逆v的变化例7 下列反应符合下图p-v变化曲线的是A. 2HIgB.C. 4NOg+D. COg+Cs 2COg8. 混合气体平均相对分子质量—温度压强图像例8可逆反应2A+B2Cg+>0随T℃变化气体平均相对分子质量的变化如图所示,则下列叙述中正确的是A. A和B可能都是固体B. A和B一定都是气体C. A和B可能都是气体D. 若B为固体,则A一定为气体9. 由体积分数—温度图像判断平衡进程例9在容积相同的不同密闭容器内,分别充入同量的,在不同温度,任其发生反应,在第7秒时分别测定其中的体积分数,并绘成下图曲线;1A、B、C、D、E中,尚未达到化学平衡状态的点是________;2此反应的正反应是______热反应;3AC段曲线是增函数曲线,CE段曲线是减函数曲线,试从化学反应速率和化学平衡角度说明理由为____________________________________________________;4v 正_____v逆。
化学平衡图像题解题技巧

6.2.2 化学平衡图像题解题技巧
(1)“定一议二”原则
在化学平衡图像中,了解纵轴、横轴和曲线所表示的三个量的意义。
在确定横轴所表示的量后,讨论纵轴与曲线的关系,或在确定纵轴所表示的量后,讨论横轴与曲线的关系。
比如:反应2A(g)+B(g) 2C(g)达到化学平衡时,A的平衡转化率与压强和温度的关系如图1所示[A的平衡转化率(α),横轴为反应温度(T)]。
图1
定压看温度变化,升高温度曲线走势降低,说明A的转化率降低,平衡向逆反应方向移动,正反应是放热反应。
定温看压强变化,因为此反应是反应后气体体积减小的反应,压强增大,平衡向正反应方向移动,A的转化率增大,故p2>p1。
(2)“先拐先平数值大”原则
对于同一化学反应在化学平衡图像中,先出现拐点的反应先达到平衡状态,先出现拐点的曲线表示的温度较高(如图2所示,α表示反应物的转化率)或压强较大[如图3所示,φ(A)表示反应物A的体积分数]。
图2 图3
图2:T2>T1,正反应放热。
图3:p1<p2,正反应为气体体积减小的反应。
(3)三步分析法
一看反应速率是增大还是减小;二看v正、v逆的相对大小;三看化学平衡移动的方向。
化学平衡图像题的解题思路和要点

化学平衡图像题的解题思路和要点摘要:由于化学平衡的图像问题不仅是对学生化学分析能力的考察,也是对学生化学平衡理论素养的考察,因此该类问题是学生感到比较犯难的一类问题。
本文将通过一些实例,对化学平衡问题中常见图像题进行深入的研究。
关键词:化学平衡;图像题;解题思路;要点1化学平衡图像题的解题思路和要点首先,看面。
看清直角坐标系平面中两坐标轴所表示的物理量。
一般纵坐标可以是某物质的百分含量、反应物的转化率、产物的产率、混合气体的平均摩尔质量、反应速率等;横坐标一般为反应时间、温度、压强等。
弄清曲线所代表的物理含义,明确纵坐标所示的物理量随横坐标所示的外界条件变化的趋势。
其次,找点。
把握图像中的特殊点,理解其含义,判断反应的特征或所处的状态。
第一,原点。
根据曲线是否经过原点,可判断反应起始特征。
第二,拐点。
曲线一般是连续光滑的,但出现拐点,说明反应到了一个新的状态,或反应过程中外界条件发生了改变。
第三,交点。
两曲线的交点表示在对应的条件下,纵坐标对应的物理量相等。
第四,线外的点。
在有些图像中,曲线上的点均表示平衡状态,而线外的点即表示非平衡状态。
再次,察线。
主要观察曲线的增减性、斜率、长短高低及连续性。
第一,增减性。
如图1表示某反应物的百分含量随温度的变化关系曲线是减函数,说明温度升高,反应物的百分含量减小,平衡正向移动,从而可判断该反应的正反应是吸热反应。
第二,斜率。
如图2中,正反应速率随压强变化的曲线比逆反应速率随压强变化的曲线斜率大,说明压强增大时,正反应速率的增幅比逆反应速率的增幅大,可判断该反应的正反应方向为气体体积减小方向。
即增大压强平衡正向移动。
第三,线的长短、高低。
如图3表示在不同温度下,转化率随时间变化的曲线,OA对应的线段OA'比OB对应的线段OB'短,说明T1温度时,OA达平衡的时间短,反应速率快,则有T1大于T2,再根据达平衡后T2线高于T1线,判断出温度低,反应物转化率高,该反应正反应为放热反应。
第四讲 【化学平衡图像】知识点总结

第四讲 化学平衡图像一、解答化学平衡图像题的一般方法化学平衡图像题,一是以时间为自变量的图像;二是以压强或温度为自变量的图像。
从知识载体角度看,其一判断化学平衡特征;其二应用勒夏特列原理分析平衡移动过程;其三逆向思维根据图像判断可逆反应的有关特征;其四综合运用速率与平衡知识进行有关计算。
①确定横、纵坐标的含义。
②分析反应的特征:正反应方向是吸热还是放热、气体体积是增大还是减小或不变、有无固体或纯液体物质参与反应等。
③分清因果,确定始态和终态;必要时可建立中间态以便联系始、终态(等效模型)。
④关注起点、拐点和终点,分清平台和极值点,比较曲线的斜率,把握曲线的变化趋势,抓住“先拐先平数值大”。
⑤控制变量:当图像中有三个变量时,先确定一个量不变,再讨论另外两个量之间的关系。
⑥最后检验结论是否正确。
二、常见化学平衡图像归纳:例:对于反应 mA (g)+nB (g) ⇌ pC (g)+qD (g),若 m+n >p+q 且ΔH >0。
1.v-t 图像增大反应物浓度,V 正>V 逆,平衡正向移动。
正反应吸热,升高温度,平衡正向移动。
m+n >p+q ,增大压强,平衡正向移动。
加催化剂,平衡不移动,减小到达平衡的时间。
2.v-p (T )图像由于m+n >p+q ,在平衡时继续加大压强,V 正>V 逆。
由于ΔH >0,在平衡时继续升温,V 正>V 逆。
3.c-t 图像先拐先平数值大,P 1斜率大,说明C 1的速率大,先拐说明先平衡,P 1>P 2。
先拐先平数值大,T 1斜率大,说明C 1速率大,先拐先平衡,T 1>T 2。
控制变量,正反应吸热,同一压强下,T1温度下C的浓度大于T2温度下C 的浓度,所以T1>T2。
控制变量,m+n>p+q,同一温度下,P1压强下C的浓度大于P2压强下C的浓度,所以P1>P2。
解答化学反应速率和平衡图像题的方法

解答化学反应速率和平衡图像题的方法化学反应速率和化学平衡的图像类试题是一种特殊题型,其特点是:图像是题目的主要组成部分,把所要考查的化学知识寓于图中曲线上,具有简明、直观、形象的特点。
该类试题以选择题为主要题型,偶尔也会在非选择题中出现。
因为图像是用二维坐标表示的,所以该类试题包含的信息量比较大,随着高考的不断改革以及对学科能力要求的不断提高,这种数形结合的试题将频频出现。
常见的命题角度有:(1)以物质的量(或浓度)随时间的变化图像为载体,考查化学反应速率的表示方法及其相关计算;(2)以反应过程速率随时间的变化图像为载体,考查反应速率的影响因素及相关分析;(3)以物质的含量随时间的变化图像为载体,考查外界条件对化学平衡的影响以及平衡移动过程中相关量的变化分析;(4)以反应速率随温度、压强等的变化图像为载体,考查化学平衡移动的规律及化学反应方向的判断。
一、速率—压强(或温度)—时间图像此类图像定性揭示了v正、v逆随时间(含条件改变对速率的影响)变化的规律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。
以反应m A(g)+n B(g)p C(g)+q D(g) ΔH>0,且m+n>p+q为例,各类条件改变图像如下:下列各图是温度(或压强)对反应:2A(s)+2B(g)2C(g)+D(g) (正反应为吸热反应)的正、逆反应速率的影响,曲线交点表示建立平衡时的温度或压强,其中正确的是( )[解析] 无论是升高温度还是增大压强,v(正)、v(逆)均应增大。
B项中v(逆)减小,D项中v(正)和v(逆)均减小,故B、D项均错误;该反应的正反应是一个气体分子数增大的吸热反应,升高温度,平衡向正反应方向移动,则v(正)>v(逆),A项错误;增加压强,平衡向逆反应方向移动,则v(逆)>v(正),C项正确。
[答案] C二、含量(或转化率)—时间图像常见的形式有如下图所示的几种(C%指某生成物百分含量,B%指某反应物百分含量),这种图像的折点表示达到平衡的时间,曲线的斜率反映了反应速率的大小,可以确定T(p)的高、低(大、小),水平线高低对应平衡移动方向。
高考化学反应图像题的解题方法总结

高考化学反应图像题的解题方法总结一、离子反应图像考查知识点:根据图像考查反应发生的先后顺序、书写离子反应方程式、分析溶液的成分、离子的共存与推断、计算反应物的量或由离子反应画出相应的图像等。
实质:离子反应图像问题,归根结底,考查的实质仍然是离子反应和离子共存问题。
1.离子反应图像溶液中存在多种还原剂(或氧化剂),加入同一种氧化剂(或还原剂)时,必须按照“强者先行”的原则,考虑反应的先后顺序。
只有当“强”的反应完后,“弱”的才能发生反应。
2.离子共存及离子计算图像离子共存图像要谨防离子共存的陷阱,特别要注意一些隐含条件和隐性关系;离子计算的前提是掌握离子反应方程式的书写,特别要注意物质间量的关系,遵循三大守恒原则和溶液电中性原则。
二、化学平衡图像化学平衡图像是中学化学基础图像知识的一个重要方面,它能把抽象的化学平衡理论形象直观地表述出来。
化学平衡图像题是高考必考题型之一,根据图像坐标表示的意义,将常考的化学平衡图像分成如下三类。
1.量值-时间图像图像中的纵、横轴分别代表物质的数量(如浓度、百分含量、转化率、产率等)与反应时间(过程),将可逆反应中物质的数量随时间的变化体现在图像中。
该类题解答时要明确曲线“走势”代表的意义,并由此确定反应进行的方向,再进一步确定改变的条件。
千万要注意此类图像中可能出现的“交点”并不代表平衡点,只有某种量值不随时间改变时的点才是平衡点。
2.量值-条件图像将物质或反应体系的某种量值与温度、压强、浓度、催化剂中的某一种之间的关系,反映在图像中。
解答时首先要仔细观察图像,找出相关量值间的变化关系,然后将图像中的这种对应关系与理论知识进行对照,分析其是否符合理论上推导出来的关系,最后确定答案。
3.量值-时间-条件图像该类图像反映的是某一物质的量值(如浓度、转化率、产率、百分含量等)与一种或两种外界条件(温度、压强、催化剂)随时间的变化关系。
其图像构成的特征是图像中有一表明反应已达到平衡的突变点(平衡点、最大值、最小值)。
高三化学--化学平衡的判断与图像题解题方法1

若反应向右进行,则X2、Y2、Z三种物质的浓度范围依次是:0~0.1mol/L、0.2mol/L~0.3mol/L、0.2mol/L~0.4mol/L;若反应向左进行,则X2、Y2、Z三种物质的浓度范围依次是:0.1~0.2mol/L、0.3mol/L~0.4mol/L、0mol/L~0.2mol/L。
②用不同种物质来表示反应速率时速率不一定相等,但必须符合两方面
(i)表示两个不同的方向。
(ii)速率之比=浓度的变化量之比=物质的量的变化量之比=化学方程式中相应的化学计量数之比
4、定:因为V(正)=V(逆)≠0,所以同一瞬间,同一物质的生成量等于消耗量。总的结果是混合体系中各组成成分的物质的量、质量,物质的量浓度,各成分的百分含量(体积分数、质量分数),转化率等不随时间变化而变化。或在反应过程中,如M、ρ、p、T等某一时刻保持不变即达到了平衡。
【解析】A、N≡N断裂代表正反应速率,H-H键形成代表逆反应速率,且比值为1:2,A正确。B、N≡N断裂,H-H断裂都只代表逆反应速率,B错误。C、N-H键断裂代表逆反应速率,N≡N断裂代表正反应速率,且ΔN2:ΔNH3=1:2,C正确。D、表示反应速率的方向一致,D错误。
【答案】A、C
2、从物质的量、质量、浓度(g、aq)、百分含量、体积(g)、体积分数(g)等命题
教育学科教师辅导教案
学员编号:年级:高三课时数:3
学员姓名:YYY辅导科目:化学学科教师:XX
课题
第3课化学平衡的判断与图像题解题方法
教学目标
1、学会化学平衡的判断方法
2、了解并会运用常见化学平衡图像题的解法
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
A、正反应吸热,L是气体 B、正反应吸热,L是固体 C、正反应放热,L是气体 D、正反应放热,L是固体
或液体
【练习】
对于可逆反应:A2(g)+3B2(g) 2AB3(g)
ΔH<0下列图象中正确的是 ( A )B
NH3%变小
三、含量—时间与温度(压强)图
注意曲线变化趋势 速率、平衡
11、温度一定,压强分别
为P1和P2时,反应体系
Y 的
X(s)+2Y(g) nZ(g)中反 转
应物Y的转化率与时间的 化
关系如图2-27所示,由 率
此可知( )A。
A、P1>P2,n>2 B、P1>P2,n<2 C、P1<P2,n<2 D、P1<P2,n>3
定其中NH3的体积分数,绘图如下:
1)A,B,C,D,E五点中,尚未达到化
学平衡状态的点是_______。
2)此可逆反应的正反应是______反应。 (放热、吸热)
3)AC段的曲线是增函数, C应A右CE速CE段进::率行曲已反和,线达应平是N平开衡H减衡始3角%函,v增正度升数>大说v温,逆明。使试,理平反从由衡应反。左向移,
qC(g) ΔH>0,在恒温条件下,B的
体积分数(B%)与压强(p)的关系如
图6所示,有关叙述正确的是(
)
。 A.n<q
AC
B.n>q
C.X点,v正>v逆; Y点,v正<v逆 D.X点比Y点反应速率快
10、下,任其发生
反应N2+3H2
2NH3,并分别在t秒时测
1.某温度下,在体积为5L
的容器中,A、B、C三
种物质物质的量随着时间
变化的关系如图1所示,则
该反应的化学方程式
为
,
2S内用A的浓度变化和用 B的浓度变化表示的平均 反应速率分别为 、 。
注意变化量、平衡的特征
2、今有正反应放热的可逆反应,若反应开始经t1s 后达平衡,在t2s时由于反应条件改变,使平衡破 坏(,1)到该t3反s时应又的达反平应衡物,是如_X_右_、_图Y__所示, (2)该反应的化学方程式为___X_+_Y_____Z______
化学平衡图像解题方法
图象题是勒沙特列原理等化 学平衡知识在直角坐标系中的直 观反映,是化学平衡的重点、难 点
图象题的一般解题思路
1.分析纵横坐标及曲线表示的意义。 2.分析曲线的变化趋势,与速率、平衡
的关系。 3.分析特殊点(起点、拐点、终点) 4.必要时添加辅助线。 5.定一议二
1.物质的量(或浓度)与时间图象
A.N2O3(g) NO2(g)+NO(g) B.3NO2(g)+H2O(l) 2HNO3(l)
+NO(g) C.4NH3(g)+5O2(g)
4NO(g)+6H2O(g) D.CO2(g)+C(S)
2CO(g)
6、对于反应X(g)+Y(g) XY(g) ΔH<0,下列能正
确描述温度或压强对正逆反应速率的影响的曲线是
8.有一化学平衡mA(g)+nB(g) p C(g)+qD(g),如图所示是A的转化 率同压强、温度的关系,分析图可以得出的正
确结论是( A )。
A.正反应吸热,m+n>p+q B.正反应吸热,m+n<p+q C.正反应放热,m+n>p+q D.正反应放热,m+n<p+q
9.可逆反应mA(s)+nB(g)
(3)分析从t2到t3时曲线改变的原因是( )D
A、增大了X或Y的浓度
B、使用了催化剂
C、缩小体积,使体系
压强增大
D、升高了反应温度
2.速率与时间图象
重点分析:改变条件的初始时刻
3、对达到平衡状态的可逆反应X+Y
Z+W,在其他条件不变的情况下,增大压
强,反应速率变化图象如图所示,则图象
中关于X、Y、Z、W四种物质的聚集状态
为( A )
v
A.Z、W均为气体, X、Y中有一种是气体
B.Z、W中有一种是 气体,X、Y皆非气体
V正
V’逆 V’正=V’逆 V’正
V逆
C.X、Y、Z、W皆非气体
t
D.X、Y均为气体,
Z、W中有一种为气体
3.速率与压强(或温度)图象
注意交点:速率相等,平衡 交点后的变化
【练习】
5、符合图象的反应为(B )。
p2 p1
t
12、同压、不同温度下的反
应:
A(g)+B(g) C(g) A
A的含量和温度的关系如图 的
所示,下列结论正确的是 物
( C)
质 的
A.T1>T2,△H>0
量
B.T1<T2,△H>0
分
C.T1>T2,△H<0
数
D.T1<T2,△H<0
T1 T2
t
13、在密闭容器中进行下列反应: M(g)+N(g) R(g)+2L 此反应符合下面图象,下列叙述正确的是
(v为反应速率,T为温度,P为压强) (
)
EF
7、反应A(g)+B(g) C(g) △H<0已达平衡, 升高温度,平衡逆移,当反应一段时间 后反应又达平衡,则速率对时间的曲线
为( )C
4.转化率(或质量分数等)与压强、 温度图象
线上的点的意义?线外的点(A或B)的意义? 根据线的走势又可以分析哪些问题?
