第十一章 电解分析法(用)
11 电位分析法

膜电位
E膜
K
RT nF
ln
a阳离子
RT E膜 K nF ln a阴离子
EISE=E膜+ E内参
比
2.晶体膜电极
结构:(氟电极) 敏感膜:(氟化镧单 晶):掺有EuF2 的LaF3单晶切片;
内参比电极:Ag-AgCl电极(管内)。
内参比溶液:0.1mol/L的NaCl和0.10mol/L 的NaF混合溶液(F-用来控制膜内表面的电位, Cl-用以固定内参比电极的电位)。
E E甘汞 E玻璃 E液接
EHg2Cl2/Hg (EAgCl/Ag E膜 ) E液接
2.303RT
EHg2Cl2/Hg EAgCl/Ag K
F
lgaH EL
常数K´包括:
外参比电极电位 内参比电极电位 不对称电位 液接电位
E K 2.303RT pH F
25 C : E K 0.059pH
a’1 、 a’2 分别表示玻璃膜外、内水合硅胶层表面的
H+活度;
k1 、 k2 则是由玻璃膜外、内表面性质决定的常数。 由于玻璃膜内、外表面的性质基本相同,则k1=k2 , a’1 = a’2
E膜 = E外 - E内 = 0.059 lg( a1 / a2)
由于内参比溶液中的H+活度( a2)是固定的,则:
膜电极
特点:仅对溶液中特定离子有选择性响应(离子 选择性电极)。
膜电极的关键:是一个称为选择膜的敏感元 件。
敏感元件:单晶、混晶、液膜、高分子功能 膜及生物膜等构成。
膜内外被测离子活度的不同而产生电位差。
将膜电极和参比电极一起插到被 测溶液中,则电池结构为:
外参比电极‖被测溶液( ai未知)∣ 内充溶液( ai一定)∣ 内参比电极 (敏感膜)
无机及分析化学第十一章 电势分析法

二、参比电极
Ag/AgCl电极: A g (l) A g C l(s) C l (a Cl )
A g C l(s) e A g (s) C l
0 .0 5 9 2 lg a C l 0 .1 9 4 V (2 9 8 K ))
第十一章第一节
导线 电极帽 加液口 饱和KCl溶液 Ag/AgCl
第二类电极——金属金属难溶盐电极:M MXn
M 这X n 类 电n e 极主M 要有 n AX g /AgX 电极M n 、/M 甘 汞0 .0 电n 5 9 极2 l 等g K 。s p ( a (M X ) X nn )
三、指示电极
第十一章第一节
第三类电极——氧化还原电极
差。
膜电势=膜外相间电势-膜内相间电势
电极管
内参比电极 内参比溶液 敏感膜
三、指示电极
第十一章第一节
M
外内k1
0.0n592lgaaM M外 外液 膜k2
0.0n592lgaaM M内 内液 膜
(k1 k2)0.0n592lgaaM M内 外液 液
k
0.0592 n lgaM外
阳离子取“+” 阴离子取“–”
若化学电池为: () 参比电极 待测溶液(ai) 指示电极 (+) 则 EKSlgai
一、电势分析法的基本原理
第十一章第一节
2. 电势滴定法的测量原理
电势滴定法就是以指示电极的电势突变(或电池电 动势的突变)来指示滴定终点的滴定分析法。
(2)导电性(尽管很小):通常以荷电离子的在膜内 的迁移形式传导;
(3)高选择性:膜或膜内的物质能选择性地和待测离 子“结合”。通常的“结合”方式有:离子交换、结晶 、络合。
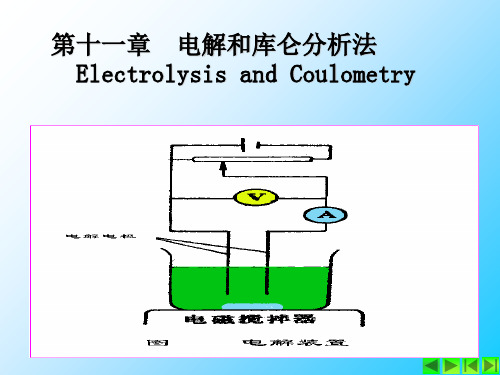
电解及库仑分析法

第十一章电解及库仑分析法1、什么叫做分解电压?为什么实际分解电压的数值比按电解产物所形成的原电池的反电动势要大?答:分解电压:在电解时,能够使被电解物质在两电极上产生迅速、连续的电极反应,所需的最低外加电压。
因为当电流通过电解池时,电极的实际电位常偏离平衡电位,即产生极化现象。
极化使阳极电位变得更正,阴极电位变得更负,即产生过电位(η=ηa-ηc),而分解电压是原电池电动势、电池过电位、电解池电压降iR之和,即:U = (E a +ηa) -(E c +ηc) + iR所以,实际分解电压比电池反电动势大。
2、控制电流电解分析和控制电位电解分析各有何优缺点?答:控制电流电解分析,由于电解电流大,并且基本恒定,因此电解效率高,分析速度快。
但由于阴极电位不断负移,其它离子也可能沉积下来,故选择性差。
而控制阴极电位能有效防止共存离子的干扰,选择性好,该法即可作定量测定,又可广泛作为分离技术,常用于多种金属离子共存情况下某一种离子的测定。
3、库仑分析与电解分析在原理、装置上有何异同点?答:电解分析与库仑分析在原理、装置上有许多共同之处,都需要通过控制分解电压或阴极电位来实现不同金属离子的分离,库仑分析也属于电解分析的范畴。
不同的是通常的电解分析是通过测量电解上析出的物质的质量来进行定量分析,而库仑分析是通过测量通过体系的电量(Q nFM m )来进行定量测定。
在测量装置上,二者也有共同之处,均需要有阴极电位控制装置,不同之处在于库仑分析中需要在电解回路中串联一个库仑计以测量通过体系的电量。
4、用库仑法在定量分析时,要取得准确的分析结果应注意些什么?答:要求电极反应单纯,电流效率100%,应注意消除各种影响电流效率的因素。
5、在恒电流库仑分析法和控制电位库仑分析法中,是如何测得电量的?答:在控制电位库仑分析法中,是用精密库仑计来测量电量的。
常用的有气体库仑计和电子积分库仑计等。
在恒电流库仑滴定中,由于电流是恒定的,因而通过精确测定电解进行的时间及电流强度,即可计算出电量。
电解及库仑分析法习题解答

第十一章 电解及库仑分析法习题解答1.以电解法分析金属离子时,为什么要控制阴极的电位解:由于各种金属离子具有不同的分解电位,在电解分析时,金属离子又大部分在阴极上析出,因此需要控制阴极的电位,以便不同金属离子分别在不同的电位析出,从而实现分离的目的。
2. 库仑分析法的基本依据是什么为什么说电流效率是库仑分析发关键问题在库仑分析中用什么方法保证电流效率达到100%解:根据法拉第电解定律,在电极上发生反应的物质的质量与通过该体系的电量成正比,因此可以通过测量电解时通过的电量来计算反应物质的质量,这即为库仑分析法的基本原理。
由于在库仑分析法中是根据通过体系的电量与反应物质之间的定量关系来计算反应物质的质量的,因此必须保证电流效率100%地用于反应物的单纯电极反应。
可以通过控制电位库仑分析和恒电流库仑滴定两种方式保证电流效率达到100%。
3. 电解分析和库仑分析在原理、装置上有何异同之处解:电解分析与库仑分析在原理、装置上有许多共同之处,都需要通过控制分解电压或阴极电位来实现不同金属离子的分离,库仑分析也属于电解分析的范畴。
不同的是通常的电解分析是通过测量电解上析出的物质的质量来进行定量分析,而库仑分析是通过测量通过体系的电量来进行定量测定。
在测量装置上,二者也有共同之处,均需要有阴极电位控制装置,不同之处在于库仑分析中需要在电解回路中串联一个库仑计以测量通过体系的 电量。
4. 试述库仑滴定的基本原理。
解: 库仑滴定是一种建立在控制电流电解基础之上的滴定分析方法。
在电解过程中,于试液中加入某种特定物质,以一定强度的恒定电流进行电解,使之在工作电极上(阳极或阴极)电解产生一种试剂,此试剂与被测物质发生定量反应,当被测物质反应完全后,用适当的方法指示终点并立即停止电解。
然后根据所消耗的电量按照法拉第定律计算出被测物质的质量:nitM m 96487= 5. 在控制电位库仑分析法和恒电流库仑滴定中,是如何测定电量的解:在控制电位库仑分析法中,是用精密库仑计来测定电量的.在恒电流库仑滴定中,由于电流是恒定的,因而通过精确测定电解进行的时间及电流强度,即可计算出电量.6.在库仑滴定中,相当于下列物质多少克 (1)OH-, (2) Sb(III 到V 价), (3) Cu(II 到0价), (4)As2O3(III 到V 价).解:根据法拉第电解定律,n itMm 96487=得: (1) mOH-=1×10-3 ×1 × (96487 ×2)= × ×10-9= ×10-8g(2)mSb= × × 10-9= × 10-7g(3)mCu= × × 10-9= × 10-7g(4)mAs2O3 = × ×10-9 /2 = ×10-7g7.在一硫酸铜溶液中,浸入两个铂片电极,接上电源,使之发生电解反应.这时在两铂片电极上各发生什么反应写出反应式.若通过电解池的电流强度为,通过电流时间为, 在阴极上应析出多少毫克铜解:阴极:Cu2+ + 2e = Cu↓阳极: 4OH- - 4e = 2H2O + O2↑故: m = it ×MCu/(2 ×96487) =8. 10.00mL浓度越为的 HCl溶液,以电解产生的OH-滴定此溶液,用pH计指示滴定时pH的变化,当到达终点时,通过电流的时间为,滴定时电流强度为20mA,计算此HCl溶液的浓度.解:根据题意:m/M = 20 ×10-3 ××60/96487 = ×10-5mol故: CHCl = ×9.以适当方法将0.854g铁矿试样溶解并使之转化为Fe2+后,将此试液在处,在铂阳极上定量地氧化为Fe3+,完成次氧化反应所需的电量以碘库仑计测定,此时析出的游离碘以标准溶液滴定时消耗. 计算试样中Fe2O3的质量分数.解: 1mol Fe2+ ~ 1mol e ~ 1/2mol I2 ~1mol S2O32-1mol Fe2O3 ~ 2mol Fe ~ 2mol S2O32-设试样中FeO3的摩尔数为x,则: 1: 2 = x : ×x = ×10-4molW% = ××10-4 × 100/ = %10.上述试液若改为以恒电流进行电解氧化,能否根据在反应时所消耗的电量来进行测定为什么解:不行,难以维持电流效率为100%(原因参见教材第189页)。
硫酸铜分解电压解释

极化的结果出现了过电位! 极化的结果出现了过电位!
东 北 师 范 大 学 分 析 化 学 精 品 课
16
按 照极化 产生的 原 可分为两种: 因,可分为两种:
浓差极化: (1)浓差极化:是由于 电解过程中电极表面附 近溶液的浓度与主体溶 本体) 液(本体)的浓度差别引 起的极化现象称为浓差 极化。譬如电解Cu 极化。譬如电解Cu2+: Cu2+ + 2e = Cu
过电压:电解池的过电压等于阴阳极过电位绝对值之和。 过电压:电解池的过电压等于阴阳极过电位绝对值之和。
η= ηc + ηa
东 北 师 范 大 学 分 析 化 学 精 品 课
14
电 综合来看 解 电 流
东 北 师 范 大 学 分 析 化 学 精 品 课
15
理论分解电压小于实际分解电压的原因是由于过 电位的存在,但过电位是如何产生的呢? 电位的存在,但过电位是如何产生的呢? 极化:为了使电解反应能显著地进行, 极化:为了使电解反应能显著地进行,回路中有一定的电 解电流通过,对阴极反应来说,必须使阴极电位比其平衡 解电流通过,对阴极反应来说, 电位更负一些,而对于阳极来说, 电位更负一些,而对于阳极来说,必须使电极电位比其平 衡电位更正一些。 衡电位更正一些。这种电极电位与平衡电位之间产生偏差 的现象称为极化。 的现象称为极化。
东 北 师 范 大 学 分 析 化 学 精 品 课
6
以下列电池为例 分解电压
电动势
东 北 师 范 大 学 分 析 化 学 精 品 课
7
因此外加电压U 因此外加电压 外 U外= U分+iR 式中i为电解电流, 为回路中的中电阻 为回路中的中电阻。 式中 为电解电流,R为回路中的中电阻。 为电解电流
第十一章__电位分析和电导分析

内
内Θ
2.303RT F
log
a( H ,内 ) a'( H ,内 )
膜 外 内
膜 2 .3 0 F 3 R T lo g a a ( ( H H ,,内 试 ) ) K 2 .3 0 F 3 R T lo g a (H ,试 )
2019/8/8
Es = Ks + 0.0591pHs
⑶测定未知溶液的电动势
(1)
Ex = Kx + 0.0591pHx (2)
2019/8/8
第21页
上一页
下一页
总目录
由于测量条件基本相同,所以: Ks = Kx
(2) - (1)得:
Ex - Es = 0.0591(pH x -pH s )
pH x
pHs
Ex - Es 0.0591
:电导率,指两个相距1cm、面积为1cm2
的平行电极间电解质溶液的电导
2019/8/8
第30页
上一页
下一页
总目录
电导的测量装置包括电导池和电导仪。 电导池:由两个电导电极构成。电导电极一般由两片
平行的铂片制成,铂片的形状面积及两片间 的距离可以根据不同要求进行设计。
电导仪:主要由电源、测量电路和显示器三部分组
1)准确度高于一般的滴定分析方法。
与经典的滴定分析相比,由于终点的判断采用的 是电信号而非指示剂,因而大大提高了滴定的精确 度。这种方法特别是用于指示剂无法判断终点的滴 定分析。
2019/8/8
第25页
上一页
下一页
总目录
2)特别适用于混浊、有色、无适合指示剂的溶液 中待测物质的测定。
第11章电化学分析法导论

NCE 0.2828V
2020/1/17
21
双液接甘汞电极示意图:
导线 绝缘帽 加液口
饱和KCl溶液 内部电极
多孔物质
2020/1/17
22
外盐桥套管 0.1mol/L KNO3溶液
(2)指示电极 电极电位则随测量溶液和浓度不同而变
化。由电池电动势的大小可以确定待测溶液 的活度(常用浓度代替)大小。
适合于化工生产中的自动控制和在线分析。 4.传统电化学分析:无机离子的分析; 5.测定有机化合物也日益广泛。如药物分析
2020/1/17
4
三、电化学分析法的类别(主要) 1.电位分析法 ①直接电位法:电极电位与溶液中电活性物质
的活度有关。 ②电位滴定:用电位测量装置指示滴定分析过
程中被测组分的浓度变化。
第十一章
11-1 概述
电化学分析法导论 11-2 电化学分析基础
11-3电极的分类
2020/1/17 1
11-1 概述
一、电化学分析 1.定义
应用电化学的基本原理和实验技术,依据物 质的电化学性质来测定物质组成及含量的分 析方法称之为电化学分析或电分析化学。
2020/1/17
2
2.电化学分析法的重要特征 直接通过测定电流、电位、电导、电量
电极反应速度慢,电极上聚集了过多的电 荷(与平衡状态比)。 ★减小电化学极化的方法
只有增加外加电压, 克服反应的活化能,才 能使电解反应得以进行。
2020/1/17
18
二、电动势及电化学参数测量的基本原理
1.电动势的测量
当电池中的电流为零或接近零时,两电极间
的电位差即为电池的电动势E。
EΔ
★为了使U外= E测 ,在外电路上加一大小相等、 方向相反的反向外加电压,并使外电位随两
11电解与库仑分析法

在阴极 阴极上,析出电位越正 析出电位越正的组分,越易还原; 阴极 析出电位越正 在阳极 阳极上,析出电位越负 析出电位越负的组分,越易氧化 越易氧化。 阳极 析出电位越负 越易氧化 分解电压是指整个电解池来说,析出电位就某一电 极来考虑,因而析出电极电位更具实际意义。
电解与库仑分析法
对于电化学可逆电极过程,分解电压与析出 电位间有
U = (ϕa +ηa ) −(ϕc +ηc ) +iR
电解与库仑分析法
浓差极化与电化学极化
产生超电位的原因: 产生超电位的原因:电极极化 电极极化:电解时, 电极极化:电解时,电极上有净电 流流过时, 流流过时,电极电位偏离其平衡电位的 现象。 现象。 浓差极化:电流流过电极, 浓差极化:电流流过电极,表面形 成浓度梯度。使正极电位增大, 成浓度梯度。使正极电位增大,负极电 位减小。 位减小。 减小浓差极化的方法: 减小浓差极化的方法: a.减小电流,增加电极面积; a.减小电流,增加电极面积; 减小电流 b.搅拌, b.搅拌,有利于扩散 搅拌
作业
第
11
章
电解与库仑分析法
电解与库仑分析法
概述
电位分析法 化学电池有 无电流通过 电解与库仑分析法
电解分析法
库仑分析法
电解与库仑分析法
电解与库仑分析法
电解分析: 应用外加电源电解试液, 电解分析: 应用外加电源电解试液,通过电极反应 使被测物质转化为固相在电极上析出, 使被测物质转化为固相在电极上析出,然后对析出物进行 转化为固相在电极上析出 称量以求得被测组分的含量。 电重量分析法。 称量以求得被测组分的含量。又称为 电重量分析法。 以求得被测组分的含量 适用于对常量组分的测定。 适用于对常量组分的测定。 常量组分的测定 库仑分析法: 依据法拉第电解定律,由电解过程中 库仑分析法: 依据法拉第电解定律, 所消耗的电量来求出被测组分的含量。 所消耗的电量来求出被测组分的含量。 电量来求出被测组分的含量 适用于对微量组分的测定 有较高的准确度。 微量组分的测定, 适用于对微量组分的测定,有较高的准确度。
第十一章 电解及库仑分析法..

it:t时的瞬间电流; i0 :初始电流; ct :t时刻的浓度; c0 :初始浓度;k为常数
4.特点与应用
选择性好;可定量分析,又可分离。表11-2
三、汞阴极电解分离法
特点:
1 、 H 在汞阴极上过电位大,许多金属可以在汞 阴极上析出为金属或汞齐 2、由于多数金属能形成汞齐,使得汞电极上金 属活度减小,析出电位变正,易于被还原。
1.基本装置
三电极系统 自动调节外电压,阴极电位保持恒定。选择性好。
电位计
R′
图11-6 自动控制阴极电位电解装置
2.阴极电位的选择
a.a、b分别为A、B两种金属离子析 出电位。 b. A物质析出完全时,阴极电位未达 到B物质的析出电位(图),电位控制 在d处;控制在c处,B物可电解 c.对于反应离子,浓度降低10倍,阴极 电位降低0.059 /n V。 d.被分离两金属离子均为一价,析出 电位差>0.3 V e. 被分离两金属离子均为二价或三 价,析出电位差分别为0.15 V和0.10 V
Ag的析出电位为: E = E0Ag+,Ag+0.059log[Ag+] =0.80+0.059log0.01 =+0.68V Cu的析出电位为 E = E0Cu2+,Cu + =0.35 + =+0.35V
0.059 2 0.059 log[Cu2+] 2
log1.0
因银的析出电位较铜为正,故银离子先在阴极上析出。
本章小结
1、分解电压、析出电位、极化现象、过电位 2、实际分解电压 U=(Ea-Ec)+(ηa+ηc)+iR 3、控制电流或控制电位电解法基本原理 i-t及c-t关系 4、库伦分析法的基础——法拉第定律
仪器分析第十一章 电解与库仑分析法

U (a a ) (c c ) iR
——称为电解方程式,表示电解时,外加电压等于阳、 阴两极实际电位的差值与电解电路中的iR降。 上述电解CuSO4溶液中, a= 0.72V(O2), c可忽 略。则实际的外加电压为: 实际需要的外加电压 U U d iR 0.89 0.72 0.05 高达1.66V,大于理论计
电极反应: Ag+ + e- = Ag Cu2+ + 2 e- = Cu
d , Ag 'Ag / Ag 0.059lg[ Ag ] Ag的析出电位:
0.80 0.059lg(0.01) 0.682 (V )
Cu的析出电位:
d ,Cu
0.059 lg[ Cu 2 ] 2 0.059 0.345 lg( 1) 0.345 (V ) 2
三、二者的异同点:
1. 不同点
电重量法只能用来测定高含量物质;库仑分析法
特别适用于微量、痕量成分的分析。
2. 共同点: a. 测定过程中不需要基准物质和标准溶液,是一 种绝对分析法; b. 两种方法的准确度都高。
§11-2 电解分析法
一、电解过程
1. 电解
以电解池为基础,以双铂电极作电极,在电解池的 两个电极上加一直流电压,使电解池中有电流通过,物 质在两个电极上发生氧化还原反应而引起物质分解的过
二、库仑分析法
定义:以测量电解过程中所消耗的电量为基础来求 出待测组分含量的方法。
可用于测量留在溶液中或排到周围大气中而不在电
极上沉积的物质。由于现代测量技术可以精确测量微小 的电流,因此,库仑分析法是一种高精密度和灵敏度的 分析方法误差较小。 库仑分析法是根据法拉第定律从电解过程中消耗的 电量来测定物质的含量,所以要求100%的电流效率。
聊城大学仪器分析—11.电解与库伦分析法

3
11.2 电解分析的基本原理
电解Cu2+溶液的电流-电压曲线
理论计算曲线
i/A
a' a
实验曲线
理论分解电压
0
U
U
d'
d
实际分解电压
U/V
电解方程式: U iR
阳
阳
阴
阴
理论分解电压小于实际分解电压的原因是由于超电位的存在
4
11.2 电解分析的基本原理
阳极氧化析出:阳极电位比析出电位更正; 阴极还原析出:阴极电位比析出电位更负; 在阳极上,析出电位越负者,越容易氧化; 在阴极上,析出电位越正者,越容易还原。
7
11.2.4 离子的析出顺序及完全程度
例:含有1mol/LCu2+-0.01mol/L Ag+的混合液,以Pt为 电极进行电解,哪种离子先析出? 能否完全分离?
辅助电极:套一多孔性隔膜(如微孔玻璃),防止干扰测定
(2) 库伦滴定终点的判定 根据测定溶液的性质选择适宜的方法 例如各种伏安法、电导法及比色法、化学指示剂等 伏安法判定:两组电极,一组电解,一组指示终点
22
3. 指示终点的方法 (1) 指示剂法:以电解过程中指示剂颜色的变化指示
滴定终点 (2) 电位法:由一指示电极如Pt电极和一参比电极如
第十一章 电解与库伦分析法
11.1 电解与库伦分析法 电解分析法:利用外加电源电解试液,通过称量沉积于
电极表面的沉积物的质量进行测定的方法
库伦分析法:在电解效率为100%的条件下,记录电解 过程中消耗的电量,根据法拉第定律求得 待测组分的含量的分析法
特点: (1) 历史悠久,方法成熟 (2) 准确度高,适用于痕量和微量组分的测定 (3) 无需基准物质和标准溶液
第十一章-体液电解质和微量元素检验(一)

(2)吸收与排泄 钾主要来自蔬菜、水果、谷类、豆类及肉类, 成人需要量KCl 2~3g/d, 吸收率约90%。
钾主要通过肾排泄, 约占80%, 但肾脏对钾的保留能力 小于钠, 特点为“多吃多排, 少吃少排, 不吃也排”。 每日约有20~40mmol KCl从尿中排出(当没有K+摄 入时), 另外, 粪便和汗液也有少量K+排出。
90%。血清氯98~106mmol/L。
(2)吸收与排泄
① 人体所摄入的钠与氯主要来自食盐, 需要量为4.5~ 9.0g/d, 几乎全部被消化道吸收。
② Na+、Cl-主要由尿伴行排出, 尤对Na+排出有很 强的调控能力, 即“多吃多排、少吃少排、不吃不排”。 肾钠阈为110~130 mmol/L。汗液亦可排出少量的
(二)血清钠、钾的测定 1.血清钠、钾测定方法
火焰光度法(FES)、原子吸收分光光度法 (AAS)、离子选择电极法(ISE)和酶法。
参考方法---火焰光度法 常规方法---离子选择电极法
1. 火焰光度法(FES)
➢原理(发射光谱分析法)
样品被吸入雾化室雾化后, 钠、钾经火焰
激发, 由基态原子跃迁到激发态原子, 激发
态原子不稳定, 继而以特定的光谱释放能量
返回基态,
钠、钾发射的光谱分别为
589nm(黄色)和767nm(深红色)。发
射光谱强度在一定范围内与样品中Na+、
K+成正比。
➢方法学评价
(1)优点: 快速、准确、精密度高、特异性好、成本低 廉。 被推荐为Na+、K+测定的参考方法。 (2)缺点: 使用丙烷等燃气,给实验室带来安全隐患。
体液中主要的阳离子有Na+、K+、Ca2+、Mg2+等。
分析化学 第十一章 电位分析法

拓展知识:自动电位滴定法的应用
实验二十二
一、实验目的
电位法测定溶液的pH
1.学会用单标准和双标准pH缓冲溶液法测定 一、实验目的 水溶液pH的测量技术; 2.掌握用玻璃电极测量溶液pH值的基本原理。
二、实验原理
以玻璃电极作指示电极,饱和甘汞电极作参比电极, 用电位法测量溶液的pH值,常采用相对方法,即选用 pH值已经确定的标准缓冲溶液进行比较而得到欲测溶 液的pH值。
Ag / Ag
Ag / Ag
第十一章 电位分析法
“十二五”职业教育国家规划教材
实验二十二 电位法测定溶液的pH 第一节 概述
第二节 参比电极
第三节 指示电极第四节 源自接电位法实验二十三 水中氟化物含量的测定(离子选择性电极法)
第五节 电位滴定法
实验二十四 水中氯含量的测定(电位滴定法)
学习目标
1、掌握电位分析法基本原理,电极电位、参比 电极、指示电极等基本概念。
一、甘汞电极
甘汞电极是以甘汞(Hg2Cl2)饱和的一定浓度的 KCl溶液为电解液的电极, 内玻璃管中封接一根 铂丝,铂丝插入纯汞中(厚约0.5~1 cm),下置 一层甘汞(Hg2C12)和汞的糊状物;外玻璃管中 装入KCl溶液,即构成甘汞电极。电极下端与被测 溶液接触部分是以石棉丝或玻璃砂芯等多孔物质 组成的通道。
第一节 概述
一、测量装置的组成
电位分析法(Potentiometric methods)是在通过 电池的电流为零的条件下测定电池的电动势,从 而利用电动势与浓度的关系来测定物质活度或浓 度的一种电化学分析方法。
电动势测定装置
二、电位分析法的分类
电位法: 用专用的指示电极如离子选择电极, 把被测离子A的活度α A转变为电动势E
第11章电解及库仑分析法

Ud=-(Ec-Ea)
电解池的反电动势
Cu2+ + 2e = Cu
2H2O = O2 + 4H+ +4e 阳极
阴极
铜电极(正极)
氧电极 (负极)
铜氧原电池
铜氧原电池:阴极(+)为铜电极,阳极(-)为氧电极
0.059V lg aCu 2 2 0.059V 0.34V lg 0.1 0.31 (V) 2 若原电池的氧气分压PO2 为21278 Pa,则 E (Cu 2 /Cu) 0.34V 0.059V 4 E (O 2 /H 2 O) 1.23V lg pO2 aH 4 0.059V 21278 4 1.23V lg[(2 0.5) ] 4 101325 1.22 (V)
恒电位电解法是依据电解后称量析出的物质质量来 在控制电位电解过程中,为了保 计算含量; 持电极电位恒定,必须:
A.保持外加电压不变 恒电位库仑分析是依据电解过程中所消耗的电量来 B. 不断改变外加电压 计算物质的含量。 C.保持电解电流恒定 恒电位库仑分析法已用于50多种元素的测定。
电量测量方法: 1、气体库仑计 在电路中串联一个用于测量 电解中所消耗电量的库仑计。常用 氢氧库仑计,其构造如右图所示。 标准状态下,每库仑电量相当于 0.1741mL 氢氧混合气体,设得到 V mL 混 合 气 体 , 则 电 量 Q=V/0.1741 , 0.5mol· L-1 由Faraday定律得待测物的质量 Na2SO4溶液
在阳极上析出氧气的平衡电位,是氧气的析出电位。 阳极氧化析出时所需最负的阳极电位。
阴极反应:
Cu 2 2e Cu
2 H 2 O 4 H O 2 4e
第十一章电解质检测与血气分析

第十一章电解质检测与血气分析人体内存在的液体称为体液(bodyfluid)。
体液中有无机物和有机物,无机物与部分以离子形式存在的有机物统称为电解质。
葡萄糖、尿素等不能解离的有机物称为非电解质。
体液以细胞膜为界,可分为两大部分,即细胞内液(intracellulerfluid,ICF)和细胞外液(extracellulerfluid,ECF)。
细胞外液因其存在部分不同,又可分为血浆和细胞间液,后者包括淋巴液。
各部位体液之间处于动态平衡,其内的水与电解质也处于动态平衡,这种平衡状态,很易受外界或机体内部因素的影响,导致破坏出现代谢紊乱,即水电解质平衡紊乱和酸碱平衡紊乱。
第一节钠、钾、氯代谢和检验氯和钠是细胞外液的主要阴阳离子。
体内Na+约有50%分布于细胞外液,约40%存在于骨骼,约10%存在于细胞内。
机体通过膳食及食盐形式摄入氯和钠,成人每日需要量5-9g,一般是摄入体内NaCL的量大于其需要量,所以,一般情况下,人体不会缺钠缺氯。
Na+、CL-主要从肾排出,肾排钠量与食入量保持平衡。
肾对保持体内钠的含量起有很重要的作用。
当无钠摄入时,肾排钠减少,甚至可以不排钠,而让钠保留于体内,以维持体内钠的平衡。
钠的摄入与排出往往伴随有氯的出入,钠与氯还有少部分以出汗形式丢失。
体液中Na+主要分布在细胞外液,K+主要分布在细胞内液。
Na+有65%-71%是可交换的,其中85%存在于细胞外液,15%在细胞内液。
用同位素标记Na+的实验证明,Na+既能透过细胞膜,还可通过主动转运机制,即细胞上存在的钠钾泵将Na+从细胞内泵出到细胞外,使细胞内的Na+保持在低水平。
人体中K+约90%是可交换的,大部分存在于细胞内液。
体液中细胞外液的Na+浓度高于细胞内液,K+是细胞内液高于细胞外液。
一、体液电解质及其生理功用血浆中主要电解质有Na+、Cl-、K+。
细胞间液是血浆的超滤液,其电解质成分和浓度与血浆极为相似,不同之处是血浆含有较多的蛋白质,而细胞间液不含或仅含少量的蛋白质,由于蛋白质是大分子量物质,不易通过细胞膜,故血浆蛋白含量高于细胞间液。
仪器分析考试练习题和答案(4)

仪器分析考试练习题和答案第11章电解与库仑分析法【11-1】解释下列名词。
电解、理论分解电压、实际分解电压、析出电位、控制电流电解法、控制电位电解法、汞阴极电解法、死停终点法、电流效率。
答:电解:将电流通过电解质溶液或熔融态电解质,(又称电解液),在阴极和阳极上引起氧化还原反应的过程,电化学电池在外加直流电压时可发生电解过程。
理论分解电压:使被电解的物质在两个电极上产生迅速的、连续不断的电极反应时所需要的最小外加电压的最小外加电压。
实际分解电压:指使电解质在电极上分解生成电解产物所需施加的最小电压。
析出电位:物质在阴极上产生迅速的连续不断的电极反应而被还原析出时所需要的最正的阴极电位或在阳极上被氧化析出时的阴极电位;或在阳极上被氧化析出时所需要的最负阳极电位。
控制电流电解法:在恒定的电流条件下进行电解,通过称量电解前后电极上沉积的析出物的质量来进行定量分析。
控制电位电解法:控制工作电极(阴极或阳极)电位为一恒定值的条件下进行电解的分离分析方法。
汞阴极电解法:电解时以汞作阴极,铂为阳极的电解法。
死停终点法:指把两个相同的铂电极插入滴定溶液中,在两个电极之间外加一小电压,观察滴定过程中通过两个电极间的电流突变,根据电流的变化情况确定滴定终点。
电流效率:指电解时在电极上实际沉积或溶解的物质的量与按理论计算出的析出或溶解量之比,通常用符号η表示。
【11-2】什么是电解分析和库仑分析?它们的共同点是什么?不同点是什么?答:电解分析是指在外加电压的作用下通过电极反应将试液中的待测组分转变为固相析出,称量析出物的重量以求得被测组分的含量。
库仑分析是指通过测量被测物质在100%电流效率下电解所消耗的电量来进行定量分析的方法。
共同点:测定的过程中不需要基准物质和标准溶液,且都基于电解反应。
不同点:电解分析采用称量电解后铂阴极的增量来定量的,电极不一定具有100%的电流效率;库仑分析用电解过程中消耗的电量来定量,要求电极反应必须单纯,用于测定的电极反应必须具有100%的电流效率,电量全部消耗在被测物质上。
电解和库仑分析法
3.特点及其应用范围
电解效率高,分析速度快,选择性差。只能用 于溶液中有一种可还原金属离子的定量分析, 用于分 离金属活动顺序氢两侧的金属元素。
(二)、控制电位电解分析
1. 控制外加电压 例如:0.1M H2SO4介质中,含1.0M Cu2+ 和 0.01M
Ag+,问能否通过控制外加电压方法使二者分别电解而 不相互干扰?
a) 各离子在阴极的析出电位 Cu的析出电位: Cu = Cu +0.059/2 lg cCu2+ = 0.337V Ag的析出电位: Ag=Ag+0.059lg cAg+
=0.779+0.059lg0.01=0.681V 因为Ag > cu ,故Ag2+先于Cu2+析出。
b) Ag完全析出时的外加电压 设Ag2+“完全”析出时溶液中Ag2+的浓度为10-6M,则
可见在Ag完全析出时的电压并未达到Cu析出时的
分析电压。即此时Cu不析出或者说Cu不干扰测定。即 可以通过控制外加电压来进行电解分析。
图11.7 自动控制电极电位装置
A:辅助电压;Amp:放大;M:可逆电机
2、控制阴极电位电解分析
当试样中存在两种以上离子时,随着电解反应的进 行,离子浓度将逐渐下降,电池电流也逐渐减小,此 时通过外加电压方式达不到好的分别电解的效果。即 第二种离子亦可能被还原,从而干扰测定。因此,常 以控制阴极电位的方式进行电解分析。
通常,可设iR→0,则 E外=E分=(φ平(阳)+ηa)-(φ平(阴)+ηc)
有两种极化作用产生的过电位
过电位可分为浓差过电位和电化学过电位两类。 前者是由浓差极化产生的,后者是由电化学极化产生 的。电化学极化是由电化学反应本身的迟缓性所引起 的。一个电化学过程实际上由许多分步过程所组成, 其中最慢一步对整个电极过程的速度起决定性的作用。 在许多情况下,电极反应这一步的速度很慢,需要较 大的活化能。因此,电解时为使反应能顺利进行,对 阴极反应而言,必须使阴极电位比其平衡电位更负一 些;对阳极反应而言,则必须使阳极电位比其平衡电 位更正一些。这种由于电极反应引起的电极电位偏离 平衡电位的现象,称为电化学极化。电化学极化伴随 产生过电位。可分析如下:
第11章 电解与库仑分析法

库仑分析法根据电解过程中所消耗的电量来求出被测组分的 含量。
1.电解过程
电解硫酸铜溶液, 当逐渐增加电压,达到一
定值后,电解池内与电源 “-” 极相连的阴极上开 始有Cu生成,同时在与电源“+”极相连的阳极上有 气体放出,电解池中发生了如下反应:
阴极反应:Cu2+ + 2e = Cu
阳极反应:2H2O = O2 + 4H+ +4e
11-3 库仑分析法
根据被测物质在电解过程中所消耗的电量来求得该物质的含量 的方法,叫库仑分析法。
电极反应单纯,电流效率100%是库仑分析的先决条件。
法拉第电解定律是库仑分析法的理论基础。
法拉第第一定律: 物质在电极上析出产物的质量m与通过电解池的电量Q 成 正比。
法拉第第二定律:
Q M M m it F n nF
氢氧库仑计
(电解水)
1F电量产生氢气11200 mL 氧气 5600 mL
共产生: 16800 mL气体
从电解水产生的氢氧混合气体的体积来计算工作电极上 有多少物质起反应。
11-3-2恒电流库仑滴定法
1. 仪器装置
它包括发生系统和终点指示系统两部分。前者的作用是提
供一个数值已知的恒电流,产生滴定剂并准确记录电解时间; 后者的作用是指示滴定终点,以控制电解的结束。
c. 产生差别的原因 超电位(η)、电解回路的电压降(iR)的 存在。则外加电压应为:
E外 = (E阳 + η
阳)-
(E阴 + η
阴)
+ iR
理论分解电压小于实际分解电压的原因是由于超电位的存在,但超 电位是如何产生的呢?
u外=(+平衡+ +) – (-平衡+ -)+iR =理论分解电压+超电压+回路电压降
仪器分析之第十一章极谱分析法

二、极谱分析的特点: 极谱分析的特点: ★有较高的灵敏度。 有较高的灵敏度。 普通极谱: mol/L, 普通极谱:10-5~10-2mol/L, 催化极谱等:10-11~10-8mol/L。 催化极谱等: mol/L。 ★分析速度快,且易实现自动化。 分析速度快,且易实现自动化。 重现性好:同一溶液可反复测定。 ★重现性好:同一溶液可反复测定。 ★应用范围广。 应用范围广。
浓差极化建立的条件: <三> 浓差极化建立的条件: ★极化电极的表面积要小; 极化电极的表面积要小; 电极表面附近的离子浓度C 电极表面附近的离子浓度Cs易于 趋近于零。 趋近于零。 ★溶液中被测物的浓度要低; 溶液中被测物的浓度要低; 也易于趋近于零。 Cs也易于趋近于零。 ★溶液不搅拌。 溶液不搅拌。 有利于电极表面附近建立扩散层。 有利于电极表面附近建立扩散层。
影响扩散电流的主要因素: 二、影响扩散电流的主要因素: 1.毛细管特性的影响: 1.毛细管特性的影响: 毛细管特性的影响 称为毛细管常数。 m 毛细管常数: ●毛细管常数: 2/3t1/6称为毛细管常数。 与汞柱高度h的关系: ●id与汞柱高度h的关系: id∝= m2/3t1/6= ∴ id∝h1/2
§11—3 11—
极谱定量分析
扩散电流方程式: 一、扩散电流方程式:
在汞滴生长期内,任一瞬间τ的电流是 的电流是: ●在汞滴生长期内,任一瞬间 的电流是: 此式为扩散电流方程式, 此式为扩散电流方程式,又称为尤考维奇 方程式。 方程式。 τ=0时 =0。 τ=t为汞滴从开始生 ●当τ=0时,iτ=0。设τ=t为汞滴从开始生 被测离子电极反应的电子转移数; n——被测离子电极反应的电子转移数; 被测离子电极反应的电子转移数 长到离开滴汞电极滴下所需的时间, 长到离开滴汞电极滴下所需的时间,称为 被测物的扩散系数( D——被测物的扩散系数(cm2/s); 被测物的扩散系数 cm2/s); 滴下时间。此时, 达到最大值: 滴下时间。此时,iτ达到最大值: 汞流速( m——汞流速(mg/s); 汞流速 mg/s); 滴下时间( t——滴下时间(s); 滴下时间 被测物浓度( C——被测物浓度(mol/L)。 被测物浓度 mol/L)。 平均极限扩散电流i ●平均极限扩散电流id:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2. 控制阴极电位电重量分析法
(1)装置:三电极系统 调节外电压,阴极电位控制在一定范围内。选择性好。
(电解硫酸铜溶液为例说明)
电解液:0.5 mol L-1 H2SO4 -0.1 mol L-1 CuSO4
螺
旋
网
状
状
Pt 电
Pt
电 阴极反应:Cu2+ + 2e = Cu
极
极 阳极反应:2H2O = O2 + 4H+ +4e
电池反应: 2Cu2+ + 2H2O = 2Cu + O2 + 4H+
产生超电位的原因:电极的极化 电极极化:电解时,电极上有净电流流过时,电极电 位偏离其平衡电位的现象。 电极极化包括浓差极化和电化学极化。我们复习一下。
浓差极化
E(Cu/Cu 2 ) 0.337 0.059 lg[ Cu2 ] 0.307 (V) 2
E(O2/H2O) 1.229
第十一章 电解与库仑分析法
第十一章 电解与库仑分析法
电重量法:应用外加直流电源电解试液,电解后直接称
电解分析法 量电极上析出待测物的质量的分析方法。
电解分离法:将电解分析用于物质的分离。
库仑分析法:根据电解过程中消耗的电量求得待测物质的含量的分
析方法。
共同点: 区别:
(1) 都在电解池中进行; (2) 不需要基准物质和标准溶液,属于绝对分析法; (3) 准确度高。 (1) 测量的参量不同;
a.减小电流,增加电极面积。因此,电解分析 法通常用大表面积电极。
b.搅拌,有利于扩散。因此,电解分析通常需 要搅拌。
电化学极化
E(Cu/Cu 2 ) 0.337 0.059 lg[ Cu2 ] 0.307 (V) 2
E(O2/H2O) 1.229
0.059 lg 4
[O2 ][H ]4 [H 2O]2
析出电位是指某物质在阴极上还原析出所需的最正的阴极 电位,或在阳极氧化析出时所需的最负阳极电位。
对于可逆电极反应,某物质的析出电位就等于电极的平衡 电位。
电解时,物质在阴极、阳极上析出的先后顺序:
阴极上,析出电位越高的组分,优先还原;
阳极上,析出电位越低的组分,优先氧化。
二、电解分析方法和应用
极
化。
阴极电位随时间变化曲线
螺
旋
网
E阴=E0+0.0259
V lg
[Cu2+]
状
状
Pt
Pt
电
电
E外 = (E阳 + η阳)- (E阴 + η阴) + iR
极
极
这就是控制电流电解的原理。
特点及应用范围
Hale Waihona Puke 优点:分析速度快缺点:选择性差
应用:只能用于溶液中 只有一种可还原的金属 离子的定量分析;本法 可用于分离金属活动顺 序氢两侧的金属元素。
析出电位
O2 +
+
+ + +
在采用网状大面积阴极,并充 分搅拌时,阴=0,因此,
E外 = (E阳 + η阳)- (E阴 + η阴) + iR=(1.22 + 0.72) – (0.31 - 0) + 0.05 =1.68 V (实际分解电压)
6. 析出电位
电解方程式 E外 = (E阳 + η阳)- (E阴 + η阴) + iR
1.22
(V)
电池电动势为:E = 0.307 - 1.22 = -0.91 (V)
外加电压为0.91V时,阴极是否有铜析出?
理论分解电压:图上D’点的电压(Ud), Ud= -E
螺 旋
实际分解电压:图中D点对应的电压值。可见,实 状
网 状 Pt
际为分何解?电?压(D点),其值大于理论分解电压(D’点)。P电极t
e- Cu2+Cu2+
e- Cu2+ Cu2+
浓差极化(
电流较大)
ee-
Cu2+Cu2+
e- Cu2+ Cu2+
e-
Cu2+
eeee-
Cu2+ Cu2+ Cu2+ Cu2+
e-
Cu2+
e- Cu2+ Cu2+
E阴=E0+
0.059 2
V lg
[Cu2+]
浓差极化使阴极电位变得更负。
减小浓差极化的方法:
3. 分解电压
(电解硫酸铜溶液为例说明)
分解电压:图中D点对应的电压值。
反电动势:原电池电动势,与外加电压方向 相反(E)。 E(Cu/Cu 2 ) 0.337 0.059 lg[ Cu2 ] 0.307 (V)
2
E (O2 /H 2O)
1.229
0.059 lg 4
[O2 ][H ]4 [H 2O]2
电重量分析法:利用电解将被测 组分从一定体积溶液中完全(浓度低 于10-6 mol/L)沉积在阴极上,通过称 量阴极增重的方法来确定溶液中待测 离子的浓度。
1.恒电流电重量分析法
装置:
蓄电池、可变电阻、电压表、
电流表、网状Pt电极(阴极)、螺旋
螺 旋
网
状Pt电极(阳极)。
状
状
操作:
Pt
Pt
电
电
保持电流在0.5-5A之间恒定,电压变 极
(2) 电重量法用于高含量物质测定,库仑法用于微量和痕 量物质测定。
第一节 电解分析法
一、电解分析法原理
1.电解装置
电解电池:
正极(阳极)、负极(阴极) 零类电 极;直流电源;电压表;电流表; 变阻器
装置上的特点:
螺 旋
网 状
状
使用大表面积零类电极;需
Pt
Pt 电
要搅拌试液。
电
极
极
2.电解过程中电流与电压的关系
1.22
(V)
电荷迁越相界面放电所需的超电位。
产生的原因:电极反应速度慢,电极上聚集了一定的电 荷。结果使阳极电位变得更正。当电极反应的析出物为金属 时,电化学极化的过电位很小;当析出物为气体(尤其是H2 和O2)时,电化学极化的过电位很大。本例中η阳=0.72 V
阳极反应:2H2O = O2 + 4H+ +4e
0.059 lg 4
[O2 ][H ]4 [H 2O]2
1.22
(V)
电流流过电极,表面形成浓度梯度。使正极电位增大,负极
电位减小。
阴极反应:Cu2+ + 2e = Cu
平衡(电
流极小或 零)
ee-
Cu2+Cu2+
e- Cu2+ Cu2+
eeeee-
Cu2+Cu2+ Cu2+ Cu2+ Cu2+CuC2+u2+
电 极
4. 实际分解电压大于理论分解电压的原因
实际分解电压大于理论分解电压的原因是 超电位(η)、电解回路的电压降(iR) 的存在。则外加电压应为:
E外 = (E阳 + η阳)- (E阴 + η阴) + iR 上式称为电解方程式
5. 电解方程式的应用
利用电解方程式可对某物质的实际分解电压进行估算
实际分解电压大于理论分解电压的原因是由于超电位 的存在,但超电位是如何产生的呢?
