不同价态钒的颜色
钒

钒钒:元素符号V,银白色金属,在元素周期表中属VB族,原子序数23,原子量50.9414,体心立方晶体,常见化合价为+5、+4、+3、+2。
钒的熔点很高,常与铌、钽、钨、钼并称为难熔金属。
有延展性,质坚硬,无磁性。
具有耐盐酸和硫酸的本领,并且在耐气-盐-水腐蚀的性能要比大多数不锈钢好。
于空气中不被氧化,可溶于氢氟酸、硝酸和王水。
1. 3~6mm 小颗粒状产品牌号化学成分,%V含量不小于杂质含量,不大于Fe Cr Al Si O N CV199.95 0.005 0.006 0.005 0.004 0.025 0.006 0.01 V299.5 0.10 0.10 0.05 0.05 0.08 ——V399.0 0.15 0.15 0.07 0.09 0.10 ——钒钒2. 枝状结晶名称产品牌号 化 学 成 份 %V 含量(不小于)杂质含量(不大于) FeCrAlSiOV a 99.9 0.025 0.025 0.01 0.004 0.036 V b990.150.150.080.080.13. 金属钒粉名称 产品牌号状态粒度 (目) 化 学 成 份 %V 含量(不小于)杂质含量(不大于) FeCrAlSiO高纯 V 200 -200 99.9 0.032 0.025 0.01 0.004 0.05 V 325-32599.90.032 0.025 0.01 0.004 0.05名称 牌号 状态粒度 化学成分% 核 用 钒 V h枝 状 结 晶V Fe Si Al O C 99.9 0.004 0.004 0.01 0.025 0.01 N CuCdCo Nb Mo 0.010.006 0.0050.0050.010.005V 锭99.9% 杂质ImpurityFe 0.01Ni 0.001Cu 0.001Al 0.05Si 0.019Ca 0.001Mg 0.005Mo 0.001P 0.0053C 0.01O 0.015N 0.01H 0.001Ti+Zr+Hf 0.01 W 0.002B 0.001Sn 0.005Ta 0.005Mn 0.0001K 0.001Na 0.001Li 0.001Cr 0.002Nb 0.005%物理状态:钒熔点1890℃,有良好的耐蚀性、延展性和可锻性。
钒及其化合物

在强酸中, V(V) 以 VO3+ 形式存在
或以 VO2+ 形式存在 V(IV) 以 VO2+ 形式存在
V2O5 在氢气流中加热,将被还原 成 V2O3
V2O5 + 2 H2 —— 2 V2O3 + 2 H2O
若与高压氢气在高温下作用, 其 将被还原成单质钒。
VSO4 中的 V(II)可以被 KMnO4 氧化成 V(III)
若浓缩上述红色溶液或再滴加 H2O2, 则 [ V(O2)](2 SO4)3 将转化 为黄色的 H3 [ V(O2)O3 ]。
V2O5 溶于 H2O2,可直接得到 过氧偏钒酸。
V2O5 + 2 H2O2 —— 2 HVO4 + H2O
碱金属的偏钒酸盐溶于 H2O2,可生成碱金属的过氧 偏钒酸盐,如 KVO4。
或 9. 7. 1 钒的氧化物
V2O5 为砖红色固体,无臭、 无味、有毒,是钒酸 H3VO4 及 偏钒酸 HVO3 的酸酐。
除通过单质高温合成外,加热 偏钒酸铵可得 V2O5
2 NH4VO3 —> 4—00 ℃— V2O5 + 2 NH3 + H2O
钒的氢化物为灰黑色物质,仍保 持金属外观。
金属钒吸氢后晶格膨胀,随 着吸氢量的不同其密度比金属钒 减小 6~10%。
金属钒吸氢后变脆变硬。
钒的氢化物在真空中加热到 600 ~ 700℃ 将发生分解,随着氢 的释出,钒的硬度降低,并恢复 原有的延展性。
钢中加 0.1% ~ 0.2 % 的钒,韧性、强度、延展性 及抗冲击力均加强。
2 H3VO4 + HCOOH + 4 H+ —— 2 VO2+ + CO2↑ + 6 H2O
金属钒价态

金属钒价态金属钒是一种重要的过渡金属元素,其化学性质非常活泼,可以形成多种不同的化合物。
在自然界中,钒主要以氧化物的形式存在,而在工业上,钒主要用于制造钢铁和合金等材料。
钒的价态对其化学性质和应用有着重要的影响,下面我们来详细了解一下金属钒的价态。
1. 钒的价态钒的原子序数为23,其电子排布为[Kr]4s23d3。
由于钒的3d轨道与4s轨道的能量非常接近,因此钒的电子排布比较特殊,其价电子可以在3d轨道和4s轨道之间转移。
这也是钒的化学性质非常活泼的原因之一。
钒的价态主要有+2、+3、+4、+5,其中+5是最常见的价态。
在氧化钒(V)的化合物中,钒的电子排布为3d0 4s0,即钒离子的电子全部填满了3d轨道和4s轨道,成为一个稳定的离子。
而在其他价态下,钒的电子排布都比较不稳定,容易发生氧化还原反应。
2. 钒的化学性质钒的化学性质非常活泼,可以形成多种不同的化合物。
在氧化钒(V)的化合物中,钒的化学性质最为稳定,可以与氧、氮、硫等元素形成多种不同的化合物。
例如,钒(V)氧化物(V2O5)是一种重要的工业原料,可以用于制造硫酸、钒酸等化学品。
在其他价态下,钒的化学性质也非常活泼。
例如,钒(IV)化合物可以与氧气反应生成钒(V)化合物,而钒(III)化合物则可以被氧化成钒(IV)或钒(V)化合物。
此外,钒还可以形成多种不同的配合物,这些配合物在催化、电化学等领域有着广泛的应用。
3. 钒的应用钒在工业上主要用于制造钢铁和合金等材料。
钒可以与铁、钢等金属形成钒合金,可以提高钢铁的强度、硬度、耐磨性等性能。
此外,钒合金还可以用于制造航空发动机、汽车发动机等高温高压的设备。
除了钢铁和合金,钒还可以用于制造电池、催化剂、陶瓷等材料。
例如,钒氧化物可以用于制造锂离子电池的正极材料,而钒酸盐则可以用于制造催化剂、陶瓷等材料。
钒的价态对其化学性质和应用有着重要的影响。
钒的化学性质非常活泼,可以形成多种不同的化合物,而钒的应用也非常广泛,主要用于制造钢铁和合金等材料。
钒的由来

钒的由来(摘自互联网)以女神名字命名的稀有金属钒钒元素名称:钒元素符号:V元素原子量:50.94元素类型:金属元素质子数:23中子数:37原子序数:23所属周期:3所属族数:VB电子层分布:2-8-11-2发现人:塞夫斯唐姆发现年代:1830年发现过程:1830年,瑞典的塞夫斯唐姆,在研究斯马兰铁矿的铁渣时,得到氧化钒,发现了钒的存在。
元素描述:高熔点金属之一,呈浅灰色。
密度5.96克/厘米3。
熔点1890±10℃,沸点3380℃,化合价+2、+3、+4和+5。
其中以5价态为最稳定,其次是4价态。
电离能为6.74电子伏特。
有延展性,质坚硬,无磁性。
具有耐盐酸和硫酸的本领,并且在耐气-盐-水腐蚀的性能要比大多数不锈钢好。
于空气中不被氧化,可溶于氢氟酸、硝酸和王水。
元素来源:矿物有钒酸钾铀矿、褐铅矿和绿硫钒矿等。
非常纯的钒很难制成,在通常的高温条件下,钒对氧、氮和碳都活泼,容易起反应。
工业上用它制成合金。
很纯的钒可由五氧化二钒与碘化钙作用制成VI5,再经热分解可以制得。
钒的传说:在很久以前,在遥远的北方住着一位美丽的女神名叫凡娜迪丝。
有一天,一位远方客人来敲门,女神正悠闲地坐在圈椅上,她想:他要是再敲一下,我就去开门。
然而,敲门声停止了,客人走了。
女神想知道这个人是谁,怎么这样缺乏自信?她打开窗户向外望去,哦,原来是个名叫沃勒的人正走出她的院子。
几天后,女神再次听到有人敲门,这次的敲门声持续而坚定,直到女神开门为止。
这是个年青英俊的男子,名叫塞弗斯托姆。
女神很快和他相爱,并生下了儿子——钒。
这个故事虽然生动,却并不十分确切。
原来第一次敲门的是墨西哥化学家里奥,第二次才是德国化学家沃勒。
他们虽然发现了新元素,但不能证实自己的发现,甚至误认为这种元素就是“铬”。
而塞弗斯托姆,通过锲而不舍的努力,才从一种铁矿石中得到了这种新元素,并以凡娜迪丝女神之名命名为“钒”。
元素用途:如果说钢是虎,那么钒就是翼,钢含钒犹如虎添翼。
钒资源及其制备技术

钒资源及其制备技术作者:范亮张炜来源:《新材料产业》 2016年第1期文/ 范亮张炜北京航空航天大学一、钒的概述钒(V)是银白色金属,在元素周期表中属V B族,原子序数23,相对原子质量50.9414,体心立方晶体(见图1),常见化合价为+2、+3、+4、+5。
钒属稀有高熔点金属,熔点为1700±20℃,沸点达3 000 ~3 400℃,常与铌、钽、钨、钼并称为难熔金属。
20℃时,钒的密度为6.1g / c m3,是一种较轻的金属,具有延展性、质坚硬、无磁性,但是若含有少量的杂质,尤其是氮、氧、氢等特点,也能显著的降低其可塑性。
钒具有较好的耐腐蚀性能,在空气中不易被氧化,且在气-盐-水腐蚀的性能要比大多数不锈钢好,单质金属钒能够耐常见的淡水以及海水的腐蚀,也可以耐常见的除氢氟酸以外的非氧化性酸(如盐酸,稀硫酸和稀硝酸)的腐蚀,也能耐常见的碱溶液的腐蚀(如氢氧化钠和氢氧化钾),但是,单质金属钒却可以被氧化性的酸所溶解(如浓硫酸,浓硝酸和王水)。
钒的电子结构具有明显的特点,即N层具有2个电子,而M层有3个电子,因此钒元素可以表现出不同的价态。
最高位+5价,最低为-1价。
还有0、+2、+3、+4价。
在常见的价态中,以+4和+5价最为稳定。
+5价的钒是一种常见的强氧化剂,而其他价态钒则具有不同程度的还原性。
其中+4钒是最稳定的氧化态,几乎所有的+4价均源于V O2。
呈氧化状态的钒形成5或6个配位价的复合物,如在原油中的氧钒生物碱和氧钒乙酰丙酮等。
钒的化合物颜色绚丽,多带有不同的颜色特征。
其中+5价的钒化合物一般呈现褐色或者红色,+4价钒的化合物通常呈现蓝色;而+3价价钒的化合物呈绿色,+2价钒的化合物则呈现紫色。
自然界中常见的钒的化合物有五氧化二钒( V2O5)、三氧化二钒(V2O3)、偏钒酸铵(NH4V O3)、氯化钒(V C l3)等。
钒的化合物的水溶性一般均较差,其中氯化钒和氯氧钒的沸点较低,金属钒也可以和一些有机物发生反应,生成一些常温常压下并不太稳定的有机金属化合物。
钒的性质及用途简介解析

钒的性质及用途简介解析钒的性质及用途简介钒是一种神奇的金属,化合价有2+、3+ 和5+ ,金属单质钒很少,其主要形态有:VO(氧化钒),V2O3(三氧化二钒),V2O5(五氧化二钒),FeV(钒铁)及偏钒酸铵等,工业上使用最多的是V2O5和FeV,主要用于冶金的添加剂,增强钢铁的强度和韧性。
一、性质1、钒的性质钒(Vanadium),化学符号V,元素周期表中序数为23,原子量为50.94。
钒是银白色略带蓝色的金属,具有延展性;含有氧、氮、氢时则变脆、硬。
钒在较高的温度下与原子量较小的非金属形成稳定的化合物;在低温下有良好的耐腐蚀性。
钒进入合金后可增强合金的强度,降低热膨胀系数。
钒在地壳中的丰度约为0.02%,比铜、锌、镍、铬都高。
按地壳中元素丰度排列第13位。
可以说,在地壳中含有非常丰富的钒金属。
但钒金属有一个特点,很难形成独立的矿床,伴生性非常明显,因此在自然界非常分散,通常和其他金属伴生,如:钒钛磁铁矿。
因此,不太容易单独对钒金属进行开采和提炼,钒产品多作为冶金业的副产品生产。
2、五氧化二钒的性质五氧化二钒(V2O5)为褐色固体,有两种形态:粉状和片状,因在富氧和缺氧的加热条件下而得到不同的形态。
五氧化二钒有毒性。
在国际化学剧毒品名录中排名第43位。
其毒性主要是对呼吸道有刺激,引起鼻粘膜充血。
如果过多的吸入了粉状的五氧化二钒,有头昏、恶心等感觉,擤鼻涕时可能会带有血丝。
如果五氧化二钒中毒,离开了现场症状自然缓解,休息一两天一般自然恢复,不需治疗。
在国内没有对五氧化二钒毒性检测的规程,但中华人民共和国国标中也明确列示其为剧毒物质,生产过程需要在省级安监部门办理安全生产许可证。
3 、偏钒酸铵偏钒酸铵(NH4VO3)为白色结晶体,既是一种独立的产品,也是制造五氧化二钒的上一道工序的中间产品,其性质与五氧化二钒相似,其生产也需要办理安全生产许可证。
4 、钒铁的性质工业上使用的钒,主要是元素钒。
五氧化二钒(V2O5)中,钒的原子量仅占56%,其余为氧原子量。
5价钒化合物

5价钒化合物5价钒化合物是一类含有5价钒离子(V5+)的化合物。
钒是一种过渡金属元素,其5价态的化合物在化学和材料科学领域具有重要的应用价值。
本文将介绍5价钒化合物的性质、制备方法以及其在不同领域的应用。
5价钒化合物的性质。
由于钒的5价态具有五个未成对的电子,因此5价钒化合物通常具有较强的氧化性和催化活性。
这些化合物的颜色通常为橙黄色或橙红色,具有良好的热稳定性和化学稳定性。
此外,它们还具有一定的磁性和电导性。
制备5价钒化合物的方法有多种。
常见的方法包括氧化法、还原法、水热法等。
氧化法是最常用的方法之一,通常通过将钒金属或钒的低价化合物与氧气或氧化剂反应制得。
还原法则是将高价态的钒化合物与还原剂反应制得5价钒化合物。
水热法则是利用高温高压条件下水溶液中的热力学和动力学性质制备5价钒化合物。
然后,5价钒化合物在不同领域具有广泛的应用。
在化学领域,它们常用作催化剂,在有机合成和氧化反应中发挥重要作用。
例如,五氧化二钒(V2O5)常用于合成有机酸和酯,氧化苯乙烯等反应中作为催化剂。
在材料科学领域,5价钒化合物常用于制备电池材料、光学材料和催化剂载体等。
例如,钒酸锂(LiVO3)是一种重要的锂离子电池正极材料,具有较高的比能量和循环稳定性。
此外,钒酸铋(BiVO4)是一种可见光响应的光催化剂,可用于水分解和有机废水处理等领域。
5价钒化合物还具有医学应用的潜力。
研究表明,一些5价钒化合物具有抗肿瘤和抗菌活性,可以作为新型的抗癌和抗菌药物的候选物。
例如,五氧化二钒和钒酸铋等化合物在体内具有抑制肿瘤细胞生长和诱导凋亡的作用。
5价钒化合物是一类具有重要应用价值的化合物。
它们具有较强的氧化性和催化活性,可以在化学、材料科学和医学领域发挥重要作用。
通过合适的制备方法可以得到这些化合物,并利用它们的特性来开发新的材料和药物。
随着对5价钒化合物的深入研究,相信它们的应用领域将进一步扩展,为人类的生活和科技发展带来更多的机遇和挑战。
钒元素的知识点汇总介绍

钒元素的知识点汇总介绍
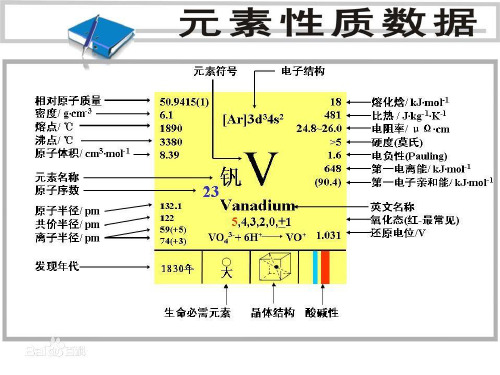
钒,元素符号 V,银⽩⾊⾦属,在元素周期表中属VB族,原⼦序数23,原⼦量50.9414,体⼼⽴⽅晶体,常见化合价为+5、+4、+3、+2。
钒的熔点很⾼,常与铌、钽、钨、钼并称为难熔⾦属。
有延展性,质坚硬,⽆磁性。
具有耐盐酸和硫酸的本领,并且在耐⽓、耐盐、耐⽔腐蚀的性能要⽐⼤多数不锈钢好。
室温下致密状态的⾦属钒较稳定,不与空⽓、⽔和碱作⽤,也能耐稀酸。
钒元素
纯的⾦属钒⼀般是⽤钾在⾼压下将五氧化⼆钒还原⽽得到的。
⼤多数钒是其它矿物加⼯时的副产品,1840年,俄罗斯矿物⼯程师苏宾写道“含铜(cu元素)⽣铁、⿊铜、铜锭是含钒合⾦,由于钒的存在,使它们具有较⾼的硬度”⼯业上也可以以铝,焦炭还原五氧化⼆钒⽣产纯钒。
焦炭还原五氧化⼆钒⽣产纯钒是将V2O5粉与⾼纯碳粉混合均匀,加10%樟脑⼄醚溶液或酒精,压块后放⼊真空碳阻炉或感应炉内。
炉内真空压⼒到6.66×10-1Pa后,升温⾄1573K,保温2h。
冷却后将反应产物破碎。
根据第⼀次还原产物的组分再配⼊适量碳化钒或氧化钒进⾏⼆次还原。
⼆次还原炉内的真空压⼒为2.66×10-2Pa,温度控制在1973~2023K之间,并保温⼀段时间。
真空碳还原法所得⾦属钒的成分(质量分数m/%)为:钒99.5,氧0.05,氮0.01,碳0.1。
钒收率可达98%~99%。
铝热还原法是将五氧化⼆钒和纯铝放在反应弹进⾏反应,⽣成钒铝合⾦。
钒合⾦在2063K的⾼温和真空中脱铝,可制得含钒94%~97%的粗⾦属钒。
钒的物化性质

钒--碳系中只有V2C和VC两个中间相在1320℃以上的温度下稳定,两种碳化钒均系非化学计量化合物,其物理性能均与其实际组成有依赖关系。
一、钒的物理性质
钒属于元素周期表第VB族。它与其他VB族金属一样,具有体心立方结构,没有任何晶型变化,致密钒的外观呈浅灰色,熔点较高,在冶金分类上与同一副族的铌和钽同属于稀有高熔点金属。琪硬度和抗拉强度极限与加工和热处理状况及杂质含量有密切关系。纯钒具有良好的可塑性,在常温下可轧成片、箔和拉成丝。少量的杂质,特别是碳、氧、氮和氢等间隙元素,可使钒的可塑性降低,硬度和脆性增加。
不同价态的钒离子在酸性溶液中具有不同的颜色。因此,可以根据离子的颜色和颜色的深浅初步鉴别酸性溶液中钒离子的价态和离子浓度。
室温下金属钒较稳定,不与空气、水和碱作用,也能耐稀酸。高温下,金属钒很容易与氧化氮作用。当金属钒在空气中加热时,钒氧化成棕黑色的三氧化二钒、铁红色的四氧化二钒,并最终成为桔黄色的五氧化二钒。钒在氮气中加热至900~1300℃会生成氮化钒。钒与碳在高温下可生成碳化钒,但碳化反应必须在真空中进行。当钒在真空下或惰性气氛中与硅、硼、磷、砷一同加热时,可形成相应的硅化物、硼化物、磷化物和砷化物。
3、3、2、钒酸铵
偏钒酸铵在钒的湿法冶金中占有重要地位。偏钒酸铵为白色或微黄色的晶体粉末,微溶于水和氨水,难溶于冷水。它在不同温度下在水中溶解度也不尽相同。
当水溶液中有铵盐存在时,因共同离子效应,偏钒酸铵的溶解度下降。这一现象在钒的湿法冶金中被广泛应用。偏钒酸铵在常温下稳定,加热时易分解。它在空气中的分解反应为:
3、3、钒酸盐
通常说的钒酸盐多指含(V)V的钒酸盐。钒酸盐分偏矾酸盐MVO3、正钒酸盐M3VO4、和焦钒酸盐M4V2O7,式中M代表一价金属。Bi、Ca、Cd、Cr、Co、Cu、Fe、Pb、Mg、Mn、Ni、K、Ag、Na、Sn和Zn均能生成钒酸盐。碱金属和镁的偏矾酸盐可溶于水,得到的溶液呈淡黄色。其他金属的钒酸盐不大能溶于水。
钒化合物性质资料

1.钒A.物理性质钒是一种单晶金属,呈银灰色,具有体心立方晶格,曾发现在1550℃以及-28~-38℃时有多晶转变。
钒的力学性质与其纯度及生产方法密切相关。
O、H、N、C等杂质会使其性质变脆,少量则可提高其硬度及剪切力,但会降低其延展性。
钒的主要物理性质见表2-1钒的力学性质如表2-2所示。
表2-1 金属钒的物理性质性质数值性质数值原子序数23 热导率(100℃)/J·(cm·s·K)-10.31原子量50.9415 外观浅灰晶格结构体心立方外电子层3d34s2晶格常数a/mm 0.3024 焓(298K)/kJ·(mol·K)-1 5.27密度/kg·m-36110 熵(298K)/J·(mol·K)-129.5熔点/℃1890~1929 热容c p(298K液态)/kJ·(mol·K)-124.35~25.59 47.43~47.51沸点/℃3350~3409熔化热/kJ·mol-116.0~21.5热容c p①(298~990K)/kJ·(mol·K)-1a.24.134b.6.196×10-3c.-7.305×10-7d.-1.3892×105蒸气压/Pa 1.3×10-6(1200℃)1.3(2067℃)3.73(2190K) 207.6(2600K)蒸发热/kJ·mol-1444~502热容c p②(900~2200K)/kJ·(mol·K)-1a.25.9b.-1.25×10-4c.4.08×10-6线膨胀系数(20~200℃)/K-1(7.88~9.7)×10-6比电阻(20℃)/μΩ·cm24.8 温度系数(100℃)/cm·K-10.0034钒同位素46V 47V 48V 49V 50V 51V 52V 53V 54V 半衰期0.426s 33min 16.0d 330d 6×1015a 稳定 3.75min 2.0min 55s 丰度/% 0.25 99.75①c p=a+b T+c T 2+d T -2;②c p=a+b T+c T 2,式中,T为温度,K。
钒的性质及用途简介解析

钒的性质及用途简介钒是一种神奇的金属,化合价有2+、3+ 和5+ ,金属单质钒很少,其主要形态有:VO(氧化钒),V2O3(三氧化二钒),V2O5(五氧化二钒),FeV(钒铁)及偏钒酸铵等,工业上使用最多的是V2O5和FeV,主要用于冶金的添加剂,增强钢铁的强度和韧性。
一、性质1、钒的性质钒(Vanadium),化学符号V,元素周期表中序数为23,原子量为50.94。
钒是银白色略带蓝色的金属,具有延展性;含有氧、氮、氢时则变脆、硬。
钒在较高的温度下与原子量较小的非金属形成稳定的化合物;在低温下有良好的耐腐蚀性。
钒进入合金后可增强合金的强度,降低热膨胀系数。
钒在地壳中的丰度约为0.02%,比铜、锌、镍、铬都高。
按地壳中元素丰度排列第13位。
可以说,在地壳中含有非常丰富的钒金属。
但钒金属有一个特点,很难形成独立的矿床,伴生性非常明显,因此在自然界非常分散,通常和其他金属伴生,如:钒钛磁铁矿。
因此,不太容易单独对钒金属进行开采和提炼,钒产品多作为冶金业的副产品生产。
2、五氧化二钒的性质五氧化二钒(V2O5)为褐色固体,有两种形态:粉状和片状,因在富氧和缺氧的加热条件下而得到不同的形态。
五氧化二钒有毒性。
在国际化学剧毒品名录中排名第43位。
其毒性主要是对呼吸道有刺激,引起鼻粘膜充血。
如果过多的吸入了粉状的五氧化二钒,有头昏、恶心等感觉,擤鼻涕时可能会带有血丝。
如果五氧化二钒中毒,离开了现场症状自然缓解,休息一两天一般自然恢复,不需治疗。
在国内没有对五氧化二钒毒性检测的规程,但中华人民共和国国标中也明确列示其为剧毒物质,生产过程需要在省级安监部门办理安全生产许可证。
3 、偏钒酸铵偏钒酸铵(NH4VO3)为白色结晶体,既是一种独立的产品,也是制造五氧化二钒的上一道工序的中间产品,其性质与五氧化二钒相似,其生产也需要办理安全生产许可证。
4 、钒铁的性质工业上使用的钒,主要是元素钒。
五氧化二钒(V2O5)中,钒的原子量仅占56%,其余为氧原子量。
化学元素钒

化学元素钒1. 引言化学元素钒(vanadium)是一种过渡金属,原子序数为23,元素符号为V。
它在自然界中广泛存在于地壳中,并具有重要的工业应用。
本文将对钒的性质、用途、生产方法以及环境影响进行全面的探讨。
2. 钒的基本性质2.1 物理性质钒是一种银灰色的金属,在常温下呈固态。
它具有高熔点和高沸点,密度较大,是一种相对重的金属。
2.2 化学性质钒具有良好的耐腐蚀性,在常温下不易与氧气、酸、碱发生反应。
然而,在高温和一些特殊条件下,钒可以与氧、氮等元素形成化合物。
3. 钒的用途3.1 钢铁工业钒是一种重要的合金元素,在钢铁工业中广泛应用。
它可以改善钢的硬度、强度和耐磨性,提高钢的耐腐蚀性能,使钢具备更广泛的应用领域。
3.2 催化剂钒及其化合物在催化剂领域有着重要的地位。
氧化钒可以催化一些重要的化学反应,如氨氧化反应、烯烃氧化反应等。
钒催化剂具有高效率、选择性和稳定性的特点,被广泛用于化学工业的生产。
3.3 储能技术随着可再生能源的快速发展,钒电池作为一种储能技术逐渐受到关注。
钒电池具有高能量密度、长寿命、高效率等优点,可以用于储存大规模的电能,为可再生能源的应用提供支持。
3.4 医学应用钒化合物在医学领域有一定的应用。
钒化合物可以用于治疗糖尿病,具有降低血糖和改善胰岛素敏感性的作用。
钒还被用作放射治疗的辅助药物,用于治疗某些恶性肿瘤。
4. 钒的生产方法4.1 矿石提取钒矿石是钒的主要来源,主要含有钒的矿石有钒云母、钒矾石等。
通过矿石选矿、冶炼等工艺,可以提取出纯度较高的钒。
4.2 合成制备除了从矿石中提取钒外,还可以通过化学合成的方法制备钒。
常见的方法有还原法、氧化法等,可以得到不同形态和纯度的钒。
5. 钒的环境影响5.1 生态系统影响钒的广泛应用和生产会对环境造成一定的影响。
钒污染可能导致土壤和水体的污染,对生态系统产生负面影响。
5.2 人体健康影响高浓度的钒对人体健康有一定的危害。
长期接触钒可能导致呼吸系统疾病、消化系统问题等。
无机元素化学——钒
7
钒酸盐和多钒酸盐
MIVO3(偏钒酸盐) M3IVO4(正钒酸盐) M2V2O7(焦钒酸盐) M3V3O9(多钒酸盐) VO43-时四面体结构,但是V-O键结合不十分牢固, 其中O2-可能同H+离子结合成水。 向钒酸盐中加H+,pH值逐渐下降,生成不同聚合度 的多钒酸盐,随着pH值的下降,多钒酸根中钒原子越 多。
VB
V 钒 3d34s2
绿硫钒矿(VS4)、钒铅矿 [Pb5(VO4)3Cl],丰度仅为 0.016%(列第19位)。
钒的主要化合物 V2O5
制备:工业上用氯化焙烧法或碱熔法;
若要制取纯度较高的五氧化二钒:
2NH4VO3 = V2O5 + 2NH3 + H2O
•晶体结构2V:OCl3 + 3H2O = V2O5 + 6HCl
钒
单质 钒是一种银灰色金属,具有典型的
体心立方结构,纯钒较软,具有延展性, 含有杂质时脆而硬。
钒与碱和非氧化性酸都不作用, 但 可溶于HF溶液,浓硫酸、硝酸和王水中:
V + 8HNO3 = V(NO3)4 + 4NO2 + 4H2O
由于外2V层+d6电H子FV=B存2V在F较2 +强3H的2 金属键, 使得钒具有较高的熔V 沸点钒和原3d子34s化2 焓。
溶液转为酸性后,聚合度不改变,直到十钒酸盐而终止,
后面是获质子的反应:
[V10O28]6- + H+
[HV10O28]5-
[HV10O28]5- + H+ [H2V10O28]4-
钒介绍——精选推荐

钒钒的简史元素钒是墨西哥矿物学家节烈里瓦于1801年在含有钒的铅试样中首先发现的。
由于这种新元素的盐溶液在加热时呈现鲜艳的红色,所以被取名为“爱丽特罗尼”,即“红色”的意思。
但是当时有人认为这是被污染的元素铬,所以没有被人们公认。
后来到了1830年写佛寺特勒木在由瑞典铁矿石提炼出的铁中发现了它,并肯定这是一种新元素称之为钒钒的性质钒是一种银灰色的金属。
熔点1919正负2摄氏度,属于高熔点稀有金属之列。
它的沸点3000--3400摄氏度,钒的密度为6.11克每立方厘米纯钒具有展性,但是若含有少量的杂质,尤其是氮,氧,氢等,也能显著的降低其可塑性。
一般来源:以矿物绿硫钒石vs4 钒铝矿钒紒铀矿为主钒的氧化物钒能分别以二、三、四、五价于氧结合,形成四种氧化物,一氧化钒(vo),三氧化二钒(v2o3),二氧化钒,五氧化二钒钒及其化合物的用途钒所以用于钢铁中,是由于钒能与钢铁中的碳元素生成稳定的碳化合物(v4c3),她可以细化钢的组织和晶粒,提高晶粒粗话温度。
显著提高改善钢铁的性能。
可加大钢的强度、韧性、抗腐蚀能力、耐磨能力和承受冲击负荷的能力等钒渣从含钒原料中提炼钒的工艺过程钒拼音:fán繁体字:钒部首:钅,部外笔画:3,总笔画:8 ; 繁体部首:金,部外笔画:3,总笔画:11五笔86:QMYY五笔98:QWYY仓颉:XCHNI笔顺编号:31115354四角号码:87710UniCode:CJK 统一汉字U+9492基本字义--------------------------------------------------------------------------------● 钒(钒)fánㄈㄢˊ◎一种金属元素,银白色。
汉英互译--------------------------------------------------------------------------------◎钒vanadiumEnglish--------------------------------------------------------------------------------◎vanadium元素名称:钒元素符号:V元素原子量:50.94原子体积:(立方厘米/摩尔)8.78元素在海水中的含量:(ppm)太平洋表面0.0016元素在太阳中的含量:(ppm)0.4地壳中含量:(ppm)160质子数:23中子数:37原子序数:23所属周期:3所属族数:VB电子层分布:2-8-11-2晶体结构:晶胞为体心立方晶胞,每个晶胞含有2个金属原子。
高考化学工艺流程中的新宠---钒

高考化学工艺流程中的新宠---钒一、认识钒及其化合物钒在周期表中位于第4周期、VB族,属于过渡金属元素,呈浅银灰色,有良好的可塑性和可锻性。
钒具有很高的熔点,用作合金的添加剂。
钒对稀硫酸、稀盐酸、稀磷酸保持相对稳定。
但在硝酸、氟氢酸中溶解。
常见的钒氧化物为+2、+3、+4、+5价的氧化物:VO、V2O3、VO2、V2O5,钒的氧化物从低价(二价)到高价(五价),系强还原剂到强氧化剂,其水溶液由强碱性逐渐变成弱酸性。
低价氧化钒不溶于水,但遇强酸会形成强酸盐如VCl2、VSO4;如遇强碱则形成V(OH)2,V(OH)2水解会放出H2。
1.五氧化二钒V2O5,是钒氧化物中最重要的,也是最常用钒化工制品。
工业上首先是制取NH4VO3,然后加热至500℃,即可制得V2O5。
其反应如下:2NH4VO3→2NH3+H2O+V2O5;另一个方法是用VOCl3水解,反应如下:2VOCl3+3H2O=V2O5+6HCl;在700~1125℃,V2O5存在下列可逆反应:V2O5=V2O5-x+(x/2)O2V2O5是两性化合物,但其碱性弱,酸性强,易溶于碱性构成钒酸盐,强酸也能溶解V2O5。
在酸、碱溶液中,生成物的形态取决于溶液的钒浓度和pH值,当溶液处于强碱性,pH值大于13,则会以VO43-存在,V2O5 + 6OH- == 2VO43- + 3H2O;若处于强酸性溶液中(pH值小于3),则主要以VO2+存在,V2O5 + 2H+== 2VO2+ + H2O;如果处在中间pH值的状态,则会以下列配合物存在:VO3-、HVO42-、V3O93-、V4O124-、V10O286-、V2O74-;V2O5有氧化性:和盐酸反应,生成VOCl2,放出Cl2,V2O5 + 6HCl == 2VOCl2 + Cl2↑+ 3H2;.在强酸中,V(Ⅴ)以VO3+、VO2+形式存在,VO2+具有较强的氧化性,易被SO32-还原为VO2+:2VO2++SO32-=2VO2++SO42-+H2O2.二氧化钒与四氧化二钒四价钒在空气中被缓慢氧化,加热则快速被氧化;四价钒的氧化物也是两性物质,在热酸中溶解形成稳定的VO2+,例如与硫酸形成VOSO4;在碱性溶液中则形成次钒酸盐HV2O5-。
钒对玻璃的着色

钒对玻璃的着色钒在玻璃中以V”、(VO)“,V“离子的形态存在。
含有这种元素的玻璃可能是无色、黄色,褐色,绿色和灰色的。
黄色着色是由V”离子引起的,它们在紫外光谱区产生吸收,吸收带要延伸到紫色区。
当V“的浓度较高时,吸收带会延伸到光谱的蓝色区,而黄色着色则过渡为褐色着色。
V”在红外区不产生吸收。
V。
+离子可引起绿色着色,透过率的极大值在525nm 处,而吸收极大值在波长为425和625nm处。
在红外区的l。
ltxm处也有峰值吸收带。
含四价钒的(VO)。
+钒离子在光谱的长波区会引起吸收。
在B:O。
含量高的玻璃中呈现的灰色着色,最大可能是由于着色物质以胶体状态析出所造成的。
这样的颜色可用钒同时以两种价态存在来解释。
在用普遍方法制造的玻璃中,通常是钒的各种离子共存。
在着色剂含量约为1%和玻璃层厚度为3mm时,这种玻璃是无色的,但是它们能有效地吸收紫外辐射。
当着色剂的含量更高时,出现了绿色着色,当其浓度超过5:6时,会由绿色过渡到橄榄褐色。
钒的化合物因其在紫外光谱区具有独特的吸收,故在玻璃着色实践中未能得到广泛应用。
这种特性可在制造保护视力不受有害光线损伤的玻璃时使用(例如,电焊工眼镜或太阳防护镜用的玻璃)。
用钒和铈的化合物组合着色的玻璃在短波辐射作用下,具有如此强烈的辐射照变暗作用(颜色由绿变到红紫),以致在技术上可用它们来测量太阳的辐射剂量(玻璃剂量计)。
呈无色结晶的钒酸铵(NH,V09)是一种应用得最广泛的钒化合物,二氧化钒在理论上含有77.7%的V:O。
,所购试剂中V。
Oa的实际含量在76一?7.5%的范围内。
(七)铀对玻璃的着色(图2—-14)铀在玻璃液中通常以六价形式存在,在还原条件下熔炼的玻璃中,铀以四价形式存在。
六价铀离子使玻璃着成深黄绿色,随着它含量的提高,在光谱紫色和蓝色区域的吸收强度将增大。
当浓度较高时,在480—490nm的区域内会出现一条特征的暗带。
在530Ⅱm以上的波长,即使引入8%的着色剂都不会使玻璃对光的收吸受到影响。
