保健用品批准证书申报指南
保健品申报攻略

保健食品申报注册攻略之一:增强免疫力篇一、背景描述:免疫力是指人体免疫系统抵御病原体感染的能力。
免疫系统由胸腺(青春期以后即逐渐萎缩、退化)、脾脏和淋巴组织等组成。
如果一个人身体差,容易生病,人们就会说他抵抗力差;也就是医学上所说的免疫力,健全的人体免疫系统主要作用之一是机体防御功能,即保护机体不受损害,帮助机体消灭外来的细菌、病毒以及避免发生疾病。
免疫力是一个从弱到强,再从强到弱的动态发展过程。
0~12岁前的儿童免疫器官发育不完善,体内有抗体活性的免疫球蛋白分泌量少,免疫功能不健全,这时的孩子极容易生病。
13~45岁期间是免疫功能相对稳定期,免疫功能相对完善。
但是由于这一阶段的人容易受到生活、学习、工作的压力影响,使体内的抗体和生长因子分泌量大幅度波动,这种就会造成体内的免疫球蛋白含量不稳定,导致免疫力下降而生病。
46岁以后人体的免疫器官功能开始衰退,体内有抗体活性的免疫球蛋白和生长因子分泌下降,免疫力下降;开始诱发老年性疾病。
据世界卫生组织调查,全球约有35%以上的人处于疲劳状态,尤其是中年男性人群疲劳状态者高达60-75%。
专家们指出,持续过度疲劳、长期睡眠不佳后果严重,既引发慢性咽喉炎、颈部或腋窝淋巴结肿痛、肌肉酸痛、多发性非关节炎性关节疼痛、头昏、头晕、头痛等病症,并最终导致免疫力下降;而免疫力下降之后,又使“疲劳综合症”更加突出和恶化,从而形成一个恶性循环。
据相关统计显示,我国保健食品市场中增强免疫力的产品占有主要地位,约占全部保健食品市场的10%左右,其销售收入与增强免疫力、调节血脂产品一起约占总销售收入的40%。
随着我国亚健康人群的进一步扩大,本类市场仍有很大潜力。
二.该功能适宜人群和不适宜人群:1.适宜人群免疫力低下的人群就是适宜增强免疫力的人群。
一般人如果有以下现象,都属于免疫力低下:1、容易感到疲劳,但是查不出器质性病变;2、经常感冒;3、伤口容易感染,愈合慢;4、肠胃差。
怎么申请办理保健食品批文

如何办理保健食品批文保健食品定义:我国保健食品是经国家食品药品监督管理局批准生产和销售的保健食品,是指声称具有特定保健功能(27种)或者以补充维生素、矿物质为目的的食品。
即适宜于特定人群食用,具有调节机体功能,不以治疗疾病为目的,并且对人体不产生任何急性、亚急性或者慢性危害的食品。
所以备案保健食品的产品,必须具有三种属性:1)食品属性;2)功能属性,具有特定的功能;3)非药品属性。
保健食品批文定义:通常也叫保健食品批文备案,是指国家食品药品监督管理局根据申请人的申请,依照法定程序、条件和要求,对申请备案的保健食品的安全性、有效性、质量可控性以及标签说明书内容等进行系统评价和审查,并决定是否准予其批文的审批过程;包括对产品备案申请、变更申请和技术转让产品批文申请的审批。
最终拿到批文:国食健字GXXXXXXX。
申请备案企业资质要求:合法的营业执照。
保健食品备案流程配方研究论证:根据中国保健食品原料用量要求,做出配伍性强、剂型合理、有一定功效的配方,经保健食品专家、营养师等研究论证。
小试生产研究:在保健食品GMP小试车间进行配方的小试生产论证,小试研究员不断的尝试和检测,最终确定产品配方、生产工艺和一套产品检测的方法学论证。
中试生产:要求:保健食品GMP车间,合格的原、辅料及包材(在实验室中做入厂检测);按照小试的配方和工艺生产三批样品,在实验室中对成品功效成分、成分、理化指标等检测。
省局抽样:省局向试制单位进行抽样,主要检查:产品配方;产品质量标准及说明书;原辅料包材出入库及检测记录、厂家资质;成品生产记录;成品检测记录;仪器使用记录、设备使用记录、生产单位资质、中试生产表等等。
理化、毒理、功能试验:一般产品都需要进行安全性试验(毒理)、功能学试验(动物功能/人体试食试验)、稳定性试验、卫生学检验、功效/标志性成分鉴定试验。
根据产品的功能和原料特性,还有可能要求备案的产品进行激素、兴奋剂检测、菌株鉴定试验、原料品种鉴定等。
[医药]《吉林省保健用品批准证书》申报指南
![[医药]《吉林省保健用品批准证书》申报指南](https://img.taocdn.com/s3/m/bd36fa33a98271fe910ef99d.png)
[医药]《吉林省保健用品批准证书》申报指南《吉林省保健用品批准证书》申报指南申报依据:《吉林省保健用品管理办法》《吉林省保健用品审批工作程序》受理范围:吉林省行政区域内从事保健用品生产的单位。
申办程序一、保健用品咨询、保健用品咨询设在吉林省政府政务大厅“卫生厅窗口”。
12、保健用品咨询属免费服务~旨在为生产厂家提供参考意见~不承担任何法律责任。
二、保健用品预审保健用品生产企业须提供如下书面材料:1、产品配方或结构图,2、保健功能,3、产品研制报告,4、产品生产工艺流程简述及简图,5、产品使用说明书,6、省级卫生行政部门要求提供的其他资料。
预审会议通过的产品~预审意见中提出申报产品需进行检测的项目,预审会议未通过的产品~预审意见中说明原因~资料返回申报单位。
三、保健用品检验生产厂家按照委托单要求到法定检验机构检验。
四、保健用品受理保健用品生产厂家需提供以下资料一式5份,原件1份~复印件4份,: 1、《吉林省保健用品批准证书》申请表,2、《企业法人营业执照》或《企业名称预先核准通知书》复印件,3、生产企业场地卫生许可证复印件,4、保健功能,5、产品配方或结构图,6、产品生产工艺简述和简图,— 1 —7、产品研制报告,8、产品卫生质量标准,企业标准,,9、产品设计包装,含产品标签或铭牌,样稿,10、产品标签和说明书样稿,11、产品检测报告:(1)产品原料和产品的安全性性评价报告,(2)产品保健功能评价报告,(3)产品的卫生学检验报告;(4)使用人群的保健功能效果,50例抽样调查结果,报告; 12、检测机构资质认证复印件,13、有助于评审的其它资料,14、完整的产品样品1件,15、省级卫生行政部门要求提供的其他资料。
五、保健用品评审省卫生厅于材料受理后组织召开保健用品评审专家会议。
六、结论反馈省卫生厅自召开评审会议后在规定期限内~对符合条件的~予以批准~并发给批准证书,不符合条件的~不予批准~并通知申请人。
国产保健食品册申请须知

国产保健食品册申请须知尊敬的申请人:欢迎您申请国产保健食品册,为更好地提供服务,特向您说明以下须知事项,请仔细阅读并按要求提交相关材料:一、申请人资格要求:1.申请人必须是经营保健食品相关业务的企事业单位、个体工商户或个人。
2.申请人应具备一定的经济实力和资质,并拥有符合国家食品安全相关法规的生产、经营条件。
二、申请流程:2.提交完整的申请材料后,请将申请表及相关附件通过邮寄或专递方式寄送至国产保健食品册申请审批部门,同时保留原件备查。
三、申请材料要求:2.企业注册证明:申请人应提供有效的企业注册证明,确保申请人合法经营。
3.经营许可证:申请人需提供有效的经营许可证,证明经营范围符合相关规定。
4.产品相关证明:请提供产品的生产许可证明或者相关标准检验合格证明,确保产品质量符合国家标准。
6.其他相关材料:根据申请要求,可能需要提供其他相关材料,如产品生产过程监控记录等。
四、申请承诺:1.申请人应对提供的所有材料的真实性、合法性负责。
2.申请人应保证所申请产品的质量和安全,并承诺遵守国家食品安全相关法规。
3.如有变更,申请人应及时向审核部门提交相关变更材料,确保申请信息的及时更新。
五、申请费用:1.申请国产保健食品册需要缴纳一定的申请费用,请将费用按规定缴纳至指定账户。
2.申请费用不予退还,且不得抵扣其他费用。
六、审核与答复:1.国产保健食品册申请审批部门将对申请材料进行审核。
如发现不符合要求或不真实的情况,将拒绝申请。
2.审核周期一般为30个工作日,请您耐心等待审核结果。
3.审核结果将以书面形式通知申请人,包括审批通过的申请、需要修改补充的申请以及未通过的申请。
4.申请通过后,申请人将获得国产保健食品册。
在有效期内,可合法生产、销售符合相关标准的保健食品。
七、其他事项:1.申请人应密切关注国家食品安全相关法规的更新与变动,并及时进行调整。
3.如申请人需要加急办理,请在申请表中注明,具体的加急费用和时限可与国产保健食品册申请审批部门进行沟通。
保健品批文申报流程

保健品批文申报流程
【提交申请资料】
在申请保健品批准文号前,应准备以下必要的申请资料:
国产保健食品注册申请表。
申请人身份证、营业执照或者其它机构合法登记证明文件的复印件。
提供申请注册的保健食品的通用名称与已经批准注册的药品名称不重名的检索材料。
申请人对他人已取得的专利不构成侵权的保证书。
提供商标注册证明文件(如未注册商标则不需提供)。
产品研发报告,包括研发思路,功能筛选过程,预期效果等。
产品配方及配方依据,包括原料和辅料的来源及使用的依据。
功效成分/标志性成分、含量及功效成分/标志性成分的检验方法。
生产工艺简图及其详细说明和相关的研究资料。
产品质量标准及其编制说明。
直接接触产品的包装材料的种类、名称、质量标准及选择依据。
检验机构出具的试验报告及其相关资料。
【受理与审批】
申请资料提交后,将由相关部门进行受理和审批。
审批过程中将对申请注册的保健食品的安全性、有效性、质量可控性以及标签说明书内容等进行系统评价和审查。
【出具批件】
经过审批同意后,相关部门将出具保健品批准文号,即“健字号”
批件,标志着该保健食品已获得国家批准上市。
保健品的批准文号申请流程

保健品的批准文号申请流程一。
保健品批准文号申请可不是一件简单的事儿,得一步步来,走稳每一步。
1.1 首先得搞清楚自己的产品到底符不符合申请的条件。
这就像是打地基,基础得打好。
比如说,产品的成分得合规,不能有那些乱七八糟不允许的东西。
而且,生产工艺也得过关,得保证质量稳定,不能今天一个样,明天又一个样。
1.2 接下来,准备一大堆的资料。
这可真是个繁琐的活儿,得有耐心。
像产品的配方、生产工艺的详细说明、质量标准等等,一样都不能少。
这就好比是给房子添砖加瓦,材料准备齐全了,房子才能盖得好。
二。
2.1 资料准备好,就得提交申请啦。
这时候得找对门,别走错了地方。
按照规定,把资料递交给相关的部门。
这一步就像是把钥匙插进锁孔,方向对了,门才能开。
2.2 然后就是等待审核。
这期间,可能会有工作人员来实地考察,看看你的生产场地、设备啥的。
这就像是人家来家里做客,得把家里收拾得干干净净,让人挑不出毛病。
2.3 要是审核过程中有啥问题,得积极配合整改。
可别犯倔,人家指出问题是为了让你的产品更好,更合规。
三。
3.1 要是一切顺利,通过审核,那恭喜你,离拿到批准文号就不远啦。
但也别高兴得太早,还得按照规定缴纳相关的费用。
3.2 拿到批准文号,可别以为就万事大吉了。
还得严格按照批准的内容生产、销售,保证产品的质量和安全。
这就像开车上了路,得遵守交通规则,不然就得吃罚单。
保健品批准文号申请这事儿,得认真、细心、有耐心,一步一个脚印,才能最终成功。
保健食品申报攻略

保健食品申报攻略1.什么样的产品可以申报保健食品?我国保健食品是经国家食品药品监督管理局(2003年6月之前为卫生部)批准生产和销售的保健食品,是指声称具有特定保健功能(27种)或者以补充维生素、矿物质为目的的食品。
即适宜于特定人群食用,具有调节机体功能,不以治疗疾病为目的,并且对人体不产生任何急性、亚急性或者慢性危害的食品。
所以申报保健食品的产品,必须具有三种属性:①食品属性;②功能属性,具有特定的功能;③非药品属性。
经批准的产品发给保健食品批准文号。
批准文号原为卫食健字(XXXX)第XXXX号(国产)、卫食健进字(XXXX)第XXXX 号(进口),2003年下半年后改为国食健字和国食健进字。
2.对申请人和产品资格的要求?国产保健食品注册申请,是指申请人拟在中国境内生产销售保健食品的注册申请。
申请注册保健食品所需的样品,应当在符合《保健食品良好生产规范》的车间生产,其加工过程必须符合《保健食品良好生产规范》的要求。
进口保健食品注册申请,是指已在中国境外生产销售一年以上的保健食品拟在中国境内上市销售的注册申请。
境内申请人应当是在中国境内合法登记的公民、法人或者其他组织。
境外申请人应当是境外合法的保健食品生产厂商。
境外申请人办理进口保健食品注册,应当由其驻中国境内的办事机构或者由其委托的中国境内的代理机构办理。
3.保健食品可申报哪些功能?保健食品可申报的功能经历过多次调整。
根据保健食品检验与评价技术规范(中华人民共和国卫生部2003年版)规定,保健食品可申报的功能从之前的22种调整为27种:1.增强免疫力功能。
2.辅助降血脂功能**。
3.辅助降血糖功能**。
4.抗氧化功能**。
5.辅助改善记忆功能**。
6.缓解视疲劳功能*。
7.促进排铅功能**。
8.清咽功能**。
9.辅助降血压功能**。
10.改善睡眠功能。
11.促进泌乳功能**。
12.缓解体力疲劳#。
13.提高缺氧耐受力功能。
14.对辐射危害有辅助保护功能。
中国保健食品化妆品相关法规与注册申报程序

进口第二类、第三类医疗器械注册:
申请注册的进口第二类、第三类医疗器械,应当是在 出口国家或者地区获得上市许可的医疗器械;未在出 口国家或者地区获得上市许可的,经国务院药品监督 管理部门确认该医疗器械安全、有效而且临床需要的, 可以依照下述规定批准注册。
膳食补充剂进口时注册的要求
食品标签或说明书中如未宣称具有保健功 能,且产品中不含卫生部规定仅限用于保健食 品的成分,则不需办理保健食品审批。
检验检疫机构对进口食品进行检验,检验 合格后发给《卫生证书》,产品方可销售使用。 有特殊规定的除外,如燕窝等。
保健食品注册法规
《食品安全法》(2009年6月1日实施) 《保健食品监督管理条例》
上述资料均应翻译成中文。
2、检测
保健食品的检测须在卫生部认定的检测机构进 行。进口保健食品须在国家CDC营养与食品 安全所进行检测。检测内容包括:毒理学安全 性评价、功能性评价、产品功效成分、稳定性、 卫生学检测及根据产品特性需要进行的其他检 测。兴奋剂检测在国家兴奋剂检测中心进行。
3、评审
A、评审由卫生部(国家食品药品监督管理局)负责组织专家委 员会进行技术审核。专家包括:食品卫生、毒理学、工艺、检测、 营养、医学等领域的专家。
1、申请《进口保健食品批准证书》
需提供:
A、进口保健食品申请表 B、产品配方及配方依据 C、功效成分含量及测定方法 D、名称及命名依据 E、生产工艺及说明 F、产品质量标准 H、毒理学安全性评价报告 I、保健功能评价报告 J、产品功效成分检测报告 K、产品稳定性实验报告 L、产品卫生学实验报告 M、出口国或国际组织的有关标准、生产国允许生产销售的证明 N、代理商须提供生产企业的委托书 O、标签及说明书 P、国内外有关资料 Q、根据产品特性或有关规定应提交的其他资料
保健品审批办法

陕西省保健用品审批管理办法(试行)第一条为规范保健用品的注册管理,保证保健用品安全有效,根据《陕西省保健用品管理条例》,制定本办法。
第二条在陕西省境内生产的产品,凡是纳入《陕西省保健用品分类目录》(附件1)的,除法律、行政法规另有规定外,均应按本办法的规定申请注册。
第三条申请保健用品注册,申请人应当按照规定填写《陕西省保健用品注册申请表》,并如实报送下列资料:(一) 产品研制报告、命名依据、组方依据或者构造原理及相关资料;(二) 产品生产工艺;(三) 产品质量标准;(四) 检验机构出具的产品检验报告(微生物检验、理化鉴别检验、毒理安全性评价、功能学评价,具体检验项目的确定见附件2);(五) 产品包装、标签及说明书样稿(彩色);(六) 生产企业的营业执照和资质证明。
申报资料一式6份(1份原件、5份复印件),并附样品1份。
第四条收到申报资料后,省食品药品监督管理局应当在5日内对申报资料的规范性、完整性、合法性进行审查,并发出受理或者不受理通知书。
第五条省食品药品监督管理局受理注册申请后,应当在15日内对生产企业的生产条件、从业人员资格、质量管理机构、设备及管理制度等按《保健用品生产质量管理规范》的要求进行现场核查,并提出核查意见。
现场核查符合规定要求的,核查人员同时抽取检验用样品,封存送第三方检验机构进行复核检验。
第六条检验机构应当依据省食品药品监督管理局出具的检验通知书接收样品并进行微生物和理化鉴别项目的检验。
申请人取得检验机构出具的检验报告后,应将1份原件、5份复印件报送省食品药品监督管理局。
第七条收到全部申报资料后,省食品药品监督管理局应在60日内从陕西省保健用品审评咨询专家库随机抽取5名专家组成评审小组对申报资料进行技术审评,并提出技术审评意见。
第八条对于通过技术审评的注册申请,经主管局领导批准后,签发《陕西省保健用品生产批准证书》,并于5日内送达注册申请人。
对未通过现场核查或技术审评未予通过,不予许可的注册申请,应发给不予许可决定书,并书面说明理由。
保健生产许可证办理流程

保健生产许可证办理流程1.申请人填写《保健食品生产许可申请表》。
The applicant fills in the "Application Form for Health Food Production License".2.申请人准备相关资料。
The applicant prepares the relevant materials.3.递交申请表和相关资料至当地食品药品监管部门。
Submit the application form and related materials to the local food and drug regulatory department.4.监管部门受理申请材料,并进行初审。
The regulatory authority accepts the application materials and conducts initial review.5.监管部门组织现场核查。
The regulatory authority organizes on-site inspections.6.接受监管部门的抽检和检测。
Accept random sampling and testing by the regulatory authority.7.监管部门对审批材料进行终审。
The regulatory authority conducts final review of the approval materials.8.申请人接受监管部门的专业指导和培训。
The applicant receives professional guidance and training from the regulatory authority.9.监管部门对审批结果进行公示。
The regulatory authority publicizes the approval results.10.接受监管部门的监督和检查。
保健食品新产品备案网上申报指南word版本

保健食品新产品备案网上申报指南保健食品新产品备案网上申报指南按照《中华人民共和国食品安全法》《保健食品注册与备案管理办法》关于保健食品备案管理的相关规定,为统一规范全国保健食品备案管理工作,国家市场监督管理总局保健食品备案信息系统于2017年5月1日正式上线运行。
网址为:。
希望下面的内容可以为保健食品备案人快速、方便、正确的使用保健食品备案管理信息系统提供帮助。
如果在阅读之后仍不能顺利填写,建议可找专业的申报代理公司协助完成。
国产保健食品新产品及首次进口的保健食品符合备案要求的应进行网上填报。
Step1获取备案系统登录帐号1.1获取帐号国产保健食品备案人应当是保健食品生产企业(以下称备案人)或者保健食品原注册人(以下简称原注册人)。
当备案人第一次使用本系统时,看到的是下图的页面,首先需要获取一个登录帐号。
点击获取登录帐号按钮,进入获取帐号页面。
进入获取备案人帐号页面如下图:首先是填写帐号信息,如图输入帐号、密码、确认密码、备案类型、选择是否原注册人。
五项内容都是必填项缺一不可。
其中用户名不能为汉字,建议使用字母与数字结合,区分大小写。
登录密码长度6-18位,建议使用字母与数字结合,区分大小写,两次输入密码必须一致。
点击下一步进入下一页面继续完善帐号信息。
在上图中点击下一步,来到如下页面。
按照页面顺序和页面提示内容一步步输入备案人真实的符合规范的信息。
带红色*号的为必填项,必填项未填写点击下一步页面不会转入下一页,并提示相关信息为必填项。
企业信息填写过后,点击下一步进入如下页面,在此页面备案人需要上传营业执照、食品生产许可证、商标证、法人代表身份证/护照扫描件、联系人授权书。
具体操作:点击上传文件按钮,从弹出的菜单框中选择计算机本地文件。
点击提交按钮后完成操作,如果操作正确,系统会在页面中显示“提交完成!请等待登录帐号”以及提交帐号和注册手机号的相关信息。
注册信息提交后请耐心等待帐号信息的确认,确认结果会以短信的形式通知联系人。
保健食品申报流程
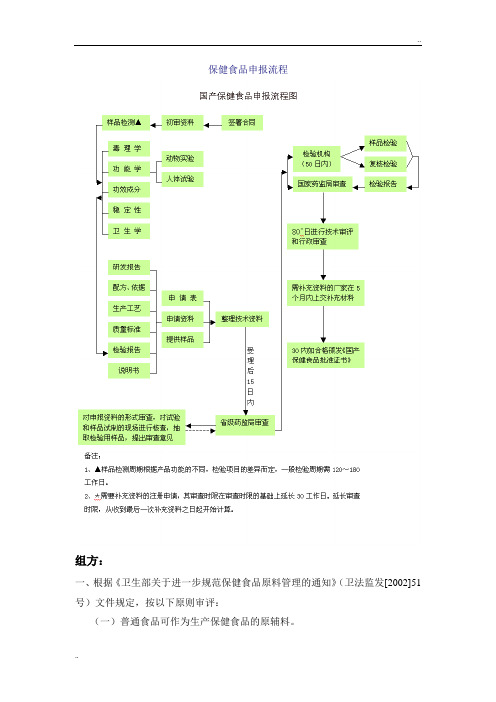
保健食品申报流程组方:一、根据《卫生部关于进一步规范保健食品原料管理的通知》(卫法监发[2002]51号)文件规定,按以下原则审评:(一)普通食品可作为生产保健食品的原辅料。
(二)申请注册的保健食品中涉及食品添加剂的,应符合《食品添加剂使用卫生标准》的规定,即所用品种为列入《食品添加剂使用卫生标准》(GB2760)、《食品营养强化剂使用卫生标准》(GB14880)或卫生部公告名单中的食品添加剂新品种。
(三)卫生部批准的食品新资源或新资源食品(仅限于食品新资源或新资源食品生产批件中载明的申报单位使用)。
(四)申请注册的保健食品涉及动植物物品的,该物品应为卫生部发布的《即是食品又是药品的物品名单》和《可用于保健食品的物品名单》内规定的物品。
(五)在我国新研制、新发现、新引进的无食用习惯或仅在个别地区有食用习惯的,符合食品基本要求的物品,称之为食品新资源或新资源食品,申请注册保健食品中涉及食品新资源或新资源食品的,应按照《新资源食品卫生管理办法》的有关规定执行,申请人应按以下要求提供该物品相应的安全性毒理学评价试验报告及相关的食用安全资料:1、根据卫法监发[2002]51号文件规定,申请注册的保健食品中含有动植物物品(或原料)总数不得超过14个,允许使用《既是食品又是药品的物品名单》(附件1)、《可用于保健食品的物品名单》(附件2)之外的动植物物品(或原料),总个数不得超过1个,且该物品(或原料)应参照《食品安全性毒理学评价程序》(GB15193.1-1994)及《保健食品检验与评价技术规范(2003)》的有关要求进行安全性毒理学试验,原则上应进行第一、二、三个阶段毒性试验,及必要的人群流行病学调查,必要时应进行第四阶段试验。
具体规定如下:(1)仅在国外少数国家或国内局部地区有食用历史的原料或成分,原则上应对该原料或成分进行第一、二、三阶段的毒性试验,必要时进行第四阶段毒性试验。
(2)若根据有关文献资料及成分分析,未发现有毒或毒性甚微不至构成对健康损害的物质,以及较大数量人群有长期食用历史而未发现有害作用的动植物及微生物等,可以先对该物质进行第一、二阶段的毒性试验,经初步评价后,决定是否需要进行下一阶段的毒性试验。
保健食品注册申报申请指南(中保办)

保健食品注册申请指南一、受理单位、地址、时间以及联系电话等受理单位:国家食品药品监督管理局保健食品审评中心保健食品受理处受理时间:每周一、二、四(节假日除外)上午9:00—11:30;下午1:30—3:30国家食品药品监督管理局网站:中国注册申报网:国家食品药品监督管理局保健食品审评中心:二、保健食品审批工作程序国产保健食品,由省、自治区、直辖市(食品)药品监督管理部门负责对国产保健食品注册申请资料的受理和形式审查,对申请注册的保健食品试验和样品试制的现场进行核查,组织对样品进行检验。
进口保健食品,由申请人将申报资料和样品报送国家食品药品监督管理局。
三、申报资料的一般要求(一)申报资料首页为申报资料项目目录,目录中申报资料项目按《保健食品注册申请表》中“所附资料”顺序排列。
每项资料加封页,封页上注明产品名称、申请人名称,右上角注明该项资料名称。
各项资料之间应当使用明显的区分标志,并标明各项资料名称或该项资料所在目录中的序号。
整套资料用打孔夹装订成册。
(二)申报资料使用A4规格纸张打印(中文不得小于宋体小4号字,英文不得小于12号字),内容应完整、清楚,不得涂改。
(三)除《保健食品注册申请表》及检验机构出具的检验报告外,申报资料应逐页加盖申请人印章或骑缝章(多个申请人联合申报的,应加盖所有申请人印章),印章应加盖在文字处。
加盖的印章应符合国家有关用章规定,并具法律效力。
(四)多个申请人联合申报的,应提交联合申报负责人推荐书。
(五)申报资料中同一内容(如产品名称、申请人名称、申请人地址等)的填写应前后一致。
(六)产品名称应包括品牌名、通用名和属性名。
产品名称应符合以下要求:1.符合国家有关法律、法规、规章、标准、规范的规定。
2.反映产品的真实性,简明易懂,符合中文语言习惯。
3.品牌名可以采用产品的注册商标或其他名称。
4.通用名应当准确、科学,不得使用明示或暗示治疗作用以及夸大功能作用的文字。
5.属性名应当表明产品的客观形态,其表述应规范、准确。
保健用品批准证书申报指南

《XX省保健用品批准证书》申报指南申报依据:《XX省保健用品管理条例》受理范围:XX省行政区域内从事保健用品生产的单位申报程序:一、保健用品生产企业现场核查1、符合《XX省保健用品生产企业卫生规范》要求的企业,可以向省卫生健康委行政审批办申请生产现场核查。
2、省卫生健康委行政审批办在受理申请后15日内,组织省级卫生监督机构专业人员会同生产企业所在地市(州)级(含省直管市县)卫生监督机构专业人员进行现场核查。
3、现场核查时,申请企业应根据产品类别提供核查资料,包括(1)厂区平面图、生产车间平面图(2)生产工艺流程简图(3)生产设备清单及检验设备清单(委托检验提供委托检验协议)(4)生产环境及生产用水检测报告(5)其他所需资料。
4、对通过核查的生产企业出具现场核查意见。
二、保健用品检验1、保健用品生产企业自主选择具有资质认定的检测机构进行产品检测。
2、申报的保健用品需要提供同一批次产品的安全评价报告、保健功能评价报告、卫生学评价报告及其他必要的检测报告。
三、保健用品批准证书的受理申报保健用品批准证书时,申报单位应提交以下资料(资料一式6份,其中原件1份,复印件5份。
A4纸打印,加盖公章,装订成册):1、《XX省保健用品批准证书》申请表;2、《企业法人营业执照》;3、生产企业现场核查意见(附现场核查资料);4、产品配方或者结构图;5、产品生产工艺简述、简图或者制造原理;6、产品研制报告;7、产品卫生质量标准(企业标准);8、产品安全性评价报告;9、产品保健功能评价报告;10、产品卫生学评价报告;11、产品标签、说明书以及设计包装样稿;12、产品样品(三件);13、其他材料(有助于评审的资料)。
四、保健用品评审及批准1、省卫生健康委行政审批办定期组织专家召开保健用品评审会,对申报的保健用品进行技术审查,出具评审报告。
2、对通过评审的产品发放《XX省保健用品批准证书》;未通过评审的,将评审意见书面告知申报单位。
保健食品申报流程

保健食品申报流程1.保健食品申报定义:通常也叫保健食品注册申报,是指国家食品药品监督管理局根据申请人的申请,依照法定程序、条件和要求,对申请注册的保健食品的安全性、有效性、质量可控性以及标签说明书内容等进行系统评价和审查,并决定是否准予其注册的审批过程;包括对产品注册申请、变更申请和技术转让产品注册申请的审批。
最终拿到批文:国食健字G2*******.2.保健食品定义:我国保健食品是经国家食品药品监督管理局批准生产和销售的保健食品,是指声称具有特定保健功能(27种)或者以补充维生素、矿物质为目的的食品。
即适宜于特定人群食用,具有调节机体功能,不以治疗疾病为目的,并且对人体不产生任何急性、亚急性或者慢性危害的食品。
所以申报保健食品的产品,必须具有三种属性:1)食品属性;2)功能属性,具有特定的功能;3)非药品属性。
工具/原料•申报注册企业资质要求:合法的营业执照。
保健食品申报流程1配方研究论证:根据中国保健食品原料用量要求,做出配伍性强、剂型合理、有一定功效的配方经保健食品专家、营养师等研究论证2小试生产研究:在保健食品GMP小试车间进行配方的小试生产论证,小试研究员不断的尝试和检测,最终确定产品配方、生产工艺和一套产品检测的方法学论证3中试生产:要求:保健食品GMP车间,合格的原、辅料及包材(在实验室中做入厂检测);按照小试的配方和工艺生产三批样品,在实验室中对成品功效成分、成分、理化指标等检测。
4省局抽样:省局向试制单位进行抽样,主要检查:产品配方;产品质量标准及说明书;原辅料包材出入库及检测记录、厂家资质;成品生产记录;成品检测记录;仪器使用记录、设备使用记录、生产单位资质、中试生产表等等。
5理化、毒理、功能试验:一般产品都需要进行安全性试验(毒理)、功能学试验(动物功能/人体试食试验)、稳定性试验、卫生学检验、功效/标志性成分鉴定试验。
根据产品的功能和原料特性,还有可能要求申报的产品进行激素、兴奋剂检测、菌株鉴定试验、原料品种鉴定等。
中药保健品申报流程及相关政策法规

英文回答:The reporting process for Chinese medicine health products is governed by the relevant policy regulations and regulations,and is based on the provisions of laws and regulations such as the Law of the People ' s Republic of China on Medicines andthe Law of the People ' s Republic of China on Chinese medicine,including information on the production process, the selection of raw materials and the analysis of the drug ' s effects。
Declarers need to strengthen product quality and safety management to ensurepliance with relevant national standards and requirements。
(b) Submit to the National Drug Supervisory Authority the declarations, pay the declaration fees in accordance with the law and specify the health functionof the product and the application of the dress, and submit clinical studies and test results。
四、申请的保健品批准证书

四、申请的保健品批准证书The approval certificate of health care products在中国,保健食品是指:经国家食品药品监督管理局批准生产和销售,声称具有特定保健功能(27种)或者以补充维生素、矿物质为目的的食品。
即适宜于特定人群食用,具有调节机体功能,不以治疗疾病为目的,并且对人体不产生任何急性、亚急性或者慢性危害的食品。
In China, the health food which is: by the state food and drug administration to approve the production and sales, claims to have specific health functions (27) or to supplement the vitamins, minerals for the purpose of food. That is suitable for specific populations edible, which can adjust the function of the body, not to treat the disease for the purpose, and to the human body does not produce any acute, subacute or chronic of the harm of food.一、分类:两大类,主要是指27种保健功能和营养补充剂:A, classification: two kinds big, is mainly refers to 27 of health care function and nutrition supplements:27种保健功能包括:27 of health care features include:增强免疫力、Enhance immunity,对辐射危害有辅助保护功能、To radiation hazards have assisted protection function,改善睡眠、Improve sleep,增加骨密度、Increased BMD,缓解体力疲劳、The alleviation physical fatigue,对化学性肝损伤有辅助保护功能、For chemical liver damage have assisted protection function,提高缺氧耐受力;Improve oxygen tolerance;缓解视疲劳、Alleviate visual fatigue,祛痤疮祛、Remove acne, remove祛黄褐斑、Remove age spot,改善皮肤水份、Improve skin moisture,改善皮肤油份;Improve skin oil share;辅助降血脂、reducing blood fat,辅助降血糖、Auxiliary fall blood sugar,辅助降血压、Auxiliary fall blood pressure,对胃粘膜有辅助保护功能、To gastric mucous membrane have assisted protection function,抗氧化、Antioxidant,辅助改善记忆、Auxiliary improve memory,促进排铅、Promote row lead,清咽、Qing pharynx,促进泌乳、Promote lactation,减肥、Reducing weight,改善生长发育、Improve growth and development,改善营养性贫血、Improve nutritional anemia,调节肠道菌群、Adjust the intestinal flora,促进消化、Promote digest,通便。
保健食品申报流程

保健食品申报流程国产保健食品申报流程图备注:1、▲样品检测周期根庭产品功能的不同,检验项目的差异而定,一股检验周120-180 工作日.2、龙需要补充盜料的注毋申恃HSW时限在宙査时阴的基紬上延长30工作日。
延长目杳时限从收至煖后一次补充资料之日起开始计韋组方:一、根据《卫生部关于进一步规范保健食品原料管理的通知》(卫法监发[2002J51 号)文件规定,按以下原则审评:(一)普通食品可作为生产保健食品的原辅料。
(二)申请注册的保健食品中涉及食品添加剂的,应符合《食品添加剂使用卫生标准》的规定,即所用品种为列入《食品添加剂使用卫生标准》(GB2760)、《食品营养强化剂使用卫生标准》(GB14880)或卫生部公告名单中的食品添加剂新品种。
(三)卫生部批准的食品新资源或新资源食品(仅限于食品新资源或新资源食品生产批件中载明的申报单位使用)。
(四)申请注册的保健食品涉及动植物物品的,该物品应为卫生部发布的《即是食品乂是药品的物品名单》和《可用于保健食品的物品名单》内规定的物品。
(五)在我国新硏制、新发现、新引进的无食用习惯或仅在个别地区有食用习惯的,符合食品基本要求的物品,称之为食品新资源或新资源食品,申请注册保健食品中涉及食品新资源或新资源食品的,应按照《新资源食品卫生管理办法》的有关规定执行,申请人应按以下要求提供该物品相应的安全性毒理学评价试验报告及相关的食用安全资料:1、根据卫法监发[2002]51号文件规定,申请注册的保健食品中含有动植物物品(或原料)总数不得超过14个,允许使用《既是食品乂是药品的物品名单》(附件1)、《可用于保健食品的物品名单》(附件2)之外的动植物物品(或原料), 总个数不得超过1个,且该物品(或原料)应参照《食品安全性毒理学评价程序》(GB15193.1-1994)及《保健食品检验与评价技术规范(2003)》的有关要求进行安全性毒理学试验,原则上应进行笫一、二、三个阶段毒性试验,及必要的人群流行病学调查,必要时应进行笫四阶段试验。
保健品代理商需知保健食品申报流程(2)

保健品代理商需知保健食品申报流程(2)保健品代理商需知保健食品申报流程中试生产量应为配方量的10倍以上(或≥30kg原料量)。
5三批中试生产数据应包括原料用量、辅料用量、总配制量、理论产量、实际产量、成品得率等乳制品中试投料根据设备能力,最低不能低于配方量的 10倍。
注:样品试制现场必须符合符合保健食品良好生产规范,即试制单位必须具有GMP资质⑥ 三批中试产品的自检报告中试生产完成后,应对三批中试产品进行自检,并出具规范的自检报告,包括理化指标、功效成分指标、卫生学、稳定性检测。
(2)样品试验阶段中试生产完成后,将样品送检验机构进行样品试验,试验包括:① 安全性评价(毒理学试验)② 功能学试验(动物功能、人体试食)在确定的27个保健功能中,其中:7个只作动物功能试验,不做人体试食试验(增强免疫力功能、改善睡眠、缓解体力疲劳、提高缺氧耐受力,对辐射危害有辅助保护功能、对化学性肝损伤有辅助保护功能、增加骨密度);5个只作人体试食试验,不做动物功能试验(缓解视疲劳、祛痤疮、祛黄褐斑、改善皮肤水分、改善皮肤油分),其余15个即做动物试验,也做人体试验。
缓解体力疲劳、减肥需做兴奋剂检测;改善生产发育需进行激素的检测;试验时间不等,最长需18-19个月,如抗氧化、改善生长发育。
最短6-7个月,如营养素补充剂、增强免疫力功能③ 功效成分或标志性成试验报告功效成分:与产品保健功能有关的成分;如营养素补充剂中补充维生素A、D、E、C等及矿物质钙、铁锌硒等标志性成分:代表产品特性的成分;如粗多糖、总黄酮等④ 稳定性试验⑤ 卫生学试验⑥ 其他报告(原料的品种鉴定报告、菌种的毒力试验报告)注:营养素补充剂不需做毒理试验报告和功能试验报告试验报告的有效期为2年(3)资料准备阶段(由钱月同志讲)(4)省级药局初审阶段省级药局在接到申请人的注册申请后的5个工作日内,给出受理或不受理的通知,,在受理后的15个工作日内对样品试制现场和试验现场进行核查① 样品试制现场的核查内容● 样品试制单位生产资质证明GMP证书。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《XX省保健用品批准证书》
申报指南
申报依据:《XX省保健用品管理条例》
受理范围:XX省行政区域内从事保健用品生产的单位
申报程序:
一、保健用品生产企业现场核查
1、符合《XX省保健用品生产企业卫生规范》要求的企业,可以向省卫生健康委行政审批办申请生产现场核查。
2、省卫生健康委行政审批办在受理申请后15日内,组织省级卫生监督机构专业人员会同生产企业所在地市(州)级(含省直管市县)卫生监督机构专业人员进行现场核查。
3、现场核查时,申请企业应根据产品类别提供核查资料,包括(1)厂区平面图、生产车间平面图(2)生产工艺流程简图(3)生产设备清单及检验设备清单(委托检验提供委托检验协议)(4)生产环境及生产用水检测报告(5)其他所需资料。
4、对通过核查的生产企业出具现场核查意见。
二、保健用品检验
1、保健用品生产企业自主选择具有资质认定的检测机构进行产品检测。
2、申报的保健用品需要提供同一批次产品的安全评价
报告、保健功能评价报告、卫生学评价报告及其他必要的检测报告。
三、保健用品批准证书的受理
申报保健用品批准证书时,申报单位应提交以下资料(资料一式6份,其中原件1份,复印件5份。
A4纸打印,加盖公章,装订成册):
1、《XX省保健用品批准证书》申请表;
2、《企业法人营业执照》;
3、生产企业现场核查意见(附现场核查资料);
4、产品配方或者结构图;
5、产品生产工艺简述、简图或者制造原理;
6、产品研制报告;
7、产品卫生质量标准(企业标准);
8、产品安全性评价报告;
9、产品保健功能评价报告;
10、产品卫生学评价报告;
11、产品标签、说明书以及设计包装样稿;
12、产品样品(三件);
13、其他材料(有助于评审的资料)。
四、保健用品评审及批准
1、省卫生健康委行政审批办定期组织专家召开保健用品评审会,对申报的保健用品进行技术审查,出具评审报告。
