第六章 难溶强电解质的沉淀
无机化学第六章

s[Mg(OH) 2 ] =
3
K sp [Mg(OH) 2 ] 2 ×1
2 −12
c
5.1×10 = mol ⋅ L−1 4 = 1.1×10−4 mol ⋅ L−1
对于同类型的难溶强电解质,标准溶度积常 数越大,溶解度也就越大。但对于不同类型的难 溶强电解质,不能直接用标准溶度积常数来比较 溶解度的大小,必须通过计算进行比较。
= (v+ s / c )v+ ⋅ (v− s / c )v− = (v+ )v+ ⋅ (v− )v− ⋅ ( s / c )v+ + v−
v+ + v−
s = c
Ksp (v+ )v+ ⋅ (v− )v−
例题
例 6-1 已知 25 ℃ 时 BaSO4 的溶解度为 1.05× 10-5 mol·L-1 ,试求该温度下 BaSO4 的标准溶度积常 数。 解:BaSO4 为 1-1 型难溶强电解质,其标准溶度 积常数为:
(二) 发生氧化还原反应使沉淀溶解
在含有难溶强电解质沉淀的饱和溶液中加入 某种氧化剂或还原剂,与难溶电解质的阳离子或 阴离子发生氧化还原反应,使 J < Ksp ,导致难溶 强电解质的沉淀溶解。
(三) 生成配位个体使沉淀溶解
在含有难溶强电解质沉淀的饱和溶液中加入 某种电解质,与难溶强电解质的阳离子或阴离子 生成配离子,使 J < Ksp ,导致难溶电解质沉淀溶 解。
⋅
1.6 ×10−24 = = = 2.5 ×10−3 K a1 (H 2S) ⋅ K a2 (H 2S) 8.9 ×10−8 × 7.1×10−15
由反应式可知,当 0.010 mol ZnS 溶解在 1.0 L 盐酸 中, Zn2+ 和 H2S 的平衡浓度均为 0.010 mol·L-1。溶 液中 H+ 相对浓度为:
第六章 沉淀—溶解平衡

第六章 沉淀—溶解平衡∙教学基本要求∙⑴熟悉难溶电解质的沉淀溶解平衡,掌握标准溶度积常数及其与溶解度间的关系和有 关计算。
⑵掌握溶度积规则,能用溶度积规则判断沉淀的生成和溶解。
熟悉 PH 对难溶金属氢氧 化物和金属硫化物沉淀溶解平衡的影响及有关计算。
熟悉沉淀的配位溶解及其简单计算。
⑶了解分步沉淀和两种沉淀间的转化及有关计算。
∙重点概要∙1.溶度积常数⑴沉淀溶解平衡与溶度积在一定条件下,难溶电解质与其饱和溶液中的相应阴、阳离子之间达到沉淀溶解平衡:A nB m (s) ƒnA m+ (aq) +mB n(aq)沉淀溶解平衡属于多相离子平衡,其标准平衡常数的表达式为:( ) ( ) ( ) mm n sp n m K A B c A c c B c +- éùéù = ëûëû(61)sp K 称为溶度积常数,简称为溶度积。
⑵溶度积与溶解度的关系溶度积和溶解度都可以表示难溶电解质的溶解性,它们之间可以相互换算。
对于同类型的电解质, sp K 小者,其溶解度(以 mol ∙L -1 为单位)也小。
对于不同类型的难溶电解质,不能直接用 sp K 的大小来比较其溶解度的大小,必须通 过计算比较。
⑶溶度积规则对于难溶电解质 A n B m ,通过比较任意状态时的反应商J 与溶度积 sp K 的大小,可以判 断沉淀的生成和溶解,即溶度积规则。
J > sp K ,沉淀从溶液中析出。
J = sp K ,溶液为饱和溶液,系统中有固相(沉淀)存在,溶液与固相相处于平衡状态。
J < sp K ,溶液为不饱和溶液,无沉淀析出;若原来有沉淀,则沉淀溶解。
⑷同离子效应和盐效应在难溶电解质溶液中加入含有系统相同离子的易溶强电解质,可使难溶电解质的溶解 度降低,这种现象称为同离子效应。
六章难溶强电解质的沉淀-溶解平衡讲解学习

(二) 发生氧化还原反应使沉淀溶解 在含有难溶强电解质沉淀的饱和溶液中加入
某种氧化剂或还原剂,与难溶电解质的阳离子或 阴离子发生氧化还原反应,使 J Ksp ,导致难溶 强电解质的沉淀溶解。
(三) 生成配位个体使沉淀溶解 在含有难溶强电解质沉淀的饱和溶液中加入
某种电解质,与难溶强电解质的阳离子或阴离子 生成配离子,使 J Ksp ,导致难溶电解质沉淀溶 解。
对于沉淀-溶解反应:
M v A v (s) v M z(a q ) v A z(a q )
其反应商为:
J [c (M z)/c]v [c (A z)/c]v
沉淀-溶解反应的摩尔吉布斯自由能变为:
rG m R TlnK spR TlnJ
由上式可以得出如下结论:
(1)当K sp J 时,rGm 0 ,沉淀-溶解反应 正向进行。
实现分步沉淀的最简单方法是控制沉淀剂的浓 度。
例题
实现分步沉淀的另一种方法是控制溶液 pH, 这种方法只适用于难溶强电解质的阴离子是弱酸 根或 OH- 两种情况。
例题
二、沉淀的转化
把一种沉淀转化为另一种沉淀的过程,称为沉 淀的转化。沉淀转化反应的进行程度,可以利用反 应的标准平衡常数来衡量。
沉淀转化反应的标准平衡常数越大,沉淀转化 反应就越容易进行。若沉淀转化反应的标准平衡常 数太小,沉淀转化反应将是非常困难,甚至是不可 能的。
例题
(2)当 K sp J 时,rGm 0 ,沉淀-溶解反应 处于平衡状态,此时的溶液为饱和溶液。
(3)当 K sp J 时,rGm 0 ,沉淀-溶解反 应逆向进行,有沉淀析出。
这就是沉淀 - 溶解平衡的反应商判据,也称 溶度积规则。
二、沉淀的生成
无机化学第6章 难溶强电解质的沉淀-溶解平衡

常见难溶强电解质的溶度积
二、标准溶度积常数与溶解度 的关系
一定温度下,溶度积和溶解度都可表示难 溶电解质在水中的溶解能力。
若溶解度s 的单位用mol.L-1,称为摩尔溶 解度。
注意:推导若溶度积和溶解度关系时, 溶解度采用摩尔溶解度。
2. 溶度积与溶解度
二、标准溶度积常数与溶解度的关系
难溶强电解质Mv Av饱和溶液中存在沉淀-溶解平衡:
MvAv (s) vMz (aq) vAz (aq)
1-2型
如:Ag2CrO4 (s) 2Ag+ (aq) + CrO42- (aq)
2s
s
Ksp ={ceq (Ag+ )}2 {ceq (CrO42- )}= (2 s)2 (s)
Question
我们常说的沉淀,是不是一点都不溶?
例:
实验:取上层清液适量
滴加少量KI溶液
黄色沉淀(AgI)
AgCl
是否含有 s(AgCl)=1.34×10-5 mol·L-1
Ag+、Cl-
=1.92×10-4克/100mL
Question
我们常说的沉淀,是不是一点都不溶?
例:
AgCl(s) 溶解 AgCl(aq) 沉淀
AgCl(aq)
解离 Ag+ (aq)+ Cl-(aq) 分子化
AgCl
是否含有
AgCl(s)
溶解 Ag+ (aq)+ Cl-(aq) 沉淀
Ag+、Cl-
沉淀-溶解平衡
图 6-1 难溶强电解质的溶解和沉淀过程
沉淀溶解平衡
难溶强电解质Mv+Av-饱和溶液中存在如下动态平衡:
第六章 沉淀溶解平衡-文档资料

sp
c An
/ c
m c Bm
/ c
n
沉淀溶解平衡的平衡常数Ksp称为溶度积常数, 简称溶度积(Solubility Product )。
15:22:43
7
–Ksp的写法,遵循一般平衡常数表达式的写法;
BaSO4 s
Ba2
aq
2
SO4
aq
Chap6: Precipitation-dissolution Equilibrium
Main Contents:
–Solubility product (Ksp)of Insoluble electrolytes 难溶电解质的溶度积Ksp –Calculation of solubility 溶解度的求算
Soluble ions can combine to form an insoluble compound. (可溶性离子可结合为不溶性沉淀)
AgNO3(aq) + NaI (aq) → AgI(s) + NaNO3(aq) Net ionic equation: (离子方程式)
Ag+(aq) + I- (aq) → AgI(s)
15:22:43
5
§6.1 难溶电解质的溶度积
1. Solubility Product (溶度积)
– 难溶电解质的沉淀-溶解平衡---understanding
在一定温度下,难溶电解质变成水合离子进入溶液中(即溶解)
的速率与溶液中的离子回到晶体表面(即沉淀)的速率相等时
的状态,称为沉淀溶解平衡。
NO3-
ClO4-
CH3CO2-
Compounds that are mostly soluble: 大部分可溶
第六章难溶电解质的沉淀-溶解平衡

四、同离子效应和盐效应
[ SO4 ] [Ca 2 ] K SP (CaSO4 ) K 2 [CO3 ] [Ca 2 ] K SP (CaCO3 )
当KSP(CaCO3)<<KSP(CaSO4)时,K很大,反 应正向进行;即由一种难溶物转化为另一种更难溶 的物质。
墨西哥“水晶洞”:世界上最大的自然水晶洞
H 2 S 2H 2O S 2H3O
K K a1 K a 2
[ S 2 ] [ H 3O ]2 [H 2S ]
(二)发生氧化还原反应使沉淀溶解 难溶硫化物的溶解 3CuS(s)+8HNO3(aq)=3Cu(NO3)2(aq)+
3S(s)+2NO(g)+4H2O(l)
CaCO3 + H3O+ Ca2+ + H2CO3 +H2O
例:25℃时,欲使0.010molZnS溶于1.0L盐酸中, 求所需盐酸的最低浓度? 解:ZnS(s) + 2H+(aq) c0 0.01 x ceq 0 x-0.02 Zn2+(aq) + H2S(aq) 0 0 0.01 0.01
K SP ( ZnS) [Zn 2 ] [ H 2 S ] [ S 2 ] K 2 [ H ]2 [ S ] K a1 ( H 2 S ) K a 2 ( H 2 S )
第六章沉淀-溶解平衡

6.1 溶解度和溶度积
(3) 分步解离的影响 2A+B A+ AB 如A2B 溶液中不仅有离子A、B存在,还有离子AB存在 使离子A、B的有效浓度降低
(4) 水解的影响 若难溶电解质的阴阳离子在水中能水解,会促使溶 解平衡右移。 但由溶度积计算出的溶解度在估算实际溶解度时 仍是有用的,本课程不考虑此偏差
相同类型的难溶电解质, 其 Ksp大的 S 也大。 不同类型的难溶电解质不能直接用溶度积比较 其溶解度的相对大小。
Ksp ( AgCl ) > Ksp ( Ag 2CrO4 )
S ( AgCl ) < S ( Ag 2 CrO 4 )
6.1 溶解度和溶度积
溶解度和溶度积之间的换算存在一定偏差
6.1 溶解度和溶度积
例2:25oC,已知 Ksp(Ag2CrO4)=1.1×10-12,求 同温度下s(Ag2CrO4)/g· L-1。 解:
Ag 2CrO4 (s) 2Ag (aq)+CrO4 (aq)
+ 2-
平衡浓度/molL-1
12
2x
x
2 2 ( Ag CrO ) { c ( Ag )} { c ( CrO Ksp 2 4 4 )}
在一定条件下,当溶解和沉淀速率相等时,便建立 了一种动态的多相离子平衡,表示如下:
BaSO4 (s)
溶解 沉淀
2 Ba 2 (aq) SO4 (aq)
Ksp [c(Ba 2+ ) / c ] [c(SO4 ) / c ]
2-
或简写为:Ksp {c(Ba 2+ )} {c(SO42- )}
实际溶解度 > 计算得到的离子溶解度 (1) 难溶弱电解质不是完全解离
难溶电解质的沉淀溶解平衡
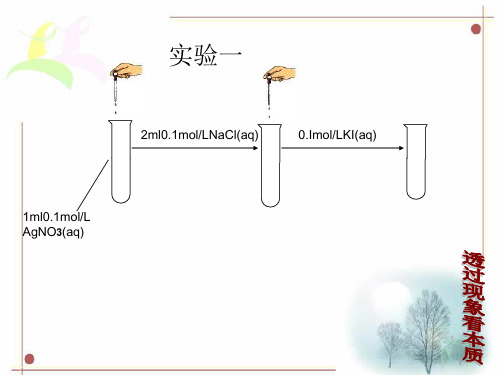
2ml0.1mol/LNaCl(aq)
0.Imol/LKI(aq)
1ml0.1mol/L AgNO3(aq)
一、 难溶电解质的溶解平衡
1、概念: 在一定条件下,当难溶电解质 v(溶解)= v (沉淀)时, 此时溶液中存在的溶解和沉淀间的动态平衡,称为沉 淀溶解平衡. 溶解平衡时的溶液是饱和溶液。
滴加0.5mol/L
Na2SO4(aq)
2C5a℃CO溶3解:1.度5 :×10-3g CaSO4:2.1 ×10-1g
注意:观察对比生成沉淀时Na2CO3(aq) 和Na2SO4(aq)的用量及实验现象。
水垢的主要成分:CaCO3、CaSO4、Mg(OH)2 如何除去水垢?
沉淀的溶解
实验三
CaCO3(S)
• 1、为什么医学上做胃部造影所服用的“钡餐”是 BaSO4而不是BaCO3?
• 2、为什么钙片的成分是CaCO3而不是CaSO4?
• 3、菠菜和豆腐为什么不宜同食?
• 4、如何预防肾结石[CaC2O4和Ca3(PO4)2]呢?
硬水的成分:是指含有较多Ca 、Mg 的水
——硬水的危害
1、全棉衣服或毛巾板结僵硬,多次洗涤后 颜色黯淡 。
2、洗澡后皮肤干燥、粗糙、发痒 。 3、热水器、增湿器、洗衣机等设备管路阻
塞、流量减小、寿命缩短 。
二、沉淀平衡的应用
沉淀的生成
实验二
滴加0.5mol/L
Na2CO3(aq)
CaCl2(aq) 0.5mol/L各1ml
①绝对不溶的电解质是没有的。
②同是难溶电解质,溶解度差别也很大。
b、外因:遵循平衡移动原理
①浓度: 加水,平衡向溶解的方向移动。 加入相同离子,平衡向沉淀方向移动。
《难溶电解质的沉淀溶解平衡》 讲义

《难溶电解质的沉淀溶解平衡》讲义一、什么是难溶电解质的沉淀溶解平衡在一定温度下,当难溶电解质溶于水形成饱和溶液时,溶解速率和沉淀速率相等的状态,就叫做沉淀溶解平衡。
比如说,把一定量的氯化银固体放入水中,氯化银会在水中溶解,同时溶解的银离子和氯离子又会结合生成氯化银沉淀。
开始时,溶解速率较大,沉淀速率较小。
随着时间的推移,溶解的氯化银逐渐增多,溶液中的银离子和氯离子浓度也逐渐增大,沉淀速率就会随之加快。
最终,溶解速率和沉淀速率相等,达到了一种动态平衡。
这就好像是一个拔河比赛,溶解和沉淀两边的力量相等,谁也无法战胜谁。
二、沉淀溶解平衡的特征1、动态平衡沉淀溶解平衡是一种动态平衡,溶解和沉淀这两个过程仍在不断进行,只是速率相等,看起来好像没有变化。
2、等速溶解速率和沉淀速率相等,这是平衡状态的重要标志。
3、定态平衡时,溶液中各离子的浓度保持不变,但不是绝对不变,而是在一定范围内波动。
4、同条件沉淀溶解平衡的建立与温度、浓度等条件有关。
在相同条件下,无论溶液中固体的量有多少,平衡状态下离子的浓度都是一定的。
三、沉淀溶解平衡的表达式以 AgCl 为例,其沉淀溶解平衡的表达式为:AgCl(s) ⇌ Ag+(aq) + Cl(aq)这里的“s”表示固体,“aq”表示在水溶液中。
四、影响沉淀溶解平衡的因素1、内因难溶电解质本身的性质是决定沉淀溶解平衡的主要内因。
不同的难溶电解质在相同条件下溶解度不同,溶解度越小,越难溶解。
2、外因(1)温度大多数难溶电解质的溶解过程是吸热的,升高温度,平衡向溶解的方向移动,溶解度增大;少数难溶电解质的溶解过程是放热的,升高温度,平衡向生成沉淀的方向移动,溶解度减小。
(2)浓度加水稀释,平衡向溶解的方向移动,但溶解度不变。
(3)同离子效应向平衡体系中加入相同的离子,平衡向生成沉淀的方向移动。
例如,在 AgCl 的饱和溶液中加入氯离子,会使平衡向左移动,生成更多的AgCl 沉淀。
(4)化学反应若加入能与体系中某些离子发生反应的物质,平衡会向溶解的方向移动。
难溶强电解质的沉淀-溶解平衡

•
一、溶度积规则
•
二、难溶强电解质沉淀的生成
•
三、难溶强电解质沉淀的溶解
•
四、同离子效应和盐效应
一、溶度积规则
• 对于化学反应,可通过比较J与 的大小判断该反应进行的方向。同理,
在沉淀溶解平衡中,可据此判断沉淀溶解平衡的方向。
K
我 们 称 J 与 Ksp 的 关 系 为 溶 度 积 规 则 (solubility product principle)。
沉淀溶解平衡
难溶强电解质Mv+Av-饱和溶液中存在如下动态平衡:
Mv Av (s) ƒ vMz (aq) vAz (aq)
理解: ②达到沉淀溶解平衡,沉淀溶解速率与沉淀 的形成的速率相等,溶质离子浓度保持不变
③平衡状态下的溶液为饱和溶液
沉淀溶解平衡
难溶强电解质Mv+Av-饱和溶液中存在如下动态平衡:
可知:
溶度积规则
J
Ksp Ksp
溶液未饱和,固体继续溶解 溶液饱和,达沉淀溶解平衡
Ksp
溶液过饱和,析出沉淀
一、溶度积规则
J Ksp
沉 淀
J Ksp
溶 解
J Ksp
溶度积规则示意图 A salt precipitates if Qsp is greater than or equal to Ksp.
Mv Av (s) ƒ vMz (aq) vAz (aq)
理解:
④沉淀溶解平衡是在一定条件下建立起来的, 当条件改变,会建立新的平衡
第一节 难溶强电解质的标准溶度积常数
• 一、难溶强电解质的标准溶度积常数
• 二、难溶强电解质的标准溶度积常数
与
•
难溶强电解质的溶解度的关系
无机及分析化学第6章-沉淀溶解平衡和沉淀滴定法

1.直接滴定法 ——测定Ag+
滴定反应: 终点反应:
Ag SCN AgSCN Fe3 SCN FeSCN2
(白色) (红色)
第二节 沉淀滴定法
二、常用的沉淀滴定法——银量法
2.返滴定法——测定卤素离子和SCN-
未滴定时: Cl-+Ag+ (过量) AgCl + Ag+ (剩余)
滴加 时: Ag+ (剩余)+ SCN-
第一节 沉淀溶解平衡
二、溶度积规则
在难溶电解质AmBn溶液平衡中,Ksp [An ]m[Bm ]n , 若用Q表示任意状态下离子浓度之积,显然Q的表示形式与
Ksp 相同,Q=[An ]m[Bm ]n ,比较 和Q可以得出如下结论: 1.Q< 为不饱和溶液,若体系中原来有沉淀,此时沉淀会
溶解,直至Q= Ksp 为止;若原来体系中没有沉淀,此时 也不会有新的沉淀生成。
的化学计量点
2.生成的沉淀 溶解度较小,
且组成恒定
4.沉淀的吸附 现象不影响
滴定终点的确定
第二节 沉淀滴定法
二、常用的沉淀滴定法——银量法
银量法根据确定终点时所用指示剂的不同,并按创立者 的名字命名为三种方法:莫尔法、佛尔哈德法和法扬司法。 (一)莫尔法——铬酸钾指示剂法 1.基本原理
莫尔法是以硝酸银为标准溶液,以铬酸钾为指示剂,在 中性或弱碱性溶液中测定Cl-或Br-的银量方法。莫尔法的反 应为:
与SCN-作用,因而干扰测定,必须预先除去。 (5)用返滴定法测定I- 时,应首先加入过量的AgNO3
,再加铁铵矾指示剂,否则Fe3+ 将氧化I- 为 I2,影 响分析结果的准确度。
第二节 沉淀滴定法
关于难溶电解质的沉淀溶解平衡

关于难溶电解质的沉淀溶解平衡●沉淀溶解平衡与电离平衡的区别:比如氢氧化铁:Fe(OH)3(s)Fe3++3OH-是沉淀溶解平衡;而Fe(OH)3(aq)Fe3++3OH-是电离平衡。
注意括号中的s、aq。
通常,(aq)可以省略不写,而(s)却不能省略不写。
当然,难溶强电解质只有沉淀溶解平衡,没有电离平衡。
●*难溶电解质的溶度积:一定温度下,难溶电解质的饱和溶液中,(难溶电解质的饱和溶液是极易获得的,只要有沉淀,就一定是饱和溶液!!)阳离子的浓度以其化学计量数(在溶解平衡的方程式中)为指数的幂与阴离子的浓度以其化学计量数(在溶解平衡的方程式中)为指数的幂的乘积为一常数,叫做溶度积常数,(不叫离子积常数!)简称为溶度积。
【参见课本p65.】记作Ksp 。
Ksp的几点用法:【以下计算是为了加深对于一些结论的理解,因为计算一般地都很麻烦,估计高考不会出现。
】1、与摩尔溶解度(用难溶电解质的饱和溶液中的溶质的物质的量浓度来表示的溶解度)互相换算。
(当然也可以与每100g水中,最多能够溶解的溶质质量g表示的溶解度继续换算。
)例1:已知常温下,硫酸钡的溶解度为0.000242g/100g水,求硫酸钡的溶度积。
解:先换算为摩尔溶解度。
硫酸钡这类难溶电解质的饱和溶液极稀,密度基本上仍然是1g/mL。
所以100g水形成的溶液认为是0.100L。
0.000242g硫酸钡的物质的量是0.000242g/233g·mol-1=1.039×10-6mol.所以摩尔溶解度为1.039×10-6mol/0.100L=1.039×10-5mol/L.那么,硫酸钡饱和溶液中C(Ba2+)= C(SO42-)=1.039×10-5mol/LKsp (BaSO4)=1.039×10-5×1.039×10-5=1.08×10-10【对于不同类型的难溶电解质,不能直接根据Ksp 的大小,来推断溶解度的大小。
沉淀溶解平衡与沉淀滴定法

应用(1)判断沉淀的生成和溶解 (2)控制离子浓度,使平衡向需要的方向移动。
二、沉淀的生成和溶解
(一)沉淀的生成
(1)沉淀生成的唯一条件是Qi>Ksp (2)在分析化学中当被沉淀离子浓度不大于
1.0×10-5mol·L-1 时认为被“沉淀完全”。 (3)沉淀剂一般过量20--50%。过多将使溶液 中离子牵制作用增强,反而使沉淀溶解。
AmBn
溶解 沉淀
mAn+ (aq) + nBm- (aq)
Ksp = cm(An+)•cn(Bm-)
在一定温度下,在难溶电解质的饱和溶液中,各 离子浓度以其计量数为指数的乘积为一常数。称为溶 度积常数
3
2.溶度积的意义:难溶化合物的溶解能力 (1)溶度积只是温度的函数。 (2)溶度积的数值可查表获得。(见附录)P276页 (3)同种类型难溶电解质溶解程度,可通过比较其 溶度积常数大小判断。 影响沉淀溶解度的因素有那些?
c(Ag+)为: c(Ag+ )
Ksp
c(CrO
24
)
1.11012 0.001
3.3105 (mol L-1)
根据溶度积规则,当c(Ag+)>3.3×10-5 mol·L-1时才会 有铬酸银沉淀析出。
10
例2 向硝酸银溶液中加入过量盐酸溶液,生成氯化 银沉淀,反应完成后,溶液中氯离子浓度为0.010 mol·L-1,问此时溶液中银离子是否沉淀完全? Ksp(AgCl)=1.8×10-10
解:Ag+ + Cl-
AgCl ↓
已知c(Cl-)=0.010 mol·L-1,根据溶度积规则,这时残
大学化学之难溶性强电解质的沉淀-溶解平衡

0
0.01
=
Ksp,SnS K1 ·K2
=
1.010–25 1.310–77.110–15
= 1.810–4
[H+]o–0.02 =
[H2S][Sn2+] = K
[H+] = [H+]o= 0.98(mol·dm–3)
2021/10/19
0.010.01 = 0.96
1.0810–4
上一页 下一页
3.3 分步沉淀
Mg(OH)2
Mg2+ + 2OH–
Ksp,Mg(OH)2 = [Mg2+][OH–]2
用类似的方法求出产生Mg(OH)2沉淀时的[OH–] [OH–] = 1.310–5(mol·dm–3)
Ksp,Fe(OH)3 = [Fe3+][OH–]3
Fe3+完全沉淀时的[OH–]可由下式求得
[OH–] =
3 Ksp,Fe(OH)3 [Fe3+]
3 =
4.010–38 1.010–5
2021/10/19
= 1.510–11(mol·dm–3)
上一页 下一页
这时的pOH = 10.8, pH = 3.2
解:
Ag2CrO4
2Ag+ + CrO42–
查表得Ag2CrO4的 溶度积常数 Ksp = 2.010–12
Ksp = [Ag+]2[CrO42–]
2021/10/19
上一页 下一页
[Ag+] =
Ksp = [CrO42–]
2.010–12 1.010–3
= 4.510–5(mol·dm–3)
• 当[Ag+] = 4.510–5mol·dm–3时, 开始有Ag2CrO4沉淀 生成。
高考化学热点:难溶电解质的沉淀溶解平衡

难溶电解质的沉淀溶解平衡【热点思维】【热点释疑】1、怎样判断沉淀能否生成或溶解?通过比较溶度积与非平衡状态下溶液中有关离子浓度幂的乘积——离子积Q c的相对大小,可以判断难溶电解质在给定条件下沉淀生成或溶解的情况:Q c>K sp,溶液有沉淀析出;Q c=K sp,溶液饱和,沉淀的生成与溶解处于平衡状态;Q c<K sp,溶液未饱和,无沉淀析出。
2、如何理解溶度积(K sp)与溶解能力的关系?溶度积(K sp)反映了电解质在水中的溶解能力,对于阴阳离子个数比相同的电解质,K sp的数值越大,难溶电解质在水中的溶解能力越强;但对于阴阳离子个数比不同的电解质,不能通过直接比较K sp数值的大小来判断难溶电解质的溶解能力。
3、沉淀溶解平衡有哪些常考的知识点?沉淀生成的两大应用①分离离子:对于同一类型的难溶电解质,如向含有等浓度的Cl-、Br-、I-的混合溶液中滴加AgNO3溶液,AgCl、AgBr、AgI中溶度积小的物质先析出,溶度积大的物质后析出。
②控制溶液的pH来分离物质,如除去CuCl2中的FeCl3就可向溶液中加入CuO 或Cu(OH)2等物质,将Fe3+转化为Fe(OH)3而除去。
【热点考题】【典例】实验:①0.1 mol·L-1 AgNO3溶液和0.01 mol·L-1 NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;②向滤液b中滴加0.1 mol·L-1 KI溶液,出现浑浊;③向沉淀c中滴加饱和KI溶液,沉淀变为黄色。
下列分析正确的是()A.通过实验①②证明浊液a中存在沉淀溶解平衡:AgCl(s) Ag+(aq)+Cl-(aq) B.滤液b中不含有Ag+C.③中颜色变化说明AgCl转化为AgID.实验可以证明AgI比AgCl更难溶【答案】C【对点高考】【2014年高考上海卷第11题】向饱和澄清石灰水中加入少量CaC2,充分反应后恢复到原来的温度,所得溶液中()A.c(Ca2+)、c(OH-)均增大B.c(Ca2+)、c(OH-)均保持不变C.c(Ca2+)、c(OH-)均减小D.c(OH-)增大、c(H+)减小【答案】B【解析】试题分析:碳化钙溶于水与水反应生成氢氧化钙和乙炔,反应的化学方程式为CaC2+2H2O→Ca(OH)2+HC≡CH↑。
第六章-沉淀溶解平衡与沉淀滴定法

沉淀和溶解平衡
(三) 溶度积规则
2、溶度积规则的应用
(1)沉淀生成的条件:Qi>Ksp
例:[CaCl2]=0.02mol/L,与[Na2CO3] =0.02mol/L等体积混合,
是否有沉淀生成?
解:混合后,[
Ca2+]
=
0.01mol/L,[
CO
2 3
]
=
0.01mol/L
Qi
=
[Ca2+]·[CO
如AgCl,CaCO3 如Mg(OH)2 ,Ag2CrO4 如 Fe(OH)3,Ag3PO4 如Bi2S3,Ca3(PO4)2
沉淀和溶解平衡
(二)溶度积与溶解度的关系
2、Ksp和S的区别与联系
(1)同种类型的难溶电解质,在一定温度下,Ksp越大则溶解度越大。不同类型的难溶 电解质,则不能用Ksp的大小来比较溶解度的大小,必须经过换算才能得出结论。
2 3
]
=
1×10–4
查表: Ksp(CaCO3)= 4.73沉淀生成。
沉淀和溶解平衡
(三) 溶度积规则
2、溶度积规则的应用
例:向0.50L 0.10mol/L的氨水中加入等体积的0.50mol/L MgCl2,问:
(1)是否有Mg(OH)2的沉淀生成?
AgCl(s)
Ag+(aq) + Cl–(aq)
当溶解和沉淀速率相等时,达到沉淀——溶解平衡,这是一种动态的平衡。此时的溶液是饱和溶液,
它是多相平衡。其平衡关系为: Ksp(AgCl) = [Ag+]·[Cl–]
对于一般沉淀反应: AnBm(s)
nAm+(aq)+mBn–(aq) Ksp= [Am+]n·[Bn–]m
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
沉淀-溶解反应的摩尔吉布斯自由能变为:
rGm RT ln Ksp RT ln J
由上式可以得出如下结论: J 时,rGm 0 ,沉淀 - 溶解反应正 (1)当 Ksp 向进行。若溶液中有难溶强电解质固体,则固体溶 J 时重新达到沉淀-溶解平衡。 解,直至 Ksp (2)当 Ksp J 时,rGm 0,沉淀-溶解反应处 于平衡状态,此时的溶液为饱和溶液。 (3)当 Ksp < J 时, rGm 0,沉淀-溶解反应逆 J 时重新达到沉淀 向进行,有沉淀析出,直至 Ksp -溶解平衡。 上述结论也称溶度积规则。利用溶度积规则, 可以判断沉淀的生成或溶解。
例题
第二节 沉淀的生成和溶解
一、溶度积规则 二、沉淀的生成 三、沉淀的溶解 四、同离子效应和盐效应
一、溶度积规则
对难溶强电解质的沉淀-溶解反应:
z z M v A v (s) v M (aq) v A (aq)
其反应商为:
J {c(Mz )}v {c(Az )}v
2NH3 (aq)
[Ag(NH3 )2 ] (aq)
四、同离子效应和盐效应
(一)同离子效应
在难溶强电解质 Mv Av 饱和溶液中加入含有 M z 或 Az 的易溶强电解质,沉淀-溶解平衡向生 成 Mv Av 沉淀的方向移动,降低了 Mv Av 的溶解 度。这种因加入与难溶强电解质含有相同离子的 易溶强电解质,使难溶强电解质的溶解度降低的 现象也称为同离子效应。
二、沉淀的生成
根据溶度积规则,如果 J Ksp ,就会有难溶 强电解质的沉淀生成。
例题
三、沉淀的溶解
根据溶度积规则,在含有沉淀的难溶强电 解质的饱和溶液中,如果能降低难溶强电解质 的阳离子浓度或阴离子的浓度,使 J Ksp ,则沉 淀就会溶解。
(一)生成弱电解质
在含有难溶强电解质沉淀的饱和溶液中加入某 种电解质,能与难溶强电解质的阳离子或阴离子生 成弱电解质,能使 J Ksp ,则难溶强电解质的沉淀 -溶解平衡向溶解方向移动,导致沉淀溶解。 难溶于水的氢氧化物能溶于酸: z M (aq) zOH (aq) M(OH) z (s)
(v {s})v (v{s})v (v )v (v )v {s}v v
v v
{s}
K
sp
(v )v (v )v
对于同类型的难溶强电解质,标准溶度积常数 越大,溶解度也就越大。但对于不同类型的难溶强 电解质,不能直接用标准溶度积常数来比较溶解度 的大小,必须通过计算进行判断。
例题
难溶强电解质的溶解过程和沉淀过程
二、标准溶度积常数与溶解度的关系
难溶强电解存在沉淀-溶解平衡: z z Mv Av (s) v M (aq) v A (aq)
标准溶度积常数与溶解度之间的关系为: Ksp {ceq (M z )}v {ceq (A种沉淀的过程,称为沉 淀的转化。沉淀转化反应的进行程度,可以利用反 应的标准平衡常数来衡量。 沉淀转化反应的标准平衡常数越大,沉淀转化 反应就越容易进行。若沉淀转化反应的标准平衡常 数太小,则沉淀的转化将是非常困难的,甚至是不 可能的。
例题
zCl (aq) zH3O (aq) zHCl(aq) zH2O(l)
2 zH2O(l) 如果加入足量的酸,难溶氢氧化物将完全溶解。
(二)发生氧化还原反应
在含有难溶强电解质沉淀的饱和溶液中加
入某种氧化剂或还原剂,与难溶电解质的阳离 子或阴离子发生氧化还原反应,降低了阳离子 或阴离子的浓度,使 J K,导致难溶强电解 sp 质的沉淀-溶解平衡向沉淀溶解的方向移动。
Ksp (Mv Av ) {ceq (Mz )}v {ceq (Az )}v 在一定温度下,难溶强电解质饱和溶液中离 子的相对浓度各以其化学计量数为指数的幂的乘 积为一常数,称为标准溶度积常数。 标准溶度积常数的大小反映了难溶强电解质 的溶解能力的大小。 K sp 只与温度有关,而与电 解质离子的浓度无关。
第六章
难溶强电解质的 沉淀-溶解平衡
第一节 标准溶度积常数 第二节 沉淀的生成和溶解 第三节 分步沉淀和沉淀的转化
第一节 标准溶度积常数
一、标准溶度积常数
二、标准溶度积常数与溶解度的关系
一、标准溶度积常数
难溶强电解质 Mv Av 在水溶液中存在下列沉 淀-溶解平衡: z z Mv Av (s) v M (aq) vA (aq) 标准平衡常数表达式为:
CuS 沉淀溶于硝酸溶液的反应式为:
3CuS(s) 8HNO3 (aq)
3Cu(NO3 )2 (aq) 3S(s) 2NO(g) 4H2O(l)
(三)生成配离子
在含有难溶强电解质沉淀的饱和溶液中加入 某种电解质,与难溶强电解质的阳离子或阴离子 生成配离子,使难溶强电解质的阳离子浓度或阴 离子浓度降低,致使 J Ksp ,沉淀 - 溶解平衡向 沉淀溶解方向移动,导致难溶电解质沉淀溶解。 AgCl 沉淀溶于氨水的反应式为: + AgCl(s) Ag (aq) Cl (aq)
第三节 分步沉淀和沉淀的转化
一、分步沉淀 二、沉淀的转化
一、分步沉淀
如果溶液中含有两种或两种以上离子,都能与 某种沉淀剂生成难溶强电解质沉淀,当加入该沉淀 剂时就会先后生成几种沉淀,这种先后沉淀的现象 称为分步沉淀。 实现分步沉淀的最简单方法是控制沉淀剂的浓 度。
例题
当溶液中同时存在几种离子,都能与加入的沉 淀剂生成沉淀时,生成沉淀的先后顺序决定于J 与 Ksp 的相对大小,首先满足 J > Ksp 的难溶强电解质 先沉淀。 实现分步沉淀的另外一种方法是控制溶液 pH, 这种方法只适用于难溶强电解质的阴离子是弱酸根 或 OH- 的两种情况。
例题
(二)盐效应
在难溶强电解质溶液中加入不具有相同离子的 易溶强电解质,将使难溶强电解质的溶解度增大, 这种现象也称为盐效应。这是由于加入易溶强电解 质后,溶液中阴、阳离子的浓度增大,难溶强电解 质的阴、阳离子受到了较强的牵制作用,使沉淀反 应速率减慢,难溶强电解质的溶解速率暂时大于沉 淀速率,平衡向沉淀溶解的方向移动。 在难溶强电解质溶液中加入具有相同离子的易 溶强电解质,在产生同离子效应的同时,也能产生 盐效应。由于盐效应的影响较小,通常可以忽略不 计。
