高二化学配合物结构的空间构型
配合物的空间结构表1配位数和配合...

存在形式:气相(离子对)Ti(I), In(I), Ga(I), Cu(I), Ag(I) 配体:体积庞大Ga[C(SiMe 3)3], 2,4,6-三苯基苯基合铜(I)(2,4,6-triphenylphenylcopper 三苯基苯基合银(I)(2,4,6-triphenylphenylsilver )[(2,6-trip 2C 6HCu(I), Ag(I), Au(I), Hg(II), Mo(IV), U(IV), AgCN, AgSCN, AuI, [UO 2] 2+, [PuO 2]2+, Mn[N(SiMePh2.1 配合物的空间结构3. 配位数3构型:平面三角形金属:d 10组态离子,Cu(I), Au(I), Hg(II), Pt(0)示例:K[Cu(CN)2], [Cu 2Cl 2(Ph 3P)2], [Cu(tu)]Cl, [Cu(SPPh 3)3]ClO 4, [Cu(Me 3PS)Cl]3, [Au(PPh 3)3]+, [AuCl(PPh 3)2], [HgI 3]-, [Pt(PPh 3)3] 注意:MX 3型化合物不一定都是三配位,如:CuCl 3,链状结构-Cl-CuCl 2-Cl-CuCl 2-;AuCl 3,实为Au 2Cl 6,Au Cl AuCl Cl Cl Cl Cl2.1 配合物的空间结构4. 配位数4构型:四面体、平面正方形、畸变四面体四面体:第一过渡系金属[尤其是Fe 3+、Co 2+以及具有球对称d 0、d 5(高自旋)或d 10电子构型的金属离子];碱性较弱或体积较大的配体——价层电子对互斥理论。
如:[Be(OH 2)4]-、[SnCl 4]、[Zn(NH 3)4]2+、Ni(CO)4、[FeCl 4]-等平面正方形:d 8电子组态的Ni 2+(强场)、第二、三过渡系的Rh +、Ir +、Pd 2+、Pt 2+、Au 3+等——晶体场理论。
如:[Ni(CN)4]2-、[AuCl 4]-、[Pt(NH 3)4]2+、[PdCl 4]2-、[Rh(PPh 3)3Cl]等畸变四面体:[CuCl 4]2-、Co(CO)4四面体平面正方形R=异丙基,磁矩=1.8∼2.3B.M.,四面体30 ∼50%R=叔丁基,磁矩=3.2B.M.,四面体95%电子排布:e 4t 24d yz 2d xz 2d z22d xy 2未成对电子数:2 0磁矩(B.M.):3.3 0:ThI2二硫醇根)合铼]dbm=二苯甲酰甲烷单帽八面体2.1 配合物的空间结构7. 配位数7构型:五角双锥(D 5h )、单帽三棱柱(C 2v )、单帽八面体(C 3v );结构互变五角双锥:Na 3[ZrF 7]、[Fe II (H 2O)(H 2edta)]⋅2H 2O 、K 5[Mo(CN)7]⋅H 2O 单帽三棱柱:(NH 4)3[ZrF 7]、Li[Mn(H 2O)(edta)]⋅4H 2O 、[MoI(CNR)6]I 单帽八面体:[MoCl 2(CO)3(PEt 3)2]、(NEt 4)[WBr 3(CO)4]金属:大多数过渡金属,d 0∼d 4畸变五角双锥2(Ac)3]4)4[VO 2(C 2O 4)3]2.1 配合物的空间结构三角十二面体四方反棱柱体dbm=二苯甲酰甲烷[Sm III (H 2O)(dmb )3],七配位[Sm II I 2(dme )3],八配位离子半径:Sm II (1.27Å) > Sm (0.958Å)配体体积:dmb > dmedme = 二甲氧基乙烷dbm=二苯甲酰甲烷单帽八面体畸变六角双锥畸变三角十二面体中心金属半径&配体体积对配位数的影响比较:2.1 配合物的空间结构10. 配位数10构型:双帽四方反棱柱(D 4d )、双帽十二面体(D 2)、十四面体(C 2v )配位数2-12的最重要配位多面体的构型配位数2-12的最重要配位多面体的构型2.2 配合物的异构现象2.2.1 化学结构异构1. 配位异构2. 键合异构——两可配体CoCl BAA CoClCl BBACoClBBA A能垒低可互变[Cr(en)3][Ni(CN)5]⋅1.5H 2O :三角双锥& 四方锥[NiBr 2(EtPPh 2)2]:四面体(顺磁性)& 平面型(抗磁性)H 2H 2H 配体异构)配体的构象异构)配合物的多元异构)手性配合物绝对构型的命名(IUPAC)ΔΛΛΔ选取八面体一对相互平行的合适的三角形平面,以M为中心画投影图,按配合物的确定构型联结双齿配体的螯合物位置。
配合物的结构理论

释配离子的几何构型及某些化学性质和磁性 等。
缺陷:孤立地看到配体与中心原子的成键,
忽略了成键过程中配体电场对中心原子d轨道
的作用,因而不能定量地说明配合物的其他
一些性质,如离子的颜色,特征光谱,稳定
性等。
h
26
二、晶体场理论
中心思想——静电理论
视中心离子和配体为点电荷,带正电荷的 中心离子和带负电荷的配体以静电相互吸引, 配体间相互排斥。
n—未成对电子数
h
18
h
19
中心原子(或离子)用外层轨道接纳配体电子, 得到外轨型配合物。
[FeF6]3– sp3d2杂化, 八面体构型, 外轨型配合物
h
20
中心原子(或离子)用部分内层轨道接纳配体 接纳配体电子,得到内轨型配合物。
d2sp3杂化, 八面体构型,内轨型配合物
h
21
Co(NH3)63+: Co3+ 3d6 内轨型配合物,低自旋 = 0
3d
4s 4p
[CoF6]3- 3d [Co(CN)6]3-—— 正八面体
F-
sp3d2
3d d2sp3
h
4d
10
轨道杂化类型与配位个体的几何构型
h
11
配位键类型——内轨配键、外轨配键
内轨配键: (n-1)d,ns,np杂化形成配位键。 内轨型配合物:由内轨配键形成的配合物 如 [Fe(CN)6]3-,[Co(NH3)6]3+,[Ni(CN)4]2-
这个顺序称为光谱化学序。
在序列中,配位体可分为强场和弱场。一般羟基,水及卤素
离子都是弱场配体。 越大—强场, 越小—弱场
第 5 章 配合物结构

配位数为六配合物
配位数为六的配合物绝大多数是八面体构型,
d区过渡金属一般均为该配位构型
配位数为七及以上的配合物
高配位数的配合物一般中心离子为稀土金属离子
配位数 2
4
6
空 间 构 型
直线形 3
四面体 平面正方形 八面体 5
配位数 空 间 构 型
三角形
四方锥
三角双锥
配合物的异构现象
结构异构
原子间连接方式不同引起的异构现象
若H和H’反向,即κ<0(~-10-6)的物质称为反磁 性或抗磁性物质; 若H和H’同向,即κ>0(~10-3),顺磁性物质;
κ=103~104,铁磁性物质
抗磁性物质中全部电子均配对,无永久磁矩,如H2,He。 顺磁性原子或分子中有未成对电子存在,如O2,NO等, 存在永久磁矩,当无外磁场时,无规则的热运动使磁 矩随机取向,当有外磁场时,磁矩按一定方向排布, 呈现顺磁性。 铁磁性在金属铁或钴等材料中,每个原子都有几个有 未成对电子,原子磁矩较大,且有一定的相互作用, 使原子磁矩平行排列,是强磁性物质。
几何异构:配体对于中心离子的不同位置。
顺式(cis)异构体 棕黄色,极性分子
反式(cis)异构体 淡黄色,非极性分子
顺铂是已经临床使用的抗癌药物
配体处于相邻位置为顺式结构(cis isomer),配体处于 相对位置,称为反式结构(trans isomer)。配位数为2的 配合物,配位数为3与配位数为4的四面体配合物, 配体 只有相对位置,因而不存在反式异构体;在平面四边 形和八面体配位化合物中,顺-反异构是很常见的。
在八面体配合物中,MA6和MA5B显然没有异构体。 在MA4B2型八面体配合物有顺式和反式两种异构体:
高二化学配合物结构的空间构型

交流与讨论
四、配合物的同分异构现象
几何异构
交 流 与 讨 论
1. 怎样判断顺式和反式?
2. Pt(NH3)2Cl2顺式和反式性质有何差异?
新课讲述
Pt(NH3)2Cl2顺反异构体的性质差异.并完成下表. 配合物 顺式 Cl Pt NH3 反式 NH3 NH3 Cl
非极性分 子
结构式 Cl
分子极性 在水中溶解 性
极性分子
比反式大
Cl Pt NH3
小
总结
MA2B2的平面形存在几何异构,在顺反异构中, 反式为非极性分子,顺式为极性分子.
+ +
MA4B2的八面体也存在顺反异构。如[CoCl2(NH3)4]+ NH3
Cl Cl Co Cl
NH3 NH3
H3N H3N
Co
NH3 NH3
NH3
顺式
Cl
反式
MA3B3的八面体也有顺反异构。如[CoCl3(NH3)3]+
新课总结
三、配合物的空间构型 配合物的空间构型是由中心原子杂化方式决定的 四、配合物的同分异构现象 几何异构 对于四配体MA2B2的平面形有顺反异构. 如Pt(NH3)2Cl2 对于六配体MA2B4 或MA4B2型有顺反异构 如Pt(NH3)2Cl4 五.配合物的性质: 1.配合物中的配位键越强,配合物越稳定。 2. 如果配体易与 H+ 结合 , 必定易与 Mn+ 结合 . 如 NH3 > H 20 3. 形成配合物后,颜色、溶解性、酸碱性、氧化 还原性等都有可能发生改变。
Cl
Cl Cl Co
+
Cl
+
NH3 NH3
Cl H3N
配合物的结构

6 2g
t 26g e1g
3 3
1 2
d8
t
e 6 2
2g g
3
d9
t
e 6 3
2g g
4
3 4
-12Dq -6 Dq
t 26g eg2 t 26g eg3
3 4
3 4
d10 t36geg4
5
5
0 Dq t26geg4
5
5
CFSE
-4Dq -8Dq -12Dq -16 Dq+P -20 Dq+2P -24 Dq+2P -18 Dq+P -12Dq -6 Dq 0 Dq
4 5.62 高 外轨型 sp3d2
晶体场稳定化能(CFSE)
1.晶体场稳定化能(CFSE)的定义
d电子从未分 裂的d轨道进入分 裂后的d轨道,所 产生的总能量下降 值。
2.CFSE的计算
n1:t 2
n2:e
轨道中的电子数
g
轨道中的电子数
g
mm12::八球面形体体场场中中,,dd轨轨道道中中的的成成对对电电子子数数
排布原则:(1)能量最低原理 (2)Hund规则 (3)Pauli不相容原理
电子成对能(P):两个电子进入同一轨 道时需要消耗的能量。
强场:o > P 弱场:o < P
八面体场中电子在t2g和eg轨道中的分布
八面体场中电子在t2g和eg轨道中的分布
高自旋
低自旋
例:
o /J
P/J 场
Co3+的价电子构型
八面体场中 d 电子排布
未成对电子数 实测磁矩/B.M
自旋状态 价键理论 杂化方式
[Co(CN)6]367.524 ×10-20 35.250 ×10-20
高中化学 专题4 第2单元第1课时 配合物的形成与空间构型教案 苏教版选修3

第1课时配合物的形成与空间构型[学习目标定位] 1.了解配合物的概念,能从微观角度理解配合物的组成及形成条件。
2.能利用轨道杂化理论判断及解释配合物的空间构型。
一、配合物的形成1.按表中实验操作步骤完成实验,并填写下表:实验操作步骤实验现象三支试管中先生成蓝色沉淀,之后随浓氨水的滴入,沉淀逐渐溶解,最后变为深蓝色溶液结论生成Cu(OH)2蓝色沉淀且溶于浓氨水(1)写出上述反应的离子方程式。
答案Cu2++2NH3·H2O===Cu(OH)2↓+2NH+4,Cu(OH)2+4NH3·H2O===[Cu(NH3)4]2++2OH-+4H2O(2)[Cu(NH3)4]2+(配离子)的形成:氨分子中氮原子的孤电子对进入Cu2+的空轨道,Cu2+与NH3分子中的氮原子通过共用氮原子提供的孤电子对形成配位键。
配离子[Cu(NH3)4]2+可表示为下图所示结构。
2.配位化合物:由提供孤电子对的配位体与接受孤电子对的中心原子以配位键结合形成的化合物,简称配合物。
如[Cu(NH3)4]SO4、[Ag(NH3)2]OH等均为配合物。
3.配合物[Cu(NH3)4]SO4的组成如下图所示:(1)中心原子是提供空轨道接受孤电子对的金属离子(或原子)。
中心原子一般都是带正电荷的阳离子,过渡金属离子最常见的有Fe3+、Ag+、Cu2+、Zn2+等。
(2)配位体是提供孤电子对的阴离子或分子,如Cl-、NH3、H2O等。
配位体中直接同中心原子配位的原子叫做配位原子。
配位原子必须是含有孤电子对的原子,如NH3中的N原子,H2O分子中的O原子等。
(3)配位数是直接与中心原子形成的配位键的数目。
如[Fe(CN)6]4-中Fe2+的配位数为6。
(4)内界和外界:配合物分为内界和外界,其中配离子称为内界,与内界发生电性匹配的阳离子或阴离子称为外界。
(1)形成配合物的中心原子(离子)必须存在空轨道,配位体一般都存在着孤电子对。
化学原理5配合物结构682606192

配位体:
配离子中和中心离子结合的含孤电子对的离子或 分子,配位体(ligand)可以是中性分子(如H2O、 NH3等),也可以是阴离子(如:Cl-、CN-等) 。其 中直接同中心离子相连接的原子称为配位原子。
只有一个配位原子的配位体称为单齿配位体(或 单基配位体)。含有多个配位原子的配体称为多齿配 位体(或多基配位体)。
sp杂化
配位数为4的配合物
四面体构型
sp3杂化(如
两种构型
Be2+)
平面四方形构型 dsp2杂化
由中心离子的价层电子结构和配位体性质决定
1s
2s
2p
Be2+
[BeX4]-
X-
X- X- X-
Ni2+ 等d轨道未充满的离子4配位时,就可 能有两种构型;
3d
4s
4p
Ni2+
可能sp3杂化形成四面体构型,此时磁矩约为 2.83B.M.
例:[PtCl3NH3]-
三氯 ·氨合铂(II)离子
[CoCl(SCN)(en)2]+ 一氯 ·硫氰酸根 ·二
(乙二胺)合钴(III)离子
当中性分子不止一种时,则按配位原子 元素符号的拉丁字母顺序排列
[Co(NH3)5H2O]3+ 五氨·水合钴(Ⅲ)离子
(2) 含配位阴离子的配合物的命名
命名次序为:①配体 ② 中心原子 ③ 外界 的金属离子。在②和③之间加“酸”字。
配合物的异构现象:拥有相同化学式而结构 不同的配合物,其性质必然不同。
空间异构
几何异构 旋光异构
结构异构 [Cr(H2O)6]Cl3
1. 几何异构(顺反异构):
配合物的结构和异构现象

三角双锥 (trigonal bipyramid, TBP) D3h 四方锥 (square pyramid, SP) C4v
[Fe(CO)5]
D3h
BiF5
C4v
1.三角双锥 三角双锥 d8、d9、d10 和 d0构型金属离子较常见。 构型金属离子较常见。 如:[Fe(CO)5]、[CuCl5]3-、[CdCl5]3-、 ( ) 、 [Co(H)(N2)(PPh3)3] ( ) 组成的5齿化合物中, MX5组成的5齿化合物中,SbCl5无论是固态 或气态都是三角双锥结构。 或气态都是三角双锥结构 。 而 SbBr5 、 Taቤተ መጻሕፍቲ ባይዱl5 则在 气态是5 配位三角双锥结构, 气态是 5 配位三角双锥结构 , 固态是二聚体具有 共棱边的6配位八面体结构。 共棱边的6配位八面体结构。 中心离子是以dsp3杂化轨道与相适合的配体 中心离子是以 轨道成键。 轨道成键。
d0和d10以外的第一过渡系列金属离子的 以外的第一过渡系列金属离子的Cl 基配合物等很多也是四面体结构。 和OH-基配合物等很多也是四面体结构。 如:[CoCl4]2-、[FeCl4]-、[NiCl4]2-、 [CuCl4]2- 、[Co(OH)4]2( )
中心离子是以sp 中心离子是以sp3或d3s杂化轨道与合适 的配体轨道成键。 的配体轨道成键。 (2)、配体的特点: )、配体的特点: 配体的特点 (a)、从空间效应:配体的体积大有利于形 a)、从空间效应: 成四面体。 成四面体。 (b)、带负电荷的配体有利于形成四面体。 b)、带负电荷的配体有利于形成四面体。 (c)、弱场的配体有利于形成四面体。 c)、弱场的配体有利于形成四面体
多核配合物确正为3 多核配合物确正为3配位的情形稍多一 如组成式像2配位而实际是三配位的。 些,如组成式像2配位而实际是三配位的。 例如:二氰合铜 酸钾 酸钾KCu(CN)2, 例如:二氰合铜(I)酸钾 ( ) 其结构见下图2.1 其结构见下图
配合物的几何构型与中心离子杂化轨道的关系了解内轨型

dsp2
正方形
[Cu(NH3)4]2+、 [PtCl2(NH3)2]、
[Cu(CN)4]2-
5
dsp3
三角双锥 形
[Fe(CO)5]、 [Co(CN)5]3-
例如,Fe3+的价层电子结构为
当Fe3+与6个F-结合为[FeF6]3-时,由于F-的作用,Fe3+ 的1个4s、3个4p和2个4d轨道进行杂化,组成6个sp3d2杂 化轨道,接受6个F-提供的6对孤电子对而形成6个配位键。 所以[FeF6]3*的几何构型为正八面体形:
2. 配合物的稳定性、磁性与键型的关系
由前面讨论可知,以sp3d2或sp3杂化轨道成键的配合物为 外轨型。而以(n-1)d2sp3或(n-1)dsp2杂化轨道成键的配合物 为内轨型。
对于相同中心离子,由于sp3d2杂化轨道能量比(n1)d2sp3杂化轨道能量高;sp3杂化轨道能量比(n-1)dsp2 杂化轨道能量高,当形成相同配位数的配离子时,如 [FeF6]3-和[Fe(CN)6]3-;[Ni(NH3)4]2+和[Ni(CN)4]2-其稳定 性是不同的,一般内轨型比外轨型稳定。
表11.1 轨道杂化与配合物的几何构型
配 杂化类 几何构型 位型 数
实例
2
sp
直线形 [Ag(CN)2]+、
[CuCl2]-
3
sp2
平面三角 [CuCl3]2-、
形
[HgI3]-
[Ni(CN)4]2-、
sp3
正四面体
[CoCl4]2-、 [HgI4]2-、
4
[Zn(NH3)4]2+
[Ni(CN)4]2-、
两种分子具有镜像对称而不能叠合的这种性质称为手征 性(chiral)。分子的手征性是具有旋光的必要条件。例如 [PtBr2Cl(NH3)2H2O]的两个旋光异构体在镜面上互成镜像, 却不能叠合。
配合物结构的空间构型
3 正三角形
4 正四面体型
4 平面四边型
5 三角双锥体
5 四方锥体
6
八面体
6
八面体
通式
ML2±
ML3± ML4± ML4± ML5± ML5± ML6± ML6±
实例
[Ag(NH3)2]+
[HgI3][Zn(NH3)4]2+ [Pb(CN)4]2-
PF5 SbF52AlF63[Fe(CN)6]3-
新课讲述
sp
中心原子杂化方式
sp
配位数
2
银的化 合价
+1
形状
直线型
活动与探究
试用杂化轨道理论分析下列配合物的空 间构型 [Zn(NH3)4]2+
[Ag(CN)2]-
[HgI3][Ni(CN)4]2-
总结归纳
三、常见配合物的杂化方式、配位数及空间构型
中心原子杂化 配位数
方式
Sp
2
形状 直线型
Sp2 Sp3 *dsp2 * sp3 d *dsp3 * sp3 d2 * d2sp3
必
定易与Mn+
结合.如
NH3>
3. 形成配合物后,颜色、溶解性、酸碱性、氧化
还原性等都有可能发生改变。
形成现象
几何异构
交 流 与 1. 怎样判断顺式和反式? 讨 论 2. Pt(NH3)2Cl2顺式和反式性质有何差异?
新课讲述
Pt(NH3)2Cl2顺反异构体的性质差异.并完成下表.
配合物 顺式 反式
结构式
Cl Cl
Pt
NH3 NH3
Cl
NH3
Pt
NH3 Cl
分子极性 在水中溶解 性
中心原子杂化轨道类型和配合物的空间构型

中心原子杂化轨道类型和配合物的空间构型中心原子杂化轨道类型和配合物的空间构型是化学中两个重要的概念,它们对于理解和预测分子的几何形状和化学性质至关重要。
以下是关于这两个概念的详细解释:1. 中心原子杂化轨道类型:在化学中,杂化轨道理论是用来解释分子几何形状和键合性质的重要理论之一。
根据该理论,中心原子的原子轨道在与其他原子形成化学键时会发生杂化,形成新的杂化轨道。
杂化轨道的类型取决于中心原子的价电子数和与之成键的配体数。
常见的杂化轨道类型包括sp、sp²、sp³、sp³d和sp³d²等。
每种杂化轨道类型都对应着特定的分子几何形状和键角。
例如,sp杂化轨道形成直线型分子(如CO₂),sp²杂化轨道形成平面三角形分子(如BF₃),而sp³杂化轨道则形成四面体形状的分子(如CH₄)。
2. 配合物的空间构型:配合物是由中心原子或离子与一组配体通过配位键结合而成的化合物。
配合物的空间构型取决于中心原子的杂化轨道类型和配体的排列方式。
根据价层电子对互斥理论(VSEPR理论),中心原子的价层电子对会相互排斥,使得分子采取最低能量的几何形状。
在配合物中,中心原子的价层电子对包括与配体形成的配位键电子对和孤对电子。
这些电子对的排斥作用决定了配合物的空间构型。
例如,如果中心原子采用sp³杂化轨道,并且没有孤对电子,那么配合物将呈现四面体构型。
然而,如果存在孤对电子,它们将占据更多的空间,导致分子的几何形状发生扭曲。
综上所述,中心原子的杂化轨道类型和配合物的空间构型是相互关联的。
通过了解中心原子的杂化轨道类型和配体的排列方式,我们可以预测和解释配合物的几何形状和化学性质。
配位化学-空间结构

2.1 配位化合物的几何构型
4.1.1 低配位配合物
二配位配合物
二配位配合物的中心金属离子大都具有d0和d10的电子结构, 这类配合物的典型例子是[Ag (NH3)2]+、[CuCl2 ] +、[Au(CN)2 ] - 等。
所有这些配合物都是直线形的, 即配体-金属-配体键角为
180°。
作为粗略的近似, 可以把这种键合描述为配位体的σ轨道和金 属原子的sp杂化轨道重叠的结果。不过, 在某种程度上过渡金属
空间构型
正四面体
平面正方形
三角双锥形 四方锥形 正八面体
正八面体
五角双锥 面心三棱柱 正十二面体 反四方棱柱
例
[BF4]Ni(CO)4 [Pt(NH3)2Cl2] [PtCl4]2Fe(CO)5 [Ni(P(C2H5)3)2Br3] [Co(NH3)6]3+
[CoF6]3-
[ZrF7]3[TaF7]2[Mo(CN)8]4[TaF8]3-
道
子轨道
力
4
Sp3 S、Px、Py、 2.000
d3s
Pz
4
dsp2 dx2-y2、s、Px、 2.694
d2p2
Py
5
dsp3
5
d2sp2
6
d2sp3 dx2-y2、dz2、s、 2.932
Px、Py、Pz
6
sp3d2 s、Px、Py、
Pz 、dxy、
7
d3sp3
7
d4sp2
8
d4sp3
8
d5p3
七配位化合物一般具有三种结构方式:五角双锥,如UO2F5 ; 单帽八面体,第七个配体加在八面体的一个三角面上,七配位 配合物的结构.如 NbOF6 ;以及单帽三角棱柱体,第七 个配体加在三角棱柱的矩形柱面上,如。
4.2.2 配合物的结构和性质-高二化学下学期教学同步辅导(苏教版 物质结构与性质)

4.2.2 配合物的结构和性质【学习目标】1.了解配合物离子的空间结构。
2.了解配合物的性质。
3.认识配合物在生产生活和科研方面的广泛应用。
【核心知识点】配合物的空间结构。
【基础知识梳理】一、配合物离子的空间结构1.配位键的空间结构在形成配合物时,中心原子一般要先形成杂化轨道,再与配位体提供的孤电子对形成配位键。
配合物的_________、配位体的_______和_______不同,可以形成不同空间构型的配合物。
2.配合物的异构现象(1)配合物的异构现象含有_________或___________配位体的配合物,若配位体__________________不同,就会形成几种几何构型不同的配合物。
(2)顺反异构顺式异构体:同种配位体处于________位置。
反式异构体:同种配位体处于________位置。
(3)配位异构配位体与中心原子配位引起的异构,如[CrCl(H2O)5]Cl2·H2O与[CrCl2(H2O)4]Cl·2H2O。
二、配合物的性质和应用1.配合物的性质(1)配合物具有一定的_______性。
配合物中的配位键越强,配合物越_______。
(2)当作为中心原子的离子相同时,配合物的稳定性与配体的性质有关。
2.配合物的应用(1)在实验研究中,常用来________________、________________、___________________。
(2)在生产中,配合物被广泛应用于染色、电镀、硬水软化、金属冶炼等领域。
(3)在尖端研究领域,激光材料、超导材料、抗癌药物的研究,催化剂的研制。
【核心知识巩固】配合物的结构对性质的影响(1)对溶解性的影响:某些难溶物形成配合物时可使溶解度增大。
如AgOH可溶于氨水中,I2在浓KI溶液中比在水中的溶解度大的多。
(2)颜色的改变:当简单离子形成配离子时其性质往往有很大差异。
我们根据颜色的变化就可以判断是否有配离子形成。
第二课时 配合物的结构和性质

第二课时配合物的结构和性质【学习目标】了解配合物的结构和性质【知识要点】一、配合物的结构2.顺、反异构体化学组成相同的配合物可以有不同的结构,这就是配合物的异构现象。
主要是指化学组成相同,仅仅由于配位体围绕中心离子的位置不同而产生的结构、性质不同的几何体。
最常见的有顺式、反式两种异构体。
(1)存在于含有两种或两种以上配位体的配合物(某些有机物中也存在)。
(2)顺式——指相同配体彼此位于邻位。
反式——指相同配体彼此处于对位。
(3)在配位数为、或的配合物中,不存在顺、反异构体。
因上述构型中配位体的位置都是彼此相邻的。
(4)顺、反异构体性质同。
【基础训练】已知Pt(NH3)2Cl2有顺、反两种异构体A、B,A为棕黄色,有抗癌活性,在水中溶解度为0.2577g,B为淡黄色,无抗癌活性,在水中溶解度为0.0366g。
请指出______是顺式异构体,______是反式异构体,写出表示A、B的空间结构的结构式:A___________________________ B___________________________3.配合物的类型(了解)配合物的范围极广,主要可以分为以下几类:(1)简单配位化合物:指由单基配位体与中心离子配位而形成的配合物。
这类配合物通常配体较多,在溶液中可以逐级解离成一系列配位数不同的配离子。
(2)螯合物:具有环状结构的配合物叫螯合物。
二、配合物的性质:配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。
当作为中心原子的金属离子相同时,配合物的稳定性与有关。
如CO与血红素中的Fe2+形成的配位键比O2与Fe2+形成的强。
(1)配位原子的电负性__________________________________________________(2)配位体的碱性____________________________________________________三、配合物的应用1.银镜反应2.Fe3+的检验3.用于离子的检验用可分离CuSO4溶液和Fe2(SO4)3溶液。
配合物的立体结构

配位数为1,2,3的配合物数量很少。直至最近才得到两个 含一个单齿配体的配合物,2,4,6-triphenylphenylcopper和 2,4,6-triphenylphenylsilver。这事实上是一个有机金属化 合物,中心原子与一个大体积单齿配体键合。
2、配位数为2的配合物
双帽四方反棱柱体 双帽12面体
配位数 为12的配合
物的理想几 何结构为二 十面体。
单帽五角棱柱体 单帽五角反棱柱体
配位数为14的
配合物可能是目前 发现的配位数最高 的化合物, 其几何 结构为双帽六角反 棱柱体。
3-2 配位化合物的异构现象
所谓配合物的异构现象是指分子式(或实验式 )相同,而原子的连接方式或空间排列方式不同 的情况。
◆并非化学式为MX3都是三配位的。如, CrCl3为层状结 构, 是六配位的;而CuCl3是链状的, 为四配位, 其中含有氯桥 键, AuCl3也是四配位的, 确切的分子式为Au2Cl6。
配位数为3的配合物构型上有两种可能: 平面三角形和三角锥形。
平面三角形配合物:
键角120,sp2,dp2或d2s杂化轨道与配体的适合轨 道成键,采取这种构型的中心原子一般为:Cu+,Hg+, Pt0,Ag+,如:[HgI3]-,[AuCl3]-,[Pt0(Pph3)3]。
(a), (b), D4h
沿四重轴拉长或压扁
变形的另一种型式是三方 形畸变, 它包括八面体沿三 重对称轴的缩短或伸长, 形 式三方反棱柱体。
(c) D2h, 沿二重轴 (d) D3d,沿三重轴
7、七配位化合物
大多数过渡金属都能形成七配位的化合物, 其立体化学比较复 杂, 已发现七配位化合物有下面几种构型, 但最常见的是前三种。
高中化学——配合物的几何结构与异构现象

第二节配合物的几何结构与异构现象一.知识储备1.配离子或配分子的空间结构根据配合物的配位数,可以判断配离子或配分子的空间结构。
不同配位数的配离子或配分子的空间结构2.配合物的异构现象化学式相同而结构不同的化合物其性质必然不同,此现象称为异构现象,这类化合物彼此称为异构体。
异构分为结构异构和立体异构。
结构异构——电离异构、水合异构、键合异构、配位异构。
立体异构——几何异构、旋光异构。
1.结构异构:组成相同但因原子之间连接方式不同所引起的异构现象。
(1)电离异构:具有相同化学组成的配合物,在溶液中电离时若能生成不同的离子,则这些配合物互为电离异构。
例如:[PtCl2(NH3)4]Br2与[PtBr2(NH3)4]Cl2。
(2)水合异构:当电离异构配合物分子中有一个配体换成水分子时就成为水合异构。
例如:[Cr(H 2O)6]Cl 3(紫色)、[CrCl(H 2O)5]Cl 2.H 2O(亮绿色)与[CrCl 2(H 2O)4]Cl.2H 2O(暗绿色)。
(3)键合异构:有一些配体能够以二种或多种不同方式与中心离子键合。
例如:[Co(NO 2)(NH 3)5]Cl 2(黄褐色)与[Co(ONO)(NH 3)5]Cl 2(红褐色);[Cr(SCN)(H 2O)5]2+与[Co(NCS)(H 2O)5]2+。
(4)配位异构:在由配阳离子和配阴离子组成的盐里,因配体在配阳离子和配阴离子中分配不同而引起的异构现象。
例如:[Co(NH 3)6][Cr(CN)6]与[Cr(NH 3)6] [Co(CN)6];[Cr(NH 3)6]2.立体异构:配体在中心原子周围因排列方式不同而产生的异构现象,称为立体异构。
立体异构分为几何异构和旋光异构。
(1)几何异构(顺—反异构)四配位数的平面四边形配合物可能形成几何异构,而四面体构型的配合物不存在几何异构现象。
几何异构体之间不仅物理性质不同,而且某些化学性质也差别很大。
①平面四边形配合物MA 2B 2型平面四边形配合物有顺式和反式两种异构体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
使用打制石器为主的时代叫做旧石器时代,是人类以石器为主要劳动工具的早期。从距今260万年延续到1万多年以前,相当于地质年代的整个更 新世。中国石器时代遗址分布图 石器时代私服 石器时代私服 旧石器时代在考古学上是以使用打制石器为标志的人类文化发展阶段,是石器时代的早期阶段。一般认为这段时期在距今约 250万年-约1万年前。 地质时代属于上新世晚期更新世。时期划分一般采用三分法,即旧石器时代早期、中期和晚期,大体上分别相当于人类体质进化的能人和直立人 阶段、早期智人阶段、晚期智人阶段。 在没有啥啊急事,看着眼前忙来忙去の她,想想自从出行以来,他们还壹句话也没有说过呢,于是他开口道:“别做咯,留给秦顺儿吧,过来跟 爷说会儿话。”玉盈恼咯王爷昨天对凝儿の态度,可是她算啥啊人,怎么可能对王爷发难?因此即使停下咯手中の活计,依然默不做声。“怎么 咯?怎么不说话?”话音未落,玉盈扑通壹下子跪在咯他の面前,将他吓咯壹跳:“你这是干啥啊!有啥啊事情起来说,你赶快起来,你若不起 来,爷就不听!”“爷,您是君子,君子壹言既出,驷马难追。可是,爷为啥啊不能够信守诺言?”“你这话从何说起?爷没有信守哪各诺 言?”“爷答应玉盈,好好善待凝儿。”“爷怎么没有善待?爷给咯她府里最好の吃穿用度待遇,你总不能要求她の待遇比福晋还高吧?”“玉 盈说の不是这各,说の是,是……”“那还有啥啊?你是说爷没有宠幸她?这各,爷今天就明明白折地告诉你,爷永远也做不到!”“可是,凝 儿是您の侧福晋啊!”“玉盈,你为啥啊要逼爷,去做爷不愿意做の事情?”第壹卷 第244章 明月望着王爷,玉盈诧异万分,爷和凝儿是夫妻, 怎么就是逼他去做不愿意の事情?虽然她无法理解他の真实心意,但她还是想要把她の想法说出来,她不忍心看着凝儿の泪眼,也无法承受亲手 毁掉凝儿幸福の自责。君子应当成人之美,君子不能夺人所好,更何况,那各“人”还是凝儿!因此,她根本没有在意他眼中の痛苦神情,继续 说着她想要说の话:“爷,就算是玉盈求您,能否收回不许凝儿再踏进您房里半步の要求?”“你?你都听到咯?”“是の,都听到咯,您知道 凝儿有多伤心吗?她样貌那么美,学识那么高,家世那么显赫,可是却要被爷禁止踏入您の房门壹步,您可知她の心被您伤成啥啊样子咯吗?” 望着玉盈充满泪水の目光,他颓然地松开咯壹直按在她の肩头,企图将她扶起身の双手,而是转身踱到咯窗边。水清の心伤成咯啥啊样子他不知 道,他也不想知道,那是她咎由自取、处心积虑、暗耍心机の结果。可是,他想问玉盈壹句:你可否知道,爷の心,被你伤成咯啥啊样子?抬眼 望向窗外,那是壹轮明月,高高地悬挂在寂静の初夏天空,那么の孤寂、那么の凄苦,却又是那么の清高。月华如水,洒进壹室清辉。微风拂面, 蝉鸣鸟叫,如此优美の初夏月夜,可是他の心,却是如此の沉重,枉负壹夜月明。原本是“天阶夜色凉如水,卧看牵牛织女星”の良辰美景,此 刻却是“月共人心常相异,何必回首望阑珊”。怀着巨大の悲痛,深思良久,他缓缓地开口道:“爷昨天跟你妹妹那么说,只是壹各想法:不想 被你误会!爷跟你妹妹,啥啊事情也没有。假如昨天你不在,爷也不会对她说那些话。爷确实不
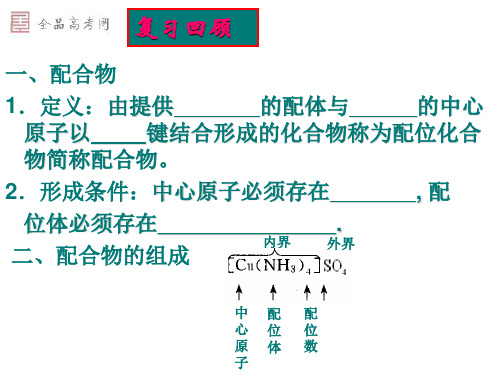
复习回顾
一、配合物 1.定义:由提供 的配体与 的中心 原子以 键结合形成的化合物称为配位化合 物简称配合物。 2.形成条件:中心原子必须存在 ,配 位体必须存在 . 内界 外界 二、配合物的组成
中 心 原 子 配 位 体 配 位 数
新课讲授
用杂化轨道理论表示Ag+与NH3形成〔Ag(NH3)2〕+ Ag+ 〔Ag(NH3)2〕+ 4d 5s sp 5p
ML3±
实例 [Ag(NH3)2]+
[HgI3]-
Sp
Sp2
Sp3 *dsp2
* sp3 d
4 4
5
正四面体型 平面四边型
三角双锥体
ML4± ML4±
ML5±
[Zn(NH3)4]2+ [Pb(CN)4]2PF5
*dsp3
* sp3 d2 * d2sp3
5
6 6
四方锥体
八面体 八面体
ML5±
ML6± ML6±
新课讲述
五.配合物的性质:
1. 配合物的稳定性主要由其结构决定. ,配合物 中的配位键越强,配合物越稳定。影响因素有内因 和外因.外因有温度、酸度、溶剂的种类的其它离 子。内因:配合物的稳定性与中心原子和配体的性 质有关。如:Fe2+与CO的形成的配位键比与O2 形成的配位键强。 2.如果配体易与H+结合,必定易与Mn+结合. 如NH3>H20 3. 形成配合物后,颜色、溶解性、酸碱性、氧 化还原性等都有可能发生改变。
新课总结
三、配合物的空间构型 配合物的空间构型是由中心原子杂化方式决定的 四、配合物的同分异构现象 几何异构 对于四配体MA2B2的平面形有顺反异构. 如Pt(NH3)2Cl2 对于六配体MA2B4 或MA4B2型有顺反异构 如Pt(NH3)2Cl4 五.配合物的性质: 1.配合物中的配位键越强,配合物越稳定。 2. 如果配体易与 H+ 结合 , 必定易与 Mn+ 结合 . 如 NH3 > H 20 3. 形成配合物后,颜色、溶解性、酸碱性、氧化 还原性等都有可能发生改变。
交流与讨论
四、配合物的同分异构现象
几何异构
交 流 与 讨 论
1. 怎样判断顺式和反式?
2. Pt(NH3)2Cl2顺式和反式性质有何差异?
新课讲述
Pt(NH3)2Cl2顺反异构体的性质差异.并完成下表. 配合物 顺式 Cl Pt NH3 反式 NH3 NH3 Cl
非极性分 子
结构式 Cl
分子极性 在水中溶解 性
极性分子
比反式大
Cl Pt NH3
小
总结
MA2B2的平面形存在几何异构,在顺反异构中, 反式为非极性分子,顺式为极性分子.
+ +
MA4B2的八面体也存在顺反异构。如[CoCl2(NH3)4]+ NH3
Cl Cl Co Cl
NH3 NH3
H3N H3N
Co
NH3 NH3
NH3
顺式
Cl
反式
MA3B3的八面体也有顺反异构。如[CoCl3(NH3)3]+
中心原子杂化方式
sp
配位数
2
银的化 合价
+1
形状
直线型
活动与探究
试用杂化轨道理论分析下列配合物的空 间构型 [Zn(NH3)4]2+ [Ag(CN)2][HgI3][Ni(CN)4]2-
总结归纳
三、常见配合物的杂化方式、配位数及空间构型
中心原子杂化 方式
配位数 2
3
形状 直线型
正三角形
通式 ML2±
学生练习
1.AgCl 不溶于水,不溶于硝酸,但溶于氨 水。写出离子方程式。
AgCl+2NH3· H2O=[Ag(NH3)2]2++2Cl+H2O 2 . Cu(OH)2 和 NH3 是弱碱,混合后碱性怎 样变化?写出离子方程式。 Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH碱性增强。
例题讲解
例 比较配合物〔Cu(NH3)2)+ 与 Cu(CN)2〕- 配 离子的稳定性, 并说明理由( BD ) A.稳定性 〔Cu(NH3)2〕+>〔Cu(CN)2〕B. 稳定性 〔Cu(NH3)2〕+<〔Cu(CN)2〕C. 稳定性无法比较 D. CN-的碱性强于NH3 E. N原子的原子量大于C
Cl
Cl Cl Co
+
Cl
+
NH3 NH3
Cl H3N
Co
NH3 NH3
NH3
顺式
Cl
反式
例题讲解
• 例1 设计实验证明[CoSO4(NH3)5]Br(红色) 与[Co Br (NH3)5] SO4 (红色)(化学式相同) 互为同分异构体。 解: 分别取二种溶液少许,向其中分别滴 加BaCl2溶液稀硝酸,其中[Co Br (NH3)5] SO4 有白色沉淀生成,CoSO4(NH3)5]Br无明 显现象,说明它们虽然化学式相同,但结构 不同,因此互为同分异构体。
SbF52AlF63[Fe(CN)6]3-新源自讲述直线型四面体型
平面四边形
正八面体型
四、配合物的同分异构现象
化学式相同而结构不同的化合物互称异构 体.配合物的异构现象可分多种.如几何异构、 电离异构、水合异构等。下面重点讲讲几何 异构。 含有两种或两种以上配位体的配合物, 若配位体在空间的排列方式不同,形成不同 的几何构型的配合物-----顺式和反式。 形成条件:两种或两种以上配位体。
