《利用化学方程式的简单计算》例题精讲1
新人教版九年级化学上册例题精讲:第5单元 课题3利用化学方程式的简单计算

课题3 利用化学方程式的简单计算答案:(1)各物质间的质量比成正比例(2)设未知量(3)化学计量数与相对分子质量的乘积(4)列出比例式1.利用化学方程式计算的步骤(1)根据化学方程式计算的依据①理论依据:质量守恒定律。
②基本依据:化学方程式中各反应物、生成物之间的质量比。
(2)利用化学方程式计算的步骤①设未知量。
一般情况下,求什么就设什么。
②写出反应的化学方程式。
③标出已知量和未知量的关系,包括相对质量、已知量、未知量。
根据化学方程式把与解题有关的物质的相对分子质量总和计算出来,标在相应化学式的下面,把题中的已知条件和待求未知量写在相应物质的相对分子质量总和的下面。
④列比例式求解。
⑤简明写出答案。
⑥回顾检查。
辨误区利用化学方程式计算的注意事项①设未知量时不带单位;②只找已知和未知的关系,列式时,单位要统一,单位要带入计算过程;③化学方程式一定要书写正确,各物质间的质量比一定要计算准确。
当已知量是体积或混合物的质量时,该如何处理?应先将体积换算成质量,不纯物质,量换算成纯净物质量,因为代入化学方程式进行计算的相关量通常是质量,而且是纯净物的质量,不包括未参加反应的质量。
【例1】计算18 g水分解生成氢气的质量是多少?解:(1)设未知量:设生成氢气的质量为…………………设(2)写出化学方程式:2H 2O=====通电2H 2↑+O 2↑…………………写(3)找出已知量和未知量的关系:2H 2O=====通电2H 2↑+O 2↑2×18 2×218 g ……………………标(4)列比例式求解:2×182×2=18 kg x…………………列 =18 kg ×2×22×18=2 g ……………算 (5)简写出答案:答:18 g 水分解生成氢气的质量是2 g …答(6)回顾检查:①方程式是否正确;②已知量和未知量间的关系是否正确;③单位是否正确;④数值大小是否合理;⑤有效数字是否正确。
利用化学方程式的简单计算典型例题

利用化学方程式的简单计算典型例题例1:(南通市中考)密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:下列说法正确的是( )A.物质C一定是化合物,物质D可能是单质B.反应后密闭容器中A的质量为19.7gC.反应过程中,物质B与物质D变化的质量比为87∶36D.若物质A与物质C的相对分子质量之比为197∶158,则反应中A与C的化学计量数之比为l∶2解读由题中所给的数据可知:C反应后质量没有了,说明是反应物,而B、D反应后质量都增加了,说明是生成物,C反应掉 31.6g,B、D共生成的质量只有11.9g,说明A也生成物,且生成的质量为19.7g,则该反应为分解反应,C一定是化合物,A、B、D可能是化合物,也可能是单质;然后由质量比、相对分子质量比求化学计量数比。
答案:AD例2:(北京市中考)甲醇(CH3OH)是一种有毒、有酒的气味的可燃性液体。
甲醇在氧气中不完全燃烧可发生如下反应:8CH3OH + nO2mCO2 + 2CO + 16H2O。
若反应生成3.6g水,请计算:(1)m值是(2)参加反应的氧气质量是多少克?(写出规范计算步骤)解读此题要求运用质量守恒定律,去确定化学计量数。
质量守恒定律不仅体现在宏观上总质量相等、元素的质量相等,还体现在微观上原子个数相等。
根据碳原子数反应前后相等,8=m+2 ,m=6 ;反应前后氧原子个数为8+2n=6×2+2+16 ,n=11 ,然后根据化学方程式,由生成3.6g水,求参加反应的氧气的质量。
答案:(1)6(2) 8+2n=6×2+2+16 n=11设参加反应的氧气质量为X 8CH 3OH + 11O 26CO 2 + 2CO + 16H 2O11×32 16×18 x 3.6ggx6.318163211=⨯⨯ x=4.4g答:参加反应的氧气为4.4g 。
例3:(江西省中考)化学兴趣小组为了测定某钢铁厂生铁样品中铁的质量分数,在实验室将5.8g 生铁样品放入烧杯中,加入50g 稀硫酸恰好完全反应(杂质不参加反应),反应后称得烧杯中剩余物质的总质量为55.6g 。
利用化学方程式的简单计算

根据化学方程式计算的注意事项:
1. 设未知量时一定要注意质量单位,已知量和未知量单 位不一致的,先换算成一致的再进行计算. 2. 化学方程式一定要注意配平,标明反应条件.气体.沉淀 符号,注意化学方程式的完整性. 3. 相关物质的相对分子质量写在相应的化学式下,一定 要注意用相对分子质量乘以化学式前的系数,已知量和 未知量写在相应相对分子质量的下边. 4. 计算结果的小数位保留按题中要求进行,若题中没有 要求,又得不到整数时,一般保留一位小数.
④相对分子质量计算错误,导致质量比错误。
⑤同一种物质不用相同的单位或单位不统一。
⑥张冠李戴,物质的量代错。 ⑦把不纯物当做纯净物。 ⑧把物质的体积直接代入化学方程式。
【三个要领】
(1)步骤要完整(设、写、算、标、列、解、答) (2)格式要规范; (3)得数要准确(保留两位小数); 【三个关键】 (1)准确书写化学方程式; (2)准确计算相对分子质量; (3)代入量均指纯净物的质量(单位要代入计算 过程);
点燃
8CH3OH + nO2
mCO2 + 2CO + 16H2O
1 m值是 8 . 2 参加反应的氧气质量是多少克? (写出计算步骤)
解:参加反应的氧气质量是 x 。
8CH3OH + 13 O2
点燃
8CO2 + 2CO + 16H2O
416 X 416 X 288 3.6g
X=5.2g
288 3.6g
C
31.6g
A + B + D
19.7g 8.7g 3.2g
C反应后质量没有了, 说明是反应物,而B、D反应 后质量都增加了,说明是生成 物,C反应掉 31.6g,B、D共 生成的质量只有 11.9g,说明A 也是生成物,且生成的质量为 19.7g, 则该反应为分解反应,C一定是化合物, A、B、D可能是化合物,也可能是单质。
利用化学方程式的简单计算(第一课时)

=
32 x
158g x
X=16g
简明地写答
答:加热分解158g高锰酸钾,可以得到16g氧气。
【例题解析】
1、在实验室中,将含有34g过氧化氢的溶液与少量 二氧化锰混合,计算:将过氧化氢完全分解后,可 以得到多少克氧气?
(1)设 (2)写 (3)找 (4)列 (5)解 (6)答
1、电解54g水,计算可得到氢气多少克? 同时生成氧气多少克?
2.制取五氧化二磷142克,需燃烧多少克 磷?消耗多少克氧气? 3、实验室要制取96克的氧气,理论上需要 分解多少克的高锰酸钾? 4、在实验室利用245g氯酸钾与少量二氧化 锰混合制取氧气,最多可制得氧气多少克?
【自主探究】
完成下题,小组交流纠错,找出其中注意点。
例2:工业上,高温煅烧CaCO3可制得 CaO和二氧化碳。如果要制取28t氧化钙, 需要碳酸钙多少吨?
第五单元 化学方程式
课题3 利用化学方程式的简单计算(1)
【学习目标】
在正确书写化学方程式 的基础上,进行简单的规范 的计算。
【知识准备】
1、请写出下列反应的化学方程式。
4P+5O2======2P2O5 (1)磷燃烧_______________________。
点燃
(2)加热高锰酸钾制氧气
2KMnO4=====K2MnO4+MnO2+O2↑ ___________________________ 。
根据化学方程式计算的步骤
例:加热分解158g高锰酸钾,可以得到多少克氧气?
设未知量 写出化学方程式并配平 写出有关物质的相对分子 质量和已知量、未知量 列出比例式、求解 解:设加热分解158g高锰酸钾可 以得到氧气的质量为x
2021-2022学年九年级化学上册《利用化学方程式的简单计算》精讲精练(人教版)原卷

5.3 利用化学方程式的简单计算考点精讲【知识点一】利用化学方程式计算的依据1.理论依据理论依据是质量守恒定律。
2.计算依据(1)化学方程式中反应物、生成物各物质的质量比等于各物质相对分子质量和化学计量数的乘积之比。
(2)化学方程式中各物质之间恒定的质量比是计算的依据。
【典型例题】镁在氧气中燃烧生成氧化镁,在这反应中,镁、氧气、氧化镁的质量比()A.24:32:56 B.24:32:40C.2:1:2 D.48:32:80【举一反三】1.利用化学方程式进行计算的依据是()A.化学方程式表示了一种化学反应的过程B.化学方程式表示了反应物、生成物和反应条件C.化学方程式表示了反应前后反应物和生成物的质量关系D.化学方程式中,各反应物质量比等于各生成物质量比2.复印机市场对纳米级四氧化三铁需求量很大,目前最普遍使用共沉淀法生产,其原理可表示为:FeCl2+FeCl3+NaOH→Fe3O4+H2O+NaCl,已知此反应中,各元素化合价均不变,又知Fe3O4中铁元素有+2、+3两种化合价。
则参加反应的FeCl2和FeCl3中铁元素的质量比为()A.1:1B.2:1C.3:4D.1:23.(2019•枣庄模拟)镁在氧气与氮气的混合气体中燃烧不仅生成氧化镁,还有少量的镁与氮气化合生成氮化镁(Mg3N2)。
由此推知8 g镁在氧气与氮气的混和气体中完全燃烧后所得产物的质量可能是()A.13.3 g B.12 g C.11.1 g D.无法确定【技巧方法】①化学方程式不仅表示什么物质参加反应和反应后生成什么物质,而且还从量的角度表示反应物和生成物各物质间的质量关系。
根据化学方程式的计算就是相关知识的延续。
其计算依据就是根据化学方程式所表示的反应物与生成物之间的质量关系。
②在物质化学反应体系中是按固定的质量比例关系进行反应的。
这个质量比例关系即是化学方程式所表示的物质间的质量比(即物质的相对分子质量与化学计量数乘积之比)。
利用化学方程式的简单计算1

36
32
18g
x
—33—62 =1—8xg— 解得 x=16g
强化练习
3、在2A+3B=2C+4D中,3.2g A与9.6g B恰好完全反应生成5.6g C,已知D的相对分子质
量为18,则C的相对分子质量为( B )
A.6 B.28 C.44 D.64
【方法点拨】根据质量守恒定律可求D的质量,进而根据D的相对分子质量,C、D的质量
48 32 80 故镁、氧气、氧化镁的质量比是48:32:80。
强化练习
2、完全电解18g水产生氧气的质量是( C )
A.2 g B.4 g C.16 g D.32 g
【方法点拨】根据分解的水的质量,由反应的化学方程式计算出产生氧气的质量即可。
【解析】解:设产生氧气的质量是x。 2H2O通==电=2H2↑+O2↑
解:反应后剩余3g氢气,说明氧气和氢气反应了9g,
设参加反应的氢气质量是x,则氧气就是(9g-x),
点燃
2H2+O2===2H2O 4 32
x 9g-x —342—=9—gx-—x 解得 x=1g
所以混合气体中氢气的质量是1g+3g=4g
方法二:根据质量守恒定律,生成水的质
量为12g-3g=9g
点燃
设B的相对分子质量为x。
A + 3B = 2C + 2D
28 3x
14g 48g
28 3x
=
14g 48g
解得 x=32
化学方程式质量比的表示方法: (1)实际质量之比(g) (2)相对分子质量×化学计量数之 比
新课讲解
【例题4】氢气和氧气的混合气体12g,点燃充分反应后,还剩余了3g氢气,则混合气体 中含有氢气多少克?
利用化学方程式的简单计算。教案

利用化学方程式的简单计算。
教案教学目标:1.学会正确书写化学方程式并进行简单计算。
2.了解化学计算在实际问题中的重要性,加深对化学定量研究的实际应用的认识。
教学重点:1.根据一种反应物(或生成物)的质量求生成物(或反应物)的质量。
2.规范化化学方程式计算的书写格式。
教学难点:训练和培养学生按照化学特点去思维的科学方法。
课时安排:1-2课时教学过程:一、导入新课化学方程式表示反应物与生成物之间的数量关系。
在研究物质的化学变化时,量的计算是非常重要的,例如:用一定量的原料最多可以生产出多少产品?制备一定量的产品最少需要多少原料?等等。
这些计算都需要根据化学方程式进行。
本节课程将从“量”的角度来研究化学方程式的计算。
二、新课教学在之前的课程中,我们研究了如何进行根据化学式的简单计算。
今天我们将研究如何根据化学方程式进行计算,包括计算步骤和方法。
下面通过实例来说明。
例题1:加热分解6.3g高锰酸钾,可以得到氧气的质量是多少?(计算结果保留一位小数)分析:这道题是已知反应物的质量来求生成物的质量,即已知原料的质量求产品。
解:设加热分解6.3 g高锰酸钾可以得到氧气的质量为x。
化学方程式:2KMnO4 → K2MnO4 + MnO2 + O2↑计算:2 × (39 + 55 + 4 × 16) g/mol。
1 × (2 × 16) g/mol6.3 g KMnO4 → x g O22 × 158.03 g/mol。
32 g/molx = 0.6 g答:加热分解6.3 g高锰酸钾,可以得到0.6 g氧气。
根据此例可总结出利用化学方程式进行计算的步骤和方法如下:1.设未知量。
2.写出反应的化学方程式。
3.写出相关物质的化学计量数与相对分子质量的乘积以及已知量、未知量。
4.列出比例式,求解。
5.简明地写出答案。
讲解并补充:在进行化学方程式计算时,还需要注意以下问题:1.设未知量时一定要注意质量单位,已知量和未知量单位不一致的,一定要进行单位换算。
利用化学方程式的简单计算PPT课件7 人教版优质课件
(相对原子质量 : Li 7
K 39 )
为什么神舟六号飞船选用 氢氧化锂而没选氢氧化钾 来吸收二氧化碳?
你能用今天学的知识解答吗?
计算1克氢氧化锂所能吸收的 二氧 化碳的质量。 (相对原子质量 : Li 7 ) 2LiOH + CO2===Li 2CO3 + H 2O
若用氢氧化钾代替氢氧化锂,计算
利用化学方程式的简单计算
穆棱市第四中学 于胜月
【例题1】加热15.8g高锰酸钾,可以得到多少克氧气?
( 相对原子质量 : Mn 55
K 39
O 16 )
设 : 解 设加热分解15.8g高锰酸钾可以 得到 氧气的质量为x
方
△ 2KMnO4 K2MnO4+MnO2+O2↑
关
2×158 15.8g
32 x
神舟六号 发射升空
两位 宇航
员向 全国
人民 问好
费俊龙 在飞船 内刮脸
神舟六号飞船内,宇航员所呼出的气 体要通过盛有氢氧化锂的过滤网,以 除去所含的二氧化碳,如下式所示:
2LiOH + CO2===Li 2CO3 + H 2O
又知,氢氧化钾也能吸收二氧化碳, 如下式
2KOH + CO2===K2CO3 + H 2O
比
2×158 32
15.8g x
解得 x =பைடு நூலகம்0.6 g
答
答:加热分解6g高锰酸钾可以
得到0.6g氧气。
【例题2】 工业上,高温煅烧石
灰石(CaCO3)可制得生石灰(CaO) 和 二氧化碳。如果要制取5.6 t 氧化钙, 需要碳酸钙多少吨? (相对分子质量: Ca 40)
就以上例题所给信息你还能设计出 什么问题,并做解答。
利用化学方程式的简单计算典型例题及解析

《利用化学方程式的简单计算》知识要点与例题精析【知识要点】一、理论依据及常见题型化学方程式是利用质量守恒定律用化学式来表示化学反应的式子,这样,化学方程式不仅表达了物质在质的方面变化关系,即什么是反应物和什么是生成物,而且还表达物质在量的方面的变化关系,即反应物和生成物之间的质量关系,同时包括反应物和生成物之间的微粒个数关系,这是有关化学方程式计算的理论依据。
利用化学方程式的计算主要包括两种类型:用一定量的反应物最多可得到多少生成物;要制取一定量生成物最少需要多少反应物。
无论哪一种类型的计算都是根据化学方程式以质量守恒定律为依据进行的。
根据化学方程式的计算,就是依据反应物和生成物间的质量比进行的。
已知反应物的质量可以算出生成物的质量,反之,已知生成物的质量也可以算出所需反应物的质量。
化学方程式是化学计算的依据,如果化学方程式写错了或者没有配平,化学计算必然会得出错误结果。
二、根据化学方程式计算的步骤1.设:根据题意设未知数;2.写:书写正确的化学方程式;3.找:写出有关物质的相对分子质量(或相对分子质量总和),找出已知量和未知量之间的质量关系;4.列:列出比例式并求解;5.答:检查结果,简明作答。
三、根据化学方程式计算应该注意的事项1.解题格式要规范,运算要准确(1)设未知量(如:设***的质量为x)(2)根据题意写出并配平化学方程式(3)求出相关的物质的质量比;将已知量、未知量对准相关物质的化学式。
列式时,各物质的质量单位必须统一,对应关系要正确;(4)列出比例式,求解(5)简明地写出答案严格要求化学方程式计算的书写格式,目的是培养按照化学特点进行思维的良好习惯。
2.正确处理含杂质的反应物或生成物的计算由于化学方程式反映的是纯净物间的质量比,所以一定要将含杂质的反应物或生成物的质量换算成纯净物的质量再代入化学方程式进行计算,若反应物或生成物为溶液,则应计算出溶质的质量再代入化学方程式进行计算。
利用化学方程式的简单计算练习 (1)

x
316
1.6克
x
=
32 1.6克 ∴ 答案为A
x = 15.8克
4.下列关于氢气在氧气中燃烧的叙述中正确的是 A.16g 氢气和2g 氧气反应能生成18g 水 B.9g 氢气和9g 氧气反应能生成18g 水 C.1g 氢气和8g 氧气反应能生成9g 水 D.8g 氢气和1g 氧气反应能生成9g 水 思路: 2H2 + O2 ==== 2H2O 4 32 36
例:6克镁粉与8克氧气充分反应后能生成氧化镁多少克? 解:设反应后生成氧化镁的质量为X
点燃
解题指导
2Mg + O2 ==== 2MgO 80 32 48 6克 8克 X
∵48 × 8克 > 32×6克 ∴反应后氧气有剩余 48 80 ∴ = 6克 X X=10克 答:6克镁粉与8克氧气充分反应能生成氧化镁10克。
(5) 简明地写出答案
….………… 答
3.根据化学方程式计算的注意事项: (1)所有代入化学方程计算的量必须是纯净物的质量,如果 是不纯物,则需要转换。 纯物质的质量=不纯物质质量×纯度=不纯物质质量×(1-杂 质的质量分数) (2)气体、液体的体积,要换算成气体、液体的质量。 气体质量(g)=气体体积(L)×密度(g/L) 液体质量(g)=液体体积(mL)×密度(g/mL) (3)若题目中只给出一种物质的质量,则另一种物质的用量 往往用“足量”、“适量”、“过量”或“完全反应”、“恰 好完全反应”等来描述。如果同时知道两种反应物的质量,需 要考虑过量问题。 (4)注意已知质量的单位;设未知数的时候要设×××的质 量为X,而不能设××× X克;整个化学计算过程要带单位, 最后求出的X的值后写上单位。(无说明则保留到小数点后一位)
7、有X、Y两种元素,12gX2与XY3反应生成24gC,若反应 的化学方程式为X2 + XY3 === 3C,则X、Y两元素的相对 原子质量之比为 ( )
利用化学方程式的简单计算习题精选
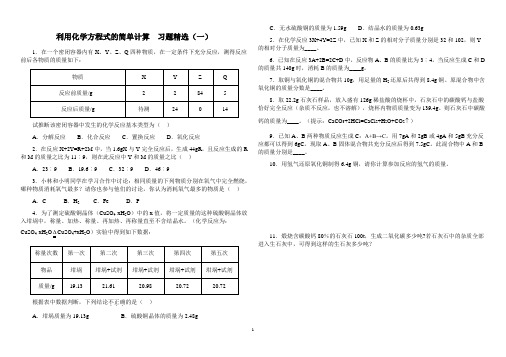
利用化学方程式的简单计算习题精选(一)1.在一个密闭容器内有X、Y、Z、Q四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:试推断该密闭容器中发生的化学反应基本类型为()A.分解反应B.化合反应C.置换反应D.氧化反应2.在反应X+2Y=R+2M中,当1.6gX与Y完全反应后,生成44gR,且反应生成的R 和M的质量之比为11︰9,则在此反应中Y和M的质量之比()A.23︰9 B.19.6︰9 C.32︰9 D.46︰93.小林和小明同学在学习合作中讨论:相同质量的下列物质分别在氧气中完全燃烧,哪种物质消耗氧气最多?请你也参与他们的讨论,你认为消耗氧气最多的物质是()A.C B.H2 C.Fe D.P4.为了测定硫酸铜晶体(CuSO4·xH2O)中的x值,将一定质量的这种硫酸铜晶体放入坩埚中,称量、加热、称量、再加热、再称量直至不含结晶水。
(化学反应为:CuSO4·xH2O∆CuSO4+xH2O)实验中得到如下数据:根据表中数据判断,下列结论不正确...的是()A.坩埚质量为19.13g B.硫酸铜晶体的质量为2.48gC.无水硫酸铜的质量为1.59g D.结晶水的质量为0.63g5.在化学反应3X+4Y=2Z中,已知X和Z的相对分子质量分别是32和102,则Y 的相对分子质量为____。
6.已知在反应3A+2B=2C+D中,反应物A、B的质量比为3︰4。
当反应生成C和D 的质量共140g时,消耗B的质量为____g。
7.取铜与氧化铜的混合物共10g,用足量的H2还原后共得到8.4g铜。
原混合物中含氧化铜的质量分数是____。
8.取22.2g石灰石样品,放入盛有126g稀盐酸的烧杯中,石灰石中的碳酸钙与盐酸恰好完全反应(杂质不反应,也不溶解),烧杯内物质质量变为139.4g。
则石灰石中碳酸钙的质量为____。
(提示:CaCO3+2HCl=CaCl2+H2O+CO2↑)9.已知A、B两种物质反应生成C:A+B→C。
修正版_利用化学方程式的简单计算1
涉及 物质的体积
通过这节课你学到什么
根据化学方程式计算的正确解题步骤: 一设、二写、三找、四列、五解、六答 根据化学方程式计算的注意事项: (1)代入化学方程式计算的量必须是纯净物的质 量,若是不纯物,则需转换. 纯净物的质量=不纯物质质量×纯度 =不纯物质质量×(1-杂质的质量分数) 纯度:为该物质在混合物中的质量分数. (2)如果为气体体积,则按下式将其换算成气体质 量. 气体质量(g)=气体体积(L)×密度(g/L)
思路1:可根据化学式的计算求解。 理由:水中的氢元素全部转化为氢气。
思路2:可根据化学方程式计算求解。 解:水中氢元素的质量分数 H的相对原子质量×H的原子数 = ×100%
H2O的相对分子质量
1×2 ×100% =11.11% 1×2+16 18g的水中所含氢元素的质量为:18g ×11.11%=2g 所以产生的氢气的质量为2g。
答:可生成五氧化二磷71克.
如果你是火箭推进器的设计师,已知 某节火箭升空至少要携带100kg的液氢,你 会在助燃仓中填充多少千克的液氧来满足 这些液氢的完全燃烧?
拓展提高
实验室用锌与稀硫酸反应制取H2 。若10克含杂质35%的粗 锌与足量的稀硫酸充分反应求(1)生成氢气的质量为多少克 (2)这些氢气在标准状况下的体积是多少升? (已知:标准状况下,氢气密度为0.0899g/L,杂质和稀硫酸不 反应 , Zn+H2SO4===ZnSO4+H2↑ ) 【解析】代入化学方程式中物质的质量应为纯净物的质量,含有 杂质的物质,应折算为纯净物的质量。 纯净物的质量=混合物的总质量×纯净物所占的质量分数 涉及 根据题意:纯锌的质量为 10克×(1-35%)=6.5克 含杂质计算
专题+利用化学方程式的简单计算--讲义

利用化学方程式的简单计算新知新讲请同学们迅速判断下列方程式的正误?并简要说出理由。
讨论:化学方程式表示哪些意义呢?①氢气和氧气在点燃的条件下反应生成水;②每2个氢分子和1个氧分子反应生成2个水分子;③每4份质量的氢气和32份质量的氧气反应后,可生成36份质量的水。
一、化学方程式的简单计算题一:加热分解6.3 g 高锰酸钾,可以得到氧气的质量是多少?(计算结果保留一位小数)二、计算的步骤题二:在二氧化锰的催化作用下,加热分解4.9 g 氯酸钾,可以得到氧气的质量是多少?课堂讨论题三:下面是一位同学解答一道化学方程式计算题的过程,请帮他们指出错误。
题:3克镁在氧气中充分燃烧,可以生成多少克氧化镁?解:设可生成氧化镁的质量为x g。
Mg+O 2MgO24 403g x g24 3g=40 x gx=5答:3克镁在氧气中充分燃烧可以生成5g氧化镁。
归纳(1)化学方程式计算中易错的地方①元素符号或化学式写错;②化学方程式没有配平;③有关物质的相对分子质量计算错误;④没有统一单位(克、千克、吨等)。
(2)根据化学方程式计算的三个关键:①准确书写化学式②化学方程式要配平③准确计算相对分子质量三、已知产物计算反应物题四:(1)工业上,高温煅烧石灰石(CaCO3)可制得生石灰(CaO)和二氧化碳。
如果需要制得5.6 t的氧化钙,需要碳酸钙多少吨?(2)实验室可以用高锰酸钾制取氧气,现实验制取4.8克氧气,问需要高锰酸钾多少克?同时产生了多少克锰酸钾?(3)氢气在氯气中燃烧生成氯化氢气体,请计算燃烧100g氢气需要氯气的质量是多少?(相对原子质量:H-1 Cl-35.5)本节小结学完本节你懂得了什么?(1)化学方程式的简单计算方法;(2)计算的基本格式;(3)质量关系的计算能力提高。
利用化学方程式的简单计算讲义参考答案新知新讲题一: 设可以得到氧气的质量是x 。
2KMnO 4K 2MnO 4+MnO 2+O 2↑316 326.3g x316 326.3g x求解:x =0.6g答:可以得到氧气的质量是0.6g 。
(完整)利用化学方程式的简单计算练习题及答案

第五单元课题3 利用化学方程式的简单计算测试题1。
在反应X+2Y====R+2M中,当1。
6 g X与Y完全反应后,生成4.4 g R,且反应生成的R和M的质量之比为11∶9,则在此反应中Y和M的质量之比为()A.23∶9 B.16∶9 C.32∶9 D.46∶92。
氯酸钾和二氧化锰的混合物共A克,加热完全反应后得到B克氧气和C克氯化钾,则混合物中二氧化锰的质量为()A.(A+B—C)克 B.(A-B—C)克 C.(A+B+C)克 D.(A+C)克3。
已知A物质与B物质反应生成C物质,现有12克A与32克B恰好完全反应,则生成C物质的质量是()A.44克 B.32克 C.22克 D.12克4。
已知A物质发生分解反应生成B物质和C物质,当一定量的A反应片刻后,生成56克B和44克C;则实际发生分解的A物质的质量为( )A.12克 B.44克 C.56克D.100克5。
只含铜和氧两种元素的固体样品9。
0 g,测得铜的质量为8。
0 g。
已知铜的氧化物有CuO和Cu2O,下列说法正确的是()A.固体样品的组成只有两种情况B.固体样品一定是CuO与Cu2O的混合物C.固体样品可能是Cu2OD.若固体样品由两种物质组成,则其中一种质量分数为4/96.在2A+B====2C的反应中,1.2 g A完全反应生成2 g C,又知B的式量是32,则C的式量为___________.7.已知在反应3A+2B====2C+D中,反应物A、B的质量比为3∶4.当反应生成C和D的质量共140 g时,B消耗的质量为___________g。
8.蜡烛燃烧后的产物有二氧化碳和水,由质量守恒定律可知,石蜡的组成中一定含有_______、_________元素。
(填写元素名称)9。
在化学反应3X+4Y====2Z中,已知X和Z的相对分子质量分别是32和102,则Y的相对分子质量为____________。
10。
火力发电厂用石灰石泥浆吸收废气中的二氧化硫以防止污染环境,其反应方程式为:2CaCO3(粉末) + 2SO2+ O2====2CaSO4+ 2CO2.(1)若100克废气中含6。
利用化学方程式的简单计算

利用化学方程式的简单计算化学方程式是表示化学反应的符号方程式,通过化学方程式可以方便地进行化学计算和判断反应的进行程度。
在实际应用中,化学方程式的简单计算常常涉及到物质的量的关系、反应产物的生成量等问题。
下面将利用化学方程式进行一些简单的计算。
1.物质的量的关系计算在化学方程式中,反应物和产物的物质的量可以通过化学平衡关系进行计算。
例如,对于以下反应:2H2+O2→2H2O如果给定了氢气的物质的量为2 mol,则氧气的物质的量可以通过化学平衡关系计算出来。
根据方程式中的系数比,氧气的系数为1,氧气的物质的量为1 mol。
类似地,如果给定了水的物质的量为3 mol,则氢气的物质的量也可以通过化学平衡关系计算出来。
根据方程式中的系数比,氢气的系数为2,氢气的物质的量为2×3=6 mol。
2.反应产物的生成量计算在一些化学实验中,需要根据反应的物质的量计算产物的生成量。
例如,对于以下反应:Fe2O3+3CO→2Fe+3CO2如果给定了铁(III)氧化物和一氧化碳的物质的量分别为4 mol和6 mol,则铁的物质的量可以通过化学平衡关系计算出来。
根据方程式中的系数比,铁的系数为2,铁的物质的量为2×4=8 mol。
类似地,二氧化碳的物质的量可以通过化学平衡关系计算出来。
根据方程式中的系数比,二氧化碳的系数为3,二氧化碳的物质的量为3×6=18 mol。
3.反应剩余物质的计算在一些限制反应中,给定了反应的物质的量和反应的物质的摩尔比例,需要计算剩余物质的物质的量。
例如,对于以下反应:2Na+Cl2→2NaCl如果给定了钠的物质的量为5 mol,氯气的物质的量为8 mol,则钠氯化物的物质的量可以通过计算反应剩余物质的物质的量得到。
根据方程式中的系数比,钠的系数为2,氯气的系数为1,钠氯化物的物质的量应该等于氯气的一半即4 mol。
由于氯气的物质的量为8 mol,因此钠氯化物的物质的量将是8-4=4 mol。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
课题3 利用化学方程式的简单计算
答案:
(1)各物质间的质量比成正比例 (2)设未知量 (3)化学计量数与相对分子质量的乘积
(4)列出比例式
1.利用化学方程式计算的步骤
(1)根据化学方程式计算的依据 ①理论依据:质量守恒定律。
②基本依据:化学方程式中各反应物、生成物之间的质量比。
(2)利用化学方程式计算的步骤 ①设未知量。
一般情况下,求什么就设什么。
②写出反应的化学方程式。
③标出已知量和未知量的关系,包括相对质量、已知量、未知量。
根据化学方程式把与解题有关的物质的相对分子质量总和计算出来,标在相应化学式的下面,把题中的已知条件和待求未知量写在相应物质的相对分子质量总和的下面。
④列比例式求解。
⑤简明写出答案。
⑥回顾检查。
辨误区 利用化学方程式计算的注意事项 ①设未知量时不带单位;②只找已知和未知的关系,列式时,单位要统一,单位要带入计算过程;③化学方程式一定要书写正确,各物质间的质量比一定要计算准确。
当已知量是体积或混合物的质量时,该如何处理?
应先将体积换算成质量,不纯物质,量换算成纯净物质量,因为代入化学方程式进行计算的相关量通常是质量,而且是纯净物的质量,不包括未参加反应的质量。
【例1】计算18 kg 水分解生成氢气的质量是多少?
解:(1)设未知量:
设生成氢气的质量为x …………………设
(2)写出化学方程式:
2H 2O=====通电
2H 2↑+O 2↑…………………写
(3)找出已知量和未知量的关系:
2H 2O=====通电2H 2↑+O 2↑
2×18 2×2
18 kg x ……………………标
(4)列比例式求解:
2×182×2=18 kg x
…………………列 x =18 kg×2×22×18=2 kg……………算
(5)简写出答案:
答:18 kg 水分解生成氢气的质量是2 kg…答
(6)回顾检查:①方程式是否正确;②已知量和未知量间的关系是否正确;③单位是否正确;④数值大小是否合理;⑤有效数字是否正确。
在实际运算过程中,还可以再简化些。
2.利用化学方程式的简单计算
(1)根据化学方程式中各物质间的质量关系,已知反应物的质量,可求生成物的质量。
【例2—1】实验室中可加热高锰酸钾制取氧气。
7.9 g 高锰酸钾受热完全分解,可制得氧气多少克?
解析:已知量是反应物高锰酸钾的质量,未知量是生成物氧气的质量。
首先写出化学反应方程式,根据高锰酸钾和氧气的质量关系(质量比为定值),可列比例式求解。
解题时还要规范解题步骤,计算过程中要带单位进行计算。
答案:解:设制得氧气的质量为x 。
2KMnO 4=====加热
K 2MnO 4+MnO 2+O 2↑
316 32
7.9 g x
31632=7.9 g x
解得,x =32×7.9 g 316
=0.8 g 答:可制得氧气0.8 g 。
(2)根据化学方程式中各物质间的质量关系,已知生成物的质量,可求反应物的质量。
【例2—2】工业上电解氧化铝制取铝,反应的化学方程式为:2Al 2O 3=====通电4Al +3O 2↑,如果加工一个铝锅需要铝1 kg ,至少需要电解多少氧化铝才能制成这个铝锅?
解析:认真审题是解题的关键。
本题的已知量是生成物铝的质量,待求量是反应物氧化铝的质量,解题时要规范解题步骤,计算过程中要带单位进行计算。
答案:解:设至少电解氧化铝的质量为x 。
2Al 2O 3=====通电4Al +3O 2↑
204 108
x 1 kg
204108=x 1 kg
解得,x =1.9 kg 答:至少需要电解氧化铝1.9 kg 。
3.利用化学方程式计算的常见题型
(1)求反应物、生成物间质量比。
质量比等于化学方程式中,各物质的相对分子质量(或相对原子质量)乘以化学计量数之后的乘积之比。
(2)已知一种反应物或生成物的质量,求另一种或几种反应物或生成物的质量。
解题依据是化学方程式中各物质间的质量比为一定值。
只要知道方程式中一种物质的质量,其他物质的质量均可求出。
(3)含有体积、密度与质量换算的化学方程式的计算。
①若已知物质(气体)的体积,应先根据质量=密度×体积,将体积换算成质量,再代入化学方程式求其他物质质量。
②若求物质(气体)的体积,应先根据化学方程式求出质量,再根据体积=质量密度
,求出物质(气体)的体积。
(4)含杂质(杂质不参加反应)的计算。
①化学方程式反映的是纯净物间的质量关系,若遇到不纯物时,应先把不纯物的质量换
算成纯净物的质量,再代入化学方程式进行计算。
物质的纯度(质量分数)=纯物质的质量混合物的质量
×100% ②当已知量是混合物质量时,有时需根据质量守恒定律,利用反应前后物质质量差,求生成气体的质量。
生成气体质量=反应前总质量-反应后剩余物质的质量。
【例3—1】(实际应用题) 6.2 g 红磷在空气中完全燃烧,生成五氧化二磷多少克?消耗标准状况下的空气多少升?(标准状况下氧气的密度为1.43 g/L)
答案:解:设生成五氧化二磷的质量为x ,消耗氧气的质量y 。
由4P + 5O 2=====点燃
2P 2O 5
124 160 284
6.2 g y x
列比例关系式并计算:124284=6.2 g x ,x =6.2 g×284124
=14.2 g 。
124160=6.2 g y ,y =6.2 g×160124
=8 g 。
氧气的体积为8 g 1.43 g/L
=5.6 L 。
标准状况下,氧气约占空气体积的21%,空气的体积为5.6 L 21%
=26.67 L 。
答:生成五氧化二磷14.2 g ,消耗标准状况下的空气26.67 L 。
【例3—2】用氯酸钾和二氧化锰的混合物15 g 加热到反应完全,称量试管内剩余固体的质量为10.2 g 。
求:
(1)原混合物中氯酸钾的质量分数。
(2)剩余固体中有何物质,各为多少克?
解析:15 g 是氯酸钾和二氧化锰的混合物质量,试管内剩余的10.2 g 固体,包括生成的氯化钾和催化剂二氧化锰的质量,也是混合物质量,均不能直接代入化学方程式计算。
应先根据质量守恒定律,求出生成氧气的质量,再将氧气质量作为已知量,求其他各量。
答案:解:反应生成的氧气质量为15 g -10.2 g =4.8 g 。
设参加反应的氯酸钾的质量为x 。
2KClO 3=====催化剂△
2KCl +3O 2↑ 245 96
x 4.8 g
245∶x =96∶4.8 g x =12.25 g
原混合物中氯酸钾的质量分数为12.25 g/15 g×100%=81.7%。
剩余固体中有生成的氯化钾和催化剂二氧化锰,其中二氧化锰质量为15 g -12.25 g =2.75 g ,氯化钾质量为10.2 g -2.75 g =7.45 g 。
4.差量法在化学计算中的应用
(1)差量法是根据化学反应中反应物和生成物的差量和造成这种差量的实质及其关系,列出比例式求解的解题方法。
(2)在解题过程中,可以把 “差量”看成是化学方程式中的一种特殊产物,该差量的大小与参与反应的物质的有关量成正比。
具体的解题步骤为:
①根据化学方程式分析反应前后形成差量的原因(即影响质量变化的因素);
②找出差量与已知量、未知量间的关系,然后再列比例式(对应成比例,单位要一致)。
(3)求解。
【例4】(创新题)将8.4 g 表面有氧化铜的粗铜丝在加热条件下与足量的氢气充分反应后得到8.0 g 铜。
试求参加反应的氢气及反应后生成铜的质量。
解析:
答案:解:设参加反应的H 2及反应后生成Cu 的质量分别为x 、y 。
CuO + H 2=====△Cu +H 2O 固体减轻
80 2 64 16
x y 0.4 g
2∶16=x ∶0.4 g,x =0.05 g ;64∶16=y ∶0.4 g,y =1.6 g 。
答:参加反应的氢气质量为0.05 g ,反应后生成铜的质量为1.6 g 。
