最新金属有机化学复习题
金属有机化学复习题

金属有机化学复习题一、写出下列有机配体、金属配合物、有机金属化合物的分子式、结构或名称1、py2、Cp3、acac4、en5、茚6、dmpe7、芴8、苯硼酸9、Zeise盐10、Stille 试剂11、Vaska配合物12、wilkinson 配合物13、BINAP 14、三甲基膦15、硫酸二(乙二胺)合铜16、三乙酰丙酮合锰(III)17、二环辛二烯合镍18、双(η5-环戊二烯基)合铁19、三(羰基)(1-6-η6-环庚三烯)合铬20、六氯合铂酸二、写出下列金属配合物、有机金属化合物的结构1、Zeise盐2、Vaska配合物3、Wilkinson配合物ClRh (Ph3P)34、BINAPPh3PIrCl COPPh33PIrClCOPPh3CH3ICH3I5、9-BBN6、二环辛二烯合镍Ni7、双(η5-环戊二烯基)合铁8、三(羰基)(1-6-η6-环庚三烯)合铬CrCO9、Ni(COD)210、RhCl(PPh 3)3 Wilkinson配合物11、η5- CpMn(CO)312、Co 2(CO )913、Cp 2(CH 3)Ta=CH 2 14、η5- Cp2ZrCl 2 15、Et 2AlCl 二乙基铝三、解释下列各名词1、金属有机化合物2、过渡金属有机化合物3、金属杂环化合物4、顺磁性配合物5、环状多烯π-金属配合物6、高自旋配合物7、低自旋配合物8、反磁性配合物9、晶体场分裂能10、电子成对能11、光谱化学序列12、配位饱和及配位不饱和13、插入反应14、还原消除反应15、氧化加成反应16、Heck反应17、Suzuki反应18、反馈π-键19、四个量子数20、EAN电子规则21、有效原子序数22、亲核型卡宾23、亲电性卡宾24、茂金属配合物26、烯烃交互置换反应27、Fischer卡宾28、Schrock卡宾29、Schlenck 技术30、σ给予体31、π酸32、叔膦配体33、圆锥角四、完成下列合成反应Bu t Oi,t BuMgClii,H3O+?(1)HOBu tBu ti3ii,H2O?(2)Tl(TFA)TFAHTFA =trifuoroacetatehv???(3)+Ni(CO)4DMF25C?(4)7.CCHH 3C (CH 322CCH 3CB(CH 3CH 2)2H,+8.Al 1.5H 2+2Et 3Al100-300C 5-30MPa9.4PPh 32RhCl 3+3CH 2=CH 2 + Al + 3/2H 2(CH 3CH 2)3AlRhCl(PPh 3)3 ,NO 2OCIr PPh 3Ph 3P1011.C 6H 5Br + LiC 6H 5Li, (C 6H 5)2CuLi13.Fe + 5CO197压力3CFe(CO)5,14.CoCO 3++8CO压加147CO2H 2Co 2(CO)8, Co 4(CO)1215.+Ni(acac)2OPhPPh 3Ni(COD)2,17.n-C 4H 9Br + 2Li3n-C 4H 9Li,CCHC 3H 7H 3CPh+19.BuLiCH TMEDAO1)3CH 2Li,HCPhCEtEt2 BuLi 20.+ CuI2(Bu)2CuLi,PhCH=CHCH 2Bu21.+THF(BH 3)2五、完成下列叙述题1、举例说明何谓有机金属化合物,何谓金属配合物,它们在结构和性能上有何异同。
有机化学实验考核复习题

有机化学实验技能考核复习题二、回答问题1、格氏反应对金属镁有什么要求?反应操作中如何隔绝水汽?答;镁条擦光亮并剪成小段。
所用仪器,在烘箱中烘干后,取出稍冷即放入干燥器中冷却。
或将仪器取出后,在开口处用塞子塞紧,以防止在冷却过程中玻璃壁吸附空气中的水分。
反应体系中与大气相通处用装有无水氯化钙干燥管相连。
2、重结晶的作用是什么?何种操作可检测重结晶后产品的纯度?答:利用物质中各组分在同一溶剂中的溶解性能不同而将杂质除去得到纯净的有机物。
(分离提纯的效果)测定重结晶后的熔程。
一般纯物质熔程在1-2℃。
3、为什么蒸馏前要把无水氯化钙干燥剂过滤掉?答:氯化钙干燥脱水时形成氯化钙六水络合物,此络合物遇热时分解放出水,因此蒸馏前么要先过滤除去氯化钙。
4、常压蒸馏中,圆底烧瓶中为什么要加入沸石?如果加热后才知道未加入,应该怎样处理才安全?怎样才能保证冷凝管套管中充满水?答:⑴止暴剂的作用是防止液体暴沸,使沸腾保持平衡。
当液体加热到沸腾时,止暴剂能产生细小的气泡,成为沸腾中心。
⑵如果事前忘记加入沸石,则应在冷却后再加入,绝不可在液体较热时加入,因为这样会引起剧烈的暴沸。
⑶冷凝管要保持竖直,水要从下口进,上口出来。
5、酯化反应的特点是什么?答:酯化反应是一个可逆反应,酯化平衡常数只是温度的数。
6、为什么在制备正溴丁烷时,溴化钠不能事先与硫酸混合,然后再加正丁醇与水?答:因为溴化钠与硫酸一混合即发生反应生成溴化氢气体,还未等加入正丁醇,溴化氢气体就会逸出,导致反应物减少了,产量也就会减少。
7、重结晶实验时,抽气过滤中布氏漏斗中的晶体应使用下列哪种物质进行洗涤?(B )A、母液B 、新鲜的冷溶剂C、冷水D、热水8、什么冷凝管用于冷凝回流?什么冷凝管用于蒸馏沸点高于130°C的液体?什么冷凝管用于蒸馏沸点低于130°C的液体?本学期的有机实验中分别在哪个实验中用过?(各举一例)答:⑴球形冷凝管制备2-甲基-2-已醇⑵空气冷凝管制备2-甲基2-已醇直形冷凝管;(3)直形冷凝管环已烯的制备(乙酸乙酯(提纯蒸馏部分))9、在正溴丁烷的制备中,将粗产物移至分液漏斗中,依次用(1)10ml 水(2)8ml 浓硫酸(3)10ml 水(4)10ml 饱和碳酸氢钠溶液(5)10ml 水洗涤,请说说每步洗涤的作用并判断产物是上层还是下层?答:(1)10ml 水—洗去HBr、正丁醇—下层;(2)8ml 浓硫酸—少量正丁醚、正丁醇、烯—上层;(3)10ml 水—洗去硫酸—下层;(4)10ml 饱和碳酸氢钠溶液—洗去硫酸—下层;(5)10ml 水洗涤—洗去碳酸氢钠—下层10、分馏的原理是什么?在制备环己烯的过程中为什么要控制分馏柱顶部的温度不超过90 C?本学期哪个有机实验用到了分馏柱?请写出该实验的原理。
金属有机化学课件和习题及答案

[Ru(C6Me6)2]2+ [Co(C6Me6)2]+
colorless yellow
-
芳烃的三羰基铬络合物是研究最多的体系:
在二丁醚中加热芳烃和Cr(CO)6可得到芳烃配位的铬络合物,如果使用的芳烃 热不稳定,则可使用含其它配体的三羰基铬络合物为原料
芳烃与金属配位后,在好的-受体CO的存在下,使芳环的电子云密度流 向CO,从而使芳烃具有了原先所没有的反应性:
金属有机化学
第10章 过渡金属单或多烯烃、 炔烃-络合物
1
10.1 金属烯烃-配合物的结构特点
10.1.1 金属-单烯烃配合物
H Cl Cl Cl Pt C C H H H K
C M C
-donation via the filled alkene -system
M
C C
-back donation via the empty alkene -system
6 M
M 4
M-C
M
Ar···Ar
[Cr]+ Me6-[Fe]2+ Me6-[Ru]2+ [Ru]2+
C-C
一些金属二芳烯配合物的性质
Complex Ti(C6H6)2 V(C6H6)2 V(C6H5F)2 Nb(C6H6)2 Cr(C6H6)2 Mo(C6H6)2 W(C6H6)2 [Mn(C6Me6)2]+ [Fe(C6Me6)2]2+ Color red red red purple brown green yellow-green pale pink orange mp/ºC Miscellaneous 227 284 115 160 空气敏感,在芳烃溶剂中自催化分解 空气非常敏感,顺磁性,可还原为 [V(C6H6)2] 空气敏感
金属有机习题

习题1,判断下列化合物中那些是金属有机化合物?(1)NaCN(2)Bu2SnCl2(3)EtCO2K(4)Et3Al(5)Co2(CO)82,对下列化合物命名。
(1)Bu3GeLi 三丁基锗锂(2)Et2AlCl 二乙基一氯合铝(3)i PrMgCl 异丙基氯化镁(4)(CO)4MnPPh3四羰基一三苯基膦合锰(5)k[(CH2CH2)PtCl3]·H2O 一水合乙烯三氯一合铂(IV)酸钾(6)η5-CpMn(CO)3三羰基-eita-5-环戊二烯基合锰(V)(7)η5-Cp2ZrCl2二氯二-eita-5-环戊二烯基合锆(VII)(8)Co2(CO)8八羰基合二钴(0)(9)IrCl(CO)(PPh3)2二(三苯基膦)一氯一羰基合铱(I)(10)RhCl(PPh3)3,三(三苯基)膦一氯合铑催化循环:Pd(PPh 3)4Pd(PPh 3)3 + PPh 318 16CoH(N 2)(PPh 3)3CoH(PPh 3)318电子 16电子CoH(N 2)(PPh 3)3CoH(PPh 3)318电子 16电子bOCRO+ [M]M OXC PhX RMδ+δ-C PhXM [PtCl 2(C 2H 4)]2 +CH 22CHPhC 2H 4(S)2Cl 2Pt CHCH PhPt(PPh 3)4 + CH 3C CNCNCNPtPh 3P Ph 3P CN C(CN)2CH 3(bipy)NiOC 6H 5CR O+OOOOOORCOC 6H 5O C O OO Co (CO), H COOH+ HCo(CO)4LnMCH 2CHRH LnMCH 2CHR H LnMH CH 2CHR LnMH + CH 2CHRLnMCH 2CH 2R LnMH + CH 2=CHRPd Et LLEt[ ]Pd Et LEt[ ]Pd Et LCO[ ]Pd CH 2L COEtCH 2H L PdHCOEt[ ]Pd(CO)n L mPd Et LEtL[ ]PdEt LEt[ ]Pd Et L Et[ ]Pd L Et COEtPd(CO)n L m R.E.OLnMCH 2CH 2R CH 2CH 2R_Ln M CH 2CH 2RCH 2CH 2R-1Ln M CH 2CH 2RH-1CH 2CHRLn M CH 2CH 2RH-12CHR还原-1 Ln M + RCH 2CH 3。
(新课标)2022版高考化学一轮复习 第三单元 金属及其化合物 考点规范练7 镁、铝及其重要化合物

考点规范练7 镁、铝及其重要化合物(时间:45分钟满分:100分)一、选择题(本题共10小题,每小题5分,共50分。
每小题只有一个选项符合题目要求)1.某化合物由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生。
下列化合物中符合上述条件的是( )A.AlCl3B.Na2OC.FeCl2D.SiO22.已知NaOH+Al(OH)3NaAl O2-+2H2O。
向集满CO2的铝制易拉罐中加入过量NaOH浓溶液,马上封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁恢复原状。
上述试验过程中没有发生的离子反应是( )A.CO2+2OH -C O32-+H2OB.Al2O3+2OH -2Al O2-+H2OC.2Al+2OH-+2H2O2Al O2-+3H2↑D.Al3++4OH -Al O2-+2H2O3.下列各组物质,不能按(“”表示反应一步完成)关系转化的是( )选项 a b cA Al2O3NaAlO2Al(OH)3B AlCl3Al(OH)3NaAlO2C Al Al(OH)3Al2O3D MgCl2Mg(OH)2MgO4.下列各组物质相互混合反应后,最终有白色沉淀生成的是( )①过量Na2O2投入到FeCl2溶液中②过量Ba(OH)2溶液和明矾溶液混合③少量Ca(OH)2投入过量NaHCO3溶液中④Na2SiO3溶液中通入过量CO2⑤CaCl2与NaOH的混合溶液中通入过量CO2A.①②③④⑤B.①⑤C.②③④D.②③④⑤5.下列除去杂质的方法不正确的是( )A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥B.用过量氨水除去Fe3+溶液中的少量Al 3+C.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤D.MgO中混有少量Al2O3:加入足量烧碱溶液,充分反应,过滤、洗涤、干燥得到MgO6.镁铝合金5.1 g溶于300 mL 2 mol·L-1盐酸中,(标准状况)放出气体的体积为5.6 L下,向反应后的溶液中加入500 mL NaOH溶液充分反应,最终产生白色沉淀。
[理学]第三章-金属有机化学-part2
![[理学]第三章-金属有机化学-part2](https://img.taocdn.com/s3/m/7ad8a60054270722192e453610661ed9ad5155a5.png)
2. 分子氮配合物中的化学键
N2与CO是等电子体,分子氮与过渡金属离子(原子) 生成配合物时的成键情况也与一氧化碳相似。
氮原子上的孤对电子进入过渡金属离子(原子)的空 轨道,形成σ配键,同时过渡金属离子(原子)的d电子进 入N2分子的反键π*空轨道,形成反馈π键,构成σ-π双键结 构。
N2比CO不易给出电子(N2的2σg比CO的5σ负),N2的 Lewis碱性较CO弱;同时N2的2πg比CO的2π正,不易接 受电子,因此,N2的π酸性较CO弱,一般认为N2是中等强 度的π-接受体和弱的σ给予体。 【 问 题 】N2 是 π- 配 体 , 在 形 成 分 子 氮 配 合 物 对 金 属 离 子 (原子)有何要求? 【问题】N2与CO配位性谁更强?哪一种更稳定?
N
NO
NO+与CO是等电子体, 键级为3。 NO的键长为115.1 pm, NO+的键长 106.2 pm。
NO 作 配 体 时 是 三 电 子 给 予 体 。 当它跟金属配位时,处于反键*轨道 上的电子先转移到金属原子上.
M+NO → NO++M-
NO+与金属M-的配位方式同CO一 样,即NO+(亚硝酰阳离子)向金属M-提 供一对电子形成配键, 而M-提供d电子 到NO+的反键* 轨道形成反馈配键, 亦即形成-反馈键。
从Raman光谱来看,端配N2配合物伸缩频率为1930 2230cm-1 ,说明NN键被削弱。
如图所示为端配和侧配的N2配合物:
N
110.1
178o N
178.4 P
Cl 218.5Co
216.7 220.2
160 P
H
(a)
Li
Li
Li
Ni
N
Li Li
有机化学复习题(含选择题答案)教学提纲

有机化学复习题(含选择题答案)有 机 化 学 习 题 课第一章绪论1、下列自由基的稳定性最小的是( C )。
O;OOO;OO;OCHO2、下列碳正离子的稳定性最大的是( A )。
OOOOOOCHOCH 2=CHCH 3 + C hv2=CHCH 2Cl + H Cl3、下列碳正离子,稳定性由大到小排列顺序是(B )。
①(CH 3)2CHCH 2+;②N NH 2N(CH 3)2⒈ (1)(2)(3);③ (CH 3)2CH +A .②>①>③;B .②>③>①;C .③>①>②;D .③>②>① 4、下列碳自由基,稳定性最大的是( B )。
①4.C CO OH OH ②CH 3C CH(CH 3)2CH 3;③CH 3C CHCH 3CH 33A .①;B .②;C .③;D .无法判断5、下列自由基,稳定性由大到小排列顺序是( B )。
① (CH 3)2CH · ;② (CH 3)3C · ;③ CH 3CH 2·A .①>②>③;B .②>①>③;C .③>①>②;D .③>②>① 6、下列碳正离子,稳定性由大到小排列顺序是(A )。
①CH 3CCH 2CH 2+CH 3CH 3;②N NH 2N(CH 3)2⒈ (1)(2)(3);③OOA .②>③>①;B .②>①>③;C .③>①>②;D .③>②>①7、在饱和碳原子中,有的碳原子只与一个碳原子直接相连,这种碳原子叫( A )碳原子。
A 、伯B 、仲C 、叔D 、手性8、按原子轨道重叠的方式不同,共价键有两种:σ键和π键。
下列不属于σ键的性质的描述是( C )。
A)重叠程度大,比较稳定; B)可以绕键轴自由旋转;C)原子轨道以“肩并肩”方式重叠;D)电子流动性小第二章烷烃一、1、+ ClCH4CCl4是(A )。
2A.自由基取代反应;B.亲电取代反应;C.亲核取代反应;D.消除反应2.化合物CH3CH2CH2CH3有( A )个一氯代产物。
备考2021年中考化学复习专题:金属与金属矿物_金属锈蚀的条件及其防护,填空题专训及答案

备考2021年中考化学复习专题:身边的化学物质_金属与金属矿物_金属锈蚀的条件及其防护,填空题专训及答案备考2021中考化学复习专题:身边的化学物质_金属与金属矿物_金属锈蚀的条件及其防护,填空题专训1、(2020城阳.中考模拟) 金属和金属材料在生产生活中应用广泛。
(1) 下列铁制品的用途中,能体现金属延展性的是________(填字母,下同)。
(2) 生活中为防止铁锅生锈,可采取的措施有________(答一条即可)。
(3) 要证明Cu 、Fe 、Zn 的活动性顺序,至少要做的实验是________(填序号)。
(4) 某生按如图所示进行了有关金属性质的探究实验。
下列说法中,错误的是_____A . 烧杯②中的溶液可能呈蓝色B . 烧杯②中的固体可能为铜和铁的混合物C . 烧杯③中的溶液中,一定含有Fe 、Cu 、AgD . 烧杯③中的固体质量一定大于烧杯②中的固体质量2、(2020濠江.中考模拟) 通过初中化学的学习,同学们掌握了一些基本的化学知识,初步形成了一些化学观念,具备了一定的化学科学素养。
(1) 周末,小星妈妈做晚饭炒菜时突然来一电话,在接电话时,听到正在忙于中考复习的小星大喊:“妈妈,锅里糊了!”接完电话,妈妈问道:“你又没看到,是怎么知道的?”小星解释道:________(从微观角度分析)。
(2) 小夏发现昨天洗好的铁锅浸水处生锈了,生锈的原因是铁与空气中的________和________等共同作用的结果,铝制品有良好的抗腐蚀性,原因是铝表面形成了致密的________。
(3) 生活中我们所使用的自来水常常使用二氧化氯来进行消毒,在一定条件下,二氧化氯与氰化氢(HCN )反应的微观示意图如图。
“”表示的物质化学式为________,上图中反应的化学方程式为________。
3、2+2++(2020石家庄.中考模拟) 自行车是常见的交通工具(如右图),回答下列问题:(1) 自行车上标出的部件由________类材料制成。
有机化学综合复习题及解答

有机化学综合复习题及解答1.写出下列反应的主要产物:OH OH+(1).H SO (CH 43)23CCH 2OH(2).(CH 3)2CC(CH 3)H 2(3).H 2SO 4(4).OHNaBr,H 2SO 4OH(5).OHHBr(6).OHPCC CH 2Cl 2CH 3CH 3(7).PBr HOH 3(8).O ()C MgBr C acetone12H 52H 5CH 3(2)H 3O +CH 3OCHCH CH 2OH(9).(10).CH H 5IO 6CH 33OHCH 3(11).H SO 4(A1)O 3H CH 23B(2)Zn,H 2OOH解答:O(1).(CH 3)2CCHCH 3(2).CH 3CC(CH 3)3(3).Br(4).CH 3(CH 2)3CH 2Br(5).(6).CH 3(CH 2)5CHOCH 3CH 3(7).HBr (8).OH +antiomer C 2H 5C 2H 5CH 3OHH 3C CH 3OO(9).(10).CH 3C(CH 2)4CCH(11).ACH 33CH 3CHCH CH 2CH 3CH 3BO CH 3O 2.解释下列现象:(1)为什么乙二醇及其甲醚的沸点随分子量的增加而降低?b.p.CH 2OH CH 2OH197CCH 2OCH 3CH 2OH125CCH 2OCH 3CH 2OCH 384C(2)下列醇的氧化(A)比(B)快?(A)OHMnO 2O(B)MnO 2OHO(3)在化合物(A )和(B )的椅式构象中,化合物(A )中的-OH 在e 键上,而化合物(B )中的-OH 却处在a 键上,为什么?(A)OH(B)OOOH解答:2.(1)醇分子中的羟基是高度极化的,能在分子间形成氢键,这样的羟基越多,形成的氢键越多,分子间的作用力越强,沸点越高。
甲醚的形成导致形成氢键的能力减弱,从而沸点降低。
(2)从产物看,反应(A )得到的是共轭体系的脂芳酮,而(B )没有这样的共轭体系。
金属有机化学习题
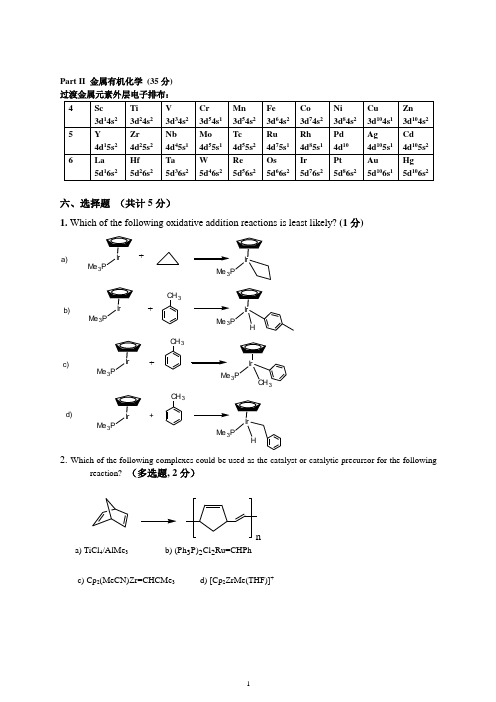
Part II 金属有机化学 (35分) 过渡金属元素外层电子排布:六、选择题 (共计5分)1. Which of the following oxidative addition reactions is least likely? (1分)Me 3PMe 3PMe 3PHMe 3PCH 3Me 3PMe 3PMe 3PIr Me 3PH+a)b)c)d)+++CH 3CH 3CH 32. Which of the following complexes could be used as the catalyst or catalytic precursor for the followingreaction? (多选题, 2分)na) TiCl 4/AlMe 3b) (Ph 3P)2Cl 2Ru=CHPhc) Cp 2(MeCN)Zr=CHCMe 3d) [Cp 2ZrMe(THF)]+3. Which of the following species could be used as the catalyst or catalytic precursor for the following reaction? (多选题, 2分)+H2a) IrCl(PPh3)3b) IrH3(PPh3)3c) RuHCl(PPh3)3d) NaH七、推导计算题(共计10分)1. On the basis of the 18 electron rule, identify the first-row transition metal for each ofthe following: (6 points)a) [M(CO)7]+; b) H3CM(CO)5; c) M(CO)2(CS)(PPh3)Br; d) [(η3-C3H5)(η3-C5H5)M(CO)]-; e) (OC)5M=C(OCH3)(C6H5); f) [(η4-C4H4)(η5-C5H5)M]+; g) [M(CO)4I(dppe)]-例e) 18 – 5x2 – 4 = 4, M(II), d4, Cr;2. On the basis of the 18 electron rule, determine the expected charge on the following: (4 points)a) [Co(CO)3]z; b) [Ni(CO)3(NO)]z (contains linear NO); c) [Ru(CO)4(CMe3)]z; d) (η3-C3H5)V(CNCH3)5]z; e) [(η5-Cp)Fe(CO)3]z例b) 18 – 3x2 – 2 = 10, Ni(0), d10, z = 0八、Provide a mechanism for the following transformation. (每题4分,共计16分)a) When A is treated with a Pd(0) catalyst and methyl acrylate, B is formed. When C is treated with a Pd(0) catalyst and methyl acrylate, D is formed. Please provide a mechanism for each reaction and explain the difference in the reaction pathways.b)ICOOH OO+34o 52%23.3c)R+PhArI+ArRPh34NaHCO3d)e)f) The Pd-catalyzed reaction of aryl halides with alcohols under an atmosphere of CO affords esters:Sketch a catalytic cycle for this reaction. You may assume the formation of small but usefulequilibrium concentrations of Et 3NHOMe.九、Predict the metal-containing products of the following reactions. (每题1分,共计4分)例,Ph 3P PtPh 3P+?IPh 3PPt PPh 3Ia)PCy 3RuPCy 3Cl OCH+Ph( )b)Mo NO CO++MeLi( )c)+IrPh 3PPPh 3PhBr( )d)NPPh 2PPh 2Pt +PhNH 22+BF 4-( )。
《金属有机化学》作业

《金属有机化学》作业一选择题1.最早的哪个金属有机化合物是1827年由丹麦药剂师Zeise合成的。
()A. (CH3)4TiB. K[Pt(C2H4)Cl3]C. (CH3)2HgD. CH3MgCl2.二茂铁(C5H5)2Fe属于哪一类非经典键合的化合物?()A. M—C键中为缺电子型键B. M—C键中碳原子为π键电子给予体的多中心键化合物C. M—C键以夹心型键形成的π键化合物D. M—C键以σ—π配键形成的化合物3.烯烃和B—H键的加成遵循以下哪个规则?()A. Markovnikov规则B. 反Markovnikov规则C. Zaitsev规则D. 反Zaitsev规则4.下列有关烷基铝说法不正确的是()A.烷基铝化合物是缺电子化合物B.烷基铝化合物一般是强的Lewis酸C.当三烷基铝的烷基为烷氧基所取代后,烷基铝化合物的反应性即降低。
D.从烷基铝和烯烃的反应能得到有很长链的烷基的化合物5.Ni(CO)4的几何构型是()A.正四面体型 B. 正方锥型 C.八面体型 D. 三角锥型6.Si—C键的反应性一般比C—C键的反应性为()A. 大B. 小C. 相等D. 不确定7.下列采用sp3杂化轨道成键的是()A. Cr(CO)6B. Fe(CO)5C. Ni(CO)4D. [Ag(CN)2]-8.Fred属于下列哪类配合物?()A. 混合配体羰基金属配合物B. 单核全羰基金属配合物C. 双核羰基金属配合物D. 原子簇配合物9.炔烃配体配合物中炔配体提供给金属的电子数是()A.4B.3C.2D.110.下列不属于类环戊二烯基配体的是()A. B. C. D.11.IA族金属的烷基物和芳基物的活性正确的是()A. Li-R<Na-R<K-R<Rb-R<Cs-RB. Li-R<K-R<Na-R<Rb-R<Cs-RC. Cs-R<Rb-R<K-R<Na-R<Li-RD. Cs-R<Rb-R<Na-R<K-R<Li-R12.Ni(CO)4属于哪一类非经典键合的化合物?()A. M—C键中为缺电子型键B. M—C键中碳原子为π键电子给予体的多中心键化合物C. M—C键以夹心型键形成的π键化合物D. M—C键以σ—π配键形成的化合物13.铝氢化物中最重要的是氢化铝锂,LiAlH4是重要的()A.还原剂 B. 氧化剂C. 催化剂D.脱水剂14.Fe(CO)5的几何构型是( )A. 正四面体型B. 正方锥型C. 三角锥型D. 八面体型15.Si —C 键的反应性一般比C —C 键的反应性为( )。
2021年高中化学必修二第七章《有机化合物》复习题(答案解析)(1)

一、选择题1.下列说法正确的是A.C240和C540互为同素异形体B.氕、氘、氚是氢元素的三种核素,其中子数相同C.CH3COOH与HCOOCH2CH3互为同系物D.C3H8的一氯取代物有3种2.下列说法不正确的是A.硬脂酸与软脂酸互为同系物B.红磷与白磷互为同素异形体C.16O与18O互为同位素D.CH3COOCH2CH3与CH3CH2OOCCH3互为同分异构体3.利用反应5NaCl+2CO2+2H2O 通电5NaClO+C2H 4O(环氧乙烷)可实现低压高效电催化还原CO 2。
下列化学用语正确的是A .NaClO的电子式:B.Cl-的结构示意图:C.CO2的比例模型:D.环氧乙烷的结构简式:4.根据下列实验操作和现象所得出的结论正确的是选项实验操作和现象实验结论A 向淀粉溶液中加入稀硫酸,水浴加热一段时间后,加入NaOH溶液至溶液呈碱性,再加入新制Cu(OH)2悬浊液,加热煮沸,有砖红色沉淀产生淀粉已水解完全B 卤代烃Y与氢氧化钠溶液共热后,滴加AgNO3溶液,观察,无淡黄色沉淀产生说明卤代烃不是溴代烃C 向浑浊的苯酚试液中滴加饱和Na2CO3溶液,试液变澄清且无气体产生说明苯酚的酸性强于碳酸D 向蛋白质溶液中滴加饱和Na2SO4溶液,有固体析出,过滤,向固体中加足量蒸馏水,固体溶解蛋白质的盐析过程是可逆的A.A B.B C.C D.D5.下列实验操作、现象和结论均正确的是()A.乙炔具有还原性B.待测液中含Fe2+C.a管发生吸氧腐蚀,b管发生析氢腐蚀D.检验溴乙烷消去反应产物A.A B.B C.C D.D6.以下6种有机物:①异戊烷②2,2—二甲基丙烷③乙醇④乙酸⑤乙二醇⑥甘油,沸点由高到低的排列顺序是()A.④>⑥>⑤>②>③>①B.⑥>④>⑤>②>③>①C.⑤>⑥>④>③>①>②D.⑥>⑤>④>③>①>②7.下列化学用语表达正确的是()A.乙酸的结构简式:C2H4O2B.氢氧化钠的电子式:C.Cl离子的结构示意图:D.NaClO的电离方程式:NaClO = Na++Cl-+O2-8.贵金属钯可催化乙醇羰基化,反应过程如图所示,下列说法错误的是A.C-H键所处环境不同,稳定性也不同B.贵金属钯也可将R2CHOH羰基化C.反应物CH3CH2OH→产物CH3CHO,发生了氧化反应D.反应过程中,Pd的成键数目保持不变9.人类肝脏蛋白质两谱三图三库基本架构已完成,它将为肝脏疾病的预警、预防、诊断和治疗提供科学依据。
有机化学——复习题

《有机化学》复习题一、选择题1.下列化合物碱性大小的顺序为: ( )① CH 3O - ② (CH 3)2CHO - ③ CH 3CH 2O - ④ (CH 3)3CO -(A) ① > ③ > ② > ④ (B) ④ > ② > ③ > ① (C) ④ > ③ > ① > ② (D) ① > ② > ③ > ④2.下列四个化合物在水中溶解度最大的是: ( ) (A)丙醇 (B)正丁醇 (C)2-氯丙烷 (D)1-氯丁烷3. 2—甲基—1─丁醇首先转变成对甲苯磺酸酯,然后与溴化钠 / 乙醇反应,使之转变为溴化物,反应中: ( )(A ) 第一步构型保持,第二步翻转 (B ) 第一步构型保持,第二步保持 (C ) 第一步构型翻转,第二步保持 (D ) 第一步构型翻转,第二步翻转4. 下列关于物质酸性大小的排列顺序正确的是: ( )A. 气相中, CH 3CH 2OH > (CH 3)2CHOH > (CH 3)3COHB. HOCH 2CH 3 > HOCH 2CH 2ClCH 3CH 2COOHH 2CCHCH 2COOH>>COOH CH 2C CH C ,D ,COOHCOOH NO 2>5.下列几个物质在液相中按酸性的大小排列正确的是: ( )(2)C H 3C H 2OH(1)H 2O5(C H 3)2C HOH (4)HCCH(3)H O C H 2C H 2C lA. (1)>(3)>(2)>(5)>(4)B. (1)>(3)>(2)>(4)>(5)C. (2)>(3)>(5)>(1)>(4)D. (3)>(1)>(2)>(5)>(4)6. 鉴别1—丁醇和2—丁醇,可用哪种试剂? ( )(A ) KI / I 2液 (B ) NaOH / H 2O 液(C)ZnCl2 / HCl液(D)Br2 / CCl4液7. 比较下列各化合物在H2SO4中的溶解度,正确的是:()O(1)(2)(3)(4)甘油A. (1)>(2)>(3)>(4)B. (4)>(3)>(2)>(1)C. (3)>(2)>(1)>(4)D. (4)>(1)>(2)>(3)8.OCH3Br在NaNH2 / 液氨条件下主要产物是:()OCH3NH2BrOCH3NH2OCH3NH2OCH3NH2A B C D9.CH2CH CH2CH3CH2CHCH2O*加热发生Claisen重排,主要产物为哪种?()A:CH2CH CH2CH3OHCH2CHCH2*B:CH2CH CH2CH3OHCH2CHCH2*C:CH2CH CH2CH3OHCH2CHCH2*D:CH2CH CH2CH3OHCH2CH2*10. C H OC H C H3稀酸水解产物为哪种?()A:乙醛和甲醇B:甲醛和乙醇C:乙烯和甲醇D:甲醛和乙醚11.下列环烷烃中加氢开环最容易的是:( )(A) 环丙烷 (B) 环丁烷 (C) 环戊烷 (D) 环己烷12. 二甲基环丙烷有几种异构体 ( ) (A) 2种 (B) 3种 (C) 4种 (D) 5种 13. 2,3-二甲基戊烷(I)、正庚烷(II)与2-甲基己烷(III)三种烃类化合物的沸点次序为: ( ) (A) I > II > III (B) II > I > III(C) II > III > I (D) III > II > I14. HBr 与3,3-二甲基-1-丁烯加成生成2,3-二甲基-2-溴丁烷的反应机理是什么?( )(A) 碳正离子重排 (B) 自由基反应 (C) 碳负离子重排 (D) 1,3-迁移15. 下列化合物酸性最强的应是 ( )16.C H O C H C H 3稀酸水解产物为哪种? ( )A :乙醛和甲醇B :甲醛和乙醇C :乙烯和甲醇D :甲醛和乙醚17.下面的氧化反应,用何种氧化剂较好? ( ) (A) K 2Cr 2O 7/H + (B) CrO 3·吡啶 (C) Ag(NH 3)2+ (D) 稀、冷KMnO 418.烟碱的结构为下列哪种? ( )(A) HC CH(B) H 2C CH 2(D) CH 3CH 3(C)CH OCO 2HN N NN COOH COOHCOOHN HABCD19.ClCH 2CH 2CH 2OH + PBr 3 ──> 主要产物为: ( ) (A) BrCH 2CH 2CH 2OH (B) CH 2=CHCH 2OH (C) ClCH 2CH =CH 2(D) ClCH 2CH 2CH 2Br20.下列结构稳定的是: ( )DCBAOH CH 3CHCH CH 2CH 3C OHCH 2CH 3CHOHCH CH 2OHCH 3CH OH21.CH 2CH 2O MM g Br+,则M 应是:( )CH 2CH 2OHCH OHCH 3CHCH 2BrCHCH 2OABCD22. 不与C 2H 5MgBr 反应的是: ( )A. CH 3CH 2OCH 2CH 3B. CH 3OHC. HClD. H 2O23. 比较化合物乙酸(I)、乙醚(II)、苯酚(III)、碳酸(IV)的酸性大小是: ( ) (A) I>III>II>IV (B) I>II>IV>III (C) I>IV>III>II (D) I>III>IV>II 24反应OC H 3IH +120C的产物是 ( )CH 2OHCH 3IOH+CH 3O HI+I 2CH 3O H++BDAC25 醚存放时间过长,会逐渐形成过氧化物,用下列哪种试剂可检验过氧化物的存在? ( )A. PH 试纸B. 石蕊试纸C. KI —淀粉试纸D. 刚果红试纸26. 下面基团是邻对位定位又是钝化苯环的是: ( )(1)(2)(3)(4)ClO CH3ClCH 2N(CH 3)2(A) (1) (2) (B) (1) (3) (C) (2) (3) (D) (1) (4)27. 下面化合物中有芳香性的是: ( )(A) (1) (2) (B) (1) (3) (C) (2) (3) (D) (2) (4)28( )(A) 对映体 (B) 非对映体 (C) 同一化合物 (D) 顺反异构体29. 在 IR 谱中醛酮 C =O 的伸缩振动应在的波数范围是 ( ) (A) 1400~1600cm -1 (B) 1300~1500cm -1 (C) 1800~1900cm -1 (D) 1600~1700cm -130. 氧化 PhCOCH 3成 CH 3COOPh 的氧化剂是 ( ) (A) CrO 3·吡啶 (B) MnO 2 (C) PhCO 3H (D) KMnO 4, OH - 31. 下面哪些(或哪个)化合物能被HIO 4氧化? ( )(1)(2)(3)(4)_+NNHCH 3I 3H HBrBr I H HCH 33化化化化化化化化IVIIIII ICH 2CH 2C CH 2OHO OHCH 3CHCH OCH 3OCH 2CH 2CH C CH 3OH OCH 3CH C CH 3OH O(A)Ⅰ (B)Ⅰ和Ⅳ (C)Ⅲ (D)Ⅰ,Ⅱ和Ⅳ32. 从PhCH 2Br 转变成PhCH 2COCH 3可采用哪个方案: ( )A. 1. Li 2. AcOHB. 1. Mg/Et 2O 2.CH 3COClC. 1. Mg/Et 2O 2. AcOHD. 1. Li 2. CH 3COCl33.下列化合物酸性强弱关系不正确的是: ( )A(CH 3)3N +COOH>COOHBC F 3COOH>CH 3COOHCCH 2CH COOH>CHC COOHDNC >COOHCH 3CH 2COOH34.下面的反应, 涉及到碳正离子重排的是: ( )CH 32HCl OC 2H 5OC 2H 5C 2H 5OH+O(D)41%%29+OHH CH 3COOHNaBH 4O(C)CH 3CHCCH 3OCH 3COOHBr 2CH 3CH 23O(B)(CH 3)3C C CH 3H+(A)CH 3OH OH CH 3CH 335.CH 2CH CH 2CH 3CH 2CH CH 2O *加热发生Claisen 重排,主要产物为哪种? ( )A :CH 2CH CH 2CH 3OHCH 2CH CH 2*B :CH 2CH CH2CH 3OHCH 2CH CH 2*C :CH2CH CH 2CH 3OHCH 2CH CH 2* D :CH 2CH CH 2CH 3OHCH2CH2*36. 下列的各组化合物中哪组都溶于水? ( )A. 乙烷,乙醇,丙酮B. 甲醚,环氧乙烷,乙醛C. 正辛醇,乙醇,甲醚D. 二正丁醚,甲醇,丙酮37. 下列各构造式中哪个属于不同的化合物? ( )-HC O NHHCONH-OCH 3COCH 2CHAD与与与O与 CH 3CO CH 2CH-+B C38. 在生产调味品香兰素(4—羟—3—甲氧基苯甲醛)时,常伴有邻香兰素(2—羟—3—甲氧基苯甲醛)存在,可用下列何法分开? ( )A. 萃取B. 水蒸气蒸馏C. 重结晶D. 升华39. 欲还原OOH合适的还原剂是: ( )A. Zn —Hg /HClB. NaBH 4C. Fe / HClD. NH 2NH 2 40 下列化合物与KHSO 3加成产率最高的是哪一个? ( )A :CH 3CHOB :C OCH 3CH 3 C :C OCH 2CH 2CH 3CH 3 D :P h C OCH 341. Williamson 合成法常用来合成 ( )(A) 酚(B) 醇 (C) 醚 (D) 环氧化物42. 比较苯酚(I)、环己醇(II)、碳酸(III)酸性的大小: ( ) (A) II>I>III (B) III>I>II (C) I>II>III (D) II>III>I43. 与FeCl 3发生颜色反应,是检验哪类化合物的主要方法? ( ) (A) 羟基结构 (B) 醚链结构 (C) 烯醇结构 (D) 酯基结构 44. 下列哪一种化合物能与NaHSO 3起加成反应? ( )45. 下列哪一种化合物不能用以制取醛酮的衍生物? ( ) (A) 羟胺盐酸盐 (B) 2,4-二硝基苯 (C) 氨基脲 (D) 苯肼46.测定油脂的不饱和度常用碘值来表示,测定时所用试剂为: ( ) (A) I 2 (B) I 2 + Cl 2 (C) ICl (D) KI47.用格氏试剂制备1-苯基-2-丙醇,最好采用哪种方案? ( ) (A) CH 3CHO + C 6H 5CH 2MgBr (B) C 6H 5CH 2CH 2MgBr + HCHO (C) C 6H 5MgBr + CH 3CH 2CHO(D) C 6H 5MgBr + CH 3COCH 348.下面哪种试剂只能将烯丙位、苯甲位的伯醇、仲醇氧化成相应的醛和酮:( )(A) 过氧酸 (B) 琼斯试剂 (C) 新制的MnO 2 (D) 费兹纳-莫发特试剂 49.羧酸的沸点比相对分子质量相近的烃,甚至比醇还高,主要原因是由于:( )A :分子极性B : 酸性C : 分子内氢键D : 形成二缔合体 50. 下列化合物中哪些可能有E ,Z 异构体? ( ) (A ) 2-甲基-2-丁烯 (B) 2,3-二甲基-2-丁烯 (C) 2-甲基-1-丁烯 (D) 2-戊烯 51.在制备COCH 3CH 3时,可采用: ( )A :顺式1,2—二甲基—1,2—环己二醇 / H +B :反式1,2—二甲基—1,2—环己二醇 / H +C :顺式1,2—二甲基—1,2—环己二醇 / -OC 2H 5D :反式1,2—二甲基—1,2—环己二醇 / -OC 2H 552. 叶绿素中含有的金属离子是: ( ) (A) Mg(B) Fe(C) Co(D) Zn(A) CH 3CC 2H 5 (B) C 2H 5CC 2H 5 (C) C 6H 5CC 2H 5 (D) C 6H 5CC 6H 5O O O O53. 下列化合物中碱性最强的是: ( ) (A) 二甲胺 (B) 吡咯 (C) 吡啶 (D) 氢氧化四甲铵54. 苯(a)、呋喃(b)、吡咯(c)、噻吩(d)发生亲电取代反应的活性次序是: ( ) (A) a>b>c>d (B) b>a>c>d (C) d>c>b>a(D) c>b>d>a55.吡啶硝化时,硝基主要进入: ( ) (A) α位(B) β位(C) γ位(D) 氮原子上56. 苯甲醛与丙醛在NaOH 溶液作用下生成什么产物? ( )(A) 苯甲酸与苯甲醇 (B) Ph ─CH =CH 2CH 2CHO (C) 苯甲酸与丙醇 (D) PhCH =CH(CH 3)CHO57. 下列化合物哪一个能溶于NaHCO 3? ( ) (A) 苯胺 (B) 对甲苯酚 (C) 苯甲酸 (D) 乙酰苯胺58. 合成喹啉环系的化合物常用: ( )(A) Fischer 合成法 (B) Skraup 合成法 (C) Hantzsch 合成法 (D) Robinson 反应59. 组成杂环化合物最常见的杂原子是: ( )(A) Si,B,P (B) S,O,N (C) F,Cl,Br (D) Cr,Ni,Al60. 下列物质中含有腺嘌呤和鸟嘌呤组分的是: ( ) (A) 蛋白质 (B) 氨基酸 (C) 核酸 (D) 糖二、填空题(共10小题 ,每小题2分,共20分)1. 写出2,4-二氯戊烷可能的立体异构体的Fisher 投影式;指出对映体,非对映体及内消旋体; 标出每个手性碳原子的R ,S 构型。
四川省雅安市中考化学 金属材料复习题1

金属材料一、选择题1.下列物质不属于合金的是()A.青铜 B.铝C.钢D.生铁2.下列有关钢铁的叙述不正确的是()A.生铁和钢都属于铁合金B.铁丝在氧气中燃烧生成Fe2O3C.在钢管表面镀锌可以防止锈蚀D.炼铁的主要原料有铁矿石、焦炭、石灰石3.哈尔滨西客站的建成促进了城市的发展,提升了哈尔滨铁路运输的能力.下列有关西客站的叙述错误的是()A.西客站是我省第一个实现高速铁路客运的现代化枢纽B.建设过程中使用了大量的纯铁.其硬度大于钢的硬度C.一些设施中使用的塑料属于合成材料D.采用了节能照明设备.降低了能源的消耗4.下列事实与对应解释不相符合的是()A.不锈钢比纯铁硬﹣﹣合金的硬度一般比各成分的金属大B.甘蔗甜,苦瓜苦﹣﹣不同分子性质不同C.切洋葱时可闻到刺激性气味﹣﹣分子在不停运动D.结冰的水不能流动(0℃以下)﹣﹣水分子不再运动5.兰州西客站在建设中,使用了大量建筑材料.下列有关材料的叙述不正确的是()A.建设过程中使用了大量的钢,其硬度小于纯铁的硬度B.一些设施中使用的合成纤维属于有机合成材料C.建设过程中,废弃的金属材料必须回收利用D.建设中使用了玻璃钢、碳纤维等材料,它们是复合材料6.下列对有关事实的解释中,错误的是()A.生铁和钢的性能不同﹣﹣含碳量不同B.硫和磷的元素种类不同﹣﹣质子数不同C.水和过氧化氢的化学性质不同﹣﹣氧原子个数不同D.硫在空气和氧气中燃烧的火焰颜色不同﹣﹣氧气浓度不同7.下列有关铁的说法错误的是()A.参考如图信息,铁的相对原子质量为26B.生铁和钢是常见的铁合金C.铁钉在潮湿的空气中容易生锈,因此钢铁的使用要注意防锈D.用赤铁矿高炉炼铁的化学反应方程式是Fe2O3+3CO2Fe+3CO28.下列关于金属及合金的叙述错误的是()A.生铁的含碳量小于钢B.湿热地区铁制品更易生锈C.多数合金硬度大于组成它的成分金属D.钛合金与人体具有优良的“相容性”,可用于制人造骨9.目前,南宁市正在进行地铁建设,修建地铁广泛使用金属材料,下列不属于合金的是()A.锰钢 B.生铁C.硬铝D.合成材料10.下列说法正确的是()A.不锈钢比纯铁软B.农药有毒,农业生产上应禁止使用农药C.绿色植物光合作用吸收二氧化碳,放出氧气D.凡含有食品添加剂的食物对人体健康均有害,不可食用11.下列说法中,不正确的是()A.不锈钢是一种合金 B.活性炭能将硬水软化C.塑料属于合成材料 D.铁制品表面刷漆能防锈12.物质的结构决定物质的性质.下列关于物质结构与性质的说法不正确的是()A.生铁和钢的性能不同,主要是由于其含碳量不同B.一氧化碳和二氧化碳的化学性质不同,是由于构成它们的分子不同C.金刚石和石墨的物理性质不同,是由于构成它们的碳原子不同D.金属钠和镁的化学性质不同,主要是由于钠原子和镁原子的最外层电子数不同13.生铁和足量的稀盐酸充分反应后,总会有一些残渣剩余,残渣的成分主要是()A.铁B.氯化铁C.氯化亚铁 D.碳14.推理是学习化学知识的一种常用方法,下列推理正确的是()A.因为生铁和钢的含碳量不同,所以两者的性能不同B.因为有机物都是含碳的化合物,所以碳酸氢钠属于有机物C.因为H2O和H2O2的组成元素相同,所以两者的化学性质相同D.因为中和反应生成盐和水,所以生成盐和水的反应都是中和反应15.不锈钢是铁的合金,与纯铁相比,不锈钢最重要的特性是()A.密度小B.光泽好C.导电性强 D.抗腐蚀性强16.金属材料在生产生活中应用非常广泛,下列属于合金的是()A.生铁 B.纯铜 C.橡胶 D.陶瓷17.金属材料在日常生活、工农业生产及航天航空中使用非常广泛.下列叙述中正确的是()A.钢是性能优良的纯铁B.在铁制水龙头表面镀铬只是为了美观C.焊锡锡铅合金的熔点远低于锡、铅的熔点,因此,焊锡不宜用于焊接金属熔点:焊锡70℃、锡232℃、铅327℃D.钛和钛合金熔点高、密度小、机械性能好且抗腐蚀性能远优于不锈钢,因而被广泛应用于火箭、导弹、航天飞机等18.比较推理是化学学习中常用的思维方法,下列推理正确的是()A.生铁比纯铁硬,故黄铜比纯铜硬B.烧碱属于碱,故纯碱也属于碱C.金刚石很硬,故石墨也很硬D.氢氧化铝可治疗胃酸过多,故氢氧化钠也可治疗胃酸过多19.下列有关铜、铁、铝的说法正确的是()A.黄铜属于纯净物B.“缺铁性贫血”里所说的铁是指铁单质C.铝是地壳中含量最高的元素D.可用铜片、FeCl2溶液、铝片来验证铜、铁、铝的金属活动性顺序二、填空题20.人类的生产和生活都离不开金属(1)生铁和钢中最主要的元素是;用铝壶烧水主要利用铝具有良好的性.(2)铝制品有良好的抗腐蚀性,其原因是在空气中铝的表面易形成致密的.(3)验证Zn、Cu、Ag的金属活动性顺序,可选择的试剂是(填字母序号).A.Zn、Ag、CuCl2溶液 B.Cu、Ag、ZnSO4溶液C.Zn、Cu、AgNO3溶液 D.Zn、Cu、Ag、稀硫酸.21.铁锅、铝锅是生活中常用的炊具,如图是铁锅的示意图.(1)铁锅含有合金单质(写化学式),含有的有机合成材料是.(2)炒菜时铁锅中的油着火可用锅盖盖灭,其原理是.(3)铝锅轻便、耐用,其原因是、.(4)废旧铁锅、铝锅不要随意丢弃,应回收利用,这样做的意义是.22.中国航空历经百年飞翔历史,正迎来崭新的空天时代.飞机的部分结构是由铝合金制成的,主要利用了铝合金的物理性质是(答一点即可).飞行员经常要进行高强度的体能训练,他们所穿的服装通常是由纤维织成的,为增强耐磨性和弹性,往往加入涤纶、锦纶等,它们属于纤维;在营养方面,每天都要食用一定量的鸡蛋、牛奶,这些食物为人体提供的营养素主要是.为了补充维生素.还要食用一定量的蔬菜,蔬菜在生长过程中常需施用化肥,在化肥的种类中氨水属于肥.浓氨水有挥发性,挥发出的氨气能与氯气(Cl2)反应生成空气中的一种单质和一种遇水蒸气能形成白雾的化合物,试写出发生反应的化学方程式,该反应前后氯元素的化合价分别为价.23.金属材料在生产和生活中有着广泛的应用.(1)下列物质中不属于合金的是(填字母).A.金刚石 B.不锈钢 C.生铁(2)铜可制成导线,主要是因为铜具有良好的.(3)黄金在自然界中主要以单质形式存在,原因是.(4)铁制品锈蚀的过程,实际上是铁跟空气中的和水蒸气等发生了化学反应.为防止铁制栏杆生锈,通常采取的措施是.(5)某溶液中含有硫酸铜和硫酸锌,向其中加入过量的铁粉,充分反应后过滤,滤渣中一定含有.24.2012年6月,“蛟龙”号载人潜水器创造了我国载人深潜新纪录,实现了我国深海技术发展的重大跨越.(1)“蛟龙”号身披能抗超高压的钛合金“龙甲”.钛合金属于材料,它的硬度(填“小于”或“大于”)金属钛的硬度;(2)下潜时,载人舱里的气体与外界空气相同,其中氧气的体积分数约为%;(3)深海潜航中可观测海底的“热液”与“冷泉”现象.前者是海水渗入地下,被熔岩加热后重返海底的活动.该海水中的丰富矿物在重返地表时遭遇冷水后沉积,沉积的主要原因是:.后者的形成原因之一是海底天然气的溢出,天然气的主要成分是甲烷,完全燃烧生成二氧化碳和水,写出该反应的化学方程式:.三、解答题25.化学就在我们身边.请根据所学化学知识回答下列问题:(1)生铁和钢都是铁的合金,其性能不同的原因是.(2)2015年5月31日是第28个“世界无烟日”.吸烟不仅危害人体健康,而且还有可能引发火灾,烟头引起火灾的原因是.(3)生活中铁制品最容易锈蚀,请说出自行车链条防锈的常用方法,写出用稀硫酸除铁锈的化学方程式.(4)某工厂的废液中含有 FeCl2、MgCl2和CuCl2,向其中加入一定量锌粉,充分反应后过滤,向滤渣中加入稀盐酸有气泡产生,则滤渣中一定含有.26.根据下列图文回答下列问题:(1)不锈钢是(填“纯净物”或“混合物”).(2)果汁中蛋白质、糖和维生素都含有元素(任填一种元素).(3)一个C60分子中含个碳原子,C60是制作某种锂电池的原料,电池的能量转化形式是由转化为电能.27.金属材料已得到越来越广泛的应用,请依据所学知识回答下列问题.(1)钢铁是最常用的金属材料.①钢属于(填“纯净物”或“混合物”);②将钢片和纯铁片相互刻画,纯铁片上留下划痕,说明.③以赤铁矿(主要成分为氧化铁)为例,写出工业上高炉炼铁的化学方程式:;(2)铝制品比铁制品抗腐蚀性更好的原因是.(3)向硝酸镁和硝酸铜的混合溶液中加入一定量锌粉,充分反应后过滤,观察到滤液为无色,则该滤液中的溶质一定有,滤渣中一定有.28.金属材料在国防建设中起着重要的作用,图1为歼﹣15飞机在辽宁舰上起飞.(1)铝合金用于制造飞机的外壳,铝合金材质的主要优点是、.(2)改装前的辽宁舰舰身锈迹斑斑,钢铁的锈蚀主要是铁与空气中的共同作用的结果.工业生产中常用稀盐酸除去铁制品表面的铁锈,该反应的化学方程式为.(3)为了避免轮船的钢质外壳被腐蚀,通常在轮船外壳上镶嵌比铁活动性强金属.小明为探究锌、铁、铜三种金属的活动性顺序,设计了如图2的两个实验:①实验一中,小明以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不够合理,理由是.②实验二中,若出现现象,可证明铁的活动性强于铜,该反应的化学方程式为.(4)辽宁舰的建造耗费了大量的钢材.某兴趣小组在实验室用图3所示装置模拟炼铁的化学原理,并测定赤铁矿中氧化铁的质量分数(装置气密性良好,反应完全且赤铁矿中的杂质不参加反应,称重赤铁矿样品的质量为wg).①装置A中生成铁的化学方程式为,装置B中发生反应的化学方程式为.②要测定该赤铁矿样品中氧化铁的质量分数,需要测量的数据是或.29.(1)根据下列图文回答问题:①青铜剑属于(填“纯金属”或“合金”).②高钙豆奶粉的“钙”指的是(填“元素”、“原子”、或“分子”).③C60分子是由构成的.④干冰可用于(填一例).(2)根据图2中自制汽水的配料回答问题.①柠檬酸的pH 7(填“<”、“=”或“>”),能使紫色石蕊溶液变为色.②配料中富含维生素的是,小苏打的化学式是.30.金属材料应用广泛,如电路板中常用到焊锡、铜、银、铁等.(1)焊锡与其组成金属相比具有的特性,可用来焊接电子元件.(2)将Cu片插入AgNO3溶液中,发生反应的化学方程式为.(3)若要验证Cu、Ag、Fe的活动性强弱,可选择的试剂组是(填序号).A.Fe、Cu、Ag、稀硫酸B.Cu、Ag、FeSO4溶液C.Fe、Ag、CuSO4溶液.参考答案一、选择题1.B;2.B;3.B;4.D;5.A;6.C;7.A;8.A;9.D;10.C;11.B;12.C;13.D;14.A;15.D;16.A;17.D;18.A;19.D;二、填空题20.铁元素;导热;氧化铝保护膜;A;21.Fe、C;塑料;隔绝氧气;铝的密度小;常温下,与氧气反应表面生成致密的氧化铝薄膜,阻止铝的进一步氧化;减少环境污染,节约资源.;22.密度小;合成;蛋白质;氮;2NH3+3Cl2=N2+6HCl;0、-1;23.A;导电性;金的化学性质不活泼;氧气;刷油漆;铁和铜;24.金属;大于;21;温度降低,矿物的溶解度减小,结晶析出;CH4+2O2CO2+2H2O;三、解答题25.含碳量不同;使可燃物温度达到着火点;涂油;Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;Fe、Cu;26.混合物;C(H或O);60;化学能;27.混合物;钢比铁的硬度大;Fe2O3+3CO2Fe+3CO2;铝在空气中易被氧气氧化生成致密的氧化铝保护膜;硝酸锌和硝酸镁;铜;28.强度大;质量轻;氧气、水;Fe2O3+6HCl═2FeCl3+3H2O;选取的酸的种类不同;铁丝表面出现红色物质;Fe+CuSO4═FeSO4+Cu;Fe2O3+3CO 2Fe+3CO2;2NaOH+CO2═Na2CO3+H2O;反应后装置A中药品的质量;测出反应前后装置B增加的质量;29.合金;元素;碳原子;人工降雨;<;红;果汁;NaHCO3;30.熔点低; Cu+2AgNO3=2Ag+Cu(NO3)2;C;。
高考化学总复习 专题十 第3讲 晶体结构与性质练习(含解析)-人教版高三全册化学试题

第3讲晶体结构与性质一、单项选择题1.二茂铁[(C5H5)2Fe]的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。
已知二茂铁熔点是173 ℃(在100 ℃时开始升华),沸点是249 ℃,不溶于水,易溶于苯、乙醚等非极性溶剂。
下列说法不正确的是( )A.二茂铁属于分子晶体B.在二茂铁结构中,C5H5-与Fe2+之间形成的化学键类型是离子键C.已知:环戊二烯的结构式为,则其中仅有1个碳原子采取sp3杂化D.C5H5-中一定含π键答案 B 碳原子提供孤电子对,铁原子提供空轨道,两者形成配位键,B项错误。
2.下列有关晶体的叙述中,不正确...的是( )A.氯化钠和氯化铯晶体中,阳离子的配位数均为6B.金刚石为空间网状结构C.金属钠晶体采用体心立方堆积,每个晶胞含2个原子,配位数为8D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子答案 A NaCl和CsCl晶体中,阳离子的配位数分别为6和8,A项错误;金刚石为空间网状结构,B项正确;金属钠的晶体采用体心立方堆积,每个晶胞含(1+8×1)个原子,配位数为8,C项正确;干冰晶体中,每2个CO2分子周围紧邻12个CO2分子,D项正确。
二、非选择题3.(2018淮阴中学高三上检测)金属钛性能优越,被誉为继Fe 、Al 后应用广泛的“第三金属”。
(1)Ti 基态原子的核外电子排布式为 。
(2)钛能与B 、C 、N 、O 等非金属元素形成稳定的化合物。
第一电离能:N (填“>”或“<”)O。
(3)月球上的岩石——玄武岩的主要成分为钛酸亚铁(FeTiO 3)。
FeTiO 3与80%的硫酸反应可生成TiOSO 4。
S O 42-的空间构型为 形,其中硫原子采取 杂化,写出S O 42-的一种等电子体的化学式: 。
(4)Ti 的氧化物和CaO 相互作用能形成钛酸盐CaTiO 3,CaTiO 3的晶体结构如图所示(Ti 原子位于立方体的顶点)。
有机化学——复习题

《有机化学》复习题一、选择题1.下列化合物碱性大小的顺序为: ( )① CH 3O - ② (CH 3)2CHO - ③ CH 3CH 2O - ④ (CH 3)3CO -(A) ① > ③ > ② > ④ (B) ④ > ② > ③ > ① (C) ④ > ③ > ① > ② (D) ① > ② > ③ > ④2.下列四个化合物在水中溶解度最大的是: ( ) (A)丙醇 (B)正丁醇 (C)2-氯丙烷 (D)1-氯丁烷3. 2—甲基—1─丁醇首先转变成对甲苯磺酸酯,然后与溴化钠 / 乙醇反应,使之转变为溴化物,反应中: ( )(A ) 第一步构型保持,第二步翻转 (B ) 第一步构型保持,第二步保持 (C ) 第一步构型翻转,第二步保持 (D ) 第一步构型翻转,第二步翻转4. 下列关于物质酸性大小的排列顺序正确的是: ( )A. 气相中, CH 3CH 2OH > (CH 3)2CHOH > (CH 3)3COHB. HOCH 2CH 3 > HOCH 2CH 2ClCH 3CH 2COOHH 2CCHCH 2COOH>>COOH CH 2C CH C ,D ,COOHCOOH NO 2>5.下列几个物质在液相中按酸性的大小排列正确的是: ( )(2)CH 3CH 2OH(1)H 2O5(CH 3)2CH OH (4)HCCH(3)HO CH 2CH 2ClA. (1)>(3)>(2)>(5)>(4)B. (1)>(3)>(2)>(4)>(5)C. (2)>(3)>(5)>(1)>(4)D. (3)>(1)>(2)>(5)>(4)6. 鉴别1—丁醇和2—丁醇,可用哪种试剂? ( )(A ) KI / I 2液 (B ) NaOH / H 2O 液(C)ZnCl2 / HCl液(D)Br2 / CCl4液7. 比较下列各化合物在H2SO4中的溶解度,正确的是:()O(1)(2)(3)(4)甘油A. (1)>(2)>(3)>(4)B. (4)>(3)>(2)>(1)C. (3)>(2)>(1)>(4)D. (4)>(1)>(2)>(3)8.OCH3Br在NaNH2 / 液氨条件下主要产物是:()OCH3NH2BrOCH3NH2OCH3NH2OCH3NH2A B C D9.CH2CH CH2CH3CH2CHCH2O*加热发生Claisen重排,主要产物为哪种?()A:CH2CH CH2CH3OHCH2CHCH2*B:CH2CH CH2CH3OHCH2CHCH2*C:CH2CH CH2CH3OHCH2CHCH2*D:CH2CH CH2CH3OHCH2CH2*10. CH OCH CH3稀酸水解产物为哪种?()A:乙醛和甲醇B:甲醛和乙醇C:乙烯和甲醇D:甲醛和乙醚11.下列环烷烃中加氢开环最容易的是:( )(A) 环丙烷 (B) 环丁烷 (C) 环戊烷 (D) 环己烷12. 二甲基环丙烷有几种异构体 ( ) (A) 2种 (B) 3种 (C) 4种 (D) 5种 13. 2,3-二甲基戊烷(I)、正庚烷(II)与2-甲基己烷(III)三种烃类化合物的沸点次序为: ( ) (A) I > II > III (B) II > I > III(C) II > III > I (D) III > II > I14. HBr 与3,3-二甲基-1-丁烯加成生成2,3-二甲基-2-溴丁烷的反应机理是什么?( )(A) 碳正离子重排 (B) 自由基反应 (C) 碳负离子重排 (D) 1,3-迁移15. 下列化合物酸性最强的应是 ( )16.CH O CH CH 3稀酸水解产物为哪种? ( )A :乙醛和甲醇B :甲醛和乙醇C :乙烯和甲醇D :甲醛和乙醚17.下面的氧化反应,用何种氧化剂较好? ( ) (A) K 2Cr 2O 7/H + (B) CrO 3·吡啶 (C) Ag(NH 3)2+ (D) 稀、冷KMnO 418.烟碱的结构为下列哪种? ( )(A) HC CH(B) H 2C CH 2(D) CH 3CH 3(C)CH OCO 2HN N NN COOH COOHCOOHN HABCD19.ClCH 2CH 2CH 2OH + PBr 3 ──> 主要产物为: ( ) (A) BrCH 2CH 2CH 2OH (B) CH 2=CHCH 2OH (C) ClCH 2CH =CH 2(D) ClCH 2CH 2CH 2Br20.下列结构稳定的是: ( )DCBAOH CH 3CHCH CH 2CH 3C OHCH 2CH 3CHOHCH CH 2OHCH 3CH OHOH21.CH 2CH 2O MMg Br+,则M 应是:( )CH 2CH 2OHCH OHCH 3CHCH 2BrCHCH 2OABCD22. 不与C 2H 5MgBr 反应的是: ( )A. CH 3CH 2OCH 2CH 3B. CH 3OHC. HClD. H 2O23. 比较化合物乙酸(I)、乙醚(II)、苯酚(III)、碳酸(IV)的酸性大小是: ( ) (A) I>III>II>IV (B) I>II>IV>III (C) I>IV>III>II (D) I>III>IV>II24反应OCH 3IH +120C的产物是 ( )CH 2OHCH 3IOH+CH 3O HI+I 2CH 3O H++BDAC25 醚存放时间过长,会逐渐形成过氧化物,用下列哪种试剂可检验过氧化物的存在? ( )A. PH 试纸B. 石蕊试纸C. KI —淀粉试纸D. 刚果红试纸26. 下面基团是邻对位定位又是钝化苯环的是: ( )(1)(2)(3)(4)ClO CH3ClCH 2N(CH 3)2(A) (1) (2) (B) (1) (3) (C) (2) (3) (D) (1) (4)27. 下面化合物中有芳香性的是: ( )(A) (1) (2) (B) (1) (3) (C) (2) (3) (D) (2) (4)28( )(A) 对映体 (B) 非对映体 (C) 同一化合物 (D) 顺反异构体29. 在 IR 谱中醛酮 C =O 的伸缩振动应在的波数范围是 ( ) (A) 1400~1600cm -1 (B) 1300~1500cm -1 (C) 1800~1900cm -1 (D) 1600~1700cm -130. 氧化 PhCOCH 3成 CH 3COOPh 的氧化剂是 ( ) (A) CrO 3·吡啶 (B) MnO 2 (C) PhCO 3H (D) KMnO 4, OH - 31. 下面哪些(或哪个)化合物能被HIO 4氧化? ( )(1)(2)(3)(4)_+NNHCH 3I 3H HBrBr I H HCH 33»¯ºÏÎïÓ¦¸ÃÊôÓÚÓëIVIIIII ICH 2CH 2C CH 2OHO OHCH 3CHCH OCH 3OCH 2CH 2CH C CH 3OH OCH 3CH C CH 3OH O(A)Ⅰ (B)Ⅰ和Ⅳ (C)Ⅲ (D)Ⅰ,Ⅱ和Ⅳ32. 从PhCH 2Br 转变成PhCH 2COCH 3可采用哪个方案: ( )A. 1. Li 2. AcOHB. 1. Mg/Et 2O 2.CH 3COClC. 1. Mg/Et 2O 2. AcOHD. 1. Li 2. CH 3COCl33.下列化合物酸性强弱关系不正确的是: ( )A(CH 3)3N +COOH>COOHBC F 3COOH>CH 3COOHCCH 2CH COOH>CHC COOHDNC >COOHCH 3CH 2COOH34.下面的反应, 涉及到碳正离子重排的是: ( )CH 32HCl OC 2H 5OC 2H 5C 2H 5OH+O(D)41%%29+OHH CH 3COOHNaBH 4O(C)CH 3CHCCH 3OCH 3COOHBr 2CH 3CH 23O(B)(CH 3)3C C CH 3H+(A)CH 3OH OH CH 3CH 335.CH 2CH CH 2CH 3CH 2CH CH 2O *加热发生Claisen 重排,主要产物为哪种? ( )A :CH 2CH CH 2CH 3OHCH 2CH CH 2*B :CH 2CH CH2CH 3OHCH 2CH CH 2*C :CH2CH CH 2CH 3OHCH 2CH CH 2* D :CH 2CH CH 2CH 3OHCH2CH2*36. 下列的各组化合物中哪组都溶于水? ( )A. 乙烷,乙醇,丙酮B. 甲醚,环氧乙烷,乙醛C. 正辛醇,乙醇,甲醚D. 二正丁醚,甲醇,丙酮37. 下列各构造式中哪个属于不同的化合物? ( )-HC O NHHCONH-OCH 3COCH 2CHAD与与与O与 CH 3CO CH 2CH-+B C38. 在生产调味品香兰素(4—羟—3—甲氧基苯甲醛)时,常伴有邻香兰素(2—羟—3—甲氧基苯甲醛)存在,可用下列何法分开? ( )A. 萃取B. 水蒸气蒸馏C. 重结晶D. 升华39. 欲还原OOH合适的还原剂是: ( )A. Zn —Hg /HClB. NaBH 4C. Fe / HClD. NH 2NH 2 40 下列化合物与KHSO 3加成产率最高的是哪一个? ( )A :CH 3CHOB :C OCH 3CH 3 C :C OCH 2CH 2CH 3CH 3 D :PhC OCH 341. Williamson 合成法常用来合成 ( )(A) 酚(B) 醇 (C) 醚 (D) 环氧化物42. 比较苯酚(I)、环己醇(II)、碳酸(III)酸性的大小: ( ) (A) II>I>III (B) III>I>II (C) I>II>III (D) II>III>I43. 与FeCl 3发生颜色反应,是检验哪类化合物的主要方法? ( ) (A) 羟基结构 (B) 醚链结构 (C) 烯醇结构 (D) 酯基结构 44. 下列哪一种化合物能与NaHSO 3起加成反应? ( )45. 下列哪一种化合物不能用以制取醛酮的衍生物? ()(A) 羟胺盐酸盐(B) 2,4-二硝基苯(C) 氨基脲(D) 苯肼46.测定油脂的不饱和度常用碘值来表示,测定时所用试剂为: ()(A) I2 (B) I2+ Cl2(C) ICl (D) KI47.用格氏试剂制备1-苯基-2-丙醇,最好采用哪种方案? ()(A) CH3CHO + C6H5CH2MgBr (B) C6H5CH2CH2MgBr + HCHO(C) C6H5MgBr + CH3CH2CHO (D) C6H5MgBr + CH3COCH348.下面哪种试剂只能将烯丙位、苯甲位的伯醇、仲醇氧化成相应的醛和酮:() (A) 过氧酸 (B) 琼斯试剂 (C) 新制的MnO2(D) 费兹纳-莫发特试剂49.羧酸的沸点比相对分子质量相近的烃,甚至比醇还高,主要原因是由于:( ) A:分子极性 B:酸性 C:分子内氢键 D :形成二缔合体50. 下列化合物中哪些可能有E,Z异构体? ()(A) 2-甲基-2-丁烯 (B) 2,3-二甲基-2-丁烯(C) 2-甲基-1-丁烯 (D) 2-戊烯51.在制备COCH3CH3时,可采用:()A:顺式1,2—二甲基—1,2—环己二醇/ H+B:反式1,2—二甲基—1,2—环己二醇/ H+C:顺式1,2—二甲基—1,2—环己二醇/ -OC2H5D:反式1,2—二甲基—1,2—环己二醇/ -OC2H552. 叶绿素中含有的金属离子是: ()(A) Mg(B) Fe (C) Co(D) Zn(A) CH3CC2H5 (B) C2H5CC2H5 (C) C6H5CC2H5 (D) C6H5CC6H5O O O O53. 下列化合物中碱性最强的是: ( ) (A) 二甲胺 (B) 吡咯 (C) 吡啶 (D) 氢氧化四甲铵54. 苯(a)、呋喃(b)、吡咯(c)、噻吩(d)发生亲电取代反应的活性次序是: ( ) (A) a>b>c>d (B) b>a>c>d (C) d>c>b>a(D) c>b>d>a55.吡啶硝化时,硝基主要进入: ( ) (A) α位(B) β位(C) γ位(D) 氮原子上56. 苯甲醛与丙醛在NaOH 溶液作用下生成什么产物? ( )(A) 苯甲酸与苯甲醇 (B) Ph ─CH =CH 2CH 2CHO (C) 苯甲酸与丙醇 (D) PhCH =CH(CH 3)CHO57. 下列化合物哪一个能溶于NaHCO 3? ( ) (A) 苯胺 (B) 对甲苯酚 (C) 苯甲酸 (D) 乙酰苯胺58. 合成喹啉环系的化合物常用: ( )(A) Fischer 合成法 (B) Skraup 合成法 (C) Hantzsch 合成法 (D) Robinson 反应59. 组成杂环化合物最常见的杂原子是: ( )(A) Si,B,P (B) S,O,N (C) F,Cl,Br (D) Cr,Ni,Al60. 下列物质中含有腺嘌呤和鸟嘌呤组分的是: ( ) (A) 蛋白质 (B) 氨基酸 (C) 核酸 (D) 糖二、填空题(共10小题 ,每小题2分,共20分)1. 写出2,4-二氯戊烷可能的立体异构体的Fisher 投影式;指出对映体,非对映体及内消旋体; 标出每个手性碳原子的R ,S 构型。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2013-2014学年第一学期金属有机化学复习(本)2013年12月一、写出下列有机配体、金属配合物、有机金属化合物的结构或名称1、Zeise 盐2、Vaska3PIrClCOPPh3CH3I3、Wilkinson配合物ClRh (Ph3P)34、BINAP5、9-BBN6、二环辛二烯合镍Ni7、双(η5-环戊二烯基)合铁8、三(羰基)(1-6-η6-环庚三烯)合铬CrCO9、Ni(COD)210、RhCl(PPh 3)3 Wilkinson配合物11、η5- CpMn(CO)312、Fe (CO )513、MoH 4(PPh 3) 414、η5- Cp 2Zr(CH 3)215、Et 2AlCl 二乙基氯化铝二、解释下列各名词1、金属有机化合物含有金属-碳键(M-C)的化合物定义为金属有机化合物2、过渡金属有机化合物含有过渡金属-碳键(M-C)的化合物,过渡金属含有d电子,在(n-1)d, ns, np原子构型中,(n-1)d轨道能级与ns接近,它们皆可参与成键。
符合18电子规则。
3、18电子规则对于稳定的单核反磁过渡金属络合物,其金属外层的电子数与配体配键的电子数的总和等于18。
只有当金属具有稳定的惰性气体结构时才能形成热力学稳定的过渡金属有机化合物。
4、EAN电子规则过渡金属配合物的中心(形成体)倾向于与一定数目的配体结合,以使自身周围的电子数等于同周期稀有气体元素的电子数5、环状多烯π-金属配合物6、高自旋配合物成对能(P)大于分裂能(△)的配合物,当P>△时, 因电子成对需要的能量高, 电子将尽量以单电子排布分占不同的轨道, 取高自旋状态。
7、低自旋配合物成对能(P)小于分裂能(△)的配合物,当P<△时, 电子成对耗能较少, 此时将取低自旋状态。
8、反馈π-键烯烃的π电子配位到金属的σ空轨道,形成σ授予键,同时充满电子的金属d 轨道与烯的反键空轨道π*相重叠,形成π反馈键。
9、晶体场分裂能中心离子的d轨道的简并能级因配位场的影响而分裂成不同组能级之间的能量差,以△表示10、电子成对能所谓成对能是电子在配对时为了克服静电场的排斥作用所需的能量, 通俗地讲就是使自旋成对的两个电子占据同一轨道所必须付出的能量, 以P表示。
11、光谱化学序列将一些常见配体按光谱实验测得的分裂能从小到大次序排列起来,便得光谱化学序列12、配位饱和及配位不饱和满足18电子规则的化合物称为配位饱和的络合物,否则为配位不饱和络合物13、插入反应不饱和烃或含有孤对电子的化合物插入过渡金属有机物的M-C, M-X或M-H键的反应称为插入反应,其逆反应称为反插入(脱出)反应14、还原消除反应还原消除(reductive elimination)是氧化加成反应的逆反应,其氧化态及配位数均降低2。
还原消除反应是一个协同过程,伴随着氧化数降低和配位数减少,其实质是过渡金属有机物的一种分解反应。
还原消除反应是催化反应中给出有机产物的一步。
15、氧化加成反应中性分子加到配位不饱和的低价过渡金属有机配合物上,使配合物中心金属的配位数和氧化态都同时上升的反应16、Heck反应在三乙胺存在下,醋酸钯催化卤代芳烃与烯烃反应生成苯乙烯型化合物17、Suzuki偶联反应在Pd(PPh3)4催化下,芳基硼酸与溴或碘代芳烃的交叉偶联反应.该反应因具有反应条件温和、可容忍多种活性官能团、受空间位阻影响不大、产率高以及芳基硼酸经济易得且对潮气不敏感等优越性而成为普遍适用的C一C键偶联方法。
三、完成下列合成反应Bu t Oi,t BuMgClii,H3O+?(1)HOBu tBu ti3ii,H2O?(2)Tl(TFA)TFAH TFA=trifuoroacetate hv???(3)Br+Ni(CO)4DMF25C?(4)7.CCHH 3C (CH 3CH 2)2BHCCH 3CHB(CH 3CH 2)2H,+8.Al 1.5H 2+2Et 3AlC 5-30MPa9.4PPh 32RhCl 3+RhCl(PPh 3)3 ,NO 2OCIr PPh 3Ph 3P103CH 2=CH 2 + Al + 3/2H 2(CH 3CH 2)3Al11.C 6H 5Br + LiC 6H 5Li, (C 6H 5)2CuLi 13.Fe + 5CO197压力3CFe(CO)5,14.CoCO 3++8CO压加147CO2H 2Co 2(CO)8, Co 4(CO)1215.+Ni(acac)2OPhPPh 3Ni(COD)2,17.n-C 4H 9Br + 2Li3n-C 4H 9Li,CCHC 3H 7H 3CPh+19.BuLiCH TMEDAO1)3CH 2Li,HCPhCEtEt2 BuLi 20.+ CuI2(Bu)2CuLi,PhCH=CHCH 2Bu21.+THF(BH 3)2HB,BGrignard试剂合成方程式为:RX + Mg RMgXEthers/THF硼氢化反应方程式为:硼氢化反应是反马氏规则的顺式加成四、1970年Monsanto公司最先在工业上实现了手性铑配合物催化C=C不对称加氢,合成治疗帕金森综合症的特效药L-Dopa。
催化剂就是含手性双膦配体(R, R)-Dipamp的Wilkinson型配合物,得到94%ee的L-Dopa。
直到20世纪90年代Burk (杜邦公司)发现更好(99%ee)的配体DuPhos。
后来,Noyori发现新类型的手性配体(R) or (S)-BINAP,其Rh络合物催化不对称氨基酸合成的ee%最高达100%;后来用其Ru络合物催化各种官能化烯烃的氢化,如用来合成非麻醉性消炎止痛药Naproxen(萘普生)和i-Buprofen(S-异丁基布洛芬)。
试写出这三种手性配体的结构式。
五、完成下列叙述题1、举例说明何谓有机金属化合物,何谓金属配合物,它们在结构和性能上有何异同。
金属有机化合物含有金属-碳键(M-C)的化合物金属与有机配体键合,但不存在直接的金属-碳键,也不是金属有机化合物,而是配位化合物。
2、简述有机金属化合物的特性。
3、简述配合物的18电子规则,并应用18电子规则说明下列化合物的稳定性差异。
(1)Fe(η5-C5H5)2(2) Ti(η5-C5H5)2 (3) Co(η5-CH5)25Fe(η5-C5H5)2 Fe2+ 6电子C5H5- 6电子6+2*6=18Ti(η5-C5H5)2 Ti2+2电子C5H5- 6电子2+2*6=14 不稳定Co(η5-C5H5)2 Co 2+ 6电子C5H5- 6电子6+2*6=18 不稳定,但可以再失1个电子来稳定4、简述配合物的EAN规则和18电子规则,并应用18电子规则说明二茂铁与二茂镍的稳定性差异。
(1)Fe(η5-C5H5)2(2) Ni(η5-CH5)25Fe(η5-C5H5)2 Fe2+ 6电子C5H5- 6电子6+2*6=18Ni(η5-C5H5)2 Ni 2+ 6电子C5H5- 6电子6+2*6=18 不稳定,但可以再失1个电子来稳定5、根据晶体场理论说明二价锌的配合物通常为无色配合物,而三价钛分别与不同配体结合后产生不同颜色,如:[Ti(OH2)6]3+带有紫色这是因为在晶体场的影响下,过渡金属离子的d轨道发生分裂,由于这些金属离子的d轨道没有充满,在吸收了一部分光能后,就可产生从低能量的d轨道向高能量d轨道的电子跃迁,这种跃迁称d-d跃迁。
配离子的颜色是从人射光中去掉被吸收的光,剩下来的那一部分可见光所呈现的颜色。
吸收光的波长越短,表示电子跃迁(被激发)所需要的能量越大,亦即Δ大,反之亦然。
而Zn2+d-d分裂能Δ值在可见光范围外~无色在配位场的作用下,裂分的这些d能级对理解经典的配位化合物的吸收光谱、磁性和esr谱十分重要。
但在金属有机化学中,因为过渡金属有机物中由d-d跃迁引起的光谱带常被强的“电荷转移”吸收所掩盖。
事实上,随着10DQ变大,d-d跃迁光谱移至紫外区域。
所以三价钛分别与不同配体结合后产生不同颜色,[Ti(OH2)6]3+带有紫色6、简述在八面体配合物中,d轨道裂分形成t2g轨道和eg轨道的原理并画出能级裂分图。
7、简述在四配位的正四面体过渡金属配合物中,d轨道裂分形成t2轨道和e轨道的原理并画出能级裂分图,标出相应能级的轨道符号,计算出△t值。
六、写出下列过渡金属催化反应的反应1、写出乙烯通过催化水合反应合成乙醛的反应机理(画出催化循环过程图),并说明每一步反应属于何种基元反应。
瓦克(Wacker)以顺时针方向分别是配体解离,烯烃配位,烯烃插入和氧化加成,还原消除。
2、由丁烯在Wilkinson催化剂作用下合成戊醛的反应机理(画出催化循环过程图),并写出每步基元反应的名称。
顺时针分别是烯烃配位,配体解离,氧化加成,烯烃插入,配体配位,还原消除,氧化加成,配体解离,烯烃配位。
3、由Ni(CO)4催化下,由乙炔、乙醇合成丙烯酸乙酯的反应机画出催化循环过程图,并写出每步基元反应的名称。
HC CH H 2C CH 2COOR4、写出在Wilkinson 配合物[RhCl (PPh 3)3]催化下,均相氢化合成4-(2-硝基乙基)亚甲二氧基苯的反应机理(画出催化循环过程图),并说明每一步反应属于何种基元反应。
O NO 2O ONO2100%5.给出金属有机化学基元反应的各个名称,并分别举例说明。
⑴配体的配位和解离;⑵ 氧化加成和还原消除;(3) 插入和脱出(反插入)反应;CpCo(CD 3)2PPh 3 + CH 2=CH 2CpCo(CD 3)2CH 2=CH 2 + PPh 3RCOCo(CO)4RCOCo(CO)39+1+2×4 = 189+1+2×3 = 16RCOCo(PPh 3)(CO)39+1+2+2×3 =18- CO+ PPh 3(4)配体与外来试剂的反应6.简述18电子规则的原理及应用,并举5个以上的典型例子加以说明。
18电子规则:对于稳定的单核反磁过渡金属络合物,其金属外层的电子数与配体配键的电子数的总和等于18。
只有当金属具有稳定的惰性气体结构时才能形成热力学稳定的过渡金属有机化合物。
它是一个经验规则,满足18电子规则的化合物称为配位饱和的络合物,否则为配位不饱和络合物。
18电子规则的重要性:根据n+2x(CN)=18, 当电子数n固定时, 配合物的最高配位数可推知, 同时也可以推测配合物的几何构型。
d6电子构型,为六配位的八面体;d10电子构型,为四配位四面体。
具有同种d电子构型的络合物,配位数和配合物的构型相同。
7.Fischer型卡宾和Schrock型卡宾在结构特点和反应性能上的不同之处在于:Fischer特点:含有一个或两个与卡宾C相连的杂原子(O, N )。
