溶出度与释放度的区别
中美英三国药典溶出度、释放度检查方法比较

S3
12
24个样本( S1 + S2+ S3)的平均溶出量应大于等于Q
缓释制剂
Extended-Release Dosage Forms
步骤
L1
供试量
6
可判定为符合规定的标准
每片(个)的各规定时间测得的释药量应在规定范围内,最后 时间点释药量应不低于规定值 另取6片(个)测试,初复试的12片(个)在各规定时间测得的 平均释药量应在规定范围内,最后时间点平均释药量应不低于 规定值,且在规定时间内不得有释药量超出规定范围10%者,在 最后时间释药量不得有低于规定值10%者 另取12片(个)测试,初复试的24片(个)在各规定时间测得 的平均释药量应在规定范围内,最后时间点平均释药量应不低 于规定值。24片(个)中超出规定范围10%者不得多于2片 (个);最后时间释药量低于规定范围10%者不得多于2片 (个),且在规定时间内不得有释药量超出规定范围20%者,在 最后时间释药量不得有低于规定值20%者
S3
12
另取12片(个)测试,初复试的24片(个)中无低于Q-25%者, 且低于Q-15%者不多于2片(个),其平均溶出量不低于Q
速释制剂取样混合后(pooled sample)进行测定
步骤
S1 S2
供试量
6 6
可判定为符合规定的标准
平均溶出量应不低于Q+10% 12个样本( S1 + S2 )的平均溶出量应大于等于Q+5%
除另有规定,限度Q为75%,Q值是酸中释放量和缓冲液中释放量的总和。
透皮给药系统 Transdermal delivery systems
步骤 L1 供试量 6 可判定为符合规定的标准 每片(个)的各规定时间测得的释药量应在规定范围内
医药制造业的溶出度与释放度检测

医药制造业的溶出度与释放度检测溶出度与释放度是医药制造业中非常重要的质量控制指标。
它们用于评价药物制剂在特定条件下的溶出速率和释放特性,以确保药物的安全性和有效性。
溶出度是指药物从制剂中溶出的速度和程度。
它是一个重要的质量控制指标,用于评价药物的生物可用性。
溶出度检测可以通过不同的方法进行,如篮法、桨法、旋转 disk 法等。
篮法是最常用的溶出度检测方法之一。
在该方法中,药物制剂被放入一个篮子中,然后将篮子放入溶出介质中。
通过测量药物从制剂中溶出的速率,可以评价药物的溶出性能。
桨法是另一种常用的溶出度检测方法,它通过搅拌溶出介质来模拟胃肠道环境。
旋转 disk 法是一种较新的溶出度检测方法,它通过旋转 disk 来加速药物的溶出。
溶出度检测的结果可以通过不同的参数来表征,如溶出速率、溶出百分比、溶出曲线等。
这些参数可以用于评价药物的溶解性能和制剂的质量。
释放度是指药物从制剂中释放到溶液中的速度和程度。
它是一个重要的质量控制指标,用于评价药物的持续释放性能。
释放度检测可以通过不同的方法进行,如桨法、流池法、动态渗透法等。
桨法是最常用的释放度检测方法之一。
在该方法中,药物制剂被放置在一个桨子上,然后将桨子放入溶出介质中。
通过测量药物从制剂中释放到溶液中的速率,可以评价药物的释放性能。
流池法是另一种常用的释放度检测方法,它通过在制剂和溶出介质之间建立流动来模拟胃肠道环境。
动态渗透法是一种较新的释放度检测方法,它通过模拟体内的渗透过程来评价药物的释放性能。
释放度检测的结果可以通过不同的参数来表征,如释放速率、释放百分比、释放曲线等。
这些参数可以用于评价药物的持续释放性能和制剂的质量。
溶出度与释放度是医药制造业中非常重要的质量控制指标。
它们用于评价药物制剂的溶出速率和释放特性,以确保药物的安全性和有效性。
通过进行溶出度与释放度检测,可以评价药物的溶解性能和制剂的质量,从而保证患者的用药安全。
这是医药制造业的溶出度与释放度检测的内容。
释放度名词解释

释放度名词解释
释放度系指药物从缓释制剂、控释制剂、肠溶制剂及透皮贴剂等在规定条件下释放的速率和程度。
溶出速率亦称释放度或溶出度。
是指固体药物制剂(片剂、丸剂、散剂、胶囊剂等)中有效成分在特定的溶解介质中的溶解速度和程度。
固体制剂中有效成分的溶解和释放直接影响药物的吸收速度和程度,因而与药效密切相关,是控制和评定药品质量的重要指标之一。
一般采用体外恒温(37℃±0.5℃)动态下进行的理化方法予以测定。
常用的测定仪器有转篮式、桨叶式、循环式及崩解式等。
测定固体制剂的溶出速率,不仅可以评价中成药的内在质量(如相同药物的不同剂型、不同厂家或不同批号、同品种、同规格制剂质量的优劣),而且可以作为筛选处方。
评定工艺的依据和指标(如考察处方设计的合理性及药物的粒度、辅料等对药效的影响)。
中、美、英三国新版药典溶出度、释放度检查方法比较

中、美、英三国新版药典溶出度、释放度检查方法比较许鸣镝胡琴摘要:目的通过对中国药典、美国药典和英国药典中溶出度、释放度测定方法的比较,使广大药物分析工作者了解其异同,为新药开发及进出口检验服务。
方法就其历史沿革,最新版所采用的仪器装置和结果判定等方面进行比较和讨论。
结果三国药典收载的仪器装置各有异同,结果判定差异较大,应引起注意。
结论如何能准确有效地监控药物释放过程,仍是有待深入研究和完善的课题。
关键词溶出度;释放度;中国药典;美国药典;英国药典中图分类号:R921 文献标识码:E文章编号:1001-2494(2000)07-0491-04溶出度和释放度是指药物从片剂、胶囊剂和其它缓释、控释制剂中,在规定介质内,在一定条件下的溶出速度和溶出程度,是评价药物制剂质量的内在指标,是制剂质量控制的重要手段。
在药检工作中,经常要查阅中国药典、美国药典和英国药典。
中国药典是我国药品的最高法典,而美国药典和英国药典由于历史悠久,技术先进又具有代表性,在世界各国有较大影响。
有些国家没有药典,而以美国药典和英国药典为标准,在世界药品贸易中也常以其标准来要求。
综观新版三国药典所收载的溶出度、释放度检查方法在很多方面趋向一致,但又在某些方面存在差别。
下面仅就其历史沿革,最新版所采用的仪器装置和结果判定要求等方面进行比较和讨论。
1 历史沿革1.1 中国药典中国药典在1985年版引入溶出度检查法时,设定篮法、桨法及类似于流室法的装置等3种装置,1990年版仅保留了前2种装置,1995年版中增订了小杯法装置,并引入了释放度检查法,至2000年版又增加了测定透皮贴剂释放度所需的桨碟装置,方法发展很快。
1.2 美国药典美国药典自1970年版(第18版)率先引入溶出度检查法,最初只设转篮法装置,且无图例。
1975年版(第19版)增加了转篮法的图例,但与现在试验的篮法装置也不相同。
1980年版(第20版)增设了桨法装置和改造后的崩解仪两种装置,未给出图例,也无统一的仪器配件尺寸规格。
中国药典中溶出度与释放度测定法的英文

我国药典中溶出度与释放度测定法的英文一、概述我国药典中的溶出度与释放度测定法是评价药物在体内释放的速度和程度的重要方法。
该方法对于评估药物的生物利用度和药效学具有重要意义。
掌握我国药典中溶出度与释放度测定法的英文是非常必要的,有助于促进国际间的药物研究和交流。
二、溶出度与释放度测定法的中文表述在我国药典中,溶出度与释放度测定法的中文表述为“溶出度与释放度测定法”。
三、溶出度与释放度测定法的英文表述在进行翻译时,溶出度与释放度测定法的英文表述为“Dissolution and Release Test”.四、溶出度与释放度测定法的具体步骤1. 准备溶出溶出度和释放度测定仪器及试剂。
测定仪器包括溶出仪和释放仪,试剂包括模拟胃液、模拟肠液等。
2. 将试验药物制成适宜的制剂形式,如片剂、胶囊剂等。
3. 进行试验前的准备工作,包括清洗试剂槽、浸泡测量器具等。
4. 设置测定仪器的条件,包括温度、转速等。
5. 通过适当的方法将试剂加入测定仪器中。
6. 开始测定,记录溶出曲线和释放曲线。
7. 根据测定数据,计算出溶出度和释放度的相应参数。
五、溶出度与释放度测定法的意义通过溶出度和释放度测定法,可以评价药物在不同制剂形式中的释放速度和程度,进而指导药物的配方设计和制备工艺的改进。
六、结论掌握我国药典中溶出度与释放度测定法的英文表述及具体步骤对于开展国际间的药物研究和交流具有重要意义。
该方法在药物生产和研发中具有广泛的应用前景。
七、参考文献1. 《我国药典》2. International Pharmacopeia standards八、溶出度与释放度测定法在药物研究和开发中的应用溶出度与释放度测定法在药物研究和开发领域中扮演着重要的角色。
在药物设计阶段,研究人员可以利用该方法评估不同制剂形式的药物释放性能,选择最佳的制剂形式以提高药效。
在药物生产过程中,溶出度与释放度测定法可以用来控制药物释放速度和稳定性,确保药物品质符合要求。
2010版-溶出度

释放度
依然是三种方法:第一法用于缓释制剂或控释制剂, 第二法用于肠溶制剂,第三法用于透皮贴剂。 第一法:增加了补充介质的温度 (37℃±0.5℃) 第二法:增加了缓冲液中释放量,加入介质的温度 (37℃±0.5℃)。方法2缓冲液中释放量,直接弃去酸液, 加37℃±0.5℃的缓冲液,这样可以使pH更准确。 第三法:未调整 (不锈钢网碟,释放面朝上,介质 温度为32℃±0.5℃)
15
正文修订更合理
本版药典对大部分难溶性口服固体制剂进 行了筛选,除增加了大量品种的溶出度检 查项外,同时也修改了一部分原有的不合 理的溶出度方法,使参数更合理,药品安 全性显著提高。 例如:非洛地平片 P454 2005:三法(小杯法),转速100转/分, 2010:二法(桨法),转速50转/分,
21
新版更加环保
1、很多盐酸盐原料药的含量测定由传统的加入醋 酸汞试液后高氯酸滴定的方法改为电位滴定方法测 定,即可不用醋酸汞了。例如:盐酸二甲双胍,盐 酸曲马多,盐酸美西律,盐酸氯丙嗪等 2、试验中用到的毒性大,有放射性等试剂的方法 都改成了对人无危害的试剂来试验。例如:a.薄层 色谱展开剂中用到苯的都用其它试剂取代了。b、 钠盐鉴别试验取消了醋酸氧铀锌试液鉴别法。c、 锌盐鉴别试验取消了硫氰酸汞铵试液鉴别法。 3、新版HPLC中已明确了超高效液相色谱的应用。
17
溶出度测定中存在的问题
1、个别品种未能按附录的修订而在文字上作相 应修订。(例如:溶出介质量没有在品种中具体说明,
右旋糖酐铁片 、灰黄霉素片 、氢氯噻嗪片 等)
2、部分难溶性品种因建立溶出度测定方法的研 究还未成熟,未能收入药典中。 3、个别品种溶出度测定方法中的参数欠合理, 仍要继续完善。
溶出度与释放度测定方法

溶出度与释放度测定方法溶出度是指固体药物在一定温度和一定条件下溶解到介质中的程度,一般使用溶出度仪来进行测定。
常用的溶出度测定方法包括:1.离体释放法:将药物样品装入溶出度杯中,并将溶出度杯放入溶出度仪中,通过搅拌或振荡,使介质中的药物溶解,并采用适当的分析方法测定溶出度。
离体释放法适用于针对固体制剂的溶出度测定。
2.血浆蛋白结合法:药物在体内往往与血浆蛋白结合,只有游离态的药物才能被有效地吸收和发挥药效。
该方法通过测定药物与血浆蛋白的结合率来评估药物的体外释放动力学特性。
3. 细胞透过性法:该方法主要用于研究药物在体内过程中的渗透和吸收性能,常用的方法包括Caco-2细胞模型和MDCK细胞模型等,通过测定药物透过透过率或透过系数来评估溶出度。
释放度是指药物在给定时间范围内从给定剂量的制剂中释放到介质中的比例。
一般采用释放度仪来进行测定,常用的释放度测定方法包括:1.离体释放法:该方法通过将给定剂量的固体药物制剂装入释放度杯中,将释放度杯放入释放度仪中,通过搅拌或振荡,使药物从制剂中释放,然后采用合适的分析方法测定释放度。
该方法适用于评估固体制剂的释放度。
2.体内释放法:该方法用于研究药物在体内释放的动力学特性。
通常将药物制剂直接给予动物内,通过采集从体内取出的样品,使用分析方法来测定药物的释放度。
3.微弹簧法:利用微弹簧将药物制剂固定在其表面,然后将微弹簧放入释放度仪中,通过弹簧的压缩来实现药物的释放。
该方法适用于固体制剂和微球制剂的释放度测定。
总结起来,溶出度和释放度的测定方法主要包括离体释放法、血浆蛋白结合法、细胞透过性法、体内释放法和微弹簧法。
通过选择合适的测定方法,能够获得药物在溶解和释放过程中的动力学特性,为药物研究和开发提供有价值的参考。
溶出度与释放度测定法

溶出曲线表示制剂的整个溶出过程,相同处方同一 生产工艺的产品,其溶出曲线应该是相近的。
一、溶出度的基本概念
溶出度与溶出曲线?
溶出度----系指活性药物从片剂、胶囊剂或颗粒剂等制剂在规 定条件下溶出的速率和程度。 规定条件中的时间如果是一点,测得的溶出量就是 单点溶出度;时间如果是连续的多个点,测得的溶出量 按次序连起来就是溶出曲线。
转轴的晃动
篮法:晃动在2.0~5.0mm时,水杨酸和泼尼松标准片溶出比晃动在2.0mm时增加 5% 桨法:晃动在1.0~2.0mm时,水杨酸和泼尼松标准片溶出比晃动在0.5mm时增加 8%和5%
处理方法:
设计时考虑:
转轴杆越短越好 转轴杆实行双点固定,两个固定点距离越大越好,下固定点至杆底的距离越 小越好 检测转轴杆的垂直度 转轴杆应垂直挂放,不得横放,防止变形
四、影响溶出度测定的因素
2、介质的影响
脱气程度
气泡对药物溶出的影响复杂,因药物品种而异,使结果重现性不好
气泡的影响
影响流体力学效应 影响制剂与介质的接触面积 影响筛网的通透性 聚集崩解的颗粒 吸附在杯壁的气泡提供了崩解颗粒的聚集场所
泼尼松标准片在脱气的水中,溶出比未脱气的高约30%
四、影响溶出度测定的因素 3、流体力学的影响 溶出杯一致性(尺寸配套)
二、溶出度测定法在中国药典中的发展
1、方法发展 1985年版 篮法、桨法
1995年版
2、品种发展 1985年版 1990年版 1995年版 2000年版 2005年版 2010年版
溶出度和释放度指导方法

溶出度和释放度指导方法溶出度和释放度是药学领域中对药物溶解和释放性能进行评价的重要指标。
溶出度指的是在特定条件下,固体药物溶解成溶液中的可溶性药物的能力;释放度则是药物从固体制剂中迅速或逐渐释放的程度,并在生理环境中可用于吸收的方式。
在新药研发、药物质量控制和制剂设计中,准确评价药物的溶出度和释放度对于保证药物疗效和安全性至关重要。
本文将介绍溶出度和释放度的基本原理、评价方法以及如何进行指导。
首先,溶出度的评价方法主要包括离线法和在线法两种。
离线法是指将固体药物溶于溶剂中,然后通过分析溶液中的药物浓度来计算溶出度。
常见的离线法有体外流散器法、漏斗法和取样分析法等。
在线法是指通过测量固体药物溶解的速度或离子浓度来评价溶出度,常见的在线法有离子选择电极法和超过饱和法等。
在选择评价方法时,需要根据药物的性质和制剂特点进行选择,并确保评价结果准确可靠。
其次,释放度的评价方法则包括离线法和在线法以及体外-体内相关性评价。
离线法是指将固体制剂放入溶液中,然后通过分析溶液中的药物浓度来计算释放度。
离线法常用的方法有振荡器法、滚筒法和静态曲线法等。
在线法是指通过测量药物的溶解速度或药物在释放过程中相关参数的变化来评价释放度,常见的在线法有闪光法、荧光法和紫外-可见光谱法等。
体外-体内相关性评价是指通过体外释放度和体内药物吸收性能的相关性来评价释放度。
该评价方法包括体外结构亲和法、体外模型预测法和体外-体内连用法等。
在选择评价方法时,需要根据具体需求和要求进行选择,并综合考虑评价结果的准确性和可行性。
最后,为能够准确评价溶出度和释放度,需要注意以下指导原则:1.选择合适的溶剂和溶出或释放介质,根据药物的溶解性质和释放机制进行选择。
例如,根据药物的疏水性或亲水性选择适当的溶剂和pH值。
2.控制测试条件的一致性,例如温度、搅拌速度和介质的体积等。
确保在不同批次或不同实验中的条件一致,以保证评价结果的可比性和可靠性。
3.选择合适的评价方法和技术。
溶出度与释放度测定法 PPT

三、溶出度测定法
2.篮法(第一法)
适用范围: 适用于:胶囊、丸剂、片剂、 漂浮的制剂
不适用于:崩解型片崩解后颗粒 下沉的片剂,或粘性 易堵塞筛网的制剂
装置: 篮与转轴:不锈钢或其他惰 性材料 溶出杯:硬质玻璃或其他惰 性材料
操作时,应先降篮,再开电机
三、溶出度测定法
2.篮法
优点: 应用广泛 装置简单、成熟
溶出度-----
溶出度系指活性药物从片剂、胶囊剂或颗粒剂等普通制 剂在规定条件下溶出的速率和程度,在缓释制剂、控释 制剂、肠溶制剂及透皮贴剂等制剂中也称释放度。
溶出度试验-----
是一种控制药物制剂质量的体外检测方法,是以实验为基础,以 溶解为理论,并用数学分析手段处理溶出度试验数据,是研究制剂 所含主药的晶型、粒度、处方组成、辅料品种和性质、生产工艺等 对制剂质量统一性的方法。
二、溶出度测定法在中国药典中的发展
1、方法发展 1985年版 篮法、桨法 1995年版 篮法、桨法、小杯法
2、品种发展 1985年版 7个 1990年版 44个 1995年版 128个 2000年版 205个 2005年版 275个 2010年版 418个
3、仪器发展:第一代:常规溶出度试验仪;第二代:自动取样溶出 度试验仪;第三代:光纤原位实时在线溶出度试验仪
(3)漏槽条件尽可能的模拟胃肠中药物的吸收。
二、溶出度测定法在中国药典中的发展
漏槽条件
漏槽条件是指药物所处释放介质的浓度远小于其饱 和浓度,生理学解释为药物在体内被迅速吸收,制剂的 体外包括释放度等测定需要模仿体内生理条件的,满足 药物溶解-吸收的过程,漏槽条件起到了修正作用,一般 释放介质的体积为药物饱和溶液所需介质体积的3~7倍。 漏槽条件即做溶出的最佳条件,一般情况下我们选择溶 出介质的体积为500ml、1000ml和900ml 。
溶出度三种测定方法

溶出度三种测定方法
溶出度是指药物在给定条件下从固体制剂中溶出的速度和程度,它是评价固体
制剂释药性能的重要指标之一。
溶出度的测定方法有很多种,其中比较常用的有三种,分别是离体溶出法、体外释放法和体内释放法。
离体溶出法是指将已包衣或未包衣的固体制剂置于一定溶出介质中,通过不同
的溶出设备和条件,测定药物在不同时间内从固体制剂中溶出的速度和程度。
这种方法操作简单,重现性好,适用于常规制剂的溶出度测定。
但是,它不能真实反映体内环境对固体制剂溶出的影响,因此在评价缓释、控释和靶向制剂时存在局限性。
体外释放法是指通过模拟人体生理环境,如模拟胃肠道的 pH 值、体温、溶出
介质的流动速度等条件,测定固体制剂在模拟体内环境中的溶出度。
这种方法能更真实地模拟体内环境,对于评价缓释、控释、靶向制剂的溶出性能具有重要意义。
但是,体外释放法的操作相对复杂,需要模拟人体生理环境,因此成本较高。
体内释放法是指通过动物实验或临床试验,直接测定固体制剂在体内的溶出度。
这种方法最能真实地反映固体制剂在体内的溶出情况,对于评价药物在体内的释放性能具有重要意义。
但是,体内释放法的操作较为复杂,需要动物实验或临床试验,因此成本和时间都比较高。
总的来说,不同的溶出度测定方法各有优缺点,选择合适的方法要根据具体的
制剂特性和研究目的来决定。
在实际研究中,可以根据需要综合运用多种方法,以全面评价固体制剂的溶出性能。
同时,随着科学技术的不断发展,我们相信会有更多更准确、更便捷的溶出度测定方法出现,为固体制剂研究提供更多的选择和可能性。
中美英三国药典溶出度、释放度检查方法比较 共32页PPT资料

于规定限度(Q);除另有规定外,Q应为标示量的70%
2
6
6片(粒)中仅有1~2片(粒)低于Q,但不低于Q-10%,且
其平均释放量不低于Q
3
12
6片(粒)中如有1~2片(粒)低于Q,其中仅有1片(粒)
低于Q-10%,但不低于Q-20%,且其平均释放量不低于Q时,应另
取6片(粒)复试;初复试的12片(粒)中有1~3片(粒)低于
1990年版(第22版)增加了测定透皮贴剂的三种装 置桨碟法:(paddle over disk)、筒 法(cylinder)、往复碟法 (reciprocating disk)
2019年版(第23版)仪器增至7种 2000年版(第24版)进一步增加和完善设备
. . . . .
2019年版(第30版) 7种仪器设备 篮法 basket 桨法 paddle 往复筒法 reciprocating cylinder 流通池(流室)法 flow-through cell 桨碟法 paddle over disk 筒法 cylinder 往复架法 peciprocating holder
2.装置四(流通池法)主要用于缓释、难溶剂型的 测试。
3.装置五(桨碟法)和装置六(筒法)专门用于透 皮吸收贴剂的测试。
• 英国药典
1973年版规定了地高辛片的溶出度和释放度检查 1988年版引入溶出度检查法,篮法、桨法 1993年版增加流通池法装置,未规定药物释放度
检查法 2019年版增加透皮每个点测得的释放量,如有1~2片(粒)超出 规定范围,其中仅有1片(粒)超出规定范围的10%,但未超过规 定范围的20%,且其平均释放量未超出规定范围,应另取6片(粒) 复试;初复试的12片(粒)中,在每个时间点测得的释放量,如 有1~3片(粒)超出规定范围,其中仅有1片(粒)超出规定范 围的10%,但未超出规定范围的20%,且其平均释放量未超出规定 范围
释放度和溶出度有区别吗?

释放度和溶出度有区别吗?
想问一下大家,释放度和溶出度有区别吗?溶出度有四条曲线,释放度是不是要做四条释放曲线?
1.
溶出度是针对速释制剂(即普通制剂)而言
释放度是针对缓、控、迟释(肠溶)制剂而言
做四条曲线是指体外相关性
无论速释还是缓释都要做。
2.
释放度和溶出度本质量上是有区别的。
释放度是药物在体释放的速度和程度,释放度有速率的要求,要考虑药物释放的快慢问题,一般来说在分几个时间点(如1小时、3小时、7小时)来考察的,在不同时间段释放的速率是不一样的,不是以一恒定的速率释放。
溶出度没有考察速率的要求,也不分时间点,只要在规定的时间内(如75分种)溶出多少,到达这样的要求。
第9章2 溶出度及释放度【执业药师 药物分析】
活性药物从片剂、胶囊剂或颗粒剂等制剂在规
定条件下溶出的速率和程度。
测定目的
•区分同一药物制剂生物利用度的 差异,是控制固体制剂内在质量 的重要指标之一。 •凡进行此项检查的药品,不再检 查崩解时限。
பைடு நூலகம்
桨法
搅拌装置不同,转速50r /min,其余全部相同。 (用
于胶囊测定时,如胶囊上浮,将胶 囊装入耐腐蚀的金属沉降篮内)
符合下述条件之一者,可判为符合
规定
除另有规定外为70%
结 (1) 6片(粒、袋)中,每片(粒、 果 袋)的溶出量按标示量计算,均不 判 低于规定限度(Q)。 断 (2) 6片(粒、袋)中,有1-2片(粒
由于溶出介质中溶解的气体, 在37℃时会形成小气泡聚集在固体 制剂或颗粒表面,会使它们浮起或 阻止其与介质接触,从而影响药物 的溶出,一般可用煮沸5 ~ 10分钟 来除气,各国药典规定溶出介质的 温度37±0.5℃,并且每只溶出介质 的温度差最大不超过0.5℃。
取样点
• 篮法:转篮顶端至液面的中点,距溶出杯内壁不小于10mm处。 • 桨法:应在桨叶顶端至液面的中点,距溶出杯内壁不小于 10mm处。 • 小杯法:桨叶上端距液面的中间,离烧杯壁不小于6mm处。
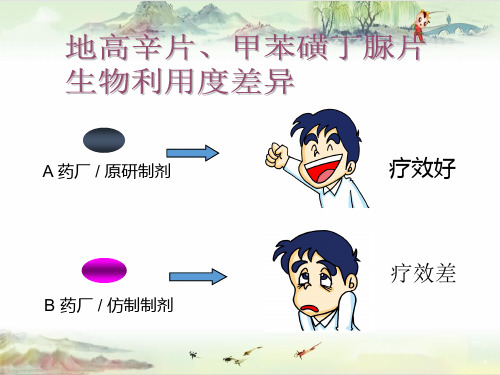
A 药厂 / 原研制剂 B 药厂 / 仿制制剂
疗效好 疗效差
为什么两者会有差异? 为什么两者的血药 浓度会不一致?
仿制药 研发的 瓶颈在 哪里?
药品行业作 为高科技行 业的体现所 在?
犹如“四两拨千斤”
➢ “撬动”了整个日本制药
行业和相关产业的全面发展!
对固体制剂溶 出度的深入研 究和严格要求
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溶出度系指药物从片剂或胶囊剂等固体制剂在规定溶剂中溶出的速度和程度。
释放度系指口服药物从缓释制剂、控释制剂,肠溶制剂及透皮贴剂等在规定溶剂中释放的速度和程度。
溶出度一般是针对普通制剂而言,看药物在一定的时间内是否能够释放出来。
一般测一个点。
释放度主要针对特殊制剂(包括缓控释制剂),测试时最少测三个点,第一个点看药物有没有突释,第二个点是药物释放一半左右的点,主要考察药物释放的特征,第三个点则是考察药物释放是否完全。
难溶药物检查溶出度,易溶药物检查崩解时限,检查溶出度的药物就不需要再检查崩解时限。
1. 对于确定的药物,如何选择“崩解时限”与“溶出度”在上篇指导原则中介绍了固体口服制剂是否建立溶出度的判断方法:
①如果制剂设计为修饰释放,则需建立释放度的标准(包括缓释、控释、胃溶和肠溶等)②如果制剂没有设计为修饰释放,则做如下考察:考察一次剂量的原料药在37±0.5℃,pH1.2-6.8范围内, 在不多于250ml水中是否完全溶解。
如果不溶解,则建立单时间点的溶出度检查标准,如果溶解,则继续考察③以上考察的意义在于原料药的溶解性是综合剂量和胃容量来考虑的, 即验证一次服用量的原料药在胃中(250ml)是否完全溶解。
这使一些溶解性能并不好、但剂量小, 在250ml中可以完全溶解的药品可选择做崩解时限而不做溶出度检查。
③该制剂在15分钟内,在pH1.2、4.0、6.8条件下能否达到80%以上的溶出量。
如果达不到80%的溶出量,则建立单时间点的溶出度检查标准;如果能达到80%的溶出量,则继续考察④③步考察的意义为在考察原料的溶解性能后, 还要考察在该处方和工艺条件下制成的固体口服制剂是否在胃中达到80%以上的溶出量,否则, 溶解性能好的原料, 由于处方工艺影响了制剂溶出, 依然要做溶出度检查。
④崩解时限与溶出度之间有否相关性。
没有的话,则建立单时间点的溶出度检查标准;有的话就建立崩解时限检查标准。
在原料和制剂都达到判断程序的正结果后, 还要考虑制剂的崩解时
(学习的目的是增长知识,提高能力,相信一分耕耘一分收
获,努力就一定可以获得应有的回报)。
