环烷烃的顺反异构对映异构.共51页
环烷烃
加溴化氢、 3.2.2.2 加溴化氢、硫酸
CH3 CH3 HBr CH3 C CH CH3 Br CH3 CH3 C CH CH3 OSO3H
H2SO4
CH3
H2O
CH3
CH3 CH3 C CH CH3 OH
环丁烷、环戊烷等与溴化氢不起反应。 环丁烷、环戊烷等与溴化氢不起反应。
3.2.2.4 氧化
eg.
H 3C
CH3
H
H 3C
H
H
H
CH3
H
H3C
H
1R,2R
CH3
H
H3C
H
1S,2S
H
CH3
H CH3
H
CH3 H
H3C
H
H CH3
H 3C
H 3C
3.1.2 环烷烃的命名
根据环中碳原子的数目叫 (1)单环烷烃: a.根据环中碳原子的数目叫“环某烷”; 单环烷烃: a.根据环中碳原子的数目叫“环某烷” b.环上取代基的位次和编号写在母体环烃名 b.环上取代基的位次和编号写在母体环烃名 字前面, 编号”原则与烷烃相同; 字前面,“编号”原则与烷烃相同; c.若有两个取代基 则在最前面标明“ 若有两个取代基, c.若有两个取代基,则在最前面标明“顺、 反”; 若取代基碳链较长,则环作为取代基。 d.若取代基碳链较长 d.若取代基碳链较长,则环作为取代基。
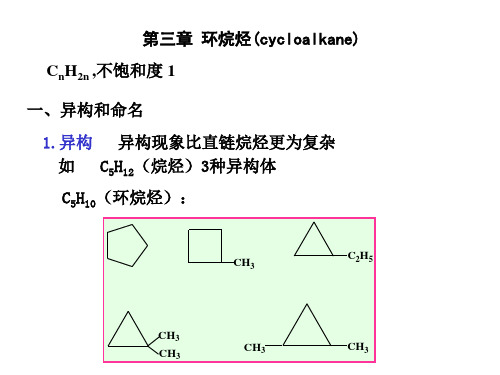
3.1. 1 环烷烃的异构 构造异构:碳链异构、官能团异构、 构造异构:碳链异构、官能团异构、 异构现象 立体异构 位置异构、 位置异构、互变异构 构型异构:顺反异构、 构型异构:顺反异构、对映异构
构象异构: 构象异构:
构型(configuration):在具有一定构造的分子中, 构型(configuration):在具有一定构造的分子中,原 子在空间的排列方式。 子在空间的排列方式。 环烷烃的顺反异构:假定环中碳原子在一个平面上, 环烷烃的顺反异构:假定环中碳原子在一个平面上,以环 平面为参考平面,两取代基在同一边的叫顺式(cis平面为参考平面,两取代基在同一边的叫顺式(cis-), 否则叫反式(trans否则叫反式(trans-)。
环烷烃

• 环烷烃的化学性质
加氢
与卤素反应
+ Cl2
hv
+ Br2 300 ℃
Cl + HCl
Br + HBr
与氢卤酸反应
+HI +HI CH3 +HI
CH3CH2CH2I
CH3CH2CH2CH2I I
CH3CHCH2CH3
反应活性次序 :
• 第三章习题 • 1-1,2,4,5,6 • 3-1,2,5 •5 • 6-1,2,4,5 • 10-1
CH3 CH3
CH3 CH3
优势构象
多取代环己烷有不同取代基时,体积较大 的取代基在e键为优势构象
CH3
CH3
(CH3)2CH
CH(CH3)2
(CH3)2CH
CH3
优势构象
(CH3)2CH
CH3
CH3
(CH3)2CH
优势构象
(CH3)2CH CH3
• 思考题: 写出反-1-甲基-3-叔丁基环己烷的优势构象。
4
315
2
6
a键和e键:
6个a键
6个e键
• a键和e键的转换
H 5H 4H 3
H
H6 1 H2
4 5
3
6
2 1
• 取代环己烷的稳定构象
单取代环己烷一般以取代基在e键的 构象为优势构象
H
5H
4
3
HH
C
H
61
室温
2
4
3
5
2
6
CH3
1
CH3
H
多取代环己烷一般以取代基在e键较多者为 优势构象
CH3 CH3
环烷烃

a键
e键
(3) 相邻两组a键伸展方向相反,一个向上,一个向下,e 键也如此。
a a
e e
e a
a e
e e a a
1
2
3
4
a
e
a 和e键的关系不清晰
5 a 和e 键的关系清晰
3.构象翻转:
Year 1883
Name of scientist Baeyer
1890 H.Sachse 1915-1918 W.M.Mohr
1920
1943 O.Hassel
1950 D.Barton
Point of view
Assumes that six carbon atoms are on the same plane
当环己烷由一种椅式构象翻转为另一种椅式构象时,原
来的a键变成e键,原来的e键变成a键。由于六个碳上连接的 都是氢原子,所以两种椅式构象完全等同。
5
61
43
2
456 3 21
O
O
O
O O O
4O
O1 O
O O
4O O
O O
O
O
O
环上原子或基团的空间关系保持。
O
O O O
O1 O
二. 取代环己烷的构象
3.3 环的张力
一、Bayer’s张力学说
Assumption: 1 成环的碳原子均在同一同面上,且呈正多边形 2 碳原子采取sp3杂化形式,正常键角应为约109.5度 3 为了满足平面正多边形的内角要求,成环的键必须向内或向
环烷烃的异构

2、加溴
+ Br2 hv
+ Br2
+ Br2
BrCH2CH2CH2; HBr
+ HBr
H3C
CH3CH2CH2Br
CH3CH2CHCH3
Br
4、氧化
三元环对氧化剂相对稳定,例如,环丙烷不能使高锰 酸钾溶液退色。含三元环的多环化合物氧化时,三元环可 以保持不变。
O
O
O2 +
O
例题:某烃A,分子式为C5H10,不能使Br2-CCl4溶液 褪色,在光照下与Br2 作用,只得到一种产物B,分子式 为C5H9Br,此化合物与KOH-EtOH溶液加热回流得化合物 C(C5H8)。请推测A,B,C的结构式。
(A)
(B)
Br
(C)
第三节 环烷烃的来源和用途(自学)
补充环烷烃的实验室合成:
CH3
CH3
顺 -1,4-二 甲 基 环 己 烷
CH3
CH3
反 -1,4-二 甲 基 环 己 烷
例题:用CCS命名法命名下列化合物:
(A)
CH3
CH3
C(CH3)3 (B)
解 :(A) 1,1- 二甲基环丙烷 (B) 叔丁基环癸烷
碳环可以简写成相同大小的正多变型,每一个定点 表示一个亚甲基。还上有取代基式,在相应的位置上写 出取代基的编号。
第一节 环烷烃的异构和命名
一、环烷烃的异构
1、构造异构 环烷烃由于环的大小及侧链的长短和位置不同而产生构造
异构体。 最简单的环烷烃含有三个碳原子,它没有异构体;含有四
个碳原子的环烷烃有两个异构体;含五个碳原子的环烷烃有五 个构造异构体。
2、立体异构
构造相同,分子中原子在空间的排列方式不同的化合物互 称为立体异构体。
c3-环烷烃

(2) 不同取代基
例:写出顺-1-甲基-2-叔丁基环己烷的稳定构象。
CH3 (H3C)3C e H H a C(CH3)3 a H H3 C e H
不稳定,因 叔丁基在a键 受到环同边 a-H的排斥力 远大于甲基
e-叔丁基
a-叔丁基
结论:不同取代基时体积大的取代基在e位的构象较稳定,当然也是 ee >ae >aa,若只能为ae式时,则体积大者在e键时比较稳定,即 e(大)a(小)>e(小)a(大)
10
例: 环丙烷分子中环内C-C键之间的夹角为60° (为几何角),要使键角由正常的109°28′→ 60°,必须使两个价键各向内偏转 24°44′= (109°28′- 60°)/2
60°
环烷烃: 分子中价键的 偏转程度:
109°28′ 60° 24°44′
120°
90°
108°
+24°44′ +9°44′
(Cycloalkane )
第三章 环烷烃
1
◇环烷烃 — 分子中C原子以单键互相连接成闭合环 ◇通 式 — CnH2n,链成环需增加一个C-C单键,同时减少两个H,与烯 烃为同分异构体
一、环烷烃的异构和命名
1.环烷烃的异构
◇环烷烃构造异构产生的原因: ◎环的大小
◎侧链的长短和位置
◎顺反异构(cis-trans-isomerism)
30
作业
一、第三版P41问题3.1 (1)(3)(4) (第二版P45) 二、第三版P54问题3.5 (1)(2)(3)(4) (第二版P59) 三、补充题:有一饱和烃,其分子式位C7H14,并只含有一个一级碳原 子,写出该化合物可能的结构式并命名之。
31
补充:十氢化萘的构象
有机化学课件-3-环烷烃

105.5o,H-C-H键角114º:
HH
C
H
H
CC
H
H
C-C弯曲键电子云重叠面积较链状烷烃的小,故键的稳定性
较低。
(二)环丁烷和环戊烷:
环丁烷与环丙烷相似,C-C键也是弯曲的,C-C-C键角约111.5º, 其中四个C不在同一平面。呈信封式结构。
十氢萘有两种顺反异构体:
H
顺式:
或
H
H
反式:
或
H
Bp(0C) 187.3
195.7
顺式的构象: 反式的构象:
a
H
e
H H
e
e
H
反式的十氢萘内能更低一些;
H
H
Pd
500oC
H
H
9%
91%
4
5
6
7
8
△ H[(CH2)n]
n
-697.1 -686.2 -664 -658.6 -662.4 -663.6
(kJ/mol)
从环烷烃的开环反应条件(见本章§2)及燃烧热数据可以看出: 环丙烷最不稳定,环丁烷次之,环戊烷比较稳定,环己烷以上的 大环都稳定,这反映了环的稳定性与环的结构有着密切的联系。
H
H
HH
H
HH
H
环戊烷分子中,C-C-C夹角为108°,接近sp3杂化轨道间夹角
109.5°,环张力甚微,是比较稳定的环。因此,环戊烷的化学性
质稳定。
H
H H
H
H
H H
H HH
(三)环己烷
所有键的键角都接近于理想sp3杂化的109.50,故最稳定;
第三章环烷烃
(2 0 0 p m )
CH3
取代基的体积越大,e键的比例越高
C(CH
3)3
~100%
2) 二取代环己烷的构象
CH3 E=10.4 kJ/mol CH3 CH3 CH3
试比较顺式和反式 1,4-二甲基环己烷的稳定性。
H3 C CH3
CH3 a CH3 a
1-甲基螺[3.4]辛烷
2.编号从连接螺碳的小环的碳开始; 3.将编号和取代基名称写在螺字前.
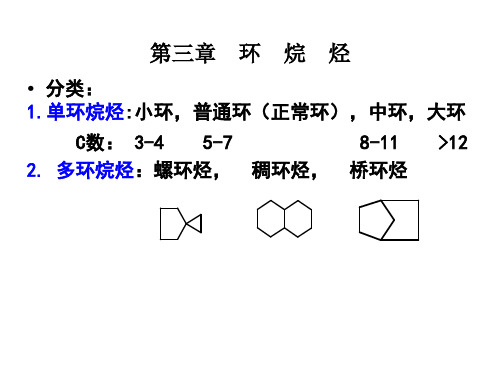
2.桥环烃
两个环共用两个或两个以上碳原子的多环烃。两 个碳原子之间的距离叫桥,桥的交点为桥头碳。
二环[1.1.0]丁烷 bicyclo[1.1.0]butane
CH
3
二环[2.2.1]庚烷 bicyclo[2.2.1]heptane
四元环
60°
9 °44′
0 ° 44′ -5 °16 ′
五元环 六元环
109° 8′ 2
解释了小环化合物的性质,大环化合物的出现否 定了该学说。因六元环以上的环烷烃的碳原子能以正 常的键角成键,因此稳定性很高。
2.张力因素
引起分子不稳定的因素
范德华张力 非键原子之间的距离较近时引起的排斥作用。 角张力 键张力 扭转张力
信封式
4.环己烷及其衍生物的构象 (1) 环己烷的构象 极端构象: A)椅式构象 透视式
H 2 H H 1 H H 250pm H 3 H H 5 H H 4 H H
椅式
船式 纽曼投影式
H
H
H
H H
6 1
H H H
2 5
H H
4
H
6
交叉型
3
有机化学-环烷烃

CH3
CH3
H
H
H3C H
CH3 H
H3C
CH3
顺-1,3-二甲基环戊烷 (cis-1, 3-dimethylcyclopentane)
CH3 H H3C
H
镜
H
面
CH3
CH3
CH3
H3C
CH3
顺反异构体
H CH3
➢ 顺反异构用“顺” 或“反”注明基团相 对位置。 英文用 “cis”和“trans”表示。
萘 naphthalene
O
莰烷
2-莰酮(樟脑)
camphane camphor
§3.2 环烷烃的物理性质和化学反应
一、物理性质
环烷烃的bp. mp.和相对密度比同碳原子数的直链烷烃高。 例题:将下列化合物按沸点降低的顺序排列: (1)丁烷(2)己烷(3)3-甲基戊烷 (4)2-甲基丁烷(5)2,3-二甲基丁烷(6)环己烷
解:(6)(2)(3)(5)(4)(1)
二、化学性质 饱和环烷烃对强酸、强碱、强氧化剂稳定
自由基取代反应(普通脂环烃具有开链烃的通性 )
Br2
30 0 ℃
CH3
光
Cl2
Br HBr
CH3
Cl
HCl
小环化合物的特殊性质 —— 易开环加成
➢ 小环化合物的催化加氢
H2 / Pt, 50oC or Ni, 80oC
环烷烃:碳干为环状而性质与开链烷烃相似的烃类。
§3.1 环烷烃的异构和命名
一、分类 环烷烃的类型
(单)环烷烃
通式:CnH2n
(与烯烃通式相同)
桥环烃(稠环) 桥环烃
螺环烃
小 环 ( C3、 C4)
环状化合物的顺反异构

环状化合物的顺反异构概述定义环状化合物是一类分子结构中含有一个或多个环状结构的有机化合物。
其中,环状结构由原子间的共享键连接而成。
顺反异构是指在环状化合物中,一个或多个官能团相对于环的位置的不同排列方式。
重要性环状化合物的顺反异构在有机化学中具有重要意义。
它们能够影响分子的物理性质和化学性质,从而对分子的反应性以及生物活性产生影响。
研究和理解环状化合物的顺反异构对于设计合成新药物、开发新材料以及理解化学反应机制等方面具有重要的应用价值。
顺反异构的两种形式顺异构顺异构是指在环状化合物中,官能团相对于环的位置是连续排列的形式。
例如,苯环上的取代基可以在顺位(1,2-位)或者次顺位(1,3-位或1,4-位)。
顺异构的性质顺异构体具有相似的物理性质和化学性质。
它们的融点、沸点等物理性质可能略有差异,但一般而言,它们的化学性质并无明显差别。
顺异构体的分离顺异构体的分离通常较为困难。
因为它们具有相似的物理性质,传统的分离方法如晶体化学、蒸馏法等往往无法有效区分。
异构体的比例顺异构体的比例可以通过在反应过程中引入手性诱导剂(手性控制剂)或者利用非对映选择性酶进行选择性反应等方法来调控。
反异构反异构是指在环状化合物中,官能团相对于环的位置是交替排列的形式。
例如,苯环上的取代基可以在反位(1,3-位或1,4-位)。
反异构的性质反异构体与顺异构体在物理性质和化学性质上有明显不同。
由于官能团位置的差异,反异构体的分子结构和空间构型也有所不同,从而导致其物理性质和化学性质的差异。
反异构体的分离反异构体的分离相对较为容易。
由于它们具有不同的物理性质,可以通过常规的物理分离方法,如晶体化学、蒸馏法等来实现。
异构体的比例反异构体的比例可以通过在反应过程中引入手性诱导剂(手性控制剂)或者利用非对映选择性酶进行选择性反应等方法来调控。
环状化合物顺反异构的影响因素环状化合物的顺反异构受多种因素的影响。
下面将介绍其中的几个重要因素。
掌握环烷烃的构造异构和顺反异构及其命名方法;

掌握环烷烃的构造异构和顺反异构及其命名方法;第三章环烷烃教学目的与要求:1. 掌握环烷烃的构造异构和顺反异构及其命名方法;2. 了解环烷烃的物理性质,掌握环烷烃的化学性质;3. 理解环的张力;4. 掌握环己烷和取代环己烷的的构像;5. 了解多环烃命名方法。
教学重点、难点:环烷烃的化学性质;环己烷和取代环己烷的的构像。
环烷烃是指分子中碳原子以单键互相连接成闭合的碳环,剩余的价完全与氢原子相连。
将链烃变为环烃,要在分子中增加一个碳-碳单键,同时减少两个氢原子,因此,单环烷烃的通式为CH。
n2n ? 3.1环烷烃的异构和命名3.1.1 环烷烃的异构1. 构造异构:环烷烃由于环的大小,侧链的长短及位置的不同而产生构造异构体。
CH 无构造异构 36CH 48CH 5102. 顺反异构1,4-二甲基环己烷分子中,两个甲基可以在环平面的同侧,也可以在环平面的异侧,形成顺反异构:HCHHH3CHCH33CH3H顺反异构体由于环的存在,不能互变(断键)。
其物理性质有差异。
13.1.2 环烷烃的命名1.单环体系1)根据环中碳原子数目叫做环某烷。
2)有取代基时,编号应使取代基位次尽可能小。
3)有不同取代基时,编号从小基团开始。
CH3CHCH3CHCHCH2331-甲基-3-乙基环戊烷 1-甲基-4-异丙基环己烷 2. 顺反异构体命名时,取代基在环平面同侧称顺式(cis-),异侧称反式(trans-)。
HCHHH3CHCH33CH3H顺-1.4-二甲基环己烷反-1.4-二甲基环己烷为书写方便,环烷烃常用键线式:戊烷 3-环己基己烷?3.2 环烷烃的物理性质和化学反应3.2.1 环烷烃的物理性质环烷烃的熔点、沸点和比重都较相应的开链烷烃高。
因环烷烃的环状结构,分子较有序,排列较紧密,分子间作用力较大。
而直链烷烃分子自由摇摆,有序度小,分子间作用力较弱,故熔点、沸点和比重较小。
3.2.2 环烷烃的反应环烷烃与直链烃结构相似,所表现出的化学性质也相似(常温下,不与强酸、强碱、强氧化剂、强还原剂起反应,可以起燃烧、热解、卤代等反应)。
高中化学《环烷烃》课件

H2O
CH3 CH3 H3C C CH CH3
OH
四元环及四元环以上的环烷烃与HX,H2SO4 不易发生反应
相当 于烷对氧化剂稳定,不 被高锰酸钾、臭氧、氧气 等氧化剂氧化
O
O
CO2H
O O
可用高锰酸钾溶液来区 别烯烃与环丙烷衍生物
性质小结
▪小环烷烃(3,4元环)易加成,难氧 化,似烷似烯。
L-(-)-乳酸 mp: 53°
构象异构:
H
CH3 H
H CH3CH3
H
HH
H
CH3
H
对位交叉 邻位交叉
3.1.3 环烷烃的命名
(1) 根据分子中成环碳原子数目,称为环某烷。 (2) 单取代的环烷烃,将取代基的名称写在环烷烃的名称前面。 (3) 多取代的环烷烃则须加以编号。编号时,由小基团所在碳
原子编起,沿着距第2个取代基最近的环边依次编号。当环 上有不饱和键时,从不饱和键处开始编号。 (4) 取代基位次按“最低系列”原则列出,基团顺序按“次序 规则”小的优先列出。 (5) 有顺反异构时,须标明。
+ HBr CH3
+ HBr
+ H2SO4
CH3CH2CHCH3 Br
CH3 CH3
H3C C CH CH2
Br
H
CH3 CH3 H3C C CH CH2
OSO3H H
不对称取代环丙烷与不 对称试剂进行加成开环 反应时,环从取代基最 多和最少的环边打开, 氢加在氢多的碳上,卤 素或试剂的负电荷部分 加在氢少的碳上
多的构象。 4°环上有不同取代基时,大的取代基在e键上构
象最稳定。
§3.4 多环烃
3.4.1 多环烷烃的命名
有机化学 第4章 环烃

H3 C
H
H
H
CH3
H3 C
H
H
H3C
H
CH3
H
H
CH3
H CH3
H
CH3 H
H3 C
H
H CH3
H3 C
H3C
2.系统命名
(1) 单环体系 脂环烃的命名,是在同数目碳原子的开链烃名称前加 “环”字,取代基的名称和位次写在环烷烃的名称前面。
分子中有不饱和碳碳键,命名时应使不饱和键上的碳
编号最小。 碳原子编号时,应使取代基的位次尽可能最小。 若取代基碳链较长,则环作为取代基。
1,2,4-三甲苯 (偏三甲苯)
1,3,5-三甲苯 (均三甲苯)
(4) 对结构复杂或支链上有官能团的化合物,也可把支 链作为母体,苯环当作取代基命名.
CH3 CH3-CH2-CH-CH-CH3
2-甲基-3-苯基戊烷
CH=CH2
C=CH
CH 3-C=CHCH3
苯乙烯 (乙烯基苯)
苯乙炔
2-苯基-2-丁烯
(5) 芳基,苯基,苄(bian)基
芳基--芳烃分子的芳环上减去一个H后的基团叫芳基,用 “Ar”表示. 苯基--苯分子上减去一个H后的基团叫苯基,用“Ph”表示.
苄基--甲苯的甲基上减去一个H,叫苯甲基或苄基:
4.2.2苯环的结构
(一) 凯库勒结构式
• 苯的分子式: (C6H6)
(1)不易发生加成反应, (2)而容易起取代反应, (3) 一取代产物只有一种.
KMnO4/H+
(2) 氯化反应
—比较两种反应的条件
•苯环侧链上的H取代,自由基型取代反应:
CH3
Cl2 日光或热
环烷烃的顺反异构对映异构.

• ·手性化合物的光学特性
• 必须清楚的几个概念:
• 物质是集合、宏观概念,分子是单体、 微观概念。
• 由一种构型的手性分子组成的物质有旋 光性。
• 手性分子组成的物质不一定有旋光性
• 2.手性和对称性
• 判断分子有无手性的方法有:
• ·2 对称中心(center of symmetry):假 想分子中有一个点,如果离中心相等距 离遇到相同原子或原子团。该中心点就 是该分子的对称中心,用i表示。
• 对称分子
• ·凡具有对称面或对称中心任一对成元素 的分子就属于对称分子,没有手性。
• ·通常如果分子中只有一个原子连接有四 个不同的基团或原子,该分子一定是手 性分子,没有对称因素。连接四个不同 基团或原子的原子称为手性中心、一般 是碳原子,但也可以是N、P、Si As等。
• ·手性化合物的特点: • 结构:镜像与实物不重合。 • 内能相同(左、右旋)
• 物理性质与化学性质在非手性环境中相 同,在手性环境中有区别。
• 旋光能力相同,但旋光方向相反。
• 3. 手性分子构型表示法
• 构型是表示分子中原子或基团在空间 的排列,手性分子构型就是表示手性碳 原子相连的四个原子或基团在空间的排 列。它的表示方法有:
得到的投影式与原来投影式都表示同一 构型。
• ⅰ与 ⅲ表示同一构型。 • 通过上述方法,可以从若干个Fisher投
影式式中,判断那些代表同一构型化合 物,那些是不同的化合物。 • • 4、 手性化合物的构型标记:
• D/L构型标记法(相对构型):
• 下面是甘油醛的一对对应体,一个使偏 振光偏振面向右旋转某个角度,是右旋 体,用(+)表示;另一个是左旋体,用 (-)表示。
c3-环烷烃

作业
一、第三版P41问题3.1 (1)(3)(4) (第二版P45) 二、第三版P54问题3.5 (1)(2)(3)(4) (第二版P59) 三、补充题:有一饱和烃,其分子式位C7H14,并只含有一个一级碳原 子,写出该化合物可能的结构式并命名之。
31
补充:十氢化萘的构象
双环[4.4.0]癸烷
Br
开环加成
Br
+
(4) 加HBr
例:
H3C CH3
Br2
CH3
+
HBr
(H3C )2 C Br
C H(C H 3) 2
1,1,2-三甲基环丙烷
在含H最少C与含H最多C间断裂,Br-加到含H最少C上
8
(5)氧化 例:
CH3 CH2 C CH2
+
CH3
KMnO4
H+
?
答:
CH2 C O
+ CO2,
不被氧化。
10
例: 环丙烷分子中环内C-C键之间的夹角为60° (为几何角),要使键角由正常的109°28′→ 60°,必须使两个价键各向内偏转 24°44′= (109°28′- 60°)/2
60°
环烷烃: 分子中价键的 偏转程度:
109°28′ 60° 24°44′
120°
90°
108°
+24°44′ +9°44′
e CH(CH3 )2 e型 97% H H a型 3% H a C
主要为e型
CH3 CH3
③叔丁基环己烷:几乎完全为e 型
e C(CH3 )3 e型 > 99.99% H H H3 C a型 < 0.01% a C CH3 CH3
