5 环烷烃
5--环烷烃

109°28′,无张力;
七到十二个碳原子组成的环烷烃,环内氢原子间的扭 转张力使它们的稳定性略有下降;
当环进一步增大时, 稳定性与环己烷相似。
环二十二烷
1 顺反异构
环烷烃环中C-C单键受环约束不能自由旋转,导致产生 顺反异构。
CH3 CH3 H H
CH3 H H CH3
顺-1,2-二甲基环丙烷
比一般C-C键短
轨道夹角105.5° 说明: C-C键被弯曲了
环丙烷分子轨道图
环丁烷
从环丁烷开始,成环碳原子均不在同一平面上。
蝴蝶型(环丁烷)
信封型
扭曲型
环戊烷分子中,碳碳键的夹角为
108°,接近sp3杂化轨道间夹角,
角张力很小,是比较稳定的环。
环戊烷
环己烷分子不在同一平面上,碳原子之间的键角为
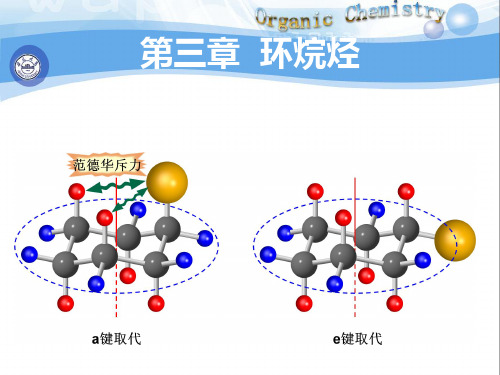
e键
同类型键: 邻位指向相反, 间位指向相同。
3 取代环己烷的构象
(1) 一元取代环己烷的构象 一元取代环己烷中,取代基占据e键的构象更稳定。
CH3
室温
CH3
5% 95%
原因:a键上的甲基和环同一边相邻的两个a键氢原子
距离较近,存在较大的斥力。
这种斥力称为范得华张力。
0.233nm
H H
H H
0.255nm
C
H
H
0.30nm
H
氢分子
H
(2) 二元取代环己烷的构象
稳定的构象是e键上取代基最多的构象,若取代基不
同时,大的取代基在e键上的构象最稳定。
1,2-二取代:
CH3
CH3 CH3
CH3
CH3
CH3 C(CH3)3
C(CH3)3
(CH3)3C
有机化学 第三章 环烷烃
张力学说( 一、Baeyer张力学说(strain theory) 张力学说 )
假定成环碳原子都在同一平面上 并排成正多边形。 同一平面上, ※ 假定成环碳原子都在同一平面上,并排成正多边形。 碳原子间的夹角必偏离正常键角。这种由于键角偏离 碳原子间的夹角必偏离正常键角。 正常键角而引起的张力称为角张力。 正常键角而引起的张力称为角张力。 角张力 。 碳环中碳原子键角偏离正常键角越大,角张力越大, ※ 碳环中碳原子键角偏离正常键角越大,角张力越大, 分子越不稳定,反应活性也越大。 分子越不稳定,反应活性也越大。
E
CH3 CH3 CH CH3
CH3 CH3
1
4-甲基环己烯 5-乙基-1,3-环己二烯 - -乙基- , -
顺-1,3-二甲基环丁烷 , -
第二节 环烷烃的性质
一、物理性质
n = 3,4 , 气态 n=5 ※状态 液态 n≥6 固态 ※m.p.: 环烷烃比直链烷烃能够更紧密地排列于晶格中 .: 同数碳原子的直链烷烃。 故m.p.>同数碳原子的直链烷烃。 同数碳原子的直链烷烃 0.688<d<0.853 ※d: 环烷烃不溶于水 ※s: 环烷烃不溶于水
在不同的环烃中键角大于或小于109° ,而正常的SP ※在不同的环烃中键角大于或小于 °28′,而正常的 3 杂化轨道之间的夹角为109°28′即C-C之间的电子云没有达 ° 即 - 之间的电子云没有达 杂化轨道之间的夹角为 到最大程度的重叠。 到最大程度的重叠。 1
( 109 °2 8′- 6 0°) = 24°64′ - ) 2 1 ( 1 09°28 ′- 90 °) = 9 °44 ′ - ) 2 1 ( 109 °2 8′- 1 08°) = 0°44′ - ) 2 1 1 09°28′- 120 °) = -5°1 6′ - ) 2(
有机化学第章烷烃和环烷烃

脂环烃:碳原子之间相互连成环,其性质类似链烃 的碳氢化合物。
脂环烃
饱和脂环烃,又称环烷烃,通式:CnH2n
不饱和脂环烃
环烯烃 环炔烃
单环脂环烃:分子中只有1个碳环。 环丙烷
环丁烷
分子中含有两个或两个以上碳环结构的脂环烃称为双环或 多环脂环烃。
两个碳环共用一个碳原子的脂环烃,称为螺环烃(spiro hydrocarbon)。“螺”字表示两个碳环只共用一个碳原子,此 碳原子称为螺原子。
Alkyl group names are obtained by removing the –ane from the alkane name , and replacing it with -yl
中文名 英文名 中文名 英文名 甲烷 methane 甲基 methyl 乙烷 ethane 乙基 ethyl 丙烷 propane 丙基 propyl 丁烷 butane 丁基 butyl
2. 编号:从第一桥头(共用碳原子)开始,沿最长桥路到第二桥 头,再沿次长桥路回到第二桥头,然后编最短的桥路。(先编大 桥,再编小桥)。取代基的位置最小。
3.命名: 某基二环[n.m.p]某烷。 n.m.p---指各桥路上碳原子数。
2 1
3
7
4
6
5
8 6
4 5
7 1
2
3
1-甲基二环[4.1.0]庚烷
Homolog
同系物: 同系列中各化合物互称同系物。
同系列差:相邻两个同系物在组成上的不变差数 CH2。
烷烃中的伯、仲、叔、季碳原子。
伯碳原子:只与1个碳原子直接相连的碳原子。 (primary) 也称一级碳原子,以1° 表示。 仲碳原子:只与2 个碳原子直接相连的碳原子。 (secondary) 也称二级碳原子,以2 ° 表示。 叔碳原子:只与3 个碳原子直接相连的碳原子。 (tertiary) 也称三级碳原子,以3 ° 表示。 季碳原子:与4个 碳原子直接相连的碳原子。 (quaternary) 是四级碳原子,以4 ° 表示。
立体化学 第5章 环烷烃
1,2,4-三甲基环己烷
C. 必要时须注明立体构型;
D. 复杂化合物也可将环的部分当作取代基。
顺-1,2-二甲基环丙烷 反-1,3-二甲基环丁烷
4-环戊基庚烷
(2) 多环化合物的命名:
(命名较为复杂, 以二环化合物为例). A. 参加成环的总碳原子数作为母体烃; 如有8个碳原子,则称为辛烷 B. 简单桥环可用“二环”、“三环”等作词头; C. 二环“连接”处的碳原子为桥头碳原子; D. 从桥头碳原子处,由大环开始编号;将各“桥”所含的碳原子 数写入方括号中(注意:桥头C原子都不可计入)。
2) 环戊烷的构象
环戊烷的结构是以拆叠的形式存在,四个C原子基本在一 平面上,另一个C则在平面之外,这种构象称为信封式构象。 环戊烷由于以“信封式”构象存在,使分子张力较小,化学性 质较稳定。
3) 环己烷的构象及构象分析
i) 椅式和船式构象
椅式
船式
船式构象相对能量较高, 不稳定,通过C-C键扭曲, 使其成为扭曲式(或称为扭 船型)。这种构象相对于船 式能量低。
角张力---由于键角偏离正常键角 而产生的张力。
环丙烷的三个C在同一平而上,相邻两个C上的C-H键都是重叠式构象, 相互拥挤,产生排斥,也具有较高的能量。
扭转张力---由于重叠式构象而产生的张力。
4. 环烷烃的构象和构象分析
1) 环丁烷的构象
环丁烷的四个C不在同一平面上,形如蝴蝶。即通过C-C键的扭转而以 一个拆叠的碳环存在。 环丁烷的三个C原子分布在同一平面,另一个C取于平面之外。 环丁烷的这种存在形式可使环的张力降低,但仍然是一个不稳定分子。
(1)分子中有两个平行的平面,C1、C3、C5和C2、C4、C6;
(2)12个氢原子分成两类:一类与分子对称轴平行,即垂直于环平面,称为
有机化学:第五章 环烷烃

? CH3 C CH3 CHC3H3
CH3 H3C CHC3H3
e, a构象
e, a构象
33
1,3-二取代环己烷的构象
CH3
CH3
CH3 CH3
CH3 CH3
e, a构象
CH3 CH3
H3C
CH3
a, a构象
e, e构象,优势
34
小结:
1°环己烷有两种极限构象(椅式和船式),椅式为优势构象。 2°一元取代基主要以e键和环相连。 3°多元取代环己烷最稳定的构象是e键上取代基最多的构象。 4°环上有不同取代基时,大的取代基在e键上构象最稳定。
1885年,Baeyer提出了张力学说(strain theory):
a. 形成环的C原子都在同一平面上,并排成正多 边形; b. 在不同环中C-C键之间的夹角小于或大于正四 面体所要求的角度:109°28′; c. 环中C-C键键角的变形会产生张力,键角变形 的程度越大,张力越大,环的稳定性低,反应活 性越大。
+
Cl2
+
Cl2
+
Cl2
+
Br2
+
Cl2
hv hv 300 oC hv hv
Cl Cl
Cl Br
Cl
10
氧化反应
KMnO4
O + CO2H
O3
( Z)
Zn/H2O
OHC
CHO
11
中小环的加成反应
加氢反应
+
H2
+
H2
+
H2
Ni 80 oC
Ni 100 oC
Pt 300 oC
环烷烃(环丙烷、环丁烷、环戊烷、环己烷)的构象

环烷烃的构象链状化合物的构象是由基团绕C—Cσ键旋转产生的;而环状化合物的构象至少涉及到两个C—Cσ键和其键角的转动和变化,有时还涉及到键长和键角的变化,比较复杂,常称环的翻转。
一、环丙烷的构象环丙烷是三个碳的环,只能是平面构象,即它的构型。
尽管只有一种构象,但这个环极不稳定,主要因为:1、所有C-H键都是重叠构象,扭转张力大。
2、C原子是不等性杂化或弯曲键,有“角张力”存在。
二、环丁烷的构象环丁烷有两种极限构象:动画演示:平面式构象:象环丙烷一样,不稳定,存在扭转张力和“角张力”。
蝶式构象:能缓解扭转张力和角张力,呈蝶式构象。
通过平面式构象,由一种蝶式翻转成为另一种蝶式构象,处于动态平衡。
蝶式是优势构象。
也有扭转能力和角张力存在。
三、环戊烷的构象环戊烷的构象主要是信封式和半椅式构象。
两者处于平衡。
因为平面构象能量较大,一般认为环戊烷采取这种构象可能性很少。
E相对=19kJ/mol 信封式半椅式四、环己烷的构象环己烷的构象经过近百年的努力才建立起来。
Baeyer 1885年提出张力学说,认为环状化合物是平面构型Sachse 1889年质疑张力学说只适合小环,提出环已烷有船式、椅式两种构象。
Hassel 1930年利用偶极矩测定法和电子衍射法研究环已烷构象,∠CCC=109.5°,气相、液相中环已烷几乎全是椅式构象。
Barton 1950年发展了构象理论,以甾族化合物为对象提出构象分析,把构象分析明确地引入有机化学中。
Hassel 和Barton获1969年Nobel化学奖1、椅式和船式构象环已烷保持碳原子的109.5°键角,提出了椅式和船式构象.1)椅式构象:C1、C2、C4、C5在一个平面上,C6和C3分别在平面的下面和平面的上面,很象椅脚和椅背,故称“椅式”。
2)船式构象:C1、C2、C4、C5在一个平面上,C3和C6在平面上面。
形状象只船,C3和C6相当船头和船尾,故称“船式”。
环烷烃(环丙烷、环丁烷、环戊烷、环己烷)的构象

环烷烃的构象链状化合物的构象是由基团绕C—Cσ键旋转产生的;而环状化合物的构象至少涉及到两个C—Cσ键和其键角的转动和变化,有时还涉及到键长和键角的变化,比较复杂,常称环的翻转。
一、环丙烷的构象环丙烷是三个碳的环,只能是平面构象,即它的构型。
尽管只有一种构象,但这个环极不稳定,主要因为:1、所有C-H键都是重叠构象,扭转张力大。
2、C原子是不等性杂化或弯曲键,有“角张力”存在。
二、环丁烷的构象环丁烷有两种极限构象:动画演示:平面式构象:象环丙烷一样,不稳定,存在扭转张力和“角张力”。
蝶式构象:能缓解扭转张力和角张力,呈蝶式构象。
通过平面式构象,由一种蝶式翻转成为另一种蝶式构象,处于动态平衡。
蝶式是优势构象。
也有扭转能力和角张力存在。
三、环戊烷的构象环戊烷的构象主要是信封式和半椅式构象。
两者处于平衡。
因为平面构象能量较大,一般认为环戊烷采取这种构象可能性很少。
E相对=19kJ/mol 信封式半椅式四、环己烷的构象环己烷的构象经过近百年的努力才建立起来。
Baeyer 1885年提出张力学说,认为环状化合物是平面构型Sachse 1889年质疑张力学说只适合小环,提出环已烷有船式、椅式两种构象。
Hassel 1930年利用偶极矩测定法和电子衍射法研究环已烷构象,∠CCC=109.5°,气相、液相中环已烷几乎全是椅式构象。
Barton 1950年发展了构象理论,以甾族化合物为对象提出构象分析,把构象分析明确地引入有机化学中。
Hassel 和Barton获1969年Nobel化学奖1、椅式和船式构象环已烷保持碳原子的109.5°键角,提出了椅式和船式构象.1)椅式构象:C1、C2、C4、C5在一个平面上,C6和C3分别在平面的下面和平面的上面,很象椅脚和椅背,故称“椅式”。
2)船式构象:C1、C2、C4、C5在一个平面上,C3和C6在平面上面。
形状象只船,C3和C6相当船头和船尾,故称“船式”。
下列环烷烃

下列环烷烃环烷烃是一群重要的有机物质,其特性常被用于制造各种用途的物质。
它们主要是碳原子和氢原子组成的环烃结构,可以是含有两个至八个碳原子的环状结构,也可以是含有更多碳原子的非环状结构,下面就是一些常见的环烷烃:1、二环烷烃:主要有氧化萘、萘和芘,这些分子中的碳原子由两个碳原子组成,特征是两个碳原子可以连接在一起;2、三环烷烃:主要有芴、吡和苯,它们的碳原子由三个组成,特征是三个碳原子环状连接在一起;3、四环烷烃:主要有芘、特芘和蒽,它们的碳原子由四个组成,具有四个碳原子环状连接的特点;4、五环烷烃:主要有喹啉、芘和唑,它们的碳原子由五个组成,具有五个碳原子环状连接的特点;5、六环烷烃:主要有芘和芘烯,它们的碳原子由六个组成,以及有六个碳原子环状连接的特点;6、七环烷烃:主要有吡嗪和苯并唑,它们的碳原子由七个组成,以及有七个碳原子环状连接的特点;7、八环烷烃:主要有吡咯和亚油酸吡咯,它们的碳原子由八个组成,以及有八个碳原子环状连接的特点。
环烷烃在有机物质的分子结构中具有重要的意义,它们的性质决定了它们在化学合成中的重要作用。
环烷烃由碳原子和氢原子环状连接形成,这种结构使它们具有强烈的立体选择性,这也是它们在有机反应中有特殊作用的一个重要原因。
此外,环烷烃还具有表面活性,其表面活性可以改变溶液的动力学、物理和性质等特性,从而对化学反应有重要作用。
环烷烃也用于制造润滑油,保护机械部件免受磨损和摩擦。
有些润滑油的制造方法是使用环烷烃,它们具有良好的润滑性、抗磨擦性和抗渗透性,这样就可以保护机械部件的表面不被摩擦磨损。
此外,环烷烃在制药工业中也有重要应用,它们具有抗菌作用,因此常被用于制造抗菌药物。
环烷烃也可以用于制造着色剂、防腐剂、光稳定剂和抗氧化剂等,此外它们还可以用于制造某些高分子化合物,并可以用于生物化学,如用于抗病毒疗法、细胞增殖促进剂和荷尔蒙类药物等。
综上所述,环烷烃是一种重要的有机物质,它们具有重要的化学特性和应用,如润滑剂、保护剂、防腐剂、抗氧化剂、着色剂和制造高分子化合物等,它们还有一定的医药价值,如抗菌药物和抗病毒药物等。
环烷烃的结构及环的稳定性

5
1
6
0.18nm
1
4
5
6
4
3
2
3
2
——环己烷及其衍生物的构象——
(3)直立键a、平伏键e与稳定构象
(A)何为a、e
键
ay
ea
a e
e
a
e a
a
e
e
a
a
a
e
e
a
a
e
e e
e
a
书写时右面三个e键向右
伸,左面三个e键向左伸。
——环己烷及其衍生物的构象——
H H
H H
H H
H H
H H H H
红色键为直立键(a键),蓝色键为平伏键(e键)。
5.5.3 脂环烃的性质
环烷烃的沸点、熔点和相对密度都较含同
数碳原子的开链脂肪烃为高。
表5-2 一些环烷烃的物理常数
名称 环丙烷
熔点/℃
-127.6
沸点/℃ 相对密度(d420)
-32.9
0.720(-79℃)
环丁烷
-80
12
0.703(0℃)
环戊烷
-93
49.3
0.745
甲基环戊烷 -142.4
H
H
H
H
H
115°
H
H
H
H
H
H
重叠构象
——环烷烃的结构与稳定性——
5.5.2 环己烷及其衍生物的构象 (1)影响构象稳定性的因素 (A)角张力
键角与成键轨道角度不相符. (B)扭转张力
sp3杂化碳交叉构象稳定,若有偏差,有扭回
交叉构象的扭转张力. (C)范德华力
有机化学-环烷烃

1
1
2
2 3
➢ 取代基位置数字取最小
3 4
1, 3-二甲基环己烷
1, 3-dimethylcyclohexane
1-甲基-4-异丙基环己烷
4-isopropyl-1methylcyclohexane
CH3
CH3
H
H
H3C H
CH3 H
H3C
CH3
顺-1,3-二甲基环戊烷 (cis-1, 3-dimethylcyclopentane)
桥头碳原子
10 2
9
1
3
8
6
4
7
5
十氢萘
环的数目
桥头间的碳原子数
(用"."隔开)
二环[4. 4. 0]癸烷
bicyclo[4. 4. 0]decane
组成桥环的 碳原子总数
✓桥 头 碳:几个环共用的碳原子, ✓环的数目:断裂二根C—C键可成链状烷烃为二环;断裂三根C—C
键可成链状烷烃为三环 ✓桥头间碳原子数:不包括桥头C,由多到少列出 ✓环的编号方法:从桥头开始,先长链后短链
椅式构象
H
H
3
H
H
2
1
H H4
56
H H
H
H
H
H
H H3
4
H H
H
5
1H
6
2H
H
C4-C3
C6-C1
交叉式
2.50nm
H
H
HH
H~H之间距离均大于
HH H
H H
H
2.49nm
H
H的Van der Waal’s半
c5氢化树脂成分

c5氢化树脂成分
C5氢化树脂,也称为C5热塑性树脂,是通过对C5石脑油(一种石油裂解产物)进行氢化处理而得到的树脂。
这种树脂主要由碳数为5的烯烃、烷烃和芳烃组成,其主要成分可以包括:
1.环烷烃(环烷烴):这类化合物是由碳数为5的环烷烃组成,
例如环戊烷等。
2.烷烃(直链烷烴):直链烷烃也是C5氢化树脂的组成部分,其
中碳数为5的烷烃可能包括正戊烷等。
3.烯烃(烯烴):C5氢化树脂中可能还包含碳数为5的烯烃,例
如戊烯等。
4.芳烃(芳香烃):芳烃是含有芳香环结构的碳氢化合物,也可
能是C5氢化树脂的成分之一。
C5氢化树脂由于其化学结构的多样性,具有优异的粘合性、耐候性和耐化学性,常用作涂料、胶粘剂、印刷油墨、沥青改性剂等工业应用中的原材料。
具体的成分比例和性质可能会因生产厂家、生产工艺和用途而有所不同。
如果需要详细的成分信息,建议查阅相关厂商的技术资料或联系生产厂家获取准确的数据。
有机化学环烷烃

总 张力能
n(Hc/n-659) 114 108 25 0 21 40 54 50 44 12 13 0 15 16
24
从上表数据可以看出: C3~C4 员 环:不稳定 C5、C7~C11员环:较稳定(稳定性相近) ≥C12 员 环:很稳定 C6 员 环:最稳定
拜耳的张力学说对六员以上的环失 去了预见性,原因是它的基本假定:成环 碳原子都在同一个平面上(除三员环外) 是错误的。
椅型
船型
31
环己烷椅型构象
环己烷船型构象
32
所有的键处于交叉式 椅式构象稳定的原因:
H H H H
5
H H
3
6
H
2
H
1
H H
H
4
H
H H
H
6 5
H
CH2 CH2
4
1
H
2 3
H
H H
在船式构象中,所有的C-H键处于重叠式。
H HH
4 5 6
H H H
1
H H
6 5
CH2 CH2
4
1
2 3
H H
H H 3 H
1
环 烷 烃
第一节:环烷烃的分类、命名及同分异构 第二节:环烷烃的化学性质 第三节:环烷烃的结构 第四节:环己烷的构象 第五节:取代环己烷的构象 第六节:十氢化萘的构象
2
第一节 分类、命名与同分异构
一、分类:
单环烃
3-4 员 5-7 员 8-11员 小环 普通环 中环 大环
饱和脂环烃
12 员
多环烃
(1).单螺环的命名
1、靠近螺C开始编号(不含螺C), 2、先小环后大环,方括号内先小后大 3、 环除螺原子外的环碳原子个数,数字间用
第四章__环烷烃

环上有取代基或不饱和键时,从靠近取代基或不饱和键 的桥头开始编号,沿最长桥编到另一桥头,然后再沿次 长桥编回到起始桥头,最短桥最后编,有等长桥时尽可 能使取代基或不饱和键编号较小
7
1
6
2
54 3
2,7,7-三甲基二环[2.2.1] 庚烷 5,6-二甲基二环[2.2.2]-2-辛烯
2)螺环的命名 螺原子:两个环共用的碳原子
螺[4.5]-1,6-癸二烯
1-甲基螺[3.5]-5-壬烯
第二节 环烷烃的性质
一、物理性质
与相应链烃变化规律相似,熔点、密度等略高于烷烃
二、化学性质
具有烷烃的类似性质,部分环烷烃还具有烯烃的加成性质 催化加氢:
与卤化氢的加成:
HBr CH3CH2CH2Br CH3CH2CH2CH2Br
HBr X
反式邻二取代:
顺式对二取代: 反式对二取代:
反式-1-甲基-3-叔丁基环己烷的最稳定构像是怎样的?
CH3 H
H C(CH3)3
H CH3
C(CH3)3 H
最大基1,4环己二醇的最稳定构象是怎样的?
H HO O
4 H
1H
HO 4
H
H 1OH
六、环烷烃构像的表示方法
H原子的范德华半径为120pm
椅 式 扭 船 式 船 式 半 椅 式
a键
a键:直立键(竖键) (axial bonds)
e键
e键:平伏键(横键) (equatorial bonds)
• a键转变成e键,e键转变成a键 • 环上原子的空间关系保持
三、一取代环己烷的构像
椅式还是船式? 椅式中取代基处于e键还是a键?
三元环 < 四元环 < 五元环 • • • • • •
环烷烃知识讲解
12
四. 环己烷及其衍生物的构象
1. 环己烷的构象 极端构象:
1)椅式构象
椅式
船式
H 2 H
250pm H3H
H 4 H
HH H
H
6
2
H
H 1 H
H6
H
H
5
H
1 H5 4
H
H
H
3H
H
H
扭船式
• 不存在: 空间张力; 扭转张力; 角张力。
13
1. 单环烃的命名
①按成环碳原子数目称为环某烷。
CH2 CH2 CH2 环丙烷
CH2 CH2
CH2 CH2 环丁烷
CH2 CH2 CH2
CH2 CH2
环戊烷
② 若环上有多个取代基时,编号从较小的取代基开始, 且使取代基的位次最小。(最低系列、次序原则)
1-甲基-4-丙基环己烷
4
3
或
5
2 1
1-甲基-3-乙基环戊烷 2
与正常键角偏差角度
49.5o
19.5o
1.5o
环烷烃
三元环
四元环
五元环
但是五元以上的环会不会因环数增大而不稳定?
四元环
五元环
六元环
10
近代共价键理论解释环的稳定性
电子云 偏向环平面 外侧,容易 受等亲电试 剂进攻,故 似烯烃进行 加成反应。
弯曲键(香蕉键)
共价键的形成是由于原 子轨道相互交盖的结果,交 盖程度越大,键越稳定。
Br
Br
20
3.环丙烷对氧化剂稳定
KMnO4 / H+
COOH
5 环烷烃

一.环烷烃的分类和命名 (一).环烷烃的分类
单环
1.根据碳环数目 双环
桥环
螺环
稠环
多环
2. 按环的饱和度
饱和脂肪烃
小环 普通环 中环
3、4C 5~7C 8~12C
大环 >12C
不饱和脂肪烃
环烯烃 环炔烃
O
O N
N
苦参碱
OH OH
薄荷醇
麝香酮
OH
CH3 COOH
7
1
6
2
2,7,7-三甲基二环[2.2.1] 庚烷
54
3
2,7,7-trimethylbicyclo[2.2.1]hepyane
a). 母体:按成环总碳原子数称某烃,桥环个数冠于词头, 称“二环[ ]某烃”。
b). 编号:自第一个桥头碳始沿最长的桥编号到另一个桥头碳,再 沿次长桥回到第一个桥头碳,最短的桥最后编号。若环 上有取代基时,应从靠近取代基的桥头开始编号。
Br + HBr
三. 环烷烃的结构与稳定性
• 角张力(拜尔张力):与正常键角偏差而引起的张力。
环烷烃
三元环 四元环 五元环 六元环
与正常键角偏差角度 49.5o 19.5o 1.5o
0o
• 扭转张力:基团避免在同一平面内而扭转所引起的张力。
环烷烃 扭转张力
三元环 大
四元环 五元环
较小
小
六元环 无
四. 环己烷及其衍生物的构象 1. 环己烷的构象
CH3
5%
95% e
平衡有利于-CH3处于e 键的构象(优势构象)
H(120pm) CH3(200pm) H
CH3
第二节 环烷烃

偏转角度= 偏转角度= 2
N = 3 偏转角度
24° 24°44’
4
9°44’
5
4°4’
6
-5°16’
7
-9°33’
从偏转角度来看,五员环应最稳定, 从偏转角度来看,五员环应最稳定,大于五员环或小于五 员环都将越来越不稳定。但实际上,五员, 员环都将越来越不稳定。但实际上,五员,六员和更大的环型 化合物都是稳定的。这就说明张力学说存在缺陷。 化合物都是稳定的。这就说明张力学说存在缺陷。
CH 3 H最 多 和 含 H最 少 的 两个碳原子之间。 加成规律: 遵循不对称加成规律。
17/77
2、取代反应
hν
+ X2 X = Cl、Br X X
3、氧化反应: 氧化反应:
+ KMnO4 不反应
可与烯烃或炔烃区别开来。
+
O2
Co+ + , P
1.2 环烷烃
环烷烃的分类、 一 、环烷烃的分类、异构和命名 环烷烃 脂环烃 环烃 环烯烃 环炔烃 单环芳烃 芳 烃 多环芳烃 非苯芳烃
1/77
单环烷烃 桥环烷烃 螺环烷烃 集合环烷烃
单环烷烃的通式: 单环烷烃的通式:CnH2n
单 环 烷
n = 3, 4 3, n = 5, 6 5,
小
环
常见环 中 环
反-1-甲基-3甲基乙基环己烷
注:当环上有复杂的取代基时,碳环作为取代基 当环上有复杂的取代基时,
CH2CH2CH2CHCH2CH3
4-甲基-1-环丙基己烷 甲基CH3
7/77
CH3 C 2H 5
2
CH3
1 5
CH3
1 6 5
C2H5
环烷烃
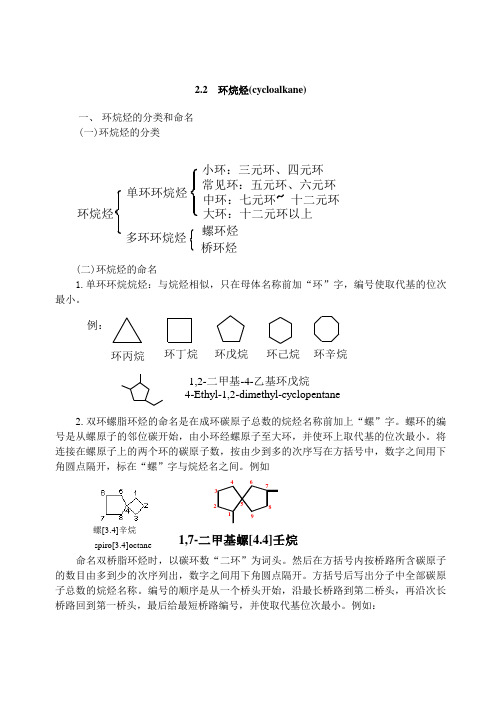
2.2 环烷烃(cycloalkane)一、环烷烃的分类和命名(一)环烷烃的分类小环:三元环、四元环中环:七元环十二元环大环:十二元环以上常见环:五元环、六元环单环环烷烃螺环烃桥环烃环烷烃多环环烷烃(二)环烷烃的命名1.单环环烷烷烃:与烷烃相似,只在母体名称前加“环”字,编号使取代基的位次最小。
环丙烷环丁烷环戊烷环己烷环辛烷4-Ethyl-1,2-dimethyl-cyclopentane1,2-二甲基-4-乙基环戊烷例:2.双环螺脂环烃的命名是在成环碳原子总数的烷烃名称前加上“螺”字。
螺环的编号是从螺原子的邻位碳开始,由小环经螺原子至大环,并使环上取代基的位次最小。
将连接在螺原子上的两个环的碳原子数,按由少到多的次序写在方括号中,数字之间用下角圆点隔开,标在“螺”字与烷烃名之间。
例如螺[3.4]辛烷spiro[3.4]octane命名双桥脂环烃时,以碳环数“二环”为词头。
然后在方括号内按桥路所含碳原子的数目由多到少的次序列出,数字之间用下角圆点隔开。
方括号后写出分子中全部碳原子总数的烷烃名称。
编号的顺序是从一个桥头开始,沿最长桥路到第二桥头,再沿次长桥路回到第一桥头,最后给最短桥路编号,并使取代基位次最小。
例如:1,7-二甲基螺[4.4]壬烷1-甲基二环[4.1.0]庚烷 二环[2.2.2]辛烷1-methylbicyclo[4.1.0]heptane bicyclo[2.2.2]octane二、环烷烃的结构与稳定性 (一)拜尔张力学说o28'60o90o(1)碳原子成环时都处于同一平面,即具有平面的分子结构。
(2)根据正四面体的模型,假设成环后键角为109º28′的环状化合物不仅稳定,而且容易形成。
角张力:SP 3杂化的C 形成环丙烷时每个键必须向内偏转24º44′,形成环丁烷则须偏转9º44′,它们都有恢复稳定的正四面体结构的趋势,即键的偏转使分子内部产生了张力,这种张力是由于键角的偏转而产生,故称角张力。
05环烷烃

3、直立键(a键)、平伏键(e键)
与分子的对称轴平行的键叫直立键或a键(axial bond) 与直立键形成接近109.5°夹角的键,叫平伏键或e 键(equatirial bond) 环己烷中六个碳原子所处的空间看作是一个较厚的平面 的话,那么六根C-H键是竖立在它的上下,称为直立键(a 键).另外六根C-H键横卧在它的四周,称为平伏键(e 键).
Bacyer讨论环张力时,是采取平面结构时的键角,即使碳 环中的碳原子在同一平面内,得出三角形每个角60°,四边形 夹角为900 正五边形的夹角是108°,正五边形的夹角(108°) 非常接近四面体的夹角。因此,环戊烷基本上没有张力. 2 、根据现代共价键 以sp3轨道成键,其夹角要求应是109.5°,碳原子之间的轴 和轨道的轴无法在同一条线上,环碳之间只得形成一个弯曲的 键(香蕉键),使整个分子像拉紧弓一样,有张力。
练习: 写出下列化合物的最稳定构象
C(CH 3)3 H CH 3 H
ቤተ መጻሕፍቲ ባይዱC2H5 H H3C H H CH(CH3)2
H3 C H
CH3 H H CH3 CH3 H
C(CH 3)3 H H OMe OMe H
HO H
H H OH H
H Cl H H
5.脂环化合物的顺反异构
由于环的存在,限制了环的碳碳 键不能自由旋转,当两个碳原子 连接上基团时,就存在顺反异构 现象. 如:十氢萘有两种顺反异构体, 两个环己烷分别以顺式和反式稠 合。反式比顺式稳定。
5.4 环己烷的构象
一、环丁烷和环戊烷的构象
电子衍射研究说明,环丁烷四个碳原子不在同一平面上, 形如蝴蝶,两"翼"上下摆动。 环戊烷的碳原子在同一平面上, 所有的氢都成重叠型,扭转张力 很大 (约58KJ/mol)因此, 避开重叠式构象而采取非平面结 构,在能量上有利,非平面结构 可以用信封式和半椅式两种作代 表。
c5~c12脂肪烃和环烷烃

c5~c12脂肪烃和环烷烃
C5到C12脂肪烃和环烷烃是一类碳链长度在5到12之间的烃类化合物,分为两大类:脂肪烃和环烷烃。
脂肪烃(Aliphatic Hydrocarbons):脂肪烃是开链烃类,其碳原子形成直链。
以下是C5到C12的一些脂肪烃:
●C5烷:Pentane(戊烷)
●C6烷:Hexane(己烷)
●C7烷:Heptane(庚烷)
●C8烷:Octane(辛烷)
●C9烷:Nonane(壬烷)
●C10烷:Decane(癸烷)
●C11烷:Undecane(十一烷)
●C12烷:Dodecane(十二烷)
环烷烃(Cycloalkanes):环烷烃是碳原子形成环状结构的烃类化合物。
⏹C5环烷:Cyclopentane(环戊烷)
⏹C6环烷:Cyclohexane(环己烷)
⏹C7环烷:Cycloheptane(环庚烷)
⏹C8环烷:Cyclooctane(环辛烷)
⏹C9环烷:Cyclononane(环壬烷)
⏹C10环烷:Cyclodecane(环癸烷)
⏹C11环烷:Cycloundecane(环十一烷)
⏹C12环烷:Cyclododecane(环十二烷)
这些化合物通常用于石油和燃料工业中,也可用于有机合成和其他化学过程。
脂肪烃和环烷烃在结构和性质上有所不同,但它们都属于碳氢化合物的大类。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H
H
HH
(CH3)3C H
H H H CH3
H
H
(3)多取代环己烷的顺反异构,以二甲基取代为例:
CH3
H CH3
H (a,e)
顺-1,2-二甲基 环己烷
H
H3C H3C
H (e, e)
H CH3
H
CH3 (e, e)
反-1,2-二甲基 环己烷
顺-1,3-二甲 基环己烷
H CH3
CH3
H (e, a)
B. 当有2个取代基时, 则从含碳最少的取代基开始编号,并以 最小和数为原则;
CH3
CH2CH3
CH3
1-甲基-3-乙基环己烷
CH3
CH3
1,2,4-三甲基环己烷
C、不饱和脂环烃中,把1,2位留给不饱和键;
CH3
CH(CH3)2
CH3
3-甲基环戊烯
CH3 1-甲基-3-异丙基环己烯
5-甲基环辛炔
D. 必要时须注明立体构型; E. 复杂化合物也可将环的部分当作取代基。
5
a键 e键
(1)分子中有两个平行的平面,C1、C3、C5和C2、C4、C6;
(2)12个氢原子分成两类:一类垂直于环平面,一类与环平 面平行。
环己烷的椅式构象分析
(3)环己烷的椅式构象也可用纽曼投影式表示
(4)a-键与e-键间可以通过环的翻转而相互转化。
❖在转环的过程中,原来的a键全都变成e键,原来的e键 全都变成a键。
C. 含5个碳原子的环烷烃有5个构造异构体。
(2) 由于环的存在阻碍了单键的旋转,故而环烷烃有顺反异 构体。
A. 三元环
CH3
CH3 CH3
H
B. 四元环
H
H
顺-1, 2-环丙烷
H
CH3
反-1, 2-环丙烷
3) 命名 (1) 单环烷烃
A. 简单环烃的命名与烷烃相似,只需加 “环”字即可;
环丙烷 环丁烷 环戊烷
反-1,3-二甲基 环己烷
H
H
CH3
CH3 H
CH3
(e, a) CH3
(e, e) H
顺-1,4-二甲基 环己烷
反-1,3-二甲基 环己烷
4) 十氢萘的构象
X
X
X
H√
〤
(4)氧化
KMnO4 H+
KMnO4 H+
CO2H
But:
Co, Cat. + O2 100oC, 10 atm
CO2H CO2H
3、小环的“张力”学说和环烃的稳定性
105.5º
60º
H
114º
H
3. 环烷烃的构象和构象分析
1) 环丁烷的构象
❖环丁烷:也存在角张力,但比环丙烷的小。 为了避免扭转张力,四个碳原子不在一个平面上,但碳 氢键仍不能达到交叉式构象,所以还存在扭转张力。
X X
4)取代环己烷的构象分析 (1)单取代环己烷以取代基为e-键的构象最稳定;
H
H CH3
H H
H H
H H
H
H
H
H
H
HH
H
H
H
HH
CH3
H
H
(2)有多个取代基时,以较多取代基为e-键的构象稳定; 若取代基不同时,以较大的取代基为e-键的构象稳定;
H (CH3)3C
H HH
HH
CH3 H
H
H
H
H H
H H
H
H H
H
2) 环戊烷的构象
❖环戊烷:碳碳键的夹角为108º,接近sp3杂化轨道间夹角, 角张力很小。 为避免扭转张力,以折叠式构象存在。
H
H
H
H H
H H
H
H H
这种构象的张力很小,化学性质较稳定。
3) 环己烷的构象及构象分析 椅式 船式
扭曲式
环己烷的椅式构象分析
2
1
6
4 3
2)按环中键的类型分:环烷烃、环烯烃、环炔烃等
(2) 多环化合物
螺环烃
桥环烃
稠环烃
螺原子 桥头碳原子
小环:3-4;普通环5-7;中环8-11;大环:≥12
2) 异构
(1)由于环的大小及取代基位置的不同而有各种构造异构体; A. 三元环最简单, 无构造异构体; B. 含四个碳原子的环烃,仅有两个构造异构体;
or
(2) 加卤素
+ X2
25oC 1 atm
XCH2CH2CH2X
+ X2 1 atm XCH2CH2CH2CH2X
X2 = Cl2, Br2
But: or
hv + Cl2 + Br2 300oC
Cl + HCl
Br
Br
or
(3) 加HX
+ HX
H
X = Cl, Br, I.
But:
H
+ HX
8CH2
3
CH2
6
5
4
2
3
பைடு நூலகம்
1
7 Cl
4
6 Cl
5
7,7-二氯双环[4. 1. 0]庚烷
E. 螺环由小环开始编号;
4 5
1
6
3
螺[2. 4]庚烷
7
2
立方烷
棱型烷
十氢萘
金刚烷
三环[3. 3. 1. 13. 7] 癸烷
2. 环烷烃的物理性质和化学性质
1) 物理性质 物态:常温下,C3~C4 为气体; C5~C10 为液体; > C12 为固体. 沸点:较含同数碳原子的烷烃高; 比重:较含同数碳原子的烷烃高, 但 < 1.
(2) 多环化合物
命名较为复杂, 以二环化合物为例.
A. 将参加成环的总碳原子数作为母体烃; 如有8个碳原子, 则称为辛烷。
B. 简单桥环可用“二环”、“三环”等作词头;
C. 二环“连接”处的碳原子为桥头碳原子;
D. 从桥头碳原子处,由大环开始编号;将各“桥”所含的
碳原子数写入方括号中。 7
1
2
二环[3. 2. 1]辛烷
第五章 环烷烃
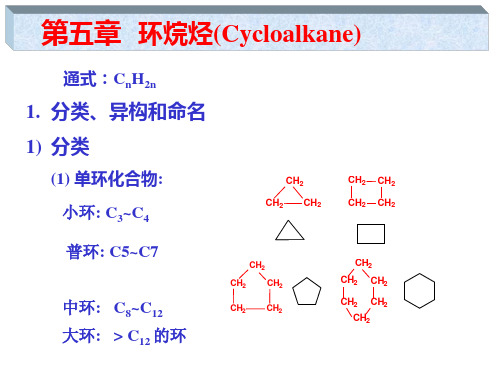
通式:CnH2n 1. 分类、异构和命名
1. 按碳环数分类
(1) 单环化合物 1)(环大小) 小环 C3~C4
CH2 CH2 CH2
CH2 CH2 CH2 CH2
普环 C5~C7
CH2
CH2
CH2
CH2
CH2
中环 C8~C12 大环 > C12 的环
CH2 CH2 CH2
CH2 CH2 CH2
2) 化学性质——(大环似烷,小环似烯) 一般与烷烃相似,但由于“张力”的存在,小环化合
物具有一些特殊性, 易开环。
(1) 催化加氢
+
H2
Ni, 40oC 1 atm
CH3CH2CH3
Ni, 100oC + H2 1 atm CH3CH2CH2CH3
Pt, 300oC
or
+ H2 1 atm
CH3CH2CH2CH2CH3
