干扰物试剂盒
试剂盒的种类和使用

试剂盒所采用的测定方法特异性好、灵敏度、准确度、 精密度符合卫生部临床检验中心、IFCC、WHO等推荐 的指标。 准确度:测定值与真值的相符合程度,常表 示为真值与测定结果之差,单位与结果单位 试剂盒的储存期至少为1年。 一致,或为真值的百分比,常以“不准确度” 水溶性、低粘度、无腐蚀、无毒害、不爆炸、不易燃、 表示,目前使用标准差SD来评价 不污染环境。 所用标准品或标准参考物符合卫生部临床检验中心、 IFCC、WHO推荐的标准和要求。
按试剂组成分类
单试剂优缺点
优点: 操作简便适用于各类生化分析仪,节约试剂位 缺点: 配方复杂(稳定剂、掩蔽剂),稳定性差,不 能完全避免内外源物质干扰。
按试剂组成分类
双试剂的特点
(1)可较彻底排除样品空白和内外源干扰物 (2)更加符合酶偶联反应的特性和过程 (3)试剂配方简单 (4)试剂稳定,便于储存,运输和使用 (5)可用抑制法直接测定某些同工酶
按试剂组成分类
单试剂 液体单试剂就是将某种生化检验项目所用到的试剂科学 地混合在一起,组成为一种试剂。应用时,只须将标本 和试剂按一定比例混合,即可进行相应的生化反应,然 后用适当的方法检测结果。 双试剂 液体双试剂就是将某些生化检测项目所用到的试剂,按 用途科学地分成两类,分别配成两种试剂,通常第一试 剂加入后可起到全部或部分消除某些内源性干扰的作用, 第二试剂为启动被检测物质反应的试剂,两种试剂混合 后才共同完成被检项目的生化反应。
液体双试剂的优点
增强了工作试剂的稳定性: 试剂组分高度均一:不必冻干复溶,避免了干粉试剂复溶时所用蒸馏水污染杂 质的干扰作用。避免了干粉试剂盒分装,冻干,复溶过程中引起的瓶间差,提 高了测定的精密度和准确度.
试剂盒性能评价
降钙素原(PCT)测定试剂盒(磁微粒化学发光免疫分析法)产品技术要求puenguangde
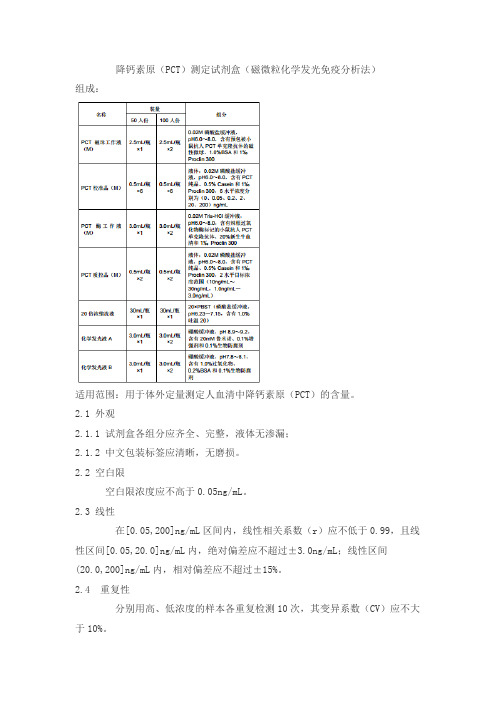
降钙素原(PCT)测定试剂盒(磁微粒化学发光免疫分析法)组成:适用范围:用于体外定量测定人血清中降钙素原(PCT)的含量。
2.1 外观2.1.1 试剂盒各组分应齐全、完整,液体无渗漏;2.1.2 中文包装标签应清晰,无磨损。
2.2 空白限空白限浓度应不高于0.05ng/mL。
2.3 线性在[0.05,200]ng/mL区间内,线性相关系数(r)应不低于0.99,且线性区间[0.05,20.0]ng/mL内,绝对偏差应不超过±3.0ng/mL;线性区间(20.0,200]ng/mL内,相对偏差应不超过±15%。
2.4 重复性分别用高、低浓度的样本各重复检测10次,其变异系数(CV)应不大于10%。
2.5 准确度将纯品配制的溶液(A)加入到人源样本(B)中,其回收率应在85%~115%之间。
2.6 分析特异性将下表规定浓度的干扰物质用试剂盒进行测定,检测结果的浓度值不得超过0.05ng/mL。
2.7 溯源性根据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供校准品的来源、赋值过程及测量不确定度等内容。
校准品溯源至企业工作校准品,并与已上市产品比对赋值。
2.8 质控品赋值有效性本试剂盒质控品的测定结果应在质控范围内。
2.9 批间差用3个批号的产品分别检测同一份样本,3批产品间的相对极差(R)应不大于15%。
2.10稳定性试剂盒在(2~8)℃储存条件下的有效期为12个月,试剂盒在规定的条件下保存,取到效期后的试剂盒进行检测,检验结果应符合2.1、2.2、2.3、2.4、2.5、2.6的规定。
胶体金检测试剂盒使用方法

胶体金检测试剂盒使用方法胶体金检测试剂盒是一种常用于生物医学研究和临床诊断中的实验试剂。
它利用胶体金颗粒与待检测物质发生特异性反应,通过观察胶体金颗粒的颜色变化来判断待测物质的存在与浓度。
下面将介绍胶体金检测试剂盒的使用方法。
1. 样品制备首先,我们需要准备待测样品。
具体制备方法根据不同的实验目的和待测物质而有所不同。
通常情况下,样品可以是血液、尿液、唾液等生物液体,或者是细胞培养上清液、细胞裂解液等。
2. 样品处理在使用胶体金检测试剂盒之前,需要对待测样品进行处理。
处理方法可以包括稀释、过滤、还原等步骤。
这些步骤的目的是为了提取和浓缩待测物质,同时排除其他干扰物质,以保证最终结果的准确性。
3. 试剂准备接下来,我们需要准备胶体金检测试剂盒的试剂。
试剂通常包括胶体金溶液、稀释缓冲液、控制品等。
根据试剂盒的要求,按照指定比例将试剂与样品混合。
4. 检测操作将混合好的样品和试剂溶液滴于胶体金检测试剂盒提供的检测条或孔板上。
确保每个样品和试剂的滴加顺序和时间相同,以保证结果的比较性。
5. 反应时间待检测物质与胶体金颗粒发生反应后,需要等待一定的时间让反应充分进行。
反应时间通常为几分钟到几十分钟不等,根据试剂盒的要求进行具体操作。
6. 观察结果观察胶体金颗粒的颜色变化。
正常情况下,胶体金颗粒呈现红色或紫色,与胶体颜色浓度成正比。
若待测物质存在,胶体金与待测物质发生特异性反应后,溶液颜色会发生变化,比如出现蓝色或者不规则沉淀。
7. 结果分析根据试剂盒上的说明书或者标准曲线,将观察到的颜色变化与已知浓度的标准物质进行比较,从而得到待测物质的浓度。
根据需要,还可以通过光密度计等仪器来量化测定。
总结:以上是胶体金检测试剂盒的使用方法。
使用者在操作过程中应当注意保持试剂的新鲜性和操作的准确性,避免与其他物质产生交叉反应,以确保检测结果的准确性和可靠性。
同时,还应当仔细读取试剂盒上的使用说明和注意事项,确保按照规定进行操作。
干扰物试剂盒

商品号/79370 干扰物检查A PLUSInterference Check.A Plus说明干扰物检查A PLUS试剂盒是用于检测胆红素(游离型、结合型)、溶血、乳糜等物质对检查结果影响程度的干扰物检查用的专用试剂盒。
制品成分1、胆红素*F(游离型)--------------2mL*12、胆红素*F(空白)---------------2mL*13、胆红素*C(结合型)--------------2mL*14、胆红素*C(空白)---------------2mL*15、溶血血红蛋白----------------2mL*16、溶血血红蛋白(空白)------------2mL*17、乳糜--------------------2mL*18、乳糜(空白)----------------2mL*1使用方法各瓶用精制水2mL溶解,当天使用。
(根据所需添加浓度不同,精制水量不同)操作方法1、溶解后的样本(干扰物质)1.0ml和事先准备好的混合血清9.0ml混合制成样本A2、溶解后的样本(空白)1.0ml和事先准备好的混合血清9.1ml混合制成样本B3、样本A和样本B按以下表格配制稀释系列对照 1/10 2/10 3/10 4/10 5/10 6/10样本A----0.10.20.30.40.50.6样本B 1.00.90.80.70.60.50.47/10 8/10 9/101样本A0.70.80.9 1.0样本B0.30.20.1----4、对以上稀释系列进行检测组成1、胆红素*F(游离型)T-BIL#牛蛋白 3.2g/dLTris.缓冲液 Ph8.5100mmol/L2、胆红素*F(空白)牛蛋白 3.2g/dLTris.缓冲液 Ph8.5100mmol/L3、胆红素*C(结合型)T-BIL/D-BIL#牛蛋白 4.0g/dLTris.缓冲液 Ph8.020mmol/L4、胆红素*C(空白)牛蛋白 4.0g/dLTris.缓冲液 Ph8.020mmol/L5、溶血血红蛋白溶血血红蛋白#蔗糖10g/dL6、溶血血红蛋白(空白)蔗糖10g/dL7、乳糜甘油三脂850mg/dL磷脂质910mg/dL游离脂肪酸620uEq/L牛蛋白 2.5g/dLTris.缓冲液 Ph7.020mmol/L8、乳糜(空白)牛蛋白 2.5g/dLTris.缓冲液 Ph7.020mmol/L #参照各成分浓度表本次实验所用批号及浓度批号:ZS5001胆红素*C(结合型)187mg/dl溶血血红蛋白4900mg/dl乳糜14700度。
试剂盒基础知识)

按试剂组成分类
单试剂优缺点
优点: 操作简便适用于各类生化分析仪,节约试剂位 缺点: 配方复杂(稳定剂、掩蔽剂),稳定性差,不
能完全避免内外源物质干扰。
按试剂组成分类
双试剂的特点
(1)可较彻底排除样品空白和内外源干扰物 (2)更加符合酶偶联反应的特性和过程 (3)试剂配方简单 (4)试剂稳定,便于储存,运输和使用 (5)可用抑制法直接测定某些同工酶
不污染环境。 所用标准品或标准参考物符合卫生部临床检验中心、
IFCC、WHO推荐的标准和要求。
试剂盒的类型
按剂型分类 按试剂组成分类 按发展阶段分类 按是否为专用包装分类 按适用通道的不同分类
按剂型分类
干粉试剂
将各组份溶于液体中分装再冻干,或用球磨粉碎、或混合后 打成片剂,用前再加入指定量的缓冲液使其溶解(称复溶), 这种类型的试剂称为干粉试剂。
按是否为专用包装分类
专用包装试剂:7060、7170、贝克曼包装等 非专用包装试剂
按适用通道的不同分类
封闭通道:性 可靠性
实用性
标本类型 操作要求 服务要求:电力供应,通风环境,试剂处理等 消耗品要求 技术职能要求 成本 分析速度 一般问题 如临床应用价值、试剂的效期、包装规格是否
重点选择的几个指标
准确度 通常以回收率、定值血清的靶值范围、对照试验及干扰 试验的结果来分析判断。
精密度 试剂的瓶间差异、批内精密度和批间差异三组测定的平 均值之间应无显著差异,否则,试剂盒的均一性不符合 要求。
线性范围 指该试剂盒按其说明使用时可准确测量的范围。
抗干扰作用 双试剂型试剂盒主要优点是抗干扰作用。
常用监测物质的特性
1.NADH辅酶I或NADPH辅酶II:
试剂盒基础知识.

试剂盒测定基本方法 速率法(Rate):
◇测光点一般设置在加入启动因子并孵育一段时间后开 始,持续1-3min。 ◇一般应用于酶类项目。 ◇可以使用因数法来计算待测浓度。
试剂盒测定基本方法 固定时间法
◇测光点设置在加入启动因子后,分前后两点。 ◇多用于免疫比浊法类项目
终点法(End Point):
可靠性(试剂盒基本性能指标)
准确度:测定值与真值的相符合程度 精密度:同一标本用同一方法在同样条件下多次重复测 定所得各次结果之间或各次结果与均值之间的相符合程 度。 线性范围(分析范围) 干扰性 灵敏度:化学反应中能检出的最小量 稳定性 特异性 方法学性能(IFCC,酶法 ,HDL,LDL方法等)
质控品
IFCC的定是专门用于质量控制目的的标本或溶液,不 用于校准,对稳定性、瓶间差要求高。分定值和不定值 两种。 质控品选择: ◇应该选择有几个浓度的、浓度范围分布较宽的、最好 是医学决定水平的、有可报告范围范围是上下限值的质 控品。 ◇人血清基质,以减少基质效应;无传染性;成分分布 均匀,瓶间差小;液态及冻干品复溶后稳定性性对要好。
试剂盒基础知识
试剂盒的概念
把某一项临床生化分析测定项目的试剂及辅助用品配套 组装在一起,各组分在较长的保存期内稳定使用时按试 剂盒中的说明书操作。
试剂盒的要求
试剂盒所采用的测定方法特异性好、灵敏度、准确度、 精密度符合卫生部临床检验中心、IFCC、WHO等推荐 的指标。 试剂盒的储存期至少为1年。 水溶性、低粘度、无腐蚀、无毒害、不爆炸、不易燃、 不污染环境。 所用标准品或标准参考物符合卫生部临床检验中心、 IFCC、WHO推荐的标准和要求。
试剂盒测定基本方法 三大方法
试剂盒检测方法

试剂盒检测方法
试剂盒检测方法是一种常用的实验室技术,用于检测特定物质的存在或浓度。
它广泛应用于医学、生物学、环境科学等领域,具有快速、准确、灵敏度高的特点。
本文将介绍试剂盒检测方法的原理、步骤和注意事项。
首先,试剂盒检测方法的原理是利用特定的试剂与待检测物质发生化学反应,
产生可观察的信号,如颜色变化、荧光发射等。
这些信号与待检测物质的浓度呈正相关关系,通过比对标准曲线或参照值,可以确定待检测物质的存在或浓度。
其次,进行试剂盒检测需要严格按照操作步骤进行。
一般包括样品处理、试剂
配置、反应体系建立、信号检测等步骤。
在进行每一步操作时,都需要严格控制实验条件,避免外部因素对结果产生干扰。
另外,试剂盒检测方法需要注意以下几点。
首先,选择合适的试剂盒对于实验
结果的准确性至关重要。
不同的试剂盒适用于不同的待检测物质,需要根据实际需求进行选择。
其次,严格按照试剂盒说明书进行操作,特别是在试剂配置和反应体系建立过程中,需要精确称量和混合试剂。
最后,合理选择检测仪器和方法,如分光光度计、荧光光度计等,以确保信号的准确检测和分析。
综上所述,试剂盒检测方法是一种快速、准确的检测技术,广泛应用于科研和
临床实验室。
通过本文的介绍,相信读者对试剂盒检测方法有了更深入的了解,希望能够在实验操作中加以应用,取得更加准确的实验结果。
试剂盒检测方法

试剂盒检测方法
试剂盒检测方法的应用领域广泛,可以用于各种生物标本的检测。
其操作步骤一般分为样品预处理、试剂添加和结果读取三个主要步骤。
样品预处理是为了去除样品中的干扰物,提高检测的准确性和灵敏度。
预处理方法包括离心、过滤、稀释等。
离心可以分离样品中的沉淀物和悬浮物,使样品更加清晰。
过滤可以去除样品中的固体颗粒和大分子物质,避免对后续试剂反应的干扰。
稀释可以调整样品的浓度,使其适合于试剂的操作要求。
试剂添加是将特定的试剂添加到样品中,以触发化学反应或生物反应。
试剂可以是荧光染料、酶底物、抗体、核酸探针等。
试剂的添加通常需要按照一定的比例和顺序进行,以确保反应的顺利进行。
结果读取是通过不同的测量方式来获取试剂反应的结果。
常见的测量方式包括比色法、荧光法、吸光度测量等。
比色法通过测量试剂反应生成的有色产物的颜色强度来判断样品的含量或活性。
荧光法通过测量试剂反应生成的荧光信号的强度来判断样品的含量或活性。
吸光度测量则是通过测量试剂反应产生的吸光度变化来判断样品的含量或活性。
试剂盒检测方法的优点是操作简便、灵敏度高、检测时间短,适用于实验室和现场快速检测。
在医学、环境监测、食品安全等领域都有广泛的应用。
化学发光免疫类体外诊断试剂(盒)产品技术审评要求规范(2017版)1204

化学发光免疫类体外诊断试剂(盒)产品技术审评规范(2017版)本规范旨在指导注册申请人对化学发光免疫类体外诊断试剂(盒)产品注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本规范是对化学发光免疫类体外诊断试剂(盒)产品的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据产品特性确定其中的具体内容是否适用。
本规范是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本规范。
本规范是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本规范相关内容也将进行适时调整。
一、适用范围本规范适用于利用化学发光免疫分析技术对被测物质进行定量检测的第二类体外诊断试剂(包括以微孔板、管、磁颗粒、微珠和塑料珠等为载体的酶促及非酶促化学发光免疫分析测定试剂)的注册技术审查。
依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号,以下简称《办法》)、《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管〔2013〕242号)化学发光免疫类体外诊断试剂(盒)产品分类代号为6840。
二、注册申报资料要求(一)综述资料综述资料主要包括产品预期用途、临床意义、产品描述、有关生物安全性的说明、研究结果的总结评价以及同类产品上市情况介绍等内容,应符合《办法》和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告2014年第44号)的相关要求。
(二)主要原材料研究资料(如需提供)主要原材料(例如各种天然抗原、重组抗原、单克隆抗体、多克隆抗体以及多肽类、激素类等生物原科,辣根过氧化物酶、碱性磷酸酶等标记用酶、磁微粒及其他主要原料)的选择、制备、质量标准及实验验证研究资料;校准品、质控品的原料选择、制备、赋值过程及试验资料;校准品的溯源性文件,包括具体溯源链、实验方法、数据及统计分析等详细资料。
SOD试剂盒说明说书(100孔)

图7:以上样品孔和空白孔是按照96 孔板的排列
注意:可以根据自己样品的情况制 订稀释倍率。
“1 Unit SOD”的定义
『 “1 Unit SOD”的定义:20 µl样 品溶液中能够抑制50%的WST®-1
和超氧阴离子的还原反应所需的
酶的量。』
SOD活性的计算
请根据附带的光盘中的计算公式计算每个样品的SOD活性。如果样品之间差异不大,建议可以先做1个样品摸索条件,
*酶工作液加入后会立即有超氧化物生成,请用多通道移液器来加酶工作液以缩短时间,减少各孔间的误差。
表1. 孔板中各孔的溶液用量 空白1:不含抑制剂的空白对照 ; 空白2:样品空白对照; 空白3:试剂空白对照; *如果样品是组织或样品溶液的颜色 较深,必须测定每个稀释样品空白2 的值并扣除。
1) 各 孔 中 加入样品溶液或双蒸水。
如果您需要更多的信息或者有任何问题可以通过以下的方式联系我们:
上海
北京
上海市零陵路 899 号飞洲国际广场 27 楼 J 座 北京市朝阳区德外马甸裕民路 12 号元辰鑫大厦 E1-210 室
邮编:200030
检测机理
超氧化物歧化酶(SOD)是一种重要的抗氧化酶,它可以催化超氧阴离子(O2- )的歧化反应,生成过氧化氢和单
质氧。目前有很多种直接或间接地测量SOD活性的方法,在这些方法中,使用硝基蓝四唑(氮蓝四唑nitroblue tetrazolium ,
简称NBT)的一种间接测量方法因其便捷、简单的使用方法而被广泛应用。但是,NBT法存在一些缺点,例如生成的染 料(Formanzan dye)的水溶性较低,会和黄嘌呤氧化酶的还原型发生反应等问题。SOD检测试剂盒- WST®提供了更为 简便的检测SOD的方法,它是利用同仁化学研究所研发的高度水溶性四唑盐WST®-1(2-(4-碘苯基)-3-(4-硝基苯基)-5-(2,4二磺酸苯基)-2氢-四唑盐,二钠盐),能与超氧阴离子(O2- )反应生成一种水溶性的染料。WST®-1被超氧阴离子还原的 比率与黄嘌呤氧化酶的活性线性相关,并且会被SOD所抑制(见下图,即红色区域SOD反应优先发生,SOD反应完后蓝
HUAXING毒品检测试剂盒简介和毒检知识

第一章产品介绍一、最新产品简介Huaxing MDMA(摇头丸)金标筛选试剂盒摇头丸兴奋剂(苯丙胺类衍生物)是近几年进入中国的新型毒品,其滥用情况日益严重,已经成为禁毒部门的主要查禁对象。
目前我国禁毒部门检验滥用摇头丸的方法是用甲基安非他明金标筛选试剂盒(以下简称甲安试剂盒)检测人体尿液中是否含有MDMA(摇头丸的主要成份之一,学名3,4—亚甲二氧基甲基安非他明)。
甲安试剂盒是检测冰毒的专用试剂盒,过去因为没有检测摇头丸的专用产品,只能用甲安试剂盒替代。
用甲安试剂盒检测摇头丸存在两个问题:1、甲安试剂盒检测MDMA的阈值是5000ng/ml,灵敏度太低,只能在人滥用摇头丸后24小时内的尿液检出阳性结果,用甲安试剂盒检测摇头丸存在大量漏检现象。
2、甲安试剂盒检测结果呈阳性时,只能说明被检测者滥用了摇头丸或者冰毒,不能肯定是滥用了摇头丸。
针对甲安试剂盒检测摇头丸存在的缺陷,我公司与在美国的协作加工厂商合作研制了检测摇头丸的专用试剂盒—ANJING MDMA(摇头丸)金标筛选试剂盒。
ANJING MDMA(摇头丸)金标筛选试剂盒具有如下优点:1、灵敏度高对MDMA的检测灵敏度是500ng/ml,可在人滥用摇头丸后72小时内的尿液中检出MDMA,不会发生遗漏。
2、特异性好甲基安非他明、安非他明、麻黄碱等滥用药物在100ug/ml浓度以下不会产生干扰,在检测结果呈阳性时,可以认为被检测人滥用了MDMA,不用考虑甲基安非他明的干扰。
二、HUAXING 系列麻醉毒品金标筛选试剂盒简介吗啡(MOR)金标筛选试剂盒:可以快速检测人是否在48小时内吸食、注射海洛因、鸦片等麻醉毒品。
吗啡筛选试剂盒可以检测人是否滥用上述麻醉毒品,对吗啡的检测阈值为300ng/ml。
甲基安非他明(M-AMP)金标筛选试剂盒:可以快速检测人是否在72小时内滥用甲基安非他明(“冰毒”);是否在24小时内滥用MDMA (“摇头丸”主要成份之一,学名3,4-亚甲二氧基甲基安非他明)。
ELISA试剂盒操作方法

ELISA试剂盒操作方法ELISA(酶联免疫吸附法)是一种常用的实验技术,用于检测目标物(如蛋白质、抗原或抗体)的存在和浓度。
ELISA试剂盒是ELISA实验的核心,包括特定的试剂和材料,用于执行特定的步骤和操作。
以下是一般ELISA试剂盒的操作方法,包含以下步骤:1.准备实验样品:收集所需分析物的样品(例如血清、细胞上清液或组织提取液等),并适当保存或稀释以便后续操作。
2.预处理步骤:根据实验的目的和试剂盒的要求,进行样品的预处理。
这可能包括去除干扰物质、离心、稀释或加热等处理步骤。
3.涂覆酶联免疫板:打开试剂盒中提供的酶联免疫板,将其放置在工作台上。
将涂覆物质(如抗体或抗原)加入到每个酶联免疫孔中,通常使用多通道移液器或微量移液器进行操作。
涂覆后,尽量避免泡沫和交叉污染。
4.触发剂孵育:将涂覆后的酶联免疫板放入孵育箱或板上孵育器中,在适当的温度下孵育一段时间。
此步骤的目的是固定涂覆物质,并优化其活性。
5.洗涤:将试剂盒中提供的缓冲液加入酶联免疫孔中,并倾斜孔盘轻轻敲打或使用洗板仪进行洗涤,以去除未结合的物质和杂质。
通常,洗涤液需要多次更换,充分洗涤以获得更好的准确性和灵敏度。
6. 过量引物(Block):加入试剂盒提供的阻断缓冲液至孔中,目的是防止非特异性结合的发生。
阻断时间可以根据试剂盒的要求进行调整。
7.加入样品和控制物质:将处理好的样品和控制物质,如阳性对照和阴性对照,加入到各个酶联免疫孔中。
注意要根据试剂盒的要求进行适当的稀释。
8.孵育和洗涤:将孔盘放回孵育箱或板上孵育器中,按照试剂盒的要求进行孵育。
完成孵育后,继续进行洗涤步骤,以去除未结合的物质。
9.检测剂加入:将检测试剂(通常是特异性抗体或酶标记物质)加入酶联免疫孔中。
如有需要,可以进一步稀释试剂以适应实验要求。
10.再次孵育和洗涤:将孔盘放回孵育箱或板上孵育器中,对要求进行的步骤进行孵育。
完成孵育后,进行洗涤步骤以去除未结合的物质。
免疫球蛋白G测定试剂盒技术要求

免疫球蛋白G测定试剂盒技术要求免疫球蛋白G(Immunoglobulin G,IgG)测定试剂盒是一种用于检测患者体内IgG水平的重要试剂盒。
它可以应用在临床诊断、疾病监测、药物疗效评估等领域,对于促进疾病的早期发现和有效治疗具有重要意义。
以下是对免疫球蛋白G测定试剂盒技术要求的介绍。
首先,免疫球蛋白G测定试剂盒应具备高灵敏度。
高灵敏度是保证试剂盒能够准确、及时地检测出低浓度IgG的关键要求。
试剂盒应当能够准确地检测出低至几微克/毫升的IgG浓度,从而提高患者的诊断准确率和疾病监测的灵敏度。
其次,免疫球蛋白G测定试剂盒需要具备高特异性。
高特异性能够保证试剂盒在检测IgG时不受其他蛋白质的干扰,从而减少假阳性或假阴性的发生。
试剂盒需要选择能够与IgG特异结合的抗体,或采用多种抗体检测,以提高特异性。
第三,免疫球蛋白G测定试剂盒需要具备良好的重复性和稳定性。
重复性是指在同一样本中,试剂盒的测定结果应该相近或一致。
稳定性是指试剂盒在储存和使用过程中不发生明显变化。
试剂盒需要在较长的储存期内保持较好的重复性和稳定性,从而保证测定结果的准确性和可靠性。
此外,免疫球蛋白G测定试剂盒应具备较宽的测量范围。
即使在不同的浓度范围内,试剂盒仍然能够准确地测量出IgG的浓度。
这有助于满足不同临床需求和样本类型的测量要求。
另外,免疫球蛋白G测定试剂盒应具备良好的耐受性和安全性。
试剂盒应当抵抗样本中可能存在的干扰物,如蛋白质结合、颜色干扰等,并且不对样本造成伤害。
同时,试剂盒中使用的各种试剂和材料也应符合安全性要求,确保操作人员和患者的安全。
最后,免疫球蛋白G测定试剂盒需要具备方便快捷的操作性和高通量性。
试剂盒应当提供简单、易操作的指南,使得临床医生或实验人员能够快速完成测定。
同时,试剂盒也应当具备较高的通量性,能够同时处理多个样本,提高检测效率。
综上所述,免疫球蛋白G测定试剂盒技术要求涵盖了高灵敏度、高特异性、良好的重复性和稳定性、较宽的测量范围、良好的耐受性和安全性、便捷快捷的操作性以及高通量性等方面。
同型半胱氨酸(HCY)测定试剂盒(酶循环法)说明书

同型半胱氨酸(HCY)测定试剂盒(酶循环法)说明书【产品名称】同型半胱氨酸(HCY)测定试剂盒(酶循环法)【包装规格】a)试剂1:1×18mL试剂2:1×5mLb)试剂1:1×33mL试剂2:1×9mLc)试剂1:2×66mL试剂2:2×18mLd)试剂1:1×66mL试剂2:1×18mL【预期用途】用于体外定量测定人血清中同型半胱氨酸的含量。
高HCY水平可导致动脉血管壁内皮片状脱落,同时刺激平滑肌细胞增生,引起血管损伤,出现类似动脉粥样硬化性病理改变。
测定同型半胱氨酸常用于冠心病、中风、高血压、老年痴呆等疾病的辅助诊断[1]。
【检验原理】同型半胱氨酸被转化为游离型后,通过与共价底物反应,同时产生腺苷。
腺苷立即水解成氨和次黄嘌呤,氨在谷氨酸脱氢酶的作用下,使β-烟酰胺腺嘌呤二核苷酸还原性(NADH)转化为NAD+,样本中的同型半胱氨酸的浓度与NADH的变化率成正相关。
【主要组成成分】试剂1主要组分磷酸盐缓冲液100mmol/L S-腺苷甲硫氨酸盐(SAM)0.1mmol/L β-烟酰胺腺嘌呤二核苷酸还原性(NADH)0.2mmol/L 三(2羧乙基)磷氯化氢(TCEP)0.5mmol/L α-酮戊二酸 5.0mmol/L 修饰化的HCY甲基转移酶(HMTase) 5.0KU/L 谷氨酸脱氢酶(GLDH)10.0KU/L ProClin300适量试剂2主要组分磷酸盐缓冲液100mmol/L 修饰化的S-腺苷同型半胱氨酸(SAH)水解酶 3.0KU/L 腺苷脱氨酶(ADA) 5.0KU/L ProClin300适量注:不同批号试剂盒中各组分未经试验不可互换。
【储存条件及有效期】1.试剂原包装在2~8℃储存,有效期为12个月,生产日期、有效期见标签。
2.开口后的试剂在仪器仓中(2~8℃)可稳定30天。
【适用仪器】艾威德AS-420/AS-660/AS-1200;日立HITACHI7020型/7060型/7180型/7600型/LABOSPECT008AS型;贝克曼AU400/AU480/AU640/AU680/ AU2700/AU5400/AU5800/AU5811/AU5821;佳能TBA-FX8/TBA-120FR/ TBA-2000FR;罗氏cobas8000c702/cobas8000c701/cobas8000c502;西门子SIEMENS ADVIA1800/ADVIA2400;雅培ABBOTT ARCHITECTc8000/ARCHITECT c16000/ARCHITECT ci8200;西森美康SYSMEX BM6010/C;科华KHB卓越310/卓越330/卓越400/卓越450/ZY-1200/ ZY-1280;迪瑞CS-240/CS-T300/CS-300B/CS-380/CS-400A/CS-400B/ CS-600A/CS-600B/CS-800A/CS-800B/CS-1200/CS-1200ISE/CS-1300B/ CS-1400;迈瑞MINDRAY BS-220/BS-330/BS-350E/BS-380/BS-390/ BS-400/BS-430/BS-600/BS-800/BS-2000M;颐兰贝ES-200/ES-380/ES-480;赛诺迈德SUNMATIK-9050型;雷杜Chemray420;英诺华D280;特康TC6010L;锦瑞GS400;普康6066。
PCR性能验证作业指导书(1)

第 1 页/ 共 5页文件类型:□质量手册□程序文件■作业指导书审批纪录/Review history:修订记录/Revision history:1 目的根据医学实验室质量和能力认可准则在分子诊断领域的应用说明对实验室开展的定性及定量检测项目进行性能验证。
证明检测结果准确可靠,可以满足临床需求。
2 职责2.1 技术负责人负责性能验证报告的批准,质量负责人负责性能验证有效性的指导及审核。
2.2 组长负责对仪器厂家的验证报告进行确认。
2.3 组长负责组织本组工作人员一起进行项目性能验证的实验。
2.4 组长负责将项目性能验证的原始数据分析整理,形成验证报告。
3 验证内容3.1 仪器性能验证仪器的验证正常情况下每年进行一次,但如有以下(但不限于)的情况发生时:仪器出现故障,扩增仪灯泡更换时、仪器迁移等需要重新进行性能验证。
验证要求详见各仪器作业指导书。
3.2 项目的性能验证3.2.1 定量项目性能验证在新项目初次开展时,检测仪器性能验证通过后,进行精密度、线性、准确度、检测下限的验证。
但如有以下(但不限于)的情况发生时:项目方法学、试剂组分及仪器故障,仪器迁移等,需要重新建立方法学并进行相关性能验证。
3.2.1.1 精密度验证1)实验方案:重复性精密度均采用2个已知浓度阳性和弱阳性临床样本,每天在RocheLightcycler480上重复检测3次;连续检测5天。
并计算SD和CV值。
2)结果判断:按照试剂盒说明书中CV的要求范围来判断。
3.2.1.2 准确度验证1)实验方案:以最近两年参加卫生部临检中心EQA室间质量回报的数据为基础,对回馈的报告进行相应的数据分析。
2)结果判断:PT成绩在80%到100%之间,即认为该项目准确度符合要求。
3.2.1.3 线性范围验证1)实验方案:将高浓度的已知临床标本采用体检健康的人血清进行梯度稀释,对高浓度样本和稀释后的样本(7个浓度点)进行同批次检测,每个样本重复检测2次,计算此范围内一系列不同样本的测量值与其实际浓度(真值)的线性相关系数。
免疫透射比浊法和免疫散射比浊法检测特定蛋白的抗干扰能力比较

免疫透射比浊法和免疫散射比浊法检测特定蛋白的抗干扰能力比较彭凤;徐晓萍;王琳;应春妹【摘要】Objective To compare the anti-interference abilities of immune turbidimetry and immune nephelometry for detecting specific proteins [ immunoglobulin G ( IgG) , immunoglobulin M (IgM ) and C reactive protein ( CRP) ] through the interferers of free bilirubin ( FBil) , conjugated bilirubin ( CBil) , hemoglobin ( Hb) and chyle ( CH ). Methods A total of 6 mixed serum samples were prepared under 2 levels (high/low) of specific proteins (IgG: 8-12 g/L, >16 g/L;IgM:1.0-1.5 g/L, > 2. 0 g/L;CRP:4-10mg/L, >100mg/L). The 4 interferers were prepared into 5 different concentrations(FBil:656, 1 312, 1 968, 2 624 and 3 280 μmol/L;CBil:688, 1 376, 2 064, 2 752 and 3 440 μmol/L;Hb:9.9, 19.8, 29.8, 39. 7 and 49.6μmol/L;CH:3 000, 6 000, 9 000, 12 000 and 15 000 FTU) by rules(l: 5 , 2- 5 , 3: 5, 4: 5 and 5: 5) , and the interferers were added to the mixed serum. The concentration of the specific proteins was detected by immune turbidimetry and immune nephelometry respectively, and the interference rate was calculated. The anti-interference abilities of the 2 methods were calculated according to Clinical and Laboratory Standards Institute (CLSI) EP7-A standard. The average concentration of the specific proteins with different in terferers ±5% of the control tubes at the same concentration was considered to have interference. Results By the immune nephelometry, the values to detect IgM (high level ) and CRP ( low level) with theinterferer of Hb (9. 9 and 29.8 μmol/L)and Hb(9.9, 29.8 and 39.7 μmol/L) respectively, also the values to detect IgM (high level and low level ) with the interferer of CH (9 000, 12 000 and 15 000 FTU)and CH (6 000, 9 000,12 000 and 15 000 FTU) were all considered to have interference. However, by the immune turbidimetry,the values to detect IgG, IgM and CRP withthe 4 interferers were considered to have no interference. Conclusions To 4 interferers (FBil, CBil, Hb and CH) ,the anti-interference ability of immune turbidimetry is better than that of immune nephelometry. The immunernturbidimetry shows better accuracy to detect specimens with the interferers of lipidemia and haemolysis as large particles in the clinical application.%目的比较免疫透射比浊法和免疫散射比浊法检测特定蛋白[免疫球蛋白G(IgG)、免疫球蛋白M(IgM)和C反应蛋白(CRP)]时对游离胆红素(FBil)、结合胆红素(CBil)、血红蛋白(Hb)和乳糜(CH)的抗干扰能力.方法收集血清样本,分别制备高、低2种浓度(IgG:8 ~ 12 g/L、>16 g/L;IgM:1.0 ~ 1.5 g/L、>2.0 g/L;CRP:4 ~ 10 mg/L、>100 mg/L)的特定蛋白混合血清6管,按1∶5、2∶5、3∶5、4∶5、5∶5将4种干扰物分别配成5种不同浓度(FBil:656、1 312、1 968、2 624、3 280 μmol/L;CBil:688、1 376、2 064、2 752、3440 μmol/L;Hb:9.9、19.8、29.8、39.7、49.6 μmol/L;CH:3 000、6 000、9 000、12 000、15 000 FTU)添加于混合血清中,用免疫透射比浊法和免疫散射比浊法分别检测相应的特定蛋白浓度,计算干扰率,按美国临床实验室标准化协会(CLSI) EP7-A文件评价2种方法的抗干扰能力.添加不同浓度干扰物之后的特定蛋白测定均值超过同一浓度下的空白对照管的±5%为产生了干扰作用.结果免疫散射比浊法检测高浓度IgM、低浓度CRP分别在Hb浓度为9.9、29.8和9.9、29.8、39.7 μmol/L时有干扰作用;免疫散射比浊法测定高、低浓度IgM分别在CH浓度为9 000、12 000、15 000和6 000、9 000、12000、15 000 FTU时有干扰作用;而4种干扰物对免疫透射比浊法检测IgG、IgM和CRP均无干扰作用.结论免疫透射比浊法对临床常见的4种干扰物(FBil、CBil、Hb和CH)的抗干扰能力优于免疫散射比浊法.免疫透射比浊法对于干扰物颗粒较大的脂血、溶血样本具有更高的准确性.【期刊名称】《检验医学》【年(卷),期】2013(028)002【总页数】4页(P142-145)【关键词】免疫球蛋白G;免疫球蛋白M;C反应蛋白;免疫透射比浊法;免疫散射比浊法;抗干扰能力【作者】彭凤;徐晓萍;王琳;应春妹【作者单位】上海交通大学医学院附属仁济医院检验科,上海200127【正文语种】中文【中图分类】R446.62在临床检测样本时,经常遇到溶血、黄疸和脂血样本。
干扰实验

一、实验目的
1.掌握GOD-POD法测定血糖的原理及临床意义。 2.掌握干扰试验的原理和方法。
二、实验原理
1、GOD-POD法测血糖原理:
葡萄糖氧化酶(glucose oxidase,GOD)能将葡萄 糖氧化为葡萄糖酸,并释放出过氧化氢。后者在过氧化物 酶(peroxidase,POD)的作用下与色原性氧受体4-氨基 安替比林偶联酚缩合成红色醌类化合物,即Trinder反应。 该红色醌类化合物的生成量与葡萄糖含量成正比。
2、干扰实验原理:
选用维生素C做GOD-POD法测血糖的干扰试 验,维生素C可和GOD反应生成的H2O2发生反应, 使部分H2O2不能参与第二步POD催化的偶联反应, 从而降低显色强度,产生负的测定误差。
三、器材
微量移液器
计算器
三用水浴箱
722型可见光分光光度计
四、试剂
1.血清标本
含血糖6.7mmol/L的血清
2、按下表操作
加入物 (ml)
B
S
干基 干1 干2 干3
DDW 0.01
—
—
—
—
—
5.55mmol /糖标
—
0.01
—
—
—
—
各个样品 —
—
0.01 0.01 0.01 0.01
酶酚试剂 1.5
1.5
1.5
1.5
1.5
1.5
混匀,置水浴箱37℃,15分钟,505nm空白管调 零,722型分光光度计分别测各管A值。
测定浓度
基础样品 干扰样品Ⅰ 干扰样品Ⅱ 干扰样品Ⅲ
加入干扰 物浓度
干扰值
干扰率
七、注意事项
1.干扰试验的对象有厂商研制的新产品;新建立的方 法;新引进的方法或试剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
商品号/79370 干扰物检查A PLUS
Interference Check.A Plus
说明干扰物检查A PLUS试剂盒是用于检测胆红素(游离型、结合型)、溶血、乳糜等物质对检查结果影响程度的干扰物检查用的专用试剂盒。
制品成分
1、胆红素*F(游离型)--------------2mL*1
2、胆红素*F(空白)---------------2mL*1
3、胆红素*C(结合型)--------------2mL*1
4、胆红素*C(空白)---------------2mL*1
5、溶血血红蛋白----------------2mL*1
6、溶血血红蛋白(空白)------------2mL*1
7、乳糜--------------------2mL*1
8、乳糜(空白)----------------2mL*1
使用方法
各瓶用精制水2mL溶解,当天使用。
(根据所需添加浓度不同,精制水量不同)
操作方法
1、溶解后的样本(干扰物质)1.0ml和事先准备好的混合血清9.0ml混合制成样本A
2、溶解后的样本(空白)1.0ml和事先准备好的混合血清9.1ml混合制成样本B
3、样本A和样本B按以下表格配制稀释系列
对照 1/10 2/10 3/10 4/10 5/10 6/10样本A----0.10.20.30.40.50.6
样本B 1.00.90.80.70.60.50.4
7/10 8/10 9/101
样本A0.70.80.9 1.0
样本B0.30.20.1----
4、对以上稀释系列进行检测
组成
1、胆红素*F(游离型)T-BIL#
牛蛋白 3.2g/dL
Tris.缓冲液 Ph8.5100mmol/L
2、胆红素*F(空白)牛蛋白 3.2g/dL
Tris.缓冲液 Ph8.5100mmol/L
3、胆红素*C(结合型)T-BIL/D-BIL#
牛蛋白 4.0g/dL
Tris.缓冲液 Ph8.020mmol/L
4、胆红素*C(空白)牛蛋白 4.0g/dL
Tris.缓冲液 Ph8.020mmol/L
5、溶血血红蛋白溶血血红蛋白#
蔗糖10g/dL
6、溶血血红蛋白(空白)蔗糖10g/dL
7、乳糜甘油三脂850mg/dL
磷脂质910mg/dL
游离脂肪酸620uEq/L
牛蛋白 2.5g/dL
Tris.缓冲液 Ph7.020mmol/L
8、乳糜(空白)牛蛋白 2.5g/dL
Tris.缓冲液 Ph7.020mmol/L #参照各成分浓度表
本次实验所用批号及浓度批号:ZS5001
胆红素*C(结合型)187mg/dl
溶血血红蛋白4900mg/dl
乳糜14700度。
