SN1和SN2反应机制
SN1和SN2反应机制复习进程

练习
SN2的立体化学
有机化学
简介 SN2立体化学 SN1立体化学 课堂总结
练习
背面进攻中心碳 !
手性中心碳的构型翻转 瓦尔登(Walden)转化
有机化学
简介 SN2立体化学 SN1立体化学 课堂总结
练习
知识拓展
在SN2反应中手性中心碳的R/S构型一定会改变?
(R-构型)
(R-构型)
Walden 转化
SN1
(1)反应分两步进行,旧键先断裂,新键再生成;
反 (2)反应速率只与卤代烷的浓度成正比; 应
机 (3)反应中有碳正离子产生,产物构型外消旋化,
理
可能会出现重排产物。
SN2
(1)反应一步完成,旧键的断裂和新键的生成同时进行;
反 应
(2)反应速率与卤代烷和亲核试剂的浓度成正比;
机
理 (3)反应过程中构型发生瓦尔登转化。
课堂练习
问:根据下列现象,判断卤代烷与NaCN的乙醇溶液
的反应,指出它们分别属于那种SN反应?
SN2
SN1
SN1
SN2
有机化学
简介 SN2立体化学 SN1立体化学 课堂总结 练 习
此课件下载可自行编辑修改,仅供参考! 感谢您的支持,我们努力做得更好!谢谢
构型翻转
中心碳上四个键构成的骨架构型的翻转
有机化学
简介 SN2立体化学 SN1立体化学 课堂总结
练习
Ts(1)
Ts(2)
E
Ea1 Ea2
(CH3)3C+
(CH3)3CBr
反应分步进行; 经过两个过渡态; 反应中有正碳离子生成。
(CH3)3COH
有机化学
反应进程
反应类型 Sn1 Sn2 SNAr
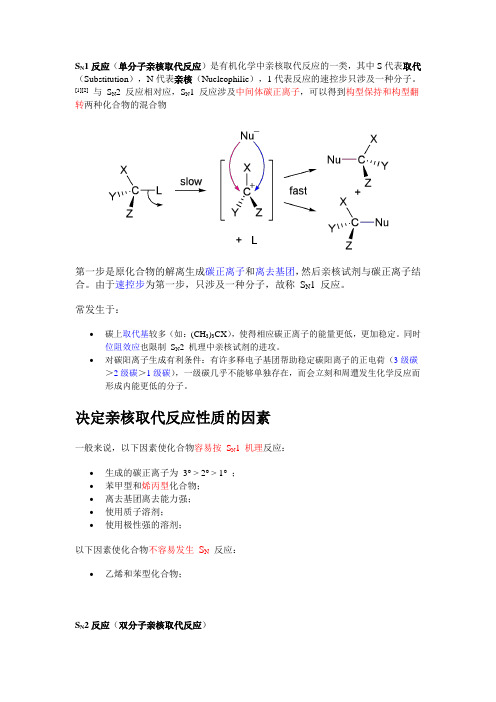
S N1反应(单分子亲核取代反应)是有机化学中亲核取代反应的一类,其中S代表取代(Substitution),N代表亲核(Nucleophilic),1代表反应的速控步只涉及一种分子。
[1][2]与S2 反应相对应,S N1 反应涉及中间体碳正离子,可以得到构型保持和构型翻N转两种化合物的混合物第一步是原化合物的解离生成碳正离子和离去基团,然后亲核试剂与碳正离子结合。
由于速控步为第一步,只涉及一种分子,故称S N1 反应。
常发生于:∙碳上取代基较多(如:(CH3)3CX),使得相应碳正离子的能量更低,更加稳定。
同时位阻效应也限制S N2 机理中亲核试剂的进攻。
∙对碳阳离子生成有利条件:有许多释电子基团帮助稳定碳阳离子的正电荷(3级碳>2级碳>1级碳),一级碳几乎不能够单独存在,而会立刻和周遭发生化学反应而形成内能更低的分子。
决定亲核取代反应性质的因素一般来说,以下因素使化合物容易按S N1 机理反应:∙生成的碳正离子为3° > 2° > 1°;∙苯甲型和烯丙型化合物;∙离去基团离去能力强;∙使用质子溶剂;∙使用极性强的溶剂;以下因素使化合物不容易发生S N反应:∙乙烯和苯型化合物;S N2反应(双分子亲核取代反应)是亲核取代反应的一类,其中S代表取代(Substitution),N代表亲核(Nucleophilic),2代表反应的决速步涉及两种分子。
与S N1反应相对应,S N2反应中,亲核试剂带着一对孤对电子进攻具亲电性的缺电子中心原子,形成过渡态的同时,离去基团离去。
反应中不生成碳正离子,速率控制步骤是上述的协同步骤,反应速率与两种物质的浓度成正比,因此称为双分子亲核取代反应。
无机化学中,常称双分子亲核取代反应类型的反应机理为“交换机理”。
由于亲核试剂是从离去基团的背面进攻,故如果受进攻的原子具有手性,则反应后手性原子的立体化学发生构型翻转,也称“瓦尔登翻转”。
有机化学基础知识点取代反应的机理和规律

有机化学基础知识点取代反应的机理和规律有机化学是研究有机物(含碳元素)的合成、性质和结构等方面的科学。
在有机化学中,取代反应是一种常见的反应类型,它涉及到一个原子或基团取代另一个原子或基团的过程。
了解取代反应的机理和规律是掌握有机化学基础知识的重要一环。
一、取代反应的机理1. 亲核取代反应机理亲核取代反应是指一个亲核试剂(如NH3、Br-等)攻击一个有机化合物中的亲电中心,使其离开并被亲核试剂取代的反应。
亲核试剂中的亲核部分在反应中发挥了重要作用。
亲核取代反应机理主要包括以下几个步骤:(1)亲核试剂攻击:亲核试剂中的亲核部分与有机化合物中的亲电中心发生攻击反应,形成一个中间体。
(2)中间体重排:中间体发生重排反应,使得取代基得以稳定排列。
(3)离去基离去:离去基离开中间体,并与溶剂或离去基之间形成新的化学键。
(4)生成产物:最后生成的产物是一个被亲核试剂取代了一个原有基团的化合物。
2. 亲电取代反应机制亲电取代反应是指一个亲电试剂(如H+, Br+, AlCl3等)攻击一个有机化合物中的亲核中心,使其离开并被亲电试剂取代的反应。
亲电试剂中的亲电部分在反应中发挥了重要作用。
亲电取代反应机制主要包括以下几个步骤:(1)亲电试剂攻击:亲电试剂中的亲电部分与有机化合物中的亲核中心发生攻击反应,形成一个中间体。
(2)中间体重排:中间体发生重排反应,使得取代基得以稳定排列。
(3)离去基离去:离去基离开中间体,并与溶剂或离去基之间形成新的化学键。
(4)生成产物:最后生成的产物是一个被亲电试剂取代了一个原有基团的化合物。
二、取代反应的规律1. Sn1和Sn2反应Sn1反应和Sn2反应是亲核取代反应中的两种常见机制。
Sn1反应是典型的两步反应,第一步是亲电离子形成,第二步是亲核试剂攻击。
Sn2反应是典型的一步反应,在反应中,亲核试剂直接攻击有机化合物中的亲电中心,并与离去基同时发生。
Sn1反应适用于三级卤化合物等离子体生成较容易的化合物;Sn2反应适用于一级卤化合物等亲电离子形成较困难的化合物。
有机化学基础知识点碳原子的亲核取代反应

有机化学基础知识点碳原子的亲核取代反应亲核取代反应是有机化学中重要的反应类型之一。
在这篇文章里,我将介绍碳原子的亲核取代反应的基础知识点。
亲核取代反应是一种化学反应,涉及到一个亲核试剂攻击一个电子云密度较低的碳原子,并将其取代。
这种反应可以发生在饱和碳原子上,也可以在环上的碳原子上发生。
1. 亲核试剂的选择亲核试剂是亲核取代反应中至关重要的一部分。
常见的亲核试剂包括卤代烷、醇、胺等。
选择适当的亲核试剂可以有效地促进反应的进行。
2. 亲核试剂的攻击在亲核取代反应中,亲核试剂攻击碳原子的位置非常重要。
碳原子可以通过两种方式进行亲核攻击:SN1和SN2机理。
- SN1机制:这是一种两步反应,首先,亲核试剂离去一个离子,形成一个带电的中间体。
然后,亲核试剂攻击中间体上的位点,取代离去的离子。
- SN2机制:这是一种一步反应,亲核试剂直接攻击碳原子,并同时取代离去的基团。
3. 碳原子的离去基团在亲核取代反应中,碳原子上的离去基团是影响反应速率和反应机理的重要因素。
常见的离去基团包括卤素原子、氨基和醇基等。
不同的离去基团会导致不同的反应速率和产物选择。
4. 反应条件的影响亲核取代反应的条件也会对反应的进行产生影响。
常见的反应条件包括溶剂的选择、温度和反应时间等。
选择合适的反应条件可以提高反应的收率和选择性。
5. 反应机理的解释了解亲核取代反应的机理对于理解反应过程和预测产物是非常重要的。
通过观察亲核试剂攻击碳原子的位置、反应速率以及产物选择等因素,可以确定反应机理。
在总结中,亲核取代反应是有机化学中基本的反应类型之一。
了解碳原子的亲核取代反应的基础知识点可以帮助我们理解反应机理、预测产物以及进行有机合成的设计。
当然,亲核取代反应还有很多细节和应用等待我们深入探索和学习。
有机反应机理-SN1及SN2机理

有机反应机理反应机理(又称反应历程)是研究反应的实际过程,哪个键先断裂、哪个键先形成、键断裂和形成的顺序、每步的相对速率、原子或基团在反应过程中的键合情况及空间位置变化等等。
由于分子的振动和碰撞是在10-12~10-14 s内完成,目前还没有能直接观察在这样短的时间内分子和原于运动情况的手段或仪器,而只能根据反应中观察的现象推测反应可能经历的过程。
因此,日前关于反应机理的描述都是根据实验的结果和观察到的现象进行间接推理或假设。
20世纪80年代末,ZewailA H研究成功了—种激光脉冲式的超高速闪光照相机,它的脉冲时间只有几十个飞秒(f s=10-15s),可以让人们通过超高速照相机拍摄的“慢动作”观察化学反应过程中原子与分子的化学键形成和断裂的转变形态,跟踪显示化学反应的全过程。
为研究反应机理和预测化学反应提供了一种新方法,这一成果最先用于研究简单气态分子的化学反应,现在已推广到液态和固态的化学变化,并由此诞生了一门称之为“飞秒化学”的新学科,zewnil也因其卓越贡献荣获1999年诺贝尔化学奖。
此外,量子化学的不断发展和超高速大容量计算机的飞速换代也为计算化学反应的全过程提供了可能。
虽然目前用计算机计算和描述化学反应的全过程还比较遥远,但已有了成功的苗头。
1、有机反应分类有机反应的数目和范围十分庞大,根据反应中键的断裂及形成方式可将有机反应分为:自由基反应、离子反应和分子反应。
有机反应也有按照原料和产物之间的关系进行分类,把几乎所有的有机反应分成六类,分别是取代反应、消去反应、加成反应、重排反应、氧化还原反应及几种反应类型的结合。
2、有机反应中试剂分类在有机反应试剂中,除双自由基外绝大部分具有偶数电子的试剂属于离子试剂;另一部分具有奇数电子的试剂则称为自由基试剂。
离子试剂又可进一步分为亲电试剂和亲核试剂。
亲电试剂:在反应过程中接受电子或共享电子(这个电子原属于另一个反应物分子)的试剂称为亲电试剂;亲核试剂:在反应过程中供给电子进攻反应物中带部分正电荷原子的试剂称为亲核试剂。
有机反应机理-SN1与SN2机理

有机反应机理反应机理(又称反应历程)是研究反应的实际过程,哪个键先断裂、哪个键先形成、键断裂和形成的顺序、每步的相对速率、原子或基团在反应过程中的键合情况及空间位置变化等-12~10-14 s 内完成,目前还没有能直接观察在这样短的时等。
由于分子的振动和碰撞是在10间内分子和原于运动情况的手段或仪器,而只能根据反应中观察的现象推测反应可能经历的过程。
因此,日前关于反应机理的描述都是根据实验的结果和观察到的现象进行间接推理或假设。
20 世纪80 年代末,ZewailA H 研究成功了—种激光脉冲式的超高速闪光照相机,它的脉-15s),可以让人们通过超高速照相机拍摄的“慢动作”观察化冲时间只有几十个飞秒(f s=10学反应过程中原子与分子的化学键形成和断裂的转变形态,跟踪显示化学反应的全过程。
为研究反应机理和预测化学反应提供了一种新方法,这一成果最先用于研究简单气态分子的化学反应,现在已推广到液态和固态的化学变化,并由此诞生了一门称之为“飞秒化学”的新学科,zewnil 也因其卓越贡献荣获1999 年诺贝尔化学奖。
此外,量子化学的不断发展和超高速大容量计算机的飞速换代也为计算化学反应的全过程提供了可能。
虽然目前用计算机计算和描述化学反应的全过程还比较遥远,但已有了成功的苗头。
1、有机反应分类有机反应的数目和范围十分庞大,根据反应中键的断裂及形成方式可将有机反应分为:自由基反应、离子反应和分子反应。
有机反应也有按照原料和产物之间的关系进行分类,把几乎所有的有机反应分成六类,分别是取代反应、消去反应、加成反应、重排反应、氧化还原反应及几种反应类型的结合。
2、有机反应中试剂分类在有机反应试剂中,除双自由基外绝大部分具有偶数电子的试剂属于离子试剂;另一部分具有奇数电子的试剂则称为自由基试剂。
离子试剂又可进一步分为亲电试剂和亲核试剂。
亲电试剂:在反应过程中接受电子或共享电子(这个电子原属于另一个反应物分子)的试剂称为亲电试剂;亲核试剂:在反应过程中供给电子进攻反应物中带部分正电荷原子的试剂称为亲核试剂。
有机化学基础知识点亲核取代反应的机理和规律

有机化学基础知识点亲核取代反应的机理和规律有机化学是一门研究碳元素的化合物及其反应的学科。
其中,亲核取代反应是有机化学中一类重要的反应类型,它在有机合成、药物开发以及材料科学等领域起着关键性作用。
本文将重点介绍亲核取代反应的机理和规律,帮助读者更好地理解和应用这一有机化学基础知识点。
一、亲核取代反应的基本概念和机理亲核取代反应是一种典型的酸碱反应,即亲核试剂(通常是含有亲核试剂的阴离子)攻击了一个电子亏损的反应物,将其取代出来,形成新的化学键。
这种反应过程中,亲核试剂的亲电性中心与电子亏损的反应物的亲电性中心发生作用,从而实现取代反应。
亲核取代反应的机理可归纳为以下几个步骤:1. 亲核试剂的进攻:亲核试剂中具有亲电性的部分与电子亏损的反应物发生反应,亲核试剂的亲电性中心接近反应物的亲电性中心。
2. 形成临时五元环中间体:亲核试剂与反应物亲电性中心的结合形成一个临时的五元环中间体。
具体形成过程中,亲核试剂中的亲电性碳离子(通常是负离子)与反应物中的亲电性碳离子形成新的化学键。
3. 断裂反应物化学键:在形成临时的五元环中间体过程中,反应物中的一个化学键断裂,释放出一个亲核试剂与离去基团。
4. 形成新的化学键:离去基团离开后,亲核试剂中的亲电性碳离子与反应物中的亲电性碳离子形成新的化学键,得到产物。
二、亲核取代反应的规律和影响因素亲核取代反应的速率和产物选择性受到多种因素的影响。
下面介绍一些常见的规律和影响因素:1. 亲核试剂的选择:不同的亲核试剂具有不同的亲电性中心和亲核性,因此在不同的反应中选择适合的亲核试剂是十分重要的。
2. 电子密度和空间位阻效应:反应物中存在不同的亲电性中心时,选择攻击电子密度较高的中心更有利于反应进行。
此外,反应物或产物中的取代基团的位阻效应也会影响反应速率和选择性。
3. 溶剂选择:不同的溶剂对反应速率和产物选择性有一定影响。
一些溶剂可以稳定或降低亲核试剂的亲电性,从而影响反应速率和选择性。
卤代烃水解制备醇
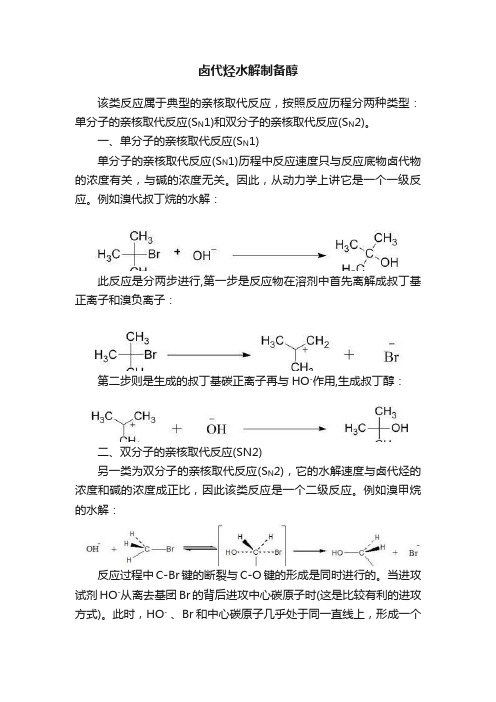
卤代烃水解制备醇该类反应属于典型的亲核取代反应,按照反应历程分两种类型:单分子的亲核取代反应(S N1)和双分子的亲核取代反应(S N2)。
一、单分子的亲核取代反应(S N1)单分子的亲核取代反应(S N1)历程中反应速度只与反应底物卤代物的浓度有关,与碱的浓度无关。
因此,从动力学上讲它是一个一级反应。
例如溴代叔丁烷的水解:此反应是分两步进行,第一步是反应物在溶剂中首先离解成叔丁基正离子和溴负离子:第二步则是生成的叔丁基碳正离子再与HO-作用,生成叔丁醇:二、双分子的亲核取代反应(SN2)另一类为双分子的亲核取代反应(S N2),它的水解速度与卤代烃的浓度和碱的浓度成正比,因此该类反应是一个二级反应。
例如溴甲烷的水解:反应过程中C-Br键的断裂与C-O键的形成是同时进行的。
当进攻试剂HO-从离去基团Br的背后进攻中心碳原子时(这是比较有利的进攻方式)。
此时,HO- 、Br和中心碳原子几乎处于同一直线上,形成一个“过渡态”。
而中间碳上的三个H原子则处于垂直于这个直线的平面上,当HO-与中心碳原子进一步接近,最终形成一个稳定的C-O键时,C-Br也彻底断裂,生成Br-离子,同时中心碳上的三个H原子也向后翻转,使碳原子恢复成原来的sp3杂化状态。
从立体化学上来看,在反应过程中发生了构型的转化,使得产物与原来的反应物构型正好相反,这也正是在1893年发现的瓦尔登(Walden)转化。
另外许多反应,卤代物直接水解并不是太好,因此一般先用AcO-取代,而后再水解得到相应的醇。
反应实例一、卤代烃的水解反应制备醇示例Combined the material with 75%DMF, 1.2 equiv of NaOH were stirred for 30 min at room temperature. Andrecrystallized from MeOH to give the colourless needles (95% yield).【.Chem.1982, 47, 4024-4029】二、卤代烃的水解反应制备醇示例Water (100mL) and CaCO3(18g, 180mmol) were added into a solution of 10.5g (35mmol) of1-bromo-2-(bromomethyl)naphthalene in 100mL of p-dioxane ,and the mixture wasrefluxed for 10hrs. The solution was cooled and the dioxane removed underreduced pressure. Methylene chloride (200mL) was added followed by treatmentwith dilute HCl until all solid had dissolved .The organic phase was separated,washed with NaHCO3solution, dried over MgSO4, and filtered. Removalof the solvent left a white solid, which was recrystallizedfrom hexane to give7.9g of (1-bromonaphthalen-2-yl)methanol (95% yield).【.Chem.1986, 51, 3762-3768】三、卤代烃的乙酰氧基取代示例A 150 g portion of thethus obtained 1-chloro-(E,Z)-7,9-dodecadiene was admixed with 150 g ofanhydrous potassium ace-tate and 100 g of acetic acid and the mixture washeated at 160 .deg.C for 6 hours under agitation in an atmosphere of nitrogento convert the chloride into acetate.. After completion of thereaction, the reaction mixture was poured into a large volume of water and theorganic phase taken by phase separation was distilled under reduced pressure togive 80 g of 7,9-dodecadienyl acetate of which the purity of the E,Z-isomer wasat least 75percent.【Patent; Shin-Etsu Chemical Co., Ltd.; Publ.: EP241335 A1 (1987/10/14),Appl.: EP1987-400592 (1987/03/17)】四、酯水解得到相应的醇示例2N sodium hydroxide (40 ml) was added to a solution of 5-(2-acetoxyethyl)-2-methyl-4-phenyloxazole (16.6 g) in methanol (40 ml) and the mixture was stirred for 30 minutes, diluted with water and extracted withethyl acetate..The ethyl acetate layer was washed with water and dried overanhydrous magnesium sulfate.The solvent was thendistilled off and the residue wwas purified by silica gel chromatography(silica gel: 190 g, eluent: isopropyl ether) to give an oil of5-(2-hydroxyethyl)-2-methyl-4-phenyloxazole, yield 11.7 g (84.8percent).NMR(CDCl3) : 2.40 (3H, s), 3.07 (2H, t), 3.20 (1H, broad), 3.97 (2H, broad),7.23-7.80 (5H, m).【Patent;Takeda Chemical Industries, Ltd.; Publ.: US4596816 A1 (1986/06/24), Appl.:US198】用户“哈喽小壮”留言:对于卤代烃水解,特别是分子量很高的卤代烃,直接水解往往发生的是消除反应,经过研究发现,使用甜菜碱,80℃的乙腈溶液中回流24h,可以制备对应的酯,碳酸氢钠60℃水解,即可获得对应醇亲测有效(药明康德)。
有机化学研究岗面试问题及答案解析

有机化学研究岗面试问题及答案解析在应聘有机化学研究岗位时,面试是一个重要的环节。
面试过程中,面试官通常会提出一系列的问题,考察应聘者对有机化学的理解、实验经验和解决问题的能力。
本文将介绍一些常见的有机化学研究岗面试问题,并提供相应的答案解析。
问题一:请介绍一下你的研究方向和研究内容。
答案解析:在回答这个问题时,应聘者需要简洁明了地介绍自己在有机化学研究方面的专长和研究内容。
可以提到自己的研究主题、所使用的实验技术和研究方法,以及在研究中取得的成果。
注意不要过于冗长,突出自己的研究亮点。
问题二:请介绍一下你在有机合成领域的实验经验。
答案解析:在回答这个问题时,应聘者可以列举自己在有机合成领域进行的实验和反应类型,如醇的脱水、酯的酯化等。
并可以深入阐述实验设计的合理性、操作方法的熟练程度以及对实验结果的分析和解读能力。
问题三:请解释一下有机化学中的取代反应和消除反应的区别。
答案解析:有机化学中的取代反应和消除反应是常见的反应类型。
取代反应是指在有机分子中,某些原子或原子团被其他原子或原子团取代,生成新的化合物。
消除反应是指有机分子中两个相邻的原子团之间发生脱去分子的过程,生成双键或叁键。
因此,取代反应和消除反应的本质区别在于反应的结果以及反应机理的不同。
问题四:请解释一下SN1和SN2反应的机理及区别。
答案解析:SN1和SN2反应是取代反应中常见的两种机理。
SN1反应是一步机制,即离子中间体的形成和生成产物的过程各自独立进行。
SN1反应速率受到底物浓度的影响,生成产物的立体化学性质由离子中间体决定。
SN2反应是一步机制,即离子中间体的形成和生成产物的过程同时进行。
SN2反应速率受到底物和试剂浓度的影响,生成产物中取代基的立体化学性质由反应过程中的氢原子和取代基的排布方式决定。
问题五:请解释一下E1和E2消除反应的机理及区别。
答案解析:E1和E2消除反应是消除反应中常见的两种机制。
E1消除反应是一步机制,即生成产物和生成离子中间体的过程各自独立进行。
亲核取代 反应机理

第八章卤代烃8.4 亲核取代反应机理卤代烃中的C-X 键为极性键,电子云明显偏向卤素一边当遇上亲核试剂时,发生取代反应,卤素X 带着一对电子离去,如下式所示:(Nucleophilic Substitution Reaction ,S N )•为什么溴代叔丁烷水解是一级反应,而溴甲烷水解是二级反应?•其根本原因是反应机理不一样单分子亲核取代机理Monomlecular NucleophilicSubstitution1SNS N1 = 单分子亲核取代,1代表单分子重排是SN 1反应的特征现象也是支持SN1机理的重要实验证据重排是SN 1反应的特征,也是支持SN1机理的重要实验证据。
如果一个亲核取代反应中有重排现象,那么这种取代一般都是SN1机理。
但要注意,如果某亲核取代反应中没有重排,则不能否定SN1机理存在的可能性。
因为并不是所有的SN1反应都会发生重排。
双分子亲核取代机理Bimolecular NucleophilicSubstitution2SNS2 反应势能图N•一步反应•过渡态能量最高•不发生重排Br C ....–....HOBr C ....–....HO CBr δ –....HO ....Br C ....–....HO CBr δ –....HO ....C HO ........Br8.4.2影响反应机理及其活性的因素烃基结构的影响离去基团的影响亲核试剂的影响溶剂效应相对速度C HH H 1.0C Br H CH 3H 1.7C CH 3CH 3H 45C CH 3CH CH 3100,000,000在S N 1反应中烃基结构的影响溴代烃在甲酸水溶液中水解反应的相对S N 1速度为:(CH3)2CHBr(CH3)2CHBrCH3BrCH CH Br(CH3)2CHBr叔卤(CH3)3CBr相对速度C C HH H H H 1.0C C H HH H CH 30.28C C HH CH 3H CH 0.036C C H H CH 3CH 3CH 0.0000042当伯卤代烃β-位上有侧链时,S N 2反应速度也有明显下降。
醇生成醚反应类型

醇生成醚反应类型醇生成醚反应是一种常见的有机化学反应,也是制备醚类化合物的重要方法之一。
醚分子中的氧原子以两个碳原子上的键连接两个烷基基团,通常可分为醇醚化和醚醚化两种类型。
在实际应用中,醇生成醚反应广泛用于合成醚类溶剂,以及药物、香料和化学品等有机合成中。
醇生成醚反应的机理主要有三种:电子转移(SN2类型)机理、质子转移(酸催化)机理和分子内消除(SN1类型,E1类型)机理。
1.电子转移(SN2类型)机理在醇生成醚反应中,若醇分子通过亲核取代反应直接攻击烷基烷氧化物(烷基氧离子),生成碳-氧之间的新键,并同时将烷基离子(消除的基团)踢出,这种反应机理称为电子转移机理,或SN2类型机理。
电子转移反应一般适用于次级醇和三级醇。
例如:CH3CH2OH + CH3Br → CH3CH2OCH3 + Br-2.质子转移(酸催化)机理醇生成醚反应还可以通过酸催化进行,其中酸催化下的醇与另一个醇分子(甲醇或乙醇)进行质子转移,生成质子化醇和水。
质子化醇与另一个醇分子反应,形成醚和水,同时还有一个质子还原步骤。
质子转移反应机理适用于一级和二级醇。
例如:CH3CH2OH + CH3OH → CH3CH2OCH3 + H2O3.分子内消除(SN1类型,E1类型)机理分子内消除机理是指醇分子中的氢离子与醇分子内的醇基发生质子化反应,形成质子化醇。
然后,质子化醇通过氧离子的抽出形成破碳-氧键,生成碳正离子。
接着,质子化醇中的氢离子以共轭碱的形式从溶液中脱除,产生另一个醇分子和水。
例如:CH3CH2OH → CH3CH=CH2 + H2O总结醇生成醚反应是一种重要的有机化学反应,常见的机理有电子转移(SN2类型)、质子转移(酸催化)和分子内消除(SN1类型,E1类型)。
根据反应机理,我们可以选择不同的底物和反应条件,以合成所需的醚类化合物。
醇生成醚反应在合成醚溶剂、药物、香料和化学品等有机化合物的合成中具有重要的应用价值。
有机反应机理-SN1及SN2机理

有机反应机理反应机理(又称反应历程)是研究反应的实际过程,哪个键先断裂、哪个键先形成、键断裂和形成的顺序、每步的相对速率、原子或基团在反应过程中的键合情况及空间位置变化等等。
由于分子的振动和碰撞是在10-12~10-14 s内完成,目前还没有能直接观察在这样短的时间内分子和原于运动情况的手段或仪器,而只能根据反应中观察的现象推测反应可能经历的过程。
因此,日前关于反应机理的描述都是根据实验的结果和观察到的现象进行间接推理或假设。
20世纪80年代末,ZewailA H研究成功了—种激光脉冲式的超高速闪光照相机,它的脉冲时间只有几十个飞秒(f s=10-15s),可以让人们通过超高速照相机拍摄的“慢动作”观察化学反应过程中原子与分子的化学键形成和断裂的转变形态,跟踪显示化学反应的全过程。
为研究反应机理和预测化学反应提供了一种新方法,这一成果最先用于研究简单气态分子的化学反应,现在已推广到液态和固态的化学变化,并由此诞生了一门称之为“飞秒化学”的新学科,zewnil也因其卓越贡献荣获1999年诺贝尔化学奖。
此外,量子化学的不断发展和超高速大容量计算机的飞速换代也为计算化学反应的全过程提供了可能。
虽然目前用计算机计算和描述化学反应的全过程还比较遥远,但已有了成功的苗头。
1、有机反应分类有机反应的数目和范围十分庞大,根据反应中键的断裂及形成方式可将有机反应分为:自由基反应、离子反应和分子反应。
有机反应也有按照原料和产物之间的关系进行分类,把几乎所有的有机反应分成六类,分别是取代反应、消去反应、加成反应、重排反应、氧化还原反应及几种反应类型的结合。
2、有机反应中试剂分类在有机反应试剂中,除双自由基外绝大部分具有偶数电子的试剂属于离子试剂;另一部分具有奇数电子的试剂则称为自由基试剂。
离子试剂又可进一步分为亲电试剂和亲核试剂。
亲电试剂:在反应过程中接受电子或共享电子(这个电子原属于另一个反应物分子)的试剂称为亲电试剂;亲核试剂:在反应过程中供给电子进攻反应物中带部分正电荷原子的试剂称为亲核试剂。
有机合成中的重要反应机理和过渡态

有机合成中的重要反应机理和过渡态有机合成是现代有机化学的重要分支领域之一,通过有机合成反应可以构建出各种有机分子结构,从而实现对药物、生物活性物质等有机化合物的合成。
在有机合成中,研究反应机理和过渡态的理解对于合成高效、高选择性的反应方法具有重要意义。
重要反应机理的研究是有机合成的基础。
在有机合成反应中,通过基础反应类型的扩展和变形,可以构建起更加复杂的分子。
而了解反应的机理,则有助于我们理解它们背后的原理。
例如,SN1和SN2反应是有机化学中最基础的亲核取代反应类型。
SN1代表“双离子替代”反应机理,其中一个反应步骤是亲核试剂(亲核物质)与基质(极性离子)之间的反应。
而SN2代表“双原子替代”反应机理,其中亲核试剂和脱离基质以共价键连接的基质在同一步骤中参与反应。
了解这些反应机理,可以指导我们在有机合成中设计和选择合适的反应条件和试剂。
过渡态是化学反应中的一个关键概念,它描述了反应物和产物之间的临时状态。
在有机合成中研究反应过渡态的结构和性质可以揭示反应的速率决定步骤,有助于我们理解催化剂的作用和反应路径的选择性。
例如,铃木偶联反应是有机合成中的重要方法,其中芳香醚汞的偶联可以在存在钯催化剂的情况下进行。
研究揭示了偶联反应的过渡态结构,这是由于钯催化剂引发的反应活性。
另一个有机合成中的重要反应是还原反应。
还原反应可以将含氧官能团(如酮、醛、酯等)还原为相应的醇。
在化学还原过程中,还原剂通常通过损失一些电子来转移氧原子,从而将氧官能团还原为醇。
而还原反应的机理研究则可以揭示还原剂的选择性和反应速率等重要信息。
例如,氢化钠是一种常用的还原剂,可以将醛和酮还原为相应的醇。
研究发现,氢化钠的机理是通过释放氢气来催化反应。
有机合成中还存在一些非常重要的反应机理,例如过渡金属催化的反应、自由基反应等。
通过研究这些反应的机理和过渡态,我们可以深入理解有机合成反应的本质,并为有机合成方法的发展提供指导。
因此,了解重要反应机理和过渡态对于有机合成领域的研究和发展具有重要意义。
北京市考研化学复习资料有机化学中的反应机制解析

北京市考研化学复习资料有机化学中的反应机制解析有机化学是化学专业中的重要分支,研究有机物的合成、结构、性质和反应机制。
在北京市考研化学复习资料中,有机化学通常是考试的重点内容之一。
本文将针对有机化学中的反应机制进行解析,帮助考生更好地理解和掌握该部分知识。
一、取代反应机制1. 亲核试剂的攻击和离去基团的离开是取代反应机制的关键步骤。
根据亲核试剂攻击的位置,反应可分为SN1和SN2两种类型。
SN1反应中,离去基团先离去,形成一个离去离子,然后亲核试剂与离去离子发生反应。
SN2反应则是亲核试剂直接与离去基团同时发生反应。
2. SN2反应的速率受到亲核试剂浓度、反应物浓度和溶剂极性的影响。
较强的亲核试剂、高浓度的反应物和无极性溶剂有利于SN2反应的进行。
3. SN1反应的速率受到离去基团离去的速度和生成物稳定性的影响。
较好的离去基团和较稳定的离去离子有利于SN1反应的进行。
二、加成反应机制1. 加成反应是指两个分子中的一个或多个原子或官能团结合成一个产物分子的反应。
加成反应可分为电子云、亲核和共轭加成三种类型。
2. 电子云加成反应中,物质的空间分布发生改变,通常由亲电试剂攻击多电子结构而形成。
3. 亲核加成反应是以亲核试剂作为反应物,与电子云中的正电荷形成新的键。
4. 共轭加成反应中,通过空间不同区域的共轭电子体系发生反应。
三、消除反应机制1. β 消除反应是指有机化合物中的两个官能团通过β碳原子之间的键的切断和新键的形成来发生反应。
最常见的β 消除反应是酸催化的加成-消除反应。
2. 非酸催化的β 消除反应主要发生在碱性条件下,例如以强碱作为试剂。
四、重排反应机制1. 重排反应是指有机化合物分子中的原子或团在内部发生重新排列形成不同的化合物。
常见的重排反应有酸催化的β消除重排和异构化反应。
2. β 消除重排反应中,分子中的酸性氢通过离子中的原子或团的移位进一步进行消除重排形成稳定的产物。
3. 异构化反应是通过原子或团的重新排列形成不同构象或同分异构体。
SN1和SN2反应机制

SN1和SN2反应机制一、SN1反应机制:SN1反应是亲核取代反应中的一个重要机制,SN代表取代反应的类型,其中S代表极性反应,N代表亲核反应。
SN1反应包括三个步骤:离去基团脱离、亲核物种攻击、质子转移。
1.离去基团脱离:在SN1反应中,首先离去基团(通常为卤素)脱离底物,形成一个类似于溴化亚甲基的离子中间体。
此步骤的速率决定了整个反应的速率。
2.亲核物种攻击:离去基团脱离后,生成的离子中间体很不稳定,会很快解离为一个稳定的互变异构体(通常为碳正离子)和一个孤立的正离子。
3.质子转移:亲核物种(通常为一个带负电的离子,例如水、醇等)攻击形成的稳定的碳正离子,形成最终的产物。
SN1反应的特点:1.SN1反应是一个两步反应,中间体稳定性较高,反应速率主要取决于离去基团的离去速率。
2.SN1反应喜欢消耗极性溶剂,反应速率越快。
3.反应底物的立体化学构型变化较小,因为离去基团首先脱离产生的离子中间体是不手性的。
4.SN1反应喜欢在稳定的孤立原子上发生,通常涉及孤立空间轨道的产物形成。
二、SN2反应机制:SN2反应也是亲核取代反应中的一种机制,代表一级亲核取代反应,其中S代表极性反应,N代表亲核反应,2代表反应中存在两个底物。
1.亲核物种攻击:在SN2反应中,亲核物种(例如卤素离子、醇酸等)直接攻击底物分子,取代底物上的一个离去基团。
此时,键的断裂和键的形成是同步进行的。
2.离去基团脱离:在亲核物种攻击时,底物上的离去基团会立即脱离,形成产物。
SN2反应的特点:1.SN2反应是一个一步反应,整个过程的速率由亲核物种的浓度和底物的浓度共同决定。
2.反应速率与底物的立体化学构型有关,反应底物的立体构型由于亲核物种的攻击而发生倒置。
3.SN2反应对于溶剂的要求较宽泛,可以在极性和非极性溶剂中进行。
4.SN2反应喜欢在不稳定的孤立原子上发生,通常对于为手性的底物可以得到相应手性产物。
总结:SN1和SN2反应机制都是有机化学中常见的取代反应机制。
单分子亲核取代反应(SN1)

亲核取代反应,或称亲核性取代反应,通常发生在带有正电或部份正电荷的碳上,碳原子被带有负电或部份负电的亲核试剂(Nu:−)进攻而取代。
常分为两种反应机构:单分子亲核取代反应(S N1)双分子亲核取代反应(S N2)单分子亲核取代反应S N1 亲核取代反应机理如下:第一步是原化合物的解离生成碳正离子和离去基团,然后亲核试剂与碳正离子结合。
由于速控步为第一步,只涉及一种分子,故称 S N1 反应。
常发生于:碳上取代基较多(如:(CH3)3CX),使得相应碳正离子的能量更低,更加稳定。
同时位阻效应也限制 S N2 机理中亲核试剂的进攻。
对碳阳离子生成有利条件:碳>1级碳),一级碳几乎低的分子。
S N 1 亲核取代反应特点: 反应速率决定步骤在于离解反应,反应物。
从立体化学观点来看,该反应在碳阳离子形成时,整个分攻击,形成新分子。
故理论亲核剂倾向由反侧攻击形成 该反应适合在高极性稍有质稳定碳正离子,稍有质子性应平衡往产物移动。
S N 2机理(双分子亲核取代)S N 2 亲核取代反应机理如下: 较强亲核试剂直接由背面进攻碳原完成取代反应。
条件:有许多释电子基团帮助稳定碳阳离子的正碳几乎不能够单独存在,而会立刻和周遭发生化于离解一步(第一步),所以根据动力学理论推,该反应的反应物若为光学异构物之一,则产物反整个分子略呈现平面三角形,亲核体可以由平面故理论上反转机率为50%,但因原先脱离的阴离击形成反转的产物。
稍有质子性溶剂中进行,高极性有助于利用本身质子性溶剂提供质子与较强亲核剂(通常是被脱攻碳原子,并形成不稳定的一碳五键的过渡态子的正电荷(3级碳>2级发生化学反应而形成内能更理论推断该反应为一级速率产物反转机率略大于50%。
由平面三角形上下两侧进行的阴离子影响碳阳离子,故用本身极性带有的部份负电是被脱离的)化合有助于反渡态,随后离去基团离去,常发生于:碳原子取代较少(如:CH3X),可较容易使 S N2 反应发生。
判断SN、SN2反应

SN1为单分子亲核取代反应;SN2为双分子亲核取代反应。
SN1的过程分为两步:第一步,反应物发生键裂(电离),生成活性中间体正碳离子和离去基团;第二步,正碳离子迅速与试剂结合成为产物。
总的反应速率只与反应物浓度成正比,而与试剂浓度无关。
S N2为旧键断裂和新键形成同时发生的协同过程。
反应速率与反应物浓度和试剂浓度都成正比。
能生成相对稳定的正碳离子和离去基团的反应物容易发生SN1,中心碳原子空间阻碍小的反应物容易发生SN2 。
1. SN1反应是一个一级反应(first order reaction);SN2反应是一个二级反应(second order reaction)2. SN1反应的溶液通常是极性的,如H2O,ROH.SN2反应的溶液通常是极性无质子的,DMSO,DMF3.如果离去集团非常容易离去,那么SN1就更容易产生,如甲苯磺酸离子,碘离子。
怎么判断卤代烃的反应是双分子亲核取代反应SN2还是单分子亲核取代反应SN1?看反应分子的结构和所给的反应条件。
如果是伯卤的话一般就是SN2叔卤、烯丙型等的话一般是SN1还有反应条件,包括亲核试剂的浓度、离去基团的好坏等等,这些都要靠自己首先要熟悉掌握了两种反应各自的特点才能正确判断的。
还有,最好能记住一些常出现的典型的反应类型,像和硝酸银的乙醇溶液反应的,就是SN1,而和碘化钠进行交换反应的就是SN2的,等等。
这样在做题时才能快速准确。
请从"立体化学”的角度阐述单分子取代反应和双分子取代反应的区别。
一、SN1反应SN1历程离解慢反应形成的碳正离子中间体具有平面结构。
可以预料,试剂Nu从平面两侧进攻的机会均等,如果反应中心是一个手性碳原子,将得到外消旋化产物。
大量的实验结果表明,100%的外消旋化并不多见。
外消旋化的同时常常伴随着某种程度的构型转化,或构型保持的光学活性产物,且构型转化产物要多些。
历程可以圆满解释上述实验结果,作用物结构、进攻试剂的种类、浓度、反应条件的影响都会使反应偏离SN1的极限情况。
双分子反应

双分子反应实质不同。
SN1:SN1的实质是单分子亲核取代反应。
SN2:SN2的实质是双分子亲核取代反应。
特点不同。
SN1:SN1只有反应物参与反应速率控制步骤。
SN2:SN2的反应速率与两种物质的浓度成正比。
看反应产物有没有构型翻转情况,如果产物构型全部翻转(即产物单一)则是SN1反应,反之若即有构型翻转产物又有不翻转的产物(即产物不唯一)则是SN2反应。
影响:SN1的条件只有底物的性质与浓度,底物C+离子稳定性越大越趋向于SN1,比如三级C+离子苄基C+ 稀丙基C+ 因为生成C+离子,所以要求溶剂是极性。
而影响SN2的条件不光是和底物的性质有关,还与溶剂,亲核试剂的性质有关,SN2影响反应的方面是空间位阻,所以底物是一级C容易进行苄基与稀丙基也容易进行,忘记原因了,亲核试剂一般碱性强的,亲核试剂比较小的容易进行,伯卤代烃以SN2为主,叔卤代烃则以SN1为主。
还有便是要根据反应的产物判断!一般说来,直链的一级卤代烷,SN2反应很容易进行(因而消除反应少,除有强碱时),二级卤代碗及在beta碳上有侧链的一级卤代烷,SN2反应速率较慢,低极性溶剂强亲核试剂有利于SN2反应发生,三级卤代烷SN2反应很慢! SN1反应的特征是分步进行的单分子反应,并有活泼中间体碳正离子的生成,在反应过程中,其决定反应速度的一步发生共价健变化的有两种分子,或者说有两种分子参与了过渡态的形成,因此,这类反应历程称为双分子亲核取代反应历程是SN2。
溴乙烷消去反应属于双分子消除反应E2反应,碱进攻β-氢,并与离去基同时离去,生成烯烃反应机理如下:CH3CH2-X + :B → CH3CH(Br)-H…B 由强碱进攻β氢,形成过渡态CH3CH(Br)-H…B → CH2=CH2 + HB 键断裂,同时生成碳碳双键SN2反应(双分子亲核取代反应)是亲核取代反应的一类,其中S代表取代(Substitution),N代表亲核(NuCleophilic),2代表反应的决速步涉及两种分子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有机化学
简介
SN2立体化学
SN1立体化学
课堂总结
练习
sp3 sp3
四面体结构
E Ea
过渡态
四面体结构
甲基溴
CH3Br + OHCH3OH + Br-
反应一步完成; 2 sp 只经过一个过渡态; 平面结构 反应中无中间体形成 。 甲醇
反应进程
有机化学
简介
SN2立体化学
SN1立体化学
课堂总结
练习
SN2的立体化学
有机化学
SN2立体化学
SN1立体化学
课堂总结
练习
Ts(1)
Ts(2)
E
Ea1 Ea2
(CH3)3C+ (CH3)3CBr (CH3)3COH
反应分步进行; 经过两个过渡态; 反应中有正碳离子生成。来自反应进程有机化学
简介 SN2立体化学 SN1立体化学 课堂总结 练习
SN1的立体化学
有机化学
SN2立体化学
SN1和SN2反应机制
分子型亲核试剂 Nu: 离子型亲核试剂 Nu-
H2O;ROH;NH3 … OH-;RO-;CN-;X- …
..
..
..
有机化学
简介
SN2立体化学
SN1立体化学
课堂总结
练习
双分子亲核取代 (SN2反应)
反应速率= k [CH3Br][OH-]
单分子亲核取代 (SN1反应)
反应速率= k [(CH3)3CBr]
SN1立体化学
课堂总结
练习
有机化学
SN2立体化学
SN1立体化学
课堂总结
练习
外消旋化
有机化学
SN2立体化学 SN1立体化学 课堂总结 练习
知识拓展
问:SN1反应的立体化学特征:产物外消旋化, 最后得到的产物会是外消旋体
?
请查阅相关资料,以小论文的形式对上述问题 进行阐述。 (可参考:《March 高等有机化学》)
SN1立体化学
课堂总结
练习
练 习
有机化学
SN2立体化学
SN1立体化学
课堂总结
练习
课堂练习
1 反应? 下列化合物中哪一个更易进行 SN2
√
√
有机化学
SN2立体化学 SN1立体化学
影响SN2反应 主要是空间效应
影响SN1反应 主要是电子效应
课堂总结
练习
课堂练习
问:根据下列现象,判断卤代烷与NaCN的乙醇溶液
有机化学
SN2立体化学
SN1立体化学
课堂总结
练习
背面进攻中心碳 !
手性中心碳的构型翻转
瓦尔登(Walden)转化
有机化学
SN2立体化学 SN1立体化学 课堂总结 练习
知识拓展
在SN2反应中手性中心碳的R/S构型一定会改变
?
(R-构型)
(R-构型)
Walden 转化
构型翻转 中心碳上四个键构成的骨架构型的翻转
(1)反应分两步进行,旧键先断裂,新键再生成; (2)反应速率只与卤代烷的浓度成正比; (3)反应中有碳正离子产生,产物构型外消旋化, 可能会出现重排产物。
(1)反应一步完成,旧键的断裂和新键的生成同时进行; (2)反应速率与卤代烷和亲核试剂的浓度成正比; (3)反应过程中构型发生瓦尔登转化。
SN2立体化学
的反应,指出它们分别属于那种SN反应?
SN2 SN1 SN1 SN2
有机化学
SN2立体化学
SN1立体化学
课堂总结
练习
有机化学
SN2立体化学
SN1立体化学
课堂总结
练习
主要产物
重排动力:从相对不稳定的碳正离子转变成更稳定的碳正离子
有机化学
SN2立体化学 SN1立体化学 课堂总结 练习
SN反应机理
总结
有机化学
SN2立体化学
SN1立体化学
课堂总结
练习
亲核取代反应
SN1 反 应 机 理 SN2 反 应 机 理
有机化学
