包材检验原始记录
包装材料微生物限度检查检验记录
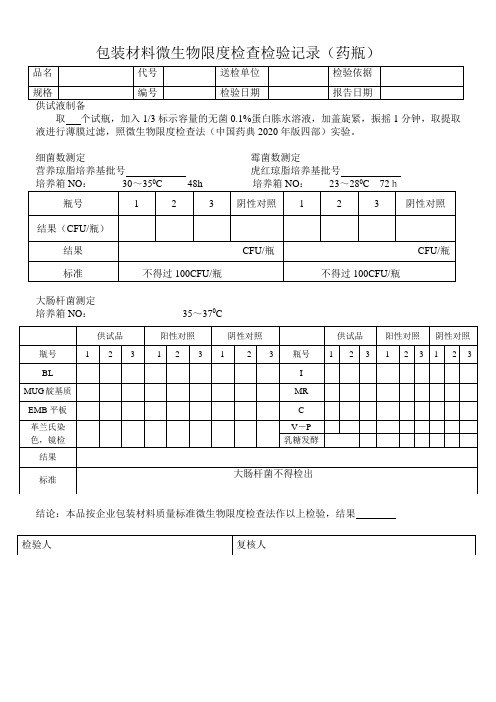
包装材料微生物限度检查检验记录(药瓶)
取个试瓶,加入1/3标示容量的无菌0.1%蛋白胨水溶液,加盖旋紧,振摇1分钟,取提取液进行薄膜过滤,照微生物限度检查法(中国药典2020年版四部)实验。
细菌数测定霉菌数测定
营养琼脂培养基批号虎红琼脂培养基批号
00
大肠杆菌测定
培养箱NO:35~370C
结论:本品按企业包装材料质量标准微生物限度检查法作以上检验,结果
包装材料(复合膜、袋)微生物限度检查检验记录
供试液制备
取试样用开孔面积为20cm2的消毒过的金属模板压在内层面上,将无菌棉签用无菌0.1%蛋白胨水溶液稍沾湿,在板孔范围内擦抹5次,换1支棉签再擦抹5次,每个位置用2支棉签共擦抹10次。
共擦抹5个位置100cm2。
每支棉签擦抹完后立即剪短,投入盛有30ml无菌0.1%蛋白胨水溶液的锥形瓶中,全部擦抹棉签均投入瓶中后。
迅速摇晃1分钟,即得供试液。
细菌数测定:霉菌数测定:
营养琼脂培养基批号玫瑰红纳琼脂培养基批号
培养箱NO:℃48h 培养箱NO:℃72h
大肠杆菌测定:
胆盐乳糖培养基批号:MUG培养基批号:
培养箱NO:36℃±1℃
结论:本品按国家药品监督管理局,国家药品包装容器(材料)标准(试行),药品包装通则,微生物限度检查法检验,结果规定。
GMP质量体系洗瓶生产原始记录

GMP质量体系洗瓶生产原始记录GMP是指良好生产规范(Good Manufacturing Practice),是一种质量体系的标准,旨在确保生产过程中的质量和一致性。
洗瓶是一种常见的包装容器,用于装载各种液体药品、食品和化妆品等。
在洗瓶生产过程中,质量体系的严格执行对于确保产品质量至关重要。
以下是GMP质量体系洗瓶生产的原始记录。
原始记录1:生产设备自检记录日期:XX年XX月XX日生产设备自检项目:1.设备清洁和卫生状况2.设备运转情况3.相关传感器和仪表是否正常工作4.环境温度和湿度是否符合要求5.相关设备标识和标牌是否完好6.设备维保情况记录结论:根据自检结果,我们的生产设备符合GMP质量体系的要求。
下一步,将进行洗瓶生产工艺的开展。
原始记录2:原料和包材检验记录日期:XX年XX月XX日原料和包材检验项目:1.原料外观和颜色检验2.原料标识、标牌和包装情况检验3.包装材料密封性检验4.包材质量证明和合格证明文件是否齐全5.原料和包材的溶解度和稳定性检验结论:根据检验结果,所有原料和包材符合GMP质量体系的要求。
下一步,将进行洗瓶生产前的清洗和消毒工作。
原始记录3:洗瓶生产清洗和消毒记录日期:XX年XX月XX日洗瓶生产清洗和消毒项目:1.清洗剂和消毒剂的浓度和使用情况记录2.清洗和消毒设备的使用情况记录3.清洗和消毒时间记录4.清洗和消毒效果检验5.清洗和消毒后的生产设备情况记录结论:根据清洗和消毒记录,洗瓶生产设备已经完成清洗和消毒工作,并符合GMP质量体系的要求。
下一步,将进行洗瓶生产的标准操作程序。
原始记录4:洗瓶生产标准操作程序记录日期:XX年XX月XX日洗瓶生产标准操作程序项目:1.操作人员的培训和操作证书记录2.操作前的准备工作,包括设备启动和校验3.洗瓶生产工艺的操作步骤记录4.洗瓶数量和生产时间记录5.洗瓶生产过程中的异常情况和处理记录结论:根据标准操作程序记录,洗瓶生产过程中符合GMP质量体系的要求。
包装材料实验数据记录表格
此册尚处完善期,请需要的同学切勿急于打印!!!!!
由于实验颇多,为方便大家系统记录各实验数据及方便保留以免丢失,根据自己预习和参照已做实验同学的数据,特制作各实验数据记录表格如下各表,由于个人能力不及和时间仓促,个别表格难免出现疏忽或错误,敬请预习好的同学及时信息我,以便更正与完善,谢谢!(实验前两天会传上最后完结版!!!!!)
编者:彭志鹏包装材料的厚度与紧度:
注:数据精确至0.01mm
瓦楞纸板试样尺寸:200×250mm(测量五个点)
注意:数据精确至0.01mm
塑料薄膜厚度:
膜宽小于100mm 时至少取三个不同点进行测量。
对于未裁边的样品,应在离边50mm
包装材料的定量:
M —试样叠的质量(g ); a —每一张试样的面积(m ); n —每一叠试样的层数
纸与纸板的撕裂强度: GB455.1:S n F t ⋅=16、GB455.2:S n F t ⋅=4
;G
F X t = 2
n —被测试样的层数;S —标尺读数(mN);F t —被测试样撕裂度值(mN );X —撕裂指数
(m N.m 2
/g )。
(或参照第六页《纸张的撕裂度》)
S:挺度实测值,;n:对应不同砝码的分度值(见指导书);R:力度盘上的读数值。
试样的定量W= g/m 2。
公式:
P X =
X :耐破度指数,2
m KPa ⋅/g ;P 平均耐破度,KPa ;W 试样的定量:g/m 2。
塑料薄膜的耐磨性:(材料LDPE膜)
塑料薄膜的撕裂强度:
纸张撕裂度:。
产品检验原始记录

产品检验原始记录日期:XXXX年XX月XX日检验员:XXX一、产品基本信息产品名称:XXXXX生产日期:XXXX年XX月XX日生产批次:XXXXX生产线号:XXXXX包装规格:XXXXX二、检验项目和要求序号检验项目检验要求1外观检查外包装应完好无损,内包装应清洁无异味;产品表面应无明显划痕、锈蚀等瑕疵。
2规格尺寸产品尺寸应符合标准规定。
3功能性能产品应具备正常的功能性能,能够满足使用要求。
4安全性能产品应符合相关的安全标准,无伤害人体的物质和设计缺陷。
三、检验步骤和结果1.外观检查-检查外包装:外包装完好无损,无破损,符合要求。
-检查内包装:内包装清洁无异味,符合要求。
-检查产品表面:产品表面无明显划痕、锈蚀等瑕疵,符合要求。
2.规格尺寸-使用测量工具对产品进行测量。
-比较测量结果与标准规定,确认产品尺寸是否符合要求。
3.功能性能-连接电源,进行基本功能测试。
-检查产品是否能够正常工作,是否满足预期的功能要求。
4.安全性能-检查产品是否符合相关的安全标准,如防火性能、电气安全等。
-检查产品是否存在可能伤害人体的物质和设计缺陷。
四、检验结论根据对产品的检验结果进行综合评估1.外观检查:合格2.规格尺寸:合格3.功能性能:合格4.安全性能:合格五、总结与建议经过本次产品检验,产品符合相关的质量标准和要求,具备正常的外观、规格、功能和安全性能。
建议在生产过程中继续保持良好的品质控制,确保产品的稳定性和一致性。
六、备注七、检验员签名:。
检验原始记录标准管理规程
目的:检验原始记录是判定检验结果的原始证明,是质量检验的原始数字和文字记录,是反映质量检验的第一手资料。
原始记录是否准确、真实、完整将直接影响检验工作的质量,为规范检验原始记录的管理,特制定规程。
应用范围:本规程适用于原辅料、包装材料、中间体、成品等检验原始记录的管理。
责任人:QC。
内容1 检验记录是出具检验报告书的原始记录,检验原始记录必须用蓝黑墨水或碳素笔及时填写,做到记录原始、数据真实、字迹清晰、易读、资料完整。
2 检验人员检验前要仔细核对检品标签内容、封装情况是否正常,样品的数量是否够所检用量的三倍。
3 检验记录应当保持清洁,不得撕毁和任意涂改,如发现有误,可在原处画一横线,保持原有信息仍清晰可辩,书写正确信息后签名或盖章并加注日期,必要时注明情况,但不得涂改。
4 检验过程中的全部项目、实验现象、原始数据、实验温度、仪器名称、型号等,均应及时完整记录。
严禁事先记录、事后补记、转抄。
5 检验原始记录应由第二个有检验资质的人进行复核并签名。
6 检验或试验结果无论成败,均应详细记录,失败的应及时总结分析,并在原始记录上注明。
7 如检验设备具备打印功能,应尽可能采用设备自动打印的记录、图谱和曲线图。
自动打印的记录、图谱和曲线图上应标明样品的名称、批号和相应要求参数,还应有操作人员签名及检验日期。
8 检验记录中不应出现空白区域或空白页。
如确认空白区域或空白页不需填写后,应在空白区域用一斜线划掉。
9 原始检验记录不得携出所外,不得私自泄露有关内容。
活页实验记录应系统收集统一编号,按规定由QA归档保存,原辅料、包材、中间产品及成品保存至相关成品有效期后一年,其它记录保存至少三年。
10 实施细则10.1 基本要求:10.1.1 原始检验记录应采用统一印制或打印的活页记录纸和各类专用检验记录表格,并用蓝黑墨水或碳素笔书写(显微绘图可用铅笔)。
凡用微机打印的数据与图谱,应附记录后或剪贴于记录上的适宜处;如系用热敏纸打印的数据,为防止日久褪色难以识别,应以蓝黑墨水或碳素笔将主要数据记录于记录纸上。
药材检验原始记录样本
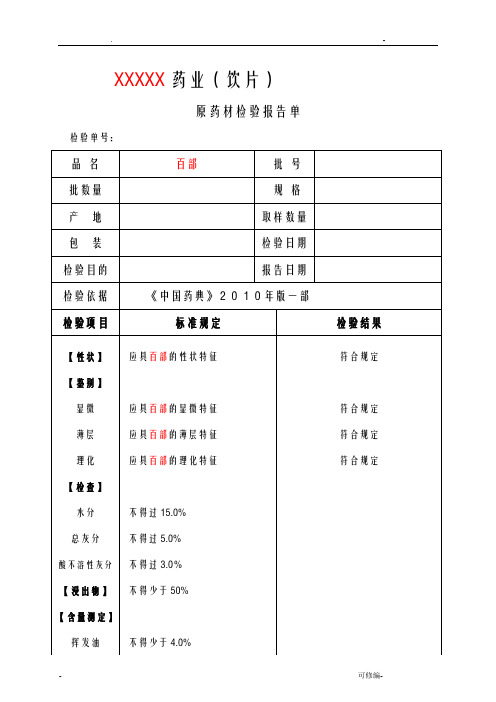
XXXXX药业(饮片)原药材检验报告单检验单号:XXXXX药业(饮片)原药材检验记录检验单号:【性状】结果:【鉴别】(1)显微鉴别横截面:结果:粉末:结果:(2)薄层鉴别供试品溶液的制备:取粉末1g,加乙醇15ml,加热回流1小时,放冷,滤过,滤液蒸干,残渣加乙醇5ml使溶解。
对照药材、对照品溶液配制:取菊花对照药材1g,同法制成对照药材溶液。
再取绿原酸对照品,加乙醇制成每1ml含O.5mg的溶液。
温度:(℃)相对湿度:(%)-丙酮-甲醇-5%浓氨试液(6:1:1:0.1)薄层板:硅胶G灯光:白光、紫外光灯(365nm)展距:(cm)供试品色谱中,在与对照药材色谱相对应的位置上,显相同颜色的荧光斑点。
S1为对照药材(对照品为中检所提供编号为)S2为对照品(对照品为中检所提供编号为)T为样品结果:【检查】杂质不得过XX % (附录IX A)杂质称重:g杂质计算结果为:% (标准规定不得过XX %)结果:膨胀度应不低于4.0(附录IX O)温度:(℃)相对湿度:(%)电子天平型号:CP214 溶剂:水样品编号1# 2# 3#干燥品称重:g g g第一次样品膨胀后体积:ml ml ml第二次样品膨胀后体积:ml ml ml(两次差异不超过0.1ml)膨胀度计算结果为:(标准规定不低于4.0)结果:水分不得过12.0% (附录ⅨH 第一法)。
温度:(℃)相对湿度:(%)烘箱型号:DHG-91012SA型电子天平型号:CP214样品编号1# 2# 第一次称量瓶干燥(105℃3h) (g)(g)第二次称量瓶恒重(105℃1h) (g)(g)样品称重(g)(g)第一次称量瓶+样品干燥(105℃5h) (g)(g)第二次称量瓶+样品恒重(105℃1h) (g)(g)水分计算结果为:(%)(标准规定不得过12.0%)结果:总灰分不得过4.0%(附录ⅨK)温度:(℃)相对湿度:(%)马福炉型号:SX2.5-10电子天平型号:CP214样品编号1# 2# 第一次坩锅称重(600℃3h)(g)(g)第二次坩锅恒重(600℃0.5h) (g)(g)样品称重(g)(g)第一次坩锅+残渣称重(600℃3h) (g)(g)第二次坩锅+残渣恒重(600℃0.5h) (g)(g)总灰分计算结果为:(%)(标准规定不得过4.0%)结果:酸不溶性灰分不得过3.0%(附录ⅨK)。
原辅料原始检验记录

原辅材料检验原始记录
磁片
温控贴
温控贴
检验人:审核人:检验日期:
底布
发热袋类型:1型口11型口
发热袋类型:1型口11型口
类型:1型口11型口
食盐
检验人:审核人:检验日期:
检验人:审核人:检验日期:
吸水树脂
吸水树脂
吸水树脂
细炭
细炭
进厂日
期供货
单位检
测项目
外观
颗粒度
水分
碘吸附值结论
检验人:
进厂批号进货数量取样量
检测依据原材料/外购(协)件检验规程
检测结果
应为黑色小颗粒符合口不符合口
称取试样G1=g,于底部套有干净底托的120目分析筛中盖上筛盖,筛分1分钟,称取过筛试样G2=g。
计算:G2/G1X100%=/X100%=%。
结果符合口不符合口
称取称量瓶重量6=g,向称量瓶中添加4g左右试样,总重记做G=g,盖上称量瓶放
在垫有石棉网的低温电炉上干燥20分钟,称重,记做G3=g。
计算:(G2-G3)/(G2-G1)X100%=()/(3)X100%=%
2321结果符合口不符合口
应三1000mg/g结果符合口不符合口
该批产品合格口不合格口
审核人:检验日期:
珍珠岩粉
珍珠岩粉
珍珠岩粉
双面胶
双面胶
双面胶
双面胶
包装箱
包装箱
包装袋
检验人:审核人:检验日期:
包装袋。
通用食品包材卫生指标检验原始记录

31.6:与 1.0mL 的高锰酸钾标准滴定溶液相当的高锰酸钾(c(1/5KMnO4)=0.001 mol/L)
的质量,单位为毫克(mg)。
重金属:
检验标准:GB/T5009.60-2003 吸取 20.0mL4%乙酸浸泡液于 50mL 比色管中,加水至刻度。同时做浓度为 1.0mg/L 的
标准溶液管,然后各加硫化钠溶液 2 滴。混匀比色。 试样管颜色 标准管颜色, 其结果为: 1.0mg/L
高锰酸钾消耗量=
(V1-V2)×31.6 100
×1000= (
- )×31.6 100
×1000=
mg/L
平均:
mg/L
计算结果保留三位有效数字。
V1: 试样浸泡液滴定时消耗高锰酸钾溶液的体积,单位为毫升(mL);
V2: 试剂空白滴定时消耗高锰酸钾溶液的体积,单位为毫升(mL);
c: 高锰酸钾标准滴定溶液的实际浓度,单位为摩尔每升(mol/L);
№:2013-SY
共 页第页
高锰酸钾消耗量:
检验标准:GB/T5009.60-2003
使用设备: 电子分析天平、
滴定管
V1=
mL V2=
mL c=
mol/L
高锰酸钾消耗量= (V1-V2)×31.6 ×1000= ( - )×31.6 ×1000=
100
100
mg/L
V1=
mL V2=
mL c=
mol/L
渭南市产品质量监督检验所 检验原始记录
№:2013-SY
共 页第页
蒸发残渣:
检验标准:GB/T5009.60-2003
使用设备:
电子分析天平、
恒温干燥箱
蒸发残渣(4%乙酸浸泡液):
包装材料检验记录
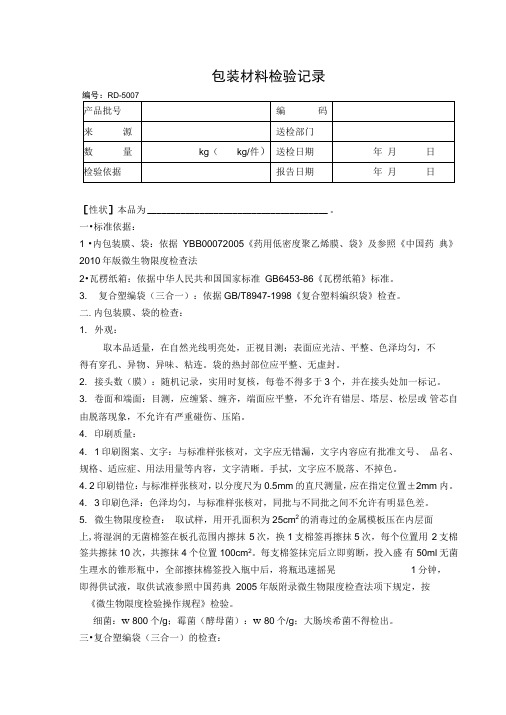
包装材料检验记录RD-5007[性状]本品为______________________________________ 。
一•标准依据:1 •内包装膜、袋:依据YBB00072005《药用低密度聚乙烯膜、袋》及参照《中国药典》2010年版微生物限度检查法2•瓦楞纸箱:依据中华人民共和国国家标准GB6453-86《瓦楞纸箱》标准。
3. 复合塑编袋(三合一):依据GB/T8947-1998《复合塑料编织袋》检查。
二.内包装膜、袋的检查:1. 外观:取本品适量,在自然光线明亮处,正视目测;表面应光洁、平整、色泽均匀,不得有穿孔、异物、异味、粘连。
袋的热封部位应平整、无虚封。
2. 接头数(膜):随机记录,实用时复核,每卷不得多于3个,并在接头处加一标记。
3. 卷面和端面:目测,应缠紧、缠齐,端面应平整,不允许有错层、塔层、松层或管芯自由脱落现象,不允许有严重碰伤、压陷。
4. 印刷质量:4. 1印刷图案、文字:与标准样张核对,文字应无错漏,文字内容应有批准文号、品名、规格、适应症、用法用量等内容,文字清晰。
手拭,文字应不脱落、不掉色。
4. 2印刷错位:与标准样张核对,以分度尺为0.5mm的直尺测量,应在指定位置±2mm 内。
4. 3印刷色泽:色泽均匀,与标准样张核对,同批与不同批之间不允许有明显色差。
5. 微生物限度检查:取试样,用开孔面积为25cm2的消毒过的金属模板压在内层面上,将湿润的无菌棉签在板孔范围内擦抹5次,换1支棉签再擦抹5次,每个位置用2支棉签共擦抹10次,共擦抹4个位置100cm2。
每支棉签抹完后立即剪断,投入盛有50ml无菌生理水的锥形瓶中,全部擦抹棉签投入瓶中后,将瓶迅速摇晃1分钟,即得供试液,取供试液参照中国药典2005年版附录微生物限度检查法项下规定,按《微生物限度检验操作规程》检验。
细菌:w 800个/g;霉菌(酵母菌):w 80个/g;大肠埃希菌不得检出。
三•复合塑编袋(三合一)的检查:1 •复合塑编袋(三合一)是指以聚乙烯树脂、聚丙烯为主要原料,经挤压、拉伸成扁丝,再经编织成的塑料编织布为基材,经流延法复合制成的用于包装粉状或粒状固体物料的复合编织袋(布/膜/纸复合为三合一,经缝制或粘和缝制成袋称为三合一袋)。
scyj-zy-gl008检验原始记录的书写要求(.教学文案

检验原始记录的书写要求一、概述检验记录是出具检验报告书的原始依据,为确保检验工作的科学和公正,检验记录必须记录及时、书写规范、数据真实、内容完整、信息充分、结论明确。
二、相关 /支持性文件《药品检验所实验室质量管理规范》(试行《中国药品检验标准操作规范》 2010年版《药品检验仪器操作规程》 (2010年版《医疗器械检验操作规范》(第一册三、检验记录的基本要求(一药品、保健食品、药包材1. 原始记录应用统一印刷的活页记录纸和各类专用检验记录表格,并用蓝黑墨水或碳素墨水笔及签字笔书写(显微绘图可用铅笔。
所有非仪器自动采集并打印的数据及计算全过程的具体数据和观察的实验现象均不得打印,必须用笔记录, 仪器自动采集并打印的数据或图谱(采集图谱时,必须开启工作站或数据处理机的日期记录功能,图谱上必须有出自于原始路径的日期记录,应剪贴于记录上的适宜处或附在记录中,粘贴处应有操作者的骑缝签名或盖章;如用热敏纸打印的数据,应将主要数据书写在记录纸上。
2.检验员在检验前必须检查检品封签是否完整,数量是否相符,包装是否完好, 应对检验卡(主卡及副卡上的全部内容逐一核对,并记录检品的编号、品名、批号、规格等。
发现检验卡与药品抽样记录及凭证和检品不一致时,应及时通知业务科核实并更正。
3.每份原始记录一般只针对一张检验卡上的检品,同时符合下列条件的一个批号以上的检品可在一份记录中按要求详细记录,其余可记录为“ 见检品编号×××××××××” :⑴供样单位相同;⑵生产单位相同;⑶品名一致;⑷规格相同;⑸包装及包装规格一致;⑹检品编号连续。
4.原始记录首页上部的栏目中不能留空白,没有内容的栏目填“ \” 。
5.检验前应详细阅读标准,发现检验标准与检品不符或有疑问时,应及时与业务科联系。
检验记录中,应先写明检验依据的名称、版本,并核对检验依据是否正确,由业务科发出的非成册标准,检验完毕后应附于检验记录之后,由业务科统一归档管理。
食品包装卫生指标检测原始记录
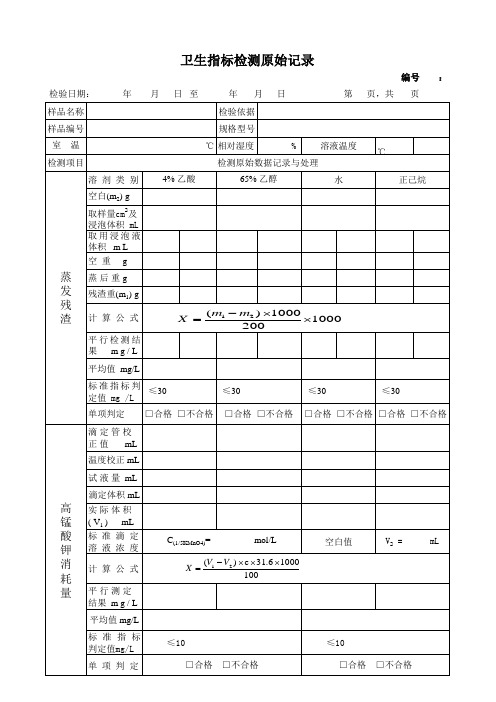
□合格 □不合格 □合格 □不合格
高 锰 酸 钾 消 耗 量
实际体积 ( V1 ) mL 标 准 滴 定 溶 液 浓 度 计 算 公 式 平行测定 结果 m g / L 平均值 mg/L 标 准 指 标 判定值mg/L 单 项 判 定 ≤10 □合格 □不合格 ≤10 □合格 □不合格 C(1/5KMnO4)=
页
深
试
样
取4%乙酸(60℃,2h)浸泡液 至 mL,硫化钠 滴。 重金属(以Pb计) □有颜色 液 □阳性 □阴性
mL,将浸泡液稀释
□
浅
标准指标 浸 泡
1.0
□无颜色
单项判定 单项判定
□合格 □不合格 □合格 □不合格
脱 色 试 验
冷餐油或无色油脂
脱脂棉往复擦拭 次: □有颜色变化 □无颜色变化 □阳性 □阴性 脱脂棉往复擦拭 次: □有颜色变化 □无颜色变化 □阳性 □阴性
主 试 仪 设
要 验 □HH-KSY型电热恒温水浴锅 65 器 备
□BJ-Y-01; □BJ-Y-02; □BJ-Y-03;□BJ-Y-04;□BJ-Y-05;□BJ-Y-06; □BJ-Y-07; □BJD-01 其他:
预 处 理 备 注
□样品满足检验要求;
□按照标准制备样品
检验人: 年 月 日
复核人: 年 月 日
单项判定
□合格 □不合格
乙
醇
单项判定
□合格 □不合格
感 官 指 标
单项判定 □合格 □不合格 □DZKW-S-6型电热恒温水浴锅96;□AUY120电子分析天平99;□ SXKW控温电热套60 □HS-211-10电热蒸馏水器 84; □HG-9023A鼓风干燥箱53; □RE-52A旋转蒸发仪 95
药品包装用铝箔检验原始记录 CP-T123-E01-01

1 / 8 检验编号物料名称药品包装用铝箔物料编码批号规格供应商生产商请验数量抽样件数检验日期请验部门报告日期复验期检验依据《内包装材料检验标准操作规程》(QC-O003-01)和《叶酸片内包装材料质量标准》(CP-T123-02)操作及结果及试液配制:序号试液名称配制日期配制数量有效期至检验用量1 高锰酸钾滴定液(0.002mol/L)2 稀硫酸溶液3 硫代硫酸钠滴定液(0.01mol/L)4 淀粉指示液5 醋酸盐缓冲液(pH3.5)6 标准铅贮备液1. 材质:本品是□否□用于固体药品包装用的铝箔,涂有保护层和粘合层【标准规定】:本品应是用于固体药品包装用的铝箔,涂有保护层和粘合层【项目结论】:检验员:检验日期:复核员:复核日期:2.尺寸:随意抽取本品长度不小于米的个样品,分别用刻度单位为1.0mm的直尺和刻度单位为0.01mm的千分尺测量其宽度和厚度。
宽度: mm mm mm mm mm mm mm mm mm mm 平均: mm厚度: mm mm mm mm mm mm mm mm mm mm 平均: mm2 / 8物料名称药品包装用铝箔批号【标准规定】:宽:200±1mm,厚度:0.024±0.003mm;宽:255±1mm,厚度:0.024±0.003mm 【项目结论】:检验员:检验日期:复核员:复核日期:3. 外观:随意抽取本品长度不小于米的个样品,在自然光线明亮处,正视目测(眼睛与被测物距离为 cm),表面是□否□洁净、是□否□平整、涂层是□否□均匀。
文字、图案印刷是□否□正确、是□否□清晰、是□否□牢固;铝箔亮面(与药品接触)是□否□为无文字面,非亮面是□否□为文字印刷面,其印刷内容及布局是□否□与质量标准所附实样一致。
【标准规定】:取本品长度不小于1米,在自然光线明亮处,正视目测,表面应洁净、平整、涂层均匀。
文字、图案印刷应正确、清晰、牢固;铝箔亮面(与药品接触)为无文字面,非亮面为文字印刷面,其印刷内容及布局应与质量标准所附实样一致。
最新药材检验原始记录样本
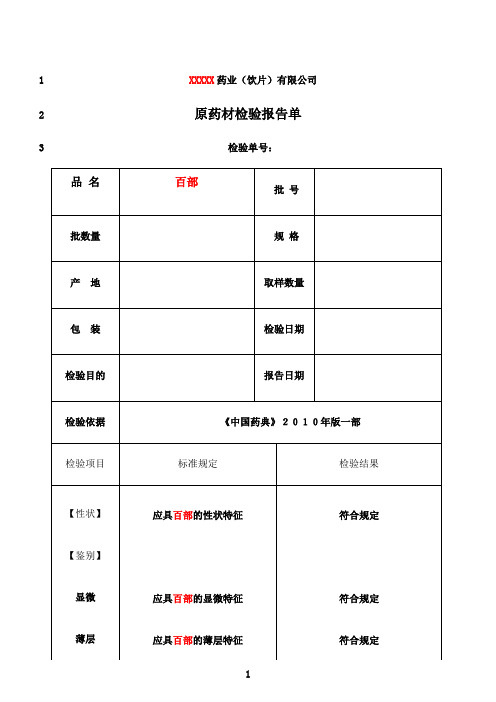
XXXXX药业(饮片)有限公司1原药材检验报告单2检验单号:345XXXXX药业(饮片)有限公司6原药材检验记录7检验单号:8【性状】9101112结果:【鉴别】(1)显微鉴别1314横截面:15161718结果:粉末:192021结果:2223(2)薄层鉴别24供试品溶液的制备:取粉末1g,加乙醇15ml,加热回流1小时,放冷,滤过,滤液蒸干,残渣加乙醇5ml使溶解。
2526对照药材、对照品溶液配制:取菊花对照药材1g,同法制成对照药材溶液。
再取绿27原酸对照品,加乙醇制成每1ml含O.5mg的溶液。
28温度:(℃)29相对湿度:(%)30展开剂:三氯甲烷-丙酮-甲醇-5%浓氨试液31(6:1:1:0.1)32薄层板:硅胶G33显色剂:稀碘化铋钾试液34灯光:白光、紫外光灯(365nm)35展距:(cm)36供试品色谱中,在与对照药材色谱相对应的37位置上,显相同颜色的荧光斑点。
38S1为对照药材(对照品为中检所提供编号39为)40S2为对照品(对照品为中检所提供编号41为)42T为样品结果:434445【检查】杂质不得过 XX % (附录IX A)杂质称重: g4647杂质计算结果为: % (标准规定不得过 XX %)48结果:膨胀度应不低于4.0(附录IX O)4950温度:(℃)相对湿度:(%)51电子天平型号:CP214 溶剂:水52样品编号 1# 2# 3#53干燥品称重: g g g54第一次样品膨胀后体积: ml ml ml55第二次样品膨胀后体积: ml ml ml56(两次差异不超过0.1ml)57膨胀度计算结果为:(标准规定不低于4.0)58结果:59水分不得过12.0% (附录Ⅸ H 第一法)。
6061温度:(℃)相对湿度:(%)62烘箱型号:DHG-91012SA型电子天平型号:CP214样品编号 1# 2#6364第一次称量瓶干燥(105℃ 3h) (g)(g)第二次称量瓶恒重(105℃ 1h) (g)(g)6566样品称重(g)(g)67第一次称量瓶+样品干燥(105℃ 5h) (g)(g)68第二次称量瓶+样品恒重(105℃ 1h) (g)(g)69水分计算结果为:(%)(标准规定不得过12.0%)7071结果:7273总灰分不得过4.0%(附录Ⅸ K)74温度:(℃)相对湿度:(%)75马福炉型号:SX2.5-10 电子天平型号:CP21476样品编号 1# 2#77第一次坩锅称重(600℃ 3h) (g)(g)78第二次坩锅恒重(600℃ 0.5h) (g)(g)79样品称重(g)(g)80第一次坩锅+残渣称重(600℃ 3h) (g)(g)81第二次坩锅+残渣恒重(600℃ 0.5h) (g)(g)82总灰分计算结果为:(%)(标准规定不得过4.0%)83结果:8485酸不溶性灰分不得过3.0%(附录Ⅸ K)。
检验原始记录与检验报告书的书写要求

XXX制药厂原辅料检验原始记录检验号:[性状]本品为无色澄明液体。
符合规定。
相对密度:韦氏比重瓶法温度:20。
C结果:0.8022结论:符合规定[鉴别] 取本品1mL, 加水5mL与氢氧化钠试液lmL后, 缓缓滴加碘试液2mL, 即发生碘仿的臭气, 并生成黄色沉淀。
结果:呈正反应[检查]酸度:取本品10.0mL, 加水25mL及酚酞指示液2滴, 摇匀, 滴加氢氧化钠滴定液(0.02mol/L)至显淡红色, 再加本品25.0mL, 摇匀, 加氢氧化钠滴定液(0.02mol/L) 0.50mL, 应显淡红色。
结果:显淡红色结论:符合规定水不溶性物质:取本品, 与同体积的水混合后, 溶液应澄清;在10。
C放置30min, 溶液仍应澄清。
结果:溶液澄清结论:符合规定复核人: 检验人: 第1页XXX制药厂原辅料检验原始记录检验号:杂醇油:取本品10mL, 加水5mL与甘油1mL, 摇匀后, 分次滴加在无臭的滤纸上, 使乙醇自然挥散, 始终不得发生异臭。
结果: 不发生异臭。
结论: 符合标准。
甲醇:取本品5.0mL, 用水稀释至100mL, 摇匀;分取1.0mL, 加磷酸溶液(1(10)0.2mL与5%高锰酸钾溶液0.25mL, 在30~35。
C保温15min, 滴加10%焦亚硫酸钠溶液至无色, 缓缓加入在冰浴中冷却的硫酸溶液(3(4)5mL, 在加入时应保持混合物冷却;再加新制的1%变色酸溶液0.1mL, 置水浴中加热20min, 如显色, 与标准甲醇溶液(精密称取甲醇20mg, 加水使成200mL)1.0mL用同一方法制成的对照液比较, 不得更深(0.20%)。
结果:供试液颜色不超过对照液结论:符合规定易氧化物:取50mL具塞量筒, 依次用盐酸、水与本品洗净后, 加入本品20mL, 放冷至150C, 加高锰酸钾滴定液(0.02mol/L)0.1mL, 密塞摇匀后, 在150C静置10min, 粉红色不得完全消失。
包材检验原始记录
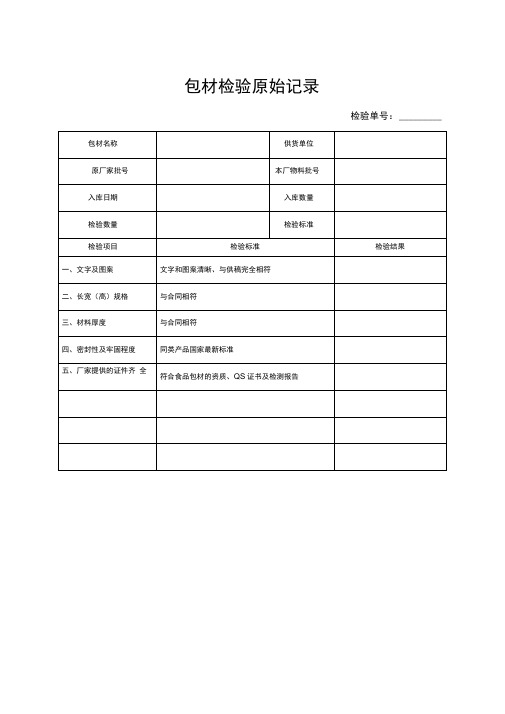
原厂家批号
本厂物料批号
入库日期
入库数量
检验数量
检验标准
检验项目
检验标准
检验结果
一、文字及图案
文字和图案清晰、与供稿完全相符
二、长宽(高)规格
与合同相符
三、材料厚度
与合同相符
四、密封性及牢固程度
同类产品国家最新标准
五、厂家提供的证件齐 全
符合食品包材的资质、QS证书及检测报告
检验过程记录:
包材名称供货单位原厂家批号本厂物料批号入库日期入库数量检验数量检验标准检验项目检验标准检验结果一文字及图案文字和图案清晰与供稿完全相符二长宽高规格与合同相符三材料厚度与合同相符四密封性及牢固程度冋类产品国家最新标准五厂家提供的证件齐全符合食品包材的资质qs证书及检测报告检验过程记录
包材检验原始记录
检验单号:
检验人(日期)
复核人(日期)
