烷烃自由基取代反应37页PPT
有机化学第02章烷烃PPT课件

B r
B r
C
H
I
C l
与
I
C H
C l
构型异构体
• 不可转换 • 理论上可分离
H HH
H H H H
与
HH H
H H
构象异构体
•可通过单键旋转转换
•一般无法分离
28
化合物性质的两个方面 物理性质 物态:气体? 液体 ? 固体? 沸点(b.p.) 熔点(m.p.) 密度(比重) 溶解度: 水中溶解度? 有机溶剂中? 折光率 化学性质:有机化学反应(本课程的重点)
5
2
4
1
3
6
7
8
这样选取主链及 编号是否合适?
20
三.构象 (comformation) 和构象异构体
➢ C—C单键是可以旋转的 ➢ 单键的旋转使分子中的原子或基团在空间产生不同的排列
(构象) ➢ 不同的构象之间为构象异构关系(一类立体异构现象)
乙烷的两种构象
21
描述立体结构的几种方式
H
H
1
H
potential energy (KJ/mol)
H H 1 12H旋 转 6 0 oH H
12H H旋 转 6 0 o
1
H2 HH
1 1
HH
HH
H
H H
H
……
HH 1 HH HH
1 2 .1
旋转中须克服能垒——扭转张力 • 电子云排斥 • 相邻两H间的von der waals排 斥力
H HH 1
CH3 C H 3C C H 3
CH3
异戊烷 新戊烷
isopentane neopentane
➢ 异构词头用词头“正”、“异”和“新”等区分 ➢ 相应的英文词头为 n- (normal)、iso和neo(注意不加“-”)
第4章烷烃自由基取代反应ppt课件

二 熔点
取决于分子间的作用力和晶格堆积的密集度。
烷烃熔点的特点
(1) 随相对分子质量增大 而增大。
(2) 偶数碳烷烃比奇数碳 烷烃的熔点升高值 大 (如右图)。
(3)相对分子质量相同的烷 烃,支链增多,熔点下降。
高度对称的烷烃分子熔点比同分子量的直链烷烃高。
伯,仲,叔氢原子的反应活性
2.溴化
C H 3 C H 2 C H 3 + B r 2
B r
1 2 7 o CC H 3 C H C H 2 B r+C H 3 C H C H 3 h v
3 %
9 7 %
Br
C H 3C H C H 3 +Br2
127oC C H 3C H C H 2Br+C H 3CC H 3 hv
第 四 章 烷烃 自由基取代反应
Chapter 2 Alkanes and free radical substitution reaction
4.1 烷烃的分类
4.2 烷烃的物理性质
外
观: 状态, 颜色, 气味
1-4 气态 5-16 液态 17- 固态 t
物理常数: 沸点(b.p.) 熔点(m.p.)
C HC H 2+B r2
C H 2 C H 2 C HC HC H 2 B r B r B r B r
4.12 烷烃的来源
(1) 石油(分馏产物); (2) 天然气
干天然气--甲烷86%~99%(体积) 湿天然气--甲烷60%~70%,还含有一定的乙烷,
丙烷,丁烷等气体. (3) 油田气--低级烷烃,如甲烷,乙烷,丙烷,丁烷和戊烷等; (4) 煤层气,沼气--甲烷等; (5) 甲烷冰.
第4章 烷烃 自由基取代

A + BC
A
........
B
...........
C
AB + C
过渡态的特点: (1)能量高。 (2)极不稳定,不能分离得到。 (3)旧键未完全断开,新键未完全形成。
反应势能图
反应势能曲线:图中表示势能高低的曲线。
势 能
A......B ....C
反应坐标:由反应物到生成物所经过的能 量要求最低的途径。 过渡态:在反应物互相接近的反应进程中, 与势能最高点相对应的结构称为过渡态。
Cl2 光
57/43=2x/6
x=4
(3)烷烃与其它卤素的取代反应 CH3 CH3-CH CH3 + Br2
光 127℃
CH3 CH3 CH3-C-Br + CH3-CHCH2Br CH3 痕量 99%
•仲,叔氢原子的反应活性:1:82:1600.溴更具有选择性.
• 与氟反应剧烈,不易控制,会引起爆炸.
CH2 > CH2
苯甲基自由基
CHCH2 > (CH3)3C > (CH3)2CH
三级丁基自由基 异丙基自由基
稀丙基自由基
> CH3CH2 > CH3
乙基自由基
>
苯基自由基
甲基自由基
两点说明
•影响自由基稳定 性的因素是很多 的,如: 电子离 域,空间阻碍, 螯合作用和邻位 原子的性质等;
•碳自由基的最外层 为七个电子,反应 时总要寻找另外的 电子来达到八隅体 结构,所以是亲电 的。
CH3 例如: CH3-CH-CH3 Br 2, 光 127 ℃ CH3 CH3-C-CH3 Br >99% CH3 CH3-CH-CH2 Br <1%
第二章 烷烃和环烷烃 自由基取代

二、小环烷烃的结构
小环环烷烃不稳定,而环戊烷、环己烷以 及大环环烷烃却比较稳定,为什么呢? 1、拜尔(Baeyer)张力学说: 为解释三、四元环不稳定,而五、六元环稳 定的原因,提出了张力学说,基本点是: (1)、假设碳原子成环后,原子都处于一个 平面上 (2)、按照碳原子的正四面体模型,碳碳键 之间的夹角为109°28’。
CH3 H H CH3 H H
H CH3 CH3
对位交叉式 63%
H 3C H
四 H H 种 H 典 邻位交叉式 37% 型 构 H3C CH 3 象
H H H H
H H
H H 3C
部分重叠式
全重叠式
稳定性次序: 对位交叉式>邻位交叉式>部分重式>全重叠式
在化学反应中,分子不一定以优势构象参与 反应。 影响构象稳定性的因素除了扭转张力和范德 华斥力外,有时还有偶极-偶极相互作用以及 氢键的影响,在这些情况下,分子优势构象 不一定都是对位交叉式。
环烷烃的分类
根据环烷烃分子中所含的碳环数目,可分为单环、 多环环烷烃。 分子中只有一个碳环结构的烷烃,称为单环环烷 烃 ,其分子通式为CnH2n 。
பைடு நூலகம்
单环环烷烃分类:小环(三元环、四元环) 常见环(五元环、六元环) 中环(七元环~十二元环) 大环(十二元环以上)环烷烃
1. 双环或多环环烷烃中,两环共用1个碳原子 称螺环烷烃,共用碳原子称螺原子。含一个螺 原子的称单螺环烷烃。 2. 两环间共用2个或2个以上的碳原子称桥环 烷烃,共用碳原子称桥头碳原子(简称桥原子) 螺原子 桥原子
H H H 锯架式 H H H
H H H H H H
Newman投影式
第四章 烷烃 自由基取代反应
键解离能 平均键能和自由基
1、键解离能 和自由基稳定性
键的解离能: 某一键断裂所吸收的热量, 是键解离反应的焓( ΔHο反应热),用 DHο 表示,如: CH3-H → CH3 ·+ H · ΔHο= DHο= + 439.3 kJmol-1
1
CH3CH2- H → CH3CH2 ·+ H · CH3CH2CH2-H → CH3CH2CH2 ·+ H · ( CH3 )2CH-H → ( CH3 )2CH · + H ·
甲烷氯化的反应热如下所示:
(1) Cl2 (+242.7 ) (2)Cl · CH4 + (+439.3 ) (3)CH3· Cl2 + CH3· HCl + (- 431.8) CH3Cl + Cl · ΔHο= (+439.3 )+(-431.8) = + 7.5 kJmol-1 ΔHο = (+ 242.7)+ (-355.6) 2Cl · ΔHο= + 242.7 kJmol-1
第四章 烷烃 自由基取代反应
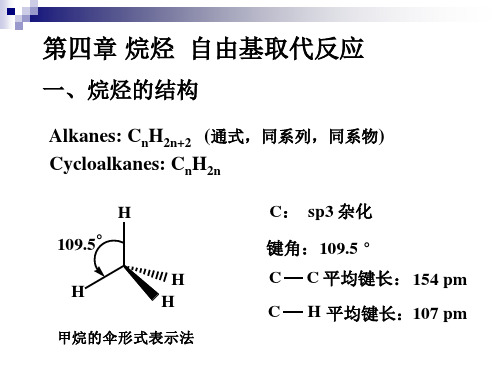
一、烷烃的结构
Alkanes: CnH2n+2 (通式,同系列,同系物) Cycloalkanes: CnH2n
H 109.5° H H H C: sp3 杂化 键角:109.5 ° C C C 平均键长: 154 pm H 平均键长:107 pm
甲烷的伞形式表示法
二、烷烃的结构特点 1、非极性分子,偶极矩为0 2、在运动中可以产生瞬时偶极矩 3、分子间有色散力(瞬时偶极矩间的相互 作用)、vander waals 引力
一步反应 A + BC [A---B---C] 过渡态 AB + C
二步反应 A + B 反应物 C 中间体 D 产物
烷烃自由基取代反应37页PPT

16、自己选择的路、跪着也要把它走 完。 17、一般情况下)不想三年以后的事, 只想现 在的事 。现在 有成就 ,以后 9、学习的关键--重复。
20、懦弱的人只会裹足不前,莽撞的 人只能 引为烧 身,只 有真正 勇敢的 人才能 所向披 靡。
END
16、业余生活要有意义,不要越轨。——华盛顿 17、一个人即使已登上顶峰,也仍要自强不息。——罗素·贝克 18、最大的挑战和突破在于用人,而用人最大的突破在于信任人。——马云 19、自己活着,就是为了使别人过得更美好。——雷锋 20、要掌握书,莫被书掌握;要为生而读,莫为读而生。——布尔沃
第四章 烷烃自由基取代反应
3. 有机反应的分类
按反应时键断裂和生产的方式 :自由基型、离子型、协同 亲电反应: 决进攻而发生的反应。 协同反应: 旧键的断裂与新键的生成都相互协调地在同一步骤中完成。 按反应物和生成物的结构关系 : 酸碱 (acid-base) 、 取代 ( substitution reaction) 、 加成 (addition reaction) 、 消除 (elimination reaction) 、 重排 ( rearrangement reaction) 、氧化还原( oxidation and reduction) 、缩合( condensation) 。
→ R3COOH + R3C·
过氧化物易产生爆炸的原因: -O-O-键是个弱键,在适当温度下很容易分解,产生自由基,自由基引发链反应,产生大量自由基,促使反应很快 进行,并放出大量热。
10. 烷烃的硝化
烷烃与硝酸或四氧化二氮进行气相(400~450℃)反应,生成硝基化合物(RNO2) 。 硝基烷烃可以转变成多种其他类型的化合物,如胺、羟胺、腈、醇、醛(Nef 反应) 、酮及羧酸等。硝基烷烃在工业上是很有用的溶剂,例如溶 解醋酸纤维、假漆、合成橡胶以及其他有机化合物。低级硝基烷烃都是可燃的,而且毒性很大。
6. 自由基反应
自由基碳呈 sp2 杂化(碳正离子 P 248 也是一样;碳负离子一般为 sp3 杂化,中的一对负电子占用的轨道会对其他 σ 轨道有排斥, 而成三角锥形,即这对负电子占有一个 sp3 杂化轨道) , p 轨道被一个孤电子占据。 在同系列中第一个化合物往往是比较特殊的。 解离能越低的碳自由基越稳定。 数据表明断裂 C-C 键所需的能量比 C-H 键小,因此 C-C 键易断同时还可以看出断裂 CH3CH2CH2CH3 中 C-C 键,形成两个 CH3CH2· 时H 最小, 说明大分子在中间断裂的机会是比较多的。 慢引发,快增长,速终止,有转移。 自由基反应的特点是没有明显的溶剂效应,酸、碱等催化剂对反应也没有明显影响当反应体系中有氧气(或有一些能捕捉自由基的杂质存在,如 下)时,反应往往有一个诱导期。所以自由基反应要做到防水防氧防铁。
理学第4章 烷烃 自由基取代

单自由基比双自由基稳定
C H 3 + O O
双自由基
C H 3O O
单自由基
异裂: A:B A+ + B-
(CH3)3C : Cl (CH3)3C+ + Cl-
• 共价键断裂时,两原子间的共用电子对完全转移到其 中的一个原子上的断裂方式.结果产生正 、负离子.
A : B → A• + B• 自由基
自由基反应中,分子经过均裂产生自由基,也称均裂 反应。
Cl2 (光照) Cl·+ Cl· CH4 + Cl · CH3 ·+ H : Cl
(1)反应机理包括链引发、链增长、链终止三个阶段。
共 (2)反应必须在光、热或自由基引发剂的作用下发生。
(3)溶剂的极性、酸或碱催化剂对反应无影响。
丙烷氯代反应:
Cl2 光
Cl
CH3CH2CH3 25℃,CCl4 CH3CH2CH2Cl + CH3CHCH3
正丙基氯43% 异丙基氯57%
设:伯氢原子活泼性为1,仲氢原子相对活泼性为x:
57/43=2x/6
x=4
(3)烷烃与其它卤素的取代反应
CH3
CH3
CH3
CH3-CH
CH3
+
Br2
光 127℃
CH3-C-Br
+ CH3-CHCH2Br
CH3
99%
痕量
•仲,叔氢原子的反应活性:1:82:1600.溴更具有选择性.
• 与氟反应剧烈,不易控制,会引起爆炸.
• 烷烃与碘作用得不到碘代烷.
产物单一,可用溴代 来制备卤代烃
烷烃和环烷烃自由基取代反应

05 烷烃和环烷烃自由基取代 反应的挑战与展望
反应选择性与效率的提高
开发高效催化剂
通过研究新型催化剂,提高自由 基取代反应的选择性和效率,减 少副反应的发生。
优化反应条件
通过调整温度、压力、溶剂等反 应条件,促进目性
研究控制反应位点的策略,实现 自由基取代反应的区域选择性, 提高产物纯度。
当两个自由基碰撞时,它们可以 结合形成分子,或者与其他物质 发生反应,使链终止。
环烷烃自由基取代反应的实例
烷基取代
01
如甲基环己烷在光照条件下与氯气反应,生成氯化甲基环己烷。
氢取代
02
如四氢萘在硫酸中加热,生成萘。
异构化
03
如甲基环戊烷在加热条件下异构化为异丁烷。
04 烷烃和环烷烃自由基取代 反应的应用
有机合成中的烷烃和环烷烃自由基取代反应
烷烃和环烷烃自由基取代反应在有机 合成中具有广泛的应用,如合成醇、 醚、卤代烃等。通过自由基取代反应, 可以方便地引入特定基团,实现化合 物的结构修饰和改造。
VS
烷烃和环烷烃自由基取代反应在药物 合成中也有重要应用,如合成药物中 间体、活性物质等。通过自由基取代 反应,可以高效地合成具有特定结构 和活性的化合物,为药物研发提供有 力支持。
热引发
在高温下,烷烃分子吸收能量,使得化学键断裂, 形成自由基。
光引发
在紫外光的照射下,某些物质(如碘)吸收光能, 形成自由基,引发链式反应。
化学引发
使用引发剂(如过氧化物)分解,产生自由基, 从而启动反应。
链增长
自由基与烷烃分子碰撞
与未反应的烷烃分子碰撞,使其化学 键断裂,形成新的自由基。
自由基之间的碰撞
高分子合成中的烷烃和环烷烃自由基取代反应
04烷烃-自由基取代反应讲解

二、有机反应机理
反应机理是对一个反应过程的详细描述, 是根据实验事实总结后提出来的,有一定 的适用范围,并在不断发展。
表示一对电子的转移
表示单电子的转移
三、有机反应中的热力学和动力学
1、热力学与化学平衡
热力学是研究一个反应能否进行及进行的程度。
A+B
C+D
K = [C][D]/[A][B] △G = -RT㏑K
第四章 烷烃 自由基取代反应
第一节 烷烃的分类
链烷烃(CnH2n+2)
小环(3、4元环)
烷烃 环烷烃
单环烷烃(CnH2n) 中环(8-11元环)
大环(≥12元环)
集合环烷烃
普通环(5-7元环)
多环烷烃
桥环烷烃
Cl
螺环烷烃
第二节 烷烃、环烷烃的物理性质
外 观: 状态, 颜色, 气味
物理常数: 沸点(b.p.)
.......态的特点: (1)能量高。 (2)极不稳定,不能分离得到。 (3)旧键未完全断开,新键未完全形成。
第一过渡态
反应势能图
二步反应: 势 能
Ea1 C A+ B
△H
第二过渡态 Ea2
A+B
C
D
反应进程 过渡态:在反应物互相接近的反应进程中,与势能最高点相 对应的结构称为过渡态。
熔点(m.p.)
折光率(n) 旋光度[α]λ t 密度(D) 溶解度 偶极矩(μ) μ=qd 光谱特征
一 沸点
沸点高低取决于分子间的作用力 (色散力,范德华力) 烷烃沸点的特点 (1)沸点一般很低(非极性,只有色散力和范德 华力)。 (2)正烷烃的沸点随相对分子质量增大而升高 (运动所需能量增大,范德华引力也增大)。 (3)相对分子质量相同、叉链越多、沸点越低。 (叉链多,分子不易接近)
烷烃和自由基取代反应同系列及同分异构现象(共101张精选PPT)

•
三,系统命名法
直链烷烃和普通命名法基本相同,但不写 “正”字。 支链烷烃,看作直链烷 烃的烷 基取代衍生物。
CH3 CH2 CH CH2 CH2 CH3
CH3
3
-Leabharlann 甲基已烷取代基位次 位次和基间短线 取代基名称 母体名称
支链烷烃的命名法步骤
支链烷 烃的命名法步骤
1,选取生链
2,生链碳原子的位次编号 3,含有几个不同的取代基时,小的在前,大的在后;几个
或,2-甲基5,5-二-1’,1’-二甲基丙基癸烷
命名法按英文名称的第一
字母的次序来命名。如:
甲基(methyl)
乙基(ethyl) 丙基(propyl) 丁基(butyl)
第三节 烷 烃的构型
• 碳原子的四面体概念及分子模型; 碳原子的sp3杂化;
• 烷 烃分子的形成
1999.7
一,碳原子的四面体概念及分子模型
1999.7
一,乙烷的构象
• 构象:指在有一定构造成的分子通过 • 单键的旋转,形成各原子或原子团的 • 空间排布。 • 乙烷 的许多构象中有两种极限有构象:
交叉式(反叠式)构象 重叠式(顺叠式)构象
纽曼(Newman)投影式
• 纽曼投影式中,以 代表前面碳 原子及 其键,以 代表后面的碳 原子及其键。
旋转时,情况更复杂, 有四种典型的构象。
• 对位交叉式
邻位交叉式
• 部分重叠式
全重叠式
• 扭转张力:在重叠式中,重叠的碳氢键 之间的相互排斥作用产生的一种张力。
绕C-2和C-3之间的σ键旋转,形成的四种典型构象
CH3
H
H
CH3
H
CH3
H3CCH3
烷烃自由基取代反应

28%
72% Cl
CH3CHCH3 + Cl2 CH3
35 oC hv
(CH3)2CHCH2Cl + (CH3)3CCl
63%
37%
V1oH : V2oH = 28/6 : 72/4 = 1 : 4
V1oH : V3oH = 63/9 : 37/1 = 1 : 5.3
氯化 V1oH : V2oH : V3oH = 1 : 4 : 5.3
自由基反应:
取代反应
(原有旳化学键发生均裂) 加成反应
离子型反应: (原有旳化学键发生异裂)
亲电反应: 取代反应 加成反应
取代反应 亲核反应:
加成反应
协同反应: (旧键断裂和新键形成相互协调地同步完毕)
二、反应机理
反应机理是指反应旳详细环节(或者说是指反
应所经历旳详细途径)。
如,甲烷氯代反应
CH4 + Cl2
第十二节 烷烃旳起源
一、起源于自然界:天然气和石油 二、人工制备
二、与氯和溴反应
+ Br2 r.t + Cl2 FeCl3
BrCH2CH2CH2Br ClCH2CH2CH2Cl
三 、与氢碘酸反应 CH3 + HI
I 开环 CH3CHCH2CH3
此反应是离子型机理,极性大旳键易 打开;三元环比四元环易发生此反应,其 它环不发生此反应。
开环反应活性:
三员环>四员环>>一般环
CH3 O O 单自由基
第六节 烷烃旳卤化
一、甲烷旳氯化
反应式 CH4 + Cl2
hv
CH3Cl + HCl
卤代反应 分子中旳原子或 基团被卤原子取代 旳反应称为卤代反 应。
《烷烃的取代反应》 讲义

《烷烃的取代反应》讲义一、什么是烷烃在深入探讨烷烃的取代反应之前,咱们先来了解一下烷烃到底是啥。
烷烃啊,是一类只含有碳(C)和氢(H)两种元素的有机化合物,而且它们的分子中的化学键都是单键。
烷烃的通式可以表示为 CₙH₂ₙ₊₂,其中 n 表示碳原子的个数。
比如说,甲烷(CH₄)就是最简单的烷烃。
烷烃的分子结构通常呈现出链状,当然也有环状的烷烃,但相对来说比较少见。
二、取代反应的概念那啥是取代反应呢?简单来说,就是有机化合物分子中的某个原子或者原子团被其他原子或者原子团所替代的反应。
在烷烃中,最常见的取代反应就是氢原子被其他原子或者原子团所取代。
三、烷烃取代反应的条件烷烃发生取代反应通常需要一定的条件。
比如说,和氯气(Cl₂)发生取代反应时,往往需要光照。
这光照就像是一把钥匙,打开了反应的大门。
在合适的温度、压力等条件下,取代反应也能更顺利地进行。
但要注意,不同的烷烃和不同的取代试剂,所需要的具体条件可能会有所不同。
四、以甲烷为例的取代反应咱们先拿甲烷(CH₄)来举个例子。
甲烷和氯气在光照的条件下,就会发生一系列的取代反应。
第一步,甲烷中的一个氢原子被氯原子取代,生成一氯甲烷(CH₃Cl)和氯化氢(HCl)。
CH₄+ Cl₂ → CH₃Cl + HCl这一步反应相对比较容易发生。
然后呢,一氯甲烷继续和氯气反应,生成二氯甲烷(CH₂Cl₂)和氯化氢。
CH₃Cl + Cl₂ → CH₂Cl₂+ HCl接着,二氯甲烷再和氯气反应,生成三氯甲烷(CHCl₃)和氯化氢。
CH₂Cl₂+ Cl₂ → CHCl₃+ HCl最后,三氯甲烷和氯气反应,生成四氯甲烷(CCl₄)和氯化氢。
CHCl₃+ Cl₂ → CCl₄+ HCl在这个过程中,每一步反应都会产生氯化氢,而且随着取代反应的进行,产物会变得越来越复杂。
五、烷烃取代反应的特点烷烃的取代反应有几个比较明显的特点。
首先,取代反应是逐步进行的。
就像咱们上面说的甲烷的取代反应,是一个氢原子一个氢原子逐步被取代的。
第4章烷烃 自由基取代反应

4.5.3. 自由基反应的共性
定义:由化学键均裂引起的反应称为自由基反应。 共 (1)反应机理包括链引发、链增长、链终止三个阶段。 性
(2)反应必须在光、热或自由基引发剂的作用下发生。 (3)溶剂的极性、酸或碱催化剂对反应无影响。 (4)氧气是自由基反应的抑制剂。
C H + O O 3
双自由基
C H O O 3
支链烷烃比同碳数的直链烷烃更稳定。
4.11小环烷烃的开环反应
大环的环烷烃是稳定的,而小环的环烷烃不稳 定,由于张力较大,易开环进行加成反应。 1、与氢反应
H2/Ni
80 ℃
CH 3CH 2CH 3
H2/Ni
200℃
CH 3CH 2CH 2CH 3
思考题:为什么环丙烷易开环发生亲电加 成反应?
(1)“弯曲键”重叠程度小,键能下降, 从而产生角张力——恢复正常σ 键的倾 向,开环后即可形成正常的σ 键,所以 易开环。 (2)“弯曲键”使电子云暴露在成键两 原子(核连线)的外侧,类似于烯烃中 的π 键,易受亲电试剂的进攻。
结论:烷烃异构体中,直链烷烃的燃烧热最大, 支链越多,燃烧热越小,其焓值越小,越稳定。 每增加一个CH2,燃烧热平均增加659klmol-1
⑵生成热:由标准状态下的元素生成某一化合物 的反应中焓的变化。用△Hf¢表示。
化合物的生成热若为负值,表示它比生成它的元素更稳定。 烷烃的生成热为负值,生成热越小,越稳定。
苯甲基自由基 烯丙基自由基 三级丁基自由基 异丙基自由基
>C H C H C H 3 2 > 3 >
乙基自由基 甲基自由基 苯基自由基
两点说明
•影响自由基稳定 性的因素是很多 的,如: 电子离 域,空间阻碍, 螯合作用和邻位 原子的性质等; •碳自由基的最外 层为七个电子, 反应时总要寻找 另外的电子来达 到八隅体结构, 所以是亲电的。
第4章烷烃自由基取代反应ppt课件

4.5.3. 自由基反应的共性
定义:由化学键均裂引起的反应称为自由基反应。 共 (1)反应机理包括链引发、链增长、链终止三个阶段。
(2)反应必须在光、热或自由基引发剂的作用下发生。
性 (3)溶剂的极性、酸或碱催化剂对反应无影响。
(4)氧气是自由基反应的抑制剂。
C H 3 + O O C H 3O O
4.5 自由基反应
1. 自由基 定义:带有孤电子的原子或原子团称为自由基。
碳自由基:含有孤电子碳的体系称为碳自由基。
4.5.1 碳自由基:含有孤电子碳的体系称为碳自由基。
CH3CH2 一级碳自由基
CH3CHCH3 二级碳自由基
CH3CCH 3 CH3
三级碳自由基
·CH3 中心C sp2杂化
C
角锥体
4.1 烷烃的分类
4.2 烷烃的物理性质
外
观: 状态, 颜色, 气味
1-4 气态 5-16 液态 17- 固态 t
物理常数: 沸点(b.p.) 熔点(m.p.)
折光率(n)
旋光度[α]λ
密度(D)
溶解度
偶极矩(μ) μ=qd
光谱特征
一 沸点
沸点大小取决于分子间的作用力 烷烃沸点的特点
(1)沸点一般很低(非极性,只有色散力)。
2 8 %
7 2 % C l
C H 3 C H C H 3+ C l2 C H 3
3 5 o C( C H 3 ) 2 C H C H 2 C l+ ( C H 3 ) 3 C C l h v
6 3 %
3 7 %
V : V = 28/6 : 72/4 = 1 : 4 1oH 2oH
V1oH : V3oH = 63/9 : 37/1 = 1 : 5.3 氯化 V1oH : V2oH : V3oH = 1 : 4 : 5.3
