果胶酶活性测定实验报告
果胶酶实验报告

实验报告果胶酶在果汁生产中的作用一.实验目的1.探究不同温度对果胶酶活性的影响;2.探究不同 ph 对果胶酶活性的影响;3.探究果胶酶的用量对果汁生产的影响。
二.实验原理1.果胶酶的活性受温度影响。
处于最适温度时,活性最高。
果肉的出汁率、果汁的澄清度与果胶酶的活性大小成正比。
2.果胶酶的活性受ph影响,处于最适ph,酶的活性最高,高于或低于此值活性均下降。
果肉的出汁率、果汁的澄清度与果胶酶的活性大小成正比。
3.在一定的条件下,随着酶浓度的增加,果汁的体积增加;当酶浓度达到某一数值后,在增加酶的用量,果汁的体积不再改变,此值即是酶的最适用量。
三.实验材料与用具苹果、果胶酶、盐酸溶液、榨汁机、电子天平、恒温水浴锅、烧杯、量筒、试管、漏斗、温度计、玻璃棒、滤纸、滴管、三脚架四.实验步骤(一)温度对果胶酶活性的影响1.制备果汁选取一个中等大小的苹果( 约 200g) 洗净后,不去皮,切成小块,放入榨汁机中,加入约 200ml 水,榨取 2min,制得苹果泥。
量取一定体积的苹果泥,不同条件下处理后,用滤纸进行过滤即可得到果汁;2.取9支试管编号并分别加入等量的果汁和果胶酶;3.将9支试管分别放入30℃、35℃、40℃、45℃、50℃、55℃、60℃、65℃、70℃的水浴锅中保温10分钟;4.过滤果汁用量筒测量果汁的里量,并记录数据。
(二)ph 对果胶酶活性的影响1.制备果汁;2.取5支试管编号并分别加入等量的果汁和果胶酶;3.将5支试管放入40℃恒温水浴锅中加热;4.待试管内温度稳定后在5支试管分别加入ph分别为5、6、7、8、9的盐酸溶液;5.恒温保持10min;6.过滤果汁用量筒测量果汁的里量,并记录数据。
(三)果胶酶的用量对果汁生产的影响1.配制不同浓度的果胶酶溶液准确称取纯的果胶酶1mg、2mg、3mg、4mg、5mg、6mg、7mg、8mg、9mg,配制成相等体积的水溶液,取等量放入9支试管中,并编号1~9。
果胶酶实验报告

一、实验目的1. 学习果胶酶的提取方法。
2. 探究不同提取条件对果胶酶活性的影响。
3. 测定果胶酶的活性。
二、实验原理果胶酶是一种复合酶,主要包括果胶分解酶、果胶酯酶和果胶酶等。
它们能将果胶分解为低聚果胶、果胶酸和果胶单糖等,从而降低果胶的粘度,提高果汁的澄清度。
本实验通过提取果胶酶,并测定其活性,旨在了解果胶酶的提取方法和活性。
三、实验材料1. 材料:新鲜柑橘皮、硫酸铵、吐温-80、磷酸氢二钠、磷酸二氢钠、葡萄糖标准液、蒸馏水等。
2. 仪器:电子天平、高速离心机、恒温水浴锅、分光光度计、烧杯、量筒、移液器、试管等。
四、实验方法1. 果胶酶的提取(1)将新鲜柑橘皮洗净,去皮,切成小块。
(2)将柑橘皮与蒸馏水按1:10(质量比)的比例混合,置于高速离心机中,以4000 r/min离心10分钟。
(3)取上清液,加入硫酸铵,使硫酸铵的终浓度为0.5 mol/L,置于4℃冰箱中沉淀过夜。
(4)将沉淀物重新溶解于蒸馏水中,加入吐温-80,使吐温-80的终浓度为1%,混匀后置于高速离心机中,以4000 r/min离心10分钟。
(5)取上清液,用0.1 mol/L磷酸缓冲液(pH 6.0)透析,去除硫酸铵,透析时间为4小时。
(6)透析后的溶液即为果胶酶提取液。
2. 果胶酶活性测定(1)绘制标准曲线:以葡萄糖标准液为参比,采用紫外分光光度法测定葡萄糖浓度,绘制标准曲线。
(2)酶活性测定:取1 mL果胶酶提取液,加入0.5 mL 0.5%果胶溶液,混匀后置于恒温水浴锅中,在40℃下反应30分钟。
(3)终止反应:向反应体系中加入1 mL 1 mol/L NaOH溶液,混匀。
(4)测定吸光度:用分光光度计测定反应体系的吸光度,根据标准曲线计算葡萄糖浓度。
(5)计算酶活性:根据葡萄糖浓度和反应体系体积,计算果胶酶活性。
五、实验结果与分析1. 果胶酶提取结果通过实验,成功提取了果胶酶,提取液呈淡黄色,说明果胶酶提取成功。
果胶酶活力测定

实验目的: 一.实验目的 实验目的 1.学习果胶酶的作用和测定原理,并掌握其测定方法。 学习果胶酶的作用和测定原理,并掌握其测定方法。 学习果胶酶的作用和测定原理 2.了解果胶酶的应用 了解果胶酶的应用
实验原理: 二.实验原理: 实验原理
1.果胶酶的测定原理 果胶酶的测定原理 果胶酶水解果胶,生成半乳糖醛酸,后者具有还原性醛基, 果胶酶水解果胶,生成半乳糖醛酸,后者具有还原性醛基,可用 次亚碘酸法进行定量测定, 次亚碘酸法进行定量测定,所生成半乳糖醛酸的量可用于表示果胶 酶的活力。 酶的活力。 果胶酶 酶解反应: 果胶 酶解反应: 半乳糖醛酸 (C6H10O7 )
mol/L碘液 碘液5ml,摇匀,暗处放置 分钟,加2 mol/L硫酸 分钟, 硫酸2ml,用 碘液 ,摇匀,暗处放置20分钟 硫酸 ,
0.025 mol/L硫代硫酸钠滴定至淡黄色。 / 硫代硫酸钠滴定至淡黄色。 淀粉指示剂1 , (4)接着加 )接着加0.5%淀粉指示剂 ml,硫代硫酸钠继续滴定至蓝色消失 淀粉指示剂 为止,记下所消耗的硫代硫酸钠 数 为止,记下所消耗的硫代硫酸钠ml数(A)。 )。 同样进行滴定, (5)空白对照取混合液 5 ml同样进行滴定,记录所消耗硫代酸钠的 ) 同样进行滴定 ml数(B)。 数 )。
(4) 果胶酶溶液:取0.1g果胶酶用 ml柠檬酸 柠檬酸钠缓冲液溶解 果胶酶溶液: 果胶酶用10 柠檬酸 柠檬酸—柠檬酸钠缓冲液溶解 果胶酶用 (5) 0.025 mol/L硫代硫酸钠溶液:0.62g固体定容至 硫代硫酸钠溶液: 固体定容至100ml ,稀释 倍 稀释20倍 硫代硫酸钠溶液 固体定容至 (6) 1 mol/L碳酸钠溶液,0.53g Na2CO3固体定容至 碳酸钠溶液, 固体定容至5ml 碳酸钠溶液 (7) 2 mol/L 硫酸,取5.6ml硫酸溶液缓慢加到 硫酸, 硫酸溶液缓慢加到94.4ml水中 硫酸溶液缓慢加到 水中
实验报告果胶酶

一、实验目的1. 了解果胶酶的提取方法;2. 掌握果胶酶活性的测定方法;3. 探究不同提取方法对果胶酶活性的影响。
二、实验原理果胶酶是一种复合酶,主要由果胶分解酶、果胶酯酶和半乳糖醛酸酶组成。
它能够分解植物细胞壁中的果胶,使植物组织变得柔软,便于提取。
本实验通过提取黑曲霉等真菌中的果胶酶,并测定其活性,以了解果胶酶的特性。
三、实验材料与仪器1. 实验材料:- 黑曲霉菌种- 柑橘皮- 硫酸铵- 乙酸乙酯- 氯化钠- 碳酸氢钠- 磷酸氢二钠- 磷酸二氢钠- 果胶- 水浴锅- pH计- 离心机- 移液器- 烧杯- 试管- 滴定管- 酶标板- 酶标仪2. 实验试剂:- 磷酸盐缓冲液(pH 6.8)- 果胶酶提取液- 果胶溶液- 氯化钠溶液- 碳酸氢钠溶液- 磷酸氢二钠溶液- 磷酸二氢钠溶液四、实验方法1. 果胶酶提取(1)将黑曲霉菌种接种于装有马铃薯葡萄糖琼脂(PDA)培养基的培养皿中,培养48小时。
(2)将培养好的黑曲霉菌种接种于装有马铃薯葡萄糖液体培养基的三角瓶中,培养48小时。
(3)将培养好的菌液以4,000 r/min离心10分钟,收集菌体。
(4)将菌体用pH 6.8的磷酸盐缓冲液洗涤三次,去除杂质。
(5)将洗涤后的菌体加入硫酸铵溶液中,搅拌溶解,调节pH至7.0。
(6)将溶液以4,000 r/min离心10分钟,收集沉淀。
(7)将沉淀用pH 6.8的磷酸盐缓冲液洗涤三次,去除杂质。
(8)将洗涤后的沉淀加入乙酸乙酯溶液中,搅拌溶解,去除蛋白质。
(9)将溶液以4,000 r/min离心10分钟,收集沉淀。
(10)将沉淀用pH 6.8的磷酸盐缓冲液洗涤三次,去除杂质。
(11)将洗涤后的沉淀加入氯化钠溶液中,搅拌溶解,调节pH至7.0。
(12)将溶液以4,000 r/min离心10分钟,收集沉淀。
(13)将沉淀用pH 6.8的磷酸盐缓冲液洗涤三次,去除杂质。
(14)将洗涤后的沉淀加入碳酸氢钠溶液中,搅拌溶解,调节pH至7.0。
分光光度计法测定果胶酶活力的方法研究

分光光度计法测定果胶酶活力的方法研究果胶酶是指分解果胶质的多种酶的总称,它可分为内切型和外切型两大类。
果胶酶广泛应用于果品的加工工业中,主要作用是果品榨汁时降低果浆泥的粘稠度,提高榨汁效率、出汁率、果汁澄清度和稳定性等。
果胶酶的活力对果品的加工品质影响很大,因此测定果胶酶的活力显得尤为重要。
测定酶活力的方法主要有还原法、色原底物法、粘度法等,其中还原法中的3,5一二硝基水杨酸比色法(简称DNS法)具有操作简便,对试剂、仪器等条件要求不高等优点。
该方法是利用果胶酶在一定温度、时间和条件下水解果胶,释放出还原性D一半乳糖醛酸,与3,5一二硝基水杨酸共热产生棕红色的氨基化合物,即发生显色反应。
在一定范围内,水解生成D一半乳糖醛酸的量与吸光度成正比,与果胶酶活力成正比,通过分光光度计测定吸光度,可以计算出果胶酶的活力。
该方法(又称分光光度计法)简单易行,但操作中影响因素较多,往往影响测定结果的准确性。
本研究就测定中各影响因素进行了优化实验,试图提出果胶酶活力测定的最佳技术参数。
1 材料与方法1.1 材料与仪器乙酸钠(CH3 C00Na·3H2O)、冰乙酸(CH3C00H)、氢氧化钠、无水亚硫酸钠、酒石酸钾钠(C 4H4KNaO6.4H2O)、苯酚以上试剂均为市售分析纯;3,5一二硝基水杨酸国药集团化学试剂有限公司;D一半乳糖醛酸97%,沃凯化学试剂有限公司;果胶、果胶酶天津利华酶制剂厂生产;实验用水均为去离子水。
TU一1810紫外分光光度计北京普析;电热恒温水浴锅上海宝磊。
1.2 实验方法1.2.1 试剂配制1.2.1.1 乙酸一乙酸钠缓冲溶液(pH4.8) 首先制备0.2mol/L 的乙酸溶液和0.2mol /L 的乙酸钠溶液,然后将0.2mol/L 乙酸溶液410.0mL 与0.2mol/L 乙酸钠溶液59 0.0mL混合均匀,用酸度计测定。
1.2.1.2 DNS试剂(3g/L) 称取3.00g 3,5一二硝基水杨酸,溶解于500mL蒸馏水中,再逐步加入10.4gNaOH、9l、0g C4H4KNaO6.4H2O、2.5g苯酚和2.5g无水亚硫酸钠,温水浴(不超过4 8oC)中不断搅拌,直至溶液清澈透明。
果胶酶的实验

“果胶酶在果汁生产中的作用”的实验设计和实施陆奇(Lu Qi)(江苏省扬州市新华中学 225009)摘要“果胶酶在果汁生产中的作用”这一课题要求学生尝试利用酶活力测定的一般原理和方法探讨酶在食品制造方面的应用,本文提供的案例介绍了如何在普通高级中学实验室允许的条件下开展此定量实验,还对课题的实验步骤及设计、实验结果分析等具体问题进行讨论。
关键字:果胶酶酶的最适用量最适温度最适pH值中国图书分类号:G633.91 文献标识码:C1、简介在果汁加工中,果胶不仅会影响出汁率,还会使果汁混浊。
果胶酶是分解果胶的一类酶的总称,它可以使榨取果汁更容易,得到的果汁更澄清。
“果胶酶在果汁生产中的作用”是人教版普通高中课程标准实验教科书《生物技术实践》(选修一)专题四“酶的研究与应用”中的课题一,课题要求学生能设计实验探究温度和pH对果胶酶活性的影响以及果胶酶的最适用量,此内容与学生的日常生活联系紧密,并且又有必修一“探究影响酶活性的条件”作基础,因此对于学生来说并不困难,适合进行实际动手操作。
但是,课题比较偏重实验方案的设计,考虑的变量相对较多,还涉及到实验变量的梯度设计,要想获得理想的结果,必须进行反复多次的实验和摸索。
学生在探究过程中,对教材和参考资料中的实验设计、方案进行了讨论和实际操作,提出了不同的问题和改进措施,笔者选取了一个较合理的案例,小结如下,仅供参考。
2、实验材料与实验方法2.1 实验材料本实验选用苹果作为实验材料,榨成汁后使用;实验中使用的果胶酶购自上海蓝季生物技术有限公司,配成质量分数为2%溶液后使用。
2.2 实验方法2.2.1 实验总体设计图1本实验设计方案2.2.2 制备果汁的方法选取一个中等大小的苹果(约200g左右)洗净后,不去皮,切成小块,放入榨汁机中,加入约200mL水,榨取2min,制得苹果泥。
量取一定体积的苹果泥,不同条件下处理后,用滤纸进行过滤即可得到果汁。
2.2.3 果胶酶活性的检测指标果胶酶能将果胶分解成小分子物质,小分子物质可以通过滤纸,苹果汁的体积大小反应了果胶酶催化分解果胶的能力。
检测果胶酶活性

酶(enzyme)是在生物体活细胞中合成的。多数酶在细 胞内直接参与生物化学反应,少数的酶要分泌到细胞 外发挥作用。
2.酶是怎样提取出来的?
如果提取存在于细胞内的酶,需要破碎生物组织细胞,可 用破碎仪、研磨器或匀浆器等机械将组织细胞破碎,使酶 从活细胞中释放出来,进入细胞外的溶液中,经过滤、离 心制备成粗酶液。对于唾液淀粉酶、胰蛋白酶等分泌到细 胞外的酶,可以直接从动物分泌物或细胞外的组织间隙中 提取。
3.酶的活性是指什么?
是指酶催化一定化学反应的能力。
4.酶活性的高低一般用什么指标表示?
其高低可以用在一定条件下,酶所催化的某一化学反 应的反应速度来表示。 酶反应速度:用单位时间内、单位体积中反应物的减 少量或产物的增加量来表示。
5.影响酶活性的主要因素有哪些?
温度、pH和酶的抑制剂等条件都会影响酶的活性.
③根据你对酶的特性的了解,画出实验结果的可能坐标曲线.
巩固练习及作业
1.果胶酶常在0-4℃下 保存。其原因是 C A.此温度条件下,酶的活性最高。 B.此温度条件下,酶变性失活。 C.低温可降低酶的活性,但酶不变性失活。 D.自然条件下,果胶酶常在0-4℃下发生催化作用。
2.关于果胶及果胶酶的叙述中,正确的是 B A.果胶酶不溶于乙醇。 B.果胶不溶于乙醇。 C.加热使果胶变性失活。 D.加热使果胶酶活性增强。
3. 为研究温度对果胶酶活性的影响.某学生设计了如下实验: ①将果胶酶与苹果泥分装于不同试管,在10℃水浴中恒温处理 10分钟(如图A)。
②将步骤①处理后的果胶酶和苹果泥混合,再次在10℃水浴中 恒温处理10分钟(如图B)。 ③将步骤②处理后的混合物过滤,收集滤液,测量果汁量(如 图C)。 :
果胶酶实验

3.果胶酶降解果胶的因素 ①温度
10 ~ 50℃ ② pH值 最适pH值为3.2~5.0 ③作用时间 ④酶的用量 ⑤酶抑制剂
二、探究制作果汁的最佳条件、检 测酶的活性
1、实验材料和用具
• 苹果、 2%果胶酶、 • 水果刀、匀浆机、水浴锅、微量可调移液 器、吸头盒、吸头、500ml烧杯、滤纸、三 角漏斗
2.实验步骤
• 1、将苹果洗净、切开,去皮、籽、柄,切 成小块,将切成小块的苹果放入匀浆机中, 榨取苹果汁
• 2、将榨取的苹果汁倒出,用双层纱布过滤 后装入烧杯中备用。
• 3、取4支试管,用记号笔写上标记,用微 量可调移液器分别向每支试管中加入4mL苹 果汁,然后向1号、2号试管中加入1mL果胶 酶溶液,向3号、4号试管中加入1mL蒸馏水, 振荡混匀,放入45℃水浴锅中10—20min后 可以观察到1号、2号、3号、4号管的变化 情况?
一、果胶酶的基础知识
1.果胶酶的简介
果胶酶并不特指某一种酶,而是分解果 胶的一类酶的总称,包括多聚半乳糖醛酸 酶、果胶分解酶和果胶酯酶等。
2.果胶酶的作用
果胶是植物细胞壁以及胞间层的主要组 成成分之一,它是由半乳糖醛酸聚合而成 的一种高分子化合物,不溶于水。在果汁 加工中,果胶不仅会影响出汁率,还会使 果汁浑浊。 因此,果胶酶能够使果胶分解,提高水 果的出汁率并使果汁变得澄清。
处理
加热
加入酒精前现象
分层十分明显,果汁变 的更加澄清
加入酒精后 现象 果汁被稀释 果汁被稀释 产生絮状沉 淀
不加 热
加热
分层十分明显,没有1号 试管澄清
液体混浊,比4号稍有澄 清。 液体混浊
不加 热
产生大量絮 状沉淀
果胶酶降解果胶的因素温度10ph值最适ph值为3250作用时间酶的用量酶抑制剂苹果2果胶酶水果刀匀浆机水浴锅微量可调移液器吸头盒吸头500ml烧杯滤纸三角漏斗1将苹果洗净切开去皮籽柄切成小块将切成小块的苹果放入匀浆机中榨取苹果汁2将榨取的苹果汁倒出用双层纱布过滤后装入烧杯中备用
果胶酶的固定化及其活力测定

正文果胶酶的固定化及其活力测定一、目的:果胶酶(EC.3.2.1.15)广泛存在于植物界,参与果实的成熟及其它代谢过程。
在果品加工业中,果胶酶主要用于果汁的澄清和提高榨汁率。
果胶酶的固定化将有助于提高酶的利用率,同时还可减少外源物质对果制品的污染。
果胶酶需求量大,且多为一次性使用,既造成了很大的浪费,又大大提高了产品生产成本。
固定化果胶酶可以重复多次使用,能够减少果胶酶的使用量,节约生产成本。
通过本实验,了解载体的制备方法,掌握酶的固定化原理及方法。
二、原理:本实验固定化方法为共价结合法。
以壳聚糖为载体,通过戊二醛共价交联固定化果胶酶。
壳聚糖是从蟹、虾外壳中提取的一种氨基多糖(α-氨基-1.4-β-葡萄糖多聚物),对人和动物无毒副作用,是一种具有网状结构,机械性能好,化学性质稳定,耐热性好的酶固定化载体材料,特别是壳聚糖分子中含有游离的氨基,通过化学交联剂(如戊二醛)很容易与酶发生间接共价结合,使酶牢固地固定在壳聚糖分子上。
果胶酶水解果胶生成半乳糖醛酸,可用DNS法定量:3,5-二硝基水杨酸与醛糖共热能产生棕红色的氨基化合物,在一定范围内还原糖的量和含有呈色氨基化合物的反应液颜色深浅成正比,在540nm下测其吸光度,从而可计算出果胶酶活力。
三、试剂及仪器仪器:冷冻离心机分光光光度计比色皿(8只)摇床水浴箱混合振荡器天平瓷盘药匙剪刀(1把) 记号笔(1支)通风橱吸水纸具塞刻度试管(4支)三角瓶(2支)烧杯(100ml×3个)试管架(1个)试管(6支)量筒(100ml×1个)滴管(16个)离心管(5ml×2个,50ml×1个)移液管架(1个) 移液管(2ml×3个,5ml×1个) 注射器(1支)滴管(1个)吸耳球(1个)洗瓶(1个)玻棒(1个)烧杯(300 ml×5个)试剂:乙酸-乙酸钠缓冲液(0.2mol/L,pH5.0)磷酸缓冲液(0.1mol/L,pH7.0) 3,5-二硝基水杨酸氢氧化钠冰醋酸丙三醇戊二醛无水乙醇浓盐酸果胶酶果胶半乳糖醛酸壳聚糖蒸馏水若干桶四、方法步骤1 载体的制备1.1取壳聚糖4g加入180ml的3%的乙酸中,加20ml甘油搅拌溶解,制得壳聚糖溶液。
果胶酶实验报告

实验报告果胶酶在果汁生产中的作用一.实验目的1.探究不同温度对果胶酶活性的影响;2.探究不同 ph 对果胶酶活性的影响;3.探究果胶酶的用量对果汁生产的影响。
二.实验原理1.果胶酶的活性受温度影响。
处于最适温度时,活性最高。
果肉的出汁率、果汁的澄清度与果胶酶的活性大小成正比。
2.果胶酶的活性受ph影响,处于最适ph,酶的活性最高,高于或低于此值活性均下降。
果肉的出汁率、果汁的澄清度与果胶酶的活性大小成正比。
3.在一定的条件下,随着酶浓度的增加,果汁的体积增加;当酶浓度达到某一数值后,在增加酶的用量,果汁的体积不再改变,此值即是酶的最适用量。
三.实验材料与用具苹果、果胶酶、盐酸溶液、榨汁机、电子天平、恒温水浴锅、烧杯、量筒、试管、漏斗、温度计、玻璃棒、滤纸、滴管、三脚架四.实验步骤(一)温度对果胶酶活性的影响1.制备果汁选取一个中等大小的苹果( 约 200g) 洗净后,不去皮,切成小块,放入榨汁机中,加入约 200ml 水,榨取 2min,制得苹果泥。
量取一定体积的苹果泥,不同条件下处理后,用滤纸进行过滤即可得到果汁;2.取9支试管编号并分别加入等量的果汁和果胶酶;3.将9支试管分别放入30℃、35℃、40℃、45℃、50℃、55℃、60℃、65℃、70℃的水浴锅中保温10分钟;4.过滤果汁用量筒测量果汁的里量,并记录数据。
(二)ph 对果胶酶活性的影响1.制备果汁;2.取5支试管编号并分别加入等量的果汁和果胶酶;3.将5支试管放入40℃恒温水浴锅中加热;3.待试管内温度稳定后在5支试管分别加入ph分别为5、6、7、8、9的盐酸溶液;4.恒温保持10min;5.过滤果汁用量筒测量果汁的里量,并记录数据。
(三)果胶酶的用量对果汁生产的影响1.配制不同浓度的果胶酶溶液准确称取纯的果胶酶1mg、2mg、3mg、4mg、5mg、6mg、7mg、8mg、9mg,配制成相等体积的水溶液,取等量放入9支试管中,并编号1~9。
果胶酶实验报告

实验报告果胶酶在果汁生产中的作用一.实验目的1.探究不同温度对果胶酶活性的影响;2.探究不同 ph 对果胶酶活性的影响;3.探究果胶酶的用量对果汁生产的影响。
二.实验原理1.果胶酶的活性受温度影响。
处于最适温度时,活性最高。
果肉的出汁率、果汁的澄清度与果胶酶的活性大小成正比。
2.果胶酶的活性受ph影响,处于最适ph,酶的活性最高,高于或低于此值活性均下降。
果肉的出汁率、果汁的澄清度与果胶酶的活性大小成正比。
3.在一定的条件下,随着酶浓度的增加,果汁的体积增加;当酶浓度达到某一数值后,在增加酶的用量,果汁的体积不再改变,此值即是酶的最适用量。
三.实验材料与用具苹果、果胶酶、盐酸溶液、榨汁机、电子天平、恒温水浴锅、烧杯、量筒、试管、漏斗、温度计、玻璃棒、滤纸、滴管、三脚架四.实验步骤(一)温度对果胶酶活性的影响1.制备果汁选取一个中等大小的苹果( 约 200g) 洗净后,不去皮,切成小块,放入榨汁机中,加入约 200ml 水,榨取 2min,制得苹果泥。
量取一定体积的苹果泥,不同条件下处理后,用滤纸进行过滤即可得到果汁;2.取9支试管编号并分别加入等量的果汁和果胶酶;3.将9支试管分别放入30℃、35℃、40℃、45℃、50℃、55℃、60℃、65℃、70℃的水浴锅中保温10分钟;4.过滤果汁用量筒测量果汁的里量,并记录数据。
(二)ph 对果胶酶活性的影响1.制备果汁;2.取5支试管编号并分别加入等量的果汁和果胶酶;3.将5支试管放入40℃恒温水浴锅中加热;4.待试管内温度稳定后在5支试管分别加入ph分别为5、6、7、8、9的盐酸溶液;5.恒温保持10min;6.过滤果汁用量筒测量果汁的里量,并记录数据。
(三)果胶酶的用量对果汁生产的影响1.配制不同浓度的果胶酶溶液准确称取纯的果胶酶1mg、2mg、3mg、4mg、5mg、6mg、7mg、8mg、9mg,配制成相等体积的水溶液,取等量放入9支试管中,并编号1~9。
实验4果汁中的果胶和果胶酶

二、探究果胶酶的最佳温度
试管编号
控制变量
控制变量
自变量 恒温水浴 控制变量
因变量检 测果汁量
1号
2号 3号
50mL苹果汁
5mL质量分数为2%果胶酶
20℃ 40℃ 60℃
分开保温10分钟
4号 80℃
实验4果汁中的果胶和果胶酶
实验4果汁中的果胶和果胶酶
A: 5g匀浆 + 10ml果胶酶溶液。 B: 5g匀浆 + 10ml水。 搅拌20-30分钟。 (3)取4支试管编号1、2、3、4。 1: A混合液, 45℃水浴10分钟; 2: A混合液, 不加热10分钟; 3: B混合液, 45℃水浴10分钟; 4: B混合液, 不加热10分钟; (4)观察实验现象记录;然后每只试管各加4ml的 95%乙醇,观察记录现象。
实验四 果汁中的果胶和果胶酶
实验4果汁中的果胶和果胶酶
一、课题背景
• 我国水果生产发展迅速,每年上市的新鲜 水果品种多、数量大。但由于收获的季节 性强,易造成积压滞销,腐烂变质。
• 水果的加工技术,不仅可以缓解产销矛盾, 而且能够提高产品的附加值,满足人们不 同层次的需求。
• 水果的加工包括制作果汁、果干、果粉和 果酒等。
沉淀少的果胶和果胶酶
三、探究果胶酶的最佳温度
试管编号
控制变量
控制变量
自变量 恒温水浴 控制变量
因变量检 测果汁量
1号
2号 3号
50mL苹果匀浆
5mL果胶酶
20℃ 40℃ 60℃
分开保温10分钟
4号 80℃
实验4果汁中的果胶和果胶酶
试管编号 1 2 3 4 56 7
果胶酶的作用温度 10℃20℃ 30℃ 40℃ 50℃ 60℃ 70℃ 过滤后苹果汁的体积/mL 6.8 7.5 8.0 7.0 5.5 4.8<, /SPAN>4.8 过滤后苹果汁的 澄清度 澄清 澄清 澄清 澄清 半混浊 混浊 混浊
果胶酶活性测定实验报告
一、实验设计实验序号实验三实验名称特定产物工业生产菌种发酵试验时间2010年13日-23日实验室基础生物2(121)一、实验目的1、掌握菌种选育、菌种发酵条件的优化和微生物酶制剂酶活测定的基本方法;2、了解酶学性质的研究.3、了解影响果胶酶对果汁澄清效果的各种因素二、实验与原理1、果胶酶概况(1)、果胶质:是高等植物细胞壁内及细胞壁间的结构性多糖,是一类高分子碳水化合物,它的存在往往给果蔬加工等工艺带来许多麻烦和损失。
(2)、果胶酶:是指能分解果胶质的多种酶的总称,广泛存在于高等植物和微生物中。
(3)、产生果胶酶的微生物:细菌、放线菌、酵母和霉菌,但目前商品果胶酶多数来自霉菌。
(4)、果胶酶的应用:主要是用于果胶的分解,在水果加工、葡萄酒生产、麻类脱胶和饲料等方面有着广泛的应用。
2、果胶酶的酶活测定方法(1)、粘度降低法:利用粘度计测量在一定温度、酶浓度和一定反应时间内,标准果胶溶液的粘度降低值。
(2)、脱胶作用时间法:以脱胶作用的时间来测定果胶酶的酶活力。
(3)、次亚碘酸法:用滴定法定量测定半乳糖醛酸的生成量,以表示果胶酶的活力。
(4)、还原糖法(DNS法):根据果胶酶水解果胶生成半乳糖醛酸,后者是一种还原糖,与3,5 -二硝基水杨酸共热后被还原成棕红色的氨基化合物,在一定的范围内,还原糖的量和反应液的颜色呈比例关系,可利用比色法在540nm进行测定。
3、微生物发酵生产产品受以下条件制约:(1)、培养基成分:C源、N源、无机盐、水和生长因子(2)、培养条件:温度、pH、溶解氧等(3)、附加条件:诱导物、表面活性剂等4、酶催化反应的进行受多种因素的影响:底物浓度、酶浓度、温度、pH、激活剂、抑制剂三、设备与材料(一)、培养基1、菌种筛选使用培养基(1)、基本培养基:果胶1% 、磷酸氢二钠0.5%、蛋白胨1%、pH4.5、琼脂2.0%。
(2)、分离培养基:果胶0.5%、磷酸氢二钠0.5%、琼脂2.0%、H4.5。
果胶酶活性测定实验报告

0.0
0.2
0.4
0.6
0.8
1.0
1.2
半乳糖醛酸(mg)
0.0
0.2
0.4
0.6
0.8
1.0
1.2
缓冲液(ml)
2.0
1.8
1.6
1.4
1.2
1.0
0.8
DNS (ml)
3
3
3
3
3
3
3
定容总体积(ml)
20
20
20
20
20
20
20
OD(540nm)
(3)、酶活的测定
操作步骤
(3)、UV2000型分光光度计的使用注意事项
提前半小时接通电源,打开机器开关使仪器通电,自检;
将对照液及测定液分别装入比色杯3/4体积并用镜头纸擦干外壁,放入样品室;
调节测定所用波长;
读数完毕,打开仪器盖板,关闭开关,将比色杯冲洗干净、浸泡于30%酒精中。
2、实验总结
实验菌种的采集不成功,没有到要求的地方采集,也可能是温度较低不适宜菌体生长;菌种分离纯化时可能是无菌操作不严格,导致平板上面杂菌滋生,没有分离出目的菌种,各方面的操作都有不严谨之处,最后得到的酶活性较低,实验做的不是很成功。
(2)、果胶酶:是指能分解果胶质的多种酶的总称,广泛存在于高等植物和微生物中。
(3)、产生果胶酶的微生物:细菌、放线菌、酵母和霉菌,但目前商品果胶酶多数来自霉菌。
(4)、果胶酶的应用:主要是用于果胶的分解,在水果加工、葡萄酒生产、麻类脱胶和饲料等方面有着广泛的应用。
2、果胶酶的酶活测定方法
(1)、粘度降低法:利用粘度计测量在一定温度、酶浓度和一定反应时间内,标准果胶溶液的粘度降低值。
实验9-果胶酶实验

在各自对应温度下,保温0.5小时,沸水浴 分钟终止反应 分钟终止反应, 在各自对应温度下,保温0.5小时,沸水浴3分钟终止反应, 0.5小时 过滤 果汁体积( ) 果汁体积(ml) 出汁率 果汁/ml果浆 ( ml果汁 果浆) 果汁 果浆)
College of Life Sciences (五)pH对果胶酶的酶反应速度的影响 对果胶酶的酶反应速度的影响
College of Life Sciences
实验九 果胶酶在苹果汁制备中的作用 及影响果胶酶活性的因素
College of Life Sciences
实 验 目 的
1. 了解果胶的成分以及果胶酶在提高水果出汁率 和澄清效果中的作用。 和澄清效果中的作用。 2. 了解酶量、温度和 值对果胶酶活性的影响。 了解酶量、温度和pH值对果胶酶活性的影响 值对果胶酶活性的影响。
College of Life Sciences
1. 果胶分子(pectin) 果胶分子( )
实 验 原 理
College of Life Sciences
的多种酶 2. 果胶酶: 分解果胶物质的多种酶的总称。 果胶酶: 分解果胶物质的多种 的总称。
多聚半乳糖醛酸酶( ) 多聚半乳糖醛酸酶(PG)
管号 pH 果浆(ml) 果浆(ml) 1 2 5 2 3 5 3 4 5 4 5 5 5 6 5
调节各试管中果浆的pH, 用 1N NaOH 或 1N HCl 调节各试管中果浆的 , 45℃,预保温5分钟 5℃, 5℃ 预保温5 果胶酶( ) 果胶酶(µl) 50 50 50 50 50
45℃保温0.5小时,沸水浴 分钟终止反应,过滤 5℃保温 小时 沸水浴3分钟终止反应 分钟终止反应, 5℃保温 小时, 果汁体积( ) 果汁体积(ml) 出汁率 果汁/ml果浆 ( ml果汁 果浆) 果汁 果浆)
番茄中果胶酶活力的测定

实验三番茄中果胶酶活力的测定一、实验原理番茄中的果胶酶系相当复杂,它主要包括聚半乳糖醛酸酶(PG)和果胶酯酶(PE)两类。
聚半乳糖醛酸酶能催化果胶降解,导致果胶溶液粘度下降。
因此,可通过测定酶催化反应体系粘度下降的速度来测定它的活力,果胶酯酶能催化果胶分子中半乳糖醛酸单位上的酯键水解,产生游离的羧基和甲醇,导致果胶溶液的pH下降,因此可以用pH—stat法测定它的活力。
二、试剂和仪器试剂:20%氯化钠溶液、0.05mol/L 醋酸-醋酸钠缓冲液pH4.5(Ⅰ)、1%果胶溶液pH4.5、0.5mol/L 醋酸-醋酸钠缓冲液pH4.5(Ⅱ)、1mol/L 氯化钠溶液、0.1mol/L 氢氧化钠溶液(准确标定)、0.05mol/L 氢氧化钠溶液仪器:组织捣碎机、抽滤装置、水浴锅、秒表、常规玻璃仪器、奥氏粘度计、pH 计三、实验步骤1、酶液的制备300g番茄+ 100mL20%氯化钠溶液↓匀浆↓ 离心(4℃,10000rpm,20min)↓¯¯¯¯¯¯¯¯¯¯↓沉淀上层清液↓ 抽滤,量取清液体积↓¯¯¯¯¯¯¯¯¯¯↓沉淀酶液Ⅰ↓ 按516g硫酸铵/L酶液(80%的硫酸铵饱和度)缓慢加入研细的硫酸铵粉末↓ 离心(40℃,10000rpm,20min)↓¯¯¯¯¯¯¯¯¯¯↓上层清液沉淀↓溶于约10mL0.05mol/L 醋酸-醋酸钠缓冲液Ⅰ酶液Ⅱ↓在0.05mol/L醋酸缓冲液Ⅰ中透析(MWCO12000)透析物↓离心(40℃,10000rpm,20min)↓¯¯¯¯¯¯¯¯¯¯↓沉淀部分纯化的果胶酶溶液2、PG活力的测定测定30℃下水的流动时间,3次平行之间相差应小于0.2秒。
果胶酶活力测定
果胶酶活力测定
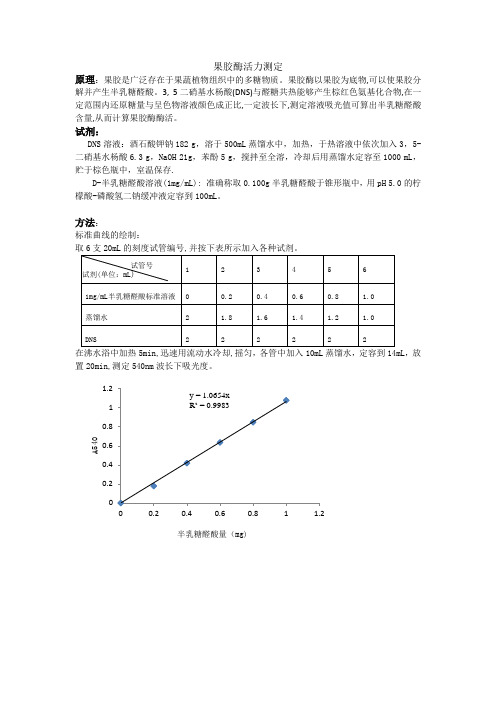
原理:果胶是广泛存在于果蔬植物组织中的多糖物质。
果胶酶以果胶为底物,可以使果胶分解并产生半乳糖醛酸。
3, 5二硝基水杨酸(DNS)与醛糖共热能够产生棕红色氨基化合物,在一定范围内还原糖量与呈色物溶液颜色成正比,一定波长下,测定溶液吸光值可算出半乳糖醛酸含量,从而计算果胶酶酶活。
试剂:
DNS溶液:酒石酸钾钠182 g,溶于500mL蒸馏水中,加热,于热溶液中依次加入3,5-二硝基水杨酸6.3 g,NaOH 21g,苯酚5 g,搅拌至全溶,冷却后用蒸馏水定容至1000 mL,贮于棕色瓶中,室温保存.
D-半乳糖醛酸溶液(1mg/mL): 准确称取0.100g半乳糖醛酸于锥形瓶中,用pH 5.0的柠檬酸-磷酸氢二钠缓冲液定容到100mL。
方法:
标准曲线的绘制:
,放置20min,测定540nm波长下吸光度。
果胶酶实验

• 3.酶活性的高低一般用什么指标表示? 酶活性的高低一般用什么指标表示? 酶活性的高低一般用什么指标表示
• 其高低可以用在一定条件下,酶所催化的某一化 其高低可以用在一定条件下, 学反应的反应速度来表示。 学反应的反应速度来表示。 酶反应速度:用单位时间内、 酶反应速度:用单位时间内、单位体积中反应物 的减少量或产物的增加量来表示。 的减少量或产物的增加量来表示。
实验方法步骤: 实验方法步骤: (1)称等量的去皮的新鲜苹果和放置一段时 间的苹果切成小块,放在榨汁机中,制成果泥, 间的苹果切成小块,放在榨汁机中,制成果泥, (2)用滤纸或5层纱布过滤,收集滤液(条件 用滤纸或 层纱布过滤,收集滤液( 层纱布过滤 相同)。 相同)。 ( 3 ) 观察比较滤液的体积和澄清度 结论: (4)结论:放置一段时间的水果果胶酶含量 比新鲜水果高 。 根据此实验, (5)根据此实验,能否得出水果放置时间越 营养价值越高的结果? 长,营养价值越高的结果? 不能。因为水果放置时间过长,维生素C损耗多 损耗多。 不能。因为水果放置时间过长,维生素 损耗多。
二、探究制作果汁的最佳条件、检 探究制作果汁的最佳条件、 测酶的活性
1、实验材料和用具
• 苹果、 2%果胶酶、 果胶酶、 苹果、 果胶酶 • 水果刀、匀浆机、水浴锅、微量可调移液 水果刀、匀浆机、水浴锅、 吸头盒、吸头、 烧杯、 器、吸头盒、吸头、500ml烧杯、滤纸、三 烧杯 滤纸、 角漏斗
序 号 1 2
下列关于果胶酶的叙述正确的是 ( C ) ①具有分泌功能的细胞产生的 ②凡是活细胞都能产生果胶酶 ③果胶酶能将果胶分解成半乳糖醛酸 植物、霉菌、 ④植物、霉菌、酵母菌和细菌均能产生果胶酶 ⑤果胶酶特指分解果胶的一种酶 ⑥纤维素酶和果胶酶可用于去除植物细胞壁 ⑦组成果胶酶的基本单位是氨基酸或核苷酸 A.①②⑤ B.②③⑦ C.③④⑥ D.③④⑤ . . . .
2009果胶酶活力与稀释倍数的测定与研究

卜Na2 体积ml; S2 03标准溶液的浓度mol/ll
0.51——1毫摩尔Naz s20。相当于 0.51毫摩尔的游离半乳糖醛酸; 194.14——半乳糖醛酸的毫摩尔质量
m卜g;酶液稀释倍数;
10——反应液总体积ml; 5——滴定时取反应混合物的体积ml; 1——反应时加入稀释酶液的体积ml; 0.5——反应时间h。 所得结果应表示至整数。
1998.625-653.
[6]孙 越.果肢酶活性的测定方法[J].食品科技,
1997.18(3):37.38.
不相同的。
.-喳+-,qq.-噎’—簟+—量·—■·‘量·‘■●_●..圣.一'+,.-'+呻·’'o呻。呻'—●·—-..噌·。量●—●o—量’—皇·—蟹●’蟹●’量·—擘+—簟·—P扣'+。堂·’■+’..’簟●—蟹·—1..'·’蟹’呻●—蟹·—擘坤·—甘·’'
(12):2261—2265.
[7]杜桂娟.刘晓宏,侯志研.等.紫花苜蓿品种比较与 性状分析初报[J].草业科学.2005,22(9):45.48.
[8]成红,杜峰·赵克学·等·宁南山苜蓿生产现状与产 革量提高途径[J]·草地学报,2002,10(3):231一
236·
[9]姬永莲.陇东紫花苜蓿主要生产性能研究.草原与 草坪[J],2003,(2):53。55.
业出版社1999,265—271. [23 张 飞,岳田利。费坚,等.果胶酶活力的测定方法
研究[J].西北农业学报,2004,13(4):134-137.
500稀释倍数比较合适。下相酶活为3 200 u/ml
[3]颜颂真.果胶酶活力测定方法的初步研究[J].工业
左右。
微生物.1988,18(5):38—40.
