克劳修斯不等式&熵增原理
物理化学:2-4 克劳修斯不等式和可逆性判据

Qi i Ti
Qi 0或
dQ 0
i Ti
T环境
等号表示可逆过程
(3)任意循环(arbitrary cycle)
循环过程
dQ
0 T环境
“<”:不可逆循环过程, dQ 是实际发生的热量
“=”:可逆循环过程,可逆性要求系统与环境
之间没有温差 T环境 T, dQ 是假想的 可逆过程产生的热量 dQ dQR
度量过程的不可逆程度
不可逆程度(degree of irreversibility)
对于微小过程,如果环境温度可以看作恒定,则
B dQ
ΔS
可简化为
A T环
dQ dS
T环
>0 不可逆过程 =0 可逆过程
<0 不可能发生
度量过程的不可逆程度
不可逆程度(degree of irreverbility)
2.熵增原理(principle of entropy increase) 绝热系统的熵有增无减
绝热系统: dQ 0
dQ
ΔS T环 0
ΔS绝热 ΔSQ0
>0 不可逆过程 =0 可逆过程 <0 不可能发生
2.熵增原理(principle of entropy increase) 孤立系统的熵有增无减
dQ dS环 T环
把环境和系统看作一个大的孤立系统,
dQ
ΔS T环 ΔS系统 ΔS环境 ΔS大孤立 0
例1 1molH2O(l)于0.1MPa下自25℃升温至50℃,求熵 变和热温商,并判断可逆性。已知Cp,m 75.40J K1 mol1 (1)热源温度700℃; (2)热源温度100℃。
2-4 克劳修斯不等式和 可逆性判据
克劳修斯不等式 熵增原理

循环过程,不等号对应于不可逆循环过程。
为了证明上式成立,在上述的诸热
源之外,再引入一个在任意的温度为 T0 的热源,同时引入 n 各可逆卡诺热机。
则
Q0i
=
T0 Ti
Qi
∑ ∑ Q0
=
n
Q0i
i =1
n
= T0
i=0
Qi Ti
借助 n 个可逆卡诺热机的辅助,系
统经历一个循环过程之后,n 个热源所放
出的热量又收回了。最后系统与卡诺热
2、温度
温度是热学中特有的物理量,这个概念的建立基于热力学第零定律的实验事 实,分别与第三个物体处于热平衡两个物体也处于热平衡,说明处于同一热平衡 状态的所有热力学系统都具有共同的宏观性质,而温度就是描述这一宏观性质的 物理量。
3、过程的可逆性与不可逆性 若某过程所产生的效果能通过某些方法完全消除,系统和外界均恢复原状, 该过程是可逆的。当过程在与原向相反方向进行时不引起其它变化。否则为不可 逆过程。 4.准静态过程 它是实际过程的理想化极限情况。当过程进行得足够缓慢,以致过程进行的 每个中间环节都来得及建立新的平衡态,并能用确定的状态参量来描述,这样的 过程是准静态过程。无摩擦的准静态过程是可逆过程。 二、两个态函数 两个基本定律和热力学基本方程。 1、态函数-内能 热力学第一定律 对于绝热过程,初态和终态是热力学平衡态,外界对系统做功与路径无关,
∑ ∑ n − Qi ≤ 0 ,即 n Qi ≥ 0
T i =0 i
T i =0 i
∑ 两式相比
n Qi = 0 T i =0 i
∑n
对于不可逆过程,应除去“=”,即
Qi < 0
T i =1 i
因为若 Q0 = 0 ,则原来不可逆过程产生的后果可以通过 n 个可逆过程而消除,
克劳修斯不等式和可逆性判据

△状态函数熵
ΔS SB SA
d=e=f
B A
dQR T
熵是一个状态函数,是物质的特性
常用单位:J·K-1
蜒 dS def dQR
T
dS dQR 0 T
不可逆程度(degree of irreversibility)
B dQ
ΔS A T环
>0 不可逆过程 =0 可逆过程 <0 不可能发生
B dQR B dQ
AT
A T环
>0 不可逆过程 =0 可逆过程
<0 不可能发生
2.克劳修斯不等式和可逆性判据(Clausius inequality and reversibility criterion) 实际过程都是不可逆过程,分为两类: 自发过程(自动过程)
无需外力帮助,顺其自然,就可以发生的过程。 系统不需从环境得到功就可以进行的过程。
A T环
AT
不可逆过程的热温商恒 小于可逆过程的热温商
(5)“任意”不可逆过程(arbitrary irreversible process)
B dQ B dQR
A T环
AT
证明过程隐含一个限制条件:
不可逆过程I1的初终态A和B是平衡态,
这样在初终态之间才存在可逆过程R2,经典热力 学能够定量分析的不可逆过程是指初终态为平衡 态的不可逆过程,而不是“任意的”不可逆过程, 这是经典热力学的局限!
2-4 克劳修斯不等式和 可逆性判据
Clausius Inequality and Reversibility Criterion
1. 热温商(heat-temperature ratio)
热温商 =
系统吸收或放出的热 相应的环境温度
第八讲:克劳修斯不等式及熵的定义

克劳修斯不等式的意义
克劳修斯积分不等式表明:任意工质在可逆循环中 的微元换热量与换热时的温度之比的循环积分等于零;任 意工质在不可逆循环中的微元换热量与换热时的温度之比 的循环积分小于零。 可以利用克劳修斯不等式来判断循环是否为可逆循 环,比前面的方法更科学,更精确,因为它是一个数学表 达式,比任何文字的表 达更简便、更明确和更通用。
总是熵增
Entropy flow and Entropy generation
熵流和熵产
对于任意微元过程有:dS >:不可逆过程 T 定义 熵流: dSf Q T 熵产:纯粹由不可逆因素引起 dSg 0
Q =:可逆过程
dS dSf dSg S Sf Sg
永远
热二律表达式之一 结论:熵产是过程不可逆性大小的度量。
工程热力学
熵流、熵产和熵变
dS dSf dSg S Sf Sg
不易求
任意不可逆过程 S 0
Sf 0
Sg 0 Sg 0 Sg 0 Sg 0
可逆过程
S Sf 0 不可逆绝热过程 S 0 Sf 0
2
2
3
s
工程热力学
思考题
• 任何过程,熵只增不减 ╳ • 若从某一初态经可逆与不可逆两条路径到
达同一终点,则不可逆途径的S必大于可 逆过程的S ╳
• 可逆循环S为零,不可逆循环S大于零 ╳
• 不可逆过程S永远大于可逆过程S ╳
工程热力学
熵的讨论
• 若工质从同一初态,分别经可逆和不可逆
工程热力学
克劳修斯不等式的推导
1、正循环(卡诺循环)
(1)可逆循环
Q Q Q
ch.1-13 克劳休斯等式和不等式

一、两个热源的情况 根据卡诺定理,工作于两个热源之间的任何一个热机 的效率不可能大于工作于这两个热源之间的可逆机(也即 卡诺机)的效率。因此
Q2 T2 1 1 Q1 T1
(1.13.1)
其中,等号对应于可逆机,不等号对应于不可逆机。
上式可改写为
Q1 Q2 0 T1 T2
(1.13.2)
式中,Q2为放出的热量,取负号,若将其看为吸收的 热量,则可改写为
Q1 Q2 0 T1 T2
称为克劳修斯等式与不等式。
(1.13.3)
二、推广到多个热源情况
设系统在循环过程中与温度为 P T1、T2、 T3…Tn 的n个热源接触, 从这n个热源吸热Q1、Q2、….Qn的 热量。一个任意循环可以看作是许 多微小卡诺循环组成。
对所要微小卡诺循环求和,有
Qi 0 i 1 Ti
n
(1.13.4)
V
当等温线和绝热线划分得很密集时,就可以将求和变为积分
d的克劳修斯等式和不等式,等号对应于可逆 过程,不等号对应于不可逆过程。
作业:pp,68 1.19
热力学第二定律计算论文素材

热力学第二定律计算论文素材热力学第二定律是热力学中的基本定律之一,它通过熵的概念,描述了自然界中不可逆过程的特点。
本文将探讨热力学第二定律的计算方法,为进一步研究热力学过程提供素材。
1. 热力学第二定律的表述热力学第二定律有多种不同的表述方式,其中最常见的是克劳修斯表述和开尔文表述。
克劳修斯表述指出,任何一个能量系统的熵都会在等概率条件下增加,即孤立系统中不可逆过程的总熵变永远大于零。
开尔文表述则涉及到了热机的工作效率问题,即热机的工作效率永远小于等于卡诺热机的最高效率。
2. 热力学第二定律的数学表达热力学第二定律的数学表达形式包括克劳修斯不等式和卡诺热机效率公式。
克劳修斯不等式是热力学第二定律的基本数学形式,它表明热力学系统的总熵变ΔS总≥0,其中ΔS表示系统的熵变。
卡诺热机效率公式是热力学第二定律的重要应用形式,它以热机的冷热源温度比为基础,计算了热机的最高理论工作效率η=1- T低/T高。
3. 热力学第二定律的计算方法热力学第二定律的计算方法主要包括熵变计算和热机效率计算。
在计算熵变时,可以利用熵的基本性质和熵的增加原理,根据系统的初始状态和末态状态的热力学性质,确定熵的变化量。
熵变的计算方法有很多种,可以根据具体问题来选择合适的方法。
计算热机效率时,可以利用卡诺热机效率公式,根据冷热源温度比计算出热机的最高理论工作效率。
同时,也可以通过实际热机的工作参数,如热机输入功和输出功,来计算实际热机的工作效率,并与理论效率进行比较,从而评估热机的性能。
4. 热力学第二定律的应用领域热力学第二定律的应用领域非常广泛,涉及到能源转化、热机工作效率、热泵制冷等方面。
在能源转化方面,热力学第二定律可以用来评估各种能源转化装置的效率,指导能源的优化利用。
在热机工作效率方面,热力学第二定律可以判断热机的性能,并优化设计热机的工作参数。
在热泵制冷方面,热力学第二定律可以用来评估热泵的制冷效果,指导热泵系统的运行。
熵克劳修斯不等式和孤立系统熵增原理汇总

热源温度=工质温度
可逆时
dS 0 dS 0 dS 0
Q 0 Q 0 Q 0
熵的物理意义 熵变表示可逆 过程中热交换 的方向和大小
熵是状态量
ds 0
可逆循环
ds
Q
T
可逆
ds不可逆 0
=0
Q
T
1a 2
a
Q
T
2 b1
0
Q
1b 2 T T Q Q 1a 2 T 1b 2 T S1a 2 S1b 2 2 b1
针对过程
克劳修斯不等式
S
Q
T
除了传热,还有其它因素影响熵
不可逆绝热过程 Q 0 dS 0 不可逆因素会引起熵变化 总是熵增
2.9.4 熵流和熵产
对于任意微元过程有:dS T 定义 熵流: dSf Q
T
Q = 可逆过程
> 不可逆过程
熵产:由过程中不可逆因素引起的熵增
径无关 不可逆过程的熵变可以在给定的初、终 态之间任选一可逆过程进行计算
熵是广度量
熵的问答题
• 任何过程,熵只增不减。 ╳ • 若从某一初态经可逆与不可逆两条路径到
达同一终点,则不可逆途径的S必大于可 逆过程的S。╳
╳ • 可逆循环S为零,不可逆循环S大于零。 • 系统吸热,其熵一定增大;系统放热,其 熵一定减小。 ╳
Q
p
2 b v
1
熵变与路径无关,只与初终态有关
2.9.3 不可逆过程的熵变
依克劳修斯不等式,对不可逆循环有:
Q
T
0
1b 2
Q
热力学第二定律8-克劳修斯不等式及熵的定义讲解

dS 0
可逆循环
dS可逆 dS不可逆
Q
T
0
Q Q 0
1a2 T
2b1 T
Q
Q
2b1 T
1b2 T
p
a
2
Q Q
1a2 T
1b2 T
S1a2 S1b2
熵变与路径无关,只与初终态有关 1
b
S21可逆 S21不可逆 Entropy change
2
b v
S与传热量的关系
S21 S2 S1
Q
12 T
热二律表达式之一
= 可逆 >不可逆 <不可能
针对过程
对于循环 =0
克劳修斯不等式
S
Q
T
除了传热,还有其它因素影响熵
不可逆绝热过程 Q 0 dS 0
不可逆因素会引起熵变化 总是熵增
工程热力学
熵流和熵产
Entropy flow and Entropy generation
T1
Q Q1' Q2' 0 放热
Q1’
Q1
假定 Q2 = Q2’
W’>W
W’
W
IR R
Q1' Q1
Q Q1' Q2' 0
T
T1
T2
Q2’
Q2
T2
工程热力学
克劳修斯不等式推导总结
正循环(可逆、不可逆)
Q 0 吸热
反循环(可逆、不可逆)
Q 0 放热
任意不可逆过程 S 0
Sf
0
熵与克劳修斯不等式

∆S = ∫
2 1
δQr
T
δQ T
⎛ > 不可逆⎞ δQ ⎜ ⎟ 微分式:dS ≥ T ⎝= 可 逆 ⎠
⎛ > 不可逆 ⎞ ⎜ ⎟ ⎝=可 逆 ⎠
称为克劳修斯不等式
(热二律的数学表达式)
克劳修斯不等式表明:不可逆过程的熵变大于不可逆 过程的热温商。
§3. 3 3. 熵增原理 (1)熵增原理
∆S ≥
⎛ >⎛ 不可逆 > 自 发⎞ ⎞ ⎜ ⎟ = + ≥ d S d S 0 = d Ssys amb ⎜ =⎜ 可 逆 ⎟ ⎟ sys + d S amb ≥ 0 ⎝ ⎝ = 平衡 ⎠⎠
式中下角标iso,sys,amb分别代表隔离系统、系统及环境 。
恒温膨胀线
绝热膨胀线
恒温压缩线
任意可逆循环
绝热压缩线
§3. 3
1.熵的导出
熵与克劳修斯不等式
●每个小卡诺循环的热温商之和等于零。于是有
δQ1
T1
+
δQ 2
T2
=0
δQ1 '
T1 '
+
δQ 2 '
T2 '
=0 "
相加得
∑
δQ r
T
= 0 极限情况下
∫
δ Qr
T
=0
表明:任意可逆循环的 热温商之和为零
δQ r
T
从状态1到状态2之间的熵变则为 : ∆S =
∫
2 1
δQ r
T
(2)熵的物理意义 熵是量度系统无序度的函数
S (g) > S (l) > S (s)
玻耳兹曼熵定理 :S = k ln Ω
克劳修斯不等式和熵增

克劳修斯不等式和熵增克劳修斯不等式和熵增,这个话题听起来有点高深,不过我们可以轻松聊聊。
想象一下,你在一个阳光明媚的下午,喝着冰凉的饮料,突然脑海里冒出这个不等式的概念,嘿,别着急,让我带你慢慢了解。
克劳修斯不等式有个很酷的特点。
它告诉我们,热量总是从高温物体流向低温物体,就像小朋友总是跑向最好玩的游乐设施,哈哈。
这就意味着,热量总是自然而然地朝着更“懒”的方向流去。
换句话说,热量不会自发地从冰块流向热水,想象一下,那会多么奇怪,像是在违背自然规律的舞蹈。
这个现象告诉我们,能量的转移总是带有方向性,像是一条单行道,只有前进而没有后退。
再说说熵,哇,这个词听起来挺吓人的,其实它的意思就是混乱和无序。
想象一下,一个原本整齐的房间,被小孩们玩耍后变得一片狼藉,玩具、书籍、衣服到处乱扔,心情也跟着“熵增”了,哈哈。
克劳修斯不等式和熵的关系就像那根不可避免的绳索,熵总是趋向增加,这就意味着无序总是在增加,而有序却难以保持。
生活中也是如此,我们总是要努力去维持秩序,但总有点儿意外会打乱我们的小天地。
很多时候,熵的增加让我们觉得无能为力,就像你拼命整理的房间,转眼又被孩子们搞得乱七八糟。
不过,熵增也是一种自然现象,是宇宙的一部分,想想看,如果没有变化,生活会多无聊呀。
无序的产生,某种程度上也代表着生命的活力。
我们的身体,细胞在不停地更新,尽管有时候看起来一团糟,但这正是生命的印记。
克劳修斯不等式在日常生活中又有什么应用呢?比如说,我们冰箱里的食物,为了保持新鲜,我们常常要调低温度。
这个时候,冰箱就像是一个小型的热泵,它从食物中吸收热量,把它转移到外部环境中去。
听起来简单,但实际上,这个过程遵循的就是克劳修斯不等式的法则。
就像我们努力工作,想要在职场上有所成就,必须付出一定的代价,换取收益。
我们也不能忘了熵的好处,熵增让我们的人生多姿多彩。
想想生活中的惊喜,突然的聚会、朋友的拜访,都是那份“无序”带来的快乐。
有人说,生活就像一场赌博,越是有变化,越能带来新鲜感。
克劳修斯不等式和可逆性判据

d-QR d-Q 0
T
T环
>0 不可逆过程 =0 可逆过程 <0 不可能发生
Байду номын сангаас
第二定律的数学表达式,其中以可逆过程作 为比较的标准。不可逆过程进行后,引起功 损失或能量品位的降低
上一页 下一页 节首
0
上一页 下一页 节首
3.任意循环的热温商 (不可逆循环)
d-Qab d- Qa'b' 0
T 环ab
T环a 'b'
d-Qab d- Qab d-Qcd
T环ab
T环a'b'
T环cd
d-Qcd 0 T环cd
d-Q
T环 0
上一页 下一页 节首
4.任意可逆过程的热温商 ——将循环解离为过程
任意过程的热温商
B
d-QR B
d- QR
T A(沿R1)
T A(沿R2)
Q 0
T环
d-Q
T环 0
B d-Q B d-QR
A T环
AT
上一页 下一页 节首
判断一个过程是否可逆(1)
可将该过程与一个以该过程的终态为初态,该过 程的初态为终态的可逆过程组成一个循环,然后 考察一个循环后环境是否留有任何不可逆变化:
dQ T环
的上、下限不能交换。
上一页 下一页 节首
4.任意可逆过程的热温商 ——将循环解离为过程
d-QR B
d- QR
T
A(沿R1 ) T
B
d- QR
A(沿R2) T
0
B
d- QR
T A(沿R1)
B
d- QR
T A(沿R2)
可逆过程的热温商只决
熵克劳修斯不等式和孤立系统熵增原理

W 功
源
孤立系熵增原理举例(5) 1 克劳修斯不等式的推导
除了传热,还有其它因素影响熵
冰箱制冷过程 取热源T1和T2为孤立系
• 若工质从同一初态,分别经可逆和不可逆过程,到达同一终态,已知两过程热源相同,问传热量是否相同?
依克劳修斯不等式,对不可逆循环有:
孤立系熵增原理举例(2)
S S S S S 功可以全部转换为热,而热不能全部转换为功?
T2
孤立系熵增原理举例(2)
两恒温热源间工作的可逆热机
S is o S T 1 S T 2 S R S 功 源 Q1 Q2 0 T1 T2
t
t,C
1Q2 Q1
1T2 T1
T1 Q1 W功
R源 Q2
T2
孤立系熵增原理举例(3)
两恒温热源间工作的不可逆热机
S is o S T 1 S T 2 S I R S 功 源 T1
例:水 c4.1868kJ/kg.K
Q re d U p d v d U c m d T
熵变与过程无关,假定可逆:dSQre cmdT
S cm ln T2
TT
T1
熵变的计算方法
4.热源:与外界交换热量,T几乎不变
热源的熵变
S Q1 T1
5.功源:功源与系统交换的能量全 部是功,功不引起熵的变化。
注意: 热量的正和负是站在循环的立场上
10 孤立系统i 熵s 增o 原理
T 0 T 2
冰 箱 功 源
对可逆过程
和 代表某一状态函数
“ < ” 适用于不可逆过程
Q Q 1 2 • 若工质从同一初态,分别经可逆和不可逆过程,到达同一终态,已知两过程热源相同,问传热量是否相同? 克劳修斯不等式反映方向性
克劳修斯对热力学的贡献

克劳修斯对热力学的贡献
克劳修斯(Rudolf Clausius)是19世纪德国物理学家,他在热力学领域做出了重要的贡献。
以下是他对热力学的主要贡献:
1. 热力学第二定律:克劳修斯提出了热力学第二定律,也称为克劳修斯不等式。
该定律描述了
自然界中热量自发传播的方向性,即热量只能从温度较高的物体流向温度较低的物体,而不能
反过来。
这个定律奠定了热力学的基础,并且在能量转换和热机理论中起到重要的作用。
2. 熵的引入:克劳修斯引入了熵(entropy)这个概念,作为描述系统无序程度的量。
他将熵定义为一个系统中微观状态数目的对数值,熵的增加代表系统的无序程度增加。
熵的引入使得热
力学能够更好地描述能量转化和热力学过程。
3. 热力学循环:克劳修斯对热力学循环(Clausius cycle)的研究也是他的重要贡献之一。
他提
出了一个理想的热机循环,称为卡诺循环(Carnot cycle),该循环是目前最高效的热机循环。
通过研究卡诺循环,克劳修斯对热机的理论性能、热效率以及能量损失等方面做出了重要贡献。
4. 克劳修斯-克拉佩龙不等式:克劳修斯还提出了克劳修斯-克拉佩龙不等式(Clausius–Clapeyron inequality),它描述了物质相变时蒸汽和液体之间的关系。
这个不等式对于理解气
体和液体的相变行为以及气液平衡的研究具有重要意义。
克劳修斯对热力学的贡献不仅丰富了热力学理论体系,而且对于能量转换、热机设计和能源利
用等应用领域也具有重要影响。
他的热力学原理和定律成为了现代热力学的基石,为后来的科
学家提供了重要的启示和指导。
克劳修斯不等式

【克劳修斯不等式】
(英语:Clausius Inequality) 也称为克劳修斯定理,全称“克劳修斯积分不等式”。
指明任意循环中加给工质的微元热量(dq) 与热源热力学温度(T)之比的沿循环路线积分值绝不可能大于零的关系式。
是德国科学家鲁道夫·克劳修斯在1855年提出的热力学不等式,描述在热力学循环中,系统热的变化及温度之间的关系。
描述在热力学循环中,系统热的变化及温度之间的关系:
其中δQ是系统热的变化,吸热为正,放热为负。
若是在可逆过程中,上式中的等号成立,其中小于符号则是对应不可逆过程。
克劳修斯定理可用来定义状态函数熵。
如果工作物质(即系统)的状态是连续改变的,则可以认为它与一系列连续改变温度的高温热源和低温热源进行热量交换,且每次交换微量的热量dQ,就可用下列积分形式:
这个公式称克劳修斯不等式,其中取“=”时,即克劳修斯等式,取“<”号时即克劳修斯不等式。
它是热力学第二定律最普遍的数学表达式。
卡诺定理克劳修斯不等式.ppt
η R
QR1 QR2 QR1
T环1 T环2 T环1
1 QR2 1 T环2 1 T2
QR1
T环1
T1
Q1 Q2 T环1 T环2
Q1
T环1
Q1 Q2 0 T环1 T环2
循环完成后,环境的变 化可通过逆卡诺循环消 除,不遗留不可逆变化
环
循环完成后,环境遗留 不能消除的不可逆变化
任意循环的热温商
◆在两个一定温度的 热源间运转的卡 诺循环,其热机 效率都具有最大 值 R 。
◆R仅决定于两个热 源的温度。
返回章首
3.热力学温标
η R
QR1 QR2 QR1
QR1 QR2
1
1
ηR
F (1,2 )
ηR
QR1 QR2 QR1
T环1 T环2 T环1
T1 T2 T1
第十届国际计量大会决定水的三相点的热力 学温度为273.16K
克劳修斯不等式(可逆性判据) 不可逆程度
返回章首
判断一个过程是否可逆(1)
可将该过程与一个以该过程的终态为初态,该过 程的初态为终态的可逆过程组成一个循环,然后 考察一个循环后环境是否留有任何不可逆变化。
◆没有—可逆过程
◆有 —不可逆过程
A
dX 0
B
◆违反热力学第二 定律,不可能发生
返回章首
判断一个过程是否可逆(2)
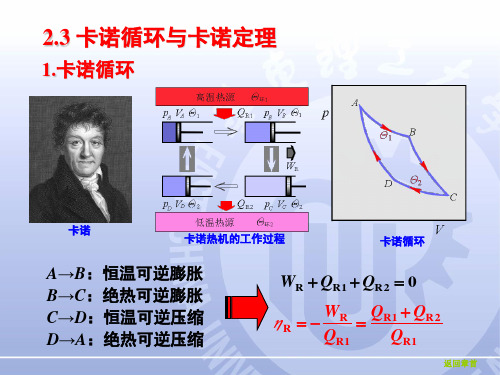
2.3 卡诺循环与卡诺定理
1.卡诺循环
卡诺
卡诺热机的工作过程
卡诺循环
A→B:恒温可逆膨胀 B→C:绝热可逆膨胀 C→D:恒温可逆压缩 D→A:绝热可逆压缩
WR QR1 QR2 0
ηR
WR QR1
QR1 QR2 QR1
3-3 熵与克劳修斯不等式

例:
始态 A,T1
B,T1
末态 A,T2 B,T2
若过程绝热恒容,则由 QV =U UA UB 0 T2
若过程绝热恒压,则由 Qp H HA HB 0 T2
SA和SB根据通式分别计算
S SA SB
例3.4.3: 始态为0ºC、100 kPa的2 mol单原子理想气体B与 150℃, 100 kPa的5 mol双原子理想气体C,在恒压100 kPa下绝 热混合达到平衡态,求过程的W、U及S。
说法(1)、(2)即为熵增原理
熵判据:
判断过程的方 向和限度
Siso Ssys Samb 0 不可逆,自发 0 可逆,平衡 0 不可能
由于隔离系统与环境间没有能量交换,所以其内部发 生不可逆过程,则一定是自发过程。
1. 绝热不可逆膨胀过程中ΔS >0,则其相反的过程即 绝热不可逆压缩过程中ΔS <0。( ╳ )
§3.4 熵变的计算
计算依据:定义式 dS δQr T
计算原则:始末态确定,S与途径无关。
系统熵变 Ssys
pVT 变化
相变化
化学变化
环境熵变 Samb
1. 环境熵变计算 Samb
对封闭系统,一般所指的环境为大气或很大的热源,当系统和 环境之间发生有限量的热量交换时,环境温度和压力变化无限 小,环境可认为时刻处于接近平衡的状态,近似看成是恒温可 逆过程!
§3-3 熵与克劳修斯不等式
1. 熵的导出
卡诺循环:
Q1 Q2 T1 T2
0
无限小的卡诺循环: δQ1 T1
δQ2 T2
0
——任何卡诺循环的可逆热温商之和为零。
对于任意的可逆循环,都可以分解为若干个小卡 诺循环。
克劳修斯不等式推导

克劳修斯不等式推导《克劳修斯不等式推导》“哎呀,这热得简直要人命啦!”我一边擦着汗,一边嘟囔着。
这是一个炎热的夏天午后,我和小伙伴们在院子里玩耍。
太阳火辣辣地烤着大地,连一丝风都没有。
我们就像被放在蒸笼里的包子,热得难受极了。
“我们去买冰淇淋吃吧!”小伙伴小明提议道。
“好呀好呀!”大家纷纷响应。
于是我们一群人跑到了附近的小卖部,买了冰淇淋,坐在树荫下享受着这片刻的清凉。
“你们说,这热和冷之间到底是怎么回事呀?”我突然好奇地问道。
“这有啥难理解的,热就是热,冷就是冷呗。
”小刚随口回答道。
“哎呀,不是啦,我是说热量的传递这些东西。
”我着急地解释着。
“哦,那个呀,我也不太懂。
”小刚挠挠头。
就在这时,我的脑海中突然闪过一个念头,这热量的传递不就和我们学的克劳修斯不等式有关系吗?我兴奋地说道:“嘿,我想到了,克劳修斯不等式不就是讲这个的嘛!”“啥?克劳修斯不等式?那是啥玩意儿?”小伙伴们一脸茫然。
我清了清嗓子,开始给他们讲解起来:“你们看啊,就像这热会从温度高的地方往温度低的地方传,克劳修斯不等式就是描述这种热量传递的规律呢!就好比说,这就像水流一样,会从高处往低处流,对吧?”“哦,好像有点懂了。
”小明若有所思地说。
“对呀,其实挺简单的嘛。
”我越说越起劲,“就像我们吃冰淇淋,冰淇淋的冷会让我们感觉凉快,这也是一种热量的交换呀!”“哇,你好厉害呀,能想到这些。
”小伙伴们纷纷夸赞道。
我得意地笑了笑:“嘿嘿,这有啥,我以后还要学更多更厉害的知识呢!”通过这个小小的生活片段,我突然明白了,知识其实就在我们身边,只要我们用心去观察和思考,就能发现很多有趣的东西。
就像克劳修斯不等式,虽然听起来很抽象,但其实和我们的日常生活息息相关呀。
我们不能只是死读书,而是要把学到的知识运用到生活中去,这样才能真正理解和掌握它们呀。
这不就是学习的意义所在吗?。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
T = T * 。在这种情况下,T 即可看成热源的温度,也可作为系统的温度。
二 熵的定义与性质
1、可逆过程 对于可逆过程,系统由状态 A 经可逆过程到 状态 B, 从状态 B 再经可逆过程到状态 A。 根据克 劳修斯等式可知
A ( R1)
∫
B
dQ dQ + ∫ =0 T T B ( R2 )
A
因为是可逆过程,T 既是热源温度,也是系 统温度。
dU = TdS − pdV
若系统还包括电场功、磁场功等其它形式的功,则热力学基本方程的更普遍 形式可表示为
3
dU = TdS − ∑ Yi dyi
i
上式概括了热力学第一定律和第二定律对可逆过程的结果, 称之为热力学基 本微分方程。 对于熵,再作以下几点说明: (1)熵是状态函数,可以用状态参量表示,即 S = S (T ,V , p) ; (2)积分 ∫
A ( R1)
∫
B
B
dQ dQ + ∫ < 0 ,则 T T B ( R2 ) dQ dQ dQ <− ∫ = ∫ T T T B ( R2 ) A ( R2 )
A B
A
A ( R1)
Байду номын сангаас
∫
由于 R2 可逆, 因此, S B − S A =
∫
(可逆)
B
A
dQ = SB − S A T
A ( R1)
∫
B
dQ T
T = 273.15 K , 【例题 1】 已知在 p = 1.0atm , 冰融化为水时, 溶解热 lm = 335 J / g 。
求一千克的冰融化为水时,熵的变化。 [解]在一个大气压下,冰水共存的平衡态温度 T = 273.15 K 。设想有一个恒 温热源,其温度比 273.15K 大一无穷小量,令冰水系统与热源接触,不断从热源 吸收热量使并逐渐融化。由于温差为无穷小,状态变化过程进行得无限缓慢,在 过程的每一步中,系统都近似处于平衡态,温度为 273.15K。这样的过程是可逆 的,因此,一千克的冰水融化为水的熵变为
四 理想气体的熵
熵是状态函数,当系统状态确定后可以用热力学参量来描述,原则上可以写 出熵的表达式。下面以真空膨胀过程中理想气体为例加以说明。 设理想气体的初态为(T0,V0)
5
TdS = dU + pdV = CV dT + pdV dS = CV dT p + dV T T pV = nRT ,则 dT dV + nR T V
dT dV + nR ,并考虑 Cp-Cv=nR 得 T V dT dp − nR dS = CV T p
T
积分得 S = ∫
Cp T
T0
dT − nRIn( p / p0 ) + S0′′
其中, S0′′ 是理想气体在参考态(T0,p0)的熵值。 若所研究问题中温度的变化范围不大, 理想气体的定压热容 C p 可视为常数, 则
对于无限小过程 dQ dS > T 将可逆与不可逆过程结合,则得到
SB − S A ≥ ∫
A
B
dQ dQ 或 dS ≥ T T
必须注意:在熵差计算式中,线积分一定要沿某一可逆过程进行。对于系统 的不可逆过程,只要其初、终态是平衡态,熵的定义就仍然有意义。只是在计算 熵变时,积分路径一定要选择一条可逆过程进行,从理论上讲,这总是存在的。 根据热力学第一定律 dU = dQ − dW ,若可逆过程中如果只有体变功,则微 功 dW = pdV ,微热量 dQ = TdS
A ( R1)
∫
B
dQ dQ dQ =− ∫ = ∫ T T T B ( R2 ) A ( R2 )
B
A
B
上式说明,在系统的初态 A 和终态 B 给定以后,线积分 ∫
A
dQ 与路径无关, T
2
仅由 A,B 决定。因此,可以定义一个态函数,克劳修斯用 S 表示,并称其为熵。
SB − S A =
A ( 可逆 )
若将 Q2 也定义为从热源 T2 吸收的热量,则
Q1 Q2 + ≤0 T1 T2
卡诺不等式
假设若一个系统在循环过程中与温度为 T1 , T2 ,…, Tn 的 n 个热源接触,并从 它们那里分别吸收 Q 1 , Q 2 ,…, Q n 的热量,则可以证明:
n
∑T
i =1
Qi
i
≤0
这里,我们规定系统吸收热量为正,放出热量为负。同样,等号对应于可逆 循环过程,不等号对应于不可逆循环过程。 为了证明上式成立,在上述的诸热 源之外,再引入一个在任意的温度为 T0 的热源,同时引入 n 各可逆卡诺热机。 则 T Q0i = 0 Qi Ti
B
A
dQ 在可逆过程中与路径无关,等于终态和初态的熵差,在不可 T
逆过程中与路径有关,但总小于终态与初态的熵差。 (3)熵是广延量,系统的熵与其质量成正比(因为 dQ 与质量成正比) 。 对于处于非平衡状态的系统,可将其分为若个内部平衡的小系统,则每个小 系统都有确定的熵值。根据熵的广延性,可将整个系统的熵定义为局域平衡的各 部分的熵之和。 (4)熵的定义式只给出熵的变化量,并不能确定熵的“绝对值” 。可以象零 电势的规定一样,人为地选取某一“标准”状态作为熵的初值,其它平衡态的熵 值都相对于这一标准熵值来计算。 如在热工过程中, 蒸汽的熵值表规定 0℃、 1atm 下,纯水的熵值为 0。 (5)熵的单位是 J/K。
dS ≥ 0 上式说明,系统的熵在绝热过程永不减少:在绝热可逆过程中熵不变;在不
4
可逆绝热过程中熵增加——熵增加原理。 熵虽然是在平衡态系统中定义的,但也可应用到非平衡态的系统中。 对于处于非平衡态的系统,可将其分为若个内部平衡的小系统,则每个小系 统都有确定的熵值。根据熵的广延性,整个系统的熵定义为处在局部平衡的各小 部分的熵之和。 S = S1 + S 2 + S3 + ⋅ ⋅ ⋅S n 可以证明,在定义了非平衡态的熵之后,熵增加原理仍然正确。 将系统划分成 n 个小部分,每部分的初态和终态都处于局域平衡。当系统由 初态 A 经一个过程到终态 B 后,令各小部分各自经可逆过程由终态 BK 回到初态 AK。 n B dQ Ak dQ + ∑ ∫A T i=1 ∫Bk T k < 0 Ak dQ Bk dQ ∫Bk T r = − ∫Ak T k = −(S Bk − S Ak ) n k Ak dQ k = − ( S Ak − S Ak ) = −( S B − S A ) ∑ ∑ ∫Bk T i =1 i =1 B dQ SB − S A > ∫ A T 对于由初态 A 变到终态 B 的绝热过程 SB-SA>0 熵增原理的一个重要应用是对孤立系统中所发生的过程进行分析。 孤立系统的熵永不减少, 孤立系中所发生的不可逆过程总是朝着熵增加的方 向进行。 熵的统计意义——微观粒子无规则运动的混乱程度的量度。 系统微观粒子的 混乱程度越大,其熵就越大。 熵增加原理的统计意义——孤立系统中发生的不可逆过程总是朝向混乱度 增加的方向进行的。 从热力学角度来看,熵增原理的物理意义是“能的退降” ,即所有的不可逆 过程使能量转化为外功的可用性降低。 值得注意的是,不能由过程前后熵的增加而随意得出过程不可逆的结论。由 于熵增原理是在绝热条件下得出的。因此,只有对于绝热过程,才可用熵变对过 程的性质和方向进行判断。 可以把熵增原理看作热力学第二定律一个更为普遍的叙述方式。 所以第二定 律指出过程发生的方向,不可逆绝热过程总是向着熵增加的方向进行,而可逆绝 热过程总是沿着等熵线进行。
i =1
Qi Ti
<0
因为若 Q0 = 0 , 则原来不可逆过程产生的后果可以通过 n 个可逆过程而消除, 这与热力学第二定律相违背。 替 ∑ ,上式将变为 考虑一个更一般的情况, 若系统与温度连续分布的热源交换热量, 则用 v ∫ 代
v ∫
dQ ≤0 T
这里, ∫ 表示沿某个循环过程求积分。上式就是克劳修斯等式(对于等号) 和不等式(对于不等号) 。 热源温度 T 的说明: (1)对于不可逆循环过程,热源温度与系统温度( T * )不相等。因为循环过 程是不可逆的,系统在整个过程中处于非准平衡态,因此, T ≠ T * 。若 dQ > 0 , 则系统从热源吸热,必有 T > T * ;反之, T < T * 。 (2)对于可逆循环过程,系统经历的各个过程都是准平衡态的,因此,
§4 克劳修斯不等式与熵增原理
一 克劳修斯不等式
从卡诺定理可知,工作在相同高、低温热源之间的热机效率不大于可逆机, 即η ≤ η R
η= 1 −
Q2 T ≤1 − 2 Q1 T1
其中, Q1 为从高温热源吸收的热量, Q2 为对低温热源放出的热量,且 Q1 ( Q2 )>0。 Q2 T2 ≥ Q1 T1 Q1 Q2 − ≤0 T1 T2
S 2 − S1 = ∫
1
2
dQ 1 Q ml = ∫ dQ = = m T T 1 T T
2
=
335 J / g × 1000 g = 1226.4 J / K 273.15 K
三 熵增原理
dQ T 对于任意一个初态、终态都是平衡态的系统,只要系统经历的过程是绝热的 ( dQ = 0 ) ,则
根据克劳修斯不等式 dS ≥
Q0 = ∑ Q0i = T0 ∑
i =1 n
Qi i = 0 Ti
n
借助 n 个可逆卡诺热机的辅助,系 统经历一个循环过程之后, n 个热源所放 出的热量又收回了。最后系统与卡诺热 机都恢复原状,只有热源 T0 放出了热量
Q0 。
若 Q0 > 0 ,则全部过程终了时,从单一热源 T0 吸热 Q0 全部转化为机械功, 这与热力学第二定律的开尔文表示矛盾。因此 Q0 ≤ 0 ,即 ∑
