气体摩尔体积优质课
气体摩尔体积_优质课ppt课件

Vm 22.4L/mol Mm 20g 80g/m ol
n 0.25m ol ∴ 此 气 体 的 相 对 分 子 质 量 为 8 0
三、阿伏加德罗定律(气体定律)
1、 定律:同温同压下,相同体积的任何气体都 含有相同数目的分子。
2、适用范围:任何气体及气体混合物
结论:1.在相同状况下,1mol不同的固态或液 态物质的体积不同。 2.在标准状况( 0。C,101.325kPa)下, 1mol不同气体的体积几乎相同,约为22.4L。
设问:为什么在相同状况下,1mol不同的固态 或液态物质的体积不同,而 1mol不同气体的 体积却几乎相同呢?首先是不是要弄清楚影 响物质体积的主要因素有哪些?
气态 物质
粒子数
质量
密度 体积(L) 体积(L)
(克) (g/L)(标 (标准状 常规状
准状况)
况)
况
H2 6.02×1023 2.016 0.0899 Ne 6.02×1023 20.18 0.900 N2 6.02×1023 28.04 1.250
22.4 22.4 22.4
24.5 24.5 24.5
27
2.7
10
Pb 固 6.02×1023 207
11.3
18.3
H2O 液 6.02×1023
18
H2SO4 液 6.02×1023
98
(纯)
1.0
18
1.83
53.6
7.1cm 3
6.02× 10 23 个原子
56克
1mol铁
固体物质
18.3cm3
10cm 3
6.02× 10 23 个原子 26.98克
气体摩尔体积 优质课课件

2. 标准状况,1mol任何物质的体积 都约是22.4L。(错,物质应是气体)
3. 标准状况下,1molO2和N2混合气体 的体积(约对,为气22体.4L体。积与分子种类无关)
4. 标准状况下,气体的摩尔体积都是 22.4L。(错,“约为”;单位应为L/mol
例题分析
Chem is try!
例1 标准状况下,4.48LCO2 的物 质的量是 0.2mol
4个篮球间隔 一定距离排列
2.粒子(半径)大小
个篮球紧密堆9个积3乒.粒乓球子紧间密的堆平4积个均篮距球紧离密堆积
问题与探究2:
Chem is try!
4个篮球间隔 一定距离排列
当物质的粒子数目均为 9个1摩篮球尔紧时密,堆决积定固、液、气态 物质的体积大小因素有哪些?
4个乒乓球间隔 一定距离排列
1、宏观质量(m)、物质的量(n)和微观粒子数
(N)之间的关系
m
M
n
NA N
M
NA
2、什么是摩尔质量?你能根据摩尔质量 的定义为摩尔体积下一个定义吗?
思考:
Chem is try!
不同物质的摩尔质量一般不同,
那么不同状态时(固体、液体、
气体)物质的摩尔体积是否相同 呢?
1mol物质在00C、1.01×105Pa下的体C积hem is try!
CO2 气体 N2 气体
1.965 1.25
44 22.4 28 22.4
Chem is try!
• 为什么1mol固体、液体体 积不同?而在0℃,101KPa 的条件下, 1mol气体的 体积却基本相同呢?
Chem is try!
问题与探究1:
从微观角度分析,物质的
高中化学优质课第2课时 气体摩尔体积

第2课时 气体摩尔体积学业要求核心素养对接1.了解气体摩尔体积的含义和应用。
2.能运用气体摩尔体积进行简单计算。
1.在微观与宏观转换中提升对气体摩尔体积概念的理解。
2.通过分析、推理认识气体摩尔体积的构成要素及其相互关系。
[知识梳理]知识点一 决定物质体积大小的因素气球在挤压下体积很容易变小,而铅球在挤压下体积很难发生变化,为什么会这样,带着这个问题完成下面知识点:1.物质体积大小的影响因素结论:(1)在相同条件下粒子数相同的不同固态或液态物质的体积________;(2)在同温同压条件下,粒子数相同的任何气体的体积都________。
大小相等不相同相同2.阿伏加德罗定律相同提醒:由于气体体积受温度和压强的影响较大,温度和压强不同时,体积相同的两种气体的物质的量不一定相同,所含的分子数也不一定相同。
知识点二 气体摩尔体积用打气筒给篮球打气时,气体源源不断的被打进去,而篮球的体积不发生变化,气体都去哪儿了?气体的体积与什么因素有关?只有气体才具有的性质气体摩尔体积的数值不是固定不变的,它决定于气体所处环境的温度和压强。
单位物质的量V mL·mol -1m 3/mol温度和压强22.4 L·mol -1微判断(1)在相同条件下,1 mol任何物质的体积均相同。
( )(2)同温同压下,1 mol气体的体积均为22.4 L。
( )(3)0.5 mol H2的体积约是11.2 L。
( )(4)标准状况下,1 mol任何物质的体积都约为22.4 L。
( )(5)两种气体分子的分子数相同,体积也相同。
( )(6)同温同压下,相同物质的量的气体的体积相同。
( )答案 (1)× (2)× (3)× (4)× (5)× (6)√微训练1.下列说法正确的是( )A.1 mol任何气体的气体摩尔体积都约为22.4 L·mol-1B.20 ℃、1.0×105Pa时,同体积的O2与CO2含有相同的分子数C.当1 mol气态物质的体积为22.4 L时,该气体一定处于标准状况D.2 mol气体的体积约为44.8 L答案 B2.下列说法中,正确的是( )A.1 mol O2和1 mol N2所占的体积都约为22.4 LB.在标准状况下,H2的气体摩尔体积约为22.4 LC.在标准状况下,1 mol H2和1 mol H2O所占的体积都约为22.4 LD.在标准状况下,22.4 L由N2、N2O组成的混合气体中所含有的氮原子的物质的量约为2 mol答案 D微思考1.如何利用理想气体状态方程pV=nRT,推出阿伏加德罗定律及推论?2.标准状况下,气体摩尔体积约为22.4 L/mol,那么当气体摩尔体积为22.4 L/mol时是否处于标准状况?提示 不一定。
气体摩尔体积-公开课市公开课获奖课件省名师示范课获奖课件
1mol
50
受温度和压强影响
1mol H2O(l)
二、影响物质体积大小旳原因
影响1mol不同气体体积旳原因主要是:粒子间距
受温度和压强影响 1、温度:当其他条件不变,温度升高,气体体积增大 2、压强:当其他条件不变,压强升高,气体体积减小
假如温度和压强一定,则粒子间旳距离一定, 体积也就一定。
三、阿伏伽德罗定律
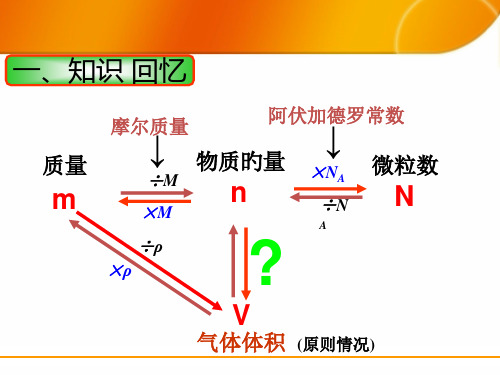
一、知识 回忆
质量
m
↓ ↓ 摩尔质量
阿伏加德罗常数
物质旳量
÷M
n
×M
×NA ÷N
微粒数
N
A
÷ρ ×ρ
?
V
气体体积 (原则情况)
第三课时 气体摩尔体积
教师:林海霞 学生:高一(4)班 日期:2023年9月23日
第三课时 气体摩尔体积
内容
一、知识回忆 二、影响物质体积大小旳原因 三、阿伏伽德罗定律 四、气体摩尔体积
• (4)原则情况下,1mol任何物质旳体积都约是22.4L。
•
错误。“物质”应是气体。
• (5)只有在原则情况下,气体摩尔体积才可能约为22.4L/mol。
•
错误。不一定。
• (6)22.4L气体所含分子数一定不小于11.2L气体所含旳分子数。
•
错误。未指明气体体积是否在相同条件下测定。
第三课时 气体摩尔体积
体积由大到小旳顺序是: ①③④②
Thank you!
A.质量为12 g
B.物质旳量为6 mol
C.体积为22.4 L
D.分子数为6.02×1023
6.(1)CO2旳摩尔质量为 44 g.mol-1 ;88g CO2旳物质旳量为
,所含2二m氧ol化碳分子数为
气体摩尔体积优质课公开课一等奖优质课大赛微课获奖课件

第17页
(5)在非原则情况下, 1mol任何气体 体积一定不是22.4升
(6)1LSO2和1LCO2所含分子数相 同
(7)1LCO和1LCO2在同温同压下所 含分子数相同
(8)原则情况下, 1gCO和1gCO2所 含分子数相同
6.按体积比为1 : 2 : 3构成N2、O2、 CO2混合气体100g,在原则情况下 体积为多少?
60 L
第23页
7、由CH4和O2构成混合气, 对H2相对 密度为14,则混合气中CH4与O2物质量 之比为( ) B
A、1 : 2
B、1 : 3
C、3 : 1
D.2 : 1
“十字交叉法”
第24页
第二节 气体摩尔体积
第1页
物质 状态 摩尔质量 (g ·mol -1)
密度
1mol物质体 积
Fe 固
56 7.86 g ·cm-3 7.2cm3
Al 固
Pb 固
H2O 液
H2SO4 液
H2
气
O2
气
CO2 气
27
ห้องสมุดไป่ตู้
2.7g ·cm-3 10cm3
207 11.3g ·cm-3 18.3cm3
18
1.0g ·cm-3 18cm3
⑷1mol HCl气体在原则情况下占有体积约 是22.4升
⑸0.5molSO2气体通常情况下体积为11.2升
⑹原则情况下, CO2气体摩尔体积为22.4升 第7页
×NA
×M
N
n
m
÷NA
÷M
V(标况气体)
第8页
同温同压下,相同体积任何气体 是否含有相同数目的分子?
新编气体摩尔体积知识公开课一等奖优质课大赛微课获奖课件

第18页
【练习:】
以下相关气体叙述中,正确是 ( B )
在一定温度和压强下,各种气态物质体 积,
由组成气体分子大小决定。
在一定温度和压强下,各种气态物质体积,
由组成气体分子数目决定。
不同气体,若体积不同,则它们所含分子 数
也不同。
阿伏加德罗常数
N
NA
n(mol)
微观
摩尔质量
M
m(g)
宏观
第3页
科学探究
提出问题 引入气体摩尔体积是否含有可行性 设想假说 气体摩尔体积数值也许存在某种特殊性
①电解水试验,比较1 mol H2和 O2体积大小
试验设计 ②已知密度,计算1 mol 不同物质体积
分析数据 分析不同条件下1 mol不同物质体积数据
H2SO4 液体
0℃ 101kPa (原则情 况)
22.4L
22.4L 7.1 cm3 10 cm3 18 cm3 53.6 cm3
25 ℃ 101kPa 0 ℃ 、202kPa (常温常压)
24.5 L
24.5 L 7.1 cm3 10 cm3 18 cm3 53.6 cm3
11.2 L
11.2 L 7.1 cm3 10 cm3 18 cm3 53.6 cm3
第19页
练习:
1、判断下列说法是否正确
①常温常压下,1 mol任何气体×体应积标都明约条为件2为2.4原L则情况
②原则情况下,气体摩尔体积都约是22.4 L
× 单位应为L/mol
③在原则情况下,1 mol H2O体×积约标为况2时2.4水L为液体
④原则情况下,1 mol O2和N2混合气体体积约为 22.4 L
气体摩尔体积优质课课件ppt
气体 物质
H2
1mol 气体 1mol气体 所含分子数 质量(g)
6.02×1023 2.016
密度
标准状况
(g/L)
0.0899
体积
标准状况 (L)
22.4
O2 6.02×1023 CO2 6.02×1023
32.00 44.01
1.429 1.977
22.4 22.3
[结论] 在标准状况下,1mol任何气体 所占的体积 都约是 22.4 L。
“非标准状况下,1mol气体的 体积一定不是22.4L。”这一说 法对吗?为什么?
不对,加压分子距离变小,升温分子距离变大。 所以适当升温并加压后气体体积可能不变。 或适当降温并减压气体体积也可能不变。
篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
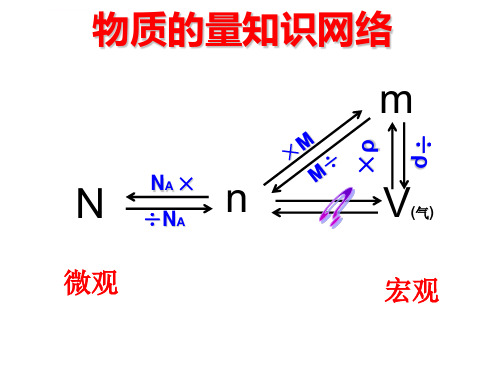
物质的量知识网络
m
×ρ
÷ρ
N n NA × ÷NA
微观
V(气)
宏观
篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
相同条件下1摩尔固体、液体物质的体积
物质
1mol物质的 质量
密度
1mol物质的 体积
Fe
56g
7.8g·cm-3 7.2cm3
Al
27g
2.7g·cm-3
10cm3
Pb
207g
11.3g·cm-3 18.3cm3
化学优质课公开课课件气体摩尔体积

√ (4)273K、101KPa下,11.2L NH3和PH3的
混合气体中所含的氢原子数约为1.5NA。
【题型二】
公式的计算
2、标准状况下,0.5molHCl气体的体积是 11.2L。
3、标况下,2.24L NO2气体的物质的量为_0__.1___mol。 4、标准状况下,0.5mol N2和1mol O2 的混合气体的 体积约是 33.6 L。 5、标准状况下,1.7g氨气所占的体积为 2.24 L,它与
3、1 mol H2O在标准状况下的体积约为 22.4 L
× 。水在标准状况下不是气体。
4、标准状况下,1mol氧气和氮气的混合气体的
体积约为22.4L。√
二、气体摩尔体积Vm
标状下,Vm=22.4L/mol的使用要点:
条件:标准状况
(0 ℃、101KPa)
对象:气体
结论
体积约占22.4L
物质的量:1mol
【题型一】Vm=22.4L/mol的适用条件 1、判断以下说法是否正确。
× (1)标准状况下,22.4L 水中所含分子数为NA。 水在标况下不是气体
× (2)标准状况下,22.4L CCl4含NA个CCl4分子。 × (3)标准状况下,22.4L氦气含有原子数为2NA。 × (3)常温常压下,22.4L氦气含有原子数为NA。
【练习】
3.4g 氨(NH3) 在标准状况时体积是多少升?
解:氨的相对分子质量是17, 摩尔质量是17g/mol。
n (NH3)
=
m(NH3) = M
3.4g = 0.2 mol 17g/mol
V(NH3) = Vm×n= 22.4L/mol
×0.2mol=4.48L 答:3.4g氨在标准状况时的体积是4.48L。
气体摩尔体积化学优质课

Al
固
6.02×1023
27
2.7 10
Pb 固
6.02×1023
207
11.3 18.3
H2O 液
6.02×1023
18
1(40C)
18
H2SO4
(纯)
液
6.02×1023
98
1.83 53.6
[结论] 相同条件下,1摩尔不同固体或液体 物质的体积是 不相同 的。
(标准状况:温度为0℃,压强为101KPa)
判断: ① 摩尔是七个基本物理量之一 ② 摩尔是物质的质量单位 ③ 1mol氧含6.02×1023个氧原子 ④ 1molNa的质量为23 ⑤ Na的摩尔质量也为23 ⑥ 1molNa+的质量为23g。
写规范计算步骤
① 1.5 mol H2SO4含有 mol O,O的个数 为 ,O的质量为 ,含有 mol H,
② 1mol任何物质具有的质量在数字上等于
③ 同温同压下, 1mol不同液体、固体所占体积
主要原因是
同温同压下, 1mol任何气体所占体积
主要原因是
,
标况下所占体积是
22.4L (标准状况)
6.02×1023 分子
标准状况下的气体摩尔体积示意图
气体 1mol 气体 1mol气体 密度
物质
所含分子数 质量(g)
标准状况
(g/L)
H2 6.02×1023 O2 6.02×1023 CO2 6.02×1023
2.016 32.00 44.01
0.0899 1.429 1.977
体积 标准状况
(L)
22.4
22.4 22.3
[结论] 在标准状况下,1mol任何气体所占 的体积 都约是 22.4 L。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【温故而知新】
Chem is try !
1、宏观质量(m)、物质的量(n)和微观粒子数
(N)之间的关系
m
?M ?M
n
? NA ? NA N
2、什么是摩尔质量?你能根据摩尔质量 的定义为摩尔体积下一个定义吗?
思考:
Chem is try !
不同物质的摩尔质量一般不同, 那么不同状态时(固体、液体、 气体)物质的摩尔体积是否相同 呢?
Chem is try !
温度升高,气体 分子间的平均距 离增大,体积增 大。
Chem is try !
压强增大,气体分子间的平 均距离减小,体积减小。
Chem is try !
气体摩尔体积 :单位物质的量的气物体质
所具有的体积。
V
公式: Vm = ——
符号: Vm
n
单位:L/mol(L ·mol-1 )和m3/mol 。
例1 标准状况下,4.48LCO2 的物 质的量是 0.2mol
例2 3.01×1023个H2的物质的量是 0.5 mol ,质量是 1 g,在
标准状况下的体积是 11.2 L
Chem is try !
练习二 填写下列空白:
(1)标准状况下,0.5 的体积约是 11.2 L
mol
H
2占有
(2)标准状况下,16gO2 的体 积约是 11.2 L
构成固态结构微粒 间的距离很小
Chem is try !
所以,固体和液体的体积主 要取决于粒子大小
构成液态结构微 粒间的距离也小
Chem is try !
所以气体所占体积 主要受粒 子间距影响,基本不受半径 影响
气体分子间距离很大
Chem is try !
问题与探究3 :
当粒子数目相同的情况 下,什么因素决定气体分子 间的平均距离呢?
1hem is try !
物质 Fe Al H 2O H2SO 4 H2 O2 CO 2 N2
状态 固体 固体 液体 液体 气体 气体 气体 气体
密度 7.8g/ml 2.7g/ml 1g/ml 1.83g/ml
0.0893g/L
1.429g/L 1.965g/L 1.25g/L
(3)标准状况下,11.2LN2 中含有 的N2 的分子数是 3.01x1023个
练习三
Chem is try !
标准状况下,1.6gO2 、 1.4gN2 和4.0g氩气 (氩的相对原子质量
为40)混合,该混合气体的体积
为 4.48 L 。
问题与探究4 :
Chem is try !
在相同温度和压强下,相 同体积的任何气体含有的分子 数目相同吗?
H2 气体 O2 气体
0.0899 1.429
2 22.3 32 22.4
CO 2 气体 N2 气体
1.965 1.25
44 22.4 28 22.4
Chem is try !
?为什么1mol固体、液体体 积不同?而在0℃,101KPa 的条件下, 1mol气体的 体积却基本相同呢?
Chem is try !
问题与探究1:
从微观角度分析,物质的
体积由哪些因素决定?
在相同条件下: 1.粒子数目.
4个篮球间隔 一定距离排列
2.粒子(半径)大小
3.粒子间的平均距离
问题与探究2:
Chem is try !
4个篮球间隔 一定距离排列
当物质的粒子数目均为 1摩尔时,决定固、液、气态 物质的体积大小因素有哪些?
4个乒乓球间隔 一定距离排列
Chem is try !
结论: 在相同温度和压强下, 相同体积的任何气体都含有的 分子数目。 阿伏加德罗定律
(错,未标明状况)
2. 标准状况,1mol任何物质的体积 都约是 22.4L 。(错,物质应是气体)
3. 标准状况下, 1molO 2和N2混合气体 的体积(约对,为气22体.4L体。积与分子种类无关)
4. 标准状况下,气体的摩尔体积都是 22.4L。(错,“约为”;单位应为 L/mol
例题分析
Chem is try !
等温、等压下的气体摩尔体积为 定值
标0 °准状C、况1下01KP 的气体摩尔体积为
约 2定2.4值L/!mol
1mol 、0℃、1.01 ×10 5Pa 下的体积 Chem is try !
物质
状态
密度
体积
O2
气体
1.429g/L
22.40L
CO 2
气体
1.977g/L
22.39L
1mol 、50 ℃、1.01 ×10 5Pa 下的体积
2H2O 通电 2H2↑ + O2↑
36 1.8g 0.1mol
4
32
0.2g 1.6g
0.1mol 0.05mol
Chem is try !
n 1 V = = o2
———
———
o2 ———
n 2 V H2
H
2
Chem is try !
结论:在相同的温度和压强下, 1mol H2 和O2的体积是相同的。
体积 7.2ml 10ml 18ml 53.6ml
22.3L 22.4L
22.39L 22.4L
由体积数据结合物质状态你得出什么结论?
气体物质 1mol下列气体在0 oC、
Chem is try !
注意啦!有条 件,为什么?
1.01×105Pa 下的体积
名称 状态 密 度(g/L) 质量(g) 体积(L)
物质
状态
密度
体积
O2
气体
1.208g/L
26.50L
CO 2
气体
1.661g/L
26.49L
2mol 、0℃、1.01 ×10 5Pa 下的体积
物质
状态
密度
体积
O2
气体
1.429g/L
44.80L
CO 2
气体
1.977g/L
44.78L
Chem is try !
等温、等压下的气体摩尔体积为 定值 0标°准C状、况10下1KP 的气体摩尔体积为定 值!
约 22.4L/mol
Chem is try !
标准状况下的气体摩尔体积 理解要点:
条件: 标准状况(S T P) 0℃、 1.01×105 Pa 对象:任何气体 物质的量:1mol
结 体积约 论 为22.4L
单一气体 和
混合气体
练习一
Chem is try !
1. 1mol气体的体积约为22.4L。
Chem is try !
化学计量在实验中的应用
第二课时 气体摩尔体积
Chem is try !
课前练习: 写出水的电解方程式并计算 1.8克水能产生多少克H2和O2? 其物质的量各是多少?
Chem is try !
V 1 = o2
———
———
V 2 H 2
电解1.8g的水
Chem is try !
