冶金物理化学习题
冶金物理化学(标注)-复习题

《冶金物理化学》复习题一、填空题1.冶金物理化学的理论基础包括、、等知识;冶金物理化学的理论基础包括普通化学、高等数学、物理化学等知识;标注:第1次作业填空2.热力学三大定律是:、、。
第一定律(能量守恒,转化);第二定律(反应进行的可能性及限度)、第三定律(绝对零度不能达到)。
标注:第1次作业填空3.在外界条件改变时,体系的状态就会发生变化,这种变化称为,变化前称,变化达到的状态称。
实现过程的方式称为。
在外界条件改变时,体系的状态就会发生变化,这种变化称为过程,变化前称始态,变化达到的状态称终态。
实现过程的方式称为途径。
标注:第3次作业填空4.状态函数的特点:只取决于,与达到此无关,等都是状态函数,U、H、S、G等也是状态函数。
状态函数的特点:只取决于体系的状态,与达到此状态的途径无关,p、V、T 等都是状态函数,U、H、S、G也是状态函数。
标注:第3次作业填空5、二元相图的反应类型有形成、、、共析反应、偏晶反应、带有固溶体的共晶反应等。
二元相图的反应类型有形成完全固溶体、共晶反应、包晶反应、共析反应、偏晶反应、带有固溶体的共晶反应等。
标注:第5次作业填空6、三元相图有:,如CaO-SiO 2-Al 2O 3三元相图;和、图和等温截面图。
三元相图有:普通相图,如CaO-SiO 2-Al 2O 3三元相图;和等活度、等黏度图和等温截面图。
标注:第4次作业填空7、炉渣的理化性质包括:、、、表面张力(界面张力)、导电性、氧化性(还原性)、气体在渣中溶解度等六个方面。
炉渣的理化性质包括:碱度、黏度、熔点、表面张力(界面张力)、导电性、氧化性(还原性)、气体在渣中溶解度等六个方面。
标注:第5次作业填空8、分子结构理论认为,分子间的作用力为。
标注:第5次作业填空9、离子结构理论认为,离子间的作用力为。
10、高炉渣内的、、、等表面张力,这些物质在表面层中的浓度大于内部的浓度,称为。
高炉渣内的SiO 2、TiO 2、K 2O 、CaF 2等表面张力较低,这些物质在表面层中的浓度大于内部的浓度,称为表面活性物质。
北京科技大学-冶金物理化学-模拟三套卷及答案

北京科技大学-冶金物理化学-模拟三套卷及答案-CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN北京科技大学2012年硕士学位研究生入学考试模拟试题(一)试题编号:809 试题名称:冶金物理化学一.简答题(每题7分,共70分)1.试用热力学原理简述氧势图中各直线位置的意义。
2.简述规则溶液的定义。
3.简述熔渣分子结构理论的假设条件。
4.已知金属氧化反应方程式(1)、(2)、(3),判断三个方程式中,哪个M是固相,液相,气相?确定之后,计算M的熔点和沸点。
已知(1)2M+O2 = 2MO(s)ΔG1θ= -1215000 + 192.88T(2)2M+O2 = 2MO(s)ΔG2θ = -1500800 + 429.28T(3)2M+O2 = 2MO(s)ΔG3θ = -1248500 + 231.8T5. 简述三元系相图的重心规则。
6. 试推导当O2在气相中的分压小于0.1Pa时硫容量的一种表达式。
7. 试写出熔渣CaO-SiO2的光学碱度的表达式。
8. 推导在铁液深度为H的耐火材料器壁上活性空隙的最大半径表达式。
9. 简述双膜传质理论。
10. 试推气固相反应的未反应核模型在界面化学反应为限制环节时的速率方程。
二.计算题(30分)在600℃下用碳还原FeO制取铁,求反应体系中允许的最大压力。
已知:FeO(s) = Fe(s)+ 1/2 O2(g) Δr Gθ= 259600 –62.55T ,J/molC(s) + O2 = CO2(g) Δr Gθ= -394100 + 0.84T,J/mol2C(s) + O2(g) = 2CO(g) Δr Gθ= -223400 - 175.30T ,J/mol 三.相图题(25分)1)标明各相区的组织。
2)分析x点的冷却过程,画出冷却曲线,并用有关相图的理论解释。
四.对渣-钢反应 [A] +(B2+) = (A2+) + [B] (25分)(1)分析该反应有几个步骤组成。
冶金物理化学习题

(2 分)
C Cr Ni aC : lg fC = eC [%C ] + eC [%Cr ] + eC [% Ni ] = 0.14 × 0.025 + ( - 0.024) × 10 + 0.012 × 9 =-
0.1285
aC =0.744×0.025=0.0186
3
(2 分)
9.96 =934706-427.38T (2 分) 0.01864 ΔG=0 时,T=2187K (2 分) 为了使 Cr10%,Ni9%的不锈钢中碳氧化到 0.025%,熔池温度应在 1914℃以上。(1 分)
LMn >> k[ Mn ] / k( MnO ) 时,哪一个环节为限制性环节?总速率方程可简化成什么形式?如果 LMn LMn << k[ Mn ] / k( MnO ) 时,哪一个环节为限制性环节?总速率方程可简化成什么形式?
∆G=934706-617.22T+RTln 四(15 分).将组成为 4.0%C、0.25%Si、0.5%V、0.03%P、0.08%S 的生铁进行氧化提钒处理, 为使生铁中钒大量氧化而碳不大量氧化, 以便获得含氧化钒高的钒渣和半钢液, 试求提钒的温度 条件。已知钒渣的成分为 25.5%V2O3、37.5%FeO、15.6%SiO2、13.4%TiO2、0.5%CaO、0.5% MgO、3.0%MnO、3.0%Al2O3。反应 2/3 [V]+CO=1/3(V2O3)+[C] ΔGθ=-218013+136.22T,假设 γ V2O3 = 10−7 。 解: 2/3 [V]+CO=1/3(V O )+[C] ΔGθ=-218013+136.22T
Cr C Ni aCr : lg f Cr = eCr [%Cr ] + eCr [%C ] + eCr [% Ni ] =-0.0003×10+(-0.12)×0.025+0.0002×9=-
809冶金物理化学考试试题C卷

昆明理工大学硕士研究生招生入学考试试题(C卷) 考试科目代码:809 考试科目名称:冶金物理化学一、选择题。
在题后括号内,填上正确答案代号。
(本大题共15小题, 每小题2分, 共30分)1、理想气体与温度为T的热源相接触,作等温膨胀吸热Q,而所作的功是变到相同终态的最大功的20 % ,则系统的熵变为()。
(1);(2);(3);(4)2、已知环己烷、醋酸、萘、樟脑的(摩尔)凝固点降低系数k f分别是20.2,9.3,6.9及39.7 K·kg·mol。
今有一未知物能在上述四种溶剂中溶解,欲测定该未知物的相对分子质量,最适宜的溶剂是:()。
( 1 ) 萘;( 2 ) 樟脑;( 3 ) 环己烷;( 4 ) 醋酸。
3、PCl5的分解反应PCl5(g) == PCl3(g) + Cl2(g) 在473 K达到平衡时PCl5(g) 有48.5%分解,在573 K 达到平衡时,有97 %分解,则此反应是:()。
(1)吸热反应;(2)放热反应;(3)反应的标准摩尔焓变为零的反应;(4)在这两个温度下标准平衡常数相等的反应。
4、对行反应A B,当温度一定时由纯A开始,下列说法中哪一点是不对的:()。
(1)开始时A的反应消耗速率最快;(2)反应的净速率是正逆二向反应速率之差;(3)k1/ k-1的值是恒定的;(4)达到平衡时正逆二向的反应速率系(常)数相等。
5、某反应的等压反应摩尔焓变∆H m = -100 kJ·mol-1,则其活化能:( )。
(1) 必定等于或小于100 kJ·mol-1;(2) 必定等于或大于100 kJ·mol-1;(3) 可以大于或小于100 kJ·mol-1;(4) 只能小于100 kJ·mol-1。
6、以下复合反应由若干元反应所组成:A用质量作用定律写出反应中与各物浓度关系为:()。
(1)= 2k1c A +2k4c Y-k3c;(2)=k1c A +k4c Y-k3c;(3)=2k1c A + 2k4c Y-2k3c;(4)= k1c A + k4c Y-2k3c。
铜冶炼过程中的物理化学原理考核试卷

1.铜主要以Cu2+的形式存在于铜矿中。()
2.铜湿法冶炼过程中,电解法是常用的提炼方法之一。()
3.铜萃取过程中,萃取剂的选择性越好,铜的纯度越高。()
4.铜电解过程中,阳极反应是氧化反应。()
5.铜火法冶炼中,增加熔炼温度可以提高铜的回收率。()
5.铜萃取过程中,常用的萃取剂是______。
6.铜冶炼过程中,浮选法主要用于______的富集。
7.铜的湿法冶炼过程中,常用的浸出剂是______。
8.铜电解过程中,电解质的浓度通常控制在______左右。
9.铜火法冶炼中,反射炉的熔炼温度大约在______摄氏度。
10.铜冶炼过程中的主要环保问题是______的排放。
铜冶炼过程中的物理化学原理考核试卷
考生姓名:__________答题日期:__________得分:__________判卷人:__________
一、单项选择题(本题共20小题,每小题1分,共20分,在每小题给出的四个选项中,只有一项是符合题目要求的)
1.铜冶炼过程中,铜主要以哪种化合物的形式存在?()
1. ×
2. √
3. √
4. √
5. √
6. ×
7. ×
8. ×
9. √
10. ×
五、主观题(参考)
1.铜火法冶炼是基于铜矿中铜的氧化物的还原反应,主要步骤包括焙烧、熔炼和吹炼。
2.铜湿法冶炼中,浸出是通过溶剂将铜从矿石中提取出来。常用浸出剂包括硫酸、氨水和硝酸。
3.控制电解质浓度是为了保证电解过程的稳定性和铜的纯度。浓度过高或过低都会影响电解效率。
A.焙烧
冶金物理化学习题解

θ
3 O2= Mn2O3 2 1mol O2 条件下:
2Mn+
⇒
4 3 Mn+ O2= Mn2O3 3 2
2 2 ∆Gθ Mn2O3 = ∆ f Gθ Mn2O3 = × (969640 + 254.18T ) J / mol 3 3
代入 T=1000K
3 MnO2 ○
则有
∆GMn2O 3 θ = −47.7 KJ / mol
M= ln 0 T 298 298 + −= 1 ln T − 4.7 + 298 T T
(T − 298) 2 T 1 M1 = = − 298 + 44402 × 2T 2 T
代入上式可得:
∆Gθ T = −1673600 + 313.315T − T × [28.49 × ln T + T 1 −18.265 ×10−3 × ( − 298 + 44402 × )] 2 T
J/mol J/mol J/mol J/mol J/mol
2Mn+O2=2 MnO 1mol O2 条件下: ∆GMnOθ =2∆ f GMnOθ =−2 × (−38490 + 76.36T )
代入 T=1000K
2 Mn2O3 ○
则有 ∆GMnO = −617.140 J / mol = 61.7 KJ / mol
⇒ ∆H 0 =1681280
3 ∆S θ = S θ 298( Al2O3 ) − 2 S θ 298( Al ) − S θ 298(O2 ) 298 2 = 51.04 − 28.33 × 2 − 105.13 × 1.5
=-313.315
∆Gθ 298 = ∆H θ 298 − T ∆S θ 298
冶金物理化学试卷(A)

(1)
J Mn
=
kd ([Mn]− [Mn]∗)
=
−
1 S
⎜⎛ dnMn ⎝ dt
⎟⎞ = − ⎠
V S
⎜⎛ ⎝
d [Mn]⎟⎞
dt ⎠
=
−h⎜⎛ d[Mn]⎟⎞
⎝ dt ⎠
(2)
[Mn]和 [Mn]∗ 分别为 Mn 在钢液和渣-钢界面的浓度,Kd 为 Mn 在钢液中传质系数。由于高
温反应速率很快,可以认为在钢渣界面反应[Mn]+(O)=(MnO)达平衡,钢渣界面 Mn 浓 度为定值,不随时间变化,
试卷 第 2 页 共 8 页
为了数学上的处理方便,将分子扩散(D)和湍流传质(ED)折算成稳态的分 子扩散,为此由浓度为 Cs 的固体表面点作浓度曲线的切线,使之与本体浓度 Cb 的延 长线相交于一点,过这点作一平行于固体表面的平面,该平面与固体表面之间的区域 称为有效边界层,其厚度用δc′表示。
4)=1)-2)-3)
ΔrG0(4)=(633000-299.8T)-(-131500-17.24T) =764500-282.56T=764500-(282.56*1800)=255892
ΔrG0(4)=-RTlnK=-8.314*1800lnK=-14965.2lnK lnK=-17.1, K=3.746X10-8
自
1. 试用热力学原理说明在氧势图上为什么位置低的金属元素可以还
觉
遵 装 原位置高的氧化物?
守
考订 试线
解:M 和 N 为两种金属单质。
规 则内
(2x/y)M+O2=(2/y)MxOy , ΔG0M (1) 氧势图上位置高
,
诚不
(2x/y)N+O2=(2/y)NxOy, ΔG0N (2) 氧势图上位置低
冶金物理化学标准答案

北京科技大学 2006—2007学年 第一学期冶金物理化学标准答案一、简答 (每小题5分,共50分)1. 试用相图的基本规则说明以下相图的错误所在?答:违背了相图的构筑规则“在二元系中,单相区与两相区邻接的界线延长线必须进入两相区,不能进入单相区”2. 在Ellingham 图上,为什么形成CO 的曲线的斜率为负值,而一般的斜率为正值? 答:CO O C 222=+ΘΘΘΘ−−=ΔC O CO S S S S 2202f ΘΘ−≈S S CO 0p ΘΔ−∴S ;∴ΘΔG ~T 曲线的斜率小于零。
同理可以证明一般反应的~T 曲线的斜率大于零。
ΘΔG 3. 简述分子理论的假设条件。
答:1)熔渣是由各种电中性的简单氧化物分子、CaO 、MgO 、、、及它们之间形成的复杂氧化物分子FeO 32O Al 2SiO 52O P 2SiO CaO •、22SiO CaO •、、等组成的理想溶液。
22SiO FeO •52O P CaO •2)简单氧化物分子于复杂氧化物分子之间存在着化学平衡,平衡时的简单氧化物的摩尔分数叫该氧化物的活度。
以简单氧化物存在的氧化物叫自由氧化物;以复杂氧化物存在的氧化物叫结合氧化物。
如:()=2()+() 22SiO CaO •CaO 2SiO 2222SiO CaO SiO CaO D x x x K •=由K D 计算的x CaO 及x SiO2叫及的活度。
CaO 2SiO 4. 试解释正规溶液定义。
答:过剩混合热(其实为混合热)不为零,混合熵与理想溶液的混合熵相同的溶液叫正规溶液。
5. 试从热力学原理说明熔渣的氧化还原性? 答:定义∑FeO 0表示渣的氧化性。
决定炉渣向钢液传氧的反应是()=FeO [][]Fe O +[]FeOa O K00=Θ或[]FeOa O L 000=令[]FeOa O L00'0=----代表实际熔渣中的值。
当时,'oL f 0L f 0'0'00ln ln ln L L RT L RT L RT G =+−=Δ0,反应逆向进行,钢液中的氧向熔渣传递;当时,='oL p 0L G Δ0'0ln L L RT 0p ,反应正向进行,熔渣中的氧向钢液传递。
冶金物理化学试卷

2010~2011学年第二学期期末考试《冶金物理化学1》试卷(A)计算中可能用到的数据:=0.140,=0.080,,= 0.051,= 0.13,=0.110,=0.120,原子量:Ca : 40,Si: 28,Fe:56,Mg: 24,V: 51,Mn:55,P: 31,Al: 27,S: 32,O: 16,Ni: 58.7,Cu: 63.54一、基本概念题(30分)1.682℃测得Cd-Sn合金:x Cd=0.0106(%Cd=1)、x Cd=1(%Cd=100) 和x Cd=0.6130(%Cd=60) 时Cd的蒸汽压分别为7.89×102 Pa、3.29×104 Pa和 3.03×104 Pa,则x Cd=0.6130(%Cd=60) 时a Cd(R)=,a Cd(%)=。
2.1600℃时液态铝在铁液中的=0.029,则以液态纯铝作标准态时,铝在铁液中的=;以质量浓度为1%的铝溶液作标准态时,铝在铁液中的=。
3.1873K时Fe-Cu系内Cu的活度a Cu(R)=0.730,=8.6,则a Cu(%)=。
4.在进行冶金中的相关反应计算时,对于金属熔体中的组元,其活度一般采用为标准态;对于熔渣中的组元,其活度一般采用为标准态。
5.由炼钢渣系1600℃等活度图上查得a FeO=0.53,则此渣与含氧0.1%的钢液接触时,钢液中氧含量将。
6.渣中SiO2浓度低时,渣中Al2O3显性,当渣中Al2O3浓度增大时,渣中SiO2活度。
7.Al2O3在碱性渣中以离子形式存在;在酸性渣中以离子和离子形式存在。
8. 碱性渣中Al2O3浓度增大时,;酸性渣中Al2O3浓度增大时,。
9.脱S反应分子方程式为(CaO)+[S]=(CaS)+[O],则离子反应方程式为。
10.当Δ[O]>0时,氧由向中传输;当Δ[O]<0时,氧由向中传输。
二、热力学计算题(50分)1.(10分)1540℃时,与含有2.1%C的铁液平衡的气相中。
计算冶金物理化学习题

习题11.计算浓度为1.0×10-6M的醋酸溶液的平衡pH,醋酸的电离常数: Ka=1.8×10-5.(HAC=H++AC-)2.在同一张图上, 画出一个多元体系平衡pH图,该平衡pH是各物种总浓度对数的函数.(列出物质)3.考察Na2CO3-H2O体系,计算所有物种的平衡浓度,平衡浓度是Na2CO3总浓度的函数.参考: F. S. Nakayama, Hydrolysis of sodium Carbonate, J.Chem. Educ., 47,67,(1970)4.修改程序1-6,使之能用于求解酸, 碱混合体系的平衡问题,例如一个溶液中HCl的浓度是aM,NH3的浓度是bM,三乙醇胺的浓度是cM.参考:M .J. D. Brand, A general method for the solution of polynomial equations in H+ion concentration, J. Chem. Educ. 53,771(1976)5.讨论溶液平衡MX(s)=M z++X z-Ksp=a Mz+.a Xz-试证明25℃时,在C摩尔1:1电解质溶液中,盐MX的溶解度是方程:F(S)=2logS-1.018Z2Z2S+C -logKsp的一个根,假定满足Debye-Huckel 极限定理,选择一系列难溶盐,画出溶解度-离子强度图.(X)6.编写一个程序, 求解在含有HCl的溶液中, CuCl溶解度的最小值.(CuCl=Cu+ClK=[Cu+]*[Cl-]=1.628*10-7[Cl]T=[Cl]cu+[Cl]h S=[Cu+]*(37.5+64)/10 [Cl-]T=0.1+[Cl-]=0.1+[Cu+] [Cu+](0.1+[Cu+])=1.628E-7X(0.1+x)=1.628e-7F(x)=x2+0.1x-1.628e-7牛顿法7.编写一个程序,用自由能极小值方法求解平衡问题.参考: S. Davidson, Iterative method of solving equilibrium problem by free-energy minimization. J. Chem. Educ. 50,299(1973)8.化学反应的平衡浓度一氧化碳与氢按以下反应生成甲醇CO+2H2=CH3OH现有1mol CO与2mol H2的混合物, 在t=590℃, P=3.04×107Pa下进行反应并达到平衡,(K f=1.393×10-15 (正反应速率常数),K r=0.43(逆反应)), 求CH3OH在平衡气相中的摩尔分数.C1=K f*Pco*P2H2 正反应速率C2=Kr*P CH3OH 逆反应速率K=P CH3OH/( Pco*P2H2 )=Kf/KrPV=nRT9.配合平衡计算将0.1mol/L Cu(NH3)42+溶于0.1mol/L氨水中, 试问所得溶液中Cu2+的离子浓度为多少,设Cu(NH3)42+的不稳定常数(电离常数)为4.6×10-14. 例题4K=[Cu][NH]/[CuNH]10.求1mol/L[Ni(NH3)6](NO3)2溶液中Ni2+的浓度,已知配合反应Ni(NH3)2+6=Ni2++6NH3的不稳定常数为K d=5.7×10-9.Kd=[Ni][NH]6/ [Ni(NH)] NH=1-Ni(NH)=NiNi+Ni(NH)=1F(Ni)=6^6*[Ni]^7+Kd*[Ni]-kdF’(x)=7*6*x^6+kd11.求0.2mol/L HF溶液的pH值. 已知HF的离解常数K=7.2×10-4.例题5 H+包括水中的12.推导浓度为C的一元弱酸水溶液中氢离子浓度的表达式.(①考虑水的离解,②不考虑水的离解)并分别计算苯酚(K=1.004×10-10)和硝基苯(K=7.096×10-8)两种酸在浓度为1mol/L和1×10-4mol/L时的pH.阴阳离子都给出则考虑电中性13.已知氨分解反应式为:NH3=0.5N2+1.5H2在450℃时平衡常数Kp=0.1132×108(Pa), 计算总压为3.039×107Pa时,氨最多能分解的百分数.习题二1.已知反应2NO3=NO+O2的平衡常数K与标准焓变ΔH及温度T(K)之间的关系如下:lnK=-ΔH/RT+C实验测定t=97℃时K=0.508×10-6,t=27℃时,K=9.79×10-11,计算t=50℃时的平衡常数。
冶金物理化学答案

一、解释下列概念(每题5分,共20分)1、扩散脱氧:在炼钢过程中,根据分配定律钢液中的[O]向熔渣中扩散,而与加入渣相中的脱氧元素进行的脱氧反应称为扩散脱氧。
2、炉渣:炉渣是火法冶金中以氧化物为主要成分形成的多组分熔体,是金属提炼和精炼过程中除金属熔体以外的另一产物。
3、硫容量:炉渣容纳或溶解硫的能力,即2/122)/()(%S O S P P S C ⨯=。
4、偏摩尔量:在恒温、恒压及其他组分的物质的量保持不变的条件下,溶液的广度性质X (X 代表U 、H 、V 、S 、G )对其组分摩尔量的偏微商值。
二、简答题(共60分)1、简述热力学计算中活度标准态之间的转换关系。
答:(1)纯物质标准态活度与假想纯物质标准态活度之间的转换:][0][0*)()(*][][//H B B R B BBx H x H B B B H B R B a r a r pK K p p p a a ====故(2)纯物质标准态活度与质量1%溶液标准态活度之间的转换:*)(*(%)(%)*[%]][100100//B BA Bx H BA BH H B B B B R B r MMp K MMp K K p p p a a ⨯=⨯===(3)假想纯物质标准态活度与质量1%溶液标准态活度之间的转换:BA x H H HB x H B B H B MMK K K p K p a a 100//)((%)(%))([%]][===2、简述炉渣氧化脱磷的热力学条件。
答:由炉渣脱磷反应可知:9245245252)(%)(%][%)(%O CaPCaOFeO PP P fCaO FeO K P O P L γγγ⋅==由上述公式可知,为使脱磷反应进行完全,必要的热力学条件是: (1) 较高的炉渣碱度; (2) 较高的氧化铁含量; (3) 较低的熔池温度;大渣量。
3、铁氧化物被CO 还原的顺序是什么?写出反应方程式(配平)。
答:氧化铁被CO 还原在570℃以上及其下有不同的转变顺序,因此氧化铁还原是逐级的,反应如下:25324332224324332)(43)(41)(2)(3570)()()(3)()(2)(3570COs Fe CO s O Fe CO s O Fe CO s O Fe Ct COs Fe CO s FeO CO s FeO CO s O Fe CO s O Fe CO s O Fe Ct oo+=++=+<+=++=++=+>4、正规溶液的定义及其热力学特征。
冶金物理化学习题

冶金原理(第二版) p431. 在不同温度测得反应FeO (s)十CO =Fe 十CO 2的平衡常数值如表1—19,请用作图法及回归分析法求上反应的平衡常数及0G ∆的温度关系式。
表1-19 反应平衡常数的测定值 温度,℃ 1038 1092 1177 1224 1303 K 0.377 0.357 0.331 0.315 0.297解:811lg 1.041k T=-分析作图结果:811ln 19.147( 1.041)1552819.93G RT k T T T∆==--=-+2. 略。
3. 在682℃测得Cd-Sn 合金的镉在不同浓度的蒸气压如表1—20。
试以(1)纯物质,(2)假想纯物质,(3)重量1%浓度溶液为标准态计算镉的活度及活度系数。
Cd P ,Pa Cd P ,Pa 1 27.8910⨯ 60 43.0310⨯ 20 31.1510⨯ 80 43.2210⨯ 40 32.3710⨯10043.2910⨯解:(1)以纯物质为标准态:CdCd Cda f x =CdCdCd P a P *=CdCd Cda r x =%%%CdCd Cd CdSnCdSnm x M M =+%Cd120 40 60 80 100 Cd x 0.0106 0.2088 0.4132 0.6130 0.8086 1.000 Cd a0.024 0.441 0.720 0.921 0.979 1.000 Cd r2.2642.1121.7421.5021.2111.000(2)以假想纯物质为标准态:Cd x0.0105 0.2088 0.4132 0.6130 0.80861.000Cd a Cd f1.0000.9330.7700.6640.5350.44227.89101%i i D K Pa ==⨯ %%Cd Cda f = %Cd120 40 60 80 100 Cd a1.000 18.38 30.04 38.40 40.81 41.70 %f1.0000.9170.7510.6400.5700.4174. A-B 系合金在1000K 时组分A 的蒸气压如表1-21。
北京科技大学 冶金物理化学 第二章 作业1

P329 1实验测得Fe-C 熔体中碳的活度C a (以纯石墨为标准态)与温度T 及浓度C x 的关系如下C C C C C11803400lg lg()0.87(0.72)()121x x a x T T x =+-++--(1)求C lg γ与温度T 及浓度C x 的关系式; (2)求C lg γ与温度T 的关系式及1600℃时的C γ; (3)求反应C (石墨)=[C]1%的sol G ∆与温度T 的二项式关系表达式;(4)当1600℃铁液含碳量为w[C]=0.24%时,碳的活度(以w[C]=1%溶液为标准态)是多少?解:(1)以纯石墨为标准态 C C C a x γ=⋅,则C CC C C C C C CC C11803400lg lg lg lg()lg 0.87(0.72)()121111803400lg()0.87(0.72)()121x x a x x x T T x x x T T x γ=-=-+-++--=+-++--(2),C C H,C C H,CH,C ,,01,R C C iC ia x f x a f x γγγγ⋅===⋅≤≤⋅由得出该式在全浓度范围内成立,没有限制条件。
在极稀溶液C 0x →且满足Henry 定律,H,C 1f =,则C C γγ=,C C CC 00C C 111803400lg lg lg()0.87(0.72)()12111800.87C x x x x T T x Tγγ→→==+-++--=-当T=1600℃=1873K 时, C C 1180lg 0.870.24,0.5751873γγ=-=-=(3)[]1%,%,%,l ,so R c cc R cC C G μμμμ=∆=-(石墨)C 在铁液中的化学势一定,即,%,R C C μμ=%,%,,,%,,;ln ln C C R C c R R C c RT a RT a μμμμ=+=+,,,%,%,ln ln R C R C C C RT a RT a μμ+=+R,C R,C sol %,C R,C %,%,ln2.303lgCCa a G RT RT a a μμ∆=-==在01C x ≤≤时,,%,R C C C Ca x a γ=⋅当[%]1C =时, [%]0.045[%]()100FeC C Fe C CC M x x C M M M ⋅===-+R,C %,2.303lg2.303lg(0.045)11802.3038.314lg 0.045 2.3038.314(0.87)2.3038.314(lg 0.0450.87) 2.3038.314118022593.62842.445sol C Ca G RT RT a T T TT Tθγ∆===⨯⨯⨯+⨯⨯⨯-=⨯⨯⨯-+⨯⨯=-(4)[%]0.011[%]()100FeC Fe C CC M x C M M M ==-+ ;,R C a 题目以给出,C x 与C γ 已求出。
冶金物理化学 2

-1 θ ∆H 298 =-943.5(kJ·mol )
L 转变=3680 J·mol
-1
Ti(α ) Ti( β )
O2(g) TiO2(s)
C p =22+10.04×10-3T (J·K-1·mol-1) C p =28.90 (J·K-1·mol-1) C p =29.96+4.18×10-3T-1.67×105 T-2(J·K-1·mol-1) C p =75.19+1.17×10-3T-18.20×105 T-2(J·K-1·mol-1)
6.试求熔化 298K 下的 lkg 的 Pb 需多少热量。 已知:Pb(s)
C p =23.56+9.75×10-3T (J·K-1·mol-1)
T 熔点=600K,Mpb=207
7.已知: Ti(α ) + O2 ( s ) = TiO2 ( s )
K Ti(α ) 1155 → Ti( β )
PDF 文件使用 "pdfFactory Pro" 试用版本创建
转化 已知:1033K α Fe(强磁) 磁性 → α Fe(顺磁),△H 磁化=2760 J·mol
-1
→ γ Fe, ∆H ′ =920 J·mol 1183K α Fe(顺磁)
FeO Fe O2 FeO
例题
[例题 1]:电炉炼钢还原期,加入渣面上的碳粉能与渣中 CaO 作用生成 CaC2
(CaO)+ 3C(s)= (CaC2)+ CO(g) 试计算在高炉中能否发生上述反应生成 CaC2?已知高炉炉缸温度为 1523℃,高 炉渣中 (CaO) 活度 (以纯 CaO 为标准态) 为 0.01, 炉缸中 CO 分压为 1.5×105Pa。 假设高炉渣中 (CaC2) 服从拉乌尔定律, 渣中 CaC2 的摩尔分数 xCaC 2 达到 1.0×10-4 时即可认为有 CaC2 生成。已知下列热力学数据: Ca(l)+2C(s)= CaC2(s) Ca(l)= Ca(g) C(s)+
冶金物理化学3

(3) γ MnO = 1.2, γ SiO 2 = 1.4 (4) M Al 2O3 = 102kg⋅mol-1, M SiO 2 = 60 kg⋅mol-1, M MnO = 71 kg⋅mol-1 (答案:(1)不能,(2)能) 7. 根据铝在铁、银间的分配平衡实验,得到 Fe-Al 合金(0< xAl <0.25)中铝的活度系数在 1600℃时为 ln γ Al = 1.20 xAl -0.65。求 铁的摩尔分数 xFe =0.85 的合金中在 1600℃时铁的活 度。 (答案:0.83) *8. 将含 w[C] =3.8%、w[Si] =1.0% 的铁水兑入转炉中,在 1250℃下吹氧炼钢,假定气体 压力为 100kPa,生成的 SiO2 为纯物质,试问当铁水中[C]与[Si]均以纯物质为标准态以及均 以 1%溶液为标准态时,铁水中哪个元素先氧化? 已知:
习题
*1. 实验测得 Fe—C 熔体中碳的活度 a C (以纯石墨为标准态)与温度 T 及浓度 x C 的关系 如下 lg a C =lg (
xC x ) + 1180 -0.87+(0.72+ 3400 ) ( C ) T T 1 − 2 xC 1 − xC
(1) 求 lg γ C 与温度 T 及浓度 x C 的关系式;
*2.
Fe—Si 溶液与纯固态 SiO2 平衡,平衡氧分压 PO 2 =8.26×10-9Pa。试求 1600℃时[Si]在
以下不同标准态时的活度。(1) 纯固态硅 (2)纯液态硅 (3)亨利标准态 (4) w[Si] =1%溶 液标准态,已知 Si(s)+O2(g)= SiO2(s) ∆fGθ=(-902070+173.64T) Jžmol-1
冶金物理化学习题
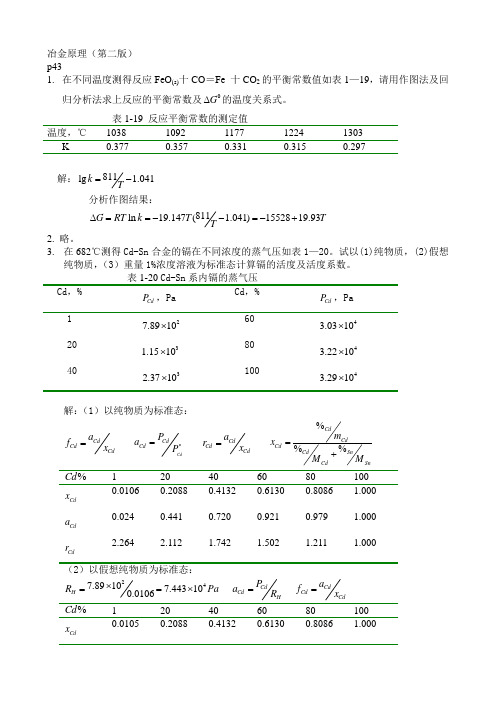
冶金原理(第二版) p431. 在不同温度测得反应FeO (s)十CO =Fe 十CO 2的平衡常数值如表1—19,请用作图法及回归分析法求上反应的平衡常数及0G ∆的温度关系式。
表1-19 反应平衡常数的测定值 温度,℃ 1038 1092 1177 1224 1303 K 0.377 0.357 0.331 0.315 0.297解:811lg 1.041k T=-分析作图结果:811ln 19.147( 1.041)1552819.93G RT k T T T∆==--=-+2. 略。
3. 在682℃测得Cd-Sn 合金的镉在不同浓度的蒸气压如表1—20。
试以(1)纯物质,(2)假想纯物质,(3)重量1%浓度溶液为标准态计算镉的活度及活度系数。
Cd P ,Pa Cd P ,Pa 1 27.8910⨯ 60 43.0310⨯ 20 31.1510⨯ 80 43.2210⨯ 40 32.3710⨯10043.2910⨯解:(1)以纯物质为标准态:CdCd Cd a f x =CdCdCd P a P *=CdCd Cd a r x =%%%CdCd Cd CdSnCdSnm x M M =+%Cd120 40 60 80 100 Cd x 0.0106 0.2088 0.4132 0.6130 0.8086 1.000 Cd a0.024 0.441 0.720 0.921 0.979 1.000 Cd r2.2642.1121.7421.5021.2111.000(2)以假想纯物质为标准态:247.89107.443100.0106H R Pa ⨯==⨯ CdCd H P a R =CdCdCd a f x =%Cd120 40 60 80 100 Cd x0.0105 0.2088 0.4132 0.6130 0.8086 1.000Cd a Cd f1.0000.9330.7700.6640.5350.44227.89101%i i DK Pa ==⨯ %%Cd Cda f =%Cd120 40 60 80 100 Cd a1.000 18.38 30.04 38.40 40.81 41.70 %f1.0000.9170.7510.6400.5700.4174. A-B 系合金在1000K 时组分A 的蒸气压如表1-21。
北京科技大学 冶金物理化学 第三章 作业3

钢液中[O]=0.058%。
试确定计算FeO 的活度的正确性。
解:1)分子理论取100g 渣,计算其中各简单氧化物分子的物质的量12.020.16772FeO n mol ==;14.970.37440MgO n mol ==;8.840.14171MnO n mol ==;219.340.37460SiO n mol ==;42.680.76256CaO n mol ==;25 2.150.015142P O n mol ==; 设熔渣中存在的复杂氧化物;在分子理论的假设下,熔渣的结构有4种组元: 简单氧化物FeO;RO(CaO,MnO,MgO 三物之和);复杂氧化物2252,4CaO SiO CaO PO . 其中,酸性氧化物全部与碱性氧化物形成复杂氧化物。
2220.374RO SiO SiO n n mol ∙== ; 252540.015RO P O P O n n mol ∙== ; 0.167FeO n mol =过剩碱22524()24 0.7620.1250.37420.33240.0150.537CaO MnO MgO CaO SiO CaO P O RO n n n n n n mol∙∙=++--=++-⨯-⨯=剩余22524()0.1670.5370.3220.015 1.041i FeO CaO SiO CaO P O RO n n n n n mol∙∙=+++=+++=∑剩余;a a a a 0.7620.732,11.041C OC O C O C O in a x n γ=====∑;n n n n 0.1250.120,11.041M O M O M O M O in a x n γ=====∑;0.1670.160,11.041FeOFeO FeO FeO in a x n γ=====∑2)完全离子理论0.079FeO a =,修正后0.166FeO a = 3)由反应()[][]FeO O Fe =+得[%O]O FeOL a =,在1873K 时实验得到0.23O L =,所以 [%O]0.0580.2520.23FeO O a L ===55试用完全离子溶液模型计算1600℃时炉渣中(CaO)、(MnO)、(FeO)的活度及活度系数。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高碱度
沉淀脱氧 和 扩散脱氧 ,用脱氧剂脱氧属于
10. 未反应核模型中, 半径为 r0 的矿球的还原度 R 和穿透度 f 与反应界面处的矿球半径 r 的关系 分别为 R=1-(r/r0)3 和 f= 1-(r/r0) 。 (每小题 2 分,根据空格数每空为 0.5 或 1.0 分) 二(15 分).将 0.25mol Fe3O4 和 1.2mol 的固体碳放入体积为 40×10-3m3 的真空反应器内,抽去空 气后加热到 710℃进行还原反应。求(1) 气相组成?(2) 反应器内总压力?(3) 反应器内未反应残 留总碳量? 已知 C+CO2=2CO ΔGθ=172130-177.46T 解:(1)气相由 CO、CO2 组成; 平衡时必然存在反应:C+CO2=2CO ΔGθ=172130-177.46T=-RTlnK,
* 内浓度为 c A ,界面浓度为 c * A ,AB 的相内浓度为 c AB ,界面浓度为 c AB ,A 的传质系数为 k A ,AB
的传质系数为 k AB ,界面反应正反应速率常数为 k + ,平衡常数为 K 。 解: 根据稳定态原理,影响反应速率的三个环节: 反应物向界面扩散速率: J A = 界面反应速率: υ A = −
所以 ln
2 PCO ∆Gθ 172130-177.46 × 983 = ln K = − =− =0.283 PCO2 RT 8.314 × 983
(2 分) (2 分)
故
2 PCO P ′2 =1.327,所以 CO = 1.327 × (1.01325 ×105 )=1.3447 × 105 Pa ′2 PCO2 PCO 2 2 ′2 nCO PCO i RT / V nCO RT = = i ′2 PCO nco2 nco2 V
∆G=934706-617.22T+RTln 四(15 分).将组成为 4.0%C、0.25%Si、0.5%V、0.03%P、0.08%S 的生铁进行氧化提钒处理, 为使生铁中钒大量氧化而碳不大量氧化, 以便获得含氧化钒高的钒渣和半钢液, 试求提钒的温度 条件。已知钒渣的成分为 25.5%V2O3、37.5%FeO、15.6%SiO2、13.4%TiO2、0.5%CaO、0.5% MgO、3.0%MnO、3.0%Al2O3。反应 2/3 [V]+CO=1/3(V2O3)+[C] ΔGθ=-218013+136.22T,假设 γ V2O3 = 10−7 。 解: 2/3 [V]+CO=1/3(V O )+[C] ΔGθ=-218013+136.22T
dn A = k A c A − c* A dt
(
) )
(1 分) (1 分) (1 分)
dn A * = k + c* A − c AB / K dt
(
)
产物从界面扩散速率: J AB =
dn AB = k AB c * AB − c AB dt
(
为了消去界面浓度,将上述各式进行整理,得: 反应物向界面扩散速率:
LMn >> k[ Mn ] / k( MnO ) 时,哪一个环节为限制性环节?总速率方程可简化成什么形式?如果 LMn LMn << k[ Mn ] / k( MnO ) 时,哪一个环节为限制性环节?总速率方程可简化成什么形式?
2006~2007 学年第一学期期末考试 《冶金物理化学 2》 试卷(B)
标准答案和评分标准
﹉﹉﹉﹉﹉﹉﹉﹉﹉﹉﹉﹉﹉﹉﹉﹉﹉﹉﹉﹉﹉﹉ ﹉﹉﹉﹉﹉﹉﹉﹉
一、填空题(每小题 2 分,共 20 分) 1. 水煤气反应式为 CO2 + H2 = CO + H2O ,压力对该反应 温度 、 CO 和 压力 H2 没有 / 无 影响。 2. 分解产物有气体的化合物分解需要在一定的 化合物分解,必须把它加热到 沸腾 温度。 、 ,其中 Fe2O3 C 的还原能 3. 冶金过程使用的还原剂主要有 力最强,又称为 万能还原剂 4. 铁氧化物的还原顺序为 Fe2O3 原, FeO 最难还原。 元素或杂质 通过 氧化 固体 C 。 、 Fe3O4 、 FeO ,其中 最容易还 下进行, 实际生产中要使
而
(2 分) (2 分)
所以
2 nCO P′ 2 V 40 × 10−3 = CO i = 1.3447 × 105 × = 0.658mol ′ 2 RT nco2 PCO 8.314 × 983
①
又由氧的质量守恒得: nCO + 2nCO2 = 4nFe3O4 =1.0mol 联立①②方程解得 nCO =0.430mol
nCO2 =0.285
②
(1 分)
P′ =1.63atm Pθ
(2 分)
P总 =
(2) n = nCO + nCO2 =0.715mol, P′ =
nRT =1.65 ×105 Pa V
(2 分)
(3) 残碳量为: nC − nCO − nCO2 = 1.2-0.715 = 0.485mol
(2 分)
V Si C P S aV : lg fV = eV [%V ] + eV [% Si ] + eV [%C ] + eV [% P] + eV [% S ]
=0.015×0.5+0.042×0.25+(-0.34)×4.0+(-0.041)×0.03+(-0.028)×0.08=-1.3515 fV =0.0445 aV =0.0445×0.5=0.0223 (2 分) 由熔渣组成计算, nV2O3=25.5/150=0.1700,nFeO=37.5/72=0.5208,nSiO2=15.6/60=0.2600,nTiO2=13.4/80=0.1675, nCaO=0.5/56=0.0089,nMgO=0.5/40=0.0125,nMnO=3.0/40=0.075,nAl2O3=3.0/102=0.0294, nz=1.2441, xV2O3 =0.1366,故 aV2O3 = 0.1366 ×10−7 = 1.366 ×10−8 (5 分)
2 3
∆G = -218013+136.22T+19.147Tlg
3 a1/ V2 O3 aC /3 a2 V ×1
(2 分)
C Si V P S aC : lg fC = eC [%C ] + eC [% Si ] + eC [%V ] + eC [% P] + eC [% S ]
=0.14×4.0+0.080×0.25+(-0.077)×0.5+0.051×0.03+0.046×0.08=0.5436 f C =3.496 aC =3.496×4.0=13.984 (2 分)
当反应过程处于稳定态时, J A = υ A = J AB = v#43; + k A k + Kk AB
= c A − c AB / K
(l 分)
(1 分)
c A − c AB / K 1 1 + + k + Kk AB
三(15 分). 在电弧炉内用不锈钢返回料吹氧冶炼不锈钢时, 熔池含有 9%Ni, 如吹氧终点碳为 0.025 %,铬保持在 10%,问吹炼应达到多高的温度?设 PCO=1atm。 已知:4[C]+Cr3O4(s)=3[Cr]+4CO,ΔGθ=934706-617.22T J/mol 3 4 aCr pCO 解:ΔG=934706-617.22T+RT ln (2 分) 4 aC
5. 氧化熔炼是把粗金属中过多的或超过产品金属允许含量的 作用 分离除去。
6.已知 CaCO3 分解的分解压 logPCO2=-8908/T+7.53,高炉中某区域炉气中的 CO2 为 18%, 总压为 1.15atm,则在该区域内,石灰石分解的开始温度为 1084K ,沸腾温度为 1192K 。 7. 炼钢脱磷反应的分子方程式为: 2[P] + 3(CaO) + 5(FeO) = (3CaO.P2O5) + Fe ,离子方程式为 2[P] + 8(O2-) + 5(Fe2+) = 2(PO43-) + 5[Fe] 8. 脱硫的热力学条件是 高温 、 9. 钢液脱氧的类型主要有 。 、 低氧化性 。 沉淀脱氧。
(1 分)
七(10 分). 根据双膜理论, 钢液中的[Mn] 氧化生成(MnO)并向熔渣中迁移, 当界面反应速率很快 时,达到稳态的总过程速率为:
v=
LMn 1 1 + k[ Mn ] k( MnO ) ⋅ LMn
w[ Mn ] −
w( MnO )
1. 说明分子项和分母项,以及分母中两项的物理意义; 2 3
Cr C Ni aCr : lg f Cr = eCr [%Cr ] + eCr [%C ] + eCr [% Ni ] =-0.0003×10+(-0.12)×0.025+0.0002×9=-
0.0042
(2 分) f Cr =0.996 (2 分) f C =0.744
aCr =0.996 ×10=9.96
JA = c A − c* A KA
(1 分)
υA
界面反应速率: 产物从界面扩散速率:
K+
* = c* A − c AB / K
(
) )
(1 分) (1 分) (1 分)
J AB * = c AB − c AB / K Kk AB
(
三式相加得
J A vA J + + AB = c A − c AB / K k A k + Kk AB
(2 分)
C Cr Ni aC : lg fC = eC [%C ] + eC [%Cr ] + eC [% Ni ] = 0.14 × 0.025 + ( - 0.024) × 10 + 0.012 × 9 =-
