第11章-氢和稀有气体习题
氢和稀有气体
2 氢气的制备
(1) 实验室制法 实验室制 H2 常采用稀盐酸与金属锌反 应的方法。
但是由于金属锌中有时含有砷化物、磷
化物等杂质,致使制得的 H2 不纯。
O
N
C
CH
R
N
长链的蛋白质分子自身可以形成螺旋 形构型,这种结构就是靠分子内氢键来稳 定的。 DNA 的双螺旋是两条螺旋形分子通
过氢键结合起来的超分子结构。
18-1-2 氢气的性质与制备
1 氢气的性质
氢有三种同位素:氕 H 、氘 D 和氚 T。
普通的氢和氘有稳定的核,氚是一种不 稳定的放射性同位素,发生 衰变,其半衰 期为 12.26 年:
似之处,但又不完全相同。
氢是唯一值得单独考虑的元素。
稀有气体
稀有气体基态的价电子构型除氦的 ns2 以外,其余均为 ns2 np6 。 在接近地球表面的空气中,1 000 dm3 空 气中约含有 9.3 103 cm3 氩、18 cm3 氖、 5.2 cm3 氦、 1.14 cm3 氪和 0.086 cm3 氙。
主要内容
11
氢 稀有气体
主族元素总结
2 2
33
通常列于碱金属 IA 族顶端
H 氢
稀有气体
He,Ne,Ar,Kr,Xe,Kr 氦、氖、氩、氪、氙 、氡
氢
H
大气中少量的氢气,H2O,及其他无机化
合物和有机化合物中化合态的氢
氢存在于地球、太阳及木星等天体上,是
最丰富的元素
氢
H
氢 稀有气体
用途
燃
料
燃烧值/kJ· -1 kg
氢 气(H2)
戊硼烷(B5H9) 戊 烷(C5H12)
120918
64183 43367
2、氢化物
(1)氢化物的合成
合成二元氢化物的三种常用方法是: 元素直接化合:2E + H2(g) → 2 EH 例如,2Li(l) + H2(g) → 2LiH(s) BrØnsted 碱的加合质子:E- + H2O(ag) → EH + OH例如,Li3N(s) + 3 H2O(l) → 3Li(OH) (aq) + NH3(g) 卤化物或拟卤化物与氢化物之间的复分解: E’H + EX → E’X + EH 例如,LiAlH4 + SiCl4 → LiAlCl4 + SiH4
(kJ•mol–1)
H2O和D2O之间沸点的差异反映了O· · —O 氢 ·H 键不如 O··· D—O氢键强。相同化学环境下键焓高于 键焓的现象在很大程度上是由零点能(指量子在绝对 温度的零点下仍会保持震动的能量 )的差别引起的。 零点能低时键焓相对比较高,零点能高时键焓相对比 较低。氢同位素造成的性质差别大得足以找到某些实 际应用。例如,由于D2O中D–O键的键焓相对比较高 ,电解速率应当低,其结果是在电解水而得到的残液 中得以富集。 利用重水与水的差别,富集重水,再以任一种从 水中制 H2 的方法从 D2O 中获得 D。 慢中子轰击锂产生T:
【思考】潜在储氢材料——化合物 A 是第二周期两种氢化物形成 的路易斯酸碱对,是乙烷的等电子体,相对分子质量30.87,常温 下为白色晶体,稳定而无毒。刚刚融化的 A 缓慢释放氢气,转变 为化合物B(乙烯的等电子体)。B 不稳定,易聚合成聚合物 C (聚乙烯的等电子体)。C 在155oC释放氢气转变为聚乙炔的等电 子体,其中聚合度为3的化合物 D 是苯的等电子体。高于500oC时 D 释放氢气,转变为化合物 E,E 有多种晶型。 (1)写出 A、B、C、D、E 的化学式。
第11章 s区元素和稀有元素 习题解答

第11章习题解答第11章(03525)重水是由H和18O组成的水。
.()解:错第11章(03526)氢在自然界中主要以单质形式存在。
()解:错第11章(03527)由于H2是双原子分子,所以H2比He的扩散速率小。
.()解:错第11章(03528)氢气是最轻的单质,所以它的熔点和沸点在所有单质中最低。
.()解:错第11章(03529)因为氢分子的极化率大于氦分子的极化率,所以氢的熔点比氦高。
.()解:对第11章(03530)常温下H2的化学性质不很活泼,其原因之一是H-H键键能较大。
()解:对第11章(03531)实验室所用氢气钢瓶应放在室外,这是因为氢气.()。
(A)密度小;(B)扩散快;(C)易燃易爆;(D)导热性好。
解:C第11章(03532)水煤气的主要成分是.()。
(A)CO和N2;(B)CO和O2;(C)CO和H2;(D)CO2和H2O。
解:C第11章(03533)下列氢气制法中,工业上不常采用的是.()。
(A)电解法;(B)水煤气法;(C)甲烷转化法;(D)活泼金属与酸反应。
解:D第11章(03534)下列反应方程式中,不适用于工业制氢的是()。
(A)H2O(电解)→H2+O2;(B)Zn+H2SO4→ZnSO4+H2;(C)C+H2O(g)∆−CO+H2;−→(D)CH4+H2O(g)∆,Ni,Co−−−−CO+H2。
−→解:B第11章(03539)在某些工厂用氢气做冷却剂,这是因为氢气.()。
(A)密度小;(B)扩散快;(C)易燃易爆;(D)导热性好。
解:D第11章(03535)下列氢气制法中,工业上不常采用的是.()。
(A)电解法;(B)水煤气法;(C)甲烷转化法;(D)碱金属氢化物与水反应。
解:D第11章(03536)下列分子或离子不能存在的是.()。
(A)H2;(B)H2+;(C)H22+;(D)H-。
解:C第11章(03537)下列原子、离子和分子中属于反磁性的是.()。
北京师范大学、华中师范大学、南京师范大学无机化学教研室《无机化学》笔记和课后习题详解(下册)氢和稀有

11.氙的氟化物是很好的氧化剂,其原因是( )。 A.氧化性强 B.还原到氙 C.不污染反应体系 D.前三者都是 【答案】D
12.下列氢化物中,在室温下与水反应不产生氢气的是( )。 A.LiAlH4 B.CaH2
3 / 15
圣才电子书
C.SiH4
十万种考研考证电子书、题库视频学习平台
14.用价层电子对互斥理论讨论下列分子和离子的几何构型和中心原子的杂化轨道。
9 / 15
圣才电子书
(1)XeF2
十万种考研考证电子书、题库视频学习平台
答: 9.完成并配平下列反应方程式。
答:
10.完成下列氟化物与水反应的方程式。
答:
(不完全水解) (完全水解)
(不完全水解) (大量水,完全水解)
11.完成并配平下列反应方程式。
8 / 15
圣才电子书 十万种考研考证电子书、题库视频学习平台
答:
12.为什么 XeOF4 不能用玻璃容器储存?并指出应该用什么容器储存? 答:XeOF4 会与 SiO2 发生如下反应: 可用镍容器(因氟与镍反应生成致密的保护膜)和某些塑料容器(如聚四氟乙烯)。 13.完成并配平下列反应方程式: (1)XeF6+H2→ (2)XeF6+Hg→ (3)XeF6+HCl→ (4)XeF6+NH3→ 答:
5 / 15
圣才电子书
与化学反应的可能性。
十万种考研考证电子书、题库视频学习平台
答:随着主量子数的增大,原子体积和电子云弥散程度亦增大,为此,从 He 到 Rn,电
离能依次减小,激发到具有未成对电子状态的可能增大,因而,化学活性从上到下增大,从
目前的情况来说,Kr 才开始具有实际的化学活性,Xe 的化学活性明显大得多,按理 Rn 应最
无机化学(第四版)课后答案

无机化学课后答案 第13章氢和稀有气体13-1 氢作为能源,其优点是什么?目前开发中的困难是什么? 1、解:氢作为能源,具有以下特点:(1)原料来源于地球上储量丰富的水,因而资源不受限制; (2)氢气燃烧时放出的热量很大;(3)作为燃料的最大优点是燃烧后的产物为水,不会污染环境; (4)有可能实现能量的储存,也有可能实现经济高效的输送。
发展氢能源需要解决三个方面的问题:氢气的发生,氢气的储备和氢气的利用13-2按室温和常压下的状态(气态 液态 固态)将下列化合物分类,哪一种固体可能是电的良导体?BaH 2;SiH 4;NH 3;AsH 3;PdH 0.9;HI13-3试述从空气中分离稀有气体和从混合气体中分离各组分的根据和方法。
3、解:从空气中分离稀有气体和从混合稀有气体中分离各组分,主要是利用它们不同的物理性质如:原子间不同的作用力、熔点沸点的高低以及被吸附的难易等差异达到分离的目的。
13-4试说明稀有气体的熔点 、沸点、密度等性质的变化趋势和原因?4、解:氦、氖、氩、氪、氙,这几种稀有气体熔点、沸点、密度逐渐增大。
这主要是由于惰性气体都是单原子分子,分子间相互作用力主要决定于分子量。
分子量越大,分子间相互作用力越大,熔点沸点越来越高。
密度逐渐增大是由于其原子量逐渐增大,而单位体积中原子个数相同。
13-5你会选择哪种稀有气体作为:(a )温度最低的液体冷冻剂;(b )电离能最低 安全的放电光源;(c )最廉价的惰性气氛。
13-6用价键理论和分子轨道理论解释HeH 、HeH +、He 2+粒子存在的可能性。
为什么氦没有双原子分子存在?13-7 给出与下列物种具有相同结构的稀有气体化合物的化学式并指出其空间构型:(a) ICl 4- (b)IBr 2- (c)BrO 3- (d)ClF7、 解: 4XeF 平面四边形 2XeF 直线形3XeO 三角锥 XeO 直线形13-8用 VSEPR 理论判断XeF 2 、XeF 4、XeF 6、XeOF 4及ClF 3的空间构型。
氢和稀有气体

TiCl4 + 4NaH == Ti+4NaCl+2H2
金属型氢化物(过渡型)
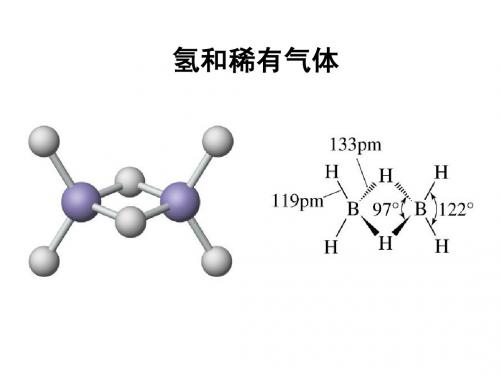
当氢同P区元素(稀有气体和铟、铊除外)结合形成形成 共价氢合物时,存在三种形式: ⑴ 缺电子氢化物,如 B2H6,结构为: ⑵ 满电子氢化物,如 CH4,结构为: ⑶ 富电子氢化物,如 NH3,结构为:
1—6 氢能源
氢燃烧时可放出大量的热,是一种新型高能燃料。但 是氢能源的使用还具有一定的局限性,在石油资源日渐匮 乏的今天,各国都在加紧对氢能源的开发利用。
与金属氧化物或金属卤化物的反应 WO3 + 3H2 → W + 3H2O TiCl4 + 2H2 → Ti + 4HCl 与CO的反应 2H2 学性质和化学反应, 无疑氢的化学性质与还原性这其主要特征,氢的用途也 都基于这一点。
(2) 原子氢
将氢分子加热,特别是通过日以电弧或者进行低压放 电,皆可得到原子氢。将原子氢气流通向金属表面即是常 说的原子氢火焰,可用于焊接金属。 原子氢是一种较分子氢更强的还原剂。如与As、S等 金属单质的反应 As + 3H → AsH3 S + 2H → H2S
5-1-2 氢的成键特征
氢原子的价电子构型为1s1,电负性为2.2。因此,当 氢同其它元素的原子化合时,其成键特征如下: (1) 离子键 当它与电负性很小的金属(Na,K,Ca等)形成氢化 物时,获得一个电子形成 H-离子(半径为 208pm),仅存在于离子型氢化物的晶体中。如 NaH (2) 共价键 A 非极性共价键,如 H2 B 极性共价键,其极性随非金属元素电负性 增强而增强 (3) 独特的键型 ——金属氢化物、氢桥键、氢键
(3)工业生产 来获得氢气。
工业生产中,可用碳还原水蒸气的方法
无机化学练习题(含答案)

无机化学练习题(含答案)第1章原子结构与元素周期系1-1试讨论,为什么有的元素的相对原子质量(原子量)的有效数字的位数多达9位,而有的元素的相对原子质量(原子量)的有效数字却少至3~4位?1-2Br2分子分解为Br原子需要的最低解离能为190kJ/mol,求引起溴分子解离需要吸收的最低能量子的波长与频率。
1-3氢原子核外电子光谱中的莱曼光谱中有一条谱线的波长为103nm,问:它相应于氢原子核外电子的哪一个跃迁?1-4周期系中哪一个元素的电负性最大?哪一个元素的电负性最小?周期系从左到右和从上到下元素的电负性变化呈现什么规律?为什么?1-5什么叫惰性电子对效应?它对元素的性质有何影响?1-6当氢原子的一个电子从第二能级层跃迁至第一能级层时发射出光子的波长是121.6nm;当电子从第三能级层跃迁至第二能级层时,发射出光子的波长是656.3nm。
问哪一个光子的能量大?1-7有A,B,C,D四种元素。
其中A为第四周期元素,与D可形成1:1和1:2原子比的化合物。
B为第四周期d区元素,最高氧化数为7。
C和B是同周期元素,具有相同的最高氧化数。
D为所有元素中电负性第二大元素。
给出四种元素的元素符号,并按电负性由大到小排列之。
1-8有A,B,C,D,E,F元素,试按下列条件推断各元素在周期表中的位置、元素符号,给出各元系的价电子构型。
(1)A,B,C为同一周期活泼金属元素,原子半径满足A>B>C,已知C有3个电子层。
(2)D,E为非金属元素,与氢结合生成HD和HE。
室温下D的单质为液体,E的单质为固体。
(3)F为金属元素,它有4个电子层并且有6个单电子。
第2章分子结构2-1键可由-、-p和p-p原子轨道“头碰头”重叠构建而成,试讨论LiH(气态分子)、HCl、Cl2分子里的键分别属于哪一种?2-2NF3和NH3的偶极矩相差很大,试从它们的组成和结构的差异分析原因。
2-3一氧化碳分子与酮的羰基(>C=O)相比,键能较小,键长较小,偶极矩则小得多,且方向相反,试从结构角度作出解释。
无机化学课后练习题解答.

无机化学课后练习题解答第二章物质的状态2.一敝口烧瓶在280K时所盛的气体,需加热到什么温度时,才能使其三分之一逸出?解:由题知要使三分之一的气体逸出瓶外,即体积为原来的1.5倍,而这一过程压力始终保持不变,故有:(P0V1)/T1= (PV2)/T2所以有 T2 = (T1V2)/V1= 280×1.5=420K答:略。
4.容器中有4.4 g CO2,14 g N2,12.8g O2,总压为2.026105Pa,求各组分的分压。
解:由题意知:CO2: n= 4.4/44 = 0.1molN2: n=14/28=0.5molO2: n=12.8/32=0.4mol有道尔顿分压定律:CO2: p=2.026×104PaN2: p=1.013×104PaO2: p=8.104×104Pa答:略。
8.在291K和总压为1.013×105Pa时,2.70 dm3含饱和水蒸汽的空气,通过CaCl2干燥管,完全吸水后,干燥空气为3.21 g,求291K时水的饱和蒸汽压。
解:3.21g空气在291K,2.7L的容积中其压力为: PV=Nrt所以 P空气=3.21×291×8.31/29×0.0027=99185PaP水蒸气=P总压- P空气=101300-99185=2.12×103Pa答:略第三章原子结构4.已知M2+离子3d轨道中有5个电子,试推出:(1)M原子的核外电子排布;(2)M原子的最外层和最高能级组中电子数;(3)M元素在周期表中的位置。
答:(1)Mn 1s22s22p63s23p63d54s2(2) 最外层2个电子,最高能级组中5个电子(3) 第四周期,第VIIIB族6.据原子结构的知识,写出第17号、23号、80号元素的基态原子的电子结构式。
答:17号元素Cl,其电子结构式为1s22s22p63s23p523号元素V, 其电子结构式为1s22s22p63s23p63d34s280号元素Hg, 其电子结构式为1s22s22p63s23p63d104s24p64d104f145s25p65d106s29.列各组量子数哪些是不合理的,为什么?(1)n=2,l=1,m=0 (2)n=2,l=2,m=-1(3)n=3,l=0,m=0 (4)n=3,l=1,m=1(5)n=2,l=0,m=-1 (6)n=2,l=3,m=2答:(2)、(5)、(6)不合理10.列说法是否正确?不正确的应如何改正?a)s电子绕核运动,其轨道为一圆周,而电子是走 S形的;b)主量子数n为1时,有自旋相反的两条轨道;c)主量子数n为4时,其轨道总数为16,电子层电子最大容量为32;d)主量子数n为3时,有3s,3p,3d三条轨道。
武汉大学、吉林大学《无机化学》(第3版)(上册)章节题库-氢和稀有气体(圣才出品)

第5章氢和稀有气体一、填空题1.人们将氢化物分为______氢化物,______氢化物和______氢化物三种类型。
【答案】离子型,分子型,金属型。
2.拉姆齐和雷利在1894年从空气中第一次分离出的稀有气体是______;l962年巴特利特第一次合成出来的稀有气体化合物是______,该化合物是模仿______合成出来的。
【答案】Ar(或氩);3.用Xe和F2直接反应合成出的化合物有______、______和______。
【答案】三、完成方程式并配平1.氙的化合物与水反应。
答:2.氢化物LiH与下列化合物反应。
答:3.完成下列氟化物与水反应的方程式。
答:4.完成并配平下列反应方程式。
答:四、问答题1.举例说明氢气都有哪些重要的化学性质。
答:氢气的化学性质主要有以下几种:(1)与活泼金属在加热条件下反应,生成离子型氢化物。
(2)与非金属元素形成分子型氢化物。
H2与氧化能力强的F2在低温下即可剧烈反应。
存光照或引燃的条件下,H2与Cl2和O2等反应。
H2是合成氨的重要原料,与N2在高温、加压和催化剂存在的条件下反应。
(3)在加压条件下与过渡金属形成金属型氢化物。
(4)在高温条件下,H2作为反应的还原剂。
(5)利用H2在有机合成中进行加氢反应,在催化剂作用下合成特定的化合物。
2.氢作为能源,其优点是什么?目前开发中的困难是什么?答:氢作为能源其优点如下:(1)原料来源于地球上储量丰富的水,因而资源不受限制;(2)氢气燃烧时放出的热量很大;(3)作为燃料的最大优点是燃烧后的产物为水,不会污染环境;(4)有可能实现能量的储存,也有可能实现经济高效的输送。
发展氢能源需要解决三个方面的问题:氢气的发生,氢气的储备和氢气的利用。
3.由氙的元素电势图计算的值。
答:酸性溶液中氙的元素电势图为说明H4XeO4具有很强的氧化性。
4.为什么XeOF4不能用玻璃容器储存?并指出应该用什么容器储存?答:XeOF4会与SiO2发生如下反应:可用镍容器(因氟与镍反应生成致密的保护膜)和某些塑料容器(如聚四氟乙烯)。
2024年新九年级化学上册讲练(人教版)第11讲 物质组成的表示(化学式与化合价)(原卷版)

化学式与化合价一、化学式与化学用语1.用表示纯净物组成的式子叫做化学式。
2.化学式的书写物质类别书写方法举例单质金属直接用元素符号来表示(I 2除外)铁:稀有气体氖气:固体非金属碳:气态非金属(稀有气体除外)在元素符号的右下角写上原子个数氢气:臭氧:化合物正左负右硫酸铝:3.化学式表示的意义(由分子构成的物质)分类意义以H 2O 为例宏观表示一种物质水表示物质的组成元素水是由氢、氧两种元素组成的微观表示1个分子1个水分子表示分子的构成1个水分子是由2个氢原子和1个氧原子构成的二、化学式中数字的含义1.写在元素符号或化学式前面的数字,表示原子或分子个数。
如:2S 表示2个硫原子,2H 2O 表示2个水分子,只表示微观意义,不表示宏观意义。
2.写在化学式中元素符号右下角的数字,表示1个分子中所含该元素的原子个数。
如:H 2O 中“2”表示1个水分子中有2个氢原子。
三、化合价1.意义:化合价是元素的一种性质,它用来表示原子之间相互化合的数目。
2.数值:由1个原子或形成的对决定的。
3.表示方法:在元素符号或原子团的,先写,再写,数值是1时,。
4.常见元素化合价:K 、、Ag 、是+1价;Ca 、、Ba 、、Hg 是+2价;是+3;是-2价,是+2或+3,Cl 是-1最常见,单质价永不变。
5.规律(1)单质中元素化合价为;(2)在化合物中,各元素正负化合价的代数和为。
(3)在同一物质中,同种元素化合价可以,如:NH 4NO 3(4)同一元素在不同化合物中可以显示化合价。
(5)金属元素与非金属元素形成的化合物,化合价为正,化合价为负。
如:NaCl 非金属元素组成的化合物正价元素在前,负价元素在后。
6.化合价的计算考点1:化学式与意义【例1】(2024·陕西宝鸡·三模)含义丰富的化学符号是独特的化学语言,根据下列符号回答:原子团SO 4NO 3OHNH 4名称硫酸根碳酸根硝酸根铵根化合价-2价-2价-1价-1价+1价离子符号CO 32-OH -NO-⑤N2①2CH4②Al3+③2H④3(1)具有宏观含义的是(填序号)。
13、无机化学万题库(填空题)(10-15)

(十)氢稀有气体1.第一个稀有气体化合物的化学式是。
**2.稀有气体有许多重要用途,如可用于配制供潜水员呼吸的人造空气,可以用于填充霓虹灯,由于热传导系数小和惰性,用于填充电灯泡。
**3.研究较多的稀有气体化合物是XeF2、XeF4和XeF6 ,它们的分子的空间构型分别是、、。
***4.依次写出下列氢化物的名称,指出它属于哪一类氢化物?室温下呈何状态?BaH2,,;AsH3,,;PdH0.9 ,,。
**5.野外制氢使用的材料主要是和,它的化学反应方程式为。
**6.地壳中丰度最大的元素是,太阳大气中丰度最大的元素是。
在所有气体中,密度最小的是,扩散速度最快的是,最难液化的是。
**7.由于离解能很大,所以氢在常温下化学性质不活泼。
但在高温下,氢显示出很大的化学活性,可以形成三种类型的氢化物,它们是、、。
**8.氢可以与其他元素形成氧化数为的化合物,能与氢直接化合形成离子型氢化物的元素有,不能与氢形成氢化物的元素是分子间可以形成氢键的共价型氢化物有。
***9.在稀有气体中,最外层电子构型与其他稀有气体不同的元素是;在空气中,含量最高的稀有气体是;在已合成的稀有气体化合物中,以的化合物最多;第一个合成出的稀有气体化合物是。
***10.氢由于原子结构和性质的特点,导致在元素周期表中的位置有不同观点,较流行的是放在,也有放在或。
***11.稀有气体中具有放射性的是,在电场激发下能发出强烈白光可用作光源的是,在冶炼、焊接中可用作保护性气体的是。
***12.第一个从空气中分离出的稀有气体是,第一个合成的稀有气体化合物是,稀有气体中是唯一没有三相点的物质。
13.由臭氧在碱性介质中氧化三氧化氙制高氙酸盐的反应方程式为。
***14.XeF4水解反应式为。
****15.符合下列要求的稀有气体是:温度最低的液体冷冻剂;电离能最低,安全的放电光源;可作焊接的保护性气体的是。
**(十一)卤素1.漂白粉的有效成分是,漂白粉在空气中放置时会逐渐失效,其反应方程式为。
氢和稀有气体

制作氢气 20 升,纯度为 99.9%。
● 生物分解水制氢
生物体分解水不需要电和高温,科学家们试图
修改光合作用旳过程来完毕这一技术。小规模旳试
验已成功。
可
见
● 从海水中制氢 光
Fe(Ⅱ ),Fe(Ⅲ) 电解质溶液
硒镍 化 镉 半 导 体箔
H2(g)
海水
原理:当可见光照射在半导体膜上时,电子被激
发进入导带而留下空穴(低能级旳电子空间)。在导带中 电子移动到金属薄膜与海水之间表面上,水即被还原产 生H2。同步,空穴迁移到半导体与电解质间旳表面,来 自Fe2+旳电子填充空穴。(美国Michigan州立大学H. Ti
RbH(s) SrH2(s) –30.0 –141.0
SnH4(g) +188.3
SbH3(g) +147.8
H2Te (g) >0
HI (g) +1.7
CsH(s) BaH2(s) –32.0 –140.0
量As
SO2 锌还原 H2SO4 产生
H2S + Pb2+ + 2H2O →PbS + 2H3O+ AsH3+3Ag2SO4+3H2O→
6Ag+H3AsO3+3H2SO4
SO2 + 2KOH → K2SO3 + H2O
工业制造措施
industrial preparation methods
水蒸气转化法 CH4(g) + H2O(g) 1 273 K 3 H2(g) + CO(g)
大气层顶 云层顶 液氢 液态金属氢
岩石关键
2. 制备 (每年估计达500×109m3)
氢和稀有气体

7.为什么合成金属氢化物时总是要用干法?38Kg的 氢化铝与水作用可以产生多少dm3的氢气? 答:因为金属氢化物极易与水反应,即使是很微量的 水分也可能发生反应:
AlH + 3 H 2 O → Al (OH
3
)3
↓ +3H
2
↑
38Kg的氢化铝与水作用可以产生的氢气为:
38 V = × 3 × 22 . 4 = 9 . 14 × 10 30
14.完成并配平下列反应方程式。 − 2 XeF4 + 2ClO3− + 4H 2O → 2ClO4 + 2 Xe + O2 + 4HF (1) (2)XeF 4 + Xe → 2 XeF 2 5 (3) Na 4 XeO 6 + 2 MnSO 4 + 7 H 2 SO 4 → 5 XeO 3 + 2 NaMnO 4 + 9 Na 2 SO 4 + 7 H 2 O 6 (4) XeF6 + 12 H 2O → 4 Xe + 2 XeO3 + 3O2 + 24 HF
5.那种稀有气体可用作制冷剂?那种稀有气体离子势 低,可作放电光源需要的安全气?那种稀有气体最 便宜? 答:它们的依次顺序为He(氦),Ar(氩),Ne(氖)
6.和为盐型氢化物?什么元素能形成盐型氢化物?怎 样证明盐型氢化物内存在H–负离子? 答:离子型氢化物为盐型氢化物。 电负性小的第一、 第二主族的元素与氢能形成 盐型氢化物。 电解熔融态的盐型氢化物,在阳极上有氢气产生, 这可证明盐型氢化物内存在H–负离子。
2 (5) XeO3 + 2Ba(OH )2 → Ba2 XeO6 + Xe + O2 ↑ +2H 2O 2 (6) XeF 6 + SiO 2 → 2 XeOF 4 + SiF 4
氢和稀有气体 习题及答案

第十八章 氢和稀有气体一 选择题1.稀有气体不易液化是因为( )A.它们的原子半径大B.它们不是偶极分子C.它们仅仅存在较小的色散力而使之凝聚D.它们价电子层已充满 2.用VSEPR 理论判断,中心原子价电子层中的电子对数为3的是( )A .PF 3 B.NH 3 C.-34PO D.-3NO 3.用价电子对互斥理论判断,中心原子周围的电子对数为3的是( )(吴成鉴《无机化学学习指导》)A.SCl 2B.SO 3 C .XeF 4 D. PF 54.用价电子对互斥理论判断,中心原子价电子层中的电子对数为6的是( ) A.SO 2 B. SF 6 C.-34AsO D. BF 35. XeF 2的空间构型是( )A.三角双锥B.角形C. T 形D.直线型 6.下列稀有气体的沸点最高的是( ) (吴成鉴《无机化学学习指导》) A.氪 B.氡 C.氦 D.氙7.能与氢形成离子型氢化物的是( ) (吴成鉴《无机化学学习指导》) A.活泼的非金属 B.大多数元素 C.不活泼金属 D.碱金属与碱土金属 8.稀有气体原名惰性气体,这是因为( ) A.它们完全不与其它单质或化合物发生化学反应B.它们的原子结构很稳定,电离势很大,电子亲合势很小,不易发生化学反应C.它们的价电子已全部成对D.它们的原子半径大9.下列各对元素中,化学性质最相似的是 ( ) (吉林大学《无机化学例题与习题》)A.Be 与MgB.Mg 与Al C Li 与Be D.Be 与Al10.下列元素中,第一电离能最小的是 ( ) (吉林大学《无机化学例题与习题》) A.Li B.Be C. Na D.Mg11.下列化合物中,在水中的溶解度最小的是()(吉林大学《无机化学例题与习题》)A.NaFB.KFC.CaF2D.BaF212.下列氢化物中,最稳定的是()(吉林大学《无机化学例题与习题》)A.LiHB.NaHC.KHD.RbH13.下列化合物中,键能最大的是()(吉林大学《无机化学例题与习题》)A.HBrB.NH3C.H2D.KH14.合成出来的第一个稀有气体化合物是()(吉林大学《无机化学例题与习题》)A.XeF2B.XeF4C.XeF6D.Xe[PtF6]15.下列化合物中,具有顺磁性的是()(吉林大学《无机化学例题与习题》)A.Na2O2B.SrOC.KO2D.BaO216.下列叙述中错误的是() (大连理工大学《无机化学习题详解》)A.氢原子可获得一个电子形成含H-的离子型化合物。
氢和稀有气体-习题及答案

第十八章 氢和稀有气体一 选择题1.稀有气体不易液化是因为( )A.它们的原子半径大B.它们不是偶极分子C.它们仅仅存在较小的色散力而使之凝聚D.它们价电子层已充满 2.用VSEPR 理论判断,中心原子价电子层中的电子对数为3的是( )A .PF 3 B.NH 3 C.-34PO D.-3NO3.用价电子对互斥理论判断,中心原子周围的电子对数为3的是( )(吴成鉴《无机化学学习指导》)A.SCl 2B.SO 3 C .XeF 4 D. PF 54.用价电子对互斥理论判断,中心原子价电子层中的电子对数为6的是( )A.SO 2B. SF 6C.-34AsOD. BF 35. XeF 2的空间构型是( )A.三角双锥B.角形C. T 形D.直线型 6.下列稀有气体的沸点最高的是( ) (吴成鉴《无机化学学习指导》) A.氪 B.氡 C.氦 D.氙7.能与氢形成离子型氢化物的是( ) (吴成鉴《无机化学学习指导》) A.活泼的非金属 B.大多数元素 C.不活泼金属 D.碱金属与碱土金属 8.稀有气体原名惰性气体,这是因为( ) A.它们完全不与其它单质或化合物发生化学反应B.它们的原子结构很稳定,电离势很大,电子亲合势很小,不易发生化学反应C.它们的价电子已全部成对D.它们的原子半径大9.下列各对元素中,化学性质最相似的是 ( ) (吉林大学《无机化学例题与习题》)A.Be 与MgB.Mg 与Al C Li 与Be D.Be 与Al10.下列元素中,第一电离能最小的是 ( ) (吉林大学《无机化学例题与习题》) A.Li B.Be C. Na D.Mg11.下列化合物中,在水中的溶解度最小的是()(吉林大学《无机化学例题与习题》)A.NaFB.KFC.CaF2D.BaF212.下列氢化物中,最稳定的是()(吉林大学《无机化学例题与习题》)A.LiHB.NaHC.KHD.RbH13.下列化合物中,键能最大的是()(吉林大学《无机化学例题与习题》)A.HBrB.NH3C.H2D.KH14.合成出来的第一个稀有气体化合物是()(吉林大学《无机化学例题与习题》)A.XeF2B.XeF4C.XeF6D.Xe[PtF6]15.下列化合物中,具有顺磁性的是()(吉林大学《无机化学例题与习题》)A.Na2O2B.SrOC.KO2D.BaO216.下列叙述中错误的是() (大连理工大学《无机化学习题详解》)A.氢原子可获得一个电子形成含H-的离子型化合物。
无机化学练习题(下)资料

第十章氢稀有气体1.用于配制潜水用的人造空气的稀有气体是()A、ArB、XeC、NeD、He2.用锌与稀硫酸反应制备的氢气中含有较多的杂质,需要通过一系列试剂溶液清洗而净化。
下列试剂中,不属于净化氢气所需要的是()A、硝酸铅溶液B、酸性高锰酸钾溶液C、氢氧化钾溶液D、氯化钴溶液E、浓硫酸3.在下述氙酸盐中,热稳定性最大的是()A、RbXeF7B、K2XeF8C、Na2XeF8D、Cs2XeF84.在空气中含量最高(以体积百分数计)的稀有气体是()A、HeB、NeC、ArD、Xe5.第一个制得的稀有气体化合物是()A、XeRuF6B、XeRhF6C、XePtF6D、XeF66.CrH2属于哪种类型的氢化物?()A、离子型B、共价型C、金属型D、都不是7.当氢原子核俘获中子时,它们形成()A、α粒子B、氘C、β射线D、正电子8.下列合金材料中可用作储氢材料的是()A、LaNi5B、Cu-Zn-AlC、TiCD、Fe3C9.符合下列要求的稀有气体是:温度最低的液体冷冻剂;电离能最低,安全的放电光源;可作焊接的保护性气体的是。
10.第一个从空气中分离出的稀有气体是,第一个合成的稀有气体化合物是,稀有气体中是唯一没有三相点的物质。
11.稀有气体中具有放射性的是,在电场激发下能发出强烈白光可用作光源的是,在冶炼、焊接中可用作保护性气体的是。
12.氢由于原子结构和性质的特点,导致在元素周期表中的位置有不同观点,较流行的是放在,也有放在或。
13.试判断下列Xe 的化合物分子或离子的空间几何构型,并指出Xe 原子的杂化轨道类型:XeF2XeF4 XeOF4 XeO3XeO4 XeO64-第十一章卤素1.卤素单质中,与水不发生歧化反应的是()A、氟B、氯C、溴D、碘2.下列叙述中错误的是()A、高氯酸的酸酐是Cl2O7B、OF2和Cl2O空间构型均为V形,后者的键角较大C、沸点最低的物质是H2D、扩散速度最快的气体是氢气3.漂白粉在潮湿空气中因发生如下反应而失效:ClO-+H2CO3 =HClO +HCO3-已知Ka H2CO3=4.30×10-7,Ka HClO=2.95×10-8,则上述反应的KΘ为()A、1.45B、5.41C、14.5D、1454.氢卤酸酸性强弱的顺序是()A、随着卤素原子序数的增大,酸性增强B、随着卤素原子序数的增大,酸性减弱C、除氢氯酸为强酸外,其余皆为弱酸D、氢溴酸酸性最强,其余酸从上至下酸性递减5.卤素单质分子的离解能大小顺序为()A、F2> Cl2> Br2> I2B、Cl2> F2> Br2> I2C、Cl2> Br2> F2> I2D、Cl2> Br2> I2 > F26.反应不能按下列式子正向进行而实现的是()A、NaCl +H2SO4 (浓) =NaHSO4+HClB、NaNO3+H2SO4=NaHSO4+HNO3C、NaI +H2SO4 (浓) =NaHSO4+HID、Na2CO3+H2SO4=NaHSO4+CO2+H2O7.下列相同浓度含氧酸盐水溶液的pH值大小排列次序正确的是()A、KClO > KBrO > KIOB、KIO > KBrO > KClOC、KBrO >KClO > KIOD、KIO > KClO > KBrO8.氯的含氧酸热稳定性顺序正确的是()A、HClO4> HClO3> HClO2>HClOB、HClO>HClO2>HClO3>HClO4C、ClO>HClO3>HClO2>HClO4D、HClO3>HClO2>HClO4> HClO9.向酸性KI溶液中滴加过量的H2O2,有灰黑色沉淀生成,下列试剂中不能使该沉淀消失的是()A、氢氧化钠溶液B、碘化钾溶液C、稀硝酸D、次氯酸钠溶液10.废弃的CN-溶液不能倒入()A、含Fe3+的废液中B、含Fe2+的废液中C、含Cu2+的酸性废液中D、含Cu2+的碱性废液中11.下列各对物质中,能起反应的是()A、FeSO4与I2B、Ag 与HClC、HIO3与Br2D、HI 与Ag12.下列物质在酸性溶液中,能将Mn2+氧化为MnO的是()4A、Cl2B、HClO3C、H5IO6D、H2O213.下列含氧酸的氧化性递变不正确的是()A、HClO4>H2SO4>H3PO4B、HBrO4> HClO4>H5IO6C、HClO> HClO3> HClO4D、HBrO3> HClO3>HIO314.室温下,下列反应式中产物正确的是()A、F2+2 OH-=F-+FO-+H2OB、Cl2+2 OH-=Cl-+ClO-+H2OC、Br2+2 OH-=Br-+BrO-+H2OD、I2+2 OH-=I-+IO-+H2O15.固体KClO3是强剂,但KClO3溶液与KI 溶液,加稀硫酸酸化后,并使KI 溶液过量,则反应的主要产物是,若KI 溶液不足量,则反应的主要产物是。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第11章氢和稀有气体习题
1.选择题
11-1根据价层电子对互斥理论,判断RnF4的空间结构式为………………( )
(A) 正八面体(B) 正四面体(C) 平面正方形(D) 变形四面体
11-2 稀有气体氙能与下列哪种元素形成化合物……………………………( )
(A) F (B) K (C) Na (D) Br
11-3氙的氟化物是很好的氧化剂,其原因是………………………………( )
(A) 氧化性强 (B) 还原到氙 (C) 不污染反应体系 (D) 前三者都是
11-4下列氢化物中,在室温下与水反应不产生氢气的是……………………( )
(A) LiAlH4(B) CaH2(C) SiH4(D) NH3
11-5在周期表中氡(Rn,原子序数86)下面的另一个未发现的稀有气体元素的原子序数应是………………………………………………………………………( )
(A) 109 (B) 118 (C) 173 (D) 222
11-6在化合物O2[PtF6]中,氧成键属于类型…………………………………( )
(A) O2 (B) +
O (C) -22O(D) -2O
2
2.填空题
11-7稀有气体的第一个化合物_____________,是由______ 于_________年制备的。
11-8根据价层电子对互斥理论,XeF2分子中,中心原子的价电子对构型为,XeF2分子稳定构型为_____________ 。
11-9稀有气体能被液化,是由于_____________。
最难被液化的稀有气体是_____________。
11-10XeO3是一种易潮解和易爆炸的固体化合物,其水溶液是一种极强的______,XeO3的水溶液能迅速地将氨氧化成______。
11-11由三氧化氙制高氙酸钠的反应方程式是__________________________。
3.简答题
11-12通常说“氢和氧可以化合成水”,即发生下面反应:
1
2H2(g) + O2(g) →1
2H2O(g) m
r
ΔH(H2O, g) = -241.8 kJ · mol-1
但在常温时却看不到反应发生,并且在温度达到4000 K高温时,将有70 %的水分解为H2和O2。
试解释之。
4.计算题
11-13某气态氟化氙在298 K,1.55 kPa时密度为1.535 × 10-4g · cm-3,试确定其分子式(F的相对原子质量为18.998;X e的相对原子质量为131.293)。
11-14已知XeF 4(g)的标准生成热为-215.476kJ ·mol-1,求XeF 4的平均键能(F–F 的键能为155 kJ ·mol-1)。
