中国药典-2019年版仪器分析方法应对
药典分析方法确认与验证

药典分析方法确认与验证分析方法的验证和确认主要内容:分析方法的验证分析方法的确认分析方法的转移方法验证、方法确认和方法转移的文件管理【背景介绍】只有经过验证或确认的分析方法,才可以用于物料和产品的检验以及清洁验证。
检验方法必须经过验证或确认是物料和产品放行的前提之一。
因为只有经过验证或确认的分析方法才可以可靠有效地用于控制药品的内在质量。
分析方法: 分析方法是为完成检验项目而设定和建立的测试方法,它详细描述了完成分析检验的每一步骤。
一般包括分析方法原理、仪器及仪器参数、试剂、供试品溶液与对照品溶液等的制备、测定、计算公式及限度要求等。
不同分析方法各有特点,同一分析方法可用于不同的检验项目,但验证内容会有不同。
例如,采用高效液相色谱法进行药品的鉴别和杂质定量检验,两检验项目在方法验证时要求不同。
前者重点要求验证专属性,而后者则需要重点验证专属性、准确度和定量限。
【适用范围】适用于:化学药品(包括物料和产品)的理化分析方法和仪器分析方法的验证与确认。
清洁验证方法的验证。
生物制品分析方法验证。
不适用于: 化学药品的微生物方法,【方法验证】方法验证就是根据检验项目的要求,预先设置一定的验证内容和验证标准要求,并通过设计合理的实验来验证所采用的分析方法是否符合检验项目的要求。
建立质量标准时,应对分析方法中的各检验项目进行完整的验证。
当药品生产工艺变更、制剂的组分变更、原分析方法修订时,可根据变更的内容决定对分析方法进行部分验证还是完整的验证。
当原料药合成工艺发生变更时,可能引入新的杂质,杂质检查方法和含量测定方法的专属性就需要进行验证,以证明有关物质检查方法能够检测新引入的杂质,且新引入的杂质对主成分的含量测定应无干扰。
当质量标准中某一项目分析方法发生部分改变时,如采用高效液相色谱法测定含量时,检测波长发生改变,则需要重新进行检测限、定量限、专属性、准确认、精密度、线性等内容的验证,证明修订后的分析方法的合理可行。
《中国药典》2020年版第四部通用技术要求主要特点和增修订内容

《中国药典》2020年版第四部通⽤技术要求主要特点和增修订内容主要特点和增修订内容2.1制剂通则论述框架和技术要求进⼀步完善2.1.1系统修订制剂通则整体框架0100制剂通则旨在通过对药物制剂的总体论述来指导医药⼯作者对不同剂型、亚剂型进⾏合理的应⽤。
《中国药典》2015年版制剂通则是《中国药典》2010年版中药、化学药和⽣物制品制剂通则的简单整合,缺少关键考察项的汇总和归纳。
为进⼀步引导⽣产企业全⾯关注制剂⽣产质量控制和整体要求,对0100制剂通则进⾏修订,主要修改包括两个⽅⾯:⾸先完善了叙述结构。
从药物制剂制备的原则“安全、有效、可控、依从性”的⾓度出发,增加对剂量单位均匀性、稳定性、安全性与有效性、剂型与给药途径、包装与贮藏和标签与说明书等部分的分论述;强调中药制剂在整个⽣产过程中的关键质量属性,关注每个关键环节的量值传递规律。
其次,完善了具体内容。
提出剂量单位均匀性的要求,保障制剂⽣产质量的批间和批内药物含量等的⼀致性,体现制剂全过程控制的理念;在稳定性中提出复检期概念,促进⽣产企业根据产品⾃⾝的稳定性特性进⾏前瞻性的质量考察;在安全性与有效性中提出“通过⼈体临床试验证明药物的安全有效性后,药物才能最终获得上市与临床应⽤”,提⽰上市制剂的处⽅和⼯艺不得随意变更。
2.1.2系统修订各制剂通则的框架和表述《中国药典》2020年版制剂通则统⼀了各剂型论述框架及主要制备技术的简单论述。
除0110糊剂及0186膏剂外,其他36个剂型均不同程度修订了体例格式。
为进⼀步统⼀⽬前各剂型的表述问题,规范统⼀“⽣产与贮藏期间应符合下列规定”项下内容,按照原辅料→⼯艺与技术→质量与控制→包装与使⽤→贮存与运输等五⽅⾯的技术要点,着重补充⼤多数剂型缺少的⼯艺与技术⽅⾯的阐述。
增加特殊亚剂型临床使⽤关注点,如泡腾⽚不得直接吞服等,指导临床合理⽤药。
2.1.3收载和整合临床成熟剂型和亚剂型收载和整合临床成熟剂型和亚剂型,体现《中国药典》的先进性和对我国临床成熟新制剂技术的⽀持。
《中国药典》版附录-精选文档33页

四、主要增订项目内容
拉曼光谱法指导原则
1、与红外光谱一样,同为分子的振动光谱
∞
IR
与偶极矩变化相关│Mnm│= ∫ΨnΡΨmdτ
-∞
a Raman 与极化率变化相关│( ij)nm│=
∞
∫Ψnaij Ψmdτ
2、两者选一律 互为补充
-∞
3、拉曼光谱测定快速、准确,样品制备简单甚至无需制备
4、拉曼光谱通常处于可见与近红外区
V0=V+(a/a + b )△V=34.30+[1100/(1100+3600)] ×0.10=34.32ml
五、主要修订项目内容
不溶性微粒检查法
1、应用对象 由溶液型静脉注射液扩大至溶液型静脉注射
液,注射用无菌粉末、注射用浓溶液及注射用无菌原料
药
2、统一了操作方法
(1)取样体积 大于5ml取5ml
五、主要修订项目内容
3、多组份原料药的鉴别 可借鉴制剂鉴别的 方法
4、混晶中无效或低效晶型的限度控制 采用基线密度法计算指定谱带的吸光度后 再计算各晶型的相对含量(甲苯咪唑和棕 榈氯霉素)
五、主要修订项目内容
高效液相色谱法 1、色谱柱 (1)常用色谱柱填料粒径3~10μm (2)微径柱填料粒径 约2μm(UPLC或UFLC) 硬件须匹配 色谱条件可适当调整 以品种正文规定条件的测定结果为准 2、柱温 (1)通常为室温 (2)以硅胶为载体的普通色谱柱,最高使用温度不得超过 60℃,(HTLC)
采用线性内插法
V0=V+
a
a +b
△V
式中 V0:终点时的滴定液体积
a:二级微商为零前的二级微商值
b:二级微商为零后的二级微商值
浅谈仪器分析在制药工程中的应用

浅谈仪器分析在制药工程中的应用(程志全武汉科技大学中南分校)摘要:通过对严拯宇等人编著的仪器分析(第二版)的解读,以及结合相关书刊的知识,对仪器分析在制药领域中的应用,做了一个初步而较全面的认识和分析。
仪器分析是现代制药工程中一项必不可少而重要的方法和途径,通过这种科学手段,我们可以全面而系统地建立药物制剂研发、生产、治疗的质量监管体系,以保证人民用药稳定、安全和有效。
关键词:仪器分析应用制药工程质量监管引言:通过对较多文献的查阅,发现很少有专门来谈仪器分析在制药领域中应用的文献。
本文正是基于这种原因,也是在这门课程的学习中,发现仪器分析的原理和方法较多,很多同学学完之后都难以将它们比较系统的归纳起来。
于是,通过解读教材和相关书刊,写出这篇综述。
正文:作为制药工程专业人才的我们,需要具备药物分析及检测方向的专业素质,学会仪器分析药物、波谱分析、药物分析和天然药物分析与分离课程基本理论,熟悉常见药物检测的操作与方法。
同时,我们也要掌握职位工作描述与产品生产、研发、检测、营销、环境保护、管理相关的波谱分析、高级仪器分析等核心能力与技巧,精通仪器分析常见药品技术,能胜任大型药厂、大型医院、药品检测中心等相关企事业单位的检测、研发、管理的工作。
可见掌握化学分析、仪器分析基本理论对制药工程的学习是非常重要的。
现在,我和大家一起探讨一下仪器分析在制药工程中的应用,从而加深对制药工程的理解和认识。
近年来,仪器分析飞速发展,新方法、新技术、新仪器层出不穷,仪器分析的应用也日益普遍。
仪器分析逐渐向药学、医学、生物学等领域渗透,特别是在新药研究、药物分析、临床检验、病因研究等方面都大量使用了仪器分析方法,其在药学专业中的重要地位日渐突[]出1。
下面是我和大家一起探讨仪器分析在制药工程中关于药物成分的检测、分离和分析等应用。
仪器分析大致可以分为电化学分析法、光谱分析法、色谱分析法和核磁共振波谱法。
接下来,我将从这四个方面描述其应用。
分析方法确认与验证管理规程

一、目的:规范药品检验方法确认与验证的管理,证明采用的方法适合相应的检测要求及在实验室条件下的适用性,保证检验结果准确、可靠。
二、适用范围:适用于中药和化学药品(包括物料和产品)的理化分析方法和仪器分析方法的确认与验证。
不适用于中药和化学药品(包括物料和产品)微生物分析方法的确认与验证。
三、相关职责:QC班组长:QC班组长根据检验方法的来源确定开展方法确认或验证。
由其本人或者其他有经验的检验人员起草方案;负责确认或验证方案的培训;安排有经验的人员参与方法确认或验证过程实施;对确认或验证过程中出现的偏差要严格按照相关管理规程的程序执行,如需要提出变更申请;对确认或验证工作中出现的问题及时纠正并记录;总结确认或验证报告。
QC主管:负责审核检验方法确认或验证方案,并对方案的执行过程进行追踪;负责组织偏差的调查,变更的审核;负责总结报告的审核。
化验室QA:监督各项目按照已制定的方案进行;参与确认或验证过程中的偏差调查;对提出的变更进行评估,确认变更的是否成立,跟踪变更实施。
QA主管:负责审核检验方法确认或验证方案,确保其法规符合性;参与偏差的调查,变更的审核;负责总结报告的审核。
验证专员:审核检验方法确认或验证方案;审核总结报告;负责验证证书的发放;负责方法确认或验证方案、记录和报告的整理、存档。
质量管理负责人:批准检验方法确认或验证方案;批准方案实施过程中出现的偏差和变更;批准总结报告。
四、制定依据:《药品GMP指南》(质量控制实验室与物料系统)、《药品生产质量管理规范》(2010年修订)、《中国药典》(2020年版)、《化学药物质量控制分析方法验证技术指导原则》、ICH分析方法验证:正文和方法学Q2(R1 )、中国药品检验标准操作规范(2010年版)(原子吸收分光光度法)。
五、内容:1、术语1.1方法验证方法验证系指根据检验项目的要求,预先设置一定的验证内容和验证标准要求,并通过设计合理的实验来验证所采用的分析方法是否符合检验项目的要求。
药典常用定量分析方法概述

分 析 化 学
酸碱滴定(非水酸碱滴定法) 配位滴定 容量分析法 沉淀滴定 氧化还原滴定 纸色谱PC 电化学分析法 平面色谱 经典色谱 薄层色谱TLC ☆色谱分析 柱色谱法(CC) 气相色谱法(GC) 现代色谱 *高效液相色谱法(HPLC) 高效毛细管电泳法(HPCE) 紫外—可见分光光度法(UV—Vis) 红外分光光度法IR 原子吸收分光光度法(AAS) 光谱分析 原子发射分光光度法(AES) 或波谱分析 荧光分析法(Fluor) 核磁共振法(NMR) 质谱法(MS)
(三)碘量法误差的主要来源
1.碘的挥发 预防: 1)过量加入KI——助溶,防止挥发 增大浓度,提高速度 2)溶液温度勿高 3)碘量瓶中进行反应(磨口塞,封水) 4)滴定中勿过分振摇 2.碘离子的氧化(酸性条件下) 预防: 1)控制溶液酸度(勿高) 2)避免光照(暗处放置) 3)I2完全析出后立即滴定 4)除去催化性杂质(NO3-,NO,Cu2+)
注:无须知道CI2
置换碘量法测定CuSO4的含量
2Cu2+ + 4I- (过量) 2CuI ↓ + I2 I2 + 2S2O322I- + S4O62-
CuSO4 %
(C Na2 S 2O3 VNa2 S 2O3 ) M CuSO4 S 1000
100 %
注: • CuI易水解,故以HAc为介质 • CuI强烈吸附I2造成终点提前,滴定时应用力振摇 或加入KSCN转化CuI沉淀为CuSCN,同时释放 I2
实质:电子的转移 特点: 1)机理复杂、多步反应 2)有的程度虽高但速度缓慢 3)有的伴有副反应而无明确计量关系 分类: 碘量法、高锰酸钾法、重铬酸钾法、 亚硝酸钠法、溴量法、铈量法 应用:广泛,直接或间接测定无机物、有机物
现代分析仪器在药品检验中的应用

现代分析仪器在药品检验中的应用【摘要】2018年1月30日国家药典委员会发布了《中国药典》2020年版编制大纲,大纲以建立“最严谨的标准”为指导,鼓励药品质量控制技术创新、检测方法创新、生产工艺创新,推进先进检测技术在药品质量控制中得到转化和应用,《中国药典》2020年版也于2020年12月30日正式实施。
一些新方法、新技术被应用到药品检验中,受到了广大药学工作者的关注。
在此背景下,本文主要以《中国药典》2010年版以来收载的现代分析仪器为基础,结合文献报道的一些代表性现代分析仪器,综述在药品检验中新方法应用以及研究热点趋势,旨在为有关研究工作者提供参考。
【关键词】现代分析仪器;药品检验;应用随着现代分析仪器的迅猛发展,一些新技术、新方法被《中国药典》收载,特别是光谱、色谱、质谱以及色谱-质谱联用等技术的不断发展,在药品检验中的应用越来越广泛,涉及含量测定、有关物质、杂质检查等多个检验项目。
新技术的普遍应用大大促进了药品质量控制技术的提高,使我国药品检验水平与国际接轨。
本文根据《中国药典》2010年版颁布以来近10年的文献,探讨现代分析仪器及其技术在药品检验中的应用和药品安全的发展方向。
1光谱分析技术光谱分析法按不同的分类可分为发射光谱法、吸收光谱法、散射光谱法,或分为原子光谱法和分子光谱法。
原子光谱常见的有原子吸收分光光度法(AAS)、原子荧光光度法(AFS)、电感耦合等离子体原子发射光谱法(ICPAES);分子光谱又可分为分子吸收光谱和分子发光光谱,分子吸收光谱主要有紫外-可见分光光度法(UV-VIS)、红外光谱法(IR),分子发光光谱主要有荧光分光光度法、火焰光度法。
1.1原子吸收分光光度法(AAS)AAS在药品质量控制中主要用于金属元素的含量测定。
在《中国药典》中主要用于中药材的铅、镉、砷、汞、铜以及空心胶囊中铬的测定。
随着技术的不断改进与提高,AAS目前已能测定70多种金属及类金属元素,因其具备灵敏度高、选择性好、操作简便快速等优点,已成为药品检验的重要工具之一。
中国药典2020年版 9101 分析方法验证指导原则
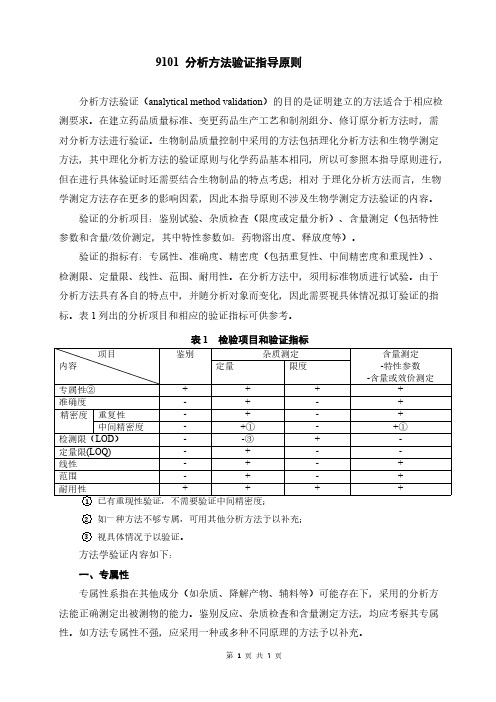
9101分析方法验证指导原则分析方法验证(analytical method validation)的目的是证明建立的方法适合于相应检测要求。
在建立药品质量标准、变更药品生产工艺和制剂组分、修订原分析方法时,需对分析方法进行验证。
生物制品质量控制中采用的方法包括理化分析方法和生物学测定方法,其中理化分析方法的验证原则与化学药品基本相同,所以可参照本指导原则进行,但在进行具体验证时还需要结合生物制品的特点考虑;相对于理化分析方法而言,生物学测定方法存在更多的影响因素,因此本指导原则不涉及生物学测定方法验证的内容。
验证的分析项目:鉴别试验、杂质检查(限度或定量分析)、含量测定(包括特性参数和含量/效价测定,其中特性参数如:药物溶出度、释放度等)。
验证的指标有:专属性、准确度、精密度(包括重复性、中间精密度和重现性)、检测限、定量限、线性、范围、耐用性。
在分析方法中,须用标准物质进行试验。
由于分析方法具有各自的特点中,并随分析对象而变化,因此需要视具体情况拟订验证的指标。
表1列出的分析项目和相应的验证指标可供参考。
表1检验项目和验证指标项目内容鉴别杂质测定含量测定-特性参数-含量或效价测定定量限度专属性②++++准确度-+-+精密度重复性-+-+中间精密度-+①-+①检测限(LOD)--③+-定量限(LOQ)-+--线性-+-+范围-+-+耐用性++++ 1已有重现性验证,不需要验证中间精密度;2如一种方法不够专属,可用其他分析方法予以补充;3视具体情况予以验证。
方法学验证内容如下:一、专属性专属性系指在其他成分(如杂质、降解产物、辅料等)可能存在下,采用的分析方法能正确测定出被测物的能力。
鉴别反应、杂质检査和含量测定方法,均应考察其专属性。
如方法专属性不强,应采用一种或多种不同原理的方法予以补充。
1.鉴别反应应能区分可能共存的物质或结构相似的化合物。
不含被测成分的供试品,以及结构相似或组分中的有关化合物,应均呈阴性反应。
常用药品检验仪器介绍-

工作环境要求
-仪器的接地、电源电压、特殊环境要求、专用通风 排气设施、防尘、温度湿度恒定、避免阳光直射、防 震动、防腐蚀等
定期校准及专人管理
-《中华人民共和国计量法》及相关SOP -操作人员的培训及仪器工作状态的确认 -专业管理人员,建立仪器档案及使用登记制度
二、常用药物检验仪器I
药物稳定性、长期试验及加速试验指导原则
-《中国药典》、ICH(国际协条会)、USP(美国药典)
恒温恒湿箱
— 以科学的方法创造一个对药品失效评测所需长时间稳 定的温度、湿度环境和光照环境适用于制药企业对药品及 新药的加速测验、长期试验、高湿试验和强光照射试验, 是制药企业进行药品稳定性试验最佳选择方案。
制剂通则
通用检测方法 仪器分析手段
一般鉴别试验 一般杂质检查方法 有关物理常数测定 试剂配制法等
仪器分析技术
-以目标物质的物理、物理化学性质为基础
光
色
质
电
热
谱
谱
谱
化
分
分
分
分
学
析
析
析
析
分
法
法
法
法
析
法
常用药物检验仪器
-基于药典二
性
状
分
析
药
现
物
代
及
仪
制
器
剂
分
性
析
质
二、常用药物检验仪器
(3)溶出量测定方法的验证
(4)溶出度均一性试验(批内)、重现性试验(批间)。
溶出度试验仪
溶出度试验方法可能存在的问题
- 溶出仪的差异 - 溶出度含量测定方法的验证(UV、HPLC)
5-分析方法的验证

专属性
鉴别试验-----含被测成分的供试品呈正反 应, 而不含被测成分的供试品以及结构 相似或组分中的有关化合物,应均呈负 反应。
专属性(杂质和含量测定 )
方法1:在杂质可获得的情况下,可向试样中 加入一定量的杂质,考察杂质与共存物质能得 到分离和检出(考察测定结果是否受干扰 ) 方法2:在杂质或降解产物不能获得的情况下, 专属性可通过测定含有杂质或降解产物的试样, 与另一个已验证的方法或药典方法比较结果。 或对试样用强光照射,高温,高湿,酸(碱) 水解或氧化的方法进行加速破坏,以研究可能 的降解产物和降解途径,并比对破坏前后检出 的杂质度 原料药含量测定
方法1:用已知纯度的对照品或供试品进行测 定。 方法2:用本法所得结果与已知准确度的另一 2 方法测定的结果进行比较 如:测定含量的准确度, 按标示量的80%, 100%和120%配制三个浓度的溶液,每个浓度 各分别制备3份供试品溶液,进行测定。根据 测定结果与配制浓度计算出平均回收率以及相 对标准偏差。
分析方法验证流程
分析方法验证流程.doc
验证文件
验证方案内容 方法验证的执行 验证报告的起草与批准 验证文件的保存
验证方案内容
唯一的方案号. 分析方法的版本号以及物料/产品的名称: 验证的实验项目 验证的原则和目的 验证的参数以及接受标准 验证实验中所用标准品,检验样品信息 分析仪器的相关信息 所用仪器的信息,如已确认的情况下 方案起草者,复核人和批准者需签字确认
中间精密度:在同一个实验室,不同时 间由不同分析人员用不同设备测定结果 之间的精密度。 验证方法:同一批样品每位分析员准备 六份进行测量,计算两人之间平均值的 差异
精密度验证方法
重现性:在不同实验室之间由不同分析人 员测定结果之间的精密度。 一般实验室不进行此项考察。只有当分 析方法将被法定标准采用时,才进行重 现性试验。
中国药典-2019年版仪器分析方法应对精品文档

甲氨蝶呤
甲氨蝶呤片
牛血清白蛋白键合硅胶柱
注射用甲氨蝶呤
12
色谱法的应用:高效液相色谱
2019版药典主要修订项目
1、色谱柱 (1)常用色谱柱填料粒径3~10μm (2)微径柱填料粒径 约2μm(UPLC或UFLC) 硬件须匹配 色谱条件可适当调整 以品种正文规定条件的测定结果为准
2、柱温 (1)通常为室温 (2)以硅胶为载体的普通色谱柱,最高使用温度不得超过60℃,(HTLC)
注射用头孢替唑钠
头孢噻吩钠 注射用头孢噻吩钠 头孢噻肟钠 注射用头孢噻肟钠 阿洛西林钠 注射用阿洛西林钠 普鲁卡因青霉素 注射用普鲁卡因青霉素
阿莫西林 阿莫西林胶囊 青霉素V钾 青霉素V钾胶囊 青霉素钠
注射用青霉素钠
青霉素钾 注射用青霉素钾 苯唑西林钠 注射用苯唑西林钠 美洛西林钠 注射用美洛西林钠 磺苄西林钠 注射用磺苄西林钠
HPLC法
2019年版
530 0
142
24 4 315 165 107 216 359
2019年版
580 73
707
97 45 414 219 132 372 694
4
色谱法在2019年版药典的应用
柱色谱 纸色谱 薄层色谱 气相色谱
• 高效液相色谱 • 离子色谱
正相色谱 反相色谱 离子对色谱
63.6
6.9
6.7
83.0
7.0
6.2
84.3
7.7
6.0
81.4
5.8
4.3
15.2
4.3
4.8
14.8
5.2
4.3
14.3
6.2
6.9
81.5
8.0%
中国药典2019年版--化学鉴别

荧光反应类型 药物本身可以发射荧光 药物溶液加硫酸使其呈酸性后,在可见光下发射
荧光 药物和溴反应,在可见光下发射荧光
药物和间苯二酚反应,发射荧光显。
示例
维生素B1中的硫色素反应.维生素B1在碱性氢氧 化钠溶液中,可被铁氰化钾氧化生成硫色素,硫 色素溶于正丁醇中,显蓝色荧光。方法:取本品 5mg,加氢氧化钠试液2.5ml溶解,加铁氰化钾试 液0.5ml与正丁醇5ml,强力振摇2min,上面的醇 层显强烈的蓝色荧光,加酸使成酸性,荧光即消 失,再加碱使成碱性,荧光又重现。此反应为维 生素B1的专属反应。
方法:取本品0.2g,加水10ml溶解, 取该液5ml,加硝酸银试液0.5ml,生 成银的黑色沉淀。
如与银盐的反应:取供试品约0.1g,加碳酸钠试 液1ml与水10ml,振摇2min,滤过,滤液中逐滴 加入硝酸银试液,即产生白色沉淀,振摇,即
溶解,继续滴加过量的硝酸银试液,沉淀不溶 解。
维生素C与硝酸银的反应:维生素C分子中含 有二烯醇基结构,具有很强的还原性,可被 硝酸银氧化生成银的黑色沉淀。
常见的生物碱
(一)烟碱 又名尼古丁,属吡啶衍生物类生物 碱。
(二)莨菪碱和阿托品 莨菪碱和阿托品属莨菪烷衍生物类生物碱。 (三)吗啡和可待因 (四)麻黄碱 又叫麻黄素 (五)小檗碱 又叫黄连素 (六)长春新碱
在试验时,通常选用三种以上不同的生物碱沉淀 试剂进行试验,如均为正反应表示检液中可能有 生物碱存在。如须确证,则要进一步精制后,再 行检验,如再次均成正反应,即可肯定有生物碱 存在。如第一次试验时就对三种沉淀剂呈负反应, 即可肯定无生物碱存在。
共存物质的干扰
必要时可对干扰物质进行分离,或者选择专属性
更高的鉴别方法
其它注意事项
中国药典版生物样品定量分析方法验证指导原则草案

中国药典版生物样品定量分析方法验证指导原则草案生物样品定量分析方法验证指导原则(草案)11. 范围2准确测定生物基质(如全血、血清、血浆、尿)中的药物浓度,对于药物和3制剂研发非常重要。
这些数据可被用于支持药品的安全性和有效性,或根据毒动4学、药动学和生物等效性试验的结果做出关键性决定。
因此,必须完整地验证和5记录应用的生物分析方法,以获得可靠的结果。
6本指导原则提供生物分析方法验证的要求,也涉及非临床或临床试验样品实7际分析的基本要求,以及何时可以使用部分验证或交叉验证,来替代完整验证。
8生物样品定量分析方法验证和试验样品分析应符合本指导原则的技术要求。
9应该在相应的生物样品分析中遵守GLP原则或GCP原则。
102.生物分析方法验证112.1 分析方法的完整验证12分析方法验证的主要目的是,证明特定方法对于测定在某种生物基质中分析13物浓度的可靠性。
此外,方法验证应采用与试验样品相同的抗凝剂。
一般应对每14个物种和每种基质进行完整验证。
当难于获得相同的基质时,可以采用适当基质15替代,但要说明理由。
16一个生物分析方法的主要特征包括:选择性、定量下限、响应函数和校正范17围(标准曲线性能)、准确度、精密度、基质效应、分析物在生物基质以及溶液18中储存和处理全过程中的稳定性。
19有时可能需要测定多个分析物。
这可能涉及两种不同的药物,也可能涉及一20个母体药物及其代谢物,或一个药物的对映体或异构体。
在这些情况下,验证和21分析的原则适用于所有涉及的分析物。
22对照标准物质23在方法验证中,含有分析物对照标准物质的溶液将被加入到空白生物基质24中。
此外,色谱方法通常使用适当的内标。
25应该从可追溯的来源获得对照标准物质。
应该科学论证对照标准物质的适用26性。
分析证书应该确认对照标准物质的纯度,并提供储存条件、失效日期和批号。
27对于内标,只要能证明其适用性即可,例如显示该物质本身或其相关的任何杂质28不产生干扰。
新版中国药典对高职仪器分析实践课程的启示

当前高职仪器分析实践课程中存在 的问题提出一些见解 ,以期不断探索高职仪器分析实践课程的教学改革思路。
关键词 :中国药典 ;仪器分析课程 ;教学改革 中 图 分 类 号 :G 1 72 文 献 标 志 码 :A
d i 03 6/sn17 — 6 6 X) 0 11. 1 o:1 . 9 i . 1 94 ( . 1 . 0 9 js 6 2 04
第l O期 ( 总第 29期) 5 21 0 1年 l 0月
农 产 品 加 工 ・ 刊 学
Acde cP r dia fF r Prd csp o esn a mi ei c l am o u t rc sig o o
No 1 .0 Oc . t
文 章 编 号 : 17 — 6 6 (0 1- 1 3 0 6 19 4 2 1) 0 0 4 - 2 1
新版 中国药典对 高职 仪器分 析实践 课程的启 示
韩 晋 辉 ,翟 培
( 广东食 品药 品职业学院 ,广东 广州 50 2) 15 0 摘要 : 《 中华人 民共和国药典》 是法定 的药 物典籍 ,对 医药类专业 的教学具有重要的指导意义。随着现代仪器分析技 术的不断进 步 ,许 多先进 的分析技术被药典收录 ,并不断在实 际生产中得到应用。通过分析新版 《 中国药典》,针对
曼光谱法等 ,其收载内容 与 目前 国际药 品质量控制 的方 法 和 技 术基 本 一 致 。例 如 :化 学 原 料 药 的鉴 别 首选专属性较强 的红外光谱法 ,共收载 50项 ;在 8 化 学 药 品标 准 中首 次 采 用 了分 离 效 能 更 高 的离 子 色 谱法和毛细管 电泳法 ;在原料药 的含量测定 中,把 采 用 紫 外分 光光 度 法 、滴 定 法 或 重 量 法 的测 定 项 目 改 用精 确性 更高 的 H L P C方法 等 。 新版药典 中大量现代仪器的应用不仅对医药企 业 提 出新 的 要求 ,对 于 为 医药 行 业 输 送 后 备 力 量 的 医药 类 高 校 也 提 出更 高 的要 求 。在 现 行 的课 程 设 置 中, ( ( f 分 析》 是 最 直 接 与现 代 分 析 仪 器 相 关 的 义器 课 程 ,是运 用 现代 科 学 理 论 和 实 验 技 术 分 离 、识 别 与 测 定 物 质 的组 成 、种 类 、成 分 与 含 量 的科 学 ,其 教 学 内容 中 理论 性 、实 践 性 和 实 用 性 都 很 强 ,学 生 不 仅 要 学 习 理论 知 识 ,更 重 要 的是 要 通 过 理 论 学 习 促 进 在 实践 操 作 中 的技 能 。根 据 当前 高 职 教 育 发展 的状 况 ,仪 器 分 析 课 程 在 高 职 院校 中普 遍 存 在 以下
药典分析方法确认与验证

药典分析方法确认与验证分析方法的验证和确认主要内容:分析方法的验证分析方法的确认分析方法的转移方法验证、方法确认和方法转移的文件管理【背景介绍】只有经过验证或确认的分析方法,才可以用于物料和产品的检验以及清洁验证。
检验方法必须经过验证或确认是物料和产品放行的前提之一。
因为只有经过验证或确认的分析方法才可以可靠有效地用于控制药品的内在质量。
分析方法:分析方法是为完成检验项目而设定和建立的测试方法,它详细描述了完成分析检验的每一步骤。
一般包括分析方法原理、仪器及仪器参数、试剂、供试品溶液与对照品溶液等的制备、测定、计算公式及限度要求等。
不同分析方法各有特点,同一分析方法可用于不同的检验项目,但验证内容会有不同。
例如,采用高效液相色谱法进行药品的鉴别和杂质定量检验,两检验项目在方法验证时要求不同。
前者重点要求验证专属性,而后者则需要重点验证专属性、准确度和定量限。
【适用范围】适用于:化学药品(包括物料和产品)的理化分析方法和仪器分析方法的验证与确认。
清洁验证方法的验证。
生物制品分析方法验证。
不适用于:化学药品的微生物方法,【方法验证】方法验证就是根据检验项目的要求,预先设置一定的验证内容和验证标准要求,并通过设计合理的实验来验证所采用的分析方法是否符合检验项目的要求。
建立质量标准时,应对分析方法中的各检验项目进行完整的验证。
当药品生产工艺变更、制剂的组分变更、原分析方法修订时,可根据变更的内容决定对分析方法进行部分验证还是完整的验证。
当原料药合成工艺发生变更时,可能引入新的杂质,杂质检查方法和含量测定方法的专属性就需要进行验证,以证明有关物质检查方法能够检测新引入的杂质,且新引入的杂质对主成分的含量测定应无干扰。
当质量标准中某一项目分析方法发生部分改变时,如采用高效液相色谱法测定含量时,检测波长发生改变,则需要重新进行检测限、定量限、专属性、准确认、精密度、线性等内容的验证,证明修订后的分析方法的合理可行。
中药制剂分析题库(含答案)

第一章绪论一、单项选择题(每题的5个备选答案中,只有一个最佳答案)1.中药制剂分析的任务是A.对中药制剂的原料进行质量分析B.对中药制剂的半成品进行质量分析C.对中药制剂的成品进行质量分析D.对中药制剂的各个环节进行质量分析E.对中药制剂的体内代谢过程进行质量检测2.中药制剂需要质量分析的环节是A.中药制剂的研究、生产、保管和体内代谢过程B.中药制剂的研究、生产、保管、供应和运输过程C.中药制剂的研究、生产、保管、供应和临床使用过程D.中药制剂的研究、生产、供应和运输过程E.中药制剂的研究、生产、供应和体内代谢过程3.中药制剂分析的特点A.制剂工艺的复杂性B.化学成分的多样性和复杂性C.中药材炮制的重要性D.多由大复方组成E.有效成分的单一性4.中医药理论在制剂分析中的作用是A.指导合理用药B.指导合理撰写说明书C.指导检测有毒物质D.指导检测贵重药材E.指导制定合理的质量分析方案5.《中国药典》规定,热水温度指A.70~80℃B.60~80℃C.65~85℃D.50~60℃E.40~60℃6.中药制剂化学成分的多样性是指A.含有多种类型的有机物质B.含有多种类型的无机元素C.含有多种中药材D.含有多种类型的有机和无机化合物E.含有多种的同系化合物7.中药制剂分析的主要对象是A.中药制剂中的有效成分B.影响中药制剂疗效和质量的化学成分C.中药制剂中的毒性成分D.中药制剂中的贵重药材E.中药制剂中的指标性成分8.中药质量标准应全面保证A.中药制剂质量稳定和疗效可靠B.中药制剂质量稳定和使用安全C.中药制剂质量稳定、疗效可靠和使用安全D.中药制剂疗效可靠和使用安全E.中药制剂疗效可靠、无副作用和使用安全9.中药制剂的质量分析是指A.对中药制剂的定性鉴别B.对中药制剂的性状鉴别C.对中药制剂的检查D.对中药制剂的含量测定E.对中药制剂的鉴别、检查和含量测定等方面的评价10.中药分析中最常用的分析方法是A.光谱分析法B.化学分析法C.色谱分析法D.联用分析法E.电学分析法11.中药分析中最常用的提取方法是A.溶剂提取法B.煎煮法C.升华法D.超临界流体萃取E.沉淀法12.指纹图谱可用于中药制剂的A.定性B.鉴别C.检查D.含量测定E.综合质量测定13.取样的原则是A.具有一定的数量B.在效期内取样C.均匀合理D.不能被污染E.包装不能破损14.粉末状样品的取样方法可用A.抽取样品法B.圆锥四分法C.稀释法D.分层取样法E.抽取样品法和圆锥四分法15.中药制剂分析的原始记录要A.完整、清晰B.完整、具体C.真实、具体D.真实、完整、具体E.真实、完整、清晰、具体二、多项选择题(每题的备选答案中有2个或2个以上正确答案,少选或多选均不得分)1.中药制剂分析的任务包括A.对原料药材进行质量分析B.对成品进行质量分析C.对半成品进行质量分析D.对有毒成分进行质量控制E.中药制剂成分的体内药物分析2.中药制剂分析的特点是A.化学成分的多样性和复杂性B.有效成分的单一性C.原料药材质量的差异性D.制剂杂质来源的多途径性E.制剂工艺及辅料的特殊性3.中药制剂分析中常用的提取方法有A.冷浸法B.超声提取法C.回流提取法D.微柱色谱法E.水蒸气蒸馏法4.中药制剂分析中常用的净化方法有A.液—液萃取法B.微柱色谱法C.沉淀法D.蒸馏法E.超临界流体萃取法5.中药制剂中化学成分的复杂性包括A.含有多种类型的有机和无机化合物B.含有多种类型的同系物C.有些成分之间可生成复合物D.在制剂工艺过程中产生新的物质E.药用辅料的多样性6.影响中药制剂质量的因素有A.原料药材的品种、规格不同B.原料药材的产地不同C.原料药材的采收季节不同D.原料药材的产地加工方法不同E.饮片的炮制方法不同三、填空题1.中药制剂分析的意义是为了保证用药的、和。
-国家药品标准主要检测方法应用指导原则

国家药品标准技术规范
• 国家药品标准工作手册(2013年7月 第四版) • 化学药物质量标准建立的规范化过程技术指 导原则 (2005年3月)
2019/1/2
5
基本原则
• 一、坚持以维护人民健康、确保安全有效 为最基本原则。 • 二、坚持科学、实用、规范原则。“科学” 系指药品标准的建立应充分考虑药品在来 源、生产、流通(包括贮运)及使用等各个 环节影响药品质量的因素,进而有针对性 地建立检测项目和相应的检测方法。
2019/1/2 25
流动相
• 反相色谱的流动相首选甲醇一水系统(采用 紫外末端波长检测时,首选乙腈一水系统), 如经试用不适合时,再选用其他溶剂系统。 采用梯度洗脱系统时,应注明洗脱程序, 并在“色谱条件与系统适用性试验”项下 规定待测物质的保留时间。
2019/1/2
26
检测器
• 首选紫外检测器。无紫外吸收的物质可选 用示差折光检测器或蒸发光散射检测器。 • 亦可根据待测物质的性质选用荧光检测器 或电化学检测器等其他检测器。
3、针对性 加强对药品内在质量的控制,有针对性 的规定检测项目,标准中限度的规定要密 切结合实际。必须结合实验研究和生产的 实际,考虑生产的全过程、稳定性等。 4、规范性 必须符合国家药典或其他法定标准的有 关规定(国内外标准)。
2019/1/2
13
• 必须坚持质量第一,充分体现“安 全有效、技术先进、经济合理、不 药品标准所载检测方法,应充分反映现阶 段国内和国际药品质量控制的先进技术和 方法,在科学合理的基础上坚持就高不就 低的标准先进性原则。
2019/1/2
9
质量标准建立的规范化过程
• 药品的质量研究与质量标准的制订是药物 研发的主要内容之一。在药物的研发过程 中需对其质量进行系统、深入的研究,制 订出科学、合理、可行的质量标准,并不 断地修订和完善,以控制药物的质量,保 证其在有效期内安全有效。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
HPLC法
2019年版
530 0
142
24 4 315 165 107 216 359
2019年版
580 73
707
97 45 414 219 132 372 694
4
色谱法在2019年版药典的应用
柱色谱 纸色谱 薄层色谱 气相色谱
• 高效液相色谱 • 离子色谱
正相色谱 反相色谱 离子对色谱
硅胶G
254个品种
硅胶G254
148个品种
硅胶H
15个品种
硅胶HF254
12个品种
硅藻土
2个品种
微晶纤维素
3个品种
氧化铝
1个品种
7
色谱法的应用:气相色谱
进样方式 直接进样 顶空进样
品种数量 75个 112个
检测方式 FID ECD
品种数量 181个 6个
ECD
伊曲康唑 联苯苄唑 恩氟烷 林旦乳膏 林旦 异氟烷
17
2019版药典二部采用常压凝胶色谱的品种
常压凝胶色谱
头孢尼西钠 注射用头孢尼西钠 头孢他啶 注射用头孢他定
头孢曲松钠
注射用头孢曲松钠
头孢呋辛钠 注射用头孢呋辛钠 头孢拉定 头孢哌酮钠 注射用头孢哌酮钠 氯唑西林钠 注射用氯唑西林钠
头孢唑肟钠 注射用头孢唑肟钠 头孢唑林钠 注射用头孢唑林钠
头孢替唑钠
素
或 指 纹 图 谱
HPL C
TL CS
UV
GC
其 他
中成
10版 新增
259
1818
25
9
54 426
8
32
16 2
6
709 12 8 24 1
药
05版 收载
281
1144
11
16 102 627
8
10 90 1
321 33 16 19 4
10版
提取 新增
物 05版
收载
21 3 2 5 1 11
50 16 17
色谱柱类型 氨基柱 丁基柱
三甲基硅烷柱 二羟基丙基硅烷键合
硅胶柱
苯乙烯-二乙烯基柱
品种数 5个 3个 2个 1个
1个
11
色谱法的应用:高效液相色谱
缬沙坦 盐酸帕罗西汀
a-酸性糖蛋白柱
瑞格列奈 瑞格列奈片
手性色谱柱α1酸性蛋白柱
苯磺酸顺阿曲库铵 注射用苯磺酸顺阿曲库铵 手性色谱柱chiralcel OD-RH
16
色谱法的应用:凝胶色谱法
固定相是有一定孔径的多孔性填料,流动相是可以溶解样 品的溶剂。小分子量的化合物可以进入孔中,滞留时间长; 大分子量的化合物不能进入孔中,直接随流动相流出。
它利用分子筛对分子量大小不同的各组分排阻能力的差异 而完成分离。
常用于分离高分子化合物,如多糖、多肽、蛋白质、核酸 等。
响雾化过程。 被分析物的浓度和体积质量决定了进入光散射池的气溶胶
13
色谱法的应用:离子色谱
基本原理
离子色谱中发生的基本过程就是离子交换,
因此,离子色谱本质上就是离子交换色谱。 色谱柱类型
在离子色谱的基本组成中,重要的和与其 他高效液相色谱不同的就是抑制器和电导 检测器,离子色谱用的泵是PEEK材料衬里的不
阳离子交换柱 阴离子交换柱
锈钢泵。
品种个数 23个 14个
《中国药典》2019年版 新仪器分析方法应对
李志伟
1
现代分析技术的应用进一步扩大
红外光谱 原料药、制剂
气相色谱 残留溶剂
HPLC 检测器
分析技术
毛细管电泳
总有机碳测定法 (TOC)
离子色谱
2
《中国药典》2019年版一部新修订项目
项目 类别
鉴别
检查
特
含量测定
征
重金
显微
TLC
HP LC
GC
理化
通则
属有 毒性 其 害元 成分 他
注射用头孢替唑钠
头孢噻吩钠 注射用头孢噻吩钠 头孢噻肟钠 注射用头孢噻肟钠 阿洛西林钠 注射用阿洛西林钠 普鲁卡因青霉素 注射用普鲁卡因青霉素
阿莫西林 阿莫西林胶囊 青霉素V钾 青霉素V钾胶囊 青霉素钠
注射用青霉素钠
青霉素钾 注射用青霉素钾 苯唑西林钠 注射用苯唑西林钠 美洛西林钠 注射用美洛西林钠 磺苄西林钠 注射用磺苄西林钠
•离子交换色谱法主要用于分析有机酸、氨基酸、多肽及核酸等离子型化合物的分离。
14
色谱法的应用:离子色谱
阳离子交换柱 山梨醇及制剂 甘油果糖氯化钠注射液 甘露醇及制剂 利巴韦林及制剂 盐酸二甲双胍及制剂 苹果酸及制剂 富马酸及制剂
阴离子交换柱
肝素钠及制剂 帕米磷酸二钠及制剂 氯膦酸二钠及制剂 硫酸软骨素钠及制剂
18
2019版药典二部采用高效凝胶色谱的品种
门冬酰胺酶(埃希)
分子量5000~60000色谱亲水改性硅胶,UV,纯度
门冬酰胺酶(欧文)
分子量5000~60000色谱亲水改性硅胶,UV,纯度
注射用门冬酰胺酶(埃希) 分子量5000~60000色谱亲水改性硅胶,UV,纯度
注射用门冬酰胺酶(欧文) 分子量5000~60000色谱亲水改性nutes
供试品毛细管电泳谱图(杭州澳亚生物技术有限公司生产,批号:071015)
23
例:毛细管电泳(抑肽酶)
编号
1 2 3 4 5 6 7 Sigma对照品 标准规定
去丙氨酸-去甘氨酸抑肽酶(%)
6.9
上海所结果
去丙氨酸-抑肽 酶(%)
面积归一化法计算抑肽酶 主峰含量(%)
6.2
18.417 18.617
16
17
18
19
20
21
22
23
24
25
Minutes
sigma抑肽酶对照品毛细管电泳谱图
22
例:毛细管电泳(抑肽酶)
0.008
0.006
0.004
0.002
18.792
AU
0.000
-0.002
18.354 18.554
-0.004
-0.006
15
16
17
18
19
20
21
• 凝胶色谱
• 毛细管电泳
5
色谱法的应用:纸色谱
纸色谱的基本原理-分配色谱 固定相-吸附在滤纸上的水 移动相-展开剂 样品在水和展开剂中的溶解度不同,故分
配不同而达到分离。例:盐酸苯乙双胍
6
色谱法的应用:薄层色谱
2019版药典(二部)采用TLC的品种数量,共435个
TLC
品种数量
同物质,ELSD相应因子的变化比其它检测器要小得多。 对环境影响不灵敏,室温下即可操作。 没有溶剂前缘峰,适用于保留时间短的物质的检测。 与LC-MS的色谱条件一致,可直接进行方法转换。
28
色谱法的应用:蒸发光散射检测器
影响ELSD响应的因素 载气流速、雾化器设计与温度、流动相的组成和流速等影
球形硅胶。
90年代早期,粒径为 5 µm 的高纯硅胶,即所谓的 B 型硅胶被发展,并成为
这个行业填料的标准,这种 B 型硅胶含有微量的金属。
90年代后期,为了满足快速分离的需求,发展了 3 µm 或 3.5 µm 的球形硅胶,
其作用和性能逐渐的获得了人们的认同和接受。手性色谱柱的开发。
21世纪早期,为适应超快速的分离要求,粒径小于 2 µm 的填料被开发出来,
7
16
17 10 12 1 56
9 115
中药
10版 新增
374
526
3
材
05版 收载
339
347
5
2 26 1127 12 14 31 179 726 17 17 71
412 3 17 9 34 175 13 20 7 30
10版 新增
633
2492
31
12 134 1554
31
40
24 3
22
1138 15 25 16 32
21
AU
例:毛细管电泳(抑肽酶)
0.008 0.006 0.004 0.002 0.000 -0.002 -0.004 -0.006
15
1:保留时间为18.417分钟的是去丙氨酸-去甘氨酸-抑肽酶, 2:保留时间为18.617分钟的是去丙氨酸-抑肽酶, 3:保留时间为18.829分钟的是抑肽酶峰
18.829
63.6
6.9
6.7
83.0
7.0
6.2
84.3
7.7
6.0
81.4
5.8
4.3
15.2
4.3
4.8
14.8
5.2
4.3
14.3
6.2
6.9
81.5
8.0%
7.5%
/
24
色谱法的应用:毛细管电泳
分离模式 毛细管区带电泳CZE 胶束电动毛细管色谱MEKC 毛细管等电聚焦CIEF 毛细管凝胶电泳CGE 毛细管电色谱CEC
20
色谱法的应用:电泳及毛细管电泳法
2019版药典二部采用电泳法的品种
乌司他丁 乌司他丁溶液 肝素钠乳膏
还原型SDS-聚丙烯酰胺凝胶,分子量 还原型SDS-聚丙烯酰胺凝胶,分子量 鉴别(琼脂糖电泳)
2019版药典二部采用CE的品种
盐酸头孢吡肟 注射用盐酸头孢吡肟 抑肽酶 注射用抑肽酶
有关物质 有关物质 有关物质 有关物质
合计
05版 收载
620
1507
16
16 298 1363 37
