天津大学无机化学原子结构与元素周期性全
天津大学无机化学课件第五章原子结构与元素周期性 共74页PPT资料

例外的还有: 41Nb、 44Ru、 45Rh、 57La、
58Ce、78Pt、89Ac、90Th、91Pa、92U、 93Np
29.11.2019
课件
36
基态原子的价层电子构型
价层——价电子所在的亚层 价层电子构型——指价层的电子分布式
29.11.2019
课件
30
无机化学多媒体电子教案
第五章 原子结构和元素周期性
第三节原子中电子的分布
第三节
原子中电子的分布
29.11.2019
课件
31
5-3-1 基态原子中电子的分布原理
泡利不相容原理——每一个原子轨道,最多
只能容纳两个自旋方向相反的电子.
能量5最-3低-原1理基—态—原原子子为中基态电时子,分电子布尽原可 能地分布在能级较低的理轨道上,使原子处于
课件
29
3. 磁量子数(m)
磁量子数(m)的取值决定于l值,可取(2l+1)个 从-l到+l(包括零在内)的整数。每一个m值代表 一个具有某种空间取向的原子轨道。
4.自旋量子数(ms)
自旋量子数(ms)只有+1/2或-1/2 这两个数值, 其中每一个值表示电子的一种自旋方向(如顺 时针或逆时针方向)。
课件
12
在量子力学中是用波函数和与其对应的 能量来描述微观粒子的运动状态的.
原子中电子的波函数ψ既然是描述电子云
运动状态的数学表达式,而且又是空间坐标的
函数,其空间图象可以形象地理解为电子运动
的空间范围,俗称”原子轨道”.为了避免与经
典力学中的玻尔轨道相混淆,又称为原子轨函
(原子轨道函数之意),亦即波函数的空间图象
激发态(电子处于能
天津大学无机化学教研室《无机化学》(第4版)课后习题(原子结构与元素周期性)【圣才出品】

价层电子构型为 为相似。
所以它属于第七周期、ⅣA 族,可能与已知元素 Pb 的性质最
5 / 13
圣才电子书
十万种考研考证电子书、题库视频学习平
台
(2)电子最先填充在第一个 59 轨道上的元素的原子序数可能是 121。
推测:根据电子填充轨道的次序为
可知出
现第一个 59 电子的元素的电子分布式应为
8.(1)试写出 S 区、P 区、d 区及 ds 区元素的价层电子构型。 (2)具有下列价层电子构型的元素位于周期表中哪一个区?它们各是金属还是非金 属?
答:(1)
表 5-2
(2)
表 5-3
3 / 13
圣才电子书
十万种考研考证电子书、题库视频学习平 台
9.已知某副族元素的 A 原子,电子最后填入 3d,最高氧化数为+4;元素 B 的原子, 电子最后填入 4p,最高氧化数为+5。回答下列问题:
所以该元素原子序数是 121。
(3)118。第七周期最后一种元素的价层构型应为
其电子分布式为
所以第七周期最后一种元素的原子序数应为 118。
(4)50。第八周期的元素种数应该是第八能级组可填充的电子数,即
,所以第八周期应该包括(2+18+14+10+6)=50 种元素。
(二)习题 1.在下列各组量子数中,恰当填入尚缺的量子数。 (1) (2) (3) (4) 解:(1)n≥3 正整数; (2)l=1;
(1)写出 A、B 元素原子的电子分布式; (2)根据电子分布,指出它们在周期表中的位置(周期、区、族)。 答:(1)A: B: (2)A:四周期、d 区、ⅣB 族元素;B:四周期、p 区、ⅤA 族元素。
10.不参看周期表,试推测下列每一对原子中哪一个原子具有较高的第一电离能和较 大的电负性值?
天津大学无机化学课后习题参考答案

第1章 化学反应中的质量关系和能量关系 习题参考答案1.解:1.00吨氨气可制取2.47吨硝酸。
2.解:氯气质量为2.9×103g 。
3.解:一瓶氧气可用天数33111-1222()(13.210-1.0110)kPa 32L9.6d 101.325kPa 400L d n p p V n p V -⨯⨯⨯===⨯⨯4.解:pV MpVT nR mR== = 318 K 44.9=℃ 5.解:根据道尔顿分压定律ii n p p n=p (N 2) = 7.6⨯104 Pap (O 2) = 2.0⨯104 Pa p (Ar) =1⨯103 Pa6.解:(1)2(CO )n = 0.114mol; 2(CO )p = 42.87 10 Pa ⨯(2)222(N )(O )(CO )p p p p =--43.7910Pa =⨯ (3)4224(O )(CO ) 2.6710Pa0.2869.3310Pan p n p ⨯===⨯ 7.解:(1)p (H 2) =95.43 kPa (2)m (H 2) =pVMRT= 0.194 g 8.解:(1)ξ = 5.0 mol(2)ξ = 2.5 mol结论: 反应进度(ξ)的值与选用反应式中的哪个物质的量的变化来进行计算无关,但与反应式的写法有关。
9.解:∆U = Q p - p ∆V = 0.771 kJ 10.解: (1)V 1 = 38.3⨯10-3 m 3= 38.3L(2) T 2 =nRpV 2= 320 K (3)-W = - (-p ∆V ) = -502 J (4) ∆U = Q + W = -758 J (5) ∆H = Q p = -1260 J11.解:NH 3(g) +45O 2(g) 298.15K−−−−→标准态NO(g) + 23H 2O(g) m r H ∆= - 226.2 kJ·mol -112.解:m r H ∆= Q p = -89.5 kJ m r U ∆= m r H ∆- ∆nRT= -96.9 kJ13.解:(1)C (s) + O 2 (g) → CO 2 (g)m r H ∆ =m f H ∆(CO 2, g) = -393.509 kJ·mol -121CO 2(g) + 21C(s) → CO(g) m r H ∆ = 86.229 kJ·mol -1CO(g) +31Fe 2O 3(s) → 32Fe(s) + CO 2(g)m r H ∆ = -8.3 kJ·mol -1各反应m r H ∆之和m r H ∆= -315.6 kJ·mol -1。
无机化学基本原理第七章原子结构与周期表2

15
五、元素周期表 1. 能级组与元素周期的划分 周期的划分就是核外电子能级的划分,各能级 组容纳的电子数就等于相应周期元素的数目。 2.原子的电子构型及周期表中族的划分 2.原子的电子构型及周期表中族的划分 主族的族数 = 最外层电子数的总和 主族元素的最高氧化态 =最外层电子数 一般:族数 = (n-1)d + ns 电子数的总和 VIIIB, IB, IIB 副族元素的族数 = 反应中失去的电子数
8
例:试应用Slater计算方法求算氧原子的第一电离能
解:氧原子O结构为1s2, 2s2 2p4, 氧离子结构为1s2, 2s2 2p3,氧原子的电离能 (I) O = O+ + e I = E (O+) - E (O) = E(2s2 2p3) - E(2s2 2p4) O+: (1s2) (2s2 2p3) ZO+* = 8 - (4×0.35 + 2×0.85) = 4.9 (4 0.35 2 0.85) E(O+) = 5×(-13.6)× = 5×(- 81.63) = 408.17eV O: (1s2) (2s2 2p4) ZO* = 8 - (5×0.35 + 2×0.85) = 4.55 E(O) = 6 ×(-13.6)× = -422.34eV
11
二、钻穿效应 n相同,l不同的轨道,由于电子云径向分布不 同,电子穿过内层到达核附近以回避其他电子 屏蔽的能力不同,而使电子具有不同的能量, 这种由于s,p,d,f 轨道径向分布不同而引起 的能量效应(penetrating effect)。 对于单电子体系: 对于单电子体系:E3s = E3p = E3d 对于多电子体系: 对于多电子体系: E3s < E3p < E3d 能级交错: 能级交错: 由于屏蔽效应和钻穿效应,使不同轨道上的电 子能级发生变化,从而引起能级上的交错。 ns电子能量变的更低,nd, nf 电子能量变的更 电子能量变的更低, 电子能量变的更低 高。
无机化学知识点学习笔记 (5)

《无机化学》学习笔记五第五章原子结构与元素周期性1.一般了解原子轨道、波函数、概率、概率密度、电子云等概念。
初步熟悉波函数、电子云的角度分布图。
2.了解四个量子数对核外电子运动状态的描述,电子层、亚层、能级、能级组的含义。
3.基本掌握原子核外电子排布原理及一般规律,了解各区元素原子电子层结构的特征。
4.了解电离能、电子亲合能、电负性及主要氧化数的周期性变化。
知识点:1.玻尔氢原子模型玻尔理论的基本假说有如下几点:(1)电子在原子内具有确定半径r和一定能量E的轨道运动。
在轨道上运动的电子处于“稳定状态”(简称“定态”)。
电子处于定态的原子并不辐射能量。
原子内的电子可以处于不同的定态,能量最低的定态称为“基态”,能量较高的定态称为“激发态”。
(2)电子可以吸收一定的能量从能量低的状态跃迁到能量高的状态,或从高能量定态辐射出一定的能量跃迁到低能量定态。
跃迁所吸收或辐射的辐射能频率ν由下式决定:hν= E2-E1(3)原子内运动的电子的能量是量子化的,这些轨道上的电子运动的能量,必须是h/2π的整数倍,即E n=nh/2π(n=1,2,3,4,・・・・・・)。
式中:h是普朗克常数,n是正整数,称为“量子数”。
此关系式为“玻尔的量子化条件”。
根据上述假设及经典力学的规律,计算得到氢原子基态时电子的能量为-13.6eV。
不同的定态轨道能量是不同的。
离核越近的轨道,能量越低,电子被原子核束缚得越牢;离核越远的轨道,能量越高。
轨道的这些不同的能量状态,称为能级。
①定态原子轨道②原子轨道的半径③原子轨道的能级④轨道能级量子化。
2.微观粒子及其运动特性--波粒二象性二十世纪初人们发现,光不仅有微粒的性质,而且有波动的性质,即具有波粒二象性。
3.测不准原理对于宏观物体,沿着确定的轨道,按确定的速度运动时,可以依据经典物理定律准确地确定其在任何指定时刻的位置和速度。
而对微观粒子则不同,不可能同时准确的确定其位置及速度。
(完整版)天津大学无机化学考试试卷(上册)答案
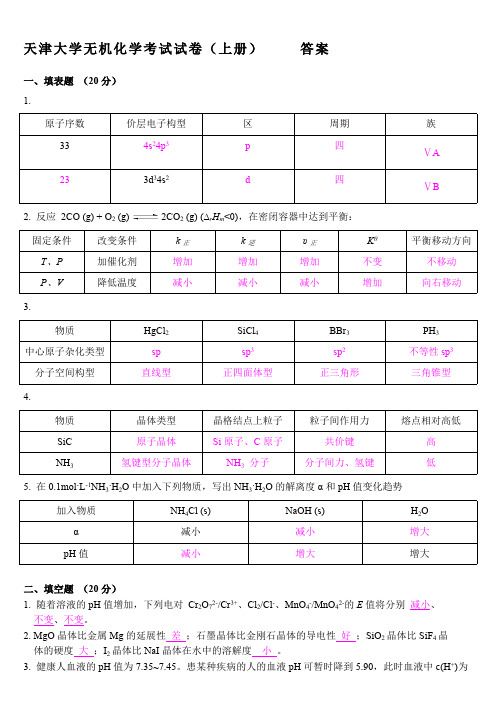
天津大学无机化学考试试卷(上册)答案一、填表题(20分)1.原子序数价层电子构型区周期族334s24p3p四ⅤA233d34s2d四ⅤB2. 反应2CO (g) + O2 (g) 2CO2 (g) (∆r H m<0),在密闭容器中达到平衡:固定条件改变条件k正k逆υ正Kθ平衡移动方向T、P加催化剂增加增加增加不变不移动P、V降低温度减小减小减小增加向右移动3.物质HgCl2SiCl4BBr3PH3中心原子杂化类型sp sp3sp2不等性sp3分子空间构型直线型正四面体型正三角形三角锥型4.物质晶体类型晶格结点上粒子粒子间作用力熔点相对高低SiC原子晶体Si原子、C原子共价键高NH3氢键型分子晶体NH3分子分子间力、氢键低5. 在0.1mol·L-1NH3·H2O中加入下列物质,写出NH3·H2O的解离度α和pH值变化趋势加入物质NH4Cl (s)NaOH (s)H2O α减小减小增大pH值减小增大增大二、填空题(20分)1. 随着溶液的pH值增加,下列电对Cr2O72-/Cr3+、Cl2/Cl-、MnO4-/MnO42-的E值将分别减小、不变、不变。
2. MgO晶体比金属Mg的延展性差;石墨晶体比金刚石晶体的导电性好;SiO2晶体比SiF4晶体的硬度大;I2晶体比NaI晶体在水中的溶解度小。
3. 健康人血液的pH值为7.35~7.45。
患某种疾病的人的血液pH可暂时降到5.90,此时血液中c(H+)为s o 正常状态的 28~35 倍。
4. 已知B 2轨道的能级顺序为σ1s σ*1s σ2s σ*2s π2py π2pz σ2px π*2py π*2pz σ*2px ,则B 2的分子轨道分布式为(σ1s )2(σ*1s )2(σ2s )2(σ*2s )2(π2py )1(π2pz )1,成键数目及名称两个单电子π键,价键结构式为 。
5. 根据E θ(PbO 2/PbSO 4) >E θ(MnO 4-/Mn 2+) >E θ(Sn 4+/Sn 2+),可以判断在组成电对的六种物质中,氧化性最强的是 PbO 2 ,还原性最强的是 Sn 2+ 。
(完整版)无机化学(天津大学版)

(完整版)⽆机化学(天津⼤学版)第⼀章化学反应中的质量关系和能量关系[学习指导]1.“物质的量”(n)⽤于计量指定的微观基本单元或其特定组合的物理量,其单位名称为摩[尔],单位符号为mol。
2.摩尔质量(M) M = m/n3.摩尔体积(V m)V m = V/n4.物质的量浓度(c B)c B = n B/V5.理想⽓体状态⽅程pV = nRT6.理想⽓体分压定律p= Σp B ;p B = (n B/n)p7.化学计量式和化学计量数O = ΣνB B ;νBB8.反应进度(ξ)表⽰化学反应进⾏程度的物理量,符号为ξ,单位为mol。
随着反应的进⾏,任⼀化学反应各反应物及产物的改变量:Δn B = νBξ9.状态函数状态函数的改变量只与体系的始、终态有关,⽽与状态变化的途径⽆关。
10.热和功体系和环境之间因温差⽽传递的热量称为热。
除热以外,其它各种形式被传递的能量称为功。
11.热⼒学能(U)体系内部所含的总能量。
12.能量守恒定律孤⽴体系中能量是不会⾃⽣⾃灭的,它可以变换形式,但总值不变。
13.热⼒学第⼀定律封闭体系热⼒学能的变化:ΔU = Q + WQ > 0, W > 0, ΔU > 0;Q < 0, W< 0, ΔU < 0。
14.恒压反应热(Q p)和反应焓变(Δr H m)H(焓) ≡ U + pV, Q p= Δr H m15.赫斯定律Q p= ∑Q B, Δr H m= ∑Δr H m(B)B B16.标准状况:p = 101.325kPa, T = 273.15 K标准(状)态:pθ= 100kPa下⽓体:纯⽓体物质液体、固体:最稳定的纯液体、纯固体物质。
溶液中的溶质:摩尔浓度为1mol·L-1标准态下17.标准摩尔⽣成焓()最稳定的单质─────—→单位物质的量的某物质=18.标准摩尔反应焓变()⼀般反应cC + dD = yY + zZ=[y(Y) + z(Z)] - [c(C)+ d(D)]=Σνi(⽣成物) + Σνi(反应物)第⼆章化学反应的⽅向、速率和限度[学习指导]1.反应速率:单位体积内反应进⾏程度随时间的变化率,即:2.活化分⼦:具有等于或超过E c能量(分⼦发⽣有效碰撞所必须具备的最低能量)的分⼦。
无机化学第四版第五章思考题与习题 - 无机化学简明教程 天津大学 杨宏孝 第四版 课后思考题和习题答案

第五章原子结构与元素周期性-思考题1.量子力学的轨道概念与波尔原子模型的轨道有什么区别和联系?解:量子力学的原子轨道是解薛定谔方程得到的,以满足量子化条件为前提的,适用于所有原子;玻尔先假定了一个量子化条件,从经典理论推导出来的,但只适用于氢原子,多电子原子不适用。
2. .量子力学原子模型是如何描述核外电子运动状态的?解:用四个量子数: 主量子数--------描述原子轨道的能级副量子数------ 描述原子轨道的形状角量子数-------描述原子轨道的伸张方向自旋量子数---------描述电子的自旋方向.3. 为什么任何原子的最外层最多只能有8个电子,次外层最多只能有18个电子? 解:根据能量最低原理,泡利不相容原理以及洪特规则,我们就可以推算出各电子层,电子亚层和轨道中最多能容纳多少电子,以及每一个原子的核外电子排布形式,从结果上看,最外层只出现s亚层和p亚层,最都只能有8个电子,而次外层只会出现s、p、d亚层,最有只能有18个电子。
4. 为什么周期表中各周期的元素数目并不一定等于原子中相应电子层的电子最大容量数(2n2)?解:因为存在能级交错现象,比如d区原子,最外层为n,但原子数目取决于n-1的d亚层的电子容量。
如第4-7周期的原子数据远远大于2n2。
5. 量子数n=3,l=1的原子轨道的符号是怎样的?该类原子轨道的形状如何?有几种空间取向?共有几个轨道?可容纳多少个电子?解:原子轨道符号位3p,原子轨道的形状为哑铃形,有3种空间取向,共3个轨道,可容纳6个电子。
6.(1) 试写出s区,p区,d区及ds区元素的价层电子构型.解:s区ns1-2 p区ns2np1-6 d区(n-1)d1-9ns1-2 ds区(n-1)d10ns1-2 (2) 具有下列价层电子构型的元素位于周期表中哪一个区?它们各是金属还是非金属?价层电子构型ns2 ns2np5 (n-1)d2ns2 (n-1)d10ns2所在区s p d ds金属或非金属金属非金属金属金属11. 已知某副元素的A原子,电子最后填入3d,最高氧化数为+4,元素B的原子,电子最后填入4p, 最高氧化数为+5.回答下列问题:(1) 写出A,B元素原子的电子分布式;(2) 根据电子分布,指出它们周期表中的位置(周期,区,族).解:(1)A:1s22s22p63s23p63d24s2B:1s22s22p63s23p63d104s24p3(2) A: 四周期,d区,IVB族元素B:四周期,p区,V A族元素习题1.在26Fe原子核外的3d,4s轨道内,下列电子分布哪个正确? 哪个错误? 为什么?答:(1) 不符合能量最低原理;(2) 不符合能量最低原理和洪特规则;(3) 不符合洪特规则;(4) 不符合泡利不相容原理;(5) 正确。
无机化学 原子结构和元素周期律 习题课

精选完整ppt课件
24
电子填充反常元素: Cr, Cu; Nb, Mo, Ru, Rh, Pd, Ag; Pt, Au.
Cr [Ar]3d54s1
Cu [Ar]3d104s1
Nb
Mo
Ru
Rh
Pd
Ag
[Kr]4d45s1 [Kr]4d55s1 [Kr]4d75s1 [Kr]4d85s1 [Kr]4d105s0 [Kr]4d105s1
Pt
[Xe]4f145d9 6s1
Au
[Xe]4f145d1 06s1
精选完整ppt课件
25
六、元素周期律和元素性质的周期性
❖元素周期律是元素核外电子层结构周期 性变化的反映,各元素原子电子层结构 的周期性变化是元素周期性变化的内在 原因。掌握好各种元素电子层结构及其 变化是学好元素周期律的关键。
均如此),为何在电子填充时仍然先填4s轨道, 后填3d轨道?
解答:这尚是一个有争议的问题, 即使采用薛 定谔方程计算, 对于多电子体系, 也是一个难于 解决的问题。关于3d 和4s 轨道能量的高低, 采 用的近似方法不同, 处理问题的角度不同, 得到 的结论也不同。
3d电子的3d = (0.35 9) + (1.00 18) = 21.15
E 3d 1.6 3 (2 9 3 2 2.1 1)2 5eV 9.1 3e 2V
精选完整ppt课件
32
计算结果是E4s > E3d,说明Cu原子失去4s轨道 中的电子。
思考:既然Cu原子有E4s > E3d (Z > 21的元素
E13.6(Z n 2 )2 eV
精选完整ppt课件
31
P153 6-8 解: Cu原子的电子结构式为1s22s22p63s23p63d104s1 4s电子的4s = (0.85 18) + (1.00 10) = 25.3
天津大学无机化学ppt课件下载

Inorganic Chemistry
绪论 1学时 第一章 化学反应中 的质量关系和能量 关系(3学时)
目 录
第二章 化学反应的 方向、速率和限度 (8学时)
第三章 酸碱反应和 沉淀反应(7学时)
§1 化学中的计量 §2 化学反应中的质量关系 §3 化学反应中的能量关系
1学时 1学时 1学时
光 学 纤 维 胃 镜
用光导纤维 做手术,不 用开刀
20/51
F-117是一种单座战斗轰炸机。设计目的是凭隐身性能,突破敌 火力网,压制敌方防空系统,摧毁严密防守的指挥所、战略要地 、重要工业目标,还可执行侦察任务,具有一定空战能力。21/51
近年发现和发明的新物质层出不穷,如球碳、管碳、俄 罗斯套娃、团簇化合物、笼合物等。
§1 镧系元素和锕系元素该素 §2 稀土元素
6/51
1 化学的研究对象 绪论 2 化学的主要分支
3பைடு நூலகம்怎样学习化学
7/51
什么是化学?它研究的对象是什么?如何才能学好化 学?这是开始学化学首先要解决的问题。下面就从回答这些 问题来开始我们的化学学习。
一.化学研 究的物质
物质是不依赖于人们的感觉而存在并且可以 被人们的感觉所认识的客观实在。简而言之,物 质是客观存在的东西。
36/51
(2)炼金术、炼丹时期(公元前后—公元 1500年)
➢ 中国炼丹术的产生有两个原因:一是五行说(五 行无常胜),此为理论基础;二是封建主的贪得 无厌,梦想长生。战国末期有了炼丹术,汉代有 较大发展,唐代达到高潮。当时所谓的丹主要是 三仙丹HgO,丹砂HgS,铅丹Pb3O4等。这些丹 实际上都是剧毒的,许多皇帝因服丹而亡。
1学时 3学时 4学时
无机化学大学课件第一章原子结构和元素周期律

• 意义:n 是决定电子层能量高低的主要因素,
n=1表示离核最近,能量最低的第一电子层;n=2表示离核
次近的能量次低的第二电子层,依此类推。能量越低,受核束 缚越大,能量越低。
(2) 角量子数(l)或副量子数(azimuthal quantum number)
电子绕核运动时,不仅具有一定的能量,而且也具有一定
电子层结构的特征,并结合原子参数熟悉元素性质周 期性的变化规律。
图1 道尔顿原子模型
§1.1 原子的含核模型
1. “枣糕模型”: 1903年W.汤姆生(1824~1907)提出, 原子是一个球体,正电荷均匀分布在整个球内,电子 则镶在球里,原子受到激发后,电子振动,产生光谱。
图2 汤姆生原子模型
r,q,R rQ qF
r,q,R rYq,
•
解薛定谔方程时,为了方便起见,将直角坐标x,y,z变
换 成 球 极 坐 标 r,q,f , 这 样 (x,y,z) 就 变 成 了 (r,q,f)=
R(r)Q(q)F(f) , 将 与 角 度 有 关 的 函 数 合 并 为 Y(q,f) , 则
要的,或者说,四个量子数确定了,核外电子的运动状态就确
定了。
• (1) 主量子数(n)(principle quantum number)
•
它是用来描述原子中电子出现概率最大区域离核远近的参
数,或者说,它是确定电子层数的。
n 的取值为:1, 2, 3, 4…n等正整数,表示电子层数。
光谱学上常用K,L,M,N…表示电子层数。
数E 就是粒子处在该定态时的总能量。
Figure 9 pherical polar coordinates(r,θ,φ) and Cartesian axes(x, y, z).
《无机化学》课件第一章

第一节 原子的组成与核外电子排布
电子云的角度分布图是通过将|Ψ|2的角度分布部分,即|Y|2随 θ、Φ的变化作图而得到的(空间)图像,它形象地显示出在原子核 不同角度与电子出现的概率密度大小的关系。图1-1(b)是电子云的 角度分布剖面图。电子云的角度分布剖面图与相应的原子轨道角 度分布剖面图基本相似,但有以下不同之处:原子轨道角度分布 图带有正、负号,而电子云的角度分布图均为正值(习惯不标出正 号);电子云的角度分布图比相应的原子轨道角度分布要“瘦”些, 这是因为Y值一般是小于1的,所以|Y|2的值就更小些。
第一节 原子的组成与核外电子排布
五、 多电子原子结构
多电子原子指原子核外电子数大于1的原子(即除H以外 的其他元素的原子)。在多电子原子结构中,核外电子是如何 分布的呢?要了解多电子中电子分布的规律,首先要知道原 子能级的相对高低。原子轨道能级的相对高低是根据光谱实 验归纳得到的。H原子轨道的能量取决于主量子数n,在多电 子原子中,轨道的能量除取决于主量子数n外,还与角量子 数l有关,总规律如下:
无机化学
第一章 原子结构和元素周期律
原子的组成与核外电子排布 元素周期律与元素周期表 元素基本性质的周期性
第一节 原子的组成与核外电子排布
一、 原子的组成
在20世纪30年代,人们已经认识到原子是由处于原子中 心的带正电荷的原子核和核外带负电荷的电子构成的。由于原 子核跟核外电子的电量相同,电性相反,所以原子呈电中性。 原子很小,半径约为10-10m;原子核更小,它的体积约为原 子体积的1/1012。如果把原子比喻成一座庞大的体育场,则原 子核只相当于体育场中央的一只蚂蚁。因此原子内部有相当大 的空间,电子就在这个空间内绕着原子核作高速运动。
第一节 原子的组成与核外电子排布
无机化学内容及要求

第一篇物质结构基础第一章原子结构和元素周期系第二章分子结构第三章晶体结构第四章配合物第二篇化学热力学与化学动力学基础第五章化学热力学基础第六章化学平衡常数第三篇水溶液化学原理第九章酸碱平衡第十章沉淀平衡第十一章电化学基础第十二章配位平衡第四篇元素化学(一)非金属第十三章氢和稀有气体第十四章卤素第十五章氧族元素第十六章氮磷砷第十七章碳硅硼第十八章非金属元素小结第五篇元素化学(二)金属第二十一章p区金属第二十二章ds 区金属第二十三章 d 区金属(一)第四周期d区金属要求绪论教学基本要求:理解化学研究的对象、内容、目的和方法。
了解化学发展的现状。
掌握学习化学的正确方法。
第一篇物质结构基础第1章原子结构与元素周期系教学基本要求:初步了解原子能级、波粒二象性、原子轨道(波函数)和电子云等原子核外电子运动的近代概念。
熟悉四个量子数对核外电子运动状态的描述。
熟悉s、p、d原子轨道的形状和伸展方向。
掌握原子核外电子排布的一般规律和各区元素原子层结构的特征。
会从原子半径、电子层构型和有效核电荷来了解元素的性质。
熟悉电离能、电子亲合能、电负性及主要氧化值的周期性变化。
1.本章第1、2、3节讨论原子、元素、核素、同位素、同位素丰度、相对原子质量等基本概念。
其中相对原子质量(原子量)是最重要的,其余都是阅读材料。
2.本张第4节讨论氢原子的玻尔行星模型,基本要求是建立定态、激发态、量子数和电子跃迁4个概念,其他内容不作为教学要求。
3.第5节是本章第1个重点。
基本要求是初步理解量子力学对核外电子运动状态的描述方法;初步理解核外电子的运动状态;掌握核外电子可能状态的推算。
本节小字部分为阅读材料。
4.第6节是本章第2个重点。
基本要求是掌握确定基态原子电子组态的构造原理,在给定原子序数时能写出基态原子的电子组态;掌握多电子原子核外电子状态的基本规律,特别是能量最低原理。
本节小字内容不作教学要求。
5.第7、8节是本章最后1个重点。
无机化学第5章
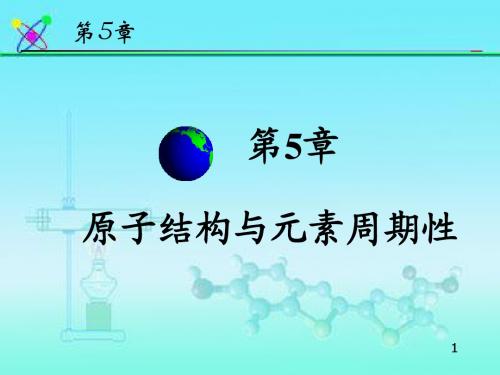
电子云图是概率密度| |2 的形象化说明。黑点密集的
地方, | |2 的值大,概率密度大;反之概率密度小。
32
电子云的角度分布
z z z x y
s y
px y y
dxz z
y
_
x
33
||2代表电子的概率密度。
每一个波函数代表一个原子轨道。
原子轨道——原子中一个电子的可能的空间运动状态。
注意:此处提到的原子轨道与 Bohr 原子模型所指的原
子轨道截然不同。 见书P127。
27
2. 波函数的径向部分和角度部分
将直角坐标三变量 x,y,z 变换成球坐标三变量 r,, 。 OP 的长度 (0—) OP 与 z 轴的夹角 ( 0 — ) OP 在 xoy 平面内的投影 OP′ 与 x 轴的夹角 ( 0 — 2 ) r P 根据 r,, 的定义,有 x = r sin cos y = r sin sin z = r cos r2 = x2 + y2 + z2
概率 = 体积×概率密度
23
二、 电子云
电子云——即电子在核外空间出现概率密度 分布的形象化描述。
y x
a
y
x
y x
b b 电子云的统计概念(二维投影) a) 单张照片;b) 二张照片 c)大量照片
24
三、 Schodinger波动方程
1926 年,奥地利物理学家 Schodinger 提 出一个描述核外电子等微观粒子运动状态 的方程,被命名为Schodinger方程。他奠 定了波动力学的基础,因而与P.A.M.狄拉 克共获1933 年诺贝尔物理学奖
天津大学无机化学教研室《无机化学》(第4版)(上册)-课后习题-第5~8章【圣才出品】

第5章原子结构与元素周期性(一)思考题1.量子力学的轨道概念与波尔原子模型的轨道有什么区别和联系?答:(1)量子力学的轨道与波尔原子模型的轨道的联系:二者均是用于描述电子、种子、质子等微观粒子的运动。
(2)量子力学的轨道与波尔原子模型的轨道的区别:波尔原子模型的轨道概念是1913年由N.Bohr提出,该模型是建立在牛顿的经典力学理论基础上的,认为微观粒子遵循经典力学的运动规律,电子在原子核外某个确定的原形轨道,但实际上粒子微小、运动速度又极快且在极小的原子体积内运动,根本不遵循经典力学的运动规律。
所以它只能解释单电子原子(离子)光谱的一般现象,不能解释多电子原子光谱,具有一定的局限性;量子力学的轨道概念是1923年薛定谔提出,该模型是建立在波粒二象性的基础上,认为微观粒子不仅具有粒子性,也具有波动性,电子在原子核外某个空间范围内运动,原子中个别电子运动的轨迹是无法确定,没有确定的轨道。
但是电子的运动呈现一定的规律性,可用量子力学理论的电子云进行描述。
2.量子力学原子模型是如何描述核外电子运动状态的?答:用四个量子数描述核外电子运动状态,它们分别是:主量子数-描述原子轨道的能级;副量子数-描述原子轨道的形状;磁量子数-描述原子轨道的伸展方向;自旋量子数-描述电子的自旋方向。
3.下列各组量子数哪些是不合理的?为什么?表5-1答:(2)、(3)不合理。
当n=2时,l只能是0.1,而(2)中的l=2;当l=0时,m只能是0,而(3)中的m却为+1。
4.为什么任何原子的最外层最多只能有8个电子,次外层最多只能有18个电子?答:由于有能级交错的现象,使得轨道的能级次序发生变化,当电子层数(n)较大时,电子填充到轨道的次序为:可见,最外层为nsnp轨道,最多只能填充8个电子;而次外层最多只能填充轨道,即最多有18个电子。
5.为什么周期表中各周期的元素数目并不一定等于原子中相应电子层的电子最大容量数()?答:由于能级交错的原因。
天津大学《无机化学》课程教学大纲

天津大学《无机化学》课程教学大纲一.课程的性质与目的无机化学是化学的一个分支,是高等学校化学、化工、药学、轻工、材料、纺织、环境、冶金地质等类有关专业的第一门化学基础课。
本课程的任务是:提供化学反应的基本原理、物质结构的基础理论、元素及其化合物的基础知识。
其目的是培养学生具有解决一般无机化学问题、自学无机化学书刊的能力。
因此它是培养上述各类专业技术人才的整体知识结构及能力结构的重要组成部分,同时也为后继化学及其它课程打下基础。
二.教学基本要求1. 在教学过程中,注意运用辩证唯物主义观点和科学思维方法阐明问题,结合科技和学科发展的实际,适当反映现代无机化学的新知识、新领域,注意理论联系实际,培养学生分析问题和解决问题的能力。
2. 基本要求大体划分三个层次:“了解”(或“学习” )、“理解”(或“熟悉” )、“掌握”(或“学会”、“能” ),这三个层次的要求依次提高。
三.教学内容1. 理论部分(1)化学反应速率了解化学反应速率方程(质量作用定律)和反应级数的概念。
能用活化能和活化分子概念说明浓度、分压、温度、催化剂对均相反应速率的影响。
了解影响多相反应速率的因素。
(2)化学平衡掌握化学平衡概念及平衡移动规律,理解反应速率和化学平衡在实际应用中需综合考虑的必要性。
掌握弱电解质的解离度、稀释定律、溶液的酸碱性和pH值、解离平衡(含分级解离平衡)、盐的水解、同离子效应、缓冲溶液、溶解-沉淀平衡、溶度积规则、氧化还原平衡和电极电势、配位平衡等内容,并能分析多重平衡系统中的成分及其相互影响。
能用平衡常数(Kθ)进行有关计算。
能计算一元弱酸、一元弱碱的解离平衡组成以及同离子效应和缓冲溶液的pH值。
能用溶度积规则判断沉淀的产生、溶解。
能用氧化数法、离子电子法配平氧化还原方程式;能通过能斯特方程式计算说明浓度(含酸度)、分压对电极电势的影响;会用电极电势判断氧化剂、还原剂的相对强弱和氧化还原反应进行的方向;会应用元素标准电极电势图讨论元素的有关性质。
无机化学课件

玻尔理论
1913年,28岁的Bohr在 爱因斯坦的光子学说 普朗克的量子学说 氢原子的光谱实验 卢瑟福的有核模型
基础上,提出了H原子结构模型即Bohr模型。
第 5章 原子结构与元素周期性 5.1.2 原子轨道能级
第5章 原子结构与元素周期性
波尔氢原子模型
氢原子中的电子在原子核周围有确定半径 n越小, 离核越近, 轨道能量越低, 和能量的圆形轨道中运动。电子在这些轨 势能值越负 道上运动不吸收能量或放出能量 En/J n 1 -2.17910-18 2 -5.4510-19 3 -2.4210-19 4 -1.3610-19 5 -8.7210-20 6 -6.0510-20
③ 同一亚层内的各原子轨道, 在没有外加磁场下,
能量是相等的, 称等价轨道 (简并轨道) 。
E2px=E2py= E2pz; Edxy= Edyz=Edxz= Edz2=Edx2-y2
第5章 原子结构与元素周期性
第5章 原子结构与元素周期性
ι m
0 0
1 -1、0、+1
2 -2、-1、0、+1 、+2
x
s 轨道,球形 p 轨道,哑铃形 d 轨道,花瓣形
dxy
dyz x
dxz
+ -d
x
+d 2 z
x2-y2
第5章 原子结构与元素周期性
第5章 原子结构与元素周期性
4f5 z 3 3 zr 2
第 5章 原子结构与元素周期性 5.2.4 电子云
第5章 原子结构与元素周期性
概率密度: | |2 表示电子在原子内核外某处出现的概率密度 电子云:| |2的空间图象 用小黑点的疏密 表示电子出现概率密度的相对大小 小黑点较密的地方, 如 1s的电子云 概率密度较大,单位 体积内电子出现的机 会多
大学无机化学第五章试题及答案

第五章 原子结构和元素周期表本章总目标:1:了解核外电子运动的特殊性,会看波函数和电子云的图形2:能够运用轨道填充顺序图,按照核外电子排布原理,写出若干元素的电子构型。
3:掌握各类元素电子构型的特征4:了解电离势,电负性等概念的意义和它们与原子结构的关系。
各小节目标:第一节:近代原子结构理论的确立 学会讨论氢原子的玻尔行星模型213.6E eV n =。
第二节:微观粒子运动的特殊性1:掌握微观粒子具有波粒二象性(h h P mv λ==)。
2:学习运用不确定原理(2h x P mπ∆•∆≥)。
第三节:核外电子运动状态的描述1:初步理解量子力学对核外电子运动状态的描述方法——处于定态的核外电子在核外空间的概率密度分布(即电子云)。
2:掌握描述核外电子的运动状态——能层、能级、轨道和自旋以及4个量子数。
3:掌握核外电子可能状态数的推算。
第四节:核外电子的排布1:了解影响轨道能量的因素及多电子原子的能级图。
2;掌握核外电子排布的三个原则:○1能量最低原则——多电子原子在基态时,核外电子尽可能分布到能量最低的院子轨道。
○2Pauli 原则——在同一原子中没有四个量子数完全相同的电子,或者说是在同一个原子中没有运动状态完全相同的电子。
○3Hund 原则——电子分布到能量简并的原子轨道时,优先以自旋相同的方式分别占据不同的轨道。
3:学会利用电子排布的三原则进行第五节:元素周期表认识元素的周期、元素的族和元素的分区,会看元素周期表。
第六节:元素基本性质的周期性掌握元素基本性质的四个概念及周期性变化1:原子半径——○1从左向右,随着核电荷的增加,原子核对外层电子的吸引力也增加,使原子半径逐渐减小;○2随着核外电子数的增加,电子间的相互斥力也增强,使得原子半径增加。
但是,由于增加的电子不足以完全屏蔽增加的核电荷,因此从左向右有效核电荷逐渐增加,原子半径逐渐减小。
2:电离能——从左向右随着核电荷数的增多和原子半径的减小,原子核对外层电子的引力增大,电离能呈递增趋势。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1927年,Davissson和 Germer应用Ni晶体进行电 子衍射实验,证实电子具有 波动性。
2020/11/15
无机化学
5.2.2 概率和概率密度
概率:电子在原子核外空间某处出现的机率。
量子力学认为,原子中个别电子运动的轨 迹是无法确定的,亦即没有确定的轨道,这一 点是与经典力学有原则的差别。但是原子中电 子在原子核外的分布还是有规律的:核外空间 某些区域电子出现的概率较大,而另一些区域 电子出现的概率较小。
可以观察到不连续的四条谱线
Hδ Hγ βH
aa
αH 为带状光谱
nm 410.2 434.1 486.1
2020/11/15
无机化学
656.3
波尔氢原子模型
氢原子中的电子在原子核周围有确定半径 和能n越量小的,圆离形核轨越道近中, 轨运道动能。量电越子低在,这些轨 道上运动不吸势收能能值量越或负放出能量
原子中电子的波函数ψ既然是描述电子云
运动状态的数学表达式,而且又是空间坐标的
函数,其空间图象可以形象地理解为电子运动
的空间范围,俗称”原子轨道”.为了避免与经
典力学中的玻尔轨道相混淆,又称为原子轨函
(原子轨道函数之意),亦即波函数的空间图象
就是原子轨道,原子轨道的数学表达式就是波
函数. 2020/11/15
无机化学
波函数的物理意义
Ψ2 :原子核外出现电子的概率密度。
电子云是电子
出现概率密度的 形象化描述。
2020/11/15
(a) 1s的 2 r
图及电子云
(b) 1s电子云的
无机化学
界面图
2. 原子轨道角度分布图
将波函数的角度分布部分(Y)作图,所 得的图象就称为原子轨道的角度分布图。
如氢原子的1s轨道的波函数为: Ψ1s = (1 /πa03)1/2 e-r/a0
2020/11/15
无机化学
5.2.1 电子的波粒二象性
20世纪初人们已经发现,光不仅有微粒的性质,而且 有波动的性质,即具有波粒二象性。
1924年,Louis de Broglie(德布罗意)认为:质量为m, 运动速度为υ的粒子,相应的波长为:
λ=h/mυ=h/p,
h=6.626×10-34J·s,Plank常量。
无机化学多媒体电子教案
第五章 原子结构和元素周期性
第一节原子与元素
第一节 原子与元素
2020/11/15
无机化学
5-1-3 原子轨道能级 氢原子光谱
日光通过棱镜分光,可得到红、橙、黄、 绿、青、蓝、紫连续变化的谱带
5-1-3 原子轨道能为连级续光aa谱
装有低压高纯H2(g)的放电管所发出的光, 通过棱镜分光后,在可见光区波长范围内,
h —Planck常数 ν —光的频率
∞ 7 6 5 4
656.5nm 486.1nm 434.1nm 410.2nm 397.2nm
n
E/10-19J
-2.42
3
-5.45
2
-21.79
1 Hα Hβ γHδ Hε H
ν=
En3-En2 h
=
-2.4210-19J- (-5.4510-19J) 6.62610-34J·s
其中径向部分为:R10(r) = 2(1/a0)3/2*e-r/a0 角度部分为: Y00 = (1/4π)1/2
2020/11/15
无机化学
对于2p轨道
以2pz为例(m 0)
2pz
1 4
1 2πa03
(r a0
)e-r / 2a0 cosq
其中 R(r) 1 ( 1 )3/ 2 ( r )e-r / 2a0 2 6 a0 a0
概率密度:电子在原子核外空间某处单位体
积内出现的概率。
2020/11/15
无机化学
5.2.3 原子轨道
1. 波函数
SchrÖdinger方程
2Ψ x 2
2Ψ y2
2Ψ z 2
8π2m h2
E
V
Ψ
Ψ :波函数 E:能量 V:势能
m:质量 h:Planck常数 x, y, z:空间直角坐标
2020/11/15
波尔理论的缺陷,促使人们去研究和建
立能描述原子内电子运动规律的量子力 学原子模型
2020/11/15
无机化学
无机化学多媒体电子教案
第五章 原子结构和元素周期性
第二节原子结构的近代概念
第二节
原子结构的近代概念
2020/11/15
无机化学
原子结构的近代概念
电子的波粒二象性 概率和概率密度 原子轨道 电子云 量子数
= 4.571014s-1
121.6nm 120.6nm 97.25nm 94.98nm 93.78nm 93.14nm
λ3→2= cν(光3→速2 )= 4.35710180m14·ss--11= 656.5nm
2020/11/15
无机化学
波尔氢原子模型
成功地解释了氢原子和类氢原子(如He+、 Li2+)的光谱现象, 推动了原子结构的发展 严重的局限性。只能解释单电子原子(或 离子)光谱的一般现象,不能解释多电子 原子光谱
无机化学
直角坐标( x,y,z) sinq sin z r cosq
r x2 y2 z2
Ψ x, y , z Ψ r ,q , R r Y q ,
2020/11/15
无机化学
在量子力学中是用波函数和与其对应的 能量来描述微观粒子的运动状态的.
Y (q )
2020/11/15
3 cosq
4π 无机化学
Y (q , ) 3 cosq A cosq 4
q 0 o 30 o
cosq 1 0.866
60 o 90 o 120 o 180o
0.5 0 -0.5 -1
Y2pz A 0.866A 0.5A 0 -0.5A -A
激发态(电子处于能
量较高的状态)
处于激发态的电子不稳定,要跳回到能量
较低的轨道, 以光的形式放出能量(即光谱
谱线对应的能量) En(2)-En(1)=hν
h — Planck常数 ν — 光的频率
2020/11/15
无机化学
0 -0.445
如
氢原子光谱中的Hα线
-0.605
-0-1.8.3762En2-En1= hν
n
En/J
1 -2.17910-18
2 -5.4510-19
3 -2.4210-19
n
4 -1.3610-19
5 -8.7210-20
6 -6.0510-20
2020/11/15
无机化学
波尔氢原子模型
正常状态下,原子中的电子尽可能在离核 最近、能量最低的轨道上运动(基态)
基态
吸收能量(跃迁) 放出能量
