重磅-初中化学酸碱盐知识点总结
初中化学酸碱盐总结知识点
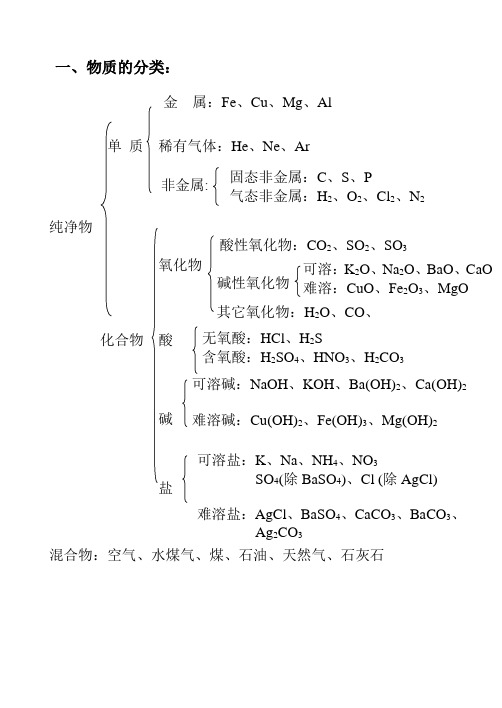
一、物质的分类:金属:Fe、Cu、Mg、Al单质稀有气体:He、Ne、Ar非金属:纯净物酸性氧化物:CO2、SO2、SO3氧化物碱性氧化物其它氧化物:H2O、CO、化合物酸碱盐混合物:空气、水煤气、煤、石油、天然气、石灰石可溶盐:K、Na、NH4、NO3SO4(除BaSO4)、Cl (除AgCl)难溶盐:AgCl、BaSO4、CaCO3、BaCO3、Ag2CO3可溶碱:NaOH、KOH、Ba(OH)2、Ca(OH)2难溶碱:Cu(OH)2、Fe(OH)3、Mg(OH)2无氧酸:HCl、H2S含氧酸:H2SO4、HNO3、H2CO3可溶:K2O、Na2O、BaO、CaO难溶:CuO、Fe2O3、MgO固态非金属:C、S、P气态非金属:H2、O2、Cl2、N2二、各类物质的主要化学性质:(见下图。
短线表示相互间能反应,箭号表示相互间能转化)1.单质: 1)金属:2)非金属 + 氧气 → 氧化物 2.氧化物:1)酸性氧化物:2)碱性氧化物:3)水:+2 Fe → Fe金属 + 氧气→ 氧化物金属 + 酸→盐 + 氢气(①H 前面的金属; ②不能是浓硫酸和硝酸)金属+盐→盐+金属(①排在前面的金属;②可溶性盐 酸性氧化物+ 水→酸 碱→盐+水(可溶性碱) 碱性氧化物+水→碱(可溶性碱) 酸→盐+水 酸性氧化物→酸 水+ 碱性氧化物→碱(可溶性碱) CuSO 4→CuSO 4·5H 2O3.酸:4.碱:石蕊变红;酚酞不变色酸+金属→盐+氢气(①H 前面的金属; ②不能是浓硫酸和硝酸) 酸 + 碱性氧化物→盐+水酸+碱→盐+水酸+盐→酸+盐(可溶反应物能生成↓、↑、H 2O ; 难溶反应物能生成↑、H 2O )石蕊变蓝;酚酞变红(可溶性碱)酸性氧化物→盐+水(可溶性碱) 酸→盐+水盐→盐+碱(反应物必须可溶且生成物之一必须是不溶物) 碱+5.盐:三、化学反应的基本类型:1)化合反应:(有单质时化合价改变)⑴单质 + 单质→ 化合物Mg + O 2 —— P + O 2 ——⑵单质 + 化合物 → 化合物 C + CO 2 ——⑶化合物 + 化合物 → 化合物 CaO + H 2O —— CuSO 4 + H 2O —— 2)分解反应:(有单质时化合价改变)⑴氧化物分解H 2O ——金属→盐+金属(①排在前面的金属;②可溶性盐) 酸→盐+酸(可溶反应物能生成↓、↑、H 2O ;难溶反应物能生成↑、H 2O )碱→盐+碱(反应物必须可溶且生成物之一必须是不溶物)盐→盐+盐(反应物必须可溶且生成物之一必须是不溶物)盐+H2O2——⑵酸分解H2CO3——⑶盐分解KClO3——CaCO3——CuSO4·5H2O ——Ca(HCO3)2——3)置换反应:(化合价一定改变)⑴金属+酸→盐+氢气(①H前面的金属;②不能是浓硫酸和硝酸)Fe + HCl—Zn + H2SO4—⑵金属+盐→盐+金属(①排在前面的金属;②可溶性盐)Fe + CuSO4—Cu + AgNO3—⑶金属氧化物 + H2(或C)→金属 + 水(或CO2)CuO + H2—C + Fe2O3——4)复分解反应:(化合价一定不变)⑴碱性氧化物 + 酸→盐 + 水Fe2O3 + HCl —CuO + H2SO4—⑵酸+碱→盐+水NaOH + H2SO4—Fe(OH)3 + HCl —⑶酸+盐→盐+酸(可溶反应物能生成↓、↑、H2O;难溶反应物能生成↑、H2O)H2SO4 + BaCl2—HCl + CaCO3—⑷碱+盐→碱+盐(反应物必须可溶且生成物之一必须是不溶物)Ca(OH)2 + Na2CO3—NaOH + FeCl3—⑸盐+盐→盐+盐(反应物必须可溶且生成物之一必须是不溶物)CaCl2+K2CO3—Ba(NO3)2 + Na2SO4—※不属于四种基本类型的反应:⑴金属氧化物+CO→金属+CO2Fe2O3+ CO ——CuO + CO ——⑵碱+酸性氧化物→盐+水(可溶性碱)NaOH + CO2—Ca(OH)2 + CO2—⑶有机物 + O2 →H2O + CO2C2H5OH + O2——CH4+ O2——☆氧化还原反应:得到氧的物质被氧化,发生氧化反应,是还原剂;失去氧的物质被还原,发生还原反应,是氧化剂。
九年级化学酸碱盐知识点总结

酸碱盐是化学中非常基础而又重要的知识点,它们在日常生活中无处不在。
以下是对九年级化学酸碱盐知识点的总结:一、酸碱盐的基本概念:1.酸:酸是指能够产生H+离子的物质。
常见的酸有硫酸、盐酸、硝酸等。
2.碱:碱是指能够产生OH-离子的物质。
常见的碱有氢氧化钠、氢氧化钾、氨水等。
3.盐:盐是酸和碱中和生成的物质。
常见的盐有氯化钠、硫酸铜、硝酸铵等。
二、酸碱的性质和酸碱中和反应:1.酸的性质:(1)酸有酸味,能腐蚀金属。
(2)酸能够改变红、蓝、紫色的性质。
(3)酸与碱反应能够生成盐和水。
2.碱的性质:(1)碱有碱味,能使植物脱水和腐蚀动物油脂。
(2)碱能够改变红、蓝、紫色的性质。
(3)碱与酸反应能够生成盐和水。
3.酸碱中和反应:酸和碱反应会产生盐和水。
它们的化学方程式为:酸+碱→盐+水。
例如:硫酸+氢氧化钠→硫酸钠+水三、酸碱指示剂:酸碱指示剂是一种能够通过颜色的变化来判断溶液是酸性、碱性还是中性的物质。
常见的酸碱指示剂有酚酞、酚红、甲基橙等。
四、盐的命名:盐的命名是根据其阳离子和阴离子的名称组合而成的。
一般来说,阳离子写在左边,阴离子写在右边。
例如:氯化钠、硫酸铜、硝酸铵等。
另外,一些过渡金属离子需要注明其氧化态,如二价铁离子是Fe2+。
五、酸碱盐的应用:酸碱盐广泛应用于日常生活和工业生产中:1.酸的应用:(1)酸可用于去除钙、镁等金属离子,软化水质。
(2)酸可用于清洁厕所、洗涤器具等。
2.碱的应用:(1)碱可用于制作肥皂和洗涤剂。
(2)碱可用于中和酸性土壤。
3.盐的应用:(1)食盐是人类生活中必备的调味品。
(2)一些盐可用于制作肥料。
(3)许多金属盐可用于制作染料和颜料等工业产品。
六、酸碱盐的鉴别方法:1.使用酸碱指示剂:通过颜色的变化来判断溶液的酸碱性质。
2.使用pH试纸:pH试纸通过pH颜色变化范围的不同来判断溶液的酸碱性质。
3.酸碱中和反应:通过观察是否产生气体、沉淀等来判断溶液的酸碱性质。
酸碱盐是化学中非常重要的概念,它们在日常生活中有着广泛的应用。
酸碱盐知识点总结

酸碱盐知识点总结
酸碱盐是一类具有一定特征的化学物质,它们可以溶于水形成具有明显的酸性或碱性的溶液。
1、酸:指能够与水反应形成质子(H+)的物质,如:硫酸、磷酸等;
2、碱:指能够与水反应形成氢氧根离子(OH-)的物质,如:氢氧化钠、氢氧化铵等;
3、盐:指酸和碱任意反应形成的物质,如:氢氧化钙、氢氧化镁等。
4、酸碱反应:在酸碱反应中,酸与碱反应后形成盐和水,即HCl + NaOH → NaCl + H2O,其中 HCl 为酸,NaOH 为碱,NaCl 为盐,H2O 为水。
5、pH值:pH值是衡量溶液酸碱度的一种标准,pH 值越大表示溶液越碱性,pH 值越小表示溶液越酸性。
6、Buffer solution:缓冲溶液是指当溶液中加入一定量的酸或碱时,可以抑制溶液pH值的变化,从而使溶液保持中性。
九年级化学酸碱盐知识点归纳

九年级化学酸碱盐知识点归纳一、酸碱盐的基本概念酸:电离时生成的阳离子全部是氢离子的化合物。
如:HCl、H2SO4、HNO3、CH3COOH 等。
碱:电离时生成的阴离子全部是氢氧根离子的化合物。
如:NaOH、KOH、Ca(OH)2、Ba(OH)2、NH3·H2O等。
盐:由金属离子(或铵根离子)和酸根离子组成的化合物。
如:NaCl、Na2CO3、CuSO4、NH4Cl等。
二、酸碱盐的通性酸的通性:使紫色石蕊试液变红,无色酚酞试液不变色。
与活泼金属反应生成盐和氢气。
与金属氧化物反应生成盐和水。
与碱反应生成盐和水。
与盐反应生成新盐和新酸。
碱的通性:使紫色石蕊试液变蓝,无色酚酞试液变红。
与非金属氧化物反应生成盐和水。
与酸反应生成盐和水。
与盐反应生成新盐和新碱。
盐的通性:有些盐能与酸反应生成新盐和新酸。
有些盐能与碱反应生成新盐和新碱。
有些盐能与某些盐反应生成两种新盐。
三、酸碱盐之间的反应酸碱中和反应:酸和碱反应生成盐和水,这类反应属于复分解反应。
如:HCl + NaOH = NaCl + H2O。
盐与酸的反应:生成新盐和新酸。
如:Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑。
盐与碱的反应:生成新盐和新碱。
如:CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4。
盐与盐的反应:生成两种新盐。
如:Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl。
四、酸碱盐在生活中的应用酸:用于清洁金属表面、除锈、生产化肥等。
碱:用于中和酸性废水、生产洗涤剂、肥皂等。
盐:用于调味、防腐、生产化学原料等。
五、常见的酸碱指示剂紫色石蕊试液:遇酸变红,遇碱变蓝。
无色酚酞试液:遇酸不变色,遇碱变红。
六、溶液的酸碱度pH值:表示溶液酸碱度的数值,范围为0-14。
pH < 7为酸性,pH = 7为中性,pH > 7为碱性。
酸碱指示剂与pH试纸:用于测定溶液的酸碱度。
七、常见的酸碱盐及其性质盐酸(HCl):无色液体,具有刺激性气味,能与多种物质发生反应。
初三化学酸碱盐知识点(最全整理版)

初三化学酸碱盐知识点(最全整理版)一、酸性溶液和碱性溶液结论:〔1〕但凡能使紫色石蕊试液变红的溶液都是酸性溶液,并且该溶液不能使无色酚酞试液变色;〔2〕但凡能使紫色石蕊试液变蓝的溶液都是碱性溶液,并且该溶液能使无色酚酞试液变红;〔3〕不能使紫色石蕊试液变色,也不能使无色酚酞试液变色的溶液,我们称为中性溶液。
〔4〕如紫色石蕊试液及无色酚酞等能检验溶液酸碱性的试液,称为酸碱指示剂。
注意:①我们有时候还用蓝色或红色石蕊试纸来检验溶液的酸碱性;②酸性溶液能使蓝色石蕊试纸变红,碱性溶液能使红色石蕊试纸变蓝;③只有可溶性的酸性、碱性物质才能使指示剂变色,变色的是指示剂,而不是该物质。
2.日常生活中常见的酸性物质与碱性物质〔1〕酸性物质:山楂、柠檬、柑橘、西红柿等;〔2〕碱性物质:茶叶碱、烟碱等。
3.区分酸溶液和酸性溶液、碱溶液和碱性溶液注意:酸溶液是指酸的水溶液,酸性溶液是指能使紫色石蕊试液变红的溶液,因此酸溶液一定是酸性溶液,而酸性溶液不一定是酸溶液;同样,碱性溶液不一定是碱溶液,碱溶液一定是碱性溶液。
例如:硫酸铜、氯化铵的水溶液显酸性,而不是酸;纯碱、肥皂的水溶液显碱性,但不是碱。
4.补充知识:酸、碱、盐的概念〔1〕酸:电离时生成的阳离子全部是氢离子的化合物。
如:HCl、HNO3、H2SO4、H2CO3等。
HCl==H++Cl-;H2SO4==2H++SO42-;〔2〕碱:电离时生成的阴离子全部是氢氧根离子的化合物。
如:NaOH、Ca(OH)2等。
NaOH==Na++OH-;Ca(OH)2==Ca2++2OH-;〔3〕盐:电离时生成金属离子〔或铵根离子〕和酸根离子的化合物。
如:NaCl、NH4NO3等。
NaCl==Na++Cl-;NH4NO3==NH4++NO3-;二、溶液的酸碱性的强弱1.酸碱度:用来表示溶液的酸性或碱性的强弱程度。
2.pH试纸用来定量的测定溶液的酸碱度。
溶液的pH值与酸碱性关系:pH=7,溶液呈中性;pH7,溶液呈碱性,且pH越大,碱性越强。
中考化学:酸碱盐总结版

专题六知识点一:常见的酸、碱、盐1. 酸金属和酸性溶液的反应条件:在金属活动性顺序表中,金属要排在氢前。
浓硫酸、硝酸跟金属反应不能生成氢气。
铁发生置换反应时,生成+2价的铁的化合物(比如FeCl 2,而不是FeCl 3)。
浓硫酸可用来洗气干燥(长进短出)。
酸酸的组成:酸 H + + 酸根离子常 见 的 酸盐酸硫酸浓盐酸的性质:无色液体,有刺激性气味,具有挥发性,打开瓶盖后可以看见白雾(盐酸小液滴),敞口放置后溶质挥发,溶质质量分数变小;稀盐酸化学性质:可与酸碱指示剂、金属、金属氧化物、碱、盐等发生化学反应; 用途:重要的化工原料。
用于金属表面除锈、精炼石油、制造药物等。
浓硫酸的性质:粘稠油状液体,无气味,具有吸水性、脱水性(碳化现象)、强氧化性,溶于水时放出大量的热,敞口放置后溶剂增多,溶质质量分数变小; 稀硫酸的化学性质:可与酸碱指示剂、金属、金属氧化物、碱、盐等发生化学反应。
用途:重要的化工原料。
用于生产化肥、农药、火药、冶炼金属、金属除锈等碱碱的组成:碱 OH - + 金属离子(或NH )常见 的 碱氢氧化钠 苛性钠、火碱、烧碱氢氧化钙 熟石灰、消石灰 物理性质:白色固体、颗粒,极易溶于水,溶于水时放出大量的热,易潮解;化学性质:可与酸碱指示剂、非金属氧化物、酸、盐等发生化学反应,有强腐蚀性,暴露在空气中会结合CO 2发生变质;用途:重要的化工产品。
广泛用于肥皂、石油、造纸、纺织等。
物理性质:白色粉末状固体,微溶于水;化学性质:可与酸碱指示剂、非金属氧化物(CO 2、SO 2)、酸、碱、盐等发生化学反应,有腐蚀性;用途:建筑业上常用来砌砖抹墙;农业上用来降低土壤的酸性,改良土壤结构,还用它来配制农药波尔多液等。
怎么判断?补充:1、注意区分酸溶液和酸性溶液、碱溶液和碱性溶液:酸溶液是指酸的水溶液,而酸性溶液是指能使紫色石蕊试液变红的溶液,因此,酸溶液一定是酸性溶液,而酸性溶液不一定是酸溶液;同样,碱性溶液不一定是碱溶液,碱溶液一定是碱性溶液。
常见酸碱盐知识归纳

常见酸碱盐知识归纳 Revised by Petrel at 2021酸碱盐知识归纳一、组成:1、酸的组成——氢离子+酸根离子2、碱的组成——金属离子+氢氧根离子3、盐的组成——金属离子+酸根离子(铵根离子+酸根离子)4、复分解反应——由两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应。
A B+C D=A D+C B5、稀释浓硫酸的方法——一定要把浓硫酸沿着器壁慢慢地注入水里,并不断搅动,使产生的热量迅速地扩散,切不可把水倒入浓硫酸里。
6、中和反应——酸跟碱作用生成盐和水的反应叫做中和反应。
二、熟记常见元素和原子团的化合价口诀:(正价)一氢钾钠银,二钙镁钡锌,三铝、四硅、五氮磷。
(负价)负一价:氟、氯、溴、碘;负二价:氧和硫。
(可变正价):一二铜汞,二三铁,二四碳,四六硫。
原子团的化合价:负一价:氢氧根(OH—),硝酸根(NO3—),氯酸根(ClO3—),高锰酸根(M n O4—);负二价:硫酸根(SO42—),碳酸根(CO32—),亚硫酸根(SO32—),锰酸根(M n O42—);负三价:磷酸根(P O43—);正一价:铵根(N H4+)。
三、熟记下列反应方程式:(一)酸的性质(1)与指示剂反应紫色石蕊试液变红色,无色酚酞试液不变色。
(2)酸+碱=盐+水。
(3)酸+某些金属氧化物=盐+水。
(4)酸+活泼金属=盐+氢气。
(5)酸+盐=新盐+新酸。
1、锌跟稀盐酸反应:Zn+2HCl=ZnCl2+H2↑有气泡产生,2、锌跟稀硫酸反应:Zn+H2SO4=ZnSO4+H2↑锌粒逐渐减少。
3、铁跟稀盐酸反应:Fe+2HCl=FeCl2+H2↑有气泡产生,铁逐渐减少4、铁跟稀硫酸反应:Fe+H2SO4=FeSO4+H2↑溶液变成浅绿色5、铁锈跟稀盐酸反应:Fe2O3+6HCl=2FeCl3+3H2O红色铁锈逐渐消失,6、铁锈跟稀硫酸反应:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O溶液变成黄色7、氧化铜跟稀盐酸反应:CuO+2HCl=CuCl2+H2O黑色氧化铜逐渐消失,8、氧化铜跟稀硫酸反应:CuO+H2SO4=CuSO4+H2O溶液变成蓝色9、氢氧化铜跟稀盐酸反应:Cu(OH)2+2HCl=CuCl2+2H2O蓝色沉淀消失10、氢氧化铜跟稀硫酸反应:Cu(OH)2+H2SO4=CuSO4+2H2O变成蓝色溶液(二)碱的性质:(1)碱溶液能使紫色石蕊试液变蓝色,无色酚酞试液变红色。
常见酸碱盐知识归纳

酸碱盐知识归纳一、组成:1、酸的组成——氢离子+酸根离子2、碱的组成——金属离子+氢氧根离子3、盐的组成——金属离子+酸根离子(铵根离子+酸根离子)4、复分解反应——由两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应。
AB+CD=AD+CB5、稀释浓硫酸的方法——一定要把浓硫酸沿着器壁慢慢地注入水里,并不断搅动,使产生的热量迅速地扩散,切不可把水倒入浓硫酸里。
6、中和反应——酸跟碱作用生成盐和水的反应叫做中和反应。
二、熟记常见元素和原子团的化合价口诀:(正价)一氢钾钠银,二钙镁钡锌,三铝、四硅、五氮磷。
(负价)负一价:氟、氯、溴、碘;负二价:氧和硫。
(可变正价):一二铜汞,二三铁,二四碳,四六硫。
原子团的化合价:负一价:氢氧根(OH—),硝酸根(NO3—),氯酸根(ClO3—),高锰酸根(MnO4—);负二价:硫酸根(SO42—),碳酸根(CO32—),亚硫酸根(SO32—),锰酸根(MnO42—);负三价:磷酸根(PO43—);正一价:铵根(NH4+)。
三、熟记下列反应方程式:(一)酸的性质(1)与指示剂反应紫色石蕊试液变红色,无色酚酞试液不变色。
(2)酸+碱=盐+水。
(3)酸+某些金属氧化物=盐+水。
(4)酸+活泼金属=盐+氢气。
(5)酸+盐=新盐+新酸。
1、锌跟稀盐酸反应:Zn + 2HCl = ZnCl2 + H2↑ 有气泡产生,2、锌跟稀硫酸反应:Zn + H2SO4 = ZnSO4 + H2↑锌粒逐渐减少。
3、铁跟稀盐酸反应:Fe + 2HCl = FeCl2 + H2↑ 有气泡产生,铁逐渐减少4、铁跟稀硫酸反应:Fe + H2SO4 =FeSO4 + H2↑ 溶液变成浅绿色5、铁锈跟稀盐酸反应:Fe2O3 +6HCl = 2FeCl3 + 3H2O 红色铁锈逐渐消失,6、铁锈跟稀硫酸反应:Fe2O3+ 3 H2SO4 = Fe2(SO4)3 + 3H2O 溶液变成黄色7、氧化铜跟稀盐酸反应:CuO + 2HCl =CuCl2 +H2O 黑色氧化铜逐渐消失,8、氧化铜跟稀硫酸反应:CuO + H2SO4= CuSO4 + H2O 溶液变成蓝色9、氢氧化铜跟稀盐酸反应:Cu(OH)2 + 2HCl = CuCl2 + 2H2O 蓝色沉淀消失10、氢氧化铜跟稀硫酸反应:Cu(OH)2 + H2SO4 = CuSO4 + 2H2O 变成蓝色溶液(二)碱的性质:(1)碱溶液能使紫色石蕊试液变蓝色,无色酚酞试液变红色。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初中化学酸碱盐知识点总结一、物质的分类:二、各类物质的主要化学性质:1.单质:1)金属:2)非金属+氧气→氧化物2.氧化物:1)酸性氧化物:2)碱性氧化物:3)水: 3.酸:4.碱:5.盐: 三、化学反应的基本类型:1)化合反应:(有单质时化合价改变)酸性氧化物→酸 水+ 碱性氧化物→碱(可溶性碱)CuSO 4→CuSO 4·5H 2O 金 属:Fe 、Cu 、Mg 、Al 单 质 稀有气体:He 、Ne 、Ar非金属 纯净物 酸性氧化物:CO 2、SO 2、SO 3氧化物 碱性氧化物 其它氧化物:H 2O 、CO 、Fe 3O 4化合物 酸 物质 碱 盐 混合物:空气、水煤气、煤、石油、天然气、石灰石 可溶盐:K +、Na +、NH 4+、NO 3-、SO 42-(除BaSO 4)、Cl - (除AgCl) 难溶盐:AgCl 、BaSO 4、CaCO 3、BaCO 3、Ag 2CO 3 可溶碱:NaOH 、KOH 、Ba(OH)2、Ca(OH)2 难溶碱:Cu(OH)2、Fe(OH)3、Mg(OH)2 无氧酸:HCl 、H 2S 含氧酸:H 2SO 4、HNO 3、H 2CO 3、H 3PO 4 可溶:K 2O 、Na 2O 、BaO 、CaO 难溶:CuO 、Fe 2O 3、MgO固态非金属:C 、S 、P 气态非金属:H 2、O 2、Cl 2、N 2⑴单质+单质→化合物Mg+O2=P+O2=⑵单质+化合物→化合物C+CO2=⑶化合物+化合物→化合物CaO+H2O=CuSO4+H2O= 2)分解反应:(有单质时化合价改变)⑴氧化物分解H2O=HgO=⑵酸分解H2CO3=⑶盐分解KMnO4=KClO3=CaCO3=CuSO4·5H2O=3)置换反应:(化合价一定改变)⑴金属+酸→盐+氢气(①H前面的金属;②不能是浓硫酸和硝酸)Fe+HCl=Al+H2SO4=⑵金属+盐→盐+金属(①排在前面的金属;②可溶性盐)Fe+CuSO4=Cu+AgNO3=⑶金属氧化物+H2(或C)→金属+水(或CO2)CuO+H2=C+Fe2O3=4)复分解反应:(化合价一定不变)⑴碱性氧化物+酸→盐+水Fe2O3+HCl=CuO+H2SO4=⑵酸+碱→盐+水NaOH+H2SO4=Fe(OH)3+HCl=⑶酸+盐→盐+酸(可溶反应物能生成↓、↑、H2O;难溶反应物能生成↑、H2O)H2SO4+BaCl2=HCl+CaCO3=⑷碱+盐→碱+盐(反应物必须可溶且生成物之一必须是不溶物)Ca(OH)2+Na2CO3=NaOH+FeCl3=⑸盐+盐→盐+盐(反应物必须可溶且生成物之一必须是不溶物)CaCl2+K2CO3=Ba(NO3)2+Na2SO4=※不属于四种基本类型的反应:⑴金属氧化物+CO→金属+CO2Fe2O3+CO=⑵碱+酸性氧化物→盐+水(可溶性碱)NaOH+CO2=⑶有机物+O2→H2O+CO2C2H5OH+O2=☆氧化还原反应:得到氧的物质被氧化,发生氧化反应,是还原剂;失去氧的物质被还原,发生还原反应,是氧化剂。
如:在2Mg+CO2点燃2MgO+C中,是氧化剂,是还原剂,被氧化,被还原。
☆常见的原子团及其化合价:四、金属活动性顺序和复分解反应发生的条件:1.金属活动性顺序:KCaNaMgAlZnFeSnPb(H)CuHgAgPtAu ———————————————————————→金属活动性由强逐渐减弱1、金属位置越靠前,金属活动性就越强;2、位于氢前面的金属能置换出酸中的氢;3、前面的金属能把后面的金属从它们的盐溶液中置换出来。
⑴判断金属与酸反应时:金属必须排在(H)前面;酸不可用硝酸。
⑵判断金属与盐反应时:必须同时满足①排在前面的金属;②可溶性盐。
2.复分解反应发生的条件:⑴可溶的反应物,能生成↓、或H2O、或↑(CO2或NH3)⑵难溶的反应物,能生成↑、或H2O☆复分解反应生成的沉淀:五、物质的鉴别、鉴定(检验)、提纯(除杂)、分离:六、气体的干燥:注意:酸性干燥剂不能用于干燥碱性气体;碱性干燥剂不能用于干燥酸性气体。
七、其他:1.物质的学名、俗名及化学式:⑴水银、汞、Hg⑵金刚石、石墨、C;硫磺、S;红磷、白磷、P⑶干冰、固体CO2⑷生石灰、氧化钙、CaO;氨气、NH3(碱性气体)⑸盐酸、氢氯酸、HCl;氢硫酸、H2S;亚硫酸、H2SO3⑹熟石灰、消石灰、Ca(OH)2;苛性钠、烧碱、火碱、NaOH;氨水、NH3·H2O(碱)⑺纯碱、Na2CO3;碳酸钠晶体、纯碱晶体、Na2CO3·10H2O;碳酸氢钠、小苏打、NaHCO3;亚硝酸钠、NaNO2(工业用盐);胆矾、蓝矾、硫酸铜晶体、CuSO4·5H2O;铜绿、Cu2(OH)2CO3⑻甲烷、CH4;甲醇、CH3OH;酒精、乙醇、C2H5OH;醋酸、乙酸、(冰醋酸)CH3COOH2.常见混合物的主要成分:煤:C;石油:C、H、O元素天然气:CH4水煤气:H2、CO石灰石、大理石:CaCO3石灰水、石灰乳、石灰浆:Ca(OH)23.常见物质的颜色:△白色固体:MgO、P2O5、CaO、NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4△银白色:镁、铝、锌、铁、汞(液态)△黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4△红色固体:Cu、Fe2O3、HgO、红磷△蓝色晶体:CuSO4·5H2O△KMnO4为紫黑色△硫:淡黄色△Cu2(OH)2CO3为绿色4.溶液的颜色:△含Cu2+的溶液呈蓝色(CuCl2溶液为蓝绿色);△含Fe2+的溶液呈浅绿色;△含Fe3+的溶液呈黄色;△其余溶液一般为无色。
(高锰酸钾溶液为紫红色)5.溶于水放热的物质:CaO、NaOH固体、浓H2SO46.刺激性气味的气体:NH3、SO2、HCl(均无色)▲刺激性气味的液体:盐酸、硝酸、醋酸▲酒精为有特殊气体的液体7.有毒的物质:CO、CH3OH、NaNO2、Cu2+(如CuSO4)、Ba2+(如BaCl2)初中化学知识点总结-----酸碱盐提要:酸碱盐是初中化学的重点和难点,本文力求把相关内容按知识呈现的规律,让你掌握这些知识后就能对酸碱盐的复习有所突破。
一、溶液的导电性1、有些化合物的水溶液能够导电的原因是什么?------原因是溶液中有自由移动的离子。
2、哪些物质的水溶液能够导电?---------------------------酸、碱、盐的水溶液能够导电。
二、酸、碱、盐的概念1、什么是酸?电离时生成的阳离子全部是氢离子(H+)的化合物叫做酸。
可表示为:酸---→氢离子(阳离子)+酸根离子(阴离子)如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)、碳酸(H2CO3)2、什么是碱?电离时生成的阴离子全部是氢氧根离子(OH-)的化合物叫做碱。
可表示为:碱---→金属离子(阳离子)+氢氧根离子(阴离子)如:氢氧化钠(NaOH)、氢氧化钙[Ca(OH)2]、氨水(NH3·H2O)3、什么是盐?由金属离子和酸根离子组成的化合物叫做盐。
可表示为:盐---→金属离子(阳离子)+酸根离子(阴离子)如:氯化钠NaCl、碳酸钠(Na2CO3)、硝酸银(AgNO3)碳酸氢钠(NaHCO3)三、常见的酸及酸的通性12、酸的通性(具有通性的原因:酸溶液中都有氢离子)(1)与酸碱指示剂的反应:酸溶液能使紫色石蕊试液变红色,不能使无色酚酞试液变色。
(2)金属+酸→盐+氢气(置换反应)条件:(1)金属:在金属活动性顺序中排在氢前面的金属;(2)酸:无氧化性酸。
如盐酸、稀硫酸(除外:浓硫酸、硝酸有氧化性与金属反应不生成氢气)。
[注意]铁与酸发生置换反应时生成亚铁盐(Fe为+2价)(3)金属氧化物+酸→盐+水(复分解反应)(4)碱+酸→盐+水(复分解反应)(5)盐+酸→另一种盐+另一种酸(复分解反应)条件:生成物中沉淀、气体或水。
练习:利用酸的通性写出四个生成氯化镁的化学方程式3三、常见的碱的物理性质、俗名、制法及用途2、碱的通性(具有通性的原因:碱溶液中都有氢氧根离子)(1)与酸碱指示剂的反应:碱溶液使紫色石蕊试液变蓝色,使无色酚酞试液变红色(难溶于水的碱不能使指示剂变色)(2)非金属氧化物+碱→盐+水(不是复分解反应)(3)酸+碱→盐+水(4)盐+碱→另一种盐+另一种碱条件:反应物均可溶,生成物中有沉淀、气体或水。
注:常见沉淀:白色----AgCl↓、BaSO4↓、Mg(OH)2↓、BaCO3↓、CaCO3↓蓝色---Cu(OH)2↓红褐色----Fe(OH)3↓四、复分解反应1、定义:由两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应。
2、符号表示:AB+CD=AD+CB3、本质:是溶液中的离子结合成难电离的物质(如水)、难溶的物质或气体,而使复分解反应趋于完成。
(可简记为:碱--盐、盐--盐水中溶,沉淀、气体、水生成。
)4、反应发生的条件:注:在复分解反应中,所有元素的化合价在反应前后都不变。
五、中和反应溶液酸碱度的表示法——pH1、中和反应的定义:酸与碱作用生成盐和水的反应叫中和反应。
中和反应属于复分解反应。
2、中和反应的应用:(1)改变土壤的酸碱性(2)处理工厂的废水(3)用于医药3、溶液酸碱度的表示法——pH(1)pH与溶液酸碱性的关系(记忆:小7酸,大7碱,是7中性显)0714酸性增强中性碱性增强(2)pH的测定:最简单的方法是使用pH试纸用玻璃棒(或滴管)蘸取待测试液少许,滴在pH试纸上,显色后与标准比色卡对照,读出溶液的pH(读数为整数)(3)酸雨:正常雨水的pH约为5.6(因为溶有CO2)pH<5.6的雨水为酸雨。
