药物临床试验立项表
药物临床试验立项资料目录

□是□否
9
招募受试者相关资料,包括广告和宣传册等(注明版本号和日期)
区是□否
□是□否
10
申办方的资质证明(营业执照,药品生产许可证、GMP证书等)
区是□否
□是□否
11
CRO的资质证明和委托书
区是□否
□是□否
12
药检报告、说明书
区是□否
□是□否
13
原始病历或研究病历等
区是□否
□是□否
14
主要研究者简历(含GCP证书复印件)
5.欲委托主要研究者(P
6.主要研究者在研项目:评估意见:同意□,不值专业组负员
F估和审核:
J受试人群:是口,否口
J试验时间:是口,否口
t备和其他技术条件:是口,否口
Z分及药理作用相同的在研项目:无口,1项□,2项口,2项以上□
I).
无口,1项□,2项口,3项口,3项以上口
]意口
f人审核签字:
年月日
是口否口
是口否口
7
知情同意书(包括译文)及其他书面资料
是口否口
是口否口
8
原始病历和/或病例报告表
是口否口
是口否口
9
试验用药物药检报告(试验药和对照药)
是□否口
是口否口
10
研究者手册
是口否口
是口否口
11
申办单位资质证明文件
是口否口
是□否□
12
研究者履历、GCP证书、资质等
是口否口
是口否口
13
受试者招募广告(如有)
是口否口
是口否口
14
组长单位伦理批件(如本中心为参加单位)
是口否□
是口否口
临床研究立项审批申请表

项目负责人目前承担项目情况
项目名称
开始时间/预计完成时间
预计承担/已入组/已完成例数
是否与将开展项目竞争病源
0
xxxx年1月/xxxx年1月
//
0
0
xxxx年1月/xxxx年1月
//
0
0
xxxx年1月/xxxx年1月
//
0
0
xxxx年1月/xxxx年1月
//
0
0
4.研究流程及进度安排
5.研究预期风险及获益
是否为多中心研究
组长单位及项目负责人
生物样本检测单位及项目负责人
xxxx-1-0
研究经费
经费来源
(经费直接拨付单位)
联系人:
0
手机:
0
提交资料
以注册为目的的临床试验
项目负责人简历
姓名
专业
0
学位
0
技术职称/职务
近5年是否接受过相关GCP培训?
既往是否参加或承担过类似试验?
xxxx年1月/xxxx年1月
//
0
0
xxxx年1月/xxxx年1月
//
否
申请人意见
签名: 日期: 年 月 日
主管部门意见
签名: 日期: 年 月 日
管理委员会意见
签名: 日期: 年 月 日
临床研究立项审批申请表
申请日期:申请编号:
项目名称
0
本院负责人姓名
0
联系方式
手机:
e-mail:
本院研究助理(key sub I)姓名
0
联系方式
手机:
e-mail:
项目类别
药物临床试验立项所需材料【模板】

药物临床试验立项所需材料:
1) 送审文件清单
2) 国家食品药品监督管理总局《药物临床试验批件》或《药品注册批件》(如适用)
3) 申办者的资质证明(营业执照,药品生产许可证、GMP证书等)及更新资质证明
4) CRO的资质证明和委托书(如有)
5) 组长单位的批件(如适用)
6) 药检报告(包括试验药、对照药和安慰剂)
7) 试验药与安慰剂GMP证书{药品生产委托书(附翻译)(如有)}
8) 受试产品说明书,对照药品购买记录等证明文件,进口药品清关单(如适用)
9) 研究者手册(注明版本号和日期)
10) 主要研究者简历
11) 主要研究者GCP证书及执业资格证
12) 临床试验方案(中英文版)(含有单独一张所有研究者签字页)(注明版本号和日期,申办者和研究者双方签字)
13) 病例报告表(CRF)(注明版本号和日期)
14) 知情同意书(注明版本和日期)
15) 受试者筛选入选记录表样表
16) 研究者签名样张及分工授权表
17) 药物临床试验受试者签认代码表样表
18) 申办者资料真实性声明
19) 保险证明(如有)
20) 临床试验的申办者与临床试验批件申请者不一致,需提供相关证明
21) 其他需要审查的资料,如患者日记、患者卡片等受试者相关资料,招募广告等(如适用)
22) 其他药物临床试验相关问卷等(如有)
23) 避免怀孕告知书(如适用)
24)其他(上述未涵盖内容)信息和。
(完整版)药物临床试验项目立项评估表
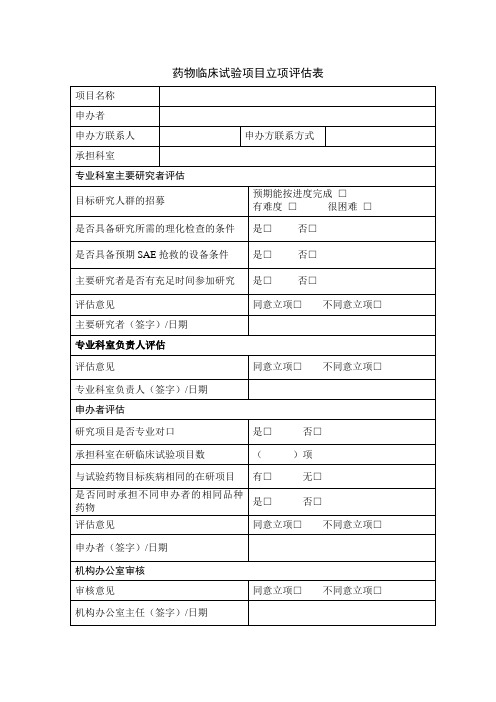
项目名称
申办者
申办方联系人
申办方联系方式
承担科室
专业科室主要研究者评估
目标研究人群的招募
预期能按进度完成□
有难度□很困难□
是否具备研究所需的理化检查的条件
是□否□
是否具备预期SAE抢救的设备条件
是□否□
主要研究者是否有充足时间参加研究
是□否□
评估意见
同意立项□不同意立项□
主要研究者(签字)/日期
专业科室负责人评估
评估意见
同意立项□不同意立项□
专业科室负责人(签字)/日期
申办者评估
研究项目是否专业对口
是□否□
承担科室在研临床试验项目数
()项
与试验药物目标疾病相同的在研项目
有□无□
是否同时承担不同申办者的相同品种药物
是□否□
评估意见
同意立项□不同意立项□
申办者(签字)/日期
机构办公室审核
审核意见
同意立项□不同意立项□
机构办公室主任(Βιβλιοθήκη 字)/日期
药物临床试验项目立项申请表

专业组负责人审核签名:日期:年月日
主要研究者申请及声明:
经专业组负责人同意,我作为主要研究者拟申请该项临床试验研究。本科室从受试者来源、设备条件、研究团队以及工作态度等方面均能满足该试验的开展,特此提出申请。
在临床试验全过程,我将严格执行CFDA颁发的《药物临床试验质量管理规范》,客观、真实的提供试验数据,充分保障受试者的合法权益,保证按时、高质量的完成药物临床试验项目。如有失实,我愿意承担相关责任。
联系电话:
本专业组对试验的评估以及专业组负责人的审核:
1、受试者的受益是否大于风险:口是口否
2、是否能保证招募足够的受试人群:口是口否
3、研究者是否具备足够的试验时间:口是口否4Βιβλιοθήκη 项目在本院是否有实施的可行性:口是口否
5、是否具备相应的仪器设备和其他技术条件:口是口否
6、欲委托医生作为本项目的主要研究者(Pl)
药物临床试验项目立项申请表
试验项目名称:
临床试验通知书/药品注册批件号:
申办单位:
联系人及电话:
CRO:
联系人及电话:
试验设计:口对照口非对照/口单盲口双盲口开放/口随机口非随机
口平行口交叉/口优效性口非劣性口等效性/口其它
药物类别口中药/天然药物口化学药口生物制品第类
试验分期:口1期口π期口ι11期口w期口其他
申请人(主要研究者)签名:日期:年月日
药物剂型:
药物规格:
药物适应症:
药物批号:
有效期:
生产日期:
是否进口注册:口否口是,进口许可证
批号:
是否国际多中心:口是口否
组长单位:
组长单位主要研究者:
整个试验计划完成例数:
临床试验立项申请表药物
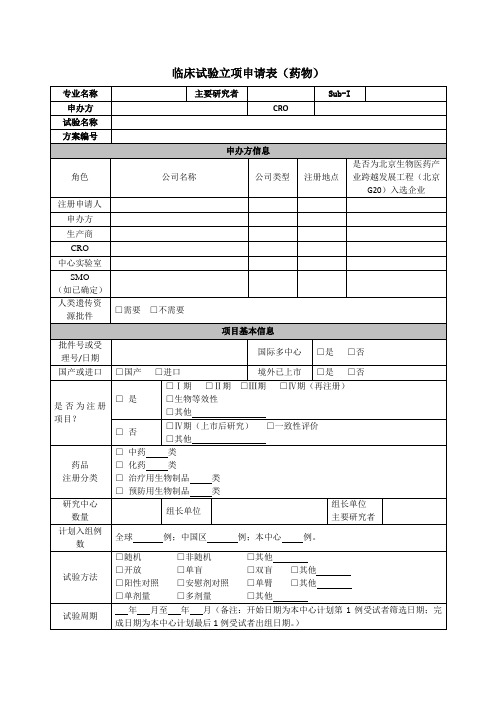
专业名称
主要研究者
Sub-I
申办方
CRO
试验名称
方案编号
申办方信息
角色
公司名称
公司类型
注册地点
是否为北京生物医药产业跨越发展工程(北京G20)入选企业
注册申请人
申办方
生产商
CRO
中心实验室
SMO
(如已确定)
人类遗传资源批件
□需要□不需要
项目基本信息
批件号或受理号/日期
国际多中心
CRO项目经理:姓名/联系电话/邮箱
SSU:姓名/联系电话/邮箱
CRA:姓名/联系电话/邮箱
CRC:姓名/联系电话/邮箱
PI:姓名/联系电话/邮箱
Sub-I:姓名/联系电话/邮箱
监查计划
次/月;天/次
申办方或CRO签字盖章/日期
主要研究者签字/日期
规格及包装规格
用法用量
储存条件
备注:药物类型填写基础用药/急救用药等。
发放周期及发放数量:
(举例:访视X:发放片或支(最小单位);访视X至访视X:发放片或支(最小单位),共次。)
是否涉及周六日或节假日发药:□是□否
是否涉及夜间发药:□是□否
联络信息及监查计划
联络信息
申办方项目经理:姓名/联系电话/邮箱
□男科中心
□药理所
□Ⅰ期临床试验研究室
受试者来源
□门诊患者
□住院患者
□住院患者+门诊随访
□健康人
试验用药物基本信息
试验药
药理学分类
目标适应症
□新靶点或新作用机制的创新药物
□罕见病品种
□优先审评审批的儿童用药品种
临床试验立项审查表
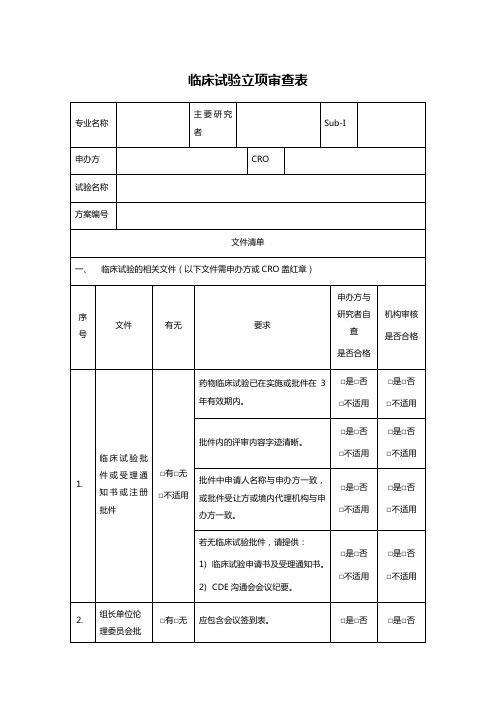
一、
简历中需体现曾经参与临床试验情况,及目前正在承担临床试验情况。
□是□否
□不适用
□是□否
□不适用
一、
简历中需体现GCP培训经历。
□是□否
□不适用
□是□否
□不适用
一、
GCP证书在有效期内(5年)。
□是□否
□不适用
□是□否
□是□否
□不适用
□是□否
□不适用
一、
需内容字迹清晰。
□是□否
□不适用
□是□否
□不适用
5.
临床试验方案
□有□无
注明版本号及版本日期。
□是□否
□不适用
□是□否
□不适用
一、
申办方签字盖章原件。
□是□否
□不适用
□是□否
□不适用
一、
主要研究者签字原件。
□是□否
□不适用
□是□否
□不适用
一、
若为参加单位,需提供组长单位主要研究者签字页复印件。
□是□否
□不适用
□是□否
□不适用
一、
在盲法试验中,试验用药品的编码系统须包括紧急揭盲程序,以便在紧急医学状态时能够迅速识别何种试验用药品,而不破坏临床试验的盲法设计。
□是□否
□不适用
□是□否
□不适用
6.
药物标签
□有□无
方案涉及的由申办方提供的试验用药品均需提供药物标签,包括研究药物、对照药品、安慰剂、基础用药、急救用药等。
□不适用
□是□否
□不适用
批件内的评审内容字迹清晰。
□是□否
□不适用
□是□否
□不适用
批件中申请人名称与申办方一致,或批件受让方或境内代理机构与申办方一致。
药物临床试验申请审批表

药物临床试验申请审批表
申办者声明
我保证以上信息真实准确,并负责该临床试验全过程的质量保证,承诺该临床试验数据真实可靠,操作规范,符合NMPA 《药物临床试验质量管理规范》(GCP )要求。
如有失实,愿意承担相关责任。
申办者代表签名(盖章):
年月日
CRO 公司声明
我保证以上信息真实准确,并负责该临床试验全过程的质量保证,承诺该临床试验数据真实可靠,操作规范,符合NMPA 《药物临床试验质量管理规范》(GCP )要求。
如有失实,愿意承担相关责任。
CRO 代表签名(盖章):
年月日
主要研究者声明
我保证以上信息真实准确,并负责该临床试验全过程中的质量保证,承诺该临床试验数据真实可靠,操作规范,符合NMPA 《药物临床试验质量管理规范》(GCP )要求。
本人承诺本研究团队人员与该项目无利益冲突。
如有失实,愿意承担相关责任。
主要研究者签字:
年月日
审批意见(手签)
主要研究者对本试验的评估及意见: 1 .试验的入排标准是否合理: 是口 2 .病源病种是否能够满足方案要求: 是口 3 .研究人员是否有足够的试验时间: 是口 4 .科室的场地和设施是否能保障: 是口 5 .是否能对试验质量进行保证: 是口
6 .是否保证能在约定时间内完成试验:是口
7 .科室在研项目情况:
是否有竞争入组临床试验在研: 是口在
研药物临床试验数量:项,其中处于筛选期和治疗期的项 8 .主要研究者决定:同意承接口
主要研究者(签字):
年月日
科室意见:
□□
□
□□
□□
否
否否否否否否。
药物临床试验立项申请表

保存
13
研究团队(含研究者资格证书、GCP证书)
保存
保存
14
其他文件
保存
保存
主要研究者签名(含时间)
机构办公室秘书(时间)
药物临床试验机构办公室意见及签名(含时间)
注意:
1.立项文件参考GCP附件2临床试验保存文件准备阶段目录;
2.“保存原件”指有鲜章或签名;
3.清单内容有修改ຫໍສະໝຸດ 请备注。保存保存3
组长单位伦理批件(含伦理委员会成员表)
保存
保存
4
申办者/CRO公司资质证明
保存
保存
5
CRA委托书和简历
保存原件
保存原件
6
研究者手册
保存
保存
7
试验方案及其修正案(已签名)
保存原件
保存原件
8
病例报告表
保存
保存
9
知情同意书
保存
保存
10
受试者招募材料
保存
保存
11
研究协议样稿(含财务规定)
保存
12
主要研究者简历
药物临床试验立项申请表
主要研究者/专业组
(科室)
项目名称
试验药品名称
申报方(含公司名称、所在地、联系人及电话)
合同研究组织(含公司名称、所在地、联系人及电话)
监查员(含姓名、公司名称、电话)
临床试验递交文件清单(含版本号及修改日期)
研究者文件夹
机构办公室
1
药物临床试验立项申请表
保存原件
2
国家食品药品监督管理局批件
立项及伦理审查表格

附件1
药物临床试验立项资料目录
备注:以上资料提供纸质版(A4)完整二套,立项备案用(如为新启动项目请至少提供
1~5项(方案未确定请提供方案初稿/摘要) 进行预审)。
附件2
药物临床试验立项申请表立项编号:日期:
附件3
研究者履历
附件4
专业组项目研究团队分工表
附件5:
药物临床试验伦理审查送审资料目录
备注:以上资料提供纸质版(A4)二套,伦理备案用。
第4~7项提供电子版的资料,发送至伦理委员会秘书邮箱,形式审查用。
第3~9项提供纸质版(A4)十套,伦理审查上会时用。
附件6:
临床试验伦理审查申请表
项目受理号:申请日期:
附件7
医疗器械临床试验伦理审查送审资料目录
备注:以上资料提供纸质版(A4)二套,伦理备案用。
第4~7项提供电子版的资料,发送至伦理委员会秘书邮箱,形式审查用。
第3~9项提供纸质版(A4)十套,伦理审查上会时用。
附件8
医疗器械临床试验伦理审查申请表。
药物临床试验立项资料目录

5、&,为必须有的资料
申办方或CRO纸质资料递交到机构办日期(以下内容由机构办填写)
机构办审核人员签名
日期
是否交伦理
□是□否
伦理秘书接收签名
接收日期
20
药物说明书(如适用)
21&
拟参加该临床试验其他中心及PI联系方式
22&
其他相关资料(受试者日记卡、光盘等)
资料目录说明:1、纸质资料未注明份数,均为4份(伦理审查2份,机构办2份),资料统一递交到机构办。
2、立项递交的资料多于机构办提供的资料目录,可在这份表格中插入行,说明资料名称。
3、立项资料目录打印4张,每份资料各一张。递交资料如需做出说明,填写在备注中。
12&
组长单位伦理审查批件和签到表(为参与单位)
13&
临床试验协议(初稿,不需具体金额信息)
14&
申办者资质(企业资质/药品生产许可证/GMP)
15
SMO资质(项目启动前必须提供)
16
CRO资质及申办方和CRO之间的委托书或合同(如适用)
17&
保险合同
18&
药物临床试验委托书
19&
药检报告(试验药物、对照药物、安慰剂)
瑞安市人民医院药物临床试验立项资料目录
顺序
文件资料
备注
1&
伦理递交信(2份,只需递交伦理,机构办不用)
2&
药物临床试验初始伦理审查申请(PI签名、日期,2份,只需递交伦理)
3&
药物临床试验机构办初始立项申请(PI签名、日期,2份,只需递交机构办)
4&
研究团队GCP培训证书复印件(可向机构办秘书要电子版)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
受试情况
临床试验目的
临床试验分期
□I期□II期
□III期□IV期
□生物利用度或生物等效
性试验;
□上市药临床试验
试验设计
是否对照:□否□是
□阳性药对照
□安慰剂对照
是否盲法:□否□是
□单盲
□双盲
SFDA批件号
试验预计
起止时间
年月~年月
组长单位伦理委员会意见
药物临床试验立项表
受理编号:
日期: 年 月 日
研究方案名称
研究方案编号
试验类型
国际多中心:□否□是
一、试验药物情况
研究药物
(化学名)
研究药物
(商品名)
试验药物
类别
□中药、天然药物:类
□化学药物:类
□生物制品:类
□进口注册药物
□上市药品
药理学分类
几线治疗
药理作用
(如若为靶向药物,应说明作用靶点)
剂型及规格
□有□无
三、申办者信息
申办者
CRO
申办者联系人
联系电话
联系地址
邮编
组长单位
负责人
参加单位
负责人
负责人
负责人
负责人
负责人
负责人
负责人
负责人
申办单位或CRO(盖公章):
日期: 年 月 日
机构办
接收人(签名) 接收日期: 年 月 日
机构办公室主任(签名): 日期: 年 月 日
备注:
