人血细胞的单细胞转录组图谱
单细胞转录组学umap模型可视化簇

一、概述在生物学研究中,单细胞转录组学一直是一个备受关注的领域。
通过研究单个细胞的基因表达情况,可以更好地理解细胞的功能和发育过程。
而在单细胞转录组学中,umap模型可视化簇的技术在近年来得到了广泛的应用和关注。
二、单细胞转录组学的意义1. 单细胞转录组学是一种能够揭示细胞多样性和功能的重要技术手段。
2. 通过单细胞转录组学,我们可以了解不同细胞之间基因表达的差异,从而揭示细胞的功能和发育过程。
三、umap模型的原理1. umap(Uniform Manifold Approximation and Projection)是一种降维技术,能够将高维数据映射到二维或三维空间中,以便于可视化和分析。
2. umap模型通过保持邻近点之间的距离关系,并最大限度地保持全局结构来实现数据的降维处理。
四、umap模型在单细胞转录组学中的应用1. 在单细胞转录组学研究中,通过umap模型可视化簇,可以将细胞按照它们的基因表达模式进行分类和展示。
2. umap模型可以帮助研究人员发现细胞之间的相似性和差异性,从而更好地理解细胞的功能和发育过程。
五、umap模型可视化簇的优势1. umap模型能够将高维数据映射到二维或三维空间中,并保持数据的全局结构,使得细胞分类和聚类更加直观和清晰。
2. umap模型具有较高的计算效率和稳定性,适用于大规模的单细胞转录组学数据分析。
六、umap模型可视化簇的局限性1. 在使用umap模型进行单细胞转录组学数据分析时,需要合理选择参数和调整参数,以获得最优的可视化效果。
2. umap模型在处理非线性数据和噪声数据时,可能会出现一定的误差和偏差。
七、结语通过umap模型可视化簇技术,我们可以更好地理解和分析单细胞转录组学数据,揭示细胞之间的功能和相互关系。
相信随着技术的不断进步和发展,umap模型在单细胞转录组学研究领域中将发挥越来越重要的作用。
八、umap模型的参数选择与调整在使用umap模型进行单细胞转录组学数据的可视化过程中,选择合适的参数和进行适当的调整是非常重要的。
单细胞转录组 sra

单细胞转录组sra**Single-Cell Transcriptomics: Unlocking the Secrets of Cellular Heterogeneity**单细胞转录组学:解锁细胞异质性的秘密The field of single-cell transcriptomics has revolutionized our understanding of cellular diversity and function.单细胞转录组学领域已经彻底改变了我们对细胞多样性和功能的理解。
By profiling the transcriptional activity of individual cells, researchers can gain insights into the unique gene expression patterns that underlie complex biological processes.通过描绘单个细胞的转录活性,研究人员可以深入了解复杂生物过程背后的独特基因表达模式。
SRA (Sequence Read Archive) databases play a crucial role in this research, providing a central repository for raw and processed sequencing data.SRA(序列读取存档)数据库在这项研究中发挥着至关重要的作用,为原始和处理的测序数据提供了一个中央存储库。
These repositories allow scientists to access and analyze vast amounts of data generated by high-throughput sequencing technologies.这些存储库使科学家能够访问和分析高通量测序技术产生的大量数据。
血细胞图谱
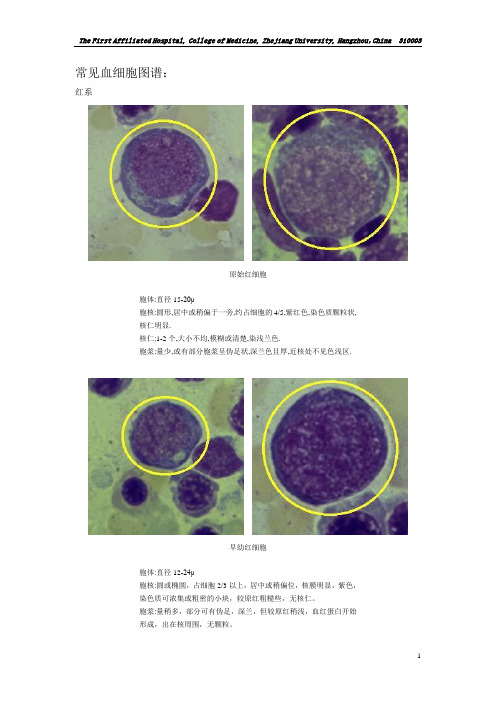
常见血细胞图谱:红系原始红细胞胞体:直径15-20μ胞核:圆形,居中或稍偏于一旁,约占细胞的4/5,紫红色,染色质颗粒状,核仁明显.核仁:1-2个,大小不均,模糊或清楚,染浅兰色.胞浆:量少,或有部分胞浆呈伪足状,深兰色且厚,近核处不见色浅区.早幼红细胞胞体:直径12-24μ胞核:圆或椭圆,占细胞2/3以上,居中或稍偏位,核膜明显,紫色,染色质可浓集或粗密的小块,较原红粗糙些,无核仁。
胞浆:量稍多,部分可有伪足,深兰,但较原红稍浅,血红蛋白开始形成,出在核周围,无颗粒。
中幼红细胞胞体:直径8-15μ胞核:圆形,居中或稍偏位,占细胞2/3-1/2大小,染色质粗糙排列成堆,其中有空白出现如打碎砚墨感,呈车轮状排列,深紫色,核染色质间有淡染区,称付染色质,核膜明显,无核仁。
胞浆:中等量或多量,不透明,浆内血红蛋白形成逐渐增多,嗜碱性物质逐渐减少。
因含不等量血红蛋白,可呈嗜多色性,可呈兰绿色,兰红色,淡红色等。
晚幼红细胞胞体:直径7-10μ胞核:圆形,稍偏或居中,占细胞的1/2以下,粗糙虽不规则致密团块。
可见车轮状痕迹,核膜明显,无核仁,随着细胞的成熟,核致密坚实,呈结构不清的紫红色的一团。
有时可见核分裂,核溶解。
溶血性贫血时,核有畸形。
胞浆:量较多,不规则,颜色因含多量血红蛋白,几乎和成熟红细胞相同呈粉红色或带极淡的兰色。
上一页嗜多色性红细胞(胞体直径:8-11μ)正常成熟红细胞浆为弱嗜酸性,呈较均匀的淡红色,如呈灰兰色(整个红细胞或其一部分)则称为嗜多色性红细胞。
这种红细胞属尚未完全成熟的红细胞,故细胞体积多较大,其染成灰兰色的嗜碱性物质是胞浆中的核糖体,它随着细胞的完全成熟而消失。
目前认为嗜多色性红细胞经煌焦油兰染色后即表现为网织红细胞。
上一页成熟红细胞(胞体直径:7-7.5μ)成熟红细胞是呈粉红色,中央稍浅,大小近似相等无核的细胞。
上一页原巨红细胞(胞体:直径19-27μ)巨红细胞是红细胞的另一系统,也分早、中、幼、晚。
各种血细胞模式图
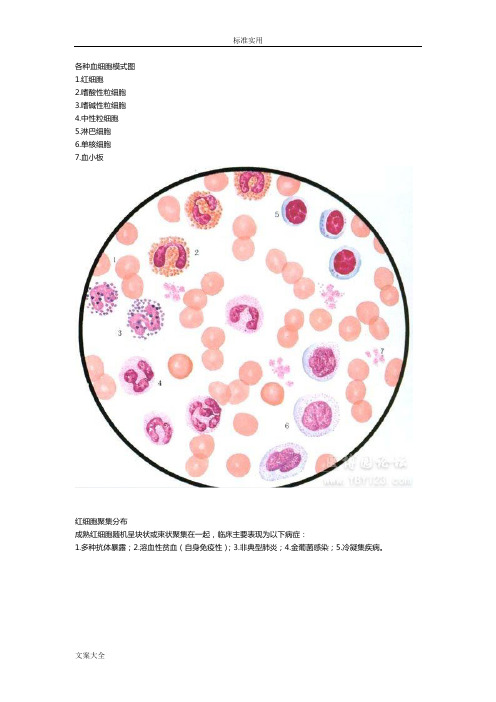
各种血细胞模式图1.红细胞2.嗜酸性粒细胞3.嗜碱性粒细胞4.中性粒细胞5.淋巴细胞6.单核细胞7.血小板红细胞聚集分布成熟红细胞随机呈块状或束状聚集在一起,临床主要表现为以下病症:1.多种抗体暴露;2.溶血性贫血(自身免疫性);3.非典型肺炎;4.金葡菌感染;5.冷凝集疾病。
靶形红细胞红细胞中央色深,外周以苍白圈,在近红细胞边缘处又较深。
形同射击之靶,在正常情况下靶形细胞极少见。
但在黄疸、肝病、脾切除后,缺铁性贫血,尤其是在地中海贫血的血涂片上颇为常见。
镰状红细胞这种红细胞两端尖锐,长而狭,形如镰刀样,见于先天性镰状红细胞贫血和Hb-C病等Bite Cell 红细胞由于细胞内血红蛋白变性或沉淀成块,使细胞呈半圆形,提示可能有红细胞膜的缺乏,如G-6-PD缺乏症。
水滴形红细胞红细胞形态如梨形或水滴形,见于各种增生性贫血及骨髓纤维化,以及地中海贫血、脾功能亢进或肾病等。
固缩红细胞红细胞中有一侧清晰区,而血红蛋白浓缩偏向另一侧,临床上常见于婴儿固缩红细胞增多症。
半月形红细胞胞体巨大,呈月形,淡红色。
为衰老红细胞在制片时人工造成,或见于某些增生性贫血、血小管球性肾炎。
刺毛红细胞亦称锯凿细胞。
包括刺细胞、钻细胞及距细胞。
往往见于微血管病性溶血性贫血、丙酮酸激酶缺乏症、PNH,距细胞多见于肝脏疾病,钻细胞也见于尿毒症。
球形红细胞此种红细胞直径缩短,厚度增加,细胞中心区的血红蛋白比周围多,呈小球形状。
常见于遗传形红细胞增多症、自身免疫性溶血性贫血、异常血红蛋白病(如Hb-S等)。
椭圆形红细胞红细胞呈椭圆形,横径缩短,长径增大,正常人椭圆形红细胞也可高达15%。
这种红细胞多见于遗传性椭圆形红细胞增多症,这种红细胞至少占25%,一般要高于25%-50%才有诊断价值。
在大红细胞性贫血可达25%,恶性贫血及严重缺铁性贫血、地中海贫血及镰刀形贫血也可见此细胞。
口形红细胞口形红细胞的中心淡染区呈条状,这种细胞正常小于4%,增高见于口细胞增多症,急性酒精性中毒时可大于5%。
单细胞转录 细胞簇鉴定标志

单细胞转录细胞簇鉴定标志
单细胞转录组学技术可以用于鉴定细胞类型和状态,其中细胞簇鉴定是其中的一个重要应用。
细胞簇鉴定是通过单细胞测序技术对单个细胞进行转录组分析,然后根据细胞的基因表达谱进行聚类,将相似的细胞归为同一簇。
通过比较不同细胞簇的表达谱,可以鉴定出不同的细胞类型和状态,如免疫细胞、干细胞、肿瘤细胞等。
在细胞簇鉴定中,通常使用聚类算法对单细胞数据进行聚类,常见的聚类算法包括K-means、DBSCAN、层次聚类等。
在聚类之后,可以使用一些标志基因对各个细胞簇进行鉴定。
这些标志基因通常是一些在特定细胞类型或状态下特异性表达的基因,如CD8、CD4、Foxp3等免疫细胞标志基因,Oct4、Sox2、Nanog等干细胞标志基因。
通过单细胞转录组学技术进行细胞簇鉴定可以帮助我们更好地理解细胞的多样性和复杂性,为疾病研究、药物研发等领域提供有力支持。
如需了解更多相关信息,建议查阅单细胞转录组学相关的前沿文献,以获取最新、最权威的研究进展。
循环肿瘤细胞 单细胞 转录组

循环肿瘤细胞单细胞转录组
循环肿瘤细胞(CTCs)是一种罕见的癌细胞,它们可以在血液中循环并在身体的其他部位形成新的肿瘤。
CTCs的研究对于癌症的早期诊断和治疗具有重要意义。
最近的研究表明,单细胞转录组技术可以用于
研究CTCs的生物学特性和分子机制。
单细胞转录组技术是一种高通量的分子生物学技术,可以对单个细胞
的基因表达进行全面的分析。
这种技术可以揭示细胞类型、细胞状态
和细胞功能等方面的信息。
在研究CTCs时,单细胞转录组技术可以
帮助我们了解CTCs的异质性和转移能力,以及它们与其他细胞的相
互作用。
通过单细胞转录组技术,研究人员可以将CTCs分为不同的亚型,并
确定它们的分子特征和生物学特性。
例如,一些研究表明,CTCs可以表达干细胞标记物,这表明它们可能具有干细胞的特性,如自我更新
和多向分化能力。
此外,一些CTCs可以表达转移相关的基因,这表
明它们可能具有更强的转移能力。
单细胞转录组技术还可以帮助我们了解CTCs与其他细胞的相互作用。
例如,研究人员可以通过单细胞转录组技术确定CTCs与免疫细胞的
相互作用,并研究它们在肿瘤免疫逃逸中的作用。
此外,单细胞转录
组技术还可以帮助我们了解CTCs与肿瘤微环境的相互作用,以及它们在肿瘤进展中的作用。
总之,单细胞转录组技术是一种强大的工具,可以用于研究CTCs的生物学特性和分子机制。
通过这种技术,我们可以更好地了解CTCs 的异质性和转移能力,以及它们与其他细胞的相互作用。
这些研究结果可以为癌症的早期诊断和治疗提供重要的参考。
一种人骨髓造血干祖细胞的单细胞转录组图谱及构建方法[发明专利]
![一种人骨髓造血干祖细胞的单细胞转录组图谱及构建方法[发明专利]](https://img.taocdn.com/s3/m/f8b0443715791711cc7931b765ce050876327595.png)
专利名称:一种人骨髓造血干/祖细胞的单细胞转录组图谱及构建方法
专利类型:发明专利
发明人:程涛,胡林萍,朱平,谢小韦,张雅文,尹秀秀
申请号:CN202111500593.4
申请日:20211209
公开号:CN114187965A
公开日:
20220315
专利内容由知识产权出版社提供
摘要:本发明公开了一种人骨髓造血干/祖细胞的单细胞转录组图谱及构建方法。
所述方法包括以下步骤:(1)分选人骨髓造血干/祖细胞;(2)构建所述人骨髓造血干/祖细胞的单细胞转录组库;(3)对所述单细胞转录组库进行测序;(4)对所述测序的数据进行分析,构建所述人骨髓造血干/祖细胞的单细胞转录组图谱;本发明通过深度单细胞转录组测序,构建人骨髓造血干/祖细胞的单细胞转录组图谱来系统研究人造血干/祖细胞特征,获取更多信息量,可为探索人骨髓造血干/祖细胞的生理和病理造血提供理论基础。
申请人:中国医学科学院血液病医院(中国医学科学院血液学研究所)
地址:300020 天津市和平区南京路288号
国籍:CN
代理机构:北京品源专利代理有限公司
代理人:边人洲
更多信息请下载全文后查看。
第一节血型和血液

运走_______________,或者________________________,就会出现贫血。
我们血液中的细胞有什么结构特点和功能?**
2.三组血细胞中,都不具有细胞核的是
()
看一看,血液出现了什么现象?
血浆 6.人体患急性炎症时,表现出________增多的现象。
请44.你.血说液明血是血由浆液_的__成是__分__和由__功和能_血。_细_胞_两_部_分__组_成和。 血细胞两部分组成。前者的主要功能是
想一想,血液的成分由哪些物质组成?
运载血细胞,运输养料和废物 血成__红年_蛋 男_白子_是:_一1_2种0_~含_1铁_60_的g_/蛋L_白_质_,_容_易_与_氧__气_结_合_,_因_此_红_细_胞__具_有_运_输_氧_气_的_功__能_。________等。血细胞包括
我想5们一.血 想液,当中各的种血细血胞细液有胞什分里么别结有_构哪_特些__点形_和态_功特_能征_?和_结*_* 构_特_点__?_,或者________________________,就会
C. 红细胞和血小板 D. 上述三组都无胞核
出现贫血。 3. 循环系统的主要功能是为组织细胞运送__________________,并运走_______________等废物。
我们的血液由哪些部分构成?能用实验方法观察到吗?
氧气和养料 第十章第一节血型和血液
3. 循环系统的主要功能是为组织细胞运送__________________,并 前者的主要功能是_________________________________________________等。
4.血液是由_________和血细胞两部分组成。
第十章第一节血型和血液
10X单细胞转录组测序原理和文库构建注意要点(PPT课件)

谢 谢!
让我们共同进步
12
区分,通过「10x Barcodes」标记每一个细胞,能实现大规模的单细胞转录组测序,从
而更高分辨率地揭示细胞间的细胞差异以及其在微环境中的功能情况,在细胞异质性研
究中表现出色。 ▽ 研究领域
▽ 技术优势
• 细胞异质性研究
• 不需要微量扩增,降低假阳性率
• 免疫反应
• 灵活的获取量,可一次性对500-10000个细胞建库,
• 定点编辑基因的细胞水平研究
提高效率
• 发育及分化
• 7分钟之内即可完成单细胞体系制备,捕获效率高
• 新型细胞发现
达65%
• 构建细胞图谱
• 成本低,广泛的研究应用领域,超短的项目周期
▽ 细胞类型
生殖细胞、胚胎细胞、神经细胞、免疫细胞、肿瘤细胞、干细胞、其他原代细胞
3
10
10X单细胞转录组测序的技术原理
枪头不要紧贴孔的底部,同时避免产生气泡, 取出移液器,确保吸头中没有气泡产生 i/用回收溶液破裂GEMs
81010X单细胞构建片段化、末端修复加A尾 SPRI磁珠双端纯化 接头连接 接头后纯化 Index PCR SPRI磁珠双端纯化
预先设定好PCR仪到4℃,在冰上准备片段化反应体系。 吸液体积要准确,取上清(去大)和去上清(去小)都不要吸到 磁珠,使用新配的80%乙醇,磁珠晾干时间不超过1min。 冰上配置接头M 10X单细胞转录组简介 10X单细胞转录组测序的技术要点 10X单细胞外出试验流程 10X单细胞建库流程 常见问题
2
单细胞转录组分析

单细胞转录组分析1 简介1.1 scRNA-seq2009年由汤富酬等⼈⾸次公开测量每个基因在细胞群中表达⽔平的分布允许研究在转录组中特定于细胞的变化的⾮常重要的⽣物学问题,例如细胞类型识别,细胞反应的异质性,基因表达的随机性,细胞内基因调控⽹络的推断bulk和单细胞RNA-seq之间的主要区别在于,每个测序⽂库代表单个细胞,⽽不是细胞群体。
因此,必须特别注意⽐较不同细胞(测序⽂库)的结果。
⽬前单细胞测序主要由于转录物的起始量较低,在扩增(1 million fold)的时候会产⽣许多问题。
⽬前,提⾼转录物捕获效率和降低扩增偏差是研究的活跃领域。
可以通过适当的归⼀化缓解其中的⼀些问题。
1.2 scRNA-seq的技术CEL-seq (Hashimshony et al. 2012)CEL-seq2 (Hashimshony et al. 2016)Drop-seq (Macosko et al. 2015)InDrop-seq (Klein et al. 2015)MARS-seq (Jaitin et al. 2014)SCRB-seq (Soumillon et al. 2014)Seq-well (Gierahn et al. 2017)Smart-seq (Picelli et al. 2014)Smart-seq2 (Picelli et al. 2014)SMARTerSTRT-seq (Islam et al. 2013)2 分析流程2.1 读⼊数据本次使⽤的数据集(Lun et al.2017 )该数据集包含两块416B细胞板(永⽣的⼩⿏⾻髓祖细胞系),使⽤Smart-seq2进⾏处理(Picelli et al,2014)。
在制备⽂库之前,还将spike-in RNA添加到每个细胞的裂解物中。
进⾏⾼通量测序,并通过计数映射到其外显⼦区域的读数总数来量化每个基因的表达。
类似地,通过计数映射到刺⼊参考序列的读数的数⽬来测量每个刺⼊转录本的量。
单细胞转录组讲解

单细胞转录组讲解单细胞转录组学是一种用于研究单个细胞中基因表达的技术。
传统的转录组学研究通常采用大量细胞的混合物作为样本,而单细胞转录组学则可以对单个细胞进行分析,从而揭示细胞之间的异质性和功能差异。
单细胞转录组学的发展受益于高通量测序技术的突破。
通过将单个细胞的RNA转录本进行扩增,并进行测序,我们可以得到每个细胞的基因表达图谱。
这种技术的应用范围非常广泛,可以用于研究发育生物学、肿瘤学、免疫学等领域。
通过分析单个细胞的基因表达,我们可以了解细胞的功能状态、细胞类型的分化和发育过程,以及细胞之间的相互作用。
单细胞转录组学的研究过程通常包括以下几个步骤。
首先,需要对单个细胞进行分离和捕获。
目前常用的方法有流式细胞术、微流控芯片和单细胞悬浮液滴等。
接下来,需要对单个细胞的RNA进行扩增。
由于单细胞中的RNA量非常有限,因此需要使用特殊的扩增方法,如T7 RNA聚合酶链式反应(T7 RNA polymerase-based linear amplification)或PCR扩增。
然后,对扩增的RNA 进行测序,可以使用第二代测序技术(如Illumina测序)或第三代测序技术(如PacBio测序)。
最后,通过生物信息学分析,可以得到每个细胞的基因表达图谱,并进行后续的差异表达分析、聚类分析等。
单细胞转录组学的应用已经在许多领域取得了重要的突破。
例如,在发育生物学中,研究人员利用单细胞转录组学技术揭示了胚胎发育过程中各个细胞类型的形成和分化过程。
在肿瘤学中,单细胞转录组学可以帮助我们了解肿瘤细胞的异质性,揭示不同细胞亚群的功能差异,并为个体化治疗提供依据。
在免疫学中,单细胞转录组学可以帮助我们深入了解免疫细胞的分化和功能,并揭示免疫细胞在疾病发生发展中的作用。
然而,单细胞转录组学也面临一些挑战和限制。
首先,由于单个细胞的RNA量非常有限,扩增过程容易引入扩增偏差和噪音。
其次,由于测序技术的局限性,目前单细胞转录组学只能测序一部分基因,无法全面了解细胞中所有基因的表达情况。
单细胞测序转录组

单细胞测序转录组
单细胞测序转录组是一种新兴的高通量测序技术,可以破解单个细胞的基因表达谱,从而揭示不同细胞类型、亚型及其功能差异。
单细胞测序转录组的应用广泛,包括研究发育过程、疾病机制、药物筛选等方面。
研究人员通过单细胞测序转录组技术,可以发现许多与疾病相关的新的细胞亚型和新靶点,为药物研发提供了新思路。
同时,单细胞测序转录组技术的发展也面临一些挑战,如细胞损伤、RNA降解、数据处理等问题。
未来,随着技术的不断发展和完善,单细胞测序转录组技术将会更加成熟,为基础科学和临床研究带来更多的启示。
- 1 -。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
人血细胞的单细胞转录组图谱文章信息文章题目:Single-cell TranscriptomicLandscape of Human Blood Cells期刊:National Science Review(IF:17.275)日期:24 August 2020DOI: /10.1093/nsr/nwaa180摘要背景:目前缺乏一个关于全血系统的单细胞层面转录组参考系。
方法:1.使用Single-Cell Tagged Reverse Transcription RNA Sequencing (STRT-seq) strategy,分析21个健康献血者的32种免疫细胞类型,得到了总共7551个人血细胞,发现蛋白质编码基因和lncRNAs 构建的人血单细胞转录图谱(atlas of blood cells ,ABC)具有高度一致性。
2.使用SCENIC构建了转录因子和靶基因的调节网络,发现中性粒细胞和单核细胞中共同的转录因子调控网络被激活。
3.分析每个特定细胞群(HSPCs、B细胞、NK细胞、T细胞、单核细胞、中性粒细胞和红细胞)的分化轨迹和特征,发现有核红细胞与免疫信号通路密切相关。
意义:提供了单细胞分辨率的人血细胞转录图谱,从而为探索生理和病理造血提供了全面的参考。
实验设计及质控样本:21个健康成人的骨髓和外周血的单核细胞细胞:流式分选了32种血细胞,过滤后得到了7551个细胞进行下游分析。
Scheme of the experimental design细胞过滤标准:1.保留至少有1000个蛋白质编码基因表达的细胞,总共有7551个细胞符合要求。
2.保留至少有500个lncRNA 表达的细胞,总共有7192个细胞符合要求。
大致的单细胞下游分析流程:SCTransform → IntegrateData→RunPCA→ FindCluster→ FindVariableFeatures→RunUMAP →FindNeighbors and FindClusters →SCENIC →HOMER → bedtools →Monocle3 →scran结果1.人类血液细胞转录组参考系首先,整体而言,HSPC和单核细胞表达的基因数量最多,而NK 细胞、T细胞和中性粒细胞的转录相对静止(图1B)。
值得注意的是,与HCA数据库相比,他们的数据能够检测到更多的基因和转录因子用于深入分析(P<2.2e-16,图1C),并且在检测低丰度基因方面尤其具有优势。
他们接着整合了所有造血细胞的单细胞转录组图谱,然后通过UMAP进行降维和可视化。
发现从HSPC开始,向淋巴细胞(B细胞、NK细胞和T细胞)、髓系细胞(单核细胞和中性粒细胞)和红细胞分支,揭示了造血分化的总体轨迹。
与B细胞、单核细胞和红细胞相比,他们发现NK细胞、T细胞和中性粒细胞缺乏从祖细胞到分化细胞的连续转录转移,这表明这些细胞在成熟过程中可能获得基因表达的”戏剧性“变化,或者存在已知的表面标记没有捕捉到的过渡群体(图1D)。
最后,他们观察到AVP在HSCs和MPPs中特异表达。
CD79B、GZMH和CCR7分别在B细胞、NK细胞和T细胞中高特异性和高表达,SPI1和GATA1分别在中性粒细胞/单核细胞和红细胞中高表达(图1E),验证了每种细胞中与造血相关的已知标记基因。
通过对20多个健康献血者的多个典型造血群体的深度测序,他们的人类血细胞单细胞转录图谱为人类生理性和病理性造血研究提供了有价值的转录组参考。
Fig.1 Transcriptome reference of human blood cells2.造血分化的转录因子调控网络为了解析造血分化相关转录因子调控网络(调节子),使用SIENIC 计算了所有转录因子的调控活性分数(RAS),然后构建了人类血细胞的调控图谱。
结果显示,由调节子揭示的造血分化轨迹与单细胞转录组的数据结果总体一致(图2A)。
接着,通过无监督的聚类将造血细胞分成20个调控簇,称为C1到C20,每个调控簇都显示出高度特异的调节子集基因的激活(图2B)。
在主要由HSPC细胞组成的C1/C2簇细胞中,HOX基因被激活。
TCF4、EBF1和LEF1在代表B细胞的C3~C7簇中活性较高,浆细胞中PRDM1和XBP1活性较高,而NK/T细胞中GATA3和Tbx21活性较高。
CEBP和SPI1在中性粒细胞/单核细胞系中显示出高活性,而GATA1和KLF1在红系中被激活(图2C)。
值得注意的是,单核细胞和中性粒细胞共享大多数髓系特有的调节子基因,而淋巴细胞调节子则有着明显的细胞类型特异性,在B淋巴细胞成熟过程中调节子的变化证明了这一特点(图2C)。
Fig 2.Transcription factor regulatory networks underlie hematopoiesis3.单细胞转录组的非编码RNA图谱LncRNAs在造血细胞的分化和发育过程中起着至关重要的作用。
然而,在单细胞水平下lncRNAs在造血细胞中的表达谱尚未见报道。
因此,他们基于lncRNA表达水平,构建一个包含7192个血细胞的转录图谱。
根据NONCODE数据库的基因组注释,32种免疫表型细胞平均可以检测到1700多个LncRNAs。
与蛋白质编码基因一致,HSPC 和单核细胞表达的lncRNAs数量最多,而NK细胞、T细胞和中性粒细胞表达的lncRNAs数量最低(图3A)。
而且仅用lncRNAs构建的造血分化轨迹与蛋白质编码基因构建的分化轨迹高度一致(图3B)。
为了进一步剖析转录异质性,他们计算了蛋白编码基因和lncRNA 在任何两种免疫表型细胞类型之间差异表达的基因(DEG)。
DEG数量表明lncRNAs和蛋白质编码基因之间有很高的一致性(图3C)。
这些结果表明,lncRNAs的动态变化能够描述整个造血系统的层次结构。
接下来,他们确定了每种免疫表型细胞类型的标志性蛋白编码基因和lncRNAs,发现lncRNA signature 倾向于与其相邻的蛋白编码基因相关联,以获得更多分化的细胞类型,而不是祖细胞(图3D)。
此外,lncRNA signatures显示出更高的PhastCons保守分数和更高的细胞特异性(图3E-F)。
特别是,与造血特征的基因(AVP、CD79B、GZMH、CCR7、SPI1和GATA1)相邻的lncRNA(NONHSAG031143.2、NONHSAG073805.1、NONHSAG069091.1、NONHSAG108638.1、NONHSAG008235.2和NONHSAG103763.2)分别在HSPC、B细胞、NK细胞、T细胞、中性粒细胞/单核细胞和红细胞中高表达(图3G)。
这些发现在单细胞水平上鉴定出了造血细胞中特异表达的lncRNAs,它们倾向于与其相邻的蛋白编码基因共表达,以获得更多的细胞分化类型。
Fig.3 Reconstruction of hematopoietic hierarchy by using lncRNAs4.造血细胞亚群的精细图谱接下来精确剖析了每个特定细胞亚群(HSPC、B细胞、NK细胞、T细胞、单核细胞、中性粒细胞和红细胞)的分化轨迹和特征。
考虑到CD71+红细胞的免疫作用在以往的研究中已有报道,因此作者们首先关注了红系细胞群。
首先将来自不同捐赠者的细胞整合在一起,然后用UMAP降维和可视化。
他们发现,在红系谱系中,Ery/Gra1和Ery/Gra2显示了与中性粒细胞和单核细胞/树突状细胞(MD)特征相关的高表达基因(图4A)。
Ery/Gra1和Ery/Gra2中特异表达基因的GO富集分析主要富集在中性粒细胞相关、吞噬和炎症反应以及抗原处理和提呈通路,这暗示了这两个红细胞亚群可能有先天性和获得性免疫功能(图4B)。
伪时间分析表明,Ery/Gra2簇有着独特的免疫相关基因表达,例如VCAN 和S100A9基因(图4C-D)。
此外,他们发现CD74+有核红细胞主要表达在Ery/Gra1和Ery/Gra2簇(图4D)。
随后,他们还描述了HSPC、B细胞、NK细胞、T细胞、单核细胞和中性粒细胞的分化轨迹和功能多样性。
正如预想的一样,HSPC的分化轨迹包含了淋巴系、髓系和红系/巨核系在内的祖细胞的分支(图4e)。
伪时间分析反映了B和NK细胞群体的分化轨迹(图4F-G)。
对于T细胞群,CD4T和CD8T细胞可各分为三类,分别包括初始T细胞、记忆T细胞和效应性T细胞。
CD4初始T细胞和记忆T细胞紧密相靠,但CD8记忆T细胞和却与效应T 细胞紧密相连(图4H-I),接着是单核细胞和中性粒细胞亚群的分化轨迹(图4J-K)。
最后,他们发现细胞周期相关基因在HSPC分化过程中被激活,而在血细胞成熟过程中则失活(图4L)。
综上所述,他们详述了每个细胞压群的分化轨迹图谱,并观察了有核红细胞的免疫激活情况。
综上所述,他们详述了每个细胞群体的分化图谱,并观察了有核红细胞的免疫激活现象。
Fig.4 Immune activation of CD74+ nucleated erythrocytes and elaborate atlas for other hematopoietic cell populations 最后,作者建立了一个在线数据库(/)来可视化数据,并且可预测用户自己数据的单细胞转录组细胞类型。
Atlas总结1.该研究借助单细胞转录组深度测序技术,覆盖了从造血干细胞到祖细胞再到各谱系成熟血细胞在内的32种类型的血细胞,绘制了人全血细胞的精细分子图谱。
2.揭示了全新的与造血分化相关的lncRNAs和转录因子,并对主要血细胞群体进行精细分群和定义,首次提出CD74阳性的有核红细胞可能具有免疫调节功能。
3.在线数据库有助于我们在单细胞水平上找到某特定基因在32种血细胞的表达水平变化,以及可以利用自己的数据绘制发育分化轨迹图谱。
总的来说,该研究图谱全面地整合了血细胞的转录组信息和免疫表型信息,为后续血液生理学和病理学研究提供了重要的血细胞注释依据和参考价值。
