最系统的初中化学知识结构图总结
「人教九年级化学」全册单元思维导图,初三学生请收藏
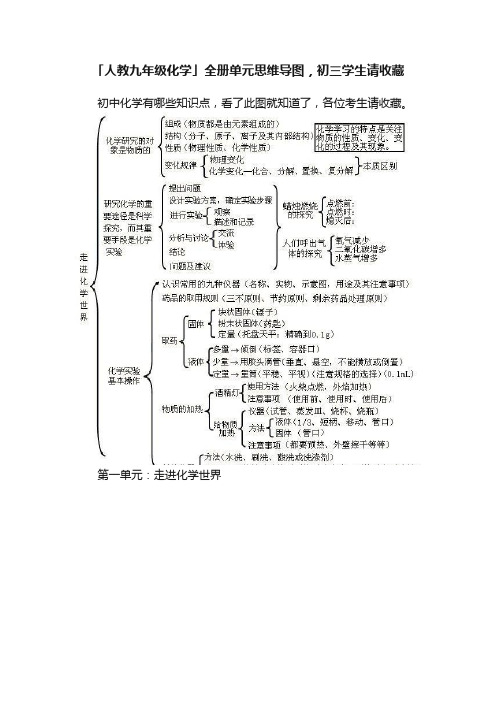
第八单元:金属和金属材料
第九单元பைடு நூலகம்溶液
第十单元:酸和碱
第十一单元:盐 化肥
第十二单元:化学与生活
初中化学有哪些知识点看了此图就知道了各位考生请收藏
「人教九年级化学」全册单元思维导图,初三学生请收藏
初中化学有哪些知识点,看了此图就知道了,各位考生请收藏。
第一单元:走进化学世界
第二单元:我们周围的空气
第三单元:物质构成的奥秘1
第三单元:物质构成的奥秘2
第四单元:自然界的水
第五单元:化学方程式
第六单元:碳和碳的氧化物
初中化学各单元知识点框架图学习资料

初中化学各单元知识点框架图初中化学各单元知识点框架图第一单元走进化学世界第二单元我们周围的空气第三单元自然界的水第四单元物质构成的奥秘第五单元化学方程式第六单元碳和碳的氧化物第七单元燃料及其利用第八单元金属和金属材料第九单元溶液第十单元 酸、碱、盐(一)化学用语1电离方程式:-++=24422SO H SO H ;-++=OH Na NaOH ;-++=24334232)(SO Al SO Al2物质的俗称和主要成分:生石灰CaO ;熟石灰、消石灰、石灰水的主要成分Ca(OH)2;石灰石、大理石CaCO 3;食盐的主要成分NaCl ;纯碱、口碱Na 2CO 3;烧碱、火碱、苛性钠NaOH ;胆矾、蓝矾CuSO 4·5H 2O ;碳酸钠晶体Na 2CO 3·10H 2O ;氨水NH 3·H 2O 。
(二)金属活动性1金属活动性顺序:K >Ca >Na >Mg >Al >Zn >Fe >Sn >Pb(H)Cu >Hg >Ag >Pt >Au2金属活动性顺序的意义:在金属活动顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失去电子而变成离子,它的活动性就越强。
3金属活动性顺序的应用:⑴排在氢前的金属能置换出酸里的氢(元素)。
⑵排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K 、Ca 、Na 除外)。
(三)酸、碱、盐的溶解性1常见盐与碱的溶解性钾(盐)、钠(盐)铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
2八个常见的沉淀物氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙、氢氧化镁、氢氧化铜、氢氧化铁3四微溶物Ca(OH)2(石灰水注明:澄清“的原因)CaSO 4(实验室制二氧化碳时不用稀硫酸的原因)Ag 2SO 4(鉴别-24SO 和-Cl 时,不用硝酸银的原因)MgCO 3(碳酸根离子不能用于在溶液中除去镁离子的原因)4三个不存在的物质氢氧化银、碳酸铝、碳酸铁(四)复分解反应发生的条件反应有气体、水或沉淀生成(即有不在溶液中存在或在水溶液中不易电离的物质)1、不溶性碱只能与酸性发生中和反应;2、不溶性盐,只有碳酸盐能与酸反应;3、KNO3、NaNO3、AgNO3、BaSO4不能做复分解反应的反应物。
初中化学各单元知识框架图(全)

小屯一中化学复习计划第一单元走进化学世界1、锅炉爆炸、轮胎爆炸是物理变化,可燃性物质导致的爆炸是化学变化,如氢气爆炸,烟花爆炸等。
2、催化剂能加快和减慢反应速率,其质量和化学性质反应前后不变,物理性质,如形状、状态可能改变3、由一种元素组成的物质可能为单质,也可能为混合物。
如氧气O2和臭氧O3两种单质混合得到混合物,也只由氧(O)元素组成。
金刚石C和石墨C的混合物,只由碳(C)元素组成等。
只有说由一种元素组成的纯净物,才能说一定是单质。
冰水混合物是纯净物,冰是水的固态,还是水。
4、原子是化学变化中的最小粒子。
但不能说原子一定就比分子小。
原子是化学变化中的最小粒子,在化学变化中不可再分。
但是某些物理变化中是可再分(核裂变)的第二单元我们周围的空气测氧气含量实验失败原因:红磷量不足,装置漏气,未等到装置冷却就打开弹簧夹不是所有的燃烧都需氧气参与。
如氢气在氯气中能燃烧。
着火点是物质的固有属性,不能说降低物质的着火点,只能说把温度升高到物质的着火点。
燃烧需三个条件都具备,灭火只要破坏任一条件。
第三单元自然界的水沉淀有静置沉淀和吸附沉淀。
吸附沉淀是指加明矾生成胶体吸附大颗粒固体杂质,获得比静置沉淀更快的沉淀。
过滤是在沉淀后,把不溶于水的沉淀和水分离的操作。
若单独提到吸附,则是指加活性炭吸附色素和气体。
蒸馏后得到的水净化程度最高,为蒸馏水,是纯净物。
蒸馏操作可以使硬水软化第四单元物质构成的奥秘原子团的记忆找诀窍:如碳酸根CO3,就是二氧化碳CO2多1个O。
硫酸根SO4,是三氧化硫SO3多1个O。
硝酸根NO3,是二氧化氮NO2多1个O。
铵根NH4,是氨气NH3多1个O.第五单元化学方程式1、如点燃A克氧气和B克氢气的混合气体,生成水的质量是小于或等于(A+B)克。
氧气和氢气要么恰好按质量比完全反应,都不剩余,则生成水质量等于(A+B)克。
要么,氢气过量剩余或者氧气过量剩余,有一种没有全部反应,则生成水质量小于(A+B)克。
(完整版)初中化学各单元知识框架图
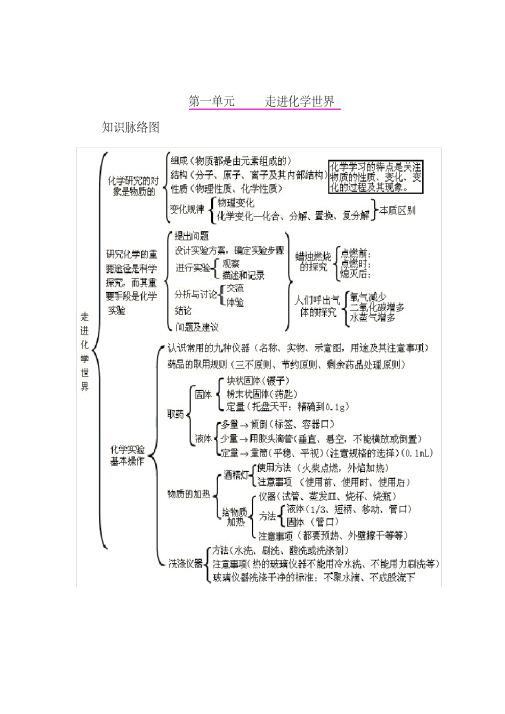
2 、溶液 ( 多为无色 ) 浅绿色溶液 ---( 亚铁盐溶液 )FeCl2
溶液、 FeSO4 溶液黄色溶液 --- ( 铁盐溶液 )FeCl3
溶液、 Fe2(SO4)3 溶液、 Fe(NO3)3
溶液蓝色溶液 ---( 铜盐溶液 )CuCl2
溶液、 CuSO4 溶液、 Cu(NO3)2 溶液蓝绿色溶液 -CuCl2
溶质的 质量分数
不饱和溶液
饱和溶液 结晶
溶解度
十、酸 碱 盐 氧化物、酸、碱和盐的知识点可以从以下十个方面掌握: 一、化学用语 1、电离方程式
H 2 SO4 2 H SO42 ; NaOH Na OH ; Al 2 ( SO4 ) 3 2Al 3 3SO42
2、物质的俗称和主要成分生石灰 ??CaO熟石灰、消石灰、 石灰水的主要成分 ??Ca(OH)2石灰石、大理石 ??CaCO3食盐的主 要成分 ??NaCl 纯碱、口碱 ??Na2CO3烧碱、火碱、苛性钠 ??NaOH 胆矾、蓝矾 ??CuSO4.5H2O碳酸钠晶体 ??Na2CO3.10H2O氨 水 ??NH3.H2O
(2) 碱能与酸性氧化物反应生成盐和水 (3) 碱能与酸反应生成盐和水 (4) 某些碱能与某些盐反应生成新的盐和新的碱 3、盐的性质 (1) 某些盐能与较活泼的金属反应生成新的盐和金属 (2) 某些盐能与酸反应生成新的盐和新的酸 (3) 某些盐能与某些碱反应生成新的盐和新的碱 (4) 有些不同的盐之间能反应生成两种新的盐
六、溶液的酸碱性与酸碱度的测定 1、指示剂 --- 溶液的酸碱性紫色的石蕊试液遇酸性溶液变 红;遇碱性溶液变蓝 无色的酚酞试液只遇碱溶液变红注:不溶性碱与指示剂无作 用碱性溶液不一定是碱的溶液 ( 特例:碳酸钠的水溶液显碱性 ) 2、pH值 --- 溶液的酸碱度 pH>7溶液为酸性 ( 越小酸性越 强)pH=7 溶液为中性 pH<7溶液为碱性 ( 越大碱性越强 ) 七、离子的检验 Cl-( 在溶液中 )--- 在被测溶液中加入硝酸银溶液 , 如果生成 不溶于硝酸的白色沉淀,则原被测液中含氯离子。 SO42-(在溶液中 )--- 在被测溶液中加入氯化钡 ( 或硝酸钡、 或氢氧化钡 ) 溶液,如果生成不溶于硝酸 ( 或盐酸 ) 的白色沉淀, 则原被测液中含硫酸根离子。 CO32-(1)( 固体或溶液 )--- 在被测物质中加入稀酸溶液,如 果产生能使澄清石灰水变浑浊的气体,则原被测物质中含碳酸 根离子。
(完整word版)初中化学各单元知识框架图
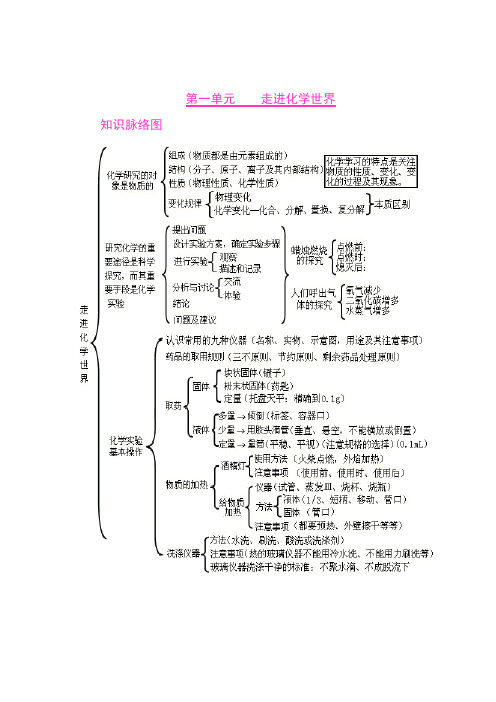
第一单元走进化学世界知识脉络图第二单元我们周围的空气知识脉络图第三单元自然界的水知识脉络图第四单元物质构成的奥秘知识脉络图第五单元化学方程式知识脉络图第六单元碳和碳的氧化物知识脉络图第七单元燃料及其利用第八单元金属和金属材料九、溶液十、酸 碱 盐氧化物、酸、碱和盐的知识点可以从以下十个方面掌握:一、化学用语1、电离方程式23224424342;;()23H SO H SO NaOH Na OH Al SO Al SO +-+-+-=+=+=+2、物质的俗称和主要成分生石灰??CaO 熟石灰、消石灰、石灰水的主要成分??Ca(OH)2石灰石、大理石??CaCO3食盐的主要成分??NaCl 纯碱、口碱??Na2CO3烧碱、火碱、苛性钠??NaOH 胆矾、蓝矾??CuSO4.5H2O 碳酸钠晶体??Na2CO3.10H2O 氨水??NH3.H2O二、化合物的分类三、金属活动性1、金属活动性顺序:KCaNaMgAlZnFeSnPb(H)CuHgAgPtAu2、金属活动性顺序的意义:在金属活动性顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失电子而变成离子,它的活动性就越强。
3、金属活动性顺序的应用:(1)排在氢前的金属能置换出酸里的氢(元素)。
(2)排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K、Ca、Na除外)。
四、酸、碱、盐的溶解性1、常见盐与碱的溶解性:(如果不读出括号中的字,是不是一个较好记忆的顺口溜?)钾(盐)、钠(盐)、铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
2、八个常见的沉淀物:氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙氢氧化镁、氢氧化铜、氢氧化铁3、四微溶物:Ca(OH)2(石灰水注明“澄清”的原因)CaSO4(实验室制二氧化碳时不用稀硫酸的原因)Ag2SO4(鉴别SO42-和Cl-时,不用硝酸银的原因)MgCO3(碳酸根离子不能用于在溶液中除去镁离子的原因)4、三个不存在的物质:所谓的氢氧化银、碳酸铝、碳酸铁五、分解反应发生的条件反应后有气体、水或沉淀生成。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
最系统的初中化学知识结构图总结
一、基本概念和基本原理
知识结构梳理
溶液
混合物
浓溶液
稀溶液
溶解度
饱和溶液
不饱和溶液
溶质质量分数
质量守恒定律
可溶性碱
不溶性碱
酸性氧化物
碱性氧化物
含氧酸盐
无氧酸盐
无氧酸
含氧酸
氧化物
酸
碱
盐吸热现象
放热现象
氧化反应
还原反应
化合反应
分解反应
置换反应
复分解反应
原子结构简图
元素符号离子符号
化学方程式化学式化合价
物质
分类
变化
元素
原子
分子
离子
物质
化合物
纯净物
单质
金属单质
非金属单质
稀有气体
物理变化
化
学
变
化
组成结构
性质
物理性质
化学性质
溶剂溶质
1、物质的组成结构
(1)物质的微观构成
构成物质的三种基本微粒:分子,原子,离子。
(2)分子、原子、离子的区别与联系离子结构简图
质子
(3)原子的结构
①每个质子相对原子质量约等于1,约等于一个质子原子的质量。
质子②每个质子带一个单位的正电荷。
③决定元素种类。
原子核①每个中子相对原子质量约等于1,约等于一个氢原子的质量。
原中子②不带电荷。
③决定同类元素中的不同种原子。
子①每个电子带一个单位的负电荷。
②核外电子分层排布, 最外层电子数决定 元素化学性质 的性质。
原子中:核电荷数 = 质子 数 = 核外电子 数=原子序数 相对原子质量≈质子数
+
阳离子:核电荷数= 阴离子:核电荷数=
(4)物质的宏观组成(物质是由自然界中的一百多种元素组成的) ①、元素:具有相同核电荷数(质子数)一类原子的总称。
②
、
③常见元素及元素符号
④元素符号表示的意义 品种(宏观):表示 一种元素
微粒(微观):①表示该元素的 一个原子 ②表示该元素的相对原子质量 ⑤元素分类及在自然界存在状态
根据元素的原子结构和化学性质,元素可分为金属元素、非金属元素和稀有气体 。
元素在地壳中含量(按质量分数的由大到小)依次为:氧、硅、铝、铁、钙
2、化学用语
(1)常见元素化合价
一价氯钠钾氢银,
二价氧钙钡镁锌,
三铝,四硅,五氮磷,
二、三铁,二、四碳,
二、四、六,硫都齐全,
铜汞二价最常见,
单质零价记心间。
(2)化学式的写法(在化合物中,正负化合价的代数和为零。
)
① 金属、固态非金属、稀有气体直接用元素符号表示。
单质如:Fe、C、He等
书写②气体单质(双原子分子)用A2表示(A表示某种元素)。
如:O2、Cl2
化合物:正价前,负价后,交叉约简,再标数
注意:1,初中化学中常见的原子团有:硫酸根SO42-、硝酸根NO3-、碳酸根CO32-
铵根NH4+、氢氧根OH-
2,原子团不是化学式,是化学式的组成部分。
(3)质量守恒定律
①内容:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总
和。
②实质:从分子—原子观点看,化学变化实质上是参加反应的各物质(反应物)发
生了原子间的重新组合,才使反应物变成生成物。
在一切化学变化中,反应前后
元素(原子)的种类不变,原子的数目不变,原子的质量也不变,所以,
参加反应的各物质的总质量等于反应后所有生成物的总质量。
