初中化学常见实验现象单质烧烧现象
单质氟在氯气中燃烧的现象

单质氟在氯气中燃烧的现象
当我们谈论单质氟在氯气中燃烧的现象时,我们进入了一个充满化学变化和反应的领域。
氟气和氯气都是非常活泼的元素,它们在一起产生的反应是非常引人注目的。
首先,让我们了解一下单质氟和氯气的性质。
氟气是一种非常活泼的元素,它在常温下是一种黄绿色的气体。
氟气具有非常强的氧化性,能够与许多其他元素和化合物发生剧烈的反应。
而氯气也是一种非常活泼的元素,它在常温下是一种黄绿色的气体,具有强烈的刺激性气味。
氯气也具有很强的氧化性,因此它与其他物质接触时也会发生剧烈的化学反应。
当单质氟和氯气混合在一起时,它们会发生激烈的化学反应。
氟气和氯气之间的反应是一种剧烈的氧化还原反应,产生的产物包括氟化氯和氯化氟。
在这个过程中,会释放出大量的能量,产生明亮的火焰和刺激性的气味。
这种反应不仅仅是化学上的奇观,它也具有重要的应用价值。
氟化氯和氯化氟是一些重要的化学中间体,在有机合成和材料制备中有着广泛的应用。
因此,研究单质氟在氯气中燃烧的现象,不仅
可以增进我们对化学反应的理解,也有助于开发新的化学技术和应用。
总之,单质氟在氯气中燃烧的现象是一种令人着迷的化学反应,它展示了化学变化和能量释放的壮观景象。
通过深入研究这种反应,我们可以更好地理解化学反应的本质,同时也可以探索新的化学应
用和技术。
最新人教版九年级化学上册化学方程式及实验现象总结

中考复习资料总结九年级上册化学方程式及实验现象总结一、化合反应1、木炭(碳)在空气中燃烧现象:发出红光..,放出热量,生成能使澄清石灰水变浑浊的气体;在氧气中燃烧现象:发出白光..,放出热量,生成能使澄清石灰水变浑浊的气体。
C+O2点燃CO2(充分燃烧)2C+O2点燃 2 CO (不充分燃烧)2、硫在空气中燃烧现象:发出微弱的淡蓝色......火焰,生成有刺激性气味的气体,放出热量;在氧气中燃烧现象:发出明亮的蓝紫色......火焰,生成有刺激性气味的气体,放出热量。
S+O2点燃SO23、红磷(或者白磷)在空气中燃烧现象:产生大量白烟,放出热量。
4P+5O2点燃2P2O54、注意..铁丝在空气中不能燃烧;在氧气燃烧现象:剧烈燃烧,火星四射,生成黑色固体,放出热量。
3Fe+2O2点燃Fe3O45、镁带在空气中燃烧现象:发出耀眼的白光,冒白烟,生成白色粉末,放出热量。
2Mg+O2点燃2MgO6、氢气在空气(或氧气)中燃烧现象:发出淡蓝色火焰,放出热量,火焰上罩一个干而冷的烧杯,烧杯内壁出现水雾。
2H2+O2点燃2H2O7、铜在空气中加热现象:红色固体逐渐变成黑色2Cu+O2△2CuO8、一氧化碳在空气中燃烧现象:发出蓝色火焰,放出热量,火焰上罩一个涂有澄清石灰水的烧杯,澄清石灰水变浑浊。
2CO+O2点燃2CO29、汞在加热的条件下与氧气反应:2Hg+O2△2HgO10、铝在空气中燃烧:4Al+3O2点燃2Al2O311、二氧化碳通过灼热的碳层:CO2 +C高温2CO12、二氧化碳与水反应:CO2 +H2O == H2CO3(二氧化碳通入紫色石蕊试液,溶液变红的原因)二、分解反应1、氧化汞加热分解:2HgO△2Hg+O2↑2、高锰酸钾制氧气:2KMnO4△K2MnO4+MnO2+O2↑3、氯酸钾制氧气:2KClO3MnO22KCl+3O2↑△MnO24、过氧化氢制氧气:2H2O2 2H2O+O2↑5、电解水:2H2O通电2H2↑+O2↑6、碳酸不稳定,易分解:H2CO3 === H2O+CO2↑ (二氧化碳通入石蕊试液,溶液变红,加热红色变为紫色的原因)三、其他反应1、实验室制取二氧化碳:CaCO3+2HCl==CaCl2+ H2O + CO2↑ (大理石或石灰石和稀盐酸)2、木炭还原氧化铜:C+2CuO高温2Cu+CO2↑ (CuO为黑色粉末)现象:黑色粉末逐渐变为红色,澄清石灰水变浑浊。
常见的化学式及化学反应现象

初中常见的化学式(1)单质类氢气氧气氮气氯气溴碘氦气氖气碳磷硫硅(2)金属单质钠:镁:铝:钾:钙:铁:锌:铜:钡 : 银: 汞: 锰:(3)化合物类:1、氧化物:水: 过氧化氢: 一氧化碳: 二氧化碳: 二氧化氮: 二氧化硫:三氧化硫: 氧化镁: 氧化铜: 氧化亚铁: 氧化铁: 四氧化铁:氧化铝: 二氧化锰: 氧化镁:氧化钠:2、常见的酸类:盐酸:硝酸:硫酸:磷酸:碳酸:硫化氢:3、常见的碱:氢氧化钠:氢氧化铜:氢氧化铁氢氧化亚铁:氢氧化钙:氢氧化钾:氢氧化钡:氢氧化镁:氢氧化锌:氢氧化铝:4、盐类硝酸钠:硝酸钾:硝酸铜:硝酸铁:硝酸亚铁:硝酸钙:硝酸钡:硝酸镁:硝酸锌:硝酸铝:硝酸铵:碳酸钠:碳酸钾:碳酸铜:碳酸钙:碳酸锌:碳酸镁:碳酸铵:硫酸钠:硫酸钾:硫酸铜:硫酸铁:硫酸亚铁:硫酸钙:硫酸钡:硫酸锌:硫酸镁:硫酸铝:硫酸铵:氯酸钾:氯化钠:氯化铵:氯化铁:氯化亚铁:氯化铜:氯化锌:高锰酸钾:碳酸氢钠:碳酸氢铵:碱式碳酸铜:(4)常见有机物甲烷:乙炔:甲醇:乙醇:乙酸:(5)常见的化肥尿素:硝酸铵:硫酸铵:碳酸氢铵:氯化铵:(6)常见的结晶水合物碱式碳酸铜:明矾:蓝矾:常见的化学反应现象及其反应方程式两种物质生成另一种物质的反应)燃烧:(1)在空气中燃烧:发出,放出,。
(2)在氧气中燃烧:发出,放出。
共同点:都能生成使变浑浊的气体是:。
反应方程式:(1)充分燃烧:(2)不充分燃烧:2、硫燃烧:(1)在空气中燃烧:发出微弱的火焰,生成的气体。
这气体是。
放出,。
(2)在氧气中燃烧:发出火焰,生成的气体。
这气体是。
放出。
反应方程式:。
3、磷在氧气中燃烧:产生大量的,这白是:。
放出。
(注:是白烟而不是白雾,白烟是固体,雾是液体)反应方程式:。
4、铁在氧气中燃烧(铁在空气中不能燃烧)现象:剧烈燃烧,,生成黑色固体叫同时放出。
反应方程式:。
(注意:因为这个实验反应很激烈,放出大量的热量,生成的黑色固体会溅落下来,会使集气瓶破裂,因此做这个实验前,要在集气瓶底部放一些沙子或少量的水)5、镁帯在氧气中燃烧:放出耀眼的,冒白烟,生成白色粉末是。
最新初中化学常见实验现象(单质)烧烧现象

部分物质在空气中和氧气中反应的对比:a)碳和氧气反应方程式:C + O2CO2现象:剧烈燃烧,发白光,放热,生成使澄清石灰水变浑浊的气体b)硫和氧气反应方程式:S + O2SO2现象:发出明亮的蓝紫色火焰,放热,生成有刺激性气味的气体注意:实验前应在瓶底放少量水,用来吸收生成的有毒气体。
c)红磷和氧气反应:方程式:4P + 5O22P2O5现象:发出耀眼的白光,放热,生成大量白烟生成的P2O5是固体小颗粒,现象为白烟,不是白雾。
d)铁和氧气的反应:方程式:3Fe + 2O2Fe3O4现象:铁丝剧烈燃烧,火星四射,放出大量热量,生成黑色固体注意:集气瓶底放一层细沙或少量水。
e)镁和氧气反应:方程式:2Mg + O22MgO现象:剧烈燃烧,发出耀眼的白光,放出热量,生成白色粉末状固体,有白烟。
注意:不能手持镁条,应用坩埚钳夹持。
f)石蜡和氧气反应文字表达式:石蜡+氧气水+二氧化碳现象:剧烈燃烧,放出热量,发出白光,如果在火焰上方罩一个干冷烧杯,烧杯内壁有水珠,生成使澄清石灰水变浑浊的气体。
烟和雾的区别:a)烟:大量固体小颗粒分散在空气长产生烟。
红磷燃烧产生大量白烟,是燃烧生成的固体P2O5分散在空气中形成的b)雾:大量小液滴分散在气体中产生雾。
打开盛浓盐酸的瓶塞,瓶口有白雾,是挥发的HCl 气体遇到空气中的水蒸气形成了盐酸小液滴。
a)光:固体物质燃烧使发光。
镁条燃烧发出耀眼的强光,木炭在氧气中燃烧产生白光b)气体物质和容易气化的物质燃烧时产生火焰。
蜡烛在氧气中燃烧产生白色的火焰,是石蜡熔化后生成的气体燃烧而产生的。
描述物质在氧气中燃烧的现象的技巧:可按三个顺序从三个方面进行:(1)剧烈燃烧,有什么颜色的光,火焰;(2)放热;(3)生成物的特性酱炒牛柳条:Sautéed Beef Filet in XO Sauce 阿香婆石头烤肉:Beef BBQ with Spicy Sauce八宝菠菜:Spinach with Eight Delicacies白菜豆腐焖酥肉:Braised Pork Cubes with Tofu and Chinese Cabbage 白菜心拌蜇头:Marinated Jellyfish and Chinese Cabbage in Vinaigrette 白灵菇扣鸭掌:Mushrooms with Duck Feet白灵菇牛柳:Stir-Fried Beef Filet with Mushrooms白切鸡:Boiled Chicken with Sauce白灼肥牛:Scalded Beef百叶结烧肉:Stewed Pork Cubes and Tofu Skin in Brown Sauce板栗红烧肉:Braised Pork with Chestnuts拌八爪鱼:Spicy Cuttlefish拌豆腐丝:Shredded Tofu with Sauce拌海螺:Whelks and Cucumber拌苦菜:Mixed Bitter Vegetables拌茄泥:Mashed Eggplant with Garlic拌双耳:Tossed Black and White Fungus拌爽口海苔:Sea Moss with Sauce拌香椿苗:Chinese Toon with Sauce包子:Baozi鲍鱼红烧肉:Braised Pork with Abalone鲍汁扣东坡肉:Braised Dongpo Pork with Abalone Sauce。
化学方程式及现象汇总

化学方程式及现象
一、物质与氧气的反应:
1、单质与氧气的反应:
①镁在空气中燃烧:
现象:
②铁在氧气中燃烧:
现象:
③铜在空气中受热:
现象:
④铝在氧气中燃烧:
现象:
⑤氢气在空气中燃烧:
现象:
⑥红磷在空气中燃烧:
现象:
⑦硫粉在空气中燃烧:
现象:
⑧碳在氧气中充分燃烧:
现象:
⑨碳在氧气中不充分燃烧:
现象:
2、化合物与氧气的反应:
①一氧化碳在氧气中燃烧:
现象:
②甲烷在空气中燃烧:
现象:
③乙炔燃烧:
④酒精在空气中燃烧:
小结:碳氢化合物燃烧一般生成CO2和H2O
二、生成氧气的几个分解反应:
①过氧化氢分解制取氧气(MnO2作催化剂):
②加热氯酸钾(MnO2作催化剂)制取氧气:
③加热高锰酸钾制取氧气:
④水在直流电的作用下分解:
三、与二氧化碳有关的几个反应:
①二氧化碳与水反应:
②碳酸不稳定而分解:
③二氧化碳与澄清石灰水反应:
④二氧化碳与氢氧化钠反应:
⑤石灰石与稀盐酸反应:
⑥饱和碳酸钠溶液与浓盐酸反应:
⑦饱和碳酸钠溶液与硫酸反应:
⑧碳酸氢钠溶液与硫酸反应:
⑨碳酸氢钠溶液与盐酸反应:
⑩镁在二氧化碳中燃烧:
四、几个作业中出现过的常见反应:
①无水硫酸铜与水反应:
②硫酸铜晶体受热分解:
③氢氧化钠与硫酸铜反应:
④钠在氯气中燃烧:
⑤氢气还原氧化铜:
⑥一氧化碳还原氧化铁:
⑦呼吸作用的表达式:
⑧光合作用的表达式:。
初中化学方程式、反应现象总结

初中化学方程式、反应现象总结一.物质与氧气的反应:(1)单质与氧气的反应:1.镁在氧气中燃烧:2Mg + O2点燃2MgO 现象:燃烧、放出大量的热、同时放出耀眼的白光2.铁在氧气中燃烧:3Fe + 2O2点燃Fe3O4 现象:剧烈燃烧、火星四射、放出大量热、生成黑色的固体3.铜在空气中受热:2Cu + O2△2CuO4.铝在空气中与氧气反应:4Al + 3O2===2Al2O35.氢气在氧气中燃烧:2H2 + O2点燃2H2O 现象:淡蓝色的火焰6.红磷在空气中燃烧:4P + 5O2点燃2P2O5 现象:生成白烟7.硫粉燃烧:S + O2点燃SO2 现象:空气中是淡蓝色的火焰;纯氧中是蓝紫色的火焰;同时生成有刺激性气味的气体。
8.碳在氧气中充分燃烧:C + O2点燃CO2 现象:生成能使澄清石灰水变浑浊的气体9.碳在氧气中不充分燃烧:2C + O2点燃2CO10.汞在空气中受热:2Hg + O2△2HgO(2)化合物与氧气的反应:1.一氧化碳在氧气中燃烧:2CO + O2点燃2CO22.甲烷在空气中燃烧:CH4 + 2O2点燃CO2 + 2H2O3.酒精在空气中燃烧:C2H5OH + 3O2点燃2CO2 + 3H2O4.乙炔在氧气中燃烧:2C2H2 + 5O2点燃4CO2 + 2H2O(氧炔焰)二.分解反应:1.双氧水制氧气:2H2O2MnO2△2H2O + O2↑2.水在直流电的作用下分解:2H2O通电2H2↑+ O2↑3.加热碱式碳酸铜:Cu2(OH)2CO3△2CuO + H2O + CO2↑现象:固体由绿色逐渐变成黑色,生成能使澄清石灰水变浑浊的气体4.加热氯酸钾(有少量的二氧化锰):2KClO3 MnO2△2KCl + 3O2↑现象:生成能让带火星的木条复燃的气体5.加热高锰酸钾:2KMnO4△K2MnO4 + MnO2 + O2↑现象:生成能让带火星的木条复燃的气体6.碳酸不稳定而分解:H2CO3 = H2O + CO2↑7.高温煅烧石灰石:CaCO3高温CaO + CO2↑现象:生成能使澄清石灰水变浑浊的气体8.加热碳酸氢铵:NH4HCO3△NH3↑ + H2O + CO2 ↑9.加热氧化汞:2HgO △2Hg + O2↑现象:生成银白色的液体金属10.加热碳酸氢钙:Ca(HCO3)2△3↓+ CO2↑+ H2O 现象:生成白色的沉淀,生成能使澄清石灰水变浑浊的气体三.氧化还原反应:1.氢气还原氧化铜:H2 + CuO △Cu + H2O 现象:由黑色的固体变成红色的,同时有水珠生成2.木炭还原氧化铜:C + 2CuO高温2Cu + CO2↑现象:固体由黑色变成红色并减少,生成能使澄清石灰水变浑浊的气体3.焦炭还原氧化铁:3C + 2Fe2O3高温4Fe + 3CO2↑4.焦炭还原四氧化三铁:2C + Fe3O4高温3Fe + 2CO2↑5.一氧化碳还原氧化铜:CO + CuO △26.一氧化碳还原氧化铁:3CO + Fe2O3高温2Fe + 3CO27.一氧化碳还原四氧化三铁:4CO+ Fe3O4高温3Fe + 4CO2四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质 + 酸 -------- 盐 + 氢气(置换反应)1.锌和稀硫酸:Zn + H2SO4 = ZnSO4 + H2↑2.铁和稀硫酸:Fe + H2SO4 = FeSO4 + H2↑现象:变成浅绿色的溶液,同时放出气体3.镁和稀硫酸:Mg + H2SO4 = MgSO4 + H2↑4.铝和稀硫酸:2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑5.锌和稀盐酸:Zn + 2HCl = ZnCl2 + H2↑6.铁和稀盐酸:Fe + 2HCl = FeCl2 + H2↑现象:铁粉慢慢减少,同时有气体生成,溶液呈浅绿色7.镁和稀盐酸:Mg + 2HCl = MgCl2 + H2↑8.铝和稀盐酸:2Al + 6HCl = 2AlCl3 + 3H2↑(2)金属单质 + 盐(溶液) ------- 另一种盐 + 另一种金属(置换反应)1.铁和硫酸铜溶液:Fe + CuSO4 = FeSO4 + Cu2.锌和硫酸铜溶液:Zn + CuSO4 = ZnSO4 + Cu3.铜和硝酸汞溶液:Cu + Hg(NO3)2 = Cu(NO3)2 + Hg4.铜和硝酸银:Cu + 2AgNO3 = Cu(NO3)2 + 2Ag5.铁和氯化铁:Fe + 2FeCl3 = 3FeCl2现象:铁粉逐渐消失,溶液由黄色变成浅绿色6.铁和硝酸银:Fe + 3AgNO3 = Fe(NO3)2 + 3Ag(3)碱性氧化物 +酸 -------- 盐 + 水1.氧化铁和稀盐酸:Fe2O3 + 6HCl = 2FeCl3 + 3H2O 现象:红色固体逐渐消失,溶液由无色变为黄色2.氧化铁和稀硫酸:Fe2O3 + 3H2SO4 =Fe2(SO4)3 + 3H2O 现象:红色固体逐渐消失,溶液由无色变为黄色3.氧化铜和稀盐酸:CuO + 2HCl = CuCl2 + H2O 现象:黑色固体逐渐消失,溶液由无色变为蓝色4.氧化铜和稀硫酸:CuO + H2SO4 = CuSO4 + H2O 现象:黑色固体逐渐消失,溶液由无色变为蓝色5.氧化镁和稀硫酸:MgO + H2SO4 = MgSO4 + H2O6.氧化钙和稀盐酸:CaO + 2HCl = CaCl2 + H2O(4)酸性氧化物 +碱 -------- 盐 + 水1.氢氧化钠暴露在空气中变质:2NaOH + CO2 = Na2CO3 + H2O2.氢氧化钠吸收二氧化硫气体:2NaOH + SO2 = Na2SO3 + H2O3.氢氧化钠吸收三氧化硫气体:2NaOH + SO3 = Na2SO4 + H2O4.检验二氧化碳气体:Ca(OH)2 + CO2 = CaCO3↓+ H2O 现象:生成白色的沉淀(5)酸 + 碱 -------- 盐 + 水1.盐酸和氢氧化钠:HCl + NaOH = NaCl + H2O2.盐酸和氢氧化铜:2HCl + Cu(OH)2 = CuCl2 + 2H2O 现象:蓝色沉淀逐渐消失,溶液由无色变为蓝色3.盐酸和氢氧化钙:2HCl + Ca(OH)2 = CaCl2 + 2H2O4.盐酸和氢氧化铁:3HCl + Fe(OH)3 = FeCl3 + 3H2O 现象:红棕色絮状沉淀溶解,形成了黄色的溶液5.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 = AlCl3 + 3H2O6.硫酸和氢氧化钠:H2SO4 + 2NaOH = Na2SO4 + 2H2O 现象:酸碱中和反应,现象不明显7.硫酸和氢氧化铜:H2SO4 + Cu(OH)2 = CuSO4 + 2H2O 现象:蓝色沉淀逐渐消失,溶液由无色变为蓝色8.硫酸和氢氧化铁:3H2SO4 + 2Fe(OH)3 = Fe2(SO4)3 + 6H2O9.硝酸和氢氧化钠:HNO3+ NaOH = NaNO3 + H2O 现象:酸碱中和反应,现象不明显10.硝酸和氢氧化铜:2HNO3 + Cu(OH)2 = Cu(NO3)2 + 2H2O 现象:蓝色沉淀逐渐消失,溶液由无色变为蓝色11.硝酸和氢氧化钠:HNO3 + NaOH = NaNO3 + H2O(6)酸 + 盐 -------- 另一种酸 + 另一种盐1.稀盐酸和碳酸钙:2HCl + CaCO3 = CaCl2 + H2O + CO2↑2.稀盐酸和碳酸钠:2HCl + Na2CO3 = 2NaCl + H2O + CO2↑现象:生成能使澄清石灰水变浑浊的气体3.稀盐酸和碳酸氢钠:HCl + NaHCO3 = NaCl + H2O + CO2↑现象:生成能使澄清石灰水变浑浊的气体4.稀盐酸和碳酸镁:2HCl + MgCO3 = MgCl2 + H2O + CO2↑现象:生成能使澄清石灰水变浑浊的气体5.盐酸和硝酸银溶液:HCl + AgNO3= AgCl↓ + HNO3 现象:有白色沉淀生成且不溶于强酸,这个反应用于检验氯离子6.硫酸和碳酸钠:H2SO4 + Na2CO3 = Na2SO4 + H2O + CO2↑现象:生成能使澄清石灰水变浑浊的气体7.硫酸和氯化钡:H2SO4 + BaCl2 = BaSO4↓+ 2HCl现象:生成不溶于强酸的白色沉淀,用于检验硫酸根离子8.硫酸和碳酸钙:H2SO4 + CaCO3 = CaSO4 + H2O + CO2↑现象:生成能使澄清石灰水变浑浊的气体9.硫酸和碳酸氢钠:H2SO4 + 2NaHCO3 = Na2SO4 + 2H2O + 2CO2↑现象:生成能使澄清石灰水变浑浊的气体10.硝酸和碳酸钠:2HNO3 + Na2CO3 = 2NaNO3 + H2O + CO2↑现象:生成能使澄清石灰水变浑浊的气体11.硝酸和碳酸氢钠:HNO3 + NaHCO3 = NaNO3 + H2O + CO2↑现象:生成能使澄清石灰水变浑浊的气体(7)碱 + 盐 -------- 另一种碱 + 另一种盐1.氢氧化钠和硫酸铜:2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4现象:生成了蓝色絮状沉淀2.氢氧化钠和氯化铁:3NaOH + FeCl3 = Fe(OH)3↓ + 3NaCl现象:生成红棕色絮状沉淀3.氢氧化钠和硝酸铁:3NaOH + Fe(NO3)3 = Fe(OH)3↓ + 3NaNO3现象:生成红棕色絮状沉淀4.氢氧化钠和硫酸铁:6NaOH + Fe2(SO4)3 = 2Fe(OH)3↓ + 3Na2SO4现象:生成红棕色絮状沉淀5.氢氧化钠和氯化镁:2NaOH + MgCl2 = Mg(OH)2↓ + 2NaCl现象:生成白色沉淀6.氢氧化钠和氯化铜:2NaOH + CuCl2 = Cu(OH)2↓ + 2NaCl现象:生成了蓝色絮状沉淀7.氢氧化钠和硫酸铜:2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4现象:生成蓝色絮状沉淀8.氢氧化钙和碳酸钠:Ca(OH)2 + Na2CO3 = CaCO3↓ + 2NaOH 现象:生成白色的沉淀9.氢氧化钠和硫酸氢钠:NaOH + NaHSO4 = Na2SO4 + H2O10.氢氧化钠和碳酸氢钠:2NaOH + Ca(HCO3)2 = CaCO3↓ + Na2CO3 + 2H2O 现象:生成白色沉淀11.氢氧化钙和碳酸氢钠:Ca(OH)2 + Ca(HCO3)2 = 2CaCO3↓ + 2H2O 现象:生成白色沉淀12.氢氧化钠和碳酸氢钠:NaOH + NaHCO3 = Na2CO3 + H2O13.氢氧化钠和氯化铵:NaOH + NH4Cl = NH3↑ + H2O + NaCl 现象:有可以使石蕊试纸变蓝的气体生成14.氢氧化钠和硝酸铵:NaOH + NH4NO3 = NH3↑ + H2O + NaNO3现象:有可以使石蕊试纸变蓝的气体生成15.氢氧化钠和硫酸铵:2NaOH + (NH4)2SO4 = 2NH3↑ + 2H2O + Na2SO4现象:有可以使石蕊试纸变蓝的气体生成(8)盐 + 盐 ----- 两种新盐1.氯化钠和硝酸银:NaCl + AgNO3 = AgCl↓ + NaNO3 现象:有白色沉淀生成,且不溶于强酸2.硫酸钠和氯化钡:Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl现象:有白色的不溶于强酸的沉淀生成3.氯化钡和碳酸钠:BaCl2 + Na2CO3 = BaCO3↓ + 2NaCl 现象:有白色沉淀生成但可溶于盐酸和硝酸4.氯化钙和碳酸钠:CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl 现象:生成白色沉淀五.其它反应:1.二氧化碳与水反应:CO2 + H2O = H2CO32.生石灰与水反应:CaO + H2O = Ca(OH)2 现象:放出大量的热3.硫酸铜晶体受热分解:CuSO4·5H2O △CuSO4 + 5H2O 现象:固体由蓝色变为白色4.无水硫酸铜作干燥剂:CuSO4 + 5H2O = CuSO4·5H2O5.CO2 + C高温2CO6.CaCO3 + CO2 + H2O = Ca(HCO3)27.2Na2O2(过氧化钠) + 2H2O = 4NaOH + O2↑现象:有能使带火星的木条复燃的气体生成8.H2 + CuO △2O 现象:固体由黑色逐渐变成红色,同时有水珠生成9.Fe3O4 + 4CO高温3Fe + 4CO216.FeO + CO高温Fe + CO217.Fe2O3 + 3CO高温2Fe + 3CO218.CuO + CO △Cu + CO2现象:固体由黑色变成红色,生成能使澄清石灰水变浑浊的气体六.呼吸、光合作用:1.呼吸作用:C6H12O6 + 6O2 = 6CO2 + 6H2O2.光合作用:6CO2 + 6H2O 光照叶绿素 C6H12O6 + 6O2↑初中化学方程式及其相关知识点总结1.澄清石灰水中通入二氧化碳气体Ca(OH)2 + CO2 = CaCO3↓ + H2O现象:石灰水由澄清变浑浊。
初中化学常见化学反应及现象[1]
![初中化学常见化学反应及现象[1]](https://img.taocdn.com/s3/m/52d6e817b42acfc789eb172ded630b1c59ee9b78.png)
初中化学常见化学反应及现象一、单质和氧气的反应三、八年级常见化学方程式1、铁在氧气中燃烧:3Fe+2O 2======Fe 3O 4食品袋内干燥剂:CaO+H 2O====Ca(OH)2 2、碳在氧气中燃烧:碳在氧气中燃烧: C+O 2======CO 2碳和三氧化二铁:3C+2Fe 2O 3 ======4Fe+3CO 2 3、磷在氧气中燃烧:在氧气中燃烧: 4P+5O 2======2P 2O 5呼吸作用(葡萄糖为例):C 6H 12O 6+6O 2=6CO 2+6H 2O 4、硫在氧气中燃烧:在氧气中燃烧: S+O 2======SO 2光合作用:CO2+HO ————→ 有机物(淀粉)+O 2 5、铝在氧气中燃烧:4Al+3O 2======2Al 2O 3汽车尾气处理:H 2S+H 2SO 4(浓)==SO+S+2H 2O 6、镁在氧气中燃烧:2Mg+O 2======2MgO ,强白光碳酸饮料生产:CO 2+H 2O=H 2CO 37、铜加热:2Cu+O 2======2CuO ,红色变黑色碳酸遇热减压分解:H 2CO 3======CO 2+H 2O 二、制取氧气的方法O 2======2O O+O 2=O 3 1、高锰酸钾加热:2KMnO 4====K 2MnO 4+MnO 2+O 2↑二氧化碳和石灰水:CO 2+Ca(OH)2=CaCO 3↓+H 2O 2、加热氯酸钾:2KClO 3======2KCl+3O 2↑灭火器:Na 2CO 3+H 2SO 4=Na 2SO 4+CO 2↑+H 2O 3、双氧水制氧:2H 2O 2 ==== 2H 2O+O 2↑氮气凝固点:-196℃,氧气:-183℃4、潜艇、飞船:2Na 2O 2+2CO 2==2Na 2CO 3+O 2↑ 石灰石高温烧制石灰:CaCO 3=====CaO+CO2↑ 5、水电解制氧:2H 2O=======2H 2↑+O 2↑四、化合价歌诀记忆法,常见原子团化合价;酸碱盐溶解性歌诀 一价钾钠氯氢银一价钾钠氯氢银 二价硫碳锰酸根二价硫碳锰酸根 SO 42-、CO 32-、SO 32-、MnO 42-二价钙镁铝钡锌二价钙镁铝钡锌 三价只有磷酸根三价只有磷酸根 Ca 2+、Mg 2+、Al 2+、Ba 2+、Zn 2+;PO 43- 一二铜、二三铁一二铜、二三铁 余下全为一价根余下全为一价根 Cu +、Cu 2+;Fe 2+、Fe 3+;OH -、NO 3-、ClO 3-、HCO 3 二四碳二四六硫二四碳二四六硫 除了铵根均为负除了铵根均为负 NH 4+ 三铝四硅五价磷三铝四硅五价磷 一二三四五价氮一二三四五价氮 钾钠硝酸铵盐溶钾钠硝酸铵盐溶 铜汞二价最常见铜汞二价最常见 盐酸盐中银不溶盐酸盐中银不溶 AgCl ↓通常氧显负二价通常氧显负二价 硫酸盐中钡不溶硫酸盐中钡不溶 BaSO 4↓(白色沉淀) 单质零价要牢记单质零价要牢记 溶解有四种:钾钠+钙钡钙钡 氟氯溴碘负一价氟氯溴碘负一价 其余碱盐全不溶其余碱盐全不溶 俗名:生石灰CaO 石灰石石灰石 CaCO 3 铁锈Fe 2O 3 干冰CO 2 熟石灰Ca(OH)2 烧碱/火碱/苛性钠NaOH 硫铁矿FeS 2纯碱Na 2CO 3 小苏打NaHCO 3 波尔多液Cu 2(OH)2SO 4 五、常见离子符号 名称符号名称符号名称符号名称符号名称符号 名称符号钠离子钠离子 Na + 钾离子钾离子 K + 氯离子氯离子 Cl - 高锰酸根MnO 4- 锌离子锌离子Zn 2+ 铝离子 Al 3+ 钙离子钙离子 Ca 2+ 镁离子镁离子 Mg 2+ 氧离子氧离子 O 2- 锰酸根锰酸根MnO 42- 硫酸根硫酸根 SO 42- 氢离子氢离子 H + 铁离子铁离子 Fe 3+ 硫离子硫离子 S 2- 碳酸氢根 HCO 3- 碳酸根碳酸根 CO 32- 银离子Ag + 铜离子铜离子Cu 2+ 铵根铵根NH 4+ 氢氧根氢氧根OH - 亚铁离子Fe 2+ 硝酸根硝酸根NO 3- 六、常见物质的颜色 颜色物 质颜色 物 质黑色 MnO 2、CuO 、C 、FeO 、Fe 3O 4红色 Cu(红)、红磷(暗红)、Fe(OH)2(红褐色)、HgO 、Fe 2O 3(红棕)、NO 2(红棕)、石蕊试液(紫色) 蓝色CuSO 4·5H 2O 、Cu(OH)2、CuSO 4溶液、液态O 2绿色Fe 2+溶液(浅绿) 点 燃点 燃点 燃点 燃点 燃点 燃△△MnO 2,MnO 2 通电光,叶绿体 △紫外线高温黄色S、Fe3+溶液(棕黄) 难溶白色固体CaCO3、BaSO4、AgCl、Mg(OH)2:BaSO4和AgCl均不溶于盐酸、稀硝酸七、化学式一氧化碳CO 四氧化三铁Fe3O4 氢氧化钙Ca(OH)2 氯化镁MgCl2碳酸钙CaCO3 碳酸铵(NH4)2CO3 二氧化碳CO2 三氧化二铁Fe2O3 氢氧化铝Al(OH)3 氯化钙CaCl2 硫酸铝Al2(SO4)3 氯酸钾KClO3 二氧化硫SO2 氧化钙CaO 氢氧化铁Fa(OH)3 氯化铁FeCl3 硫酸亚铁FeSO4 高锰酸钾KMnO4 三氧化硫SO3 氧化汞HgO 氢氧化亚铁Fe(OH)2 氯化铜CuCl2 硫酸铁Fe2(SO4)3 锰酸钾K2MnO4 水H2O 二氧化硅SiO2 氢氧化铜Cu(OH)2 氯化铝AlCl3 硫酸铜CuSO4 碳酸钠Na2CO3 过氧化氢H2O2 氯气Cl2 氮气N2 氯化钡BaCl2 硫酸钠Na2SO4 碳酸钾K2CO3 五氧化二磷P2O5氯化氢HCl 氧气O2 氯化银AgCl 硫酸钾K2SO4 碳酸氢铵NH4HCO3氧化镁MgO 硝酸HNO3 氨气NH3 氯化钠NaCl 硝酸钾KNO3 硝酸铁Fe(NO3)3 氧化铝Al2O3硫酸H2SO4 氢气H2 硫化钠Na2S 硝酸铜Cu(NO3)2 硝酸银AgNO3 氧化铜CuO 碳酸H2CO3 甲烷CH4 硫化钾K2S硝酸铝Al(NO3)3 氧化锌ZnO 氢氧化钠NaOH 乙醇/酒精C2H5OH乙炔C2H2硝酸铵NH4NO3 二氧化锰MnO2 氢氧化钾KOH 氯化钾KCl 硫酸锌ZnSO4 氯化铵NH4Cl 氧化钠Na2O氢氧化镁Mg(OH)2氯化锌ZnCl2 硫酸镁MgSO4 硫酸铵(NH4)2 SO4八、反应化学方程式及现象反应方程式现象用途盐酸HCl H+Cl-NaOH+HCl=NaCl+H2O Al(OH)3+3HCl=AlCl3+3H2O Mg(OH)2+2HCl=MgCl2+H2O Na2CO3+2HCl=2NaCl+H2O+CO2↑CaCO3+2HCl=CaCl2+H2O+CO2↑Fe2O3+6HCl=2FeCl3+3H2O Fe+2HCl=FeCl2+H2↑CuO+2HCl=CuCl2+H2O石蕊试液遇碱变蓝,遇酸变红石蕊试液遇碱变蓝,遇酸变红固体溶解,气泡产生固体溶解,气泡产生铁锈溶解,溶液变黄色铁锈溶解,溶液变黄色气泡产生,溶液变浅绿色气泡产生,溶液变浅绿色黑色粉末消失,溶液变蓝绿色黑色粉末消失,溶液变蓝绿色医学上用以中和胃酸过多CO2灭火器制取CO2气体Mg+2HCl=MgCl2+H2↑2Al+6HCl=2AlCl3+3H2↑Zn+2HCl=ZnCl2+H2↑金属+酸= 盐+氢气氢气金属氧化物+酸= 盐+水碱+酸= 盐+水盐+酸= 新盐+新酸新酸稀硫酸(H2SO4)H+SO42-Zn+H2SO4 = ZnSO4+H2↑2Al+3H2SO4 = 2Al2(SO4)3+3H2↑Mg+H2SO4 = MgSO4+H2↑Fe2O3+3H2SO4=2Fe2(SO4)3+3H2O CuO+H2SO4= Cu SO4+H2O Al2O3+6HCl = 2AlCl3+3H2O Cu(OH)2+H2SO4= Cu SO4+2H2O BaCl2+H2SO4= Ba SO4↓+2HCl Ba(NO3)2+H2SO4= Ba SO4↓+2HNO3单质+化合物=新单质+新化合物新化合物非金属氧化物+碱= 盐+水碱+盐= 新碱+新盐新盐盐+盐= 新盐+新盐新盐棕黄色粉末溶解,溶液浅黄色黑色粉末消失,溶液蓝色黑色粉末消失,溶液蓝色蓝色固体溶解,溶液变蓝色蓝色固体溶解,溶液变蓝色白色沉淀,加稀硝酸不溶解白色沉淀,加稀硝酸不溶解 Ba(NO3)2和稀硝酸检验SO42-存在2NaOH+H2SO4= Na2SO4+2H2O 精练石油用以中和酸2NaOH+SO 2 = Na 2SO 3+H 2O Ca(OH)2+2HCl = CaCl 2+2H 2O Ca(OH)2+CO 2 = CaCO 3↓+H 2O CuCl 2+Ca(OH)2 = Cu(OH)2↓+CaCl 2 CuCl 2+2NaOH = Cu(OH)2↓+2NaCl FeCl 3+3NaOH = Fe(OH)3+3NaCl 2FeCl 3+3Ca(OH)2 = 2Fe(OH)3↓+3CaCl 2蓝色溶液中出现 蓝色絮状沉淀 黄色溶液中出现 红褐色絮状沉淀农业用熟石灰中和酸白色絮状沉淀白色絮状沉淀检验Cu 2+的存在的存在检验Fe 3+的存在的存在八、(续表)反应方程式(续)现 象(续)用 途(续) 波尔多液的制作 CuSO 4+H 2O+Ca(OH)2 = Cu(OH)2SO 4Al(OH)3+3HCl = AlCl 3+3H 2O 2NaOH+CO 2 = Na2CO 3+H 2O 2NaOH+SiO 2 = Na 2SiO 3+H 2O 要求密封保存的原因要求密封保存的原因试剂瓶都用橡胶塞或软木塞试剂瓶都用橡胶塞或软木塞 中和胃酸中和胃酸Na 2CO 3+Ca(OH)2=CaCO 3↓+2NaOH Na 2CO 3+2HCl=2NaCl+H 2O+CO 2↑ Ca(OH)2+H 2CO 3=CaCO 3↓+2H 2O CaCO 3+2HCl=CaCl 2+H 2O+CO 2↑CaCO 3====CaO+CO 2↑ AgNO 3+NaCl=AgCl↓+NaNO 3 Na 2CO 3+CaCl 2 = CaCO 3↓+2NaCl 白色沉淀白色沉淀气体放出,可熄灭火柴气体放出,可熄灭火柴白色絮状沉淀,不溶于稀硝酸白色絮状沉淀,不溶于稀硝酸NH 3+H 2O+CO 2 = NH 4HCO 3(碳铵) 2NH 3+H 2SO 4 = (NH 4)2SO 4(硫铵) (NH 4)2SO 4+2NaOH=2NH 3↑+2H 2O+Na 2SO 4刺激性气味气体可使红色石蕊变蓝色,检验铵盐的存在K > Ca > Na > Mg > Al > Zn > Fe > Sn > Pb > (H) > Cu > Hg > Ag > Pt > Au 金属和氧 2Mg+O 2===2MgO ,反应剧烈,强烈白光,反应剧烈,强烈白光 2Cu+O 2===2CuO ,表面红色变黑色,表面红色变黑色 2Na+2H 2O=2NaOH+H 2↑2NaOH+CuSO 4=Na 2SO 4+Cu(OH)2↓金属和酸Mg+2HCl = MgCl 2+H 2↑ Mg+H 2SO 4 = MgSO 4+H 2↑ 2Al+6HCl=2AlCl 3+3H 2↑2Al+3H 2SO 4=Al 2(SO 4)3+3H 2↑ Zn+2HCl=ZnCl 2+H 2↑ Zn+H 2SO 4=ZnSO 4+H2↑置换反应模式:(A+BC=AC+B ) 单质+化合物=新化合物+新单质新单质复分解反应模式:(AB+CD=AD+CB) 化合物+化合物=新化合物+新化合物金属和盐Cu+2AgNO 3=Cu(NO 3)2+2Ag Fe+CuSO 4=FeSO 4+Cu Zn+CuSO 4=ZnSO 4+Cu ,氧化-还原反应还原反应 反应物中元素之间电子发生转移的反应反应物中元素之间电子发生转移的反应非金属和盐Cl 2+2NaBr=2NaCl+Br 2 I 2+Na 2S = 2NaI+S ↓ Br 2+2KI = 2KBr+I 2↓有机物含碳的化合物,除碳的氧化物、碳酸、碳酸盐外。
初中化学四大基本反应类型

初中化学四大基本反应类型一、化合反应1、镁在空气中燃烧: 2Mg + O2 =点燃= 2MgO现象:(1)发出耀眼的白光(2)放出热量(3)生成白色粉末2、铁在氧气中燃烧:3Fe + 2O2 =点燃= Fe3O4现象:(1)剧烈燃烧,火星四射(2)放出热量(3)生成一种黑色固体注意:瓶底要放少量水或细沙,防止生成的固体物质溅落下来,炸裂瓶底。
3、铜在空气中受热:2Cu + O2 =△= 2CuO 现象:铜丝变黑。
4、铝在空气中燃烧:4Al + 3O2 =点燃= 2Al2O3 现象:发出耀眼的白光,放热,有白色固体生成。
5、氢气中空气中燃烧:2H2 + O2 =点燃= 2H2O现象:(1)产生淡蓝色火焰(2)放出热量(3)烧杯内壁出现水雾。
6、红(白)磷在空气中燃烧:4P + 5O2 =点燃= 2P2O5 现象:(1)发出白光(2)放出热量(3)生成大量白烟。
7、硫粉在空气中燃烧: S + O2 =点燃= SO2现象:A、在纯的氧气中发出明亮的蓝紫火焰,放出热量,生成一种有刺激性气味的气体。
B、在空气中燃烧(1)发出淡蓝色火焰(2)放出热量(3)生成一种有刺激性气味的气体。
8、碳在氧气中充分燃烧:C + O2 =点燃= CO2现象:(1)发出白光(2)放出热量(3)澄清石灰水变浑浊9、碳在氧气中不充分燃烧:2C + O2 =点燃= 2CO10、二氧化碳通过灼热碳层: C + CO2 =高温= 2CO(是吸热的反应)11、一氧化碳在氧气中燃烧:2CO + O2 =点燃= 2CO2 现象:发出蓝色的火焰,放热,澄清石灰水变浑浊。
12、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO3 现象:石蕊试液由紫色变成红色。
注意:酸性氧化物+水→酸如:SO2 + H2O === H2SO3 SO3 + H2O === H2SO413、生石灰溶于水:CaO + H2O === Ca(OH)2(此反应放出热量)注意:碱性氧化物+水→碱氧化钠溶于水:Na2O + H2O =2NaOH 氧化钾溶于水:K2O + H2O=2KOH 氧化钡溶于水:BaO + H2O=Ba (OH)214、钠在氯气中燃烧:2Na + Cl2=点燃= 2NaCl15、无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4•5H2O二、分解反应:1、水在直流电的作用下分解:2H2O= 通电= 2H2↑+ O2 ↑现象:(1)电极上有气泡产生。
初中化学方程式及现象总结

初中化学方程式现象总结一.物质与氧气的反应:(1)单质与氧气的反应:1.镁在氧气中燃烧:2Mg + O2点燃2MgO 现象:燃烧、放出大量的热、同时放出耀眼的白光2.铁在氧气中燃烧:3Fe + 2O2点燃Fe3O4 现象:剧烈燃烧、火星四射、生成黑色的固体3.铜在氧气中受热:2Cu + O2加热2CuO4.铝在空气中燃烧:4Al + 3O2点燃2Al2O35.氢气在氧气中燃烧:2H2 + O2点燃2H2O 现象:淡蓝色的火焰6.红磷在空气中燃烧:4P + 5O2点燃2P2O5 现象:生成白烟7.硫粉在氧气中燃烧:S + O2点燃SO2 现象:空气中是淡蓝色的火焰;纯氧中是蓝紫色的火焰;同时生成有刺激性气味的气体。
8.碳在氧气中充分燃烧:C + O2点燃CO2 现象:生成能够让纯净的石灰水浑浊的气体9.碳在氧气中不充分燃烧:2C + O2点燃2CO 现象:燃烧现象外,其他现象不明显10.汞(水银)在氧气中燃烧:2Hg + O2点燃2HgO(2)化合物与氧气的反应:1.一氧化碳在氧气中燃烧:2CO + O2点燃2CO22.甲烷在空气中燃烧:CH4 + 2O2点燃CO2 + 2H2O3.酒精在空气中燃烧:C2H5OH + 3O2点燃2CO2 + 3H2O4.乙炔在氧气中燃烧:2C2H2 + 5O2点燃4CO2 + 2H2O(氧炔焰)5.二氧化硫与氧气反应:2SO2 + O2 尘埃2SO3二.分解反应:1.双氧水催化制氧气:2H2O2 MnO2催化2H2O + O2↑现象:溶液里冒出大量的气泡2.水在直流电的作用下分解:2H2O通电2H2↑+ O2↑3.加热碱式碳酸铜:Cu2(OH)2CO3加热2CuO + H2O + CO2↑现象:固体由绿色逐渐变成黑色,同时有能使纯净石灰水变浑浊的气体生成4.加热氯酸钾(有少量的二氧化锰):2KClO3 = 2KCl + 3O2↑现象:生成能让带火星的木条复燃的气体5.加热高锰酸钾:2KMnO4加热K2MnO4 + MnO2 + O2↑现象:生成能让带火星的木条复燃的气体6.碳酸不稳定而分解:H2CO3 = H2O + CO2↑7.高温煅烧石灰石:CaCO3高温CaO + CO2↑现象:有能使纯净石灰水变浑浊的气体生成8.加热碳酸氢铵:NH4HCO3 = NH3↑ + H2O + CO2 ↑9.加热氧化汞:2HgO加热2Hg + O2↑现象:生成银白色的液体金属10.加热碳酸氢钙:Ca(HCO3)2加热CaCO3↓+ CO2↑+ H2O 现象:生成白色的沉淀,同时有能使纯净的石灰水变浑浊的气体生成三.氧化还原反应:1.氢气还原氧化铜:H2 + CuO加热Cu + H2O 现象:由黑色的固体变成红色的,同时有水珠生成2.木炭还原氧化铜:C + 2CuO高温2Cu + CO2↑现象:固体由黑色变成红色并减少,同时有能使纯净石灰水变浑浊的气体生成3.焦炭还原氧化铁:3C + 2Fe2O3高温4Fe + 3CO2↑现象:固体由红色逐渐变成银白色,同时黑色的固体减少,有能使纯净的石灰水变浑浊的气体生成4.焦炭还原四氧化三铁:2C + Fe3O4高温3Fe + 2CO2↑5.一氧化碳还原氧化铜:CO + CuO加热Cu + CO26.一氧化碳还原氧化铁:3CO + Fe2O3高温2Fe + 3CO27.一氧化碳还原四氧化三铁:4CO+ Fe3O4高温3Fe + 4CO2四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质 + 酸 -------- 盐 + 氢气(置换反应)1.锌和稀硫酸:Zn + H2SO4 = ZnSO4 + H2↑现象:有可燃烧的气体生成2.铁和稀硫酸:Fe + H2SO4 = FeSO4 + H2↑现象:变成浅绿色的溶液,同时放出气体3.镁和稀硫酸:Mg + H2SO4 = MgSO4 + H2↑现象:有可燃烧的气体生成4.铝和稀硫酸:2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑现象:有气体生成5.锌和稀盐酸:Zn + 2HCl = ZnCl2 + H2↑现象:有气体生成6.铁和稀盐酸:Fe + 2HCl = FeCl2 + H2↑现象:铁粉慢慢减少,同时有气体生成,溶液呈浅绿色7.镁和稀盐酸:Mg + 2HCl = MgCl2 + H2↑现象:有气体生成8.铝和稀盐酸:2Al + 6HCl = 2AlCl3 + 3H2↑现象:有气体生成9.银和稀硝酸:3Ag + 4HNO3(稀) = 3AgNO3 + NO↑+ 2H2O 现象:银逐渐溶解,生成气体遇空气变棕色10.银和浓硝酸:Ag + 2HNO3(浓) = AgNO3 + NO2↑+ H2O 现象:银逐渐溶解,生成棕色气体11.铜和浓硫酸:Cu + 2H2SO4(浓) = CuSO4 + SO2↑+ 2H2O 现象:铜逐渐溶解,生成有刺激性气味的气体12.铜和硝酸银:Cu + 2AgNO3 = Cu(NO3)2 + 2Ag 现象:铜表面慢慢生成了银白色金属(2)金属单质 + 盐(溶液) ------- 另一种盐 + 另一种金属(置换反应)1.铁和硫酸铜溶液:Fe + CuSO4 = FeSO4 + Cu 现象:铁溶解生成红色金属2.锌和硫酸铜溶液:Zn + CuSO4 = ZnSO4 + Cu 现象:有红色金属生成3.铜和硝酸汞溶液:Cu + Hg(NO3)2 = Cu(NO3)2 + Hg4.铜和硝酸银:Cu + 2AgNO3 = Cu(NO3)2 + 2Ag 现象:红色的铜逐渐溶解,同时有银白色的金属生成5.铁和氯化铁:Fe + 2FeCl3 = 3FeCl2现象:铁粉逐渐溶解,溶液由黄色变成浅绿色6.铁和硝酸银:Fe + AgNO3 = Fe(NO3)2 + Ag 现象:铁溶解生成银白色的金属7.锌和氯化亚铁:Zn + FeCl2 = ZnCl2 + Fe 现象:锌粉慢慢溶解,生成铁(3)碱性氧化物 +酸 -------- 盐 + 水1.氧化铁和稀盐酸:Fe2O3 + 6HCl = 2FeCl3 + 3H2O 现象:红色固体逐渐溶解,形成黄色的溶液2.氧化铁和稀硫酸:Fe2O3 + 3H2SO4 =Fe2(SO4)3 + 3H2O 现象:红色固体溶解,生成黄色溶液3.氧化铜和稀盐酸:CuO + 2HCl = CuCl2 + H2O 现象:黑色固体溶解,生成黄绿色的溶液4.氧化铜和稀硫酸:CuO + H2SO4 = CuSO4 + H2O 现象:黑色固体溶解,生成蓝色溶液5.氧化镁和稀硫酸:MgO + H2SO4 = MgSO4 + H2O6.氧化钙和稀盐酸:CaO + 2HCl = CaCl2 + H2O7.氧化铁和稀硝酸:Fe2O3 + 6HNO3 = 2Fe(NO3)3 + 3H2O 现象:红色固体溶解,生成黄色溶液8.氧化铜和稀硝酸:CuO + 2HNO3 = Cu(NO3)2+ H2O 现象:黑色固体溶解,生成蓝色溶液(4)酸性氧化物 +碱 -------- 盐 + 水1.氢氧化钠暴露在空气中变质:2NaOH + CO2 = Na2CO3 + H2O 现象:无明显现象2.氢氧化钠吸收二氧化硫气体:2NaOH + SO2 = Na2SO3 + H2O3.氢氧化钠吸收三氧化硫气体:2NaOH + SO3 = Na2SO4 + H2O4.熟石灰放在空气中变质:Ca(OH)2 + CO2 = CaCO3↓+ H2O 现象:生成白色的沉淀,用于检验二氧化碳5.熟石灰吸收二氧化硫:Ca(OH)2 + SO2 = CaSO3↓+ H2O(5)酸 + 碱 -------- 盐 + 水1.盐酸和氢氧化钠:HCl + NaOH = NaCl + H2O 现象:酸碱中和反应,现象不明显2.盐酸和氢氧化钾:HCl + KOH = KCl + H2O 现象:酸碱中和反应,现象不明显3.盐酸和氢氧化铜:2HCl + Cu(OH)2 = CuCl2 + 2H2O 现象:蓝色沉淀溶解,形成黄绿色的溶液4.盐酸和氢氧化钙:2HCl + Ca(OH)2 = CaCl2 + 2H2O5.盐酸和氢氧化铁:3HCl + Fe(OH)3 = FeCl3 + 3H2O 现象:红棕色絮状沉淀溶解,形成了黄色的溶液6.盐酸和氢氧化亚铁:2HCl + Fe(OH)2 = FeCl2 + 2H2O 现象:白色絮状沉淀溶解,溶液呈浅绿色7.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 = AlCl3 + 3H2O8.硫酸和氢氧化钠:H2SO4 + 2NaOH = Na2SO4 + 2H2O 现象:酸碱中和反应,现象不明显9.硫酸和氢氧化钾:H2SO4 + 2KOH = K2SO4 + 2H2O 现象:酸碱中和反应,现象不明显10.硫酸和氢氧化铜:H2SO4 + Cu(OH)2 = CuSO4 + 2H2O 现象:蓝色沉淀溶解,生成蓝色溶液11.硫酸和氢氧化铁:3H2SO4 + 2Fe(OH)3 = Fe2(SO4)3 + 6H2O12.硝酸和氢氧化钠:HNO3+ NaOH = NaNO3 + H2O 现象:酸碱中和反应,现象不明显13.硝酸和氢氧化铜:2HNO3 + Cu(OH)2 = Cu(NO3)2 + 2H2O 现象:蓝色沉淀溶解,生成蓝色溶液14.硝酸和氢氧化钠:HNO3 + NaOH = NaNO3 + H2O 现象:酸碱中和反应,现象不明显15.硝酸和氢氧化钾:HNO3 + KOH = NaNO3 + H2O 现象:酸碱中和反应,现象不明显16.硝酸和氢氧化镁:2HNO3 + Mg(OH)2 = Mg(NO3)2 + 2H2O 现象:白色沉淀溶解17.氨水和硫酸:2NH3·H2O + H2SO4 = (NH4)2SO4 + 2H2O(6)酸 + 盐 -------- 另一种酸 + 另一种盐1.稀盐酸和碳酸钙:2HCl + CaCO3 = CaCl2 + H2O + CO2↑现象:白色固体溶解,生成能使纯净石灰水变浑浊的气体2.稀盐酸和碳酸钠:2HCl + Na2CO3 = 2NaCl + H2O + CO2↑现象:生成能使纯净石灰水变浑浊的气体3.稀盐酸和碳酸氢钠:HCl + NaHCO3 = NaCl + H2O + CO2↑现象:生成能使纯净石灰水变浑浊的气体4.稀盐酸和碳酸镁:2HCl + MgCO3 = MgCl2 + H2O + CO2↑现象:生成能使纯净石灰水变浑浊的气体5.盐酸和硝酸银溶液:HCl + AgNO3= AgCl↓ + HNO3 现象:有白色沉淀生成且不溶于强酸,这个反应用于检验氯离子6.硫酸和碳酸钠:H2SO4 + Na2CO3 = Na2SO4 + H2O + CO2↑现象:生成能使纯净石灰水变浑浊的气体7.硫酸和氯化钡:H2SO4 + BaCl2 = BaSO4↓+ 2HCl现象:生成不溶于强酸的白色沉淀,用于检验硫酸根离子8.硫酸和碳酸钙:H2SO4 + CaCO3 = CaSO4 + H2O + CO2↑现象:生成能使纯净石灰水变浑浊的气体9.硫酸和碳酸氢钠:H2SO4 + 2NaHCO3 = Na2SO4 + 2H2O + 2CO2↑现象:生成能使纯净石灰水变浑浊的气体10.硝酸和碳酸钙:2HNO3 + CaCO3 = Ca(NO3)2 + H2O + CO2↑现象:白色固体溶解,生成能使纯净石灰水变浑浊的气体11.硝酸和碳酸钠:2HNO3 + Na2CO3 = 2NaNO3 + H2O + CO2↑现象:生成能使纯净石灰水变浑浊的气体12.硝酸和碳酸氢钠:HNO3 + NaHCO3 = NaNO3 + H2O + CO2↑现象:生成能使纯净石灰水变浑浊的气体(7)碱 + 盐 -------- 另一种碱 + 另一种盐1.氢氧化钠和硫酸铜:2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO42.氢氧化钠和氯化铁:3NaOH + FeCl3 = Fe(OH)3↓ + 3NaCl现象:生成红棕色絮状沉淀3.氢氧化钠和硝酸铁:3NaOH + Fe(NO3)3 = Fe(OH)3↓ + 3NaNO3现象:生成红棕色絮状沉淀4.氢氧化钠和硫酸铁:6NaOH + Fe2(SO4)3 = 2Fe(OH)3↓ + 3Na2SO4现象:生成红棕色絮状沉淀5.氢氧化钾和氯化铁:3KOH + FeCl3 = Fe(OH)3↓ + 3KCl现象:生成红棕色絮状沉淀6.氢氧化钠和氯化亚铁:2NaOH + FeCl2 = Fe(OH)2↓ + NaCl 现象:有白色絮状沉淀生成7.氢氧化钠和硝酸亚铁:2NaOH + Fe(NO3)2 = Fe(OH)2↓ + 2NaNO3现象:生成白色絮状沉淀8.氢氧化钠和硫酸亚铁:2NaOH + FeSO4 = Fe(OH)2↓ + Na2SO4 现象:生成白色絮状沉淀9.氢氧化钠和氯化镁:2NaOH + MgCl2 = Mg(OH)2↓ + 2NaCl现象:生成白色沉淀10.氢氧化钠和硝酸镁:2NaOH + Mg(NO3)2 = Mg(OH)2↓ + 2NaNO3现象:生成白色沉淀11.氢氧化钠和硫酸镁:2NaOH + MgSO4 = Mg(OH)2↓ + Na2SO4现象:生成白色沉淀12.氢氧化钠和氯化铜:2NaOH + CuCl2 = Cu(OH)2↓ + 2NaCl现象:生成了蓝色絮状沉淀13.氢氧化钠和硝酸铜:2NaOH + Cu(NO3)2 = Cu(OH)2↓ + 2NaNO3现象:生成蓝色絮状沉淀14.氢氧化钠和硫酸铜:2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4现象:生成蓝色絮状沉淀15.氢氧化钙和碳酸钠:Ca(OH)2 + Na2CO3 = CaCO3↓ + 2NaOH 现象:生成白色的沉淀16.氢氧化钙和硫酸铜:Ca(OH)2 + CuSO4 = Cu(OH)2↓ + CaSO417.氢氧化钠和硫酸氢钠:NaOH + NaHSO4 = Na2SO4 + H2O 现象:无明显现象18.氢氧化钠和碳酸氢钠:2NaOH + Ca(HCO3)2 = CaCO3↓ + Na2CO3 + 2H2O 现象:生成白色沉淀19.氢氧化钙和碳酸氢钠:Ca(OH)2 + Ca(HCO3)2 = 2CaCO3↓ + 2H2O 现象:生成白色沉淀20.氢氧化钠和碳酸钠:NaOH + NaHCO3 = Na2CO3 + H2O 现象:不明显21.氢氧化钠和氯化铵:NaOH + NH4Cl = NH3↑ + H2O + NaCl 现象:有可以使石蕊试纸变蓝的气体生成22.氢氧化钠和硝酸铵:NaOH + NH4NO3 = NH3↑ + H2O + NaNO3现象:有可以使石蕊试纸变蓝的气体生成23.氢氧化钠和硫酸铵:2NaOH + (NH4)2SO4 = 2NH3↑ + 2H2O + Na2SO4现象:有可以使石蕊试纸变蓝的气体生成(8)盐 + 盐 ----- 两种新盐1.氯化钠和硝酸银:NaCl + AgNO3 = AgCl↓ + NaNO3 现象:有白色沉淀生成,且不溶于强酸2.硫酸钠和氯化钡:Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl现象:有白色的不溶于强酸的沉淀生成3.硝酸银和硫酸钠:2AgNO3 + Na2SO4 = Ag2SO4↓ + 2NaNO3现象:有白色沉淀生成4.氯化钡和碳酸钠:BaCl2 + Na2CO3 = BaCO3↓ + 2NaCl 现象:有白色沉淀生成但可溶于盐酸和硝酸,其实也溶于硫酸,但生成硫酸钡沉淀,不容易看出来5.氯化钙和碳酸钠:CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl 现象:生成白色沉淀五.其它反应:1.二氧化碳溶解于水:CO2 + H2O = H2CO32.生石灰溶于水:CaO + H2O = Ca(OH)2 现象:放出大量的热3.氧化钠溶于水:Na2O + H2O = 2NaOH4.三氧化硫溶于水:SO3 + H2O = H2SO45.硫酸铜晶体受热分解:CuSO4·5H2O加热CuSO4 + 5H2O 现象:固体由蓝色变为白色6.无水硫酸铜作干燥剂:CuSO4 + 5H2O = CuSO4·5H2O7.二氧化硫溶于水:SO2 + H2O = H2SO38.CO2 + C高温2CO↑现象:黑色固体逐渐减少9.3C + 2H2O = CH4 + 2CO↑现象:生成的混和气体叫水煤气,都是可以燃烧的气体10.CaCO3 + CO2 + H2O = Ca(HCO3)2现象:白色固体逐渐溶解11.2Na2O2(过氧化钠) + 2H2O = 4NaOH + O2↑现象:有能使带火星的木条复燃的气体生成12.4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3现象:氢氧化铁在空气中放置一段时间后,会变成红棕色13.2Fe2O3 + 3H2高温2Fe + 3H2O 现象:有水珠生成,固体颜色由红色变成银白色14.H2 + CuO加热Cu + H2O 现象:固体由黑色逐渐变成红色,同时有水珠生成15.Fe3O4 + 4CO = 3Fe + 4CO2↑现象:固体由黑色变成银白色,同时有能使纯净石灰水变浑浊的气体生成16.FeO + CO高温Fe + CO2↑现象:固体由黑色逐渐变成银白色,同时有能使纯净石灰水变浑浊的气体生成17.Fe2O3 + 3CO高温2Fe + 3CO2↑现象:固体由红色逐渐变成银白色,同时有能使纯净石灰水变浑浊的气体生成18.CuO + CO高温Cu + CO2↑现象:固体由黑色变成红色,同时有能使纯净石灰水变浑浊的气体生成六.呼吸、光合作用:1.呼吸作用:C6H12O6 + 6O2 = 6CO2 + 6H2O2.光合作用:6CO2 + 6H2O 光照叶绿素 C6H12O6 + 6O2↑初中化学方程式及其相关知识点总结1.澄清石灰水中通入二氧化碳气体(复分解反应)Ca(OH)2 + CO2 = CaCO3↓ + H2O现象:石灰水由澄清变浑浊。
苏版初中化学课本中一些化学反应的现象总结

苏版初中化学课本中一些化学反应的
注意
(一).描述实验现象时一定要注意试剂的用量,如:
1.固体与液体反应
①.假如液体为少量:应描述为“固体逐步减少”;
②.假如液体为足量或过量:应描述为“固体逐步减少至完全消逝”。
2.有色溶液做反应物的反应
①.假如能消耗有色溶液的另一反应物为少量:应描述为“溶液颜色变浅”,如“蓝色变浅”、“黄色变浅”;
②.假如能消耗有色溶液的另一反应物为足量或过量:应描述出“溶液颜色退去”,如“溶液由蓝色变为无色”、“溶液由黄色变为无色”等。
3.有色固体与气体反应
①.假如能消耗有色固体的气体为少量:应描述为“XX色固体中产生XX色固体”,如黑色固体中产生紫红色固体、红色固体中产生黑色固体等;
②.假如能消耗有色固体的气体为足量或过量:应描述为“XX色固体变成XX色固体”,如黑色固体变为紫红色固体、红色固体变为黑色固体等。
(二)描述实验现象时同时还要注意相应的实验操作
如有关二氧化碳与石灰水的反应,假如是把二氧化碳通入澄清的石灰水中应描述为“澄清的石灰水中导管口产生无色气泡,...”;假如是把澄清的石灰水倒入二氧化碳中应只描述为“澄清的石灰水中显现白色浑浊”。
常见的化学反应及其现象
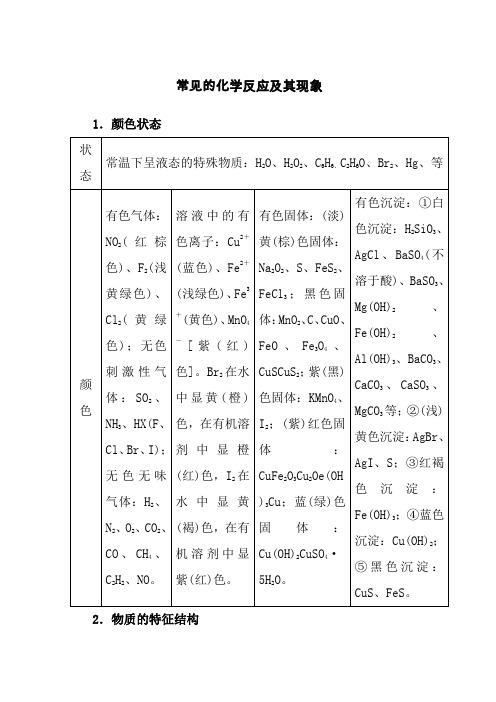
常见的化学反应及其现象1.颜色状态状态常温下呈液态的特殊物质:H2O、H2O2、C6H6、C2H6O、Br2、Hg、等颜色有色气体:NO2(红棕色)、F2(浅黄绿色)、Cl2(黄绿色);无色刺激性气体:SO2、NH3、HX(F、Cl、Br、I);无色无味气体:H2、N2、O2、CO2、CO、CH4、C2H2、NO。
溶液中的有色离子:Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄色)、MnO4-[紫(红)色]。
Br2在水中显黄(橙)色,在有机溶剂中显橙(红)色,I2在水中显黄(褐)色,在有机溶剂中显紫(红)色。
有色固体:(淡)黄(棕)色固体:Na2O2、S、FeS2、FeCl3;黑色固体:MnO2、C、CuO、FeO、Fe3O4、CuSCuS2;紫(黑)色固体:KMnO4、I2;(紫)红色固体:CuFe2O3Cu2Oe(OH)3Cu;蓝(绿)色固体:Cu(OH)2CuSO4·5H2O。
有色沉淀:①白色沉淀:H2SiO3、AgCl、BaSO4(不溶于酸)、BaSO3、Mg(OH)2、Fe(OH)2、Al(OH)3、BaCO3、CaCO3、CaSO3、MgCO3等;②(浅)黄色沉淀:AgBr、AgI、S;③红褐色沉淀:Fe(OH)3;④蓝色沉淀:Cu(OH)2;⑤黑色沉淀:CuS、FeS。
2.物质的特征结构10电子微粒可能为N3-、O2-、F-、OH-、NH2-、Ne、CH4、NH3、H2O、HF、Na+、Mg2+、Al3+、NH4+、H3O+等。
18电子微粒可能为K+、Ca2+、Ar、F2、SiH4、PH3、H2S、HCl、H2O2、N 2H4CH3CH3CH3FCH3OHHS-、S2-、Cl-、O22-等。
14电子微粒可能为CO、N2、C22-常见的正四面体结构有甲烷、CCl4、白磷、NH4+;三角锥形有NH3;直线型的多原子分子可能为CO2。
H的原子核内没有中子。
常见元素中半径最小的是H。
中学阶段中考化学实验现象归纳

中学阶段化学实验现象归纳一.物质与氧气的反应(1)单质与氧气的反应:1.镁在氧气中燃烧:现象:燃烧、放出大量的热、同时放出耀眼的白光2.铁在氧气中燃烧:现象:剧烈燃烧、火星四射、生成黑色的固体3.铜在氧气中受热:4.铝在空气中燃烧:5.氢气在氧气中燃烧:现象:淡蓝色的火焰6.红磷在空气中燃烧:现象:生成白烟7.硫粉在氧气中燃烧:现象:空气中是淡蓝色的火焰;纯氧中是蓝紫色的火焰;同时生成有刺激性气味的气体。
学霸笔记请搜索微博:中考高考冲刺墙8.碳在氧气中充分燃烧:现象:生成能够让纯净的石灰水浑浊的气体9.碳在氧气中不充分燃烧:现象:燃烧现象外,其他现象不明显10.汞(水银)在氧气中燃烧:二、分解反应:1.双氧水催化制氧气:现象:溶液里冒出大量的气泡2.水在直流电的作用下分解:5.加热氯酸钾(有少量的二氧化锰) :6.现象:生成能让带火星的木条复燃的气体7.碳酸不稳定而分解:8.高温煅烧石灰石:9.现象:有能使纯净石灰水变浑浊的气体生成8.加热碳酸氢铵:9.加热氧化汞:现象:生成银白色的液体金属10.加热碳酸氢钙:现象:生成白色的沉淀,同时有能使纯净的石灰水变浑浊的气体生成三,氧化还原反应:1.氢气还原氧化铜:现象:由黑色的固体变成红色的,同时有水珠生成2 .木炭还原氧化铜:现象:银逐渐溶解,生成气体遇空气变棕色10.银和浓硝酸:现象:银逐渐溶解,生成棕色气体11.铜和浓硫酸: 、12.现象:铜逐渐溶解,生成有刺激性气味的气体12.铜和硝酸银:现象:铜表面慢慢生成了银白色金属(2)金属单质+盐(溶液)-----另一种盐+另一种金属(置换反应) 1.铁和硫酸铜溶液:现象:铁溶解生成红色金属2.锌和硫酸铜溶液:现象:有红色金属生成3.铜和硝酸汞溶液:4.铜和硝酸银:现象:红色的铜逐渐溶解,同时有银白色的金属生成5.铁和氯化铁:现象:铁粉逐渐溶解,溶液由黄色变成浅绿色6.铁和硝酸银:现象:铁溶解生成银白色的金属7.锌和氯化亚铁:现象:锌粉慢慢溶解,生成铁(3)碱性氧化物+酸------盐+水1.氧化铁和稀盐酸:现象:红色固体逐渐溶解,形成黄色的溶液2.氧化铁和稀硫酸:现象:红色固体溶解,生成黄色溶液3.氧化铜和稀盐酸:现象:黑色固体溶解,生成黄绿色的溶液.3.氧化铜和稀硫酸:4.现象:黑色固体溶解,生成蓝色溶液5.氧化镁和稀硫酸:6..氣化丐和稀益酸:7.氧化铁和稀硝酸:8.现象:红色固体溶解,生成黄色溶液9.氧化铜和稀硝酸:现象:黑色固体溶解,生成蓝色溶液(4)酸性氧化物+碱盐+水1.氢氧化钠暴露在空气中变质:2.现象:无明显现象资料在微博搜索:考试必备君3.氢氧化钠吸收二氧化硫气体:4..氢氧化钠吸收三氧化硫气体:5.熟石灰放在空气中变质:6.现象:生成白色的沉淀,用于检验二氧化碳5.熟石灰吸收二氧化硫:(5)酸+碱-----盐+水1.盐酸和氢氧化钠:2.盐酸和氢氧化钾:3.盐酸和氢氧化铜:现象:蓝色沉淀溶解,形成黄绿色的溶液4.盐酸和氢氧化钙:5.盐酸和氢氧化铁:6.现象:红棕色絮状沉淀溶解,形成了黄色的溶液7.盐酸和氢氧化亚铁:8.现象:黑色固体溶解,生成黄绿色的溶液.9.10..氧化铜和稀硫酸:11.现象:黑色固体溶解,生成蓝色溶液12.13..氧化镁和稀硫酸:14..氣化丐和稀益酸:15..氧化铁和稀硝酸:16.现象:红色固体溶解,生成黄色溶液17.氧化铜和稀硝酸:18.现象:黑色固体溶解,生成蓝色溶液(4)酸性氧化物+碱19.1.氢氧化钠暴露在空气中变质:20.现象:无明显现象21.2.氢氧化钠吸收二氧化硫气体:22..氢氧化钠吸收三氧化硫气体:23. 4.熟石灰放在空气中变质:24.现象:生成白色的沉淀,用于检验二氧化碳25.5.熟石灰吸收二氧化硫:26.(5)酸+碱-----益+水1.盐酸和氢氧化钠:27.2.盐酸和氢氧化钾:28.3.盐酸和氢氧化铜:29.现象:蓝色沉淀溶解,形成黄绿色的溶液30.4.盐酸和氢氧化钙:31.盐酸和氢氧化铁:32.现象:红棕色絮状沉淀溶解,形成了黄色的溶液33.6.盐酸和氢氧化亚铁:34.现象:白色絮状沉淀溶解,溶液呈浅绿色35.36.7.氢氧化铝药物治疗胃酸过多:37.8.硫酸和氢氧化钠:38.现象:酸碱中和反应,现象不明显,39.9.硫酸和氢氧化钾:40.现象:酸碱中和反应,现象不明显41.10.硫酸和氢氧化铜:42.现象:蓝色沉淀溶解,生成蓝色溶液43.11.硫酸和氢氧化铁:44.12.硝酸和氢氧化钠:45.现象:酸碱中和反应,现象不明显46.13.硝酸和氢氧化铜:47.现象:蓝色沉淀溶解,生成蓝色溶液,48.14.硝酸和氢氧化钠:49.现象:酸碱中和反应,现象不明显50.15.硝酸和氢氧化钾:现象:酸碱中和反应,现象不明显51.16.硝酸和氢氧化镁:52.现象:白色沉淀溶解53.17.氨水和硫酸:54.(6)酸+盐------另一种酸+另一种盐55.56.1.稀盐酸和碳酸钙:57.现象:白色固体溶解,生成能使纯净石灰水变浑浊的气体58. 2.稀盐酸和碳酸钠:59.现象:生成能使纯净石灰水变浑浊的气体60.3.稀盐酸和碳酸氢钠61.现象:生成能使纯净石灰水变浑浊的气体62.4.稀盐酸和碳酸镁:63.现象:生成能使纯净石灰水变浑浊的气体64.22.氢氧化钠和硝酸铵:65.现象:有可以使石蕊试纸变蓝的气体生成66.23.氢氧化钠和硫酸铵:67.现象:有可以使石蕊试纸变蓝的气体生成68.(8)盐+盐-----两种新盐69.1.氯化钠和硝酸银:70.现象:有白色沉淀生成,且不溶于强酸71.2.硫酸钠和氯化钡:72.现象:有白色的不溶于强酸的沉淀生成73.3.硝酸银和硫酸钠:74.现象:有白色沉淀生成75.4.氯化钡和碳酸钠:现象:有白色沉淀生成但可溶于盐酸和硝酸,其实也溶于硫酸,但生成硫酸钡沉淀,不容易看出来76.5.氯化钙和碳酸钠:现象:生成白色沉淀。
初中化学各元素反应方程式及现象

初三化学方程式按元素归类总结编者语:这个总结的主要目的是帮助你应对初三化学的推断题,也就是所谓的框图题的。
当你在做框图题的时候应该看到某一物质时能立刻联想到跟它相关的所有反应,以及反应现象来,从中挑选出符合题目的反应,进而一步步解题。
希望这个小总结能够为你的化学学习带来一点帮助,那编者也就满足了。
因为是按元素来分类,一些反应有重复,望见谅。
与氧有关的化学方程式:2Mg+O2点燃====2MgO 现象:燃烧、放出大量的热、同时放出耀眼的白光S+O2 点燃====SO2 现象:空气中是淡蓝色的火焰;纯氧中是蓝紫色的火焰;同时生成有刺激性气味的气体。
C+O2点燃====CO2 现象:生成能够让纯净的石灰水浑浊的气体2C+O2点燃====2CO 现象:燃烧现象外,其他现象不明显4P+5O2点燃====2P2O5 现象::生成白烟3Fe+2O2点燃====Fe3O4 现象:剧烈燃烧、火星四射、生成黑色的固体2H2+O2点燃====2H2O 现象:淡蓝色的火焰2H2O2MnO2====2H2O+O2↑现象:溶液里冒出大量的气泡2HgO△====2Hg+O2↑现象:生成银白色的液体金属2KClO3MnO2====2KCl+3O2↑现象:生成能让带火星的木条复燃的气体2KMnO4△====K2MnO4+MnO2+O2↑现象:同上,—————————————————分割线————————————————跟氢有关的化学方程式:2H2+O2点燃====2H2O 现象:淡蓝色的火焰Zn+H2SO4==ZnSO4+H2↑现象:有可燃烧的气体生成Mg+H2SO4==MgSO4+H2↑现象:同上Fe+H2SO4 ==FeSO4+H2↑现象:变成浅绿色的溶液,同时放出气体2Al+3H2SO4 ==Al2(SO4)3+3H2↑现象:有气体生成Zn+2HCl==ZnCl2+H2↑现象:同上Mg+2HCl==MgCl2+H2↑现象:同上Fe+2HCl==FeCl2+H2↑现象:溶液变成浅绿色,同时放出气体2Al+6HCl==2AlCl3+3H2↑现象:有气体生成△H2+CuO====Cu+H2O 现象:由黑色的固体变成红色的,同时有水珠生成高温2Fe2O3+3H2 =====2Fe+3H2O 现象:有水珠生成,固体颜色由红色变成银白色————————————————分割线——————————————————跟碳有关的化学方程式:C+O2点燃====CO2(氧气充足的情况下) 现象:生成能让纯净的石灰水变浑浊的气体2C+O2点燃====2CO(氧气不充足的情况下) 现象:不明显高温C+2CuO=====2Cu+CO2↑现象:固体由黑色变成红色并减少,同时有能使纯净石灰水变浑浊的气体生成高温3C+2Fe2O3=====4Fe+3CO2↑现象:固体由红色逐渐变成银白色,同时黑色的固体减少,有能使纯净的石灰水变浑浊的气体生成CO2+C高温====2CO 现象:黑色固体逐渐减少3C+2H2O=CH4+2CO 现象:生成的混和气体叫水煤气,都是可以燃烧的气体跟二氧化碳有关的化学方程式:C+O2点燃====CO2 现象:生成能使纯净的石灰水变浑浊的气体Ca(OH)2+CO2===CaCO3↓+H2O现象:生成白色的沉淀,用于检验二氧化碳CaCO3+CO2+H2O===Ca(HCO3)2 现象:白色固体逐渐溶解Ca(HCO3) △====CaCO3↓+CO2↑+H2O现象:生成白色的沉淀,同时有能使纯净的石灰水变浑浊的气体生成Cu2(OH)2CO3△====2CuO+H2O+CO2↑现象:固体由绿色逐渐变成黑色,同时有能使纯净石灰水变浑浊的气体生成2NaOH+CO2===Na2CO3+H2O(也可为KOH)现象:不明显CaCO3高温====CaO+CO2↑现象:有能使纯净石灰水变浑浊的气体生成跟一氧化碳有关的,但同时也跟二氧化碳有关:Fe3O4+4CO====3Fe+4CO2 现象:固体由黑色变成银白色,同时有能使纯净石灰水变浑浊的气体生成高温FeO+CO===Fe+CO2 现象:固体由黑色逐渐变成银白色,同时有能使纯净石灰水变浑浊的气体生成高温Fe2O3+3CO====2Fe+3CO2 现象:固体由红色逐渐变成银白色,同时有能使纯净石灰水变浑浊的气体生成高温CuO+CO====Cu+CO2 现象:固体由黑色变成红色,同时有能使纯净石灰水变浑浊的气体生成————————————————分割线——————————————————跟盐酸有关的化学方程式:NaOH(也可为KOH)+HCl==NaCl+H2O 现象:不明显HCl+AgNO3==AgCl↓+HNO3现象:有白色沉淀生成,这个反应用于检验氯离子CaCO3+2HCl==CaCl2+H2O+CO2↑现象:百色固体溶解,生成能使纯净石灰水变浑浊的气体Na2CO3+2HCl==2NaCl+H2O+CO2↑现象:生成能使纯净石灰水变浑浊的气体NaHCO3+HCl==NaCl+H2O+CO2↑现象:生成能使纯净石灰水变浑浊的气体Fe2O3+6HCl==2FeCl3+3H2O 现象:红色固体逐渐溶解,形成黄色的溶液Fe(OH)3+3HCl==FeCl3+3H2O 现象:红棕色絮状沉淀溶解,形成了黄色的溶液Cu(OH)2+2HCl==CuCl2+2H2O 现象:蓝色沉淀溶解,形成黄绿色的溶液CuO+2HCl==CuCl2+H2O 现象:黑色固体溶解,生成黄绿色的溶液Zn+2HCl==ZnCl2+H2↑现象:同上Mg+2HCl==MgCl2+H2↑现象:同上Fe+2HCl==FeCl2+H2↑现象:溶液变成浅绿色,同时放出气体2Al+6HCl==2AlCl3+3H2↑现象:有气体生成以上四个反应,盐酸、硫酸都相似,后面两类就不赘述了,读者只需写出配平即可;硝酸一般具有氧化性,所以产物一般不为H2————————————————分割线—————————————————跟硫酸有关的化学方程式:2NaOH(或KOH)+H2SO4==Na2SO4+2H2O 现象:不明显Fe2O3+3H2SO4==Fe2(SO4)3+3H2O 现象:红色固体溶解,生成黄色溶液CuO+H2SO4==CuSO4+H2O 现象:黑色固体溶解,生成蓝色溶液Cu(OH)2+H2SO4==CuSO4+2H2O 现象:蓝色沉淀溶解,生成蓝色溶液H2SO4+BaCl2==BaSO4↓+2HCl现象:生成不溶于强酸的白色沉淀,用于检验硫酸根离子CaCO3+H2SO4==CaSO4+H2O+CO2↑Na2CO3+H2SO4==Na2SO4+H2O+CO2↑2NaHCO3+H2SO4==Na2SO4+2H2O+2CO2↑现象:这三个反应现象同与盐酸反应现象一致————————————————分割线—————————————————跟硝酸有关的化学方程式:Fe2O3+6HNO3==2Fe(NO3)3+3H2O 现象:红色固体溶解,生成黄色溶液CuO+2HNO3==Cu(NO3)2 +H2O 现象:黑色固体溶解,生成蓝色溶液Cu(OH)2+2HNO3==Cu(NO3)2+2H2O 现象:蓝色沉淀溶解,生成蓝色溶液NaOH(或KOH)+HNO3==NaNO3+H2O 现象:不明显Mg(OH)2+2HNO3==Mg(NO3)2+2H2O 现象:白色沉淀溶解CaCO3+2HNO3==Ca(NO3)2+H2O+CO2↑Na2CO3+2HNO3==2NaNO3+H2O+CO2↑NaHCO3+HNO3==NaNO3+H2O+CO2↑现象:以上三个反应现象同与盐酸反应现象一致———————————————分割又见分割——————————————————跟碱有关的化学方程式:NaOH+HCl(或HNO3、H2SO4)==NaCl+H2O 现象:酸碱中和反应,现象不明显CaO+H2O==Ca(OH)2现象:放出大量的热NaOH(KOH)+FeCl3(Fe(NO3)3、Fe2(SO4)3)==Fe(OH)3↓+NaCl现象:生成红棕色絮状沉淀,括号里面的反应过程相似,产物相对应就行了2NaOH(KOH)+FeCl2(Fe(NO3)2、FeSO4)==Fe(OH)2↓+2NaCl现象:生成白色絮状沉淀,括号里面的反映过程相似,产物相对应就行了2NaOH(KOH)+CuCl2(Cu(NO3)2、CuSO4)==Cu(OH)2↓+2NaCl现象:生成蓝色絮状沉淀,括号里面的反应过程相似,产物相对应就行了NH4Cl(NH4NO3、(NH4)2SO4)+NaOH(KOH)==NH3↑+H2O+NaCl现象:有可以使石蕊试纸变蓝的气体生成MgCl2(Mg(NO3)2、MgSO4)+NaOH(KOH)==Mg(OH)2↓+NaCl现象:生成白色沉淀,括号里面的反应过程相似,产物相对应就行了NaHCO3+NaOH==Na2CO3+H2O 现象:不明显此反应的Na换成K是一样的Ca(HCO3)2+2NaOH==CaCO3↓+Na2CO3+2H2O现象:生成白色沉淀,此反应把Na换成K 是一样的2NaOH+CO2==Na2CO3+H2O 现象:无明显现象此反应的Na换成K是一样的Ca(OH)2+CO2==CaCO3↓+H2O现象:产生白色沉淀,此反应用于检验二氧化碳NaHSO4+NaOH==Na2SO4+H2O 现象:无明显现象2NaOH+SO2==Na2SO3+H2O 现象:无明显现象跟钡盐有关的化学方程式:BaCl2+Na2SO4==BaSO4↓+2NaCl现象:有白色的不溶于强酸的沉淀生成BaCl2+Na2CO3==BaCO3↓+2NaCl现象:有白色沉淀生成但可溶于盐酸和硝酸,其实也溶于硫酸,但生成硫酸钡沉淀,不容易看出来跟钙盐有关的化学方程式:CaCl2+Na2CO3==CaCO3↓+2NaCl现象:生成白色沉淀CaCO3+CO2+H2O==Ca(HCO3)2 现象:固体逐渐溶解Ca(HCO3)2+Ca(OH)2==2CaCO3↓+2H2O现象:生成白色沉淀————————————————偶还是分割线—————————————————跟几种金属及其盐有关的化学方程式:铜:CuSO4•5H2O△====CuSO4+5H2O↑现象:固体由蓝色变为白色高温CuO+CO====Cu+CO2 现象:固体由黑色逐渐变成红色,同时有能使纯净的石灰水变浑浊的气体生成△H2+CuO====Cu+H2O 现象:固体由黑色逐渐变成红色,同时有水珠生成Cu+2AgNO3==Cu (NO3)2+2Ag 现象:铜表面慢慢生成了银白色金属CuCl2+2NaOH==Cu (OH) 2↓+2NaCl现象:生成了蓝色絮状沉淀CuO+H2SO4==CuSO4+H2O 现象:黑色固体溶解,生成蓝色溶液Cu (OH) 2+H2SO4==CuSO4+2H2O 现象:蓝色沉淀溶解,生成蓝色溶液Fe(Zn)+CuSO4==FeSO4+Cu 现象:有红色金属生成Cu2(OH)2CO3△====2CuO+H2O+CO2↑现象:固体由绿色逐渐变成黑色,同时有能使纯净石灰水变浑浊的气体生成铁:Fe+2HCl==FeCl2+H2 现象:铁粉慢慢减少,同时有气体生成,溶液呈浅绿色FeCl2+2NaOH==Fe(OH)2↓+NaCl现象:有白色絮状沉淀生成4Fe(OH)2+O2+2H2O==4Fe(OH)3 现象:氢氧化铁在空气中放置一段时间后,会变成红棕色Fe (OH) 3+3HCl==FeCl3+3H2O 现象:红棕色絮状沉淀溶解,溶液呈黄色Fe (OH) 2+2HCl==FeCl2+2H2O 现象:白色絮状沉淀溶解,溶液呈浅绿色Fe+CuSO4==FeSO4+Cu 现象:铁溶解生成红色金属Fe+AgNO3==Fe(NO3)2+Ag 现象:铁溶解生成银白色的金属Fe2O3+6HCl==2FeCl3+3H2O 现象:红色固体溶解,生成黄色的溶液现象:铁剧烈燃烧,火星四射,生成黑色的固体Zn+FeCl2==ZnCl2+Fe 现象:锌粉慢慢溶解,生成铁银:AgNO3+HCl==AgCl↓+HNO3现象:有白色沉淀生成,且不溶于强酸AgNO3+NaCl==AgCl↓+NaNO3现象:有白色沉淀生成,且不溶于强酸Cu+2AgNO3==Cu(NO3)2+2Ag 现象:红色的铜逐渐溶解,同时有银白色的金属生成2AgNO3+Na2SO4==Ag2SO4↓+2NaNO3现象:有白色沉淀生成补充化学方程式:3Ag+4HNO3(稀)==3AgNO3+NO↑+2H2O现象:银逐渐溶解,生成气体遇空气变棕色Ag+2HNO3(浓)==AgNO3+NO2↑+H2O现象:银逐渐溶解,生成棕色气体Cu+2H2SO4(浓)==CuSO4+SO2↑+2H2O现象:铜逐渐溶解,生成有刺激性气味的气体2FeCl3+Fe==3FeCl2 现象:铁粉逐渐溶解,溶液由黄色变成浅绿色2Na2O2(过氧化钠)+2H2O=4NaOH+O2 现象:有能使带火星的木条复燃的气体生成化学方程式汇总一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg + O2 点燃 2MgO2. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O43. 铜在空气中受热:2Cu + O2 加热2CuO4. 铝在空气中燃烧:4Al + 3O2 点燃 2Al2O35. 氢气中空气中燃烧:2H2 + O2 点燃 2H2O6. 红磷在空气中燃烧:4P + 5O2 点燃 2P2O57. 硫粉在空气中燃烧: S + O2 点燃 SO28. 碳在氧气中充分燃烧:C + O2 点燃 CO29. 碳在氧气中不充分燃烧:2C + O2 点燃 2CO(2)化合物与氧气的反应:10.一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO211.甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O12.酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O二.几个分解反应:13.水在直流电的作用下分解:2H2O 通电2H2↑+ O2 ↑14.加热碱式碳酸铜:Cu2(OH)2CO3 加热 2CuO + H2O + CO2↑15.加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl + 3O2 ↑16.加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 + O2↑17.碳酸不稳定而分解:H2CO3 === H2O + CO2↑18.高温煅烧石灰石:CaCO3 高温 CaO + CO2↑三.几个氧化还原反应:19.氢气还原氧化铜:H2 + CuO 加热 Cu + H2O20.木炭还原氧化铜:C+ 2CuO高温 2Cu + CO2↑21.焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑22.焦炭还原四氧化三铁:2C+ Fe3O4 高温 3Fe + 2CO2↑23.一氧化碳还原氧化铜:CO+ CuO 加热Cu + CO224.一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO225.一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温 3Fe + 4CO2四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质 +酸 -------- 盐+氢气(置换反应)26.锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑27.铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑28.镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑29.铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑30.锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑31.铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑32.镁和稀盐酸Mg+ 2HCl === MgCl2 + H2↑33.铝和稀盐酸2Al + 6HCl== 2AlCl3 + 3H2↑(2)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐34.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu35.锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu36.铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg(3)碱性氧化物 +酸 -------- 盐 +水37.氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O38.氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O39.氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O40.氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O41.氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O42.氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O(4)酸性氧化物 +碱 -------- 盐 + 水43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O 44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O 45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O 46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O 47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3 ↓+ H2O(5)酸 + 碱 -------- 盐 + 水48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O54.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸 + 盐 -------- 另一种酸 +另一种盐59.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO363.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4 ↓+ 2HCl (7)碱 + 盐 -------- 另一种碱 + 另一种盐65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO4 66.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl 67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(O H)2↓ + 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH (8)盐 + 盐 ----- 两种新盐70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ==== AgCl↓ + NaNO3 71.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl 五.其它反应:72.二氧化碳溶解于水:CO2 + H2O === H2CO373.生石灰溶于水:CaO + H2O === Ca(OH)274.氧化钠溶于水:Na2O + H2O ==== 2NaOH75.三氧化硫溶于水:SO3 + H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O 加热CuSO4 + 5H2O 77.无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2。
初中化学方程式大全及现象总结

--精品文档word版初中化学方程式现象总结物质与氧气的反应一. (1)单质与氧气的反应:2MgO 2Mg + O现象:燃烧、放出大量的热、同时放出耀眼的白光1.镁在氧气中燃烧:2Fe2.铁在氧气中燃烧:3Fe + 2OO现象:剧烈燃烧、火星四射、生成黑色的固体24 32CuO 3.铜在氧气中受热:2Cu + O22AlO4.铝在空气中燃烧:4Al + 3O 3222H氢气在氧气中燃烧:5.2H + OO 现象:淡蓝色的火焰2222PO4P + 5O红磷在空气中燃烧:现象:生成白烟 6. 225SO现象:空气中是淡蓝色的火焰;纯氧中是蓝紫色的火焰;同时硫粉在氧气中燃烧:7.S + O 22 生成有刺激性气味的气体。
CO现象:生成能够让纯净的石灰水浑浊的气体C + O8.碳在氧气中充分燃烧: 2 22CO 碳在氧气中不充分燃烧:9.2C + O 现象:燃烧现象外,其他现象不明显22HgO2Hg + O10.汞(水银)在氧气中燃烧:2 (2)化合物与氧气的反应:2CO1.一氧化碳在氧气中燃烧:2CO + O 22CO + 2HO CH2.甲烷在空气中燃烧:+ 2O22242CO + 3HH酒精在空气中燃烧:3.COH + 3OO 225224CO+ 2H+ 5OH2C4.乙炔在氧气中燃烧:O(氧炔焰)222 2 2 尘埃2SO二氧化硫与氧气反应:5.2SO + O32 2二.分解反应:双氧水催化制氧气:1.现象:溶液里冒出大量的气泡O + O 2HO2H↑2222 2. 2H ↑水在直流电的作用下分解:↑+ O2HO222………………………………………….word版-精品文档-2CuO + HO + CO↑(OH)CO 现象:固体由绿色逐渐变成黑色,同时有3.加热碱式碳酸铜:Cu22322能使纯净石灰水变浑浊的气体生成4.加热氯酸钾(有少量的二氧化锰):2KClO= 2KCl + 3O↑现象:生成能让带火星的木条复燃的气23体KMnO + MnO + O↑ 5.加热高锰酸钾:2KMnO现象:生成能让带火星的木条复燃的气体244226.碳酸不稳定而分解:HCO = HO + CO↑2223CaO + CO↑现象:有能使纯净石灰水变浑浊的气体生成7.高温煅烧石灰石:CaCO 238.加热碳酸氢铵:NHHCO = NH↑ + HO + CO↑ 2 34232HgO2Hg + O↑ 9.加热氧化汞:现象:生成银白色的液体金属2)Ca(HCO10.加热碳酸氢钙:↑+ HO 现象:生成白色的沉淀,同时有能使纯净的石灰CaCO↓+ CO23322水变浑浊的气体生成三.氧化还原反应:+ CuOCu + HO 氢气还原氧化铜:H现象:由黑色的固体变成红色的,同时有水珠生成 1.222Cu + CO↑2.木炭还原氧化铜: C + 2CuO现象:固体由黑色变成红色并减少,同时有能使纯净2石灰水变浑浊的气体生成4Fe + 3CO↑3.焦炭还原氧化铁:3C + 2FeO 现象:固体由红色逐渐变成银白色,同时黑色的223固体减少,有能使纯净的石灰水变浑浊的气体生成3Fe + 2CO↑ O4.焦炭还原四氧化三铁:2C + Fe243Cu + CO一氧化碳还原氧化铜: CO + CuO5.22Fe + 3COO 一氧化碳还原氧化铁:6.3CO + Fe2 323Fe + 4CO 4CO+ Fe7.一氧化碳还原四氧化三铁:O234四.单质、氧化物、酸、碱、盐的相互关系氢气(置换反应) + + (1)金属单质酸 -------- 盐↑ + H = ZnSOSO锌和稀硫酸:1.Zn + H现象:有可燃烧的气体生成2442 + H = FeSOSO ↑铁和稀硫酸:2.Fe + H现象:变成浅绿色的溶液,同时放出气体2244………………………………………….word版-精品文档-3.镁和稀硫酸:Mg + HSO = MgSO + H↑现象:有可燃烧的气体生成24244.铝和稀硫酸:2Al + 3HSO = Al(SO) + 3H↑现象:有气体生成2232445.锌和稀盐酸:Zn + 2HCl = ZnCl + H↑现象:有气体生成226.铁和稀盐酸:Fe + 2HCl = FeCl + H↑现象:铁粉慢慢减少,同时有气体生成,溶液呈浅绿色227.镁和稀盐酸:Mg + 2HCl = MgCl + H↑现象:有气体生成228.铝和稀盐酸:2Al + 6HCl = 2AlCl + 3H↑现象:有气体生成239.银和稀硝酸:3Ag + 4HNO(稀) = 3AgNO+ NO ↑+ 2HO 现象:银逐渐溶解,生成气体遇空气变棕色23310.银和浓硝酸:Ag + 2HNO(浓) = AgNO+ NO↑+ HO 现象:银逐渐溶解,生成棕色气体23 3211.铜和浓硫酸:Cu + 2HSO(浓) = CuSO+ SO↑+ 2HO 现象:铜逐渐溶解,生成有刺激性气味的气体24 42212.铜和硝酸银:Cu + 2AgNO= Cu(NO)+ 2Ag 现象:铜表面慢慢生成了银白色金属 2 3 3(2)金属单质 + 盐(溶液) ------- 另一种盐 + 另一种金属(置换反应)1.铁和硫酸铜溶液:Fe + CuSO = FeSO + Cu 现象:铁溶解生成红色金属442.锌和硫酸铜溶液:Zn + CuSO = ZnSO + Cu 现象:有红色金属生成443.铜和硝酸汞溶液:Cu + Hg(NO) = Cu(NO) + Hg铜和硝酸银:Cu + 2AgNO= Cu(NO)+ 2Ag 现象:红色的铜逐渐溶解,同时有银白色的金属22334.生成 2 335.铁和氯化铁:Fe + 2FeCl= 3FeCl 现象:铁粉逐渐溶解,溶液由黄色变成浅绿色236.铁和硝酸银:Fe + AgNO = Fe(NO) + Ag 现象:铁溶解生成银白色的金属2337.锌和氯化亚铁:Zn + FeCl = ZnCl+ Fe 现象:锌粉慢慢溶解,生成铁 2 2(3)碱性氧化物 +酸 -------- 盐 + 水1.氧化铁和稀盐酸:FeO + 6HCl = 2FeCl + 3HO 现象:红色固体逐渐溶解,形成黄色的溶液22332.氧化铁和稀硫酸:FeO + 3HSO =Fe(SO) + 3HO 现象:红色固体溶解,生成黄色溶液224432323.氧化铜和稀盐酸:CuO + 2HCl = CuCl + HO 现象:黑色固体溶解,生成黄绿色的溶液224.氧化铜和稀硫酸:CuO + HSO = CuSO + HO 现象:黑色固体溶解,生成蓝色溶液22445.氧化镁和稀硫酸:MgO + HSO = MgSO + HO 24246.氧化钙和稀盐酸:CaO + 2HCl = CaCl + HO 氧化铁和稀硝酸:FeO+ 6HNO = 2Fe(NO)+ 3HO 现象:红色固体溶解,生成黄色溶液23 23 338. 227.氧化铜和稀硝酸:CuO + 2HNO = Cu(NO) + HO 现象:黑色固体溶解,生成蓝色溶液2323(4)酸性氧化物 +碱 -------- 盐 + 水1.氢氧化钠暴露在空气中变质:2NaOH + CO = NaCO + HO 现象:无明显现象22322.氢氧化钠吸收二氧化硫气体:2NaOH + SO = NaSO + HO 22323.氢氧化钠吸收三氧化硫气体:2NaOH + SO = NaSO + HO2324………………………………………….word版-精品文档-4.熟石灰放在空气中变质:Ca(OH) + CO = CaCO ↓+ HO 现象:生成白色的沉淀,用于检验二氧化2223碳5.熟石灰吸收二氧化硫:Ca(OH) + SO = CaSO ↓+ HO 2232(5)酸 + 碱 -------- 盐 + 水1.盐酸和氢氧化钠:HCl + NaOH = NaCl + HO 现象:酸碱中和反应,现象不明显22.盐酸和氢氧化钾:HCl + KOH = KCl + HO 现象:酸碱中和反应,现象不明显23.盐酸和氢氧化铜:2HCl + Cu(OH) = CuCl + 2HO 现象:蓝色沉淀溶解,形成黄绿色的溶液2224.盐酸和氢氧化钙:2HCl + Ca(OH) = CaCl + 2HO盐酸和氢氧化铁:3HCl + Fe(OH) = FeCl + 3HO 现象:红棕色絮状沉淀溶解,形成了黄色2225.的溶液2336.盐酸和氢氧化亚铁:2HCl + Fe(OH)= FeCl + 2HO 现象:白色絮状沉淀溶解,溶液呈浅绿色2227.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH) = AlCl + 3HO硫酸和氢氧化钠:HSO + 2NaOH = NaSO + 2HO 现象:酸碱中和反应,现象不明显222449.硫2338.酸和氢氧化钾:HSO + 2KOH = KSO + 2HO 现象:酸碱中和反应,现象不明显2244210.硫酸和氢氧化铜:HSO + Cu(OH) = CuSO + 2HO 现象:蓝色沉淀溶解,生成蓝色溶液2442211.硫酸和氢氧化铁:3HSO + 2Fe(OH) = Fe(SO) + 6HO硝酸和氢氧化钠:HNO+ NaOH = NaNO + HO 现象:酸碱中和反应,现象不明显23313.硝酸243423212.和氢氧化铜:2HNO + Cu(OH) = Cu(NO)+ 2HO 现象:蓝色沉淀溶解,生成蓝色溶液2322 314.硝酸和氢氧化钠:HNO + NaOH = NaNO+ HO 现象:酸碱中和反应,现象不明显23 315.硝酸和氢氧化钾:HNO + KOH = NaNO+ HO 现象:酸碱中和反应,现象不明显23 316.硝酸和氢氧化镁:2HNO + Mg(OH) = Mg(NO)+ 2HO 现象:白色沉淀溶解2332217.氨水和硫酸:2NH·HO + HSO = (NH)SO + 2HO 22224443(6)酸 + 盐 -------- 另一种酸 + 另一种盐1.稀盐酸和碳酸钙:2HCl + CaCO= CaCl + HO + CO↑现象:白色固体溶解,生成能使纯净石灰水223 2变浑浊的气体2.稀盐酸和碳酸钠:2HCl + NaCO = 2NaCl + HO + CO↑现象:生成能使纯净石灰水变浑浊的气体23223.稀盐酸和碳酸氢钠:HCl + NaHCO = NaCl + HO + CO↑现象:生成能使纯净石灰水变浑浊的气体2234.稀盐酸和碳酸镁:2HCl + MgCO = MgCl + HO + CO↑现象:生成能使纯净石灰水变浑浊的气体22325.盐酸和硝酸银溶液:HCl + AgNO = AgCl↓ + HNO现象:有白色沉淀生成且不溶于强酸,这个反应 33用于检验氯离子6.硫酸和碳酸钠:HSO + NaCO = NaSO + HO + CO↑现象:生成能使纯净石灰水变浑浊的气体24342222………………………………………….word版-精品文档-7.硫酸和氯化钡:HSO + BaCl = BaSO↓+ 2HCl 现象:生成不溶于强酸的白色沉淀,用于检验硫酸根4224离子8.硫酸和碳酸钙:HSO+ CaCO = CaSO+ HO + CO↑现象:生成能使纯净石灰水变浑浊的气体24 4硫酸和碳酸氢钠:HSO + 2NaHCO = NaSO+ 2HO + 2CO↑现象:生成能使纯净石灰水变浑浊2239.的气体24 2242310.硝酸和碳酸钙:2HNO+ CaCO = Ca(NO)+ HO + CO↑现象:白色固体溶解,生成能使纯净石灰水变22 33 23浑浊的气体11.硝酸和碳酸钠:2HNO+ NaCO = 2NaNO+ HO + CO↑现象:生成能使纯净石灰水变浑浊的气体233 22312.硝酸和碳酸氢钠:HNO+ NaHCO = NaNO+ HO + CO↑现象:生成能使纯净石灰水变浑浊的气体23 3 23(7)碱 + 盐 -------- 另一种碱 + 另一种盐1.氢氧化钠和硫酸铜:2NaOH + CuSO = Cu(OH)↓ + NaSO 44222.氢氧化钠和氯化铁:3NaOH + FeCl = Fe(OH)↓ + 3NaCl 现象:生成红棕色絮状沉淀333.氢氧化钠和硝酸铁:3NaOH + Fe(NO) = Fe(OH)↓ + 3NaNO 现象:生成红棕色絮状沉淀33334.氢氧化钠和硫酸铁:6NaOH + Fe(SO) =2Fe(OH)↓ + 3NaSO 现象:生成红棕色絮状沉淀4322345.氢氧化钾和氯化铁:3KOH + FeCl = Fe(OH)↓ + 3KCl 现象:生成红棕色絮状沉淀336.氢氧化钠和氯化亚铁:2NaOH + FeCl = Fe(OH)↓ + NaCl 现象:有白色絮状沉淀生成227.氢氧化钠和硝酸亚铁:2NaOH + Fe(NO) = Fe(OH)↓ + 2NaNO 现象:生成白色絮状沉淀32238.氢氧化钠和硫酸亚铁:2NaOH + FeSO4 = Fe(OH)↓ + NaSO4 现象:生成白色絮状沉淀229.氢氧化钠和氯化镁:2NaOH + MgCl = Mg(OH)↓ + 2NaCl 现象:生成白色沉淀2210.氢氧化钠和硝酸镁:2NaOH + Mg(NO) = Mg(OH)↓ + 2NaNO 现象:生成白色沉淀323211.氢氧化钠和硫酸镁:2NaOH + MgSO = Mg(OH)↓ + NaSO 现象:生成白色沉淀442212.氢氧化钠和氯化铜:2NaOH + CuCl = Cu(OH)↓ + 2NaCl 现象:生成了蓝色絮状沉淀2213.氢氧化钠和硝酸铜:2NaOH + Cu(NO) = Cu(OH)↓ + 2NaNO 现象:生成蓝色絮状沉淀332214.氢氧化钠和硫酸铜:2NaOH + CuSO = Cu(OH)↓ + NaSO 现象:生成蓝色絮状沉淀442215.氢氧化钙和碳酸钠:Ca(OH) + NaCO = CaCO↓ + 2NaOH 现象:生成白色的沉淀323216.氢氧化钙和硫酸铜:Ca(OH)+ CuSO = Cu(OH)↓ + CaSO442217.氢氧化钠和硫酸氢钠:NaOH + NaHSO = NaSO+ HO 现象:无明显现象 44 2218.氢氧化钠和碳酸氢钠:2NaOH + Ca(HCO)= CaCO↓ + NaCO+ 2HO 现象:生成白色沉淀232 3 3219.氢氧化钙和碳酸氢钠:Ca(OH) + Ca(HCO) = 2CaCO↓ + 2HO 现象:生成白色沉淀2223320.氢氧化钠和碳酸钠:NaOH + NaHCO = NaCO+ HO 现象:不明显233 221.氢氧化钠和氯化铵:NaOH + NHCl = NH↑ + HO + NaCl 现象:有可以使石蕊试纸变蓝的气体生成24322.氢氧化钠和硝酸铵:NaOH + NHNO = NH ↑ + HO + NaNO 现象:有可以使石蕊试纸变蓝的气体生成33432………………………………………….word版-精品文档-23.氢氧化钠和硫酸铵:2NaOH + (NH)SO = 2NH↑ + 2HO + NaSO 现象:有可以使石蕊试纸变蓝的气体4432242生成(8)盐 + 盐 ----- 两种新盐1.氯化钠和硝酸银:NaCl + AgNO = AgCl↓ + NaNO现象:有白色沉淀生成,且不溶于强酸 332.硫酸钠和氯化钡:NaSO + BaCl = BaSO↓ + 2NaCl 现象:有白色的不溶于强酸的沉淀生成42243.硝酸银和硫酸钠:2AgNO+ NaSO = AgSO↓ + 2NaNO 现象:有白色沉淀生成3443 224.氯化钡和碳酸钠:BaCl+ NaCO = BaCO↓ + 2NaCl 现象:有白色沉淀生成但可溶于盐酸和硝酸,其实32 32也溶于硫酸,但生成硫酸钡沉淀,不容易看出来5.氯化钙和碳酸钠:CaCl+ NaCO = CaCO↓ + 2NaCl 现象:生成白色沉淀3232五.其它反应:1.二氧化碳溶解于水:CO + HO = HCO 32222.生石灰溶于水:CaO + HO = Ca(OH)现象:放出大量的热 223.氧化钠溶于水:NaO + HO = 2NaOH 224.三氧化硫溶于水:SO + HO = HSO 4232加热CuSO + 5HO 现象:固体由蓝色变为白色硫酸铜晶体受热分解:CuSO·5HO5.24426.无水硫酸铜作干燥剂:CuSO + 5HO = CuSO·5HO 24427.二氧化硫溶于水:SO + HO = HSO3 222高温2CO↑现象:黑色固体逐渐减少 8.CO + C29.3C + 2HO = CH+ 2CO↑现象:生成的混和气体叫水煤气,都是可以燃烧的气体 4 210.CaCO+ CO+ HO = Ca(HCO) 现象:白色固体逐渐溶解 3 2 32211.2NaO(过氧化钠) + 2HO = 4NaOH + O↑现象:有能使带火星的木条复燃的气体生成222212.4Fe(OH)+ O+ 2HO = 4Fe(OH) 现象:氢氧化铁在空气中放置一段时间后,会变成红棕色322 2现象:有水珠生成,固体颜色由红色变成银白色 + 3H13.2FeO2223高温2Fe + 3HO现象:固体由黑色逐渐变成红色,同时有水珠生成 14.H22加热Cu + HO + CuO15.FeO+ 4CO = 3Fe + 4CO↑现象:固体由黑色变成银白色,同时有能使纯净石灰水变浑浊的气体生成234Fe + CO↑16.FeO + CO 现象:固体由黑色逐渐变成银白色,同时有能使纯净石灰水变浑浊的气体2生成2Fe + 3CO+ 3COO17.Fe现象:固体由红色逐渐变成银白色,同时有能使纯净石灰水变浑浊的↑223气体生成………………………………………….word版-精品文档-现象:固体由黑色变成红色,同时有能使纯净石灰水变浑浊的气体生成Cu + CO↑18.CuO + CO 2呼吸、光合作用:六.O + 6H + 6O = 6CO1.呼吸作用:CHO2266212叶绿素光照 + 6O↑O C2.光合作用:6CO + 6HO H2212662初中化学方程式及其相关知识点总结) 1.澄清石灰水中通入二氧化碳气体(复分解反应O = CaCO↓ + HCa(OH) + CO2322现象:石灰水由澄清变浑浊。
初中九上常考的化学方程式分类汇总

初中化学方程式分类汇总一、化合反应1.单质的燃烧:(1)镁带在空气中燃烧(照明弹)化学方程式:2Mg+O点燃2MgO实验现象:剧烈燃烧,放出热量,发出耀眼白光,产生白烟,生成白色固体。
(2)细铁丝在氧气中燃烧化学方程式:3Fe+20点燃FeO234实验现象:细铁丝在纯净的氧气中剧烈的燃烧,火星四射,放出热量,生成黑色固体。
(3)硫粉分别在空气中,氧气中燃烧化学方程式:S+0点燃S022实验现象:硫在空气中燃烧发出微弱的淡蓝色火焰,在氧气中剧烈燃烧发出明亮的蓝紫色火焰,放出热量,生成有刺激性气味的气体。
(4)红磷在氧气中燃烧(烟幕弹)化学方程式:4P+50去燃2P0225实验现象:红磷在氧气中剧烈燃烧,发光放热,产生大量白烟。
(5)木炭在充足的氧气中燃烧化学方程式:C+0点燃C022实验现象:剧烈燃烧,放出热量,发出白光生成能使澄清石灰水变浑浊的气体。
木炭在不充足的氧气中燃烧化学方程式:2C+0点燃2C02(6)纯净的氢气在空气中燃烧化学方程式:2H+0点燃2H0222实验现象:纯净的氢气在空气中安静的燃烧发出淡蓝色的火焰,放出热量,在火焰的上方罩一干而冷的烧杯,烧杯内壁有水雾出现2.有毒气体的燃烧(尾气处理):(7)一氧化碳燃烧化学方程式:2C0+0点燃2C022实验现象:燃烧放出热量,发出蓝色火焰同时生成使澄清石灰水变浑浊的气体。
3.碱性氧化物与水的反应(Na20、Ca0等):(8)氧化钠溶于水化学方程式:Na0+H02Na0H22(9)氧化钙溶于水化学方程式:Ca0+H0Ca(0H)22实验现象:白色固体逐渐溶解,同时放出大量的热4.二氧化碳气体通入炽热的炭层:(10)化学方程式:C0+C蛊温2C025.酸性氧化物与水的反应(C02、S02、S03等): (11)二氧化碳溶于水化学方程式:C0+H0HC02223(12)二氧化硫溶于水化学方程式:S0+H0HS02223(13)三氧化硫溶于水化学方程式:S0+H0HS032246.酸性氧化物与水的反应(C02、S02、S03等): (14)二氧化碳溶于水化学方程式:C0+H0HC02223(15)二氧化硫溶于水可得亚硫酸溶液化学方程式:S0+H0HS02223(16)三氧化硫溶于水可得硫酸溶液化学方程式:S0+H0HS03224二、分解反应:1.实验室制取氧气:(17)用氯酸钾和二氧化锰为原料制氧气:化学方程式:2KC10Mn O22KC1+30f32 (18)用咼锰酸钾制氧气:化学方程式:2KMn0仝KMn0+Mn0+0f42422(19)用双氧水和二氧化锰为原料制氧气:化学方程式:2H0MnO^2H0+0f22222.红色粉末氧化汞受热分解:(20)化学方程式:2Hg0=2Hg+02f实验现象:红色的氧化汞粉末逐渐变成白色液体,同时有能使带火星的木条复燃的气体生成。
红磷燃烧实验原理

红磷燃烧实验原理
红磷燃烧实验是一种常见的化学实验,用于展示红磷与氧气反应产生的火焰和白色烟雾现象。
原理涉及红磷的氧化反应及其与氧气的反应。
红磷化学式为P4,属于单质。
在空气中存在时,红磷会与氧气发生反应,生成五氧化二磷(化学式为P4O10)。
具体反应方程式为:
P4 + 5O2 → P4O10
红磷在与氧气反应时,放出大量的能量,形成燃烧火焰。
火焰呈现为明亮的黄白色。
同时,在燃烧过程中,还会产生大量的白色烟雾。
这是因为生成的五氧化二磷是一种高沸点的白色固体,会迅速冷却并凝结成微小的固体颗粒,形成烟雾。
红磷燃烧实验可以通过直接将红磷置于点燃状态的蜡烛火焰中进行。
红磷会立即点燃并发出独特的火焰和烟雾。
这是因为蜡烛的火焰提供了足够的热量和氧气,以使红磷能够快速燃烧。
在实验过程中,需要注意安全,避免火焰伤害和烟雾吸入。
红磷燃烧实验的原理可以用于解释其他一些现象,例如火药爆炸或磷火的产生。
这个实验也有助于加深对化学反应和氧化反应的理解,以及引发对元素和化学品的兴趣。
初中化学单质与化合物知识点总结

初中化学单质与化合物知识点总结单质与化合物是初中化学中的重点内容之一,它们是化学世界中最基本的概念。
本文将对初中化学中的单质与化合物进行知识点的总结和介绍。
一、单质单质是由同种元素组成,具有相同的化学性质的物质。
在自然界中,单质以原子或者分子的形式存在。
根据状态的不同,单质可以分为固体、液体和气体。
1. 固体单质:如金、银、铜等,它们具有一定的硬度、固定的形状和体积,可以通过物理手段进行改变。
2. 液体单质:如水银、溴等,它们具有一定的流动性,不具有固定的形状,但有固定的体积。
3. 气体单质:如氧气、氮气等,它们具有较小的密度,可以自由扩散和流动,没有固定的形状和体积。
二、化合物化合物是由不同元素按照一定的比例结合而成的物质。
化合物中的元素以原子的形式存在,它们通过化学反应发生化学变化,形成新的物质。
1. 离子化合物:离子化合物是由金属和非金属元素结合而成的化合物。
离子化合物的特点是具有高熔点、良好的导电性和溶解性。
2. 分子化合物:分子化合物是由非金属元素结合而成的化合物。
分子化合物的特点是具有低熔点、较差的导电性和溶解性。
三、物质的变化物质在化学反应中会发生各种不同的变化,这些变化可以分为化学变化和物理变化。
1. 化学变化:化学变化指的是物质在化学反应中发生的变化,原有物质消失,新的物质生成。
化学变化是永久性的,并且伴随着能量的吸收或释放。
2. 物理变化:物理变化指的是物质在物理条件下发生的可逆的改变,原有物质没有消失,只是改变了一些物理性质,如形状、大小、状态等。
四、物质的性质物质的性质是描述物质特征和行为的规律性,包括物理性质和化学性质。
1. 物理性质:物理性质指的是物质的固有特性,不改变物质的化学组成。
如颜色、形状、硬度、密度、熔点、沸点等。
2. 化学性质:化学性质指的是物质在化学反应中表现出来的特性,涉及到物质的化学变化。
如与其他物质发生反应、挥发性、稳定性等。
五、实验室中的常见操作在化学实验室中,常见的操作包括制备、分离和鉴定等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
部分物质在空气中和氧气中反应的对比:
a)碳和氧气反应
方程式:C + O2CO2
现象:剧烈燃烧,发白光,放热,生成使澄清石灰水变浑浊的气体
b)硫和氧气反应
方程式:S + O2SO2
现象:发出明亮的蓝紫色火焰,放热,生成有刺激性气味的气体
注意:实验前应在瓶底放少量水,用来吸收生成的有毒气体。
c)红磷和氧气反应:
方程式:4P + 5O22P2O5
现象:发出耀眼的白光,放热,生成大量白烟
生成的P2O5是固体小颗粒,现象为白烟,不是白雾。
d)铁和氧气的反应:
方程式:3Fe + 2O2Fe3O4
现象:铁丝剧烈燃烧,火星四射,放出大量热量,生成黑色固体
注意:集气瓶底放一层细沙或少量水。
e)镁和氧气反应:
方程式:2Mg + O22MgO
现象:剧烈燃烧,发出耀眼的白光,放出热量,生成白色粉末状固体,有白烟。
注意:不能手持镁条,应用坩埚钳夹持。
f)石蜡和氧气反应
文字表达式:石蜡+氧气水+二氧化碳
现象:剧烈燃烧,放出热量,发出白光,如果在火焰上方罩一个干冷烧杯,
烧杯内壁有水珠,生成使澄清石灰水变浑浊的气体。
烟和雾的区别:
a)烟:大量固体小颗粒分散在空气长产生烟。
红磷燃烧产生大量白烟,是燃烧生成的固体P2O5分散在空气中形成的
b)雾:大量小液滴分散在气体中产生雾。
打开盛浓盐酸的瓶塞,瓶口有白雾,是挥发的HCl气体遇到空气中的水蒸气形成了盐酸小液滴。
a)光:固体物质燃烧使发光。
镁条燃烧发出耀眼的强光,木炭在氧气中燃烧产生白光
b)气体物质和容易气化的物质燃烧时产生火焰。
蜡烛在氧气中燃烧产生白色的火焰,是石蜡熔化后生成的气体燃烧而产生的。
描述物质在氧气中燃烧的现象的技巧:
可按三个顺序从三个方面进行:
(1)剧烈燃烧,有什么颜色的光,火焰;
(2)放热;
(3)生成物的特性。
