物质的变化及反应类型
2024年中考化学考点全透视—物质的变化、性质、用途及化学反应类型(考前必看)

2024年中考化学考点全透视—物质的变化、性质、用途及化学反应类型(考前必看)考点1物理变化和化学变化物理变化化学变化定义没有生成其他物质的变化叫物理变化生成其他物质的变化叫化学变化本质区别是否有新物质生成常见现象物质的状态、形状可能发生变化,可能有发光、放热等现象出现颜色改变、放出气体、生成沉淀等,并吸热、放热、发光等(一定伴随能量改变)微观实质构成物质的分子是否发生变化物理变化分子不改变,化学变化分子发生改变联系发生化学变化时一定同时发生物理变化,而发生物理变化时不一定同时发生化学变化。
举例:蜡烛燃烧时一定伴随蜡烛的熔化。
实例性状改变:破碎、弯曲、拉成丝、压成片等状态改变:熔化、凝固、汽化、液化、升华、凝华、铸造等其他:灯泡通电发光、活性炭吸附色素、金属导电、压强过大导致爆炸(气球、轮胎、高压锅)燃烧变化:物质燃烧、汽油火药等爆炸变质变化:发酵、酿酒、发霉、腐烂等锈蚀变化:金属生锈其他变化:光合呼吸作用、杀菌消毒、物质分解等考点2物理性质和化学性质物理性质化学性质定义物质不需要发生化学变化就可以表现出来的性质物质在化学变化中表现出来的性质区别某种性质是否需要经过化学变化才能表现出来注意物质的性质受外界条件影响,在描述物质性质时注明条件。
(如液体沸点受大气压影响)实例颜色、状态、气味;硬度、密度、燃点、沸点、熔点;溶解性、挥发性、导电性、导热性、吸附性等可燃性、助燃性;氧化性、还原性;稳定性、活泼性;酸性、碱性、毒性等考点3物质性质和用途关系例:木炭具有可燃性,可以发生燃烧变化,生活中用于作燃料。
考点4四种基本化学反应类型的判断类型定义代表式特点化合价变化备注化合反应由两种或两种以上的物质生成另一种物质的反应A+B→C多变一可能变化(就某些反应中某些元素而言)反应物A 、B 既可代表单质,又可代表化合物分解反应由一种物质生成两种或两种以上其他物质的反应A→B+C一变多可能变化(就某些反应中某些元素而言)生成物中的B 、C 既可代表单质,又可代表化合物置换反应由一种单质跟一种化合物反应生成另一种单质和另一种化合物的反应A+BC→B+AC一换一肯定变化(就所有反应中某些元素而言)反应范围:①金属和酸;②金属和盐;③氢气、碳和金属氧化物;④碳和水蒸气等复分解反应由两种化合物互相交换成分,生成另外两种化合物的反应AB+CD→AD+BC相互交换肯定不变(就所有反应中所有元素而言)反应范围:①酸+碱;②酸+盐;③酸+碱性氧化物;④盐+碱;⑤盐+盐(1)关于氧化还原反应及中和反应初中阶段根据在化学反应中得氧或失氧的情况,将化学反应分为氧化反应和还原反应。
物质的变化与化学反应

物质的变化与化学反应物质的变化是化学研究中最基本的概念之一。
从我们日常生活中常见的变化,如水的沸腾、铁的生锈,到实验室中的化学反应,如氧化反应、还原反应,物质的变化无处不在。
本文将介绍物质的变化和化学反应的基本概念和特征,以及常见的几种化学反应类型。
一、物质的变化物质的变化是指物质发生了某种性质或组成上的变化,从而形成了新的物质。
物质的变化可以分为两类:物理变化和化学变化。
1. 物理变化物理变化是指物质的性质改变了,但其组成没有发生变化。
例如,水从液态变为固态,冰的性质发生了变化,但它仍然是由水分子组成的。
物理变化可以逆转,即改变条件后,物质可以恢复到原来的状态。
2. 化学变化化学变化是指物质的性质和组成都发生了变化,形成了新的物质。
在化学变化中,常会伴随着能量的吸收或释放,以及产生气体、固体等的变化。
例如,燃烧是一种常见的化学变化,燃烧物质燃烧后会生成新的物质,同时释放出大量的能量。
二、化学反应化学反应是物质发生化学变化的过程。
化学反应可以用化学方程式表示,反应物在方程式的左边,生成物在方程式的右边。
在化学方程式中,反应物和生成物之间用箭头“→”表示。
1. 反应物与生成物反应物是参与化学反应的物质,生成物是在反应过程中形成的新物质。
例如,二氧化碳与水反应生成碳酸氢根离子,可以用化学方程式表示为:CO2 + H2O → HCO3-在这个反应中,二氧化碳和水是反应物,碳酸氢根离子是生成物。
2. 化学反应的特征化学反应具有一些基本的特征,如化学反应速率、化学平衡和化学能量变化。
化学反应速率是指反应物转变为生成物的速度。
反应速率受到多种因素的影响,如温度、浓度、物质的性质和催化剂等。
化学平衡是指在闭合系统中,反应物与生成物的浓度达到一定比例后,反应停止进行,称为化学平衡。
在化学平衡状态下,反应物与生成物的浓度不再发生变化。
化学反应涉及能量的吸收或释放。
吸热反应是指反应过程中吸收热量,释热反应是指反应过程中释放热量。
2024年中考化学一轮复习知识点总结—物质的变化和性质-化学反应类型(含解析)
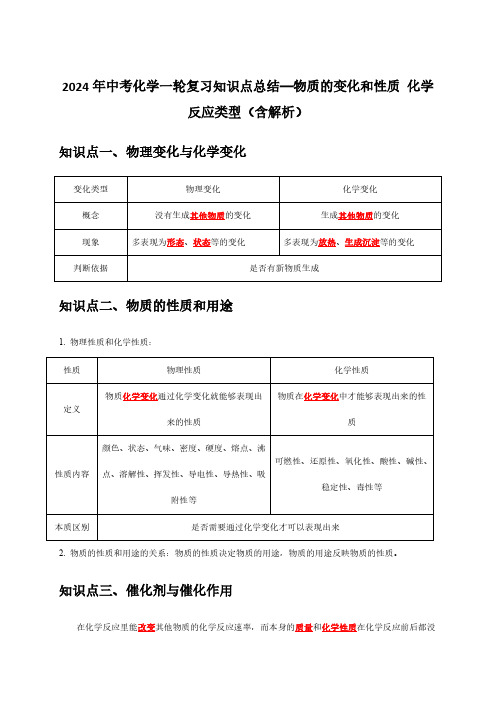
2024年中考化学一轮复习知识点总结—物质的变化和性质化学反应类型(含解析)知识点一、物理变化与化学变化变化类型物理变化化学变化概念没有生成其他物质的变化生成其他物质的变化现象多表现为形态、状态等的变化多表现为放热、生成沉淀等的变化判断依据是否有新物质生成知识点二、物质的性质和用途1.物理性质和化学性质:2.物质的性质和用途的关系:物质的性质决定物质的用途,物质的用途反映物质的性质。
知识点三、催化剂与催化作用在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在化学反应前后都没性质物理性质化学性质定义物质化学变化通过化学变化就能够表现出来的性质物质在化学变化中才能够表现出来的性质性质内容颜色、状态、气味、密度、硬度、熔点、沸点、溶解性、挥发性、导电性、导热性、吸附性等可燃性、还原性、氧化性、酸性、碱性、稳定性、毒性等本质区别是否需要通过化学变化才可以表现出来有变化的物质叫做催化剂。
催化剂在化学反应中所起的作用叫催化作用。
知识点四、四种基本反应类型1.四种基本反应类型定义通式特点基本反应类型A+B→AB二合一或多合一化合反应由两种或两种以上的物质生成另外一种物质的反应AB→A+B一变二或一变多分解反应由一种物质生成两种或两种以上物质的反应A+BC→AC+B单换单、强换弱置换反应一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应AB+CD→AD+CB双交换、价不变复分解反应两种化合物互相交换成分生成另外两种化合物的反应【注意】①发生复分解反应要满足的条件:生成物中必须有沉淀或气体或水。
②中和反应:酸与碱作用生成盐和水的反应称为中和反应。
中和反应属于复分解反应,它是特指酸与碱之间发生的复分解反应。
2.其他反应类型定义实例氧化反应物质与氧发生的反应,根据反应的剧烈程度不同,分为缓慢氧化和剧烈氧化(其中提供氧的物质具有氧化性)C+O 2CO 2还原反应含氧化合物里的氧被夺走的反应(其中能夺取氧的物质具有还原性,如CO )CO+CuO Cu+CO 2考点一.化学变化和物理变化的判别1.(2023•自贡)水是重要的资源,城市里的生活用水是经自来水厂净化处理过的。
化学反应的基础知识

化学反应的基础知识化学反应是化学中最基本的过程之一,它涉及物质之间的转化和变化。
本文将介绍化学反应的基础知识,包括化学反应的定义、化学反应的类型、化学反应方程式的表示方法,以及常见的化学反应实例。
一、化学反应的定义化学反应是指物质在一定条件下发生变化的过程。
在化学反应中,原有的物质转变为新的物质,伴随着能量的变化。
化学反应也称化学变化,是化学研究的基础。
二、化学反应的类型1. 合成反应(Combination Reaction):两种或多种物质结合生成一种物质的过程。
例如,氢气与氧气发生合成反应生成水:2H₂(g) + O₂(g) → 2H₂O(l)2. 分解反应(Decomposition Reaction):一种物质分解为两种或多种物质的过程。
例如,水分解为氢气和氧气:2H₂O(l) → 2H₂(g) + O₂(g)3. 位移反应(Single Replacement Reaction):一种物质中的原子或离子被另一种离子取代的过程。
例如,铜与盐酸发生位移反应生成铜盐和氢气:Cu(s) + 2HCl(aq) → CuCl₂(aq) + H₂(g)4. 双位移反应(Double Replacement Reaction):两种物质中的阳离子和阴离子交换位置的过程。
例如,氯化银与硝酸钠发生双位移反应生成氯化钠和硝酸银:AgCl(aq) + NaNO₃(aq) → AgNO₃(aq) + NaCl(aq)5. 氧化还原反应(Redox Reaction):涉及到电子转移的反应,包括氧化和还原两个过程。
例如,铁与氧气发生氧化还原反应生成三氧化二铁:4Fe(s) + 3O₂(g) → 2Fe₂O₃(s)三、化学反应方程式的表示方法化学反应方程式用化学符号和化学式表示反应物和生成物之间的关系。
方程式由反应物和生成物的化学式组成,用化学平衡符号“→”表示反应过程。
例如,氢气与氧气生成水的方程式为:2H₂(g) + O₂(g) → 2H₂O(l)化学反应方程式中的系数表示反应物和生成物的摩尔比例关系,必须经过平衡处理才能符合实际反应过程。
化学反应的类型和特征

化学反应的类型和特征一、化学反应的类型1.化合反应:两种或两种以上物质反应后生成一种物质的反应,其特点可总结为“多变一”。
2.分解反应:一种物质反应后生成两种或两种以上的物质,其特点可总结为“一变多”。
3.置换反应:一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。
4.复分解反应:两种化合物相互交换成分生成两种新的化合物的反应。
二、化学反应的特征1.化学变化:有新物质生成的变化。
2.能量变化:化学反应过程中,反应物和生成物的总能量不同,表现为放热或吸热。
3.物质变化:反应物种类和数量发生变化,生成物种类和数量也发生变化。
4.原子重新组合:化学反应的实质是反应物中的原子重新组合形成生成物。
5.化学平衡:在封闭系统中,正反应速率相等时,反应物和生成物的浓度不再发生变化,达到化学平衡。
6.催化作用:催化剂能改变化学反应速率,而本身的质量和化学性质在反应前后不变。
三、化学反应的基本定律1.质量守恒定律:化学反应中,反应物质的质量总和等于生成物质的质量总和。
2.定律定律:化学反应中,反应物质的质量比等于生成物质的质量比。
3.摩尔定律:化学反应中,反应物质的摩尔比等于生成物质的摩尔比。
四、化学反应速率1.反应速率:单位时间内反应物消失或生成物出现的量。
2.影响反应速率的因素:反应物浓度、温度、压强、催化剂以及固体表面积等。
3.反应速率方程:反应速率与反应物浓度之间的关系。
五、化学反应的限度和条件1.化学反应限度:反应物转化为生成物的程度。
2.可逆反应:反应物和生成物之间可以相互转化的反应。
3.化学反应条件:温度、压力、浓度、催化剂等对化学反应的影响。
六、化学反应的实际应用1.合成材料:塑料、合成纤维、合成橡胶等。
2.燃料的燃烧:石油、天然气、煤炭等能源的利用。
3.药物制备:化学合成药物。
4.环境保护:化学方法处理废水、废气等。
5.食品工业:食品添加剂的使用、食品保存等。
以上为化学反应的类型和特征的相关知识点,供您参考。
物质的变化与化学反应

物质的变化与化学反应物质的变化与化学反应是化学领域中极为重要的概念。
在日常生活中,我们经常会观察到物质发生变化的现象,如水煮沸、铁生锈、草木腐烂等等。
这些现象都是由于物质发生了化学反应,导致了物质的变化。
本文将从物质的变化过程、化学反应的定义和特征,以及化学反应的分类等方面展开论述。
一、物质的变化过程物质的变化过程是指物质由一种形态转变为另一种形态的过程。
物质的变化可以是可逆的,也可以是不可逆的。
可逆变化是指物质在外界条件改变后,能够恢复到原来的状态;不可逆变化是指物质在发生变化后无法恢复到原来的状态。
例如,水的沸腾是可逆变化,因为水可以被冷却后再变回液态,而木头燃烧是不可逆变化,因为燃烧后的木头无法还原为原来的形态。
二、化学反应的定义和特征化学反应是指物质在一定条件下,通过化学变化形成新的物质的过程。
化学反应的特征主要包括以下几个方面:1. 反应物与生成物:化学反应中,参与反应的物质称为反应物,生成的新物质称为生成物。
反应物和生成物在化学反应前后的物质组成上发生了明显的变化。
2. 化学键的形成与断裂:化学反应过程中,化学键会断裂或形成。
化学键是维持原子团结的力,包括离子键、共价键等。
断裂和形成化学键是化学反应中发生物质变化的重要原因。
3. 反应热变化:化学反应会伴随着能量的变化,即反应热变化。
吸收热量的反应称为吸热反应,释放热量的反应称为放热反应。
反应热变化对化学反应的进行和判断具有重要意义。
三、化学反应的分类化学反应可以根据反应类型和反应机理进行分类。
以下是常见的几种化学反应分类:1. 氧化还原反应:氧化还原反应是指物质在反应中发生电子的转移,其中一种物质被氧化,另一种物质被还原。
典型的氧化还原反应是金属与非金属的化合物反应,如铁生锈。
2. 酸碱反应:酸碱反应是指酸和碱反应生成盐和水的反应。
酸具有产生H+离子的性质,碱具有产生OH-离子的性质。
典型的酸碱反应是酸与碱的中和反应,如盐酸与氢氧化钠反应生成氯化钠和水。
高中化学物质的变化知识点

高中化学物质的变化知识点引言物质的变化是化学研究的核心内容,包括物理变化和化学变化。
了解物质变化的类型、特征和影响因素对于掌握化学知识、进行实验操作和解决实际问题都具有重要意义。
第一部分:物质变化的分类1.1 物理变化与化学变化定义:物理变化和化学变化的区别。
特征:化学变化的标志性特征,如新物质生成。
1.2 变化的可逆性可逆反应:反应物和生成物可以相互转化的过程。
不可逆反应:反应物转化为生成物后不能逆转的过程。
第二部分:化学反应的类型2.1 合成反应与分解反应合成反应:多个反应物生成一个生成物的过程。
分解反应:一个反应物生成多个生成物的过程。
2.2 置换反应与复分解反应置换反应:单质与化合物反应生成新单质和新化合物的过程。
复分解反应:两个化合物互相交换成分生成两个新化合物的过程。
2.3 氧化还原反应与酸碱反应氧化还原反应:涉及电子转移的化学反应。
酸碱反应:酸与碱反应生成盐和水的过程。
第三部分:化学反应的基本原理3.1 质量守恒定律定律内容:化学反应前后物质的总质量保持不变。
应用:在化学方程式配平和计算中的应用。
3.2 化学平衡平衡状态:反应物和生成物浓度不再变化的状态。
平衡常数:描述平衡状态的量化指标。
3.3 反应速率影响因素:温度、浓度、催化剂对反应速率的影响。
速率方程:描述反应速率与反应物浓度关系的方法。
第四部分:化学反应的能量变化4.1 反应热与焓变热化学方程式:表示反应热效应的化学方程式。
焓变:反应过程中系统与环境之间的热交换。
4.2 吸热反应与放热反应能量来源:吸热反应和放热反应的能量来源。
判断方法:根据反应物和生成物的性质判断反应的热效应。
第五部分:化学变化的表征与测量5.1 化学方程式的书写书写规则:化学方程式的书写原则和步骤。
平衡标记:表示可逆反应的化学方程式标记方法。
5.2 化学变化的观察与记录实验观察:观察化学变化中的实验现象。
数据记录:准确记录实验数据,如温度、颜色变化等。
生活中的物质和反应物的变化

生活中的物质和反应物的变化一、物质的变化1.物理变化:物质在形态、状态、位置等方面的变化,不涉及新物质的生成。
如冰融化、水蒸发、木材燃烧等。
2.化学变化:物质在化学性质上的变化,涉及新物质的生成。
如铁生锈、食物腐败、火药爆炸等。
3.反应物:参与化学反应的物质。
反应物可以是一种或多种。
4.反应物类型:(1)原料:参与合成新物质的物质。
(2)催化剂:能够改变化学反应速率,但本身不参与反应的物质。
(3)溶剂:溶解其他物质的介质。
(4)气体:在反应过程中以气体形式存在的物质。
三、物质变化的原因1.内因:物质本身的性质,如可燃性、氧化性、还原性等。
2.外因:影响物质变化的外部条件,如温度、压力、光照、接触面积等。
四、生活中的物质变化实例1.烹饪:烹饪过程中,食材发生化学变化,如蛋白质变性、糖类分解等。
2.洗涤:洗涤剂对污渍的去除过程中,涉及化学反应,如乳化、溶解等。
3.呼吸:人体呼吸过程中,氧气与食物中的营养物质发生化学反应,释放能量。
4.酿造:酿酒、制醋等过程中,糖类、淀粉等物质经过发酵生成酒精、醋酸等。
5.腐败:食物腐败过程中,微生物分解有机物,产生恶臭、有害物质等。
6.锈蚀:金属制品锈蚀过程中,金属与氧气、水等发生化学反应,生成氧化物。
五、物质变化的应用1.制备新材料:通过化学反应,制备具有特定功能的材料,如塑料、合成纤维、陶瓷等。
2.医药:药物的研发和生产过程中,涉及多种物质变化,如合成、提取、纯化等。
3.环境保护:利用化学反应处理废水、废气等污染物,实现环境保护。
4.能源开发:燃料的燃烧、太阳能电池等,都是利用物质变化转化能量。
5.农业:农药、化肥的生产和使用过程中,涉及物质变化,如合成、分解等。
六、注意事项1.掌握物质变化的本质区别:物理变化和化学变化。
2.了解反应物的类型及作用:原料、催化剂、溶剂、气体等。
3.注意物质变化的原因:内因和外因。
4.联系实际生活,举例说明物质变化的应用。
5.培养观察和思考能力,探索物质变化的规律。
化学初中三年级常见物质的变化

化学初中三年级常见物质的变化【化学初中三年级常见物质的变化】一、引言化学是一门研究物质的性质和变化的科学,通过观察和实验,我们可以了解常见物质在各种条件下的变化规律。
在初中三年级的化学学习中,我们接触到了许多常见物质的变化现象,本文将着重探讨一些常见物质的变化及其背后的化学原理。
二、物质的变化分类物质的变化可分为物理变化和化学变化两大类。
物理变化指的是物质在形态、性质上的改变,但其化学组成并未发生变化;而化学变化则表示物质在化学结构和化学性质上发生了明显变化。
接下来,我们将重点介绍几种常见物质的变化及其所依据的化学原理。
三、常见物质的变化及化学原理1. 水的凝固和融化变化水在低于0摄氏度时会发生凝固变化,将成为冰,在此情况下物质的化学组成并未改变。
当温度升高超过0摄氏度时,冰会融化成液态水,仍然是物质的物态改变,而非化学变化。
化学原理:水的凝固和融化取决于温度和压力,实质上是水分子间距离的变化。
2. 燃烧反应当物质与氧气等能够提供氧的物质发生反应时,就会产生火焰、热和光,这是一种明显的化学变化,称为燃烧反应。
化学原理:燃烧反应是氧化还原反应的一种特殊形式,在燃烧过程中,燃料物质被氧化剂——氧气氧化,形成新的物质,释放能量。
3. 酸碱中和反应酸和碱在一定条件下混合会发生中和反应,生成盐和水,这也是一种化学变化。
化学原理:酸碱中和反应基于氢离子(H+)和氢氧根离子(OH-)的结合生成水(H2O)的化学反应。
在此过程中,酸和碱中的反应物发生化学变化,生成新的化合物。
4. 金属氧化反应金属与氧气发生反应时,会生成金属氧化物,这也属于一种化学变化。
化学原理:金属与氧气反应是一类氧化反应,金属的表面会与氧气发生化学反应,产生氧化物。
这种反应常见于金属的生锈现象。
5. 食物腐败食物在一定条件下放置时间较长,会发生腐败变化,这是一种化学变化。
食物中的有机物质被微生物分解,产生新的化合物,从而导致食物的变质。
化学原理:食物腐败过程中,微生物通过分解碳水化合物、蛋白质和脂肪等有机物质,产生气体、酸和其他挥发性物质,使食物发生质的变化。
物质的变化与反应

物质的变化与反应物质是构成我们周围世界的基本单位,而物质的变化与反应是使世界充满了无限的可能性。
本文将探讨物质的变化与反应的基本概念、分类以及在日常生活中的应用。
一、物质的变化物质的变化是指物质在化学或物理条件下的性质发生改变的过程。
根据物质改变后的性质和组成是否发生变化,物质的变化可以分为化学变化和物理变化两种类型。
1. 化学变化化学变化是指物质在发生反应时,原有物质的性质和组成发生彻底改变的过程。
在化学变化中,常常伴随着能量的吸收或释放,以及化学键的断裂或形成。
化学变化的特征包括气体的生成、颜色的变化、温度的升降等。
例如,燃烧就是一种常见的化学变化,燃烧物质与氧气反应产生新的物质和能量。
另外,化学物质之间的酸碱中和反应、金属与非金属的反应等也属于化学变化。
2. 物理变化物理变化是指物质在一定条件下,不改变其分子结构和组成的情况下,改变其外部形态或分散状态的过程。
物理变化的特征包括形态的改变、物理性质的变化等。
例如,水的沸腾是一种物理变化,水在升温到100摄氏度时,液体转变为气体,但其物质组成未发生改变。
此外,物质的溶解、固体的熔化等也属于物理变化。
二、物质的反应物质的反应是指两个或更多物质之间发生化学变化的过程。
根据不同的反应类型和反应条件,物质的反应可以分为合成反应、分解反应、置换反应和氧化还原反应等。
1. 合成反应合成反应是指两个或多个物质反应生成一个新的化合物的过程。
在合成反应中,反应物的分子结构和组成发生改变,生成物质具有新的性质。
例如,二氧化碳和水反应生成碳酸氢根离子的化学方程式为:CO2 + H2O → HCO3-。
在此反应中,二氧化碳和水反应生成了碳酸氢根离子,形成了碱性溶液。
2. 分解反应分解反应是指一个化合物分解为两个或更多物质的过程。
在分解反应中,反应物的分子结构发生破坏,形成多个产物。
例如,过氧化氢分解的化学方程式为:2H2O2 → 2H2O + O2。
在此反应中,过氧化氢分解为水和氧气。
化学物质变化

化学物质变化化学作为一门自然科学,探索了物质的组成、性质以及变化的过程。
化学物质变化是指物质在化学反应中发生的各种变化现象。
本文将从化学反应的类型、影响物质变化的因素以及变化过程中的能量变化等方面进行探讨。
一、化学反应的类型化学反应可以分为多种类型,其中包括物质的合成、分解、置换和取代以及酸碱中和反应等。
物质的合成反应是指两种或多种物质通过化学反应生成新的物质的过程,例如:2H2(g) + O2(g) → 2H2O(l)。
物质的分解反应是指一种物质在反应中分解为两种或多种物质的过程,例如:2H2O(l) → 2H2(g) + O2(g)。
物质的置换和取代反应是指一种物质的原子或原子团被另一种物质所取代的反应,例如:2AgNO3(aq) + Cu(s) → Cu(NO3)2(aq) + 2Ag(s)。
酸碱中和反应是指酸和碱反应生成盐和水的过程,例如:HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)。
二、影响物质变化的因素化学物质变化受到多种因素的影响,其中包括温度、浓度、催化剂以及表面积等。
温度的提高可以加快化学反应的速率,因为高温会提高分子的平均动能,使得反应物分子之间更频繁碰撞,增加反应发生的机会。
浓度的增加也可以加快反应速率,因为高浓度会增加反应物分子之间的碰撞频率。
催化剂是可以改变反应路径和速率的物质,它能提供新的反应路径,降低反应物之间的活化能,加快了反应速率。
表面积的增大可以增强固体与液体或气体之间的反应速率,因为增大表面积会增加反应物与反应物之间的接触面积,从而加快反应速率。
三、变化过程中的能量变化化学反应过程中常常伴随着能量的释放或吸收。
放热反应是指在反应过程中释放出能量,使得周围环境的温度升高。
吸热反应是指在反应过程中吸收能量,使得周围环境的温度降低。
放热反应和吸热反应都属于化学反应的能量变化。
例如,燃烧反应是一种放热反应,它会释放大量的能量,而融化冰块则是一种吸热反应,需要吸收周围的热量来将固态水转化为液态水。
化学反应中的物质变化

化学反应中的物质变化化学反应是指物质在一定条件下相互作用,发生化学变化的过程。
在化学反应中,原有的物质会发生物质变化,形成新的物质。
这些物质变化包括化学反应中的物质转化以及物质的性质改变。
本文将从化学反应的定义和反应类型、物质变化的表现形式、物质变化的原理和应用等方面进行探讨。
一、化学反应的定义和反应类型化学反应是物质间由于电子云重新排列所引起的物质结构的变化和性质的变化。
化学反应的核心是原子间或分子间电子的重新排列,从而导致物质结构及性质的变化。
根据反应的条件和反应物种类的不同,化学反应可分为各种类型。
常见的化学反应类型包括:酸碱中和反应、氧化还原反应、置换反应、气体的合成和分解以及有机化合物的合成等。
1.酸碱中和反应酸碱中和反应是指酸和碱两种物质在一定条件下反应生成水和盐的反应。
当酸和碱按摩尔比反应时,酸碱混合溶液会发生中和反应,通常会放出热量,同时生成水和盐。
例如,盐酸与氢氧化钠反应生成氯化钠和水:HCl + NaOH → NaCl + H2O2.氧化还原反应氧化还原反应是指物质中的电子转移过程,包括电子给体的氧化和电子受体的还原。
在氧化还原反应中,还原剂失去电子,同时氧化剂接受电子。
典型的氧化还原反应是金属与非金属氧化物的反应。
例如,铁与氧反应生成铁(III)氧化物:4Fe + 3O2 → 2Fe2O33.置换反应置换反应是指一种元素或离子在化合物中取代其他元素或离子的反应。
置换反应可以分为单一置换和双重置换两种类型。
例如,铜与硫酸反应生成铜(II)硫酸:Cu + H2SO4 → C uSO4 + H24.气体的合成和分解气体的合成和分解反应是指两种或多种气体物质相互作用形成新的气体物质或者气体物质分解成其他物质的反应。
例如,氢气与氧气反应生成水蒸气:2H2 + O2 → 2H2O5.有机化合物的合成有机化合物的合成反应是指有机化合物中碳和碳之间或碳和氢之间的键合成或断裂的反应。
有机化合物的合成反应种类繁多,根据合成方式的不同,可以分为加成反应、消除反应、取代反应等。
化学反应物质变化的判断依据及反应类型的分类与实验结果的分析

化学反应物质变化的判断依据及反应类型的分类与实验结果的分析化学反应是物质之间发生的一系列变化过程。
通过观察反应物质的变化以及分析实验结果,我们可以判断化学反应发生的类型和确定物质的变化。
首先,判断化学反应物质变化的依据主要包括实验观察和理论分析两方面。
一、实验观察在化学实验中,我们通过观察物质的变化来判断化学反应的发生。
以下是常见的实验观察现象和对应的反应类型:1.气体的产生:如果反应中产生了气体,例如氢气、氧气、二氧化碳等,那么可以判断这是气体生成反应。
2.溶液的颜色变化:某些化学反应会导致溶液的颜色发生变化,比如出现浑浊、颜色变深或变浅等,这可能是颜色改变反应。
3.产生光、热或声音:有些反应会伴随着光、热或声音的产生,例如放烟花、爆炸等,可以判断这是放热反应或爆炸反应。
4.沉淀的生成:某些反应会产生沉淀,即固体颗粒悬浮在溶液中,这是沉淀生成反应。
二、理论分析在实验观察的基础上,理论分析可以进一步确定化学反应的类型。
以下是常见的化学反应类型:1.氧化还原反应:氧化还原反应是指电子在反应中的转移。
如果反应中有物质失去电子(被氧化),同时有物质获得电子(被还原),那么这是氧化还原反应。
2.酸碱反应:酸碱反应是指酸和碱在反应中发生中和反应,产生盐和水。
常见的酸碱反应有氢氧化钠与盐酸的中和反应。
3.沉淀反应:沉淀反应是指两种溶液混合后,产生固体沉淀。
比如在氯化钡溶液中加入硫酸钠溶液,会产生白色的硫酸钡沉淀。
4.配位反应:配位反应是指配体与中心金属离子形成配合物的反应。
比如在溴化物离子中加入氯离子,会形成溴氯配合物。
然后,针对实验结果的分析可以进一步确定反应类型和物质变化。
1.物质的质量变化:可以通过质量的增减来判断反应是否发生。
对于闭合系统而言,质量守恒,即反应前后物质的质量之和保持不变。
2.化学方程式的平衡:根据化学方程式的平衡情况来分析反应类型。
如果反应满足动力学平衡,可以通过化学方程式中系数之间的比例确定反应类型。
化学中的物质变化从微观到宏观的化学反应

化学中的物质变化从微观到宏观的化学反应化学是一门研究物质的性质、组成、结构、变化和相互关系的科学。
在化学中,物质的变化是一个核心概念。
物质变化指的是物质在化学反应中发生的转化过程,从微观角度到宏观角度,这些变化是通过化学反应来实现的。
本文将分析和讨论化学反应在物质变化中的微观和宏观方面的重要性,以及不同的化学反应类型。
一、微观角度的物质变化微观角度是指从分子和原子的角度来观察物质的变化过程。
在化学反应中,原子和分子之间发生了一系列的重新排列和重组,从而导致了物质的变化。
这些微观的变化是通过化学方程式来描述的,化学方程式提供了反应物和生成物之间物质的摩尔比例。
以一般的化学反应为例,假设有一个由氢气和氧气组成的反应物,经过火焰的引燃,产生了水分子。
在微观角度下,我们可以观察到氢气分子和氧气分子之间的碰撞和解离,形成新的氢氧键,从而生成水分子。
这个过程是从微观上观察到的,它展示了物质变化是如何从分子层面发生的。
二、宏观角度的物质变化宏观角度是指从人类感官可以观察到的物质变化过程。
化学反应的宏观表现是通过我们的肉眼或其他仪器看到的实验结果。
在宏观角度下,我们可以观察到一系列的物质性质的变化,例如颜色的变化、气体的释放、形态的变化等。
继续以上述的氢气与氧气反应生成水分子的例子,当我们点燃这个反应物混合物时,我们可以看到产生了明亮的火焰和激烈的爆炸声。
这个宏观的表现是化学反应从微观到宏观的转化结果。
通过宏观观察,我们可以判断化学反应是否发生以及反应的速率和产物的量。
三、不同类型的化学反应化学反应可以分为几种不同的类型,每种类型都在物质变化中起着不同的作用。
1. 合成反应:合成反应是指两个或多个物质结合形成一个新的化合物。
例如,氢气和氧气反应生成水分子就是一个合成反应。
2. 分解反应:分解反应是指一个化合物分解成两个或更多的物质。
例如,二氧化锰分解成氧气和二氧化硅就是一个分解反应。
3. 双替换反应:双替换反应是指两个化合物中的阳离子和阴离子互相交换位置,形成两个新的化合物。
专题29 物质的变化和化学反应类型

物质的变化和化学反应类型
考一
物质的变化
1.物理变化与化学变化的比较
物理变化 概念 基本 特征 没有生成新物质 的变化 没有新物质生成 化学变化 有新物质生成的 变化 有新物质生成
物理变化 本 质 区 别 现 象 构成物 质的粒子本身 没变, 变的是粒子的空 隙和排列方式
化学变化 构成物质的粒子 的组成或结构发 生了改变 常伴随发光、放
2.物质的性质 (1)物理性质:物质不需要发生化学变化就表示出 来的性质,如物质的颜色、状态、气味、硬度、密度、 熔点、沸点、溶解性、挥发性等。 (2)化学性质: 物质在化学变化中表现出来的性质, 如物质的可燃性、氧化性、还原性、酸碱性等。
考点二
基本反应类型
1.基本反应类型比较
2.基本反应类型规律 (1)在四种基本反应类型中,一定有单质参加的反 应是置换反应,一定有单质生成的反应是置换反应, 一定没有单质参加和生成的反应是复分解反应。 (2)复分解反应的结果是:生成物中一定有沉淀、 气体或水。 (3)中和反应是指酸和碱反应生成盐和水的化学反 应。 中和反应不是 (选填“是”或“不是”)基本反应类 型,属于复分解反应。
)
过程中涉及到化学变化的是( A.生产红糖时蒸发甘蔗汁液 B.酿制红曲酒时发酵糯米
C.制作火腿时将成品切块包装
D.制作蜜枣时晒干水分
解析:生产红糖时蒸发甘蔗汁液、制作火腿时切块包装、
制作蜜枣时晒干水分的过程中都没有新物质生成,属于
物理变化;而制作红曲酒时发酵糯米的过程中有新物质
酒精生成属于化学变化。 答案:B
下列过程属于化学变化的是(
A.冰雪消融 B.钢铁生锈
)
C.玻璃破碎
答案:B
D.灯丝发光
10个物理变化和10个化学变化

10个物理变化和10个化学变化物理变化:1. 蒸发:蒸发是指液体在常温下从液态转化为气态的过程。
当液体受热时,分子运动加剧,部分分子能量足够大以克服相互间的吸引力,逃离液体表面进入气相,形成蒸气。
2. 溶解:溶解是指固体、液体或气体溶质在溶剂中均匀分散形成溶液的过程。
溶质分子与溶剂分子相互作用,使溶质分子逐渐脱离原有的组成,与溶剂分子相互混合。
3. 磁化:磁化是指物体在外加磁场下,内部的微观磁矩被重新排列,使整个物体具有磁性的过程。
外加磁场能够使物体内部的磁矩朝向一致,形成磁化。
4. 弹性变形:弹性变形是指物体在受力作用下,能够发生形状改变,但在去除外力后能够恢复原状的过程。
物体受到外力后,其分子之间的相互作用会发生变化,形成临时的形变,一旦外力消失,分子重新排列,物体恢复原来的形状。
5. 熔化:熔化是指固体在一定温度下转变为液体的过程。
当固体受热达到熔点时,其分子或离子的热运动增加,逐渐克服相互间的吸引力,形成液体。
6. 融化:融化是指物质从固态转变为液态的过程。
融化与熔化类似,但融化一般用于非晶态物质或某些特殊条件下的物质。
7. 振动:振动是指物体围绕其平衡位置作周期性的来回运动。
物体受到外力作用或能量激发时,会发生振动现象。
8. 扩散:扩散是指物质从高浓度区域向低浓度区域的自发传播过程。
扩散是由于分子之间的碰撞和热运动使物质逐渐混合和分散。
9. 折射:折射是指光线从一种介质进入另一种介质时,传播方向发生改变的现象。
折射是由于光在不同介质中传播速度不同,导致光线改变传播方向。
10. 化学反应:化学反应是指物质之间发生化学变化,产生新的物质的过程。
化学反应涉及原子或分子之间的键的断裂和形成,伴随着能量的吸收或释放。
化学变化:1. 氧化反应:氧化反应是指物质与氧气发生反应,产生氧化物的过程。
氧化反应是一种常见的化学反应类型,如燃烧、金属与酸反应等。
2. 还原反应:还原反应是指物质失去氧原子或吸收氢原子,发生电子转移,还原为较低氧化态的过程。
物质的化学变化与化学反应知识点总结

物质的化学变化与化学反应知识点总结化学是研究物质的性质、变化及其规律的科学。
在化学研究中,物质的化学变化和化学反应是非常重要的内容。
本文将对物质的化学变化和化学反应的知识点进行总结。
一、物质的化学变化物质的化学变化是指物质在化学反应中发生的转变。
下面列举几个常见的化学变化现象:1. 酸碱中和反应:酸与碱反应生成盐和水的过程,例如硫酸与氢氧化钠反应生成硫酸钠和水。
2. 氧化还原反应:是指物质与氧化剂或还原剂反应而发生的电荷或氧原子的转移,例如金属与非金属氧化物反应生成盐和水。
3. 热分解反应:是指物质在高温下分解为两个或更多的物质,例如石灰石加热分解生成氧化钙和二氧化碳。
4. 氢氧化反应:是指物质与水反应生成氢氧化物的过程,例如非金属氧化物与水反应生成相应的酸。
二、化学反应的基本概念与表达方式化学反应是指物质之间发生化学变化的过程。
以下是化学反应的基本概念和表达方式:1. 反应物与生成物:反应物是参与化学反应的物质,生成物是反应过程中形成的新物质。
2. 反应物摩尔比:化学反应中,反应物之间的摩尔比是化学方程式的重要组成部分,用来表示反应物之间的摩尔比例关系。
3. 化学方程式:化学方程式是表示化学反应过程的化学式的组合。
它由反应物的化学式和生成物的化学式组成。
4. 反应热:化学反应中释放或吸收的热量称为反应热。
反应热可以分为放热反应和吸热反应。
三、化学反应的类型分类根据化学反应的特征,可以将化学反应分为多种类型。
以下是几种常见的化学反应类型:1. 合成反应:是指两种或更多的物质反应生成一种新物质的过程。
例如氮气与氢气反应生成氨气。
2. 分解反应:是指一种物质分解为两种或更多物质的过程。
例如热分解氢氧化铜生成氧化铜和水。
3. 置换反应:是指一个元素或基团与化合物中的另一个元素或基团互相置换的反应。
例如金属与酸反应生成相应的盐和氢气。
4. 双替反应:是指两种化合物中的阳离子与阴离子互相交换位置的反应。
例如氯化银与硫酸钠反应生成氯化钠和硫酸银。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物质的变化及反应类型
(教案)
花
代
粮
河口实验学校
2009.2.25
【中考要求】
1、会判断一些易分辨的、典型的物理变化和化学变化;知
道物理性质和化学性质。
2、知道物质发生化学变化时伴随有能量变化,认识通过化
学反应获得能量的重要性。
3、能够对典型反应进行分类。
4、知道影响化学反应速率的因素,认识催化剂的重要性。
【知识回放与典例分析】
一、物质变化的辨析
1、宏观判断:是否有新物质生成。
【2008山东】化学上把“生成新物质的变化叫做化学变化”,下面对化学变化中“新物质”的解释,正确的是【】
A.“新物质”就是自然界中不存在的物质
B.“新物质”就是与变化前的物质在颜色、状态
等方面有所不同的物质
C.“新物质”就是与变化前的物质在元素组成上
不同的物质
D.“新物质”就是在组成或结构上与变化前的物
质不同的物质
[2008河南】下列成语或俗语涉及化学变化的是()
A.滴水成冰
B.木已成舟
C.百炼成钢
D.大浪淘沙
2.微观判断:构成反应物的粒子是否发生了变化。
【2008山东】下列用微观图示表示的物质变化,属于化学变化的是()
A.①②
B.②③
C.①③
D.①②③
二、物质性质的辨析
1、化学性质:物质在化学变化中表现出来的性质。
如可燃性、氧化性、还原性、稳定性、酸碱性等。
2、物理性质:不需要发生化学变化就表现来的性质。
《1》物质在物理变化中表现出来的性质。
如溶解性、导电性、挥发性
《2》物质固有的属性。
如颜色、状态、气味、熔点、沸点、
硬度、密度、压强等
变化与性质的区分:在描述物质的性质时,一般常用“能”、“会”、“可以”、“容易”、“具有”等字词;描述物质的变化时,一般表示已经完成或正在进行,多用“变成了”、“生成了”
等词语。
【2008山东】下列物质的用途,主要利用了物质的化学性质的是【】
A.氧气用于急救病人
B.“干冰”用于人工降雨
C.生铁用于铸造铁锅
D.铜用于制造导线
【2007吉林】常温、常压下不适宜用物理性质区别
的一组物质是【】
A.汞和铝
B.二氧化锰和氧化铜粉末
C.酒精和醋酸
D.氢氧化铁和氢氧化铜
三、化学反应类型的划分
1、四种基本反应类型
(1)化合反应:A+B=C (多变一)
(2)分解反应:C=A+B (一变多)
(3)置换反应:A+BC=B+AC(一换一)
(4)复分解反应:AB+CD=AD+CB
2、从得氧失氧的角度划分
(1)氧化反应:物质得氧的反应
(2)还原反应:物质失去氧的反应
注:氧化反应和还原反应是同一化学反应中的两个相反的过程,两者必然同时发生。
CuO + H2=加热===== Cu + H2O
3、从能量角度划分
(1)吸热反应:吸收热量的化学反应。
从始至终需要加热或高温的反应都属于吸热反应。
C + CO2=高温=== 2CO
(2)放热反应:放出热量的化学反应。
如物质的燃烧,金属与酸的反应,生石灰与水的反应等都属于放热反应。
(2008重庆)一般情况下,二氧化碳不燃烧,也不支持燃烧,通常可以用来------。
但镁却可以在二氧化碳中燃烧,化学方程式为:
2Mg+CO2==点燃====2R+C ,其中R的化学式为--------,该反应的基本类型为-----------反应。
(2008内蒙古呼和浩特)某化工厂以石灰石、纯碱和
水为主要原料制取烧碱。
在制取过程中的变化关系为:
CaCO3----------CaO-----------Ca(OH)2------- NaOH;上述变化 过程中没有涉及的化学反应基本类型是()
A.化合反应
B.分解反应
C.置换反应
D.复分解反应
(2007甘肃兰州)在一密闭容器中有A、B、
C、D四种物质,在一定条件下使之反应,一段时间后,测
得反应前后各物质的质量如图。
则该密闭容器中发生的化学反应类型为()
A.化合反应
B.置换反应
C.分解反应
D.复分解反应
四、影响化学反应速率的因素
温度、反应物的浓度、反应物的接触面积及
催化剂等。
温度升高,反应物的浓度增大,
增加反应物的接触面积,都可以加快反应速
率;加入催化剂可以改变反应速率。
催化剂概念的理解:
改变:加快或减慢
质量和化学性质不变,物理性质可能改变
【2007安徽】研究性学习小组选择“H2O2生成O2的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:【假设】H2O2生成O2的快慢与催化剂种类有关
【实验方案】常温下,在两瓶相同体积的H2O2溶液中分别加入相同质量MnO2和红砖粉,测量各生成一瓶(相同体积)O2所需要的时间。
【进行实验】下图是他们进行实验的装置图,气体发生装置中A仪器名称是:,此实验中B处宜采用的气体收集方法是:。
【实验记录】
实验编号 1 2
反应物6%H2O26%H2O2
催化剂19红砖粉19 MnO2
时间152s 35 s
【结论】该探究过程得出的结论是。
【反思】H2O2在常温下分解缓慢,加入MnO2或红砖粉后反应明显加快,若要证明MnO2和红砖粉是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的和是否改变。
H2O2生成O2的快慢还与哪些因素有关?请你帮助他们继续探究。
(只要求提出假设和实验方案)
【假设】。
【实验方案】。
你若还能提出新的合理的假设和实验方案,本题奖励分
【假设】。
【实验方案】。
【中考练兵】
1.(08安徽中考)2008年6月14日是我国第三个“文化遗产日”。
以下是我省部分文化遗产,其制作过程主要属于化学变化()
2、(2006山东)按下列要求各写一个有水生成的化学方程式
(1)化合反应------------
(2)分解反应------------
(3)置换反应------------
(4)复分解反应-------------
(5)不属于(1)、(2)、(3)反应类型的氧化反应----------------------
3、下列物质的用途主要由其化学性质决定的是()
A. 用金刚石做玻璃刀的刀头
B. 用碳酸氢钠治疗胃酸过多症
C. 用石墨做铅笔芯写字
D. 用钨做电灯泡里的灯丝
4、(2007·南京市)下列变化中,属于物理变化的是
()
5.①酒精是一种无色透明、具有特殊气味的液体②易挥发③能与水以任意比例互溶④并能溶解碘、酚酞等多种物质⑤酒精易燃烧,⑥常作酒精灯和内燃机的燃料,是一种绿色能源。
⑦当点燃酒精灯时,酒精在灯芯上边汽化边燃烧,生成二氧化碳和水。
根据上述叙述可归纳出:酒精的物理性质有_____(填代号),化学性质有_____(填代号)。
点燃酒精灯的全过程中酒精发生的物理变化是_________(填文字),发生的化学变化是__________(填文字)。
6、按题意各写一个符号要求的化学方程式。
⑴有单质参加的化合反应。
⑵有氧化物生成的分解反应。
⑶有水生成的复分解反应。
⑷有金属单质生成的置换反应。
[板书设计]
一、物质的变化
1、物理变化
2、化学变化
二、物质的性质
1、物理性质
2、化学性质
三、化学反应的类型
1、四种反应的基本类型
化合反应分解反应置换反应复分解反应2、得氧失氧的角度
氧化反应还原反应
3、能量角度
吸热反应放热反应
四、影响化学反应速率的因素
温度、催化剂、反应物浓度、反应物接触面积等。
