无机化学实验第四版实验24铁钴镍
实验二十四:第一过渡系元素(二)(铁、钴、镍)
实验二十四:第一过渡系元素(二)(铁、钴、镍)〔实验目的〕1.试验并掌握二价铁、钴、镍的还原性和三价铁、钴、镍的氧化性;2.试验并掌握铁、钴、镍配合物的生成及性质。
〔实验原理〕铁、钴、镍的高氧化态化合物多是以含氧酸盐或配盐形式存在,如Na2FeO4、K3CoO4、K2NiF6,这类化合物在水溶液中都是不稳定的。
一、铁的化合物1.铁的化合物铁有3种氧化物,红棕色的氧化铁,黑色的氧化亚铁和黑色的四氧化三铁。
它们都不溶于水,灼烧后的氧化铁不溶于酸,氧化亚铁能溶于酸。
四氧化三铁是二价铁和三价铁的混合型氧化物,具有磁性。
铁化合物列于下表中:物质颜色和状态性质FeCl3黑褐色晶体以共价键为主的化合物,它的蒸气为双聚分子Fe2Cl6。
Fe(NO3)3 = Fe2O3 + 6NO2 + 3/2O2 (600~700ºC) Fe(NO3)3•H2O 淡紫色晶体 2FeCl2•4H2O 淡蓝色晶体在空气中易被氧化为草绿色FeSO4•7H2O 淡绿色晶体加热分解为三氧化硫,水溶液易被氧化。
(NH4)2Fe(SO4)2•6H2O 绿色晶体摩尔氏盐,在潮湿空气和水溶液中较稳定。
2.溶液中Fe(Ⅲ)、Fe(Ⅱ)的反应⑴溶液中Fe3+的重要反应还原剂如I-,SO2,H2S,Sn2+,Fe,Cu,等――――――――――――――――→ Fe2+OH-Δ⇌ Fe(OH)3(s)(棕色)→ Fe2O3NH3•H2O———→ Fe(OH)3(s)(棕色)NH3•H2O+NH4Cl——————→ Fe(OH)3(s)(棕色)Fe2+(NaOH,80ºC) O2——————→ Fe3O4• x H2O → Fe2O3CO32-ClO-——→ Fe(OH)3——→ FeO42-NH3•H2O+(NH4)2S H+――――――→Fe2O3(黑色)―→ FeS(黑色)H2S――→Fe2+ + SNCS-过量F-――→[Fe(NCS)]2+(血红色)―→ [FeF6]3-(无色)[Fe(CN)6]4-+ K+――――――→ [KFe(CN)6Fe]x(蓝色)K2C2O4(浓),加热――――――→ [Fe(C2O4)3]3-(黄色)不稳定,见光分解⑵溶液中Fe2+的重要反应氧化剂如Cr2O72-,浓HNO3等―――――――――――→ Fe3+OH-O2⇌ Fe(OH)2(s)(纯白色)→Fe(OH)3(s)(棕色)NH3•H2O――→ Fe(OH)2(s)(纯白色)NH3•H2O+NH4Cl――――――→无沉淀CO32-H2O + CO2 O2――→ FeCO3(白色)――→ Fe(HCO3)2―→Fe(OH)3(s)(NH4)2S―――→ FeS(黑色)NO――→[Fe(NO)( H2O)5]2+( 棕色)H2O2 +过量F-―――――→ [FeF6]3-(无色)NCS-――→无溶液、无颜色CN-过量CN-Cl2―→Fe(CN)2(s) (白色) ――→[Fe(CN)6]4-――→[Fe(CN)6]3-[Fe(CN)6]3-+ K+――――――→ [KFe(CN)6Fe]x(蓝色)二、钴的化合物1. 钴的化合物钴的氧化物与铁的氧化物类似,为暗褐色的Co2O3•xH2O和灰绿色的CoO。
无机化学Ⅰ:24.铁钴镍

单晶X-Ray衍射和穆氏堡尔谱的实验说明:两者都是
水合六氰合亚铁酸铁。
§23.8.2 铁~一、铁的化合物
*Fe3+是硬酸-高自旋,和硬碱N Fe N C Fe C N Fe
原子结合;Fe2+是软酸-低自旋, N
C
N
和软碱C原子结合。
C
N
C
软硬酸碱原则:硬亲硬, Fe C N Fe N C Fe
软亲软。
*
Fe N C Fe C N Fe
N
C
N
普鲁士蓝和滕氏蓝就是在空穴 C
N
C
中包含不同离子或水分子而形 Fe C N Fe N C Fe
H2 O
OH2 H O
Fe
从水解平衡来看:H ;
H2 O
O H
pH> 0;[Fe(H 2O) 6 ]3 淡紫色
OH2
pH2 3;[Fe(H 2O)5 OH] 2 黄棕色→红棕色
OH2 OH2
Fe OH2
OH2
Fe(OH) 3即Fe2O3 nH2O 加热促进水解,加酸抑制水解;
§23.8.2 铁~一、铁的化合物
3M 2O 2 M3O4 M Fe、Co M S MS M Fe、Co、Ni M Cl 2 MCl 2 M Co、Ni
2Fe 3Cl 2 2FeCl 3 3Fe 4H2O Fe3O4
§23.8 铁钴镍~铁系元素的基本性质
常温时,铁和铝、铬一样,与浓硝酸、浓硫酸因被钝 化不起作用;
6FeSO4 K2Cr2O7 7H2SO4 3Fe2 (SO4 ) Cr2 (SO4 ) K2SO4 7H2O
§23.8.2 铁~一、铁的化合物
2、铁的重要盐类
三氯化铁: 2Fe 3Cl 2 2FeCl 3 mp555K ,bp588K ,(FeCl 3 )2 673K 2FeCl 3 1023K
无机化学实验—第一过渡系元素(II)(铁,钴,镍)

实验25 第一过渡系元素(II)(铁,钴,镍)一、实验目的与要求:1.掌握二价铁,钴,镍的还原性和氧化性。
2.掌握铁,钴,镍配合物的生成及性质。
二、教学重点与难点:掌握二价铁,钴,镍的还原性和氧化性;掌握铁,钴,镍配合物的生成及性质。
三、教学方法与手段:讲授法;演示法四、教学课时: 4课时五、课的类型:实验课六、教学内容:[实验内容]:一、铁(II)、钴(II)、镍(II)的化合物的还原性1、铁(II)的还原性(1)酸性介质:往盛有0.5ml氯水的试管中加入3滴6 mol.L-1H2SO4溶液,然后滴加(NH4)2Fe(SO4)2溶液,观察现象,写出反应式:2Fe2+ + Cl2 === 2Fe3++ 2Cl-Fe3++nSCN-====[Fe(SCN)n]3-n(血红色)说明:Fe2+被氧化为Fe3+的现象不明显(淡绿色 黄棕色),可用KSCN检验Fe3+。
亚铁盐一般用硫酸亚铁铵,它稳定,不易分解,为防万一还需要加硫酸。
(2)碱性介质:在一试管中放入2ml蒸馏水和3滴6mol.L-1H2SO4溶液煮沸,以赶尽溶于其中的空气,然后溶于少量硫酸亚铁铵晶体。
在另一试管中加入3ml 6mol.L-1NaOH溶液煮沸。
冷却后,用一长滴管吸收NaOH溶液,插入(NH4)2Fe(SO4)2溶液到底部,慢慢挤出NaOH,观察产物颜色和状态。
Fe2++2OH- ====Fe(OH)2(为纯白色沉淀)4Fe(OH)2+O2+2H2O====4Fe(OH)3 (红褐色)说明:为了得到纯净的白色氢氧化亚铁沉淀,将溶液加热以赶净溶解在其中的氧气。
放置一段时间白色沉淀变为灰绿色,至实验结束也没有变为红褐色。
【现象:沉淀由白变成灰绿色再变成红棕色】2、钴(II)的还原性(1)、往盛有CoCl2溶液的试管中加入氯水,观察有何变化两者不反应.2Co2++Cl2+2H+ 不反应说明:在酸性溶液中,Co2+比较稳定,不易被氧化。
(2)、在盛有1ml CoCl2溶液的试管中滴入稀NaOH溶液(注:),观察沉淀的生成。
铁镍钴实验报告

铁镍钴实验报告铁镍钴实验报告引言:铁镍钴是一种重要的金属合金,具有广泛的应用领域。
本实验旨在研究铁镍钴合金的物理和化学性质,探索其在材料科学中的潜力。
实验目的:1. 研究铁镍钴合金的晶体结构和相变规律;2. 分析铁镍钴合金的力学性能和磁性质;3. 探索铁镍钴合金在材料科学中的应用前景。
实验方法:1. 实验材料:纯度高的铁、镍和钴;2. 实验仪器:X射线衍射仪、扫描电子显微镜、万能材料测试机、霍尔效应测量仪等;3. 实验步骤:首先,按照一定比例混合铁、镍和钴,制备铁镍钴合金试样。
然后,利用X射线衍射仪测量其晶体结构和相变温度。
接着,使用扫描电子显微镜观察合金的表面形貌。
最后,通过万能材料测试机测试合金的力学性能和霍尔效应测量仪测量其磁性质。
实验结果:1. 晶体结构和相变规律:经X射线衍射仪测量,发现铁镍钴合金具有面心立方结构,并且在一定温度范围内发生相变。
相变温度与合金成分的比例有关,不同比例的合金具有不同的相变温度。
2. 表面形貌:通过扫描电子显微镜观察,发现铁镍钴合金的表面呈现出均匀的晶粒分布和细腻的纹理,表面光洁度较高。
3. 力学性能:通过万能材料测试机测试,发现铁镍钴合金具有良好的强度和韧性,适用于制造高强度结构材料。
4. 磁性质:通过霍尔效应测量仪测试,发现铁镍钴合金具有较强的磁性,可应用于磁性材料和磁存储器件。
讨论与应用:1. 铁镍钴合金的晶体结构和相变规律研究为合金的制备和改性提供了理论基础,可应用于材料工程领域。
2. 铁镍钴合金的力学性能和磁性质使其成为制造高强度结构材料和磁性材料的理想选择。
3. 铁镍钴合金还具有良好的耐腐蚀性和高温稳定性,可应用于航空航天、汽车制造和能源领域等。
结论:本实验通过研究铁镍钴合金的物理和化学性质,深入探索了其在材料科学中的潜力。
铁镍钴合金具有良好的晶体结构、力学性能和磁性质,可广泛应用于多个领域。
进一步的研究和开发将有助于推动铁镍钴合金的应用和创新。
铁钴镍的性质

实验六铁、钴、镍的性质一、实验目的1、试验并掌握铁、钴、镍氢氧化物的生成和氧化还原性质;2、试验并掌握铁、钴、镍配合物的生成及在离子鉴定中的作用。
二、实验原理铁、钴、镍常见氧化值:+2和+3 另外 Fe还有+61、Fe2+、Co2+、Ni2+的还原性(1)酸性介质+ 2Fe2+(浅绿)=2Fe3+(浅黄)+2Cl-Cl2(2)碱性介质铁(II)、钴(II)、镍(II)的盐溶液中加入碱,均能得到相应的氢氧化物。
Fe(OH)易被空气中的氧气氧化,往往得不到白色的氢氧化亚铁,而是变成灰绿色,2也能被空气中的氧气慢慢氧化。
最后成为红棕色的氢氧化铁。
Co(OH)22、Fe3+、Co3+、Ni3+的氧化性由于Co3+和Ni3+都具有强氧化性,Co(OH),NiO(OH)与浓盐酸反应分别生成Co(II)3和Ni(II),并放出氯气。
CoO(OH)和NiO(OH)通常由Co(II)和Ni(II)的盐在碱性条件下用强氧化剂(Cl2、Br2)氧化得到。
Fe3+易发生水解反应。
Fe3+具有一定的氧化性,能与强还原剂反应生成Fe2+。
3、配合物的生成和Fe2+、Fe3+、Co2+、Ni2+的鉴定方法(1)氨配合物Fe2+和Fe3+难以形成稳定的氨配合物。
在水溶液中加入氨时形成Fe(OH)2和Fe(OH)3沉淀。
将过量的氨水加入Co2+或Ni2+离子的水溶液中,即生成可溶性的氨合配离子[Co(NH3)6]2+或[Ni(NH3)6]2+。
不过[Co(NH3)6]2+不稳定,易氧化成[Co(NH3)6]3+。
(2)氰配合物Fe3+,Co3+,Fe2+,Co2+,Ni2+都能与CN-形成配合物。
使亚铁盐与KCN溶液作用得Fe(CN)2沉淀,KCN过量时沉淀溶解。
FeSO4+2KCN=Fe(CN)2+K2SO4Fe(CN)2+4KCN=K4[Fe(CN)6]从溶液中析出来的黄色晶体是K4[Fe(CN)6]·3H2O,叫六氰合铁(II)酸钾或亚铁氰化钾,俗称黄血盐。
无机化学实验二十五 铁、钴、镍

无机化学实验二十五铁、钴、镍实验二十五铁、钴、镍[实验目的]1、试验并掌握二价铁、钴、镍的还原性和三价铁、钴、镍的氧化性;2、试验并掌握铁、钴、镍配合物的生成和Fe2+、Fe3+、Co2+、Ni2+离子的鉴定方法;3、了解金属铁腐蚀的基本原理及其防止腐蚀的方法。
[实验用品] 仪器:试管、离心试管固体药品:硫酸亚铁铵、硫氰酸钾液体药品:H2SO4(1mo1·L-1,6mo1·L-1)、HCl(浓)、NaOH(6mo1·L-1、2mo1·L-1)、氨水(6 mo1·L-1,浓)、(NH4)2Fe(SO4)2(固体,0.1mo1·L-1)、CoC12(0.1mo1·L-1)、NiSO4(0.1mo1·L-1)、KI(0.5mo1·L-1)、K4[Fe(CN)6](0.5mo1·L-1)、FeCl3(0.2mo1·L-1)、KSCN(0.5mo1·L-1)、H2O2(3%)、氯水、碘水、四氯化碳、戌醇、乙醚材料:碘化钾淀粉试纸 [实验内容]一、铁(Ⅱ)、钴(Ⅱ)、镍(Ⅱ)的化合物·的还原性1.铁(Ⅱ)的还原性(1)酸性介质:往盛有5d氯水的试管中加入2d 6mo1·L-1硫酸溶液,然后滴加硫酸亚铁铵溶液1-2d,观察现象,写出反应式。
(如现象不明显,可加1滴KSCN 溶液,出现红色,证明有Fe3+生成)(2)碱性介质:在一试管中放入2mL蒸馏水和3d 6mo1·L-1硫酸溶液,煮沸,以赶尽溶于其中的空气,然后溶入少量硫酸亚铁铵晶体(溶液表面若加3~4d油以隔绝空气,效果更好)。
在另一试管中加入1m1 6mo1·L-1氢氧化钠溶液,煮沸(为什么?)。
冷却后,用一长d管吸取氢氧化钠溶液,插入硫酸亚铁铵溶液(直至试管底部)内,慢慢放出氢氧化钠(整个操作都要避免空气带进溶液中,为什么?)观察产物颜色和状态。
铁、钴、镍实验报告
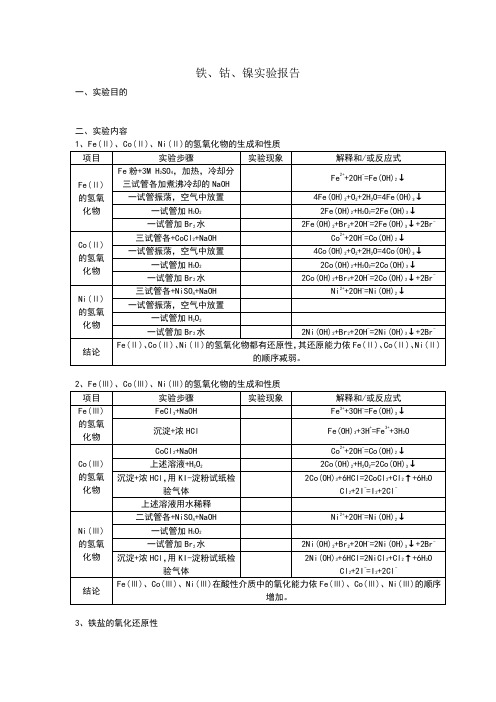
一试管加Br2水
2Co(OH)2+Br2+2OH-=2Co(OH)3↓+2Br-
Ni(Ⅱ)的氢氧化物
三试管各+NiSO4+NaOH
Ni2++2OH-=Ni(OH)2↓
一试管振荡,空气中放置
一试管加H2O2
一试管加Br2水
2Ni(OH)2+Br2+2OH-=2Ni(OH)3↓+2Br-
CoCl2+OH-=Co(OH)Cl↓+Cl-
上述溶液+过量NH3水
Co(OH)Cl+6NH3=[Co(NH3)6]2++OH-+Cl-
4[Co(NH3)6]2++O2+2H2O=4[Co(NH3)6]3++4OH-
NiSO4+适量NH3水
2Ni2++2OH-+SO42-=Ni2(OH)2SO4↓
上述溶液+过量NH3水
Fe(OH)3+3H+=Fe3++3H2O
Co(Ⅲ)的氢氧化物
CoCl2+NaOH
Co2++2OH-=Co(OH)2↓
上述溶液+H2O2
2Co(OH)2+H2O2=2Co(OH)3↓
沉淀+浓HCl,用KI-淀粉试纸检验气体
2Co(OH)3+6HCl=2CoCl2+Cl2↑+6H2O
Cl2+2I-=I2+2Cl-
Ni2(OH)2SO4+12NH3=2[Ni(NH3)6]2++2OH-+SO42↓
实验二十四第一过渡系元素(二)(铁、钴、镍)

2Fe3++2I-=2Fe2++I2
结论
水溶液中Fe3+的氧化力大于I2,而Co3+和Ni3+的氧化力大于Cl2。
三、配合物的生成
1铁的配合物
(1) 亚铁氰化钾溶液中加入碘水,摇荡试管后,加入硫酸亚铁。
加入硫酸亚铁后生成蓝色物质。
Fe(II)的CN-配合物被I2氧化成Fe(III)配合物,加入Fe2+后生成了铁蓝。
查电极电势可知,Fe2+不能被I2氧化
Fe2+?+I2=(不反应)
强氧化剂可以将Fe2+氧化成Fe3+,后者与SCN-反应生成血红色配合物:
Fe2++H2O2=Fe3++H2O
Fe3++nSCN-=[Fe(SCN)n]3-n(n=1~6)
结论
由于电极电势 I2不能将Fe2+氧化成为Fe3+,生成配合物改变了电极电势, 因此I2可以将Fe(II)的氰配合物氧化成Fe(II)配合物;H2O2能将Fe2+氧化成Fe3+。
总结:
铁、钴、镍的主要化合价为+2和+3。
其中+2氧化态具有还原性,+3氧化态具有氧化性。
通常,酸性条件下的氧化能力增加;碱性条件下物质还原能力增加;
配合物的形成能够在较大的程度上能改变元素电对的电极电势;
还原性增强
Fe(II)
Co(II)
Ni(II)
Fe(III)
Co(III)
Ni(III)
氧化性增强
2钴的配合物
(1)CoCl2溶液中加入少量KSCN固体,观察固体周围溶液的颜色。再加入戊醇和乙醚,观察有机相颜色。
无机化学实验第四版实验24 铁钴镍
实验24 铁钴镍一、实验目的1、试验并掌握铁、钴、镍氢氧化物的生成和氧化还原性质;2、试验并掌握铁、钴、镍配合物的生成及在离子鉴定中的作用。
二、实验内容(实验现象根据自己所观察到的为准)三、实验讨论(从自己实验操作展开)四、实验思考题和习题1。
实验步骤(2)要求整个实验不能带入空气到溶液中,为什么?Fe(Ⅱ)易被氧化,如若带入了空气,可能不能观察到颜色的转化过程。
2.根据实验现象总结+2价的铁、钴、镍化合物的还原性和+3价的铁钴镍化合物氧化性的变化规律。
Fe(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)的氢氧化物都有还原性,其还原能力依Fe(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)的顺序减弱。
Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)在酸性介质中的氧化能力依Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)的顺序增加。
3。
比较钴镍氨配合物的氧化还原性相对大小及溶液稳定性。
钴盐和镍盐生成碱式盐溶于过量的氨水生成氨配合物,Co(Ⅱ)氨配合物易氧化转化成 Co(Ⅲ)氨配合物。
即镍盐更稳定.4。
为什么制取+3价的钴镍氢氧化物要用+2价为原料在碱性条件下进行氧化,而不+3价直接制取?首先,作为最高价氧化值,Co3+、Ni3+氧化性比较不稳定,易变成其它价态,故不用采用+3价直接氧化得到。
其次,而Co(OH)2、Ni(OH)2两性,在碱性条件下易被氧化成+3价氢氧化物。
5。
如何分离混合液中的?Fe3+、Cr3+、Ni2+ ?6.总结Fe(Ⅱ、Ⅲ)、Co(Ⅱ、Ⅲ)、Ni(Ⅱ、Ⅲ)主要化合物性质。
Fe(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)具有强的还原性,都易形成配合物,且Co的配合物极易被氧化,它们的氢氧化物也易被氧化;Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)具有强的氧化性,也易生成配合物。
7。
(此题面字太多,不好打得,请谅解)A:(NH4)2Fe (SO4)2B:(NH4)2Fe (SO4)2溶液C:Fe(OH)2D:NH3E:I2F:Fe3+G:KFe[Fe(CN)6]H:BaSO4这些方程式都是简单的,都可以轻易写出,在此我不一一写出了。
无机化学实验第四版实验2铁钴镍
实验24铁钴镍一、实验目得1、试验并掌握铁、钴、镍氢氧化物得生成与氧化还原性质;2、试验并掌握铁、钴、镍配合物得生成及在离子鉴定中得作用。
二、实验内容(实验现象根据自己所观察到得为准)三、实验讨论(从自己实验操作展开) 四、实验思考题与习题1、实验步骤(2)要求整个实验不能带入空气到溶液中,为什么?F e(Ⅱ)易被氧化,如若带入了空气,可能不能观察到颜色得转化过程。
2.根据实验现象总结+2价得铁、钴、镍化合物得还原性与+3价得铁钴镍化合物氧化性得变化规律。
Fe (Ⅱ)、Co (Ⅱ)、Ni(Ⅱ)得氢氧化物都有还原性,其还原能力依Fe (Ⅱ)、Co (Ⅱ)、Ni (Ⅱ)得顺序减弱。
Fe(Ⅲ)、Co(Ⅲ)、Ni (Ⅲ)在酸性介质中得氧化能力依Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)得顺序增加。
3、比较钴镍氨配合物得氧化还原性相对大小及溶液稳定性。
钴盐与镍盐生成碱式盐溶于过量得氨水生成氨配合物,Co(Ⅱ)氨配合物易氧化转化成 Co (Ⅲ)氨配合物。
即镍盐更稳定。
4、为什么制取+3价得钴镍氢氧化物要用+2价为原料在碱性条件下进行氧化,而不+3价直接制取?首先,作为最高价氧化值,Co 3+、Ni 3+氧化性比较不稳定,易变成其它价态,故不用采用+3价直接氧化得到。
其次,而C o(OH)2、Ni(OH)2两性,在碱性条件下易被氧化成+3价氢氧化物。
53+3+2+ﻩ6.配合物极易被氧化,它们得氢氧化物也易被氧化;Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)具有强得氧化性,也易生成配合物。
7、(此题面字太多,不好打得,请谅解)A:(NH4)2Fe (SO4)2B:(NH4)2Fe(SO4)2溶液C:Fe(OH)2D:NH3E:I2F:Fe3+G:KFe[Fe(CN)6]H:BaSO4这些方程式都就是简单得,都可以轻易写出,在此我不一一写出了。
下学期实验报告示范p

2CoO(OH) + 6HCl = 2CoCl2+ Cl2+ 4H2+ Cl2+ 4H2O
(2) FeCl3溶液中加入KI溶液,再加入CCl4,震荡试管
FeCl3溶液中加入KI溶液后得到黄色溶液,加入CCl4震荡试管,CCl4层呈紫色。
Fe2++ 2OH-= Fe(OH)2(白色)
4Fe(OH)2+ O2+ 2H2O = 4Fe(OH)3
2 钴(II)的还原性
(1) Co2+溶液中加入Cl2水
实验未观察到溶液颜色变化。
Co2+与Cl2水不反应。
(2)CoCl2溶液中加入NaOH。所得沉淀分成两份。一份置于空气中,一份加入Cl2水
a.加入NaOH后首先观察到蓝色沉淀生成,NaOH过量,得到粉红色沉淀。
c. 加入NaOH后,由于生成了沉淀,配合物被解离得到蓝色沉淀:
[Ni(NH3)6]2++ 2OH-= Ni(OH)2+ 6NH3
d. 加入H2SO4后,由于NH3生成为NH4+,配合物也被解离得到水合Ni2+离子:
[Ni(NH3)6]2+(蓝色) + 6H+= Ni2++ 6NH4+
e. 将配合物的水溶液加热,配离子水解得到沉淀:
2[Ni(NH3)6]SO4+ 2H2O = Ni2(OH)2SO4+ 10NH3(NH4)2SO4
结论
Co2+可以生成不稳定的蓝色的配合物[Co(SCN)4]2-,此配合物在有机相中稳定性增加。Co2+也可以生成黄色的氨配合物。由于生成配合物之后电极电势发生变化,Co2+的氨配合物可以被空气氧化成Co(NH4)63+(橙色),而Ni2+的氨配合物不能被空气所氧化。Ni2+的氨配合物加酸加碱或加热都可以破坏。
铁钴镍
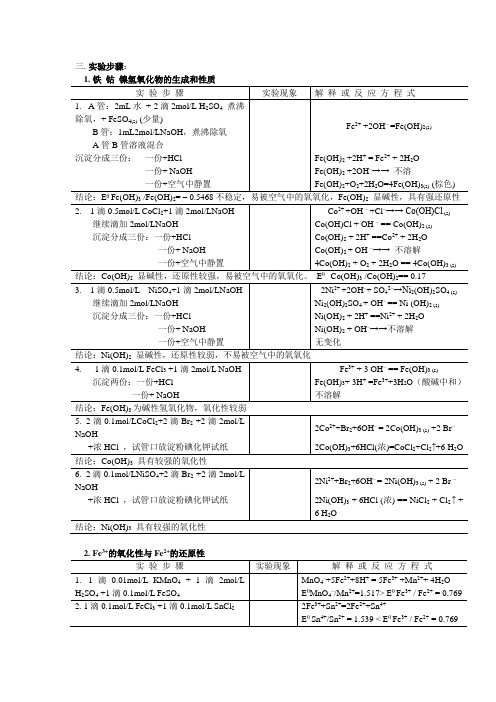
三.实验步骤:1.铁钴镍氢氧化物的生成和性质实验步骤实验现象解释或反应方程式1.A管:2mL水+ 2滴2mol/L H2SO4煮沸除氧,+ FeSO4(s) (少量)B管:1mL2mol/LNaOH,煮沸除氧A管B管溶液混合Fe2+ +2OH– =Fe(OH)2(s)沉淀分成三份:一份+HCl Fe(OH)2 +2H+ = Fe2+ + 2H2O一份+ NaOH Fe(OH)2 +2OH–→→不溶一份+空气中静置Fe(OH)2+O2+2H2O=4Fe(OH)3(s) (棕色) 结论:EθFe(OH)3 /Fe(OH)2= – 0.5468不稳定,易被空气中的氧氧化,Fe(OH)2显碱性,具有强还原性2. 1滴0.5mol/L CoCl2+1滴2mol/LNaOH Co2++OH –+Cl–→→ Co(OH)Cl (s)继续滴加2mol/LNaOH Co(OH)Cl + OH – == Co(OH)2 (s)沉淀分成三份:一份+HCl Co(OH)2 + 2H+ ==Co2+ + 2H2O一份+ NaOH Co(OH)2 + OH –→→不溶解一份+空气中静置4Co(OH)2 + O2 + 2H2O == 4Co(OH)3 (s)结论:Co(OH)2显碱性,还原性较强,易被空气中的氧氧化。
EθCo(OH)3 /Co(OH)2== 0.173. 1滴0.5mol/L NiSO4+1滴2mol/LNaOH 2Ni2+ +2OH–+ SO42–→Ni2(OH)2SO4 (s)继续滴加2mol/LNaOH Ni2(OH)2SO4 + OH–== Ni (OH)2 (s)沉淀分成三份:一份+HCl Ni(OH)2 + 2H+ ==Ni2+ + 2H2O一份+ NaOH Ni(OH)2 + OH–→→不溶解一份+空气中静置无变化结论:Ni(OH)2显碱性,还原性较弱,不易被空气中的氧氧化4. 1滴0.1mol/L FeCl3 +1滴2mol/L NaOH Fe3+ + 3 OH– == Fe(OH)3 (s)沉淀两份:一份+HCl Fe(OH)3+ 3H+ =Fe3++3H2O(酸碱中和)一份+ NaOH 不溶解结论:Fe(OH)3为碱性氢氧化物,氧化性较弱5. 2滴0.1mol/LCoCl2+2滴Br2 +2滴2mol/LNaOH2Co2++Br2+6OH–= 2Co(OH)3 (s) +2 Br–+浓HCl ,试管口放淀粉碘化钾试纸2Co(OH)3+6HCl(浓)=CoCl2+Cl2↑+6 H2O 结论:Co(OH)3具有较强的氧化性6. 2滴0.1mol/LNiSO4+2滴Br2 +2滴2mol/LNaOH2Ni2++Br2+6OH–= 2Ni(OH)3 (s) + 2 Br –+浓HCl ,试管口放淀粉碘化钾试纸2Ni(OH)3 + 6HCl (浓) == NiCl2 + Cl2 ↑ +6 H2O结论:Ni(OH)3具有较强的氧化性2.Fe3+的氧化性与Fe2+的还原性实验步骤实验现象解释或反应方程式1.1滴0.01mol/L KMnO4+ 1滴2mol/L H2SO4 +1滴0.1mol/L FeSO4MnO4–+5Fe2++8H+ = 5Fe3+ +Mn2++ 4H2OEθMnO4–/Mn2+=1.517> Eθ Fe3+ / Fe2+ = 0.7692. 1滴0.1mol/L FeCl3 +1滴0.1mol/L SnCl22Fe3++Sn2+=2Fe2++Sn4+Eθ Sn4+/Sn2+ = 1.539 < Eθ Fe3+ / Fe2+ = 0.769结论:在酸性条件下,Fe3+为中强氧化剂。
无机化学实验二十五铁、钴、镍

无机化学实验二十五铁、钴、镍(总4页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--实验二十五铁、钴、镍[实验目的]1、试验并掌握二价铁、钴、镍的还原性和三价铁、钴、镍的氧化性;2、试验并掌握铁、钴、镍配合物的生成和Fe2+、Fe3+、Co2+、Ni2+离子的鉴定方法;3、了解金属铁腐蚀的基本原理及其防止腐蚀的方法。
[实验用品]仪器:试管、离心试管固体药品:硫酸亚铁铵、硫氰酸钾液体药品:H2SO4(1mo1·L-1,6mo1·L-1)、HCl(浓)、NaOH(6mo1·L-1、2mo1·L-1)、氨水(6 mo1·L-1,浓)、(NH4)2Fe(SO4)2(固体,·L-1)、CoC12·L-1)、NiSO4·L-1)、KI·L-1)、K4[Fe(CN)6]·L-1)、FeCl3·L-1)、KSCN·L-1)、H2O2(3%)、氯水、碘水、四氯化碳、戌醇、乙醚材料:碘化钾淀粉试纸[实验内容]一、铁(Ⅱ)、钴(Ⅱ)、镍(Ⅱ)的化合物·的还原性1.铁(Ⅱ)的还原性(1)酸性介质:往盛有5d氯水的试管中加入2d 6mo1·L-1硫酸溶液,然后滴加硫酸亚铁铵溶液1-2d,观察现象,写出反应式。
(如现象不明显,可加1滴KSCN溶液,出现红色,证明有Fe3+生成)(2)碱性介质:在一试管中放入2mL蒸馏水和3d 6mo1·L-1硫酸溶液,煮沸,以赶尽溶于其中的空气,然后溶入少量硫酸亚铁铵晶体(溶液表面若加3~4d油以隔绝空气,效果更好)。
在另一试管中加入1m1 6mo1·L-1氢氧化钠溶液,煮沸(为什么)。
冷却后,用一长d管吸取氢氧化钠溶液,插入硫酸亚铁铵溶液(直至试管底部)内,慢慢放出氢氧化钠(整个操作都要避免空气带进溶液中,为什么?)观察产物颜色和状态。
铁钴镍实验报告实验结果(3篇)

第1篇一、实验目的本次实验旨在通过一系列化学反应和物理实验,研究铁、钴、镍三种金属的性质,包括它们的还原性、氧化性、配合物生成以及磁性等。
通过对比实验结果,加深对这三种金属化学性质的理解。
二、实验原理1. 还原性:在还原反应中,金属原子失去电子,氧化态降低。
铁、钴、镍在酸性或碱性介质中表现出不同的还原性。
2. 氧化性:在氧化反应中,金属原子获得电子,氧化态升高。
铁、钴、镍的三价离子具有氧化性。
3. 配合物生成:金属离子与配体形成配合物,配体提供孤对电子与金属离子配位。
4. 磁性:铁、钴、镍为铁磁性材料,其磁性能受温度、磁场等因素影响。
三、实验内容1. 还原性实验(1)铁(II)的还原性:在酸性介质中,铁(II)具有还原性,可还原溴水中的溴离子。
实验结果显示,加入(NH4)2Fe(SO4)2溶液后,溶液颜色由黄色变为棕色,说明铁(II)具有还原性。
(2)钴(II)和镍(II)的还原性:在酸性介质中,钴(II)和镍(II)的还原性较弱,氯水不能将它们氧化。
实验结果显示,加入氯水后,溶液颜色无变化,说明钴(II)和镍(II)的还原性较弱。
2. 氧化性实验(1)三价铁的氧化性:在碱性介质中,三价铁具有氧化性,可将亚铁离子氧化为铁离子。
实验结果显示,加入氯水后,溶液颜色由浅绿色变为棕色,说明三价铁具有氧化性。
(2)三价钴和三价镍的氧化性:在碱性介质中,三价钴和三价镍具有氧化性,可被还原为二价离子。
实验结果显示,加入NaOH溶液后,溶液颜色由浅绿色变为蓝绿色,说明三价钴具有氧化性;加入氯水后,溶液颜色由蓝绿色变为棕色,说明三价钴具有氧化性。
3. 配合物生成实验(1)铁(II)配合物:在氨水存在下,铁(II)难以形成稳定的氨配合物。
实验结果显示,加入氨水后,溶液中出现白色沉淀,说明铁(II)难以形成稳定的氨配合物。
(2)钴(II)和镍(II)配合物:在氨水存在下,钴(II)和镍(II)可形成稳定的氨配合物。
实验结果显示,加入氨水后,溶液颜色由浅绿色变为深蓝色,说明钴(II)和镍(II)与氨形成了稳定的配合物。
实验二十四-第一过渡系元素(二)-铁钴镍

钴的配合物
(1)往盛有1mL CoCl2 溶液的试管中加入少量硫氰酸钾固体,观察 固体颜色。再加入0.5mL 戊醇于0.5mL 乙醚,观察水相与有机相 的颜色,该反应可鉴别Co2+。
Co2++4SCN-
[Co(NCS)4]2-(蓝色)
(2)往0.5mL CoCl2溶液中滴加浓氨水,至生成的沉淀刚好溶解为 止,静置一段时间后观察溶液颜色。
•
♦0.1 mol·L-1KI
•
♦0.1 mol·L-1KMnO4
•
♦NH4Cl
•
♦KSCN
•
♦(NH4)2Fe(SO4)2
四、实验步骤
♦(一) Fe(II)、Co(II) 、Ni(II)化合物的还原性
1 铁(Ⅱ)的还原性
酸性介质 往盛有0.5mL氯水的试管中加入3 滴6mol•L-1 H2SO4溶液,然后滴加
2Fe3++2I-=2Fe2++I2
♦(三) Fe Co Ni的配合物
• 铁的配合物
(1)往盛有1mL六氰合铁(Ⅱ)酸钾溶液的试管中 加入约0.5mL碘水,摇动试管后,滴入数滴硫 酸亚铁铵溶液,观察现象。此为Fe2+的鉴定反 应。
2[Fe(CN)6]3-+3Fe2+=Fe3[Fe(CN)6]2
(2)向盛有1mL新制(NH4)2Fe(SO4)2溶 液中加入碘水,摇动试管,将溶液分成 两份,各滴入数滴硫氰酸钾溶液,然后 向其中一支试管中加入约0.5mL 3% H2O2 溶液,观察现象。此为鉴定Fe3+的反应。
3 镍(Ⅱ)的还原性 用NiSO4溶液按2(1)(2)实验方法操作, 观察现象,第二份沉淀留作下面实验用。
无机化学实验二十五铁、钴、镍

无机化学实验二十五铁、钴、镍实验二十五铁、钴、镍[实验目的]1、试验并掌握二价铁、钴、镍的还原性和三价铁、钴、镍的氧化性;2、试验并掌握铁、钴、镍配合物的生成和Fe2+、Fe3+、Co2+、Ni2+离子的鉴定方法;3、了解金属铁腐蚀的基本原理及其防止腐蚀的方法。
[实验用品]仪器:试管、离心试管固体药品:硫酸亚铁铵、硫氰酸钾液体药品:H2SO4(1mo1·L-1,6mo1·L-1)、HCl(浓)、NaOH(6mo1·L-1、2mo1·L-1)、氨水(6 mo1·L-1,浓)、(NH4)2Fe(SO4)2(固体,·L-1)、CoC12·L-1)、NiSO4·L-1)、KI·L-1)、K4[Fe(CN)6]·L-1)、FeCl3·L-1)、KSCN·L-1)、H2O2(3%)、氯水、碘水、四氯化碳、戌醇、乙醚材料:碘化钾淀粉试纸[实验内容]一、铁(Ⅱ)、钴(Ⅱ)、镍(Ⅱ)的化合物·的还原性1.铁(Ⅱ)的还原性(1)酸性介质:往盛有5d氯水的试管中加入2d 6mo1·L-1硫酸溶液,然后滴加硫酸亚铁铵溶液1-2d,观察现象,写出反应式。
(如现象不明显,可加1滴KSCN溶液,出现红色,证明有Fe3+生成)(2)碱性介质:在一试管中放入2mL蒸馏水和3d 6mo1·L-1硫酸溶液,煮沸,以赶尽溶于其中的空气,然后溶入少量硫酸亚铁铵晶体(溶液表面若加3~4d油以隔绝空气,效果更好)。
在另一试管中加入1m1 6mo1·L-1氢氧化钠溶液,煮沸(为什么)。
冷却后,用一长d 管吸取氢氧化钠溶液,插入硫酸亚铁铵溶液(直至试管底部)内,慢慢放出氢氧化钠(整个操作都要避免空气带进溶液中,为什么)观察产物颜色和状态。
振荡后放置一段时间,观察又有何变化。
写出反应方程式。
无机化学实验第四版实验2铁钴镍

实验24铁钴镍一、实验目得1、试验并掌握铁、钴、镍氢氧化物得生成与氧化还原性质;2、试验并掌握铁、钴、镍配合物得生成及在离子鉴定中得作用。
二、实验内容(实验现象根据自己所观察到得为准)三、实验讨论(从自己实验操作展开) 四、实验思考题与习题1、实验步骤(2)要求整个实验不能带入空气到溶液中,为什么?F e(Ⅱ)易被氧化,如若带入了空气,可能不能观察到颜色得转化过程。
2.根据实验现象总结+2价得铁、钴、镍化合物得还原性与+3价得铁钴镍化合物氧化性得变化规律。
Fe (Ⅱ)、Co (Ⅱ)、Ni(Ⅱ)得氢氧化物都有还原性,其还原能力依Fe (Ⅱ)、Co (Ⅱ)、Ni (Ⅱ)得顺序减弱。
Fe(Ⅲ)、Co(Ⅲ)、Ni (Ⅲ)在酸性介质中得氧化能力依Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)得顺序增加。
3、比较钴镍氨配合物得氧化还原性相对大小及溶液稳定性。
钴盐与镍盐生成碱式盐溶于过量得氨水生成氨配合物,Co(Ⅱ)氨配合物易氧化转化成 Co (Ⅲ)氨配合物。
即镍盐更稳定。
4、为什么制取+3价得钴镍氢氧化物要用+2价为原料在碱性条件下进行氧化,而不+3价直接制取?首先,作为最高价氧化值,Co 3+、Ni 3+氧化性比较不稳定,易变成其它价态,故不用采用+3价直接氧化得到。
其次,而C o(OH)2、Ni(OH)2两性,在碱性条件下易被氧化成+3价氢氧化物。
53+3+2+ﻩ6.配合物极易被氧化,它们得氢氧化物也易被氧化;Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)具有强得氧化性,也易生成配合物。
7、(此题面字太多,不好打得,请谅解)A:(NH4)2Fe (SO4)2B:(NH4)2Fe(SO4)2溶液C:Fe(OH)2D:NH3E:I2F:Fe3+G:KFe[Fe(CN)6]H:BaSO4这些方程式都就是简单得,都可以轻易写出,在此我不一一写出了。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验24 铁钴镍、实验目的
1、试验并掌握铁、钻、镍氢氧化物的生成和氧化还原性质;
2、试验并掌握铁、钻、镍配合物的生成及在离子鉴定中的作用
二、实验内容(实验现象根据自己所观察到的为准)
2、Fe(m )、Co(m )、Ni(川)的氢氧化物的生成和性质
、实验讨论(从自己实验操作展开)
四、实验思考题和习题
1.实验步骤(2)要求整个实验不能带入空气到溶液中,为什么?
Fe (H )易被氧化,如若带入了空气,可能不能观察到颜色的转化过程。
2•根据实验现象总结+2价的铁、钻、镍化合物的还原性和+3价的铁钻镍化合物氧化性的变化规律。
Fe(H )、Co(H)、Ni( n )的氢氧化物都有还原性,其还原能力依Fe(U )、Co(H )、
Ni(n)的顺序减弱。
Fe(rn )、Co⑴)、Ni(川)在酸性介质中的氧化能力依Fe(川)、Co⑴)、Ni(川) 的顺序增加。
3. 比较钻镍氨配合物的氧化还原性相对大小及溶液稳定性。
钻盐和镍盐生成碱式盐溶于过量的氨水生成氨配合物,Co( n)氨配合物易氧
化转化成Co(川)氨配合物。
即镍盐更稳定。
4. 为什么制取+3价的钻镍氢氧化物要用+2价为原料在碱性条件下进行氧化,而不+3价直接制取?
首先,作为最高价氧化值,Co3+、Ni3+氧化性比较不稳定,易变成其它价态,故不用采用+3价直接氧化得到。
其次,而C O(OH)2、Ni(OH) 2两性,在碱性条件下易被氧化成+3价氢氧化物。
5. 如何分离混合液中的?Fe3+、Cr3+、Ni2+?
NaCrO2
6. 总结Fe (u 、川)、Co (n>m )、Ni ( n>m )主要化合物性质。
Fe(H )、Co(H )、Ni( n )具有强的还原性,都易形成配合物,且 Co 的配合物极 易被氧化,它们的氢氧化物也易被氧化; Fe ⑴)、Co(川)、Ni(川)具有强的氧化 性,也易生成配合物。
7. (此题面字太多,不好打得,请谅解) A : (NH4) 2Fe (SO 4)2 B : (NH4) 2Fe (SO 4)2溶液
C : Fe(OH )2
D : NH 3
E : I 2
F : Fe 3+
G
:
KFe[Fe(CN) 6] H : BaSO 4
这些方程式都是简单的,都可以轻易写出,在此我不一一写出了
[Ni (NH 3)6]2+
力口 Na OH -------------
-> Ni (OH) 2
Fe 3+、
Cr 3+、 Ni 2+
加入过量氨水
Fe(OH)3 Cr(OH) 3 J
* L
一」
力口 Na OH
厂
户,Fe(OH )3j
J _______________。
