国家药品监督管理局关于对诺氟沙星胶囊同品种质量考核不合格品进
国家市场监督管理总局通告2020年第11号——市场监管总局关于24批次食品不合格情况的通告

国家市场监督管理总局通告2020年第11号——市场监管总局关于24批次食品不合格情况的通告文章属性•【制定机关】国家市场监督管理总局•【公布日期】2020.05.21•【文号】国家市场监督管理总局通告2020年第11号•【施行日期】2020.05.21•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】食品安全正文国家市场监督管理总局通告2020年第11号市场监管总局关于24批次食品不合格情况的通告近期,市场监管总局组织食品安全监督抽检,抽取粮食加工品、食用农产品、食盐、乳制品、饮料、酒类、糕点、炒货食品及坚果制品、饼干、淀粉及淀粉制品、方便食品、薯类和膨化食品、蛋制品、蜂产品、肉制品、罐头、水果制品、蔬菜制品、调味品、保健食品、特殊膳食食品和食用油、油脂及其制品等22大类食品1256批次样品,检出其中粮食加工品、食用农产品、酒类、糕点、炒货食品及坚果制品、饼干、淀粉及淀粉制品、薯类和膨化食品、蜂产品、肉制品、水果制品、保健食品、特殊膳食食品和食用油、油脂及其制品等14大类食品24批次样品不合格。
发现的主要问题是,微生物污染,农兽药残留超标,重金属污染,食品添加剂超范围超限量使用,质量、营养指标不达标,质量、营养指标与标签标示值不符等问题。
产品抽检结果可查询https:///。
对抽检中发现的不合格食品,市场监管总局已责成北京、河北、山西、内蒙古、辽宁、黑龙江、上海、江苏、浙江、福建、江西、河南、湖南、广东、四川、云南、甘肃、青海、新疆等省级市场监管部门立即组织开展核查处置,查清产品流向,采取下架召回不合格产品等措施控制风险;对违法违规行为,依法从严处理;及时将企业采取的风险防控措施和核查处置情况向社会公开,并向总局报告。
现将监督抽检不合格食品具体情况通告如下:一、微生物污染问题苏宁易购盈棚食品专营店(经营者为四川省成都盈棚食品有限公司)在苏宁易购(网店)销售的、标称四川省成都城东王食品有限公司生产的红薯淀粉(淀粉),菌落总数不符合食品安全国家标准规定。
国家开放大学《医药商品营销实务》形考任务1-4参考答案

国家开放大学《医药商品营销实务》形考任务1-4参考答案形考任务1一、单项选择题(每题2分,共20分)1.医药行业最根本的宗旨是()。
A.救死扶伤B.防病治病C.为人民健康服务D.为社会创造经济效益2.医药服务质量中最突出的要求是()。
A.真诚守信B.遵纪守法C.急人所难D.服务热情3.根据《中华人民共和国药品管理法》的规定,药品广告的内容必须()。
A.符合企业要求B.通俗、易懂C.真实、合法D.合理、经济4.零售药店执业药师或者其他依法经资格认定的药学技术人员不在岗时可以销售的药品是()。
A.第二类精神药品B.处方药C.甲类非处方药D.乙类非处方药5.下列不属于假药的是()。
A.药品所含成分与国家药品标准规定不符B.药品成分的含量不符合国家药品标准C.以非药品冒充药品或者以他种药品冒充此种药品的D.变质的药品6.新版GSP规定企业法定代表人或者企业负责人应当具备()。
A.执业药师资格B.药师资格C.药品购销员资格D.医药商品储运员资格7.药品生产许可的合法性的标志是()。
A.药品批号B.药品批准文号C.生产许可证D.GMP证书8.减少空气中氧的含量的灭火方法属于()。
A.冷却灭火法B.室息灭火法C.隔离灭火法D.抑制灭火法9.在工作中欲了解化学药物制剂各制剂的基本要求和常规检查内容,需查阅的是()。
A.《中国药典》二部凡例B.《中国药典》二部正文C.《中国药典》四部正文D.《中国药典》四部通则10.关于药典的说法,错误的是()。
A.药典是记载国家药品标准的主要形式B.《中国药典》二部不收载化学药品的用法用量C.《美国药典》与《美国国家处方集》合并出版,英文缩写为USP-NFD.《日本药典》不收载生药、家庭药制剂。
二、填空题(每空2分,共30分)1.执业药师职业资格实行全国统一(大纲)、统一(命题)、统一组织考试的制度。
2.《执业药师职业资格制度规定》指出,国家设置执业药师(准入)类职业资格制度,纳入国家职业资格目录,并规定从事药品(生产)、(经营)、使用和其他需要提供药学服务的单位,应当按规定配备相应的执业药师。
2024年执业药师-药事管理与法规考试历年真题摘选附带答案

2024年执业药师-药事管理与法规考试历年真题摘选附带答案第1卷一.全考点押密题库(共100题)1.(单项选择题)(每题 1.00 分)关于建立健全覆盖城乡居民的基本医疗卫生制度的基本内容的说法错误的是A. 建立健全公共卫生服务体系B. 加快建设多层次医疗保障体系C. 完善以县级公立医院为主的医疗服务体系D. 建立健全以国家基本药物制度为基础的药品供应保障关系2.(不定项选择题)(每题 1.00 分)属于国务院根据宪法和法律所制定的规范性文件的是A. 《药品管理法》B. 《药品管理法实施条例》C. 《药品非临床研究质量管理规范》D. 《吉林省药品监督管理条例》3.(单项选择题)(每题 1.00 分) A.甲类非处方药\nB.处方药\nC.乙类非处方药\nD.第二类精神药品\n在店内不得陈列,并必须存放在专柜中的是A. 甲类非处方药B. 处方药C. 乙类非处方药D. 第二类精神药品4.(单项选择题)(每题 1.00 分) 负责建立国家基本药物制度,制定国家药物政策的是A. 卫生行政部门B. 公安部门C. 发展和改革委员会D. 工业和信息化管理部门5.(单项选择题)(每题 1.00 分) 对于存在安全隐患的药品,下列叙述错误的是()。
A. 药品生产企业决定召回后,应在规定时间内通知药品经营企业、使用单位停止销售和使用该药品B. 药品经营企业应当协助药品生产企业履行召回该药品的义务C. 药品使用单位应向卫生行政部门报告,等待停止使用该药品的通知D. 药品监督管理部门采取有效途径向社会公布该药品信息和召回情况6.(不定项选择题)(每题 1.00 分)依照《药品注册管理办法》药物治疗作用初步评价阶段是A. I 期临床试验B. Ⅱ期临床试验C. Ⅲ期临床试验D. Ⅳ期临床试验7.(单项选择题)(每题 0.50 分) 负责组织药品注册技术审评的机构是A. 中国食品药品检定研究院B. 国家药品监督管理部门中药品种保护审评委员会C. 国家药品监督管理部门药品审评中心D. 国家药品监督管理部门药品评价中心8.(单项选择题)(每题 0.50 分) 《进口药品注册证》的有效期为A. 3年B. 5年C. 不超过5年D. 7年9.(单项选择题)(每题 1.00 分)生产、销售的假药被使用后,造成三人以上器官组织损伤导致严重功能障碍,应当认定为A. 足以严重危害人体健康B. 对人体健康造成轻度危害C. 后果特别严重D. 其他特别严重情节10.(单项选择题)(每题 1.00 分) 给消费者、患者、医务人员提供正确、合适的药品或与药品有关的信息是A. 执业药师职业道德准则B. 执业药师执业行为规范C. 执业药师履行的职责D. 执业药师行使的权力11.(单项选择题)(每题 1.00 分)有关基本医疗保险用药,说法错误的是A. 口服泡腾剂不能纳入医疗保险用药范围B. 血液制品不能纳入医疗保险用药范围C. 基本医疗保险药品目录中的中药饮片属于基本医疗保险基金不予支付的药品D. 基本医疗保险药品目录中的中成药属于基本医疗保险基金准予支付的药品12.(单项选择题)(每题 0.50 分) .利用广告对药品做虚假宣传,情节严重的,构成A. 虚假广告罪B. 销售劣药罪C. 销售假药罪D. 生产假药罪E. 非法经营罪13.(单项选择题)(每题 1.00 分)根据以下材料,回答91-93题2015年4月,国家食品药品监督管理总局、国家公安部、国家卫生计生委员会联合发布《关于将含可待因复方口服液体制剂列入第二类精神药品管理的公告》,将含可待因复方口服液体制剂(包括口服溶液剂、糖浆剂)列入第二类精神药品管理,5月1日实行。
SMP-SC045-01 诺氟沙星胶囊

重庆格瑞林药业有限公司一目的:规范诺氟沙星胶囊生产工艺规程,保证所生产的产品符合质量要求。
二适用范围:诺氟沙星胶囊生产全过程。
三责任者:生产部、车间主任、工艺员、QA检查员、各工序操作人员对此实施负责。
四规程:1.品名1.1通用名:诺氟沙星胶囊1.2汉语拼音:Nuofushaxing jiaonang1.3英语:Norfioxacin Capsvles1.4性状:本品内容物为白色至淡黄色颗粒和粉末。
2.剂型:胶囊剂3.规格:0.1g4. 产品概述4.1[批准文号] 国药准字H500205264.2[主要成份] 本品主含诺氟沙星每粒0.1g4.3[药理作用] 本品为氟喹诺酮类抗菌药,具广谱抗菌作用,尤其对需氧革兰阳性杆菌活性高,对下列细菌在体外具良好抗菌作用:肠杆菌科的大部分细菌,包括枸橼酸杆菌属、阴沟肠杆菌、产气肠杆菌等肠杆菌属、大肠埃希菌、克雷伯菌属、变形菌属、沙门菌属、志贺菌属、弧菌属、耶尔森菌等。
诺氟沙星体外对多重耐药菌亦具抗菌活性。
对青霉素耐药的淋病奈瑟菌,流感血杆菌和卡他莫拉菌亦有良好抗菌作用,诺氟沙星为杀菌剂,通过作用于细菌DNA螺旋菌的A亚单位,抑制DNA的合成和复制而导致细菌死亡。
4.4[适应症] 适用于敏感菌所致的尿路感染、淋病、前列腺炎、肠道感染和伤寒及其他沙门菌感染4.5[用法用量] 口服1、大肠埃希菌、肺炎克雷伯菌及奇异变形菌所致的急性单纯性下尿路感染,一次400mg,一日2次(一次4粒,一日2次),疗程10—21日。
2、其他病原菌所致的单纯性尿路感染剂量同上,疗程7—10日。
3、复杂性尿路感染剂量同上,疗程10—21日。
4单纯性淋球菌性尿道炎单次800—1200mg(单次8—12粒)。
5急性及慢性前列腺炎一次400mg,一日2次(一次4粒,一日2次),;疗程28日。
6、肠道感染一次300—400mg,一日2次),;疗程5—7日。
7、伤寒沙门菌感染一日800—1200mg,分2—3次服用(一日8—12粒,分2—3次服用),疗程14—21日。
胶囊不合格
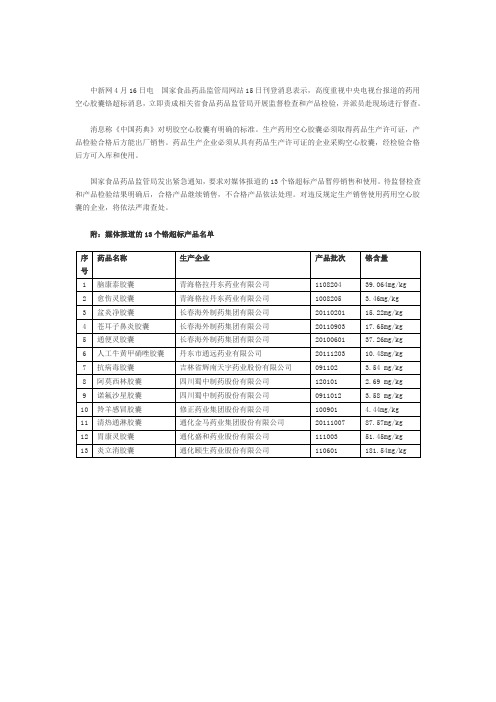
中新网4月16日电国家食品药品监管局网站15日刊登消息表示,高度重视中央电视台报道的药用空心胶囊铬超标消息,立即责成相关省食品药品监管局开展监督检查和产品检验,并派员赴现场进行督查。
消息称《中国药典》对明胶空心胶囊有明确的标准。
生产药用空心胶囊必须取得药品生产许可证,产品检验合格后方能出厂销售。
药品生产企业必须从具有药品生产许可证的企业采购空心胶囊,经检验合格后方可入库和使用。
国家食品药品监管局发出紧急通知,要求对媒体报道的13个铬超标产品暂停销售和使用。
待监督检查和产品检验结果明确后,合格产品继续销售,不合格产品依法处理。
对违反规定生产销售使用药用空心胶囊的企业,将依法严肃查处。
附:媒体报道的13个铬超标产品名单。
国家药品监督管理局关于空心胶囊有关问题的批复-
国家药品监督管理局关于空心胶囊有关问题的批复
正文:
---------------------------------------------------------------------------------------------------------------------------------------------------- 国家药品监督管理局关于空心胶囊有关问题的批复
(2001年1月2日)
四川省药品监督管理局:
你局“关于空心胶囊有关问题的请示”(川药管注[2000]52号)收悉。
经研究,现答复如下:
1、我局已明确按《仿制药品审批办法》有关规定对药用空心胶囊按药用辅料进行管理。
2、对原按药包材管理已批准生产的药用空心胶囊,其《药包材生产企业许可证》到期前6个月按《仿制药品审批办法》申报程序重新登记,核发批准文号。
3、对于新申请药用空心胶囊批准文号,按《仿制药品审批办法》审批程序由省级药品监督管理局初审合格后报我局审批。
4、药用空心胶囊生产企业按药品生产企业管理,凡开办药用空心胶囊生产企业,应由所在地省级药品监督管理局审批,核发《药品生产企业许可证》。
——结束——。
国家药品监督管理局关于公布抗生素类抗感染药等药品地方标准品种再评价结果的通知

国家药品监督管理局关于公布抗生素类抗感染药等药品地方标准品种再评价结果的通知文章属性•【制定机关】国家药品监督管理局•【公布日期】2001.06.01•【文号】•【施行日期】2001.06.01•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】标准化正文国家药品监督管理局关于公布抗生素类抗感染药等药品地方标准品种再评价结果的通知(2001年6月1日)各省、自治区、直辖市药品监督管理局,药检所:根据国家药品监督管理局关于药品地方标准品种再评价工作的要求,我局组织医药学专家对抗生素类抗感染药等药品地方标准品种进行了再评价;对已公布的拟停止使用品种的申诉意见进行了论证;对需补充资料后再议的品种进行了复审。
现将结果予以公布(见附件),并就有关事项通知如下:一、请迅速将本通知传达到辖区内相关品种生产企业,对本通知中拟停止使用品种如有申诉意见,务于2001年7月底前报我局安全监管司,对需补报资料的品种,请于2001年6月底前报国家药典委员会。
二、无论是申诉意见还是补报资料,均应经所在省(区、市)药品监督管理局审核后统一上报。
三、对本通知中拟停止使用品种无申诉意见的相关企业,也必须报所在省(区、市)药品监督管理局备案。
四、对公布结果有疑义的单位,请与我局安全监管司或国家药典委员会联系。
联系电话:(010)68313344-1039或(010)67152761特此通知。
附件:抗生素类抗感染药、抗肿瘤及调节免疫功能药、循环系统用药、激素及调节内分泌功能药、专科用药等药品地方标准品种再评价结果国家药品监督管理局二00一年六月一日附件:抗生素类抗感染药、抗肿瘤及调节免疫功能药、循环系统用药、激素及调节内分泌功能药、专科用药等类药品地方标准品种再评价结果通过品种抗生素类抗感染药注射用氨氯西林钠限用于金葡菌及其它敏感菌的感染阿莫西林颗粒剂(阿莫西林干糖浆、羟氨苄青霉素)阿莫西林口服混悬剂(羟氨苄青霉素)苯唑青霉素胶囊苯唑青霉素钠片(苯唑西林钠片)苯唑青霉素钠胶囊(苯唑西林钠胶囊,安迪灵)注射用肤脲苄青霉素钾(注射用肤苄青霉钾)说明书需注明钾离子对人体的影响硫酸卡那霉素片硫酸卡那霉素胶囊硫酸卡那霉素软膏单硫酸卡那霉素干糖浆(康纳)硫酸卡那霉素B阿米卡星滴眼液(丁胺卡那霉素滴眼液)溃疡药膜(口腔溃疡药膜)胍哌甲基四环素胍哌甲基四环素胶囊取消抗流感病毒的适应症四环素泼尼松眼膏的确当滴眼液新地松眼膏盐酸土霉素软膏盐酸土霉素胶囊盐酸脱氧土霉素干糖浆(多西环素干糖浆,强力霉素干糖浆)红霉素肠溶微丸胶囊红霉素肠溶胶囊(红霉素胶囊)注射用盐酸柔红霉素(注射用盐酸正定霉素)注射用盐酸阿霉素(注射用盐酸多柔米星)麦迪霉素胶囊硫酸庆大霉素片(肠溶)硫酸庆大霉素胶囊注射用硫酸庆大霉素酒石酸柱晶白霉素(酒石酸吉他霉素)注射用柱晶白霉素(注射用酒石酸柱晶霉素)灰黄霉素胶囊复方灰黄霉素癣药水硫酸核糖霉素注射液盐酸林可霉素滴眼液(盐酸洁霉素滴眼液)盐酸林可霉素滴耳液注射用盐酸林可霉素盐酸林可霉素软膏磷霉素钙干糖浆适应用于肠道感染多西环素胶丸(强力霉素胶丸)复方克林霉素搽剂多粘菌素E注射用硫酸多粘菌素B氯霉素耳丸(滴丸)复方制霉素栓(妇科制霉栓)制霉素栓(制霉菌素栓)制霉菌素泡腾阴道片(米可定泡腾阴道片)利福平眼膏(甲哌利福霉素眼膏)利福霉素钠(力复霉素SV钠)限用于抗结核菌利福霉素钠注射液(力复霉素SV钠注射液)限用于抗结核菌复合利福平软胶囊(复合甲哌力复霉素软胶囊)利福定(异甲哌利福霉素)利福定片(异丁基哌嗪利福霉素片)利福定胶囊(异丁基哌嗪利福霉素胶囊)交沙霉素胶囊妥布拉霉素注射液头孢硫脒注射用头孢硫脒克念菌素克念菌素片克念菌素阴道片新福菌素(更新霉素)新福菌素注射液(更新霉素注射液)抗肿瘤及调节免疫功能类氟尿嘧啶乳复方氟脲嘧啶脂质体注射液复方氟脲嘧啶多相脂质体口服液(康宁口服液)复方氟脲嘧啶乳复方替加氟胶囊替加氟胶囊(喃氟啶)替加氟栓(呋喃氟脲嘧啶栓)优福定片羟基脲胶囊喜树碱羟基喜树碱羟基喜树碱注射液注射用羟基喜树碱去甲斑蟊素去甲斑蟊素片去甲斑蟊酸钠注射液(依尔康注射液)斑蟊酸钠斑蟊酸钠片(奇宁片)斑蟊酸钠注射液(奇宁注射液)艾康注射液甲基斑蟊胺甲基斑蟊胺片氮烯咪胺注射用氮烯咪胺适用于黑色素瘤等少见肿瘤靛玉红靛玉红片小檗胺小檗胺片盐酸小檗胺盐酸小檗胺片依托泊甙(足叶乙甙)足叶乙甙注射液三尖杉酯碱三尖杉酯碱注射液六甲密胺肠溶片复方环磷酰胺片谷固醇膜谷固醇软膏限用于慢性皮肤溃疡的辅助治疗薄芝注射液顺铂注射液苦参素苦参素注射液(博尔利康注射液)迈清注射液茜草双酯茜草双酯片循环系统用药甲基橙皮甙橙皮甙地拉卓地拉卓片地拉卓胶囊没食子酸丙酯(通脉酯)适用于预防脑血栓等血栓性疾病的辅助治疗注射用通脉酯(注射用赤芍801)脑复清胶囊脑力隆胶囊脑心通胶囊降压嗪(二氮嗪)降压嗪注射液(二氮嗪注射液)北京降压平片(北京降压0号)人参茎叶总皂甙人参活力胶囊限定适应症为辅助治疗硝酸乙氧烟酸胺(硝烟酯、烟浪丁、尼可地尔)尼可地尔片(硝烟酯片、烟浪丁片)卡托普利胶囊降压灵片塞易通(阿斯达美片,复方双嘧达莫片)柳胺苄心定柳胺苄心定片(盐酸拉贝洛尔片)柳胺苄心定注射液盐酸麻黄苯丙酮(安心酮)盐酸麻黄苯丙酮片(安心酮片)吗导敏吗导敏片(脉导敏片)吗导敏气雾剂羟乙基芦丁(维脑路通、曲克芦丁)羟乙基芦丁片(维脑路通片、曲克芦丁片)羟乙基芦丁口服液(维脑路通口服液、曲克芦丁口服液)羟乙基芦丁胶囊(维脑路通胶囊、曲克芦丁胶囊)羟乙基芦丁氯化钠注射液(奇奥脉通注射液)羟乙基芦丁注射液(维脑路通注射液、曲克芦丁注射液)灯盏花素(脑栓通)月见草油月见草油胶丸心脑三效胶丸阿魏酸哌嗪阿魏酸哌嗪片(保肾康)阿魏酸钠阿魏酸钠片注射用阿魏酸钠盐酸川芎嗪磷酸川芎嗪磷酸川芎嗪片磷酸川芎嗪胶囊磷酸川芎嗪注射液(脑血通注射液)氢溴酸樟柳碱注射液氢溴酸樟柳碱片盐酸苄丙酚胺(脑清)盐酸苄丙酚胺片(脑清片)亚油酸亚油酸胶囊亚油酸丸亚油酸乙酯亚油酸乙酯胶囊(脉通胶囊)亚油酸乙酯胶丸(脉通)烟酸羟丙茶碱(脑脉康)烟酸羟丙茶碱片(脑脉康片)脑脉宁脑脉宁片(托哌酮片)脑脉宁胶囊(托哌酮胶囊)硝酸戊四醇酯片脉舒静片复方催降压片复方降压素胶囊安降片复方罗布麻片三甲氧卞嗪片曲匹地尔片甘露醇烟酸酯甘露醇烟酸酯片复方氨苯喋啶片(双克安片)治疗水肿及腹水的剂量为一次1~2片新捷络软胶囊环轮宁说明书应特别注明安全问题环轮宁注射液说明书应特别注明安全问题杏丁注射液限用于缺血性心脑血管病碟脉灵注射液冠脉苏片(微调1号片)盐酸培他定注射液盐酸培他司汀氯化钠注射液(盐酸培他定氯化钠注射液,美培啶)天麻素天麻素片天麻素胶囊天麻素注射液可乐定贴片盐酸可乐定滴丸激素及调节内分泌功能类三合激素注射液双炔失碳酯双炔失碳酯片(53-探亲抗孕片)炔诺孕酮片避孕反应抑制片地塞米松片通泰精粉(糖脂泰精粉)通泰胶囊(糖脂泰胶囊)适用于便秘和糖尿病、高血脂症的辅助治疗氢化泼尼松注射液催奶片妇复春胶囊木糖醇片木糖醇颗粒专科用药、辅料辣椒痛可贴愈创膏(创伤帖)卡普欣乳膏青光明(催醒安)青光明滴眼液(益明眼药水,催醒安)法可林(治障宁,消白灵,白可明,睛可明,障眼净,四氮戊省磺酸钠)光安眼药限用于角膜溃疡复方盐酸萘甲唑琳眼药水(消疲灵、通明)复方托品酰胺滴眼剂盐酸吗啉胍滴眼液(盐酸吗啉双胍眼药水)复方疱疹性眼膏复方醋酸曲安奈德滴耳液(复方醋酸去炎松滴耳液)盐酸麻黄素滴鼻液呋麻滴鼻液鼻通药膏(鼻灵药膏,鼻通油膏)统一到非抗生素类的鼻通软膏处方富马酸酮替芬气雾剂(酮替芬气雾剂)氯化钙葡萄糖注射液复方电解质葡萄糖R2A注射液氨丁三醇注射液(缓血酸胺注射液、氨基丁三醇注射液)防暑颗粒高渗枸橼酸盐嘌呤液(离体肾保存液)人工肾透析液AD-1人工肾透析液BD-1氯磷定氯磷定注射液解磷注射液二巯基丙磺酸钠注射液依地酸二钠依地酸钙钠片(依地钙片)氧化淀粉玉米朊氢氧化镁氯化镁醋酸钠十二烷基硫酸镁聚糖酐粉(清创愈伤散)3-7-二甲基嘌呤-2-6(3H,1H)-二酮(柯柯豆碱)樟脑酚液氟化钠甘油氢氧化钙糊剂利凡诺溶液复方硼砂溶液新洁尔灭酊甲醛甲酚溶液(牙用煤酚醛液,牙用甲酚醛液)牙用碘液牙痛水寒痛乐热敷袋吉娜舒润剂钡餐乐混悬剂(硫酸钡混悬剂,钡胶浆)硫酸钡混悬液靛胭脂注射液注射用碳酸酰胺过氧化氢(注射用内给氧)复方释氧剂复方产氧剂(氧福康产氧器)复方供氧剂氧利舒帕特药盒麻醉药类阿片片氟哌定注射液盐酸丁氧普鲁卡因盐酸丁氧普鲁卡因滴眼剂盐酸丁氧普鲁卡因胶浆剂注射用盐酸氯胺酮钠石灰(碱石灰)润滑止痛胶(丁卡因)盐酸利多卡因凝胶其它类(是指已公布过的各类药品中未包括的品种和经论证或复审通过的品种)非抗生素类抗感染药复方酮康唑软膏诺氟沙星片(氟哌酸片)苦参碱苦参碱注射液苦参碱栓(妇炎栓)鞣酸苦参碱胶囊小儿鞣酸苦参碱片磺胺嘧啶碳酸氢钠片(复方磺胺嘧啶片)应按实际体重计算用量小儿增效联磺颗粒剂(散)*说明书需注明年龄限制和不良反应复方润喉片熊胆润喉片黑癣油*去掉苯酚和硝酸新脚气药水(癣敌)*减少二甲基桠枫的含量或用乙醇替换女宝栓*去掉雄黄和樟丹解热镇痛类盐酸金刚烷胺糖浆盐酸金刚烷胺颗粒汉防己甲素感冒康胶囊重感片感炎清胶囊阿苯糖丸*(小儿退热糖丸)须按公斤体重计算用量安热静注射液*应注明不良反应,儿童慎用肺宝三效片*去苯妥英钠和扑热息痛,限适应症,注明不良反应和疗程。
国家食品药品监督管理局公告2011年第36号――国家药品质量公告(2011

国家食品药品监督管理局公告2011年第36号――国家药品质量公告(2011年第1期,总第85号)【法规类别】药品管理【发文字号】国家食品药品监督管理局公告2011年第36号【发布部门】国家食品药品监督管理局(原国家药品监督管理局)(已撤销)【发布日期】2011.04.28【实施日期】2011.04.28【时效性】现行有效【效力级别】部门规范性文件国家食品药品监督管理局公告(2011年第36号)国家药品质量公告(2011年第1期,总第85号)为加强药品监管,保障公众用药安全,根据全国药品抽验工作计划,国家食品药品监督管理局在全国范围内组织对醋酸泼尼松片等18个国家基本药物品种,以及苦碟子注射液等5个其他制剂品种进行了质量抽验,并对流通流域抽验不符合标准规定的32个基本药物品种在其生产企业进行了跟踪抽验。
结果显示,本次抽验的55个品种4035批次产品中,有4016批次产品符合标准规定,19批次产品不符合标准规定,被抽验产品总体质量良好。
现将抽验结果公告如下:一、国家基本药物品种抽验结果本次共抽验醋酸泼尼松片、硫酸链霉素注射剂、盐酸美西律片、通心络胶囊、复方氢氧化铝片、盐酸布比卡因注射液、盐酸维拉帕米制剂、藿胆丸(片)、联苯双酯制剂、消炎利胆制剂、多潘立酮口服常释制剂、盐酸多巴胺注射液、利多卡因注射液、普鲁卡因注射液、注射用哌拉西林钠、复方泛影葡胺注射液、诺氟沙星口服常释制剂、逍遥丸(颗粒)18个国家基本药物品种3383批次,其中3376批次产品符合标准规定,7批次产品不符合标准规定。
具体抽验结果如下:(一)醋酸泼尼松片本次抽样245批次,涉及40家生产企业,经河北省药品检验所检验,全部符合标准规定。
(二)硫酸链霉素注射剂本次抽样158批次,涉及7家生产企业,经河北省药品检验所检验,全部符合标准规定。
(三)盐酸美西律片本次抽样177批次,涉及6家生产企业,经河北省药品检验所检验,全部符合标准规定。
(四)通心络胶囊本次抽样31批次,涉及1家生产企业,经河北省药品检验所检验,全部符合标准规定。
诺氟沙星胶囊风险监测质量分析报告

诺氟沙星胶囊风险监测质量分析报告为加强药品质量监督管理,客观评价和提高诺氟沙星胶囊的质量,开展本次诺氟沙星胶囊风险监测评价抽验工作。
按照《中国药典》2015年版第二部进行全项目检测,并与USP40进行比较,通过对溶出度、有关物质、水分、胶囊铬进行探索性研究考察诺氟沙星胶囊总体质量。
结论:诺氟沙星胶囊药品质量总体评价良好。
标签:风险监测;工艺稳定性;探索性研究诺氟沙星是日本杏林公司Koga.H 1978年开发的第三代喹诺酮类抗感染药物,具有抗菌谱广、作用强的特点,尤其对需氧革兰阴性杆菌的抗菌活性高,1979年将专利准予默克公司,商品名Noroxin。
1984年在日本首次上市,我国于1985年由太原制药厂小试成功,1986年投产。
《中国药典》1990年版开始收载诺氟沙星的原料药、胶囊剂,1995年版起又增加了滴眼剂和软膏剂,其主要剂型为胶囊剂、片剂和注射剂。
1 诺氟沙星胶囊生产情况根据国家食品药品监督管理局网站数据库检索,国内有692家药品生产企业有诺氟沙星胶囊批准文号,此次风险排查抽验共收到诺氟沙星胶囊47批,涉及批准文号22个,占全部批准文号数的3.2%。
2 检验标准情况《中国药典》2015年版检验项目包括:性状,鉴别,检查(有关物质),检查(溶出度),检查(装量差异),含量测定。
国外药典USP40及EP9.0收载了诺氟沙星原料药及片剂,未收载胶囊剂,而《中国药典》收载剂型有胶囊剂、片剂、滴眼剂、软(乳)膏剂和注射剂等。
诺氟沙星检验标准主要区别为:鉴别项目ChP2015年版采用薄层色谱与液相色谱二选一,USP40采用红外光谱和液相色谱,有关物质项目ChP2015年版对杂质A及总杂质进行限制,USP40则对杂质K、A、H、E、其他杂质、总杂质分别进行限制。
3 依据标准检验结果与分析47批诺氟沙星胶囊按照法定标准进行检验性状、鉴别、检查(有关物质)、检查(溶出度)、检查(重量差异)、含量测定,结果均符合规定,合格率为100%。
诺氟沙星胶囊微生物限度检查法验证报告1

山西太原药业有限公司诺氟沙星胶囊微生物限度检查法验证报告文件编码:TY-GSB-YZ(02)-013-04二零一六年一月验证立项申请表目录1 验证目的 (1)2范围 (1)3责任 (1)4内容 (1)5验证方法 (1)5.1供试品 (1)5.1.1菌种名称及来源 (2)5.1.2培养基与试剂名称、批号及来源 (2)5.1.3仪器与设备 (2)5.2菌液的制备 (3)5.3菌液计数 (4)5.4计数培养基的适用性检查 (4)5.5供试液制备 (5)5.6需氧菌、霉菌和酵母菌计数方法验证 (6)5.7控制菌检查方法验证 (7)6试验结论 (8)7偏差 (9)7.1偏差报告 (9)8验证评价及建议 (9)9验证报告: (10)10验证证书 (10)1 验证目的根据《中国药典》2015年版四部通则微生物限度检查法要求,为保证检验质量,确保检验结果的准确性和可靠性,对诺氟沙星的微生物限度检查法进行方法学验证。
2范围本验证方法适用于供试品的微生物限度检查法方法验证。
3责任4内容验证方法需进行3个不同批次的产品验证并且结果都符合规定时,该方法才可以用于日后日常检验。
5验证方法根据《中国药典》2015版四部通则微生物限度检查法5.1供试品诺氟沙星胶囊规格: 10ml批号160101 160102 160103 5.1.1菌种名称及来源枯草芽孢杆菌〔CMCC(B)63501〕、金黄色葡萄球菌〔CMCC(B)26003〕大肠埃希菌〔CMCC(B)44102〕、白色念珠菌〔CMCC(F)98001〕黑曲霉〔CMCC(F)98003〕铜绿假单胞菌〔CMCC(B)10104〕以上菌种均由中国药品生物制品检定所提供。
5.1.2培养基与试剂名称、批号及来源胰酪大豆胨琼脂培养基151109 胰酪大豆胨液体培养基151112 沙氏葡萄糖琼脂培养基151117 PH7.0氯化钠蛋白胨缓冲液150313 以上培养基均由北京三药科技开发公司提供。
国家食品药品监督管理局关于加强胶囊剂药品及相关产品质量管理工作的通知-国食药监电[2012]18号
![国家食品药品监督管理局关于加强胶囊剂药品及相关产品质量管理工作的通知-国食药监电[2012]18号](https://img.taocdn.com/s3/m/2e780c18b42acfc789eb172ded630b1c59ee9b89.png)
国家食品药品监督管理局关于加强胶囊剂药品及相关产品质量管理工作的通知正文:---------------------------------------------------------------------------------------------------------------------------------------------------- 国家食品药品监督管理局关于加强胶囊剂药品及相关产品质量管理工作的通知(国食药监电[2012]18号)各省、自治区、直辖市食品药品监督管理局(药品监督管理局):近期铬超标药用胶囊问题反映出部分药品生产企业质量管理薄弱,尤其体现在原辅料及成品检验方面,一些企业不能按照有关规定进行逐批全项检验,导致不合格原辅料投入使用,不合格产品流入市场,危害公众利益。
为确保药品、保健食品质量安全,切实加强药用明胶、药用胶囊、胶囊剂药品和保健食品生产企业的质量管理和检验工作,现就有关事项通知如下:一、健全生产企业质量管理体系有关要求药用明胶、药用胶囊、胶囊剂药品和保健食品生产企业应当健全企业质量管理体系,确保质量管理部门有效履行质量保证和质量控制职责。
企业负责人及其他部门的人员不得干扰或妨碍质量管理部门履行职责。
物料供应商的确定及变更应当进行质量评估或审计,并经企业质量管理部门批准。
药用明胶、药用胶囊和胶囊剂药品每批产品出厂销售前要进行全项检验并应符合国家有关标准。
胶囊剂保健食品每批产品出厂销售前要按照产品质量安全要求进行检验并应符合国家有关标准。
产品放行前,所有生产文件和记录,包括检验数据均应经质量管理部门审查并符合要求。
不合格产品不得放行出厂。
二、加强药用明胶生产质量管理和检验有关要求药用明胶生产企业应当制定生产所用物料购入、储存、使用等管理制度;应当制定原料(皮、骨、腱)质量标准,并向省级食品药品监管部门备案。
企业应按质量标准对原料进行检验,以确保原料满足药用明胶生产的质量要求。
诺氟沙星胶囊微生物限度检查方法的验证

取供试品10 g,加pH 7.0无菌氯化钠-蛋白胨缓冲 液至100 mL,置于45 ℃水浴溶解,作为1∶10供试液; 取1∶10供试液,500 r/min离心5 min,取上清备用。 2. 3 常规法的方法验证
取供试品上清10 mL加0.1 %无菌蛋白胨水溶液至 100 mL,全量通过一次性薄膜过滤器,用pH 7.0氯化 钠-蛋白胨缓冲液冲洗滤膜2次(100 mL/次),将滤膜 和大肠埃希菌液1 mL加入5 mL MnSO4和100 mL胆盐乳 糖增菌液(1∶20),36 ℃培养箱培养18~24 h,结果 见表4。 3 结果
收稿日期:2010-03-08 作者简介:薛琦(1982-),女,药师,从事药品检验 E-mail: gaozhixueqi@
438
食品与药品 Food and Drug 2010年第 12卷第11期
取1∶10供试液1 mL和大肠埃希菌液1 mL注入平 皿(1 mL/皿),立即倾注玫瑰红钠琼脂培养基,平行 制备2个平皿;枯草芽孢杆菌、金黄色葡萄球菌、黑曲 霉、白色念珠菌亦依上法操作。置入36 ℃培养箱培养 18~24 h 。结果见表2。 2. 4 薄膜过滤法的方法验证
XMTB型水浴(北京长风);LD4-2A型台式离 心机(北京医用离心机厂);HTY-2000A型智能集菌 仪(杭州泰林);FC50型一次性薄膜过滤器(杭州泰 林);GMP-9160E隔水式恒温培养箱(上海新诺)。 1. 2 供试品
诺氟沙星胶囊系石药集团欧意药业公司、哈药集 团制药总厂、雅来(佛山)制药公司和河南天方药业 公司生产。 1. 3 培养基和试剂
2023年执业药师之药事管理与法规精选试题及答案一

2023年执业药师之药事管理与法规精选试题及答案一单选题(共30题)1、《云南省药品管理条例》属于A.法律B.部门规章C.地方性法规D.行政法规【答案】 C2、某药店经营的“×××皮炎平”为非处方药、外用药品、复方制剂(含有利尿剂醋酸地塞米松)。
其说明书内容摘录如下:①患处已破溃、化脓或有明显渗出者禁用;②小儿避免使用;③本品性状发生改变时禁止使用;④儿童必须在成人监护下使用;⑤长期大量使用可继发细菌、真菌感染。
A.【药理毒理】B.【禁忌】C.【适应症】D.【注意事项】【答案】 B3、(2018年真题)血液制品在毎批上市销售前应当由药品检验机构检验,该检验属于()A.抽查检验B.注册检验C.复验D.指定检验【答案】 D4、药品批准文号为国药准字S2*******的药品属于()。
A.化学药品B.中药C.生物制品D.境外生产药品【答案】 C5、审批核发药品批准文号的部门是A.国家药品监督管理部门B.国家卫生行政部门C.国家科技管理部门D.省级药品监督管理部门【答案】 A6、物料应按规定的使用期限储存,无规定使用期限的,其储存一般不超过A.1年B.2年C.3年D.4年【答案】 C7、某片剂的有效期为2年,生产日期若为2011年11月,有效期可标注为A.有效期至2013年11月01日B.有效期至2013年10月C.有效期至2013年11月30日D.有效期至2015年10月30日【答案】 B8、组织制定和修订药用辅料的技术要求与质量标准的机构是A.中国食品药品检定研究院B.国家药典委员会C.国家药品监督管理部门D.CFDA药品评价中心【答案】 B9、一、刘某2014年药学专业硕士研究生毕业后,应聘到A省B药品生产企业,从事药品质量管理工作。
A.取得《执业药师资格证书》B.取得药师以上专业技术职称C.身体健康,能坚持在执业药师岗位工作D.经执业单位同意【答案】 B10、药品经营许可证核发、换发、变更、补发、吊销、撤销、注销等信息办理情况在信息系统更新的行政程序为A.药品监督管理部门应当在办理工作完成后10个工作日内在信息系统中更新,并予以公开B.药品监督管理部门应当在办理工作完成前10个工作日内在信息系统中更新,并予以公开C.药品监督管理部门应当在办理工作完成时在信息系统中更新,并予以公开D.药品监督管理部门信息系统更新与社会公开选择其一即可【答案】 A11、药品生产企业在作出药品召回决定后,通知有关药品经营企业和使用单位停止销售和使用的时限,一级召回应在A.12小时内B.24小时内C.48小时内D.72小时内【答案】 B12、根据《中医药法》,关于医疗机构中药饮片管理的说法,正确的是()A.根据临床需要,可以凭本医疗机构医师处方采用中药材代替中药饮片调剂使用B.对市场供应不足的中药饮片,可以在本医疗机构内炮制使用C.医疗机构对其炮制的中药饮片质量负责D.炮制中药饮片,应当向所在地县级药品监督管理部门备案【答案】 C13、某药厂生产的诺氟沙星胶囊所用原料被污染该诺氟沙星胶囊应( )A.按假药论处B.认定为劣药C.按劣药论处D.认定为假药【答案】 A14、关于药品质量公告的说法,错误的是A.药品质量公告主要是药品质量抽查检验结果的通告B.药品质量公告可以指导药品监督管理部门查处不合格药品,对不合格药品起到控制作用C.药品质量公告可以使社会公众了解药品质量状况,引起公众对药品质量的关注和重视D.药品质量公告只能由国家药品监督管理部门统一发布【答案】 D15、纳入麻醉药品销售渠道经营,零售药店不得销售的是A.复方甘草片B.尿通卡克乃其片C.含麻黄碱类复方制剂D.药品类易制毒化学品单方制剂【答案】 D16、甲省乙市丙县的A药品生产企业未经审查批准在丙县电视台发布虚假广告,有关机关按照行政程序对其进行处罚,如果A要申请药品广告批准文号,其广告审查机关是A.甲省药品监督管理部门B.甲省工商行政管理部门C.丙县药品监督管理部门D.乙市工商行政管理部门【答案】 A17、根据《医疗机构制剂配制质量管理规范(试行)》,制剂配发记录内容可不包括A.领用部门B.批号C.制剂名称D.配制日期【答案】 D18、根据《中华人民共和国反不正当竞争法》,下列不正当竞争行为的定性,属于侵犯商业秘密行为的是A.具有独占地位的经营者,指定他人购买本企业的商品B.政府及其所属部门不准外地商品进入本市场C.在药品招标中,投标者互相串通,故意抬高标价D.个体经营者以利诱的方式,获取权利人的商业秘密【答案】 D19、执业药师应当尽心、尽职、尽责为患者及公众提供药品和药学服务,体现了A.救死扶伤,不辱使命B.尊重患者,平等相待C.依法执业,质量第一D.进德修业,珍视声誉【答案】 A20、作出责令召回决定的是A.药品生产企业B.药品经营企业C.医疗机构D.药品监督管理部门【答案】 D21、根据《药品流通监督管理办法》,下列药品生产、经营企业的行为,符合规定的是A.采用互联网交易方式直接向公众销售处方药B.为他人以本企业的名义经营药品提供场所C.为他人以本企业的名义经营药品提供本企业的票据D.在药品展示会或博览会上签订药品购销合同【答案】 D22、关于行政机关施行行政许可不正确的是A.有向申请人提供格式文本的义务B.有公示行政许可事项和条件的义务C.对公示内容进行解释的义务D.允许申请人办理许可证的义务【答案】 D23、企业法定代表人、负责人以及质量负责人的变更属于A.登记事项变更B.许可事项变更C.重新办理《药品经营许可证》D.必须出具上级法人签署意见的变更申请书【答案】 B24、下列各项中,不符合《医疗机构药品监督管理办法(试行)》的规定的是()。
国家市场监督管理总局通告2019年第30号——市场监管总局关于19批次食品不合格情况的通告

国家市场监督管理总局通告2019年第30号——市场监管总局关于19批次食品不合格情况的通告文章属性•【制定机关】国家市场监督管理总局•【公布日期】2019.08.22•【文号】国家市场监督管理总局通告2019年第30号•【施行日期】2019.08.22•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】食品安全正文国家市场监督管理总局通告2019年第30号市场监管总局关于19批次食品不合格情况的通告近期,市场监管总局组织的食品安全监督抽检(产品抽检结果可查询/)中,发现蜂产品、食用农产品、保健食品、肉制品、食用油和油脂及其制品、婴幼儿配方食品、特殊膳食食品7大类食品19批次样品不合格,检出农兽药残留、微生物污染、重金属污染、食品添加剂超限量使用、质量指标不达标、营养成分不符合产品包装标签明示值等问题。
现将具体情况通告如下:一、农兽药残留问题(一)陕西华润万家生活超市有限公司南大街分公司销售的、标称陕西老蜂农生物科技有限责任公司生产的蜂蜜,诺氟沙星不符合食品安全国家标准规定。
检验机构为湖南省产商品质量监督检验研究院。
(二)吉林省长春市宽城区水产农贸大市场家辉蛋类批发部销售的鸡蛋,恩诺沙星(以恩诺沙星与环丙沙星之和计)不符合食品安全国家标准规定。
检验机构为中国检验检疫科学研究院综合检测中心。
(三)内蒙古自治区通辽市科尔沁区永安路大家购生鲜超市销售的鸡蛋,恩诺沙星(以恩诺沙星与环丙沙星之和计)不符合食品安全国家标准规定。
检验机构为北京市产品质量监督检验院。
(四)甘肃省兰州市榆中雄昌牛羊肉经销店销售的乌鸡,恩诺沙星(以恩诺沙星与环丙沙星之和计)不符合食品安全国家标准规定。
检验机构为重庆市食品药品检验检测研究院。
(五)甘肃省兰州市榆中晓霞肉鸡经营部销售的乌骨鸡,恩诺沙星(以恩诺沙星与环丙沙星之和计)不符合食品安全国家标准规定。
检验机构为重庆市食品药品检验检测研究院。
(六)甘肃省兰州华联综合超市有限公司城关分公司销售的、来自甘肃省兰州市北方渔夫有限公司的活江鲈鱼(L),恩诺沙星(以恩诺沙星与环丙沙星之和计)和磺胺类(总量)不符合食品安全国家标准规定。
诺氟沙星胶囊等三个品种仿制药一致性评价可行性分析报告

诺氟沙星胶囊等三个品种仿制药一致性评价可行性分析报告作者:万攀攀来源:《科技风》2019年第03期摘要:分析开展一致性评价工作的可行性及通过一致性评价的品种能否给企业带来市场竞争力。
关键词:时限;竞争;销售预测1 项目概述(1)目的:促进我国仿制药整体水平提升,为保证药物的安全性和有效性,促进医药产业升级和结构调整,增强国际竞争力。
(2)背景分析:自2012年国务院药品安全“十二五”规划,启动仿制药一致性评价工作。
2016年2月6日,国办发【2016】8号提出,化学仿制药自首家品种通过一致性评价后,其他药品生产企业的相同品种原则上应在3年内完成一致性评价;逾期未完成的,不予再注册。
2017年8月,总局《关于仿制药质量和疗效一致性评价工作有关事项的公告》,公告规定同品种药品通过一致性评价的企业达到 3 家以上的,在药品集中采购等方面不再选用未通过一致性评价的品种。
(3)项目目标:我公司准备开展一致性评价工作,前期经过调研、考察预计对诺氟沙星胶囊、维生素B2片、维生素B6片进行一致性评价工作。
2 三個品种基本情况介绍(1)诺氟沙星胶囊:诺氟沙星属氟喹诺酮酸类药物,对多种革兰阳性菌和革兰阴性菌均有强大的抗菌作用;国内同品种同规格(0.1g)690个。
(2)维生素B2片:维生素B2为体内黄酶类辅基的组成部分,缺乏会影响机体的生物氧化,使代谢发生障碍;国内同品种同规格(5mg)360个。
(3)维生素B6片:维生素B6为人体内某些辅酶的组成成分,参与多种代谢反应,尤其是和氨基酸代谢有密切关系,与体内辅酶代谢密切相关;国内同品种同规格(10mg)479个。
3 三个品种一致性评价进度通过药智网一致性评价进度数据库查询情况如下:(1)诺氟沙星胶囊开展一致性评价企业数:114家;参比备案:54家;开展BE:3家;试验状态:招募完成2家。
完成BE:0家。
(2)维生素B2片开展一致性评价企业数:46家;申报:0家。
可豁免BE,不推荐参比制剂,需满足药学研究和评价要求。
SOP-QC 诺氟沙星检验操作规程

诺氟沙星检验操作规程1. 目的建立诺氟沙星检验标准操作规程,使诺氟沙星检验操作规范化。
2. 范围适用于诺氟沙星的质量检验。
3. 术语或定义N/A4. 职责质量控制部对本规程的实施负责。
5. 程序5.1 检验依据5.1.1 《中国药典》2020年版二部(第1431页)。
5.1.2 诺氟沙星质量标准(质量标准编号:)。
5.1.3 《中国药典》2020年版四部。
5.2 性状本品为类白色至淡黄色结晶性粉末;无臭;有引湿性。
本品在N,N-二甲基甲酰胺中略溶,在水或乙醇中极微溶解;在醋酸、盐酸或氢氧化钠溶液中易溶。
5.3 熔点仪器与器具:熔点测定仪、毛细管。
取干燥失重项下的本品适量,置熔点测定用毛细管中,轻击管壁或借助长短适宜的洁净玻璃管,垂直放在表面皿或其他适宜的硬质物体上,将毛细管自上口放入使自由落下,反复数次,使粉末紧密集结在毛细管的熔封端。
装入供试品的高度约为3mm。
依熔点测定操作规程操作,记录供试品在初熔至终熔时的温度,重复测定三次,取其平均值,既得。
本品的熔点应为218~224℃。
5.3 鉴别在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
5.4 检查5.4.1溶液的澄清度仪器与试剂:电子天平、氢氧化钠试液、2号浊度标准液。
取本品5份,各0.50g,分别加氢氧化钠试液10ml溶解后,溶液应澄清;如显浑浊,与2号浊度标准液(澄清度检查法标准操作规程第一法)比较,均不得更浓。
5.4.2有关物质仪器与试剂:高效液相色谱仪、电子天平、杂质A对照品、诺氟沙星对照品、环丙沙星对照品、依诺沙星对照品、乙腈、0.1mol/L盐酸溶液、0.025mol/L磷酸溶液(用三乙胺调节pH值至3.0±0.1)。
照高效液相色谱法(高效液相色谱法标准操作规程)测定。
供试品溶液取本品适量,精密称定,加0.1mol/L盐酸溶液适量(每12.5mg诺氟沙星加0.1mol/L盐酸溶液1ml)使溶解,用流动相A定量稀释制成每1ml中约含0.15mg的溶液。
诺氟沙星胶囊、盐酸环丙沙星片的质量评价及标准探讨

第一作者简介:姚永青,主管药师;研究方向:药物分析。
Tel:18625569131;E mail:18625569131@163 com 通讯作者简介:刘英,主任药师;研究方向:药物分析。
Tel:0371 65566621;E mail:ying_leaf@263 net诺氟沙星胶囊、盐酸环丙沙星片的质量评价及标准探讨姚永青,宋汉敏,刘英(河南省食品药品检验所,郑州450018)摘要 目的:对2018年我省专项监督抽验诺氟沙星胶囊、盐酸环丙沙星片的有关物质进行考察,并对现行标准进行探讨。
方法:按《中国药典》2015年版二部对2018年省抽样品进行有关物质检查,并对结果进行分析。
结果:52批次样品的有关物质均符合规定。
部分诺氟沙星胶囊样品主峰前有一杂质峰与主峰未完全分离,而现行标准未控制与该杂质峰的分离度。
采用现行标准定位环丙沙星杂质E与采用中国食品药品检定研究院标准物质定位的保留时间不同。
结论:按现行标准检验,本次省专项监督抽验诺氟沙星胶囊、盐酸环丙沙星片的有关物质情况良好。
建议优化诺氟沙星胶囊和盐酸环丙沙星片的质量标准,以期更好的控制药物的质量。
关键词:有关物质;诺氟沙星胶囊;盐酸环丙沙星片;质量标准中图分类号:R921 2 文献标识码:A 文章编号:1009-3656(2020)-4-0329-6doi:10 19778/j chp 2020 04 009QualityevaluationandstandardsofnorfloxacincapsulesandciprofloxacinhydrochloridetabletsYAOYongqing,SONGHanmin,LIUYing(HenanProvincialInstituteofFoodandDrugControl,Henan,Zhengzhou450018,China)Abstract Objective:ToinvestigatetherelatedsubstancesofNorfloxacinCapsulesandCiprofloxacinHydrochlo rideTabletsfromspecialsupervisionsamplinginourprovincein2018,andtodiscussthecurrentstandard Meth ods:AccordingtoChP2015editionⅡ,therelatedsubstancesinthesamplesoftheprovincein2018wereexam inedandtheresultswereanalyzed Results:52batchesofrelatedsubstancesmettherequirements TherewasanimpuritypeakinfrontofthemainpeakofsomeNorfloxacinCapsules,whichwasnotcompletelyseparatedfromthemainpeak However,thecurrentstandarddidnotcontroltheseparationwiththisimpuritypeak TheretentiontimeofciprofloxacinimpurityEpositionedbythecurrentstandardisdifferentfromthatofthestandardsubstance Conclusion:Accordingtothecurrentstandardtest,therelatedsubstancesofNorfloxacinCapsulesandCiprofloxa cinHydrochlorideTabletsfromspecialsupervisionsamplingin2018areingoodcondition Inordertocontrolthequalityofdrugsbetter,itissuggestedtooptimizethequalitystandardsofNorfloxacinCapsulesandCiprofloxacinHydrochlorideTablets.Keywords:relatedsubstances;norfloxacincapsules;ciprofloxacinhydrochloridetablets;qualitystandard 喹诺酮是4 吡酮 3 羧酸(PCA)的衍生物。
8075-2诺氟沙星胶囊检验标准操作程序
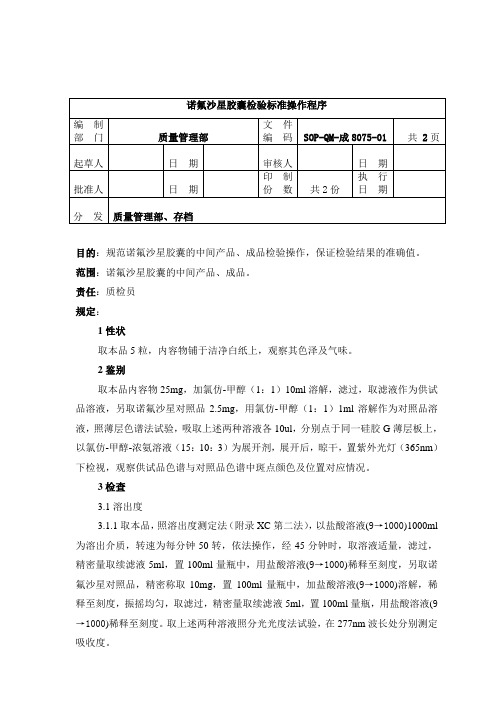
目的:规范诺氟沙星胶囊的中间产品、成品检验操作,保证检验结果的准确值。
范围:诺氟沙星胶囊的中间产品、成品。
责任:质检员规定:1性状取本品5粒,内容物铺于洁净白纸上,观察其色泽及气味。
2鉴别取本品内容物25mg,加氯仿-甲醇(1:1)10ml溶解,滤过,取滤液作为供试品溶液,另取诺氟沙星对照品2.5mg,用氯仿-甲醇(1:1)1ml溶解作为对照品溶液,照薄层色谱法试验,吸取上述两种溶液各10ul,分别点于同一硅胶G薄层板上,以氯仿-甲醇-浓氨溶液(15:10:3)为展开剂,展开后,晾干,置紫外光灯(365nm)下检视,观察供试品色谱与对照品色谱中斑点颜色及位置对应情况。
3检查3.1溶出度3.1.1取本品,照溶出度测定法(附录XC第二法),以盐酸溶液(9→1000)1000ml 为溶出介质,转速为每分钟50转,依法操作,经45分钟时,取溶液适量,滤过,精密量取续滤液5ml,置100ml量瓶中,用盐酸溶液(9→1000)稀释至刻度,另取诺氟沙星对照品,精密称取10mg,置100ml量瓶中,加盐酸溶液(9→1000)溶解,稀释至刻度,振摇均匀,取滤过,精密量取续滤液5ml,置100ml量瓶,用盐酸溶液(9→1000)稀释至刻度。
取上述两种溶液照分光光度法试验,在277nm波长处分别测定吸收度。
诺氟沙星胶囊检验标准操作程序第2页3.1.2计算公式A样溶出量= ×100%A对式中A样、A对为供试品溶液与对照品溶液的吸收值。
3.2装量差异按“装量差异检查操作程序”检验。
3.3微生物限度按“微生物检验操作程序”检验。
3.4水分用水分测定仪测定。
4含量测定4.1色谱条件与系统适用性试验填充剂:十八烷基硅烷键合硅胶流动相:0.025mol/L磷酸溶液(用三乙胺调节PH值至3.0±0.1)-乙腈(87:13)流速:0.8ml/min检测波长:278nm理论板数:≥2000(按诺氟沙星计算)4.2对照品制备取诺氟沙星对照品约25mg,精密称定,置100ml量瓶中,加0.1mol/L盐酸溶液2ml使溶解,加水稀释至刻度,摇匀,精密量取5ml,置50ml量瓶中,加流动相稀释至刻度摇匀。
国家药品监督管理局关于依法查处不合格诺氟沙星胶囊的批复

国家药品监督管理局关于依法查处不合格诺氟沙星胶
囊的批复
文章属性
•【制定机关】国家药品监督管理局
•【公布日期】1999.02.10
•【文号】药管市[1999]10号
•【施行日期】1999.02.10
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】药政管理
正文
国家药品监督管理局关于依法查处不合格诺氟沙星胶囊的批
复
(药管市[1999]10号)
江西省卫生厅药政管理局:
你局“关于查处不合格诺氟沙星胶囊的紧急请示”收悉,现批复如下:
自1998年初,各地陆续发现不法分子利用1995年版《中华人民共和国药典》诺氟沙星胶囊标准检验方法的空子进行非法生产,给人民用药安全有效带来严重威胁。
药品生产企业如没有故意违法生产行为,严格按规定进行生产,其诺氟沙星胶囊无论依1995版《中华人民共和国药典》的方法检验还是按新标准方法检验均应是合格产品。
故我局下发的“关于加强诺氟沙星胶囊质量监督检验的紧急通
知”(国药管市[1998]62号)文中要求:新标准下发之前生产的诺氟沙星胶囊一律按新标准进行检验,不合格的依法进行处理。
“依法进行处理”是指无论是新标准下发之前或之后生产的诺氟沙星胶囊,按新标准检验不合格的,都要坚决依据《药品管理法》的规定进行查处。
国家药品监督管理局市场监督司一九九九年二月十日。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
国家药品监督管理局关于对诺氟沙星胶囊同品种质量考核不
合格品进行查处的通知
【法规类别】质量管理和监督
【发文字号】国药管市[1999]188号
【发布部门】国家药品监督管理局(已变更)
【发布日期】1999.07.07
【实施日期】1999.07.07
【时效性】现行有效
【效力级别】部门规范性文件
国家药品监督管理局关于对诺氟沙星胶囊同
品种质量考核不合格品进行查处的通知
(1999年7月7日国药管市[1999]188号)
各省、自治区、直辖市药品监督管理局或卫生厅(局)、医药管理部门,解放军总后卫生部,武警总部卫生部:
根据我局《关于对诺氟沙星胶囊进行同品种质量考核的通知》(国药管市[1998]81号)的要求,全国各省级药品监督主管部门分别将抽取到标示352家生产企业的1047批次检品于1998年10月25日前送到中国药品生物制品检定所进行检验(西藏自治区、陕西省卫生厅未报送检品)。
这些检品分别是从283家生产企业抽取627批次,约占总抽样批次60%,从222家经营企业抽取269批次,约占总抽样批次20%,从129家医疗单位抽取
151批次,约占总抽样批次14%。
经中国药品生物制品检定所检验,结果表明:有152批次为不合格品,检验总不合格率为14.5%。
为进一步完成诺氟沙星胶囊同品种质量考核的查处和整顿工作,现将有关事项通知如下:
一、关于诺氟沙星胶囊审批与生产情况
据各省级药品监督管理部门报送的资料和国家药品监督管理局新药审评中心、药典委员会的记载汇总情况表明,卫生部于1987年批准了天津中央制药厂、山西太原制药厂生产诺氟沙星原料及其制剂,在1990年以前(含1990年)各省级药品监督管理部门共审批199个药品生产企业生产诺氟沙星胶囊,1990年诺氟沙星胶囊收载入《中华人民共和国药典》(1990版)以后,各地按仿制程序审批,至1998年全国各省药品监督管理部门共审批1042家制药企业生产诺氟沙星胶囊。
从各省级药品监督管理部门报送的生产企业数分析表明,部分地区审批的生产企业过于集中。
如审批40家生产企业以上的有12个省,总计审批696家,约占总审批数的67%,超过70家的有山西、吉林、辽宁、安徽、河南五省,共计审批370家占36%。
这些省审批生产企业过多,生产技术无重大改进和提高,实属低水平重复生产。
经对省级药品监督管理部门核查报送的资料汇总表明:自1996年--1998年连续3年以上未生产诺氟沙星胶囊的企业有267家。
二、全国抽检诺氟沙星胶囊及其核查情况
经中国药品生物制品检定所检验152批次不合格诺氟沙星胶囊中有假药102批次,劣药50批次,经核查:
(一)直接从四川省长江制药厂等15家生产企业成品库中抽取的17批次诺氟沙星胶囊为劣药,经复检后仍为不合格品。
(二)从药品经营企业和医疗单位抽取的135批次不合格诺氟沙星胶囊中有102批次为假药,33批次为劣药,经核查现已涉及药品经营企业156家,医疗单位44家,其中:
1.已追踪到生产企业11家15批次(其中7批次为假药,8批次为劣药)。
2.已追踪到内蒙古自治区丰镇市医药第六门市部等34家药品经营企业或从非法渠道购进假、劣诺氟沙星胶囊,或无合法购货证明及质检报告,共计28批次假药,6批次劣药。
3.经查内蒙古自治区乌海医药公司第六门市部等8个单位无《药品经营企业许可证》经营诺氟沙星胶囊7批假药,1批劣药。
三、对不合格诺氟沙星胶囊的查处和诺氟沙星生产企业的整顿工作。
(一)请各省级药品监督管理部门依据《药品管理法》、《药品管理法实施办法》和国务院办公厅《关于继续整顿和规范药品生产经营秩序加强药品管理工作的通知》(国办发[1996]14号)规定,对辖区内的有关生产、经营假劣诺氟沙星胶囊的企业和医疗单位以及有关直接责任人员进行查处:
1.责成内蒙古自治区、吉林、江苏、湖北、广东、海南、四川省、重庆市药品监督管理部门或卫生厅(局)依据国务院办公厅《关于继续整顿和规范药品生产经营秩序加强药品管理工作的通知》(国办发[1996]14号)的规定对辖区内直接从15家生产企业抽取的诺氟沙星胶囊经检验为劣药、又经重复检验仍不合格的,撤销其生产批准文号(名单见附件1)。
2.责成内蒙古自治区、河北、安徽、江西、广东省药品监督管理部门或卫生厅依据《药品管理法》第五十条、第五十一条的规定对辖区内经营假、劣诺氟沙星胶囊、且无合法购货证明及质检报告的34家药品经营企业,责令停业整顿或报同级人民政府决定吊销《药品经营企业许可证》(名单见附件2)。
3.责成河北省、内蒙古自治区药品监督管理部门或卫生厅依据《药品管理法》第五十二条的规定对辖区内无《药品经营企业许可证》经营假、劣诺氟沙星胶囊的8家单位,责令停业,没收全部药品和违法所得,可以并处罚款(名单见附件3)。
4.各省级药品监督管理部门对辖区内经核查涉及生产、经营和使用假劣诺氟沙星胶囊的11家生产企业、156家药品经营企业以及44家医疗单位,要视其情节,分别依法处理。
对尚未完全追查到生产企业的经营企业,限期于1999年8月15日前提供有关购货证明和质检报告,逾期不能提供有关证明材料的将视其情节依法严肃处理,直至报同级人民政府决定吊销《药品经营企业许可证》(名单见附件4)。
5.对诺氟沙星胶囊自1996年--1998年连续停产3年以上的生产企业,其批准文号作废,由所辖省级药品监督管理部门办理终止批准文号手续(名单见附件5)。
(二)各省级药品监督管理部门要对辖区内在此次诺氟沙星胶囊同品种质量考核中未抽到检品的423家有批准文号的生产企业,逐一进行清理整顿:
1.对原生产企业已发生变更不再生产诺氟沙星胶囊的企业,应及时终止其生产批准文号效力。
2.对不符合生产条件,无质量检测仪器设备的应责令其停产整顿,整顿无望的企业以及对有生产管理混乱、出租、转让批准文号行为的生产企业应依法处理及时终止其批准文号效力。
3.对经清理整顿确已具备生产条件予以保留生产诺氟沙星胶囊的生产企业,再生产时由省级药检所对其生产的诺氟沙星胶囊跟踪抽验三批,合格后方可准予继续生产、销售和使用。
(三)请各省级药品监督管理部门对辖区内生产诺氟沙星原料的生产企业进行调查清理:1.核发诺氟沙星原料生产批准文号的生产企业名称、批准文号、年生产能力、1996年--1998年销量、年出口量。
2.辖区内无《药品生产企业许可证》,无诺氟沙星原料生产批准文号非法生产、销售诺氟沙星原料的单位、名称以及查处情况。
此次全国诺氟沙星胶囊同品种质量考核工作涉及面广、工作量大,查出生产经营假劣诺
氟沙星胶囊的质量问题严重,反映出日常监督管理工作制度不严,力度不够,应当引起各级药品监督管理部门的高度重视,要求各省级药品监督管理部门根据上述关于查处、清理整顿的工作要求,于1999年8月30日前,将有关查处情况及清理整顿企业名单列表一式三份报我局市场监督司备案。
同时要求对在此次诺氟沙星胶囊同品种质量考核中未抽送检品和未按规定抽送检品的省级药品监督管理部门,要说明情况、原因并切实做好清理整顿工作,确保辖区人民群众用药安全有效。
在查处和清理整顿工作中如有问题请与我局市场监督司联系。
附件:1、直接从生产企业抽验诺氟沙星胶囊不合格企业名单
2、经营假、劣诺氟沙星胶囊企业名单
3、无《药品经营企业许可证》经营假、劣诺氟沙星胶囊的单位名单
4、需进一步核查生产、经营、使用假劣诺氟沙星胶囊的单位名单
5、1996-1998年连续3年以上未生产诺氟沙星胶囊的生产企业名单
国家药品监督管理局
1999年7月7日
附件1:
附件2:
附件3:
附件4:。
