联碱工艺流程简介
制碱工艺介绍

制碱工艺纯碱概述纯碱即碳酸钠,系单斜体晶体,化学分子式Na2CO3,也称苏打(Soda)或碱灰(Soda ash),外观呈白色粉末。
从化学分子式来看应为盐,但由于水溶液呈强碱性(1mol/L水溶液,25℃,PH=11.84),故称之为碱。
因天津碱厂合成碱纯度高,故将合成碱称之为纯碱,一直沿用至今。
纯碱的真实密度为2.533 g/cm3(20℃),熔点851℃,随颗粒大小不同,堆积密度也随之而变,因而有轻质纯碱和重质纯碱之分。
碳酸钠易溶于水,形成3种水合物:Na2CO3.10H2O;Na2CO3.7H2O;Na2CO3.H2O;当温度高于109℃时从水溶液中析出无水物。
十水碳酸钠简称十水碱亦称晶碱或洗涤碱,在32℃以下稳定存在。
当夏日气温超过32℃会溶解在自己的结晶水中,在低空气温度时,就会分化,脱除部分结晶水而成粉末。
因其在水中速溶,故在家庭中乐于用作洗涤剂和食用面碱。
一水碳酸钠简称一水碱,性质最为稳定,用于摄影行业中的显影液。
七水碳酸钠因为不稳定,在工业和民用方面无大用途,故不成为商品。
纯碱基本上可以称得上是无毒无害的安全物质。
但由于它呈碱性,如果人体与之接触时会受到刺激,发生皮炎。
开始时双臂、双手和双腿发红,偶尔发生小脓包和溃疡,最终导致皮肤变厚,色素沉积和产生疤痕。
纯碱的最大用户是玻璃制造业(约50%),为玻璃容器、玻璃瓶、平板玻璃和玻璃纤维的制造原料。
其次是用于其它化学制品的生产,如烧碱、洁碱、各种磷酸钠、硅酸钠、氧化铝、硼砂、铬酸钠及其它铬化学制品。
纯碱也在洗涤剂中得到了大量应用;此外纯碱还大量用于纸浆、造纸和水处理中,并用作中和、沉淀和增溶的药剂。
因此纯碱作为基本化工原料,在国民经济中占有重要地位,它是世界上用量最大化工产品之一。
纯碱工业发展简史在很早以前,人们就开始使用天然碱湖中的碱以及海草灰中的碱供洗涤和制造玻璃之用,现在保存下来的最古老的埃及玻璃大约是公元前1800年制造的。
在我国1700年前的著名药书“本草纲目”中记载“菜蒿蓼之属、晒干、烧灰、以原水淋汁,去垢发面。
联碱生产工艺

碳化的主要物料流程
澄清后的氨母液Ⅱ用AⅡ泵送至清洗塔上部,在塔内自上而 下溶解塔内结疤,并由塔底经中和泵送至制碱塔的上部自上而 下与第1圈(下段气)和第7圈(中段气)通入的二氧化碳气进 行反应,生成碳酸氢钠悬浮液,冷却结晶后由塔底取出至滤过 。
钠反应生成的碳酸氢钠沉淀和氯化铵,碳酸氢钠 之所以沉淀是因为它的溶解度较小。
• 此法优点:保留了氨碱法的优点,消除了 它的缺点,使食盐的利用率提高到 96 %; NH4Cl 可做氮肥;可与合成氨厂联合,使合 成氨的原料气 CO 转化成 CO2,革除了 CaCO3制 CO2这一工序。
本厂联碱各工序网络图
2NaHCO△ 3 = Na2CO3+H2O+CO2
炉气 去压缩
软水
洗涤塔 洗 涤 液
洗涤泵
冷凝塔 冷 凝 液
冷凝泵
水封槽
重 碱 来 NaHCO3
旋风分离 炉气 煅 烧 炉 合 成 来 中 压 蒸 汽
Na2CO3
冷凝水
埋刮板 贮水槽
热碱桶
热碱泵
送系统
热 碱液
凉碱机
埋刮板
纯碱 包装
闪蒸器
低压蒸汽去 复肥等系统
• 中国“侯氏碱法”与日本的A.C法实质均为联碱法 ,堪称提高食盐利用率,解决废液排放的成功方 法。
侯氏制碱法
(1)NH3+ H2O + CO2==== NH4HCO3 (2) NH4HCO3 + NaCl(饱和) == NH4Cl+
NaHCO3↓(平时这样的反应一般认为不进 行,但是由于在某个温度下,碳酸氢钠的 溶解度较低,会沉淀出来,所以这个反应 能够一定程度上进行)
制碱工艺

纯碱俗名苏打、石碱、碳酸钠、洗涤碱,化学式为Na2CO3。
纯碱是重要的化工原料,广泛用于玻璃、日用化学、化工、搪瓷、造纸、医药、纺织、印染、制革等工业部门以及人们的日常生活,在国民经济中占有重要地位。
制碱工业中通过氨盐水吸收二氧化碳可得到得碳酸氢钠(俗称小苏打),再送煅烧工序,得到的即为轻质纯碱(轻灰)。
轻质纯碱溶于水中,达到饱和后结晶生成一水碱,再经煅烧就成为重质纯碱(重灰)。
轻重灰最明显的区别是重度堆密度不同,即相同体积重量不一样,轻灰≥500公斤/立方,重灰≥900公斤/立方。
轻灰多用于食品,冶炼及玻璃制造,用的最多的是日化洗涤用品。
重灰多用于浮法玻璃等高档玻璃的制造。
目前纯碱的生产方法有氨碱法、联碱法、天然碱法、芒硝制碱法、霞石制碱法等,其中最重要、国内最常用的是氨碱法和联碱法。
(一)氨碱法在很早以前,人们就开始使用天然碱湖中的碱以及海草灰中的碱供洗涤和制造玻璃之用,到18世纪末,随着生产力的发展,天然碱的产量已远不能满足玻璃、肥皂、皮革等工业需要,因此人工制碱的问题就被提出来了。
1861年,比利时人索尔维原是一名工人,在煤气厂从事稀氨水的浓缩工作,发现用食盐水吸收氨和二氧化碳时可以得到碳酸氢钠,于是获得用海盐和石灰石为原料制取纯碱的专利,这种方法也就被称之为“索尔维制碱法”。
因为在生产过程中需用氨作为媒介,故又称为“氨碱法”。
氨碱法主要工艺流程如下:饱和食盐水氨盐水沉淀NaHCO3沉淀NH4Cl NaClCO2(循环使用)Na2CO3产品通NH3过滤洗涤通CO2Ca(OH)2煅烧NH3(循环使用)废液CaCl2,NaCl Δ石灰石CaCO3CO2CaO 煅烧石灰乳Ca(OH)2氨碱法制碱工艺的原理如下:NH4Cl NaHCO3H2O CO2NH3NaCl +↓→+++↑+→CO2CaO CaCO3,H2O 2CaCl NH32CaO NH4Cl 2++↑→+H2O CO2CO32Na NaHCO32+↑+→但是氨碱法存在着比较严重的缺点,即其对原料NaCl 的利用率低,且大量氯化物以废液形式排弃,不但原料无法完全利用,而且严重污染环境。
联碱法
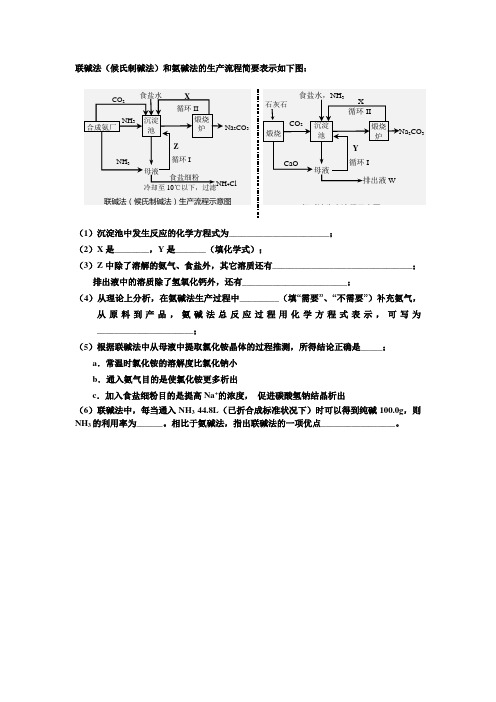
联碱法(候氏制碱法)和氨碱法的生产流程简要表示如下图:
(1)沉淀池中发生反应的化学方程式为_______________________;
(2)X是________,Y是_______(填化学式);
(3)Z中除了溶解的氨气、食盐外,其它溶质还有________________________________;
排出液中的溶质除了氢氧化钙外,还有________________________;
(4)从理论上分析,在氨碱法生产过程中_________(填“需要”、“不需要”)补充氨气,从原料到产品,氨碱法总反应过程用化学方程式表示,可写为______________________;
(5)根据联碱法中从母液中提取氯化铵晶体的过程推测,所得结论正确是_____;
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气目的是使氯化铵更多析出
c.加入食盐细粉目的是提高Na+的浓度,促进碳酸氢钠结晶析出
(6)联碱法中,每当通入NH3 44.8L(已折合成标准状况下)时可以得到纯碱100.0g,则NH3的利用率为______。
相比于氨碱法,指出联碱法的一项优点_________________。
三种制碱方法的工艺流程图

三种制碱方法得工艺流程图纯碱主要得生产工艺分为三种:天然碱法、氨碱法、联碱法。
三种制碱工艺中,氨碱法对环境污染较大,且消耗大量得自然资源,原盐得利用率较低,生产得副产品氯化钙用途较小,大部分作为废渣处理;联碱法较氨碱法污染较小,原盐利用率较高,且与合成氨工业相互匹配,且副产品氯化铵可以用作生产复合肥得原料,在我国大规模生产有很好得适用性;天然碱法不仅对环境污染较小,且相比较成本低30—40%。
下面介绍一下这三种制碱工艺得工艺流程.天然碱法天然碱加工法采用大自然碱矿物为原料来制取纯碱。
天然碱得加工方法主要有鹵水碳化法、一水碳酸钠法、倍半碳酸钠法。
卤水碳化法就是用天然碱湖水得卤水为原料。
通过碳酸化过程,先把卤水中碳酸钠与其她钠盐转化成碳酸氧钠,再把碳酸氢钠从溶液中结晶出来,再过滤、煅烧得到纯碱。
一水碳酸钠法用天然碱为原料.先粉碎再煅烧,碳酸氧钠分解之后再进行溶解、精制,得到一水碳酸钠结晶体,再经锻烧得到重质纯碱。
倍半碳酸钠法就是以天然碱矿中最常见得组分倍半碳酸钠为主要原料。
先将天然倍半碱矿粉碎,再加水溶解,去掉泥沙后再用活性炭脱去溶液中有机物杂质,再过滤、蒸发、结晶、煅烧可得纯碱产品。
倍半天然碱法工艺流程图如下:氨碱法氨碱法,又称索尔维制碱法,就是由于1862年比利时人索尔维(Ernest Solvay,1832—1922)以食盐、氨、二氧化碳为原料,成功制得碳酸钠而命名。
其主要工艺流程如下:1、煅烧石灰石制得石灰与二氧化碳,石灰消化后得到石灰乳.ﻫ2、把盐水制备成氨盐水。
3、碳化氨盐水,制得重碱。
4、把重碱进行过滤与洗涤。
5、煅烧重碱即可得到纯碱成品与二氧化碳.6ﻫ、把母液中存在得氨进行蒸馏回收。
联碱法:联碱法又称侯氏制碱法,就是我国化学工程专家侯德榜于1943年创立得.就是将氨碱法与合成氨法两种工艺联合起来,同时生产纯碱与氯化铵两种产品得方法。
原料就是食盐水、氨气与二氧化碳-合成氨厂用水煤气制取氢气时得废气。
联碱工艺流程

联碱工艺流程简介联碱生产按工序可分为碳滤、压缩、煅烧、重灰、重灰包装、结晶、制冷、干铵、干铵包装9个工序。
一:碳滤工序碳滤工序包括碳化、过滤、综合回收几个过程。
碳化过程碳化过程是利用氨母液II在碳化塔中吸收CO2生成NaHCO3结晶同时生成NH4Cl的过程。
碳化塔里的反应可用方程式NaCl+NH3+CO2+H2O NaHCO3 +NH4Cl来表示。
液相流程用方框图表示为:碳化尾气中含有大量的气氨,需经过综合回收后才能排放;其气相流程可用以下方框图表示:碳化过程是一个放热反应过程,反应过程中有大量的反应热需要移走;本工艺选用循环水冷却,下进上出间接换热闭路循环,在此不做介绍。
碳化取出液经取出槽至过滤机,气相里同样含有大量的气氨需经引风机引至净氨塔净氨后放空;过滤机上方以及MI桶放空气体同时净氨后放空。
过滤过程过滤过程是利用真空过滤原理将碳化取出液里的NaHCO3结晶分离出来,同时利用洗水降低NaHCO3里的NaCl含量;滤液去MI桶,NaHCO3结晶去煅烧;过滤尾气经净氨后去压缩工序。
用方框图可表示为:综合回收过程综合回收主要是回收碳化、过滤尾气及煅烧冷凝液里的氨;同时实现用水的回收利用。
煅烧冷凝液回收可用以下方框图表示。
碳化尾气经综合回收后放空、过滤尾气经综合回收后去压缩工序;其回收流程可用以下方框图表示:二、压缩工序压缩工序包括压缩和真空两个环节;压缩是利用压缩机将合成送过来的含98.5%和68.77%的CO2以及回收的煅烧炉气压缩、冷却后分中、下段送入碳化塔。
可用以下方框图表示。
真空环节是利用真空机抽吸过滤尾气放空,起到使过滤机连续稳定运行的作用。
三、煅烧工序煅烧工序使用蒸汽在煅烧炉内加热碳化工序送过来的NaHCO3结晶使之分解生成Na2CO3成品同时对炉气进行回收洗涤的过程。
在煅烧炉内发生以下化学反应: 2 NaHCO3 Na2CO3 + H2O +CO2 其流程可用以下方框图表示:因煅烧炉气中含有大量的CO2气、氨气及碱尘,CO2气和氨气是联碱生产的原料气;碱尘回收及是产品;而这些气体如不加以回收不光对环境造成污染,还增加生产成本。
联碱纯碱煅烧操作规程

煅烧岗位操作规程前言操作规程是企业内部使用的一种指导生产操作的规范性文件。
它是企业建立全面质量管理体系必不可少的技术文件之一。
对于企业加强内部管理,全面推行“质量兴企”战略具有重要意义。
由于操作规程是一个企业的内部标准,因而具有行业性、适宜性、持续改进的特点。
随着公司ISO9000—2008版质量管理体系换版工作的顺利完成,全面推行该体系势在必行。
本操作规程就是在这样的背景下产生的,公司总工程师办公室本着严谨科学、通俗易懂的原则,完成了这部操作规程的编写。
同时为了力求体现该规程的适宜性,在全面征求各生产作业区技术人员、操作人员和相关各部门建议的基础上修改了操作规程并定稿。
在此对他们的辛勤劳动表示由衷的感谢!目录1 范围 (4)2 目的 (4)3 岗位说明书 (4)4 规章制度 (6)5 生产原理 (6)6 工艺流程 (7)7 主要设备一览表 (9)8 工艺指标 (10)9 煅烧系统开停车程序 (11)10 正常操作控制程序 (16)11 不正常情况处理 (20)12 岗位相关计算 (22)13 岗位存在的主要危险因素辨识 (26)14 安全环保和职业卫生危害防护 (36)15 附图、附表 (40)16 参考读物 (41)17 安全操作规程 (42)煅烧岗位操作规程1 范围本规程是公司生产装置操作控制的技术标准,凡是关系到本岗位生产控制的操作与管理均遵从此办法。
适用于本岗位的操作人员以及公司各级相关的技术人员、管理人员。
2 目的为了使生产控制有章可循,操作标准科学、合理,标准执行严肃、认真,最大程度地使生产装置保持长周期、安全、稳定运行,达到低耗、清洁、优质、高产的目的,特制定本操作规程。
3 岗位说明书单位名称:纯碱作业区煅烧岗位编号:Q/GJH GZ.14~473~2009单位名称:纯碱作业区煅烧岗位编号:Q/GJH GZ.14~474~2009单位名称:纯碱作业区刮板机岗位编号:Q/GJH GZ.³³-³³³-20094 规章制度4.1 掌握的制度●现场管理规定 /GJH GL03²002—2008…………(03-9)●巡回检查管理规定 Q/GJH GL03²003—2008…………(03-12)●作业区班组基础管理规定 Q/GJH GL03²004—2008…………(03-14)●岗位基础建设管理规定 Q/GJH GL03²005—2008…………(03-29)●责任减量考核办法 Q/GJH GL06²002—2008…………(06-4)●安全核准制度 Q/GJH GL05²005—2008…………(05-23)●进入厂区安全管理规定 Q/GJH GL05²008—2008…………(05-32)4.2 了解的制度●违反公司规章制度的罚责规定 Q/GJH GL03²011—2008… (03-49)●安全生产责任制度 Q/GJH GL05²001—2008…………(05-1)●进入受限空间作业安全管理规定 Q/GJH GL05²020—2008…(05-77)●检修安全管理制度 Q/GJH GL05²009—2008…………(05-34)●压力容器安全管理制度 Q/GJH GL05²014—2008…………(05-59)●员工考勤管理制度 Q/GJH GL14²005—2008…………(14-22)●劳动合同管理制度 Q/GJH GL14²003—2008…………(14-12)5 生产原理5.1 主要物料性质重碱:氨母液Ⅱ在碳化塔内吸收二氧化碳,使其中的NaCL和NH3转化生成NaHCO3和NH4CL,并冷却使NaHCO3结晶析出,形成NaHCO3悬浮液。
联碱纯碱碳化操作规程

碳化岗位操作规程前言操作规程是企业内部使用的一种指导生产操作的规范性文件。
它是企业建立全面质量管理体系必不可少的技术文件之一。
对于企业加强内部管理,全面推行“质量兴企”战略具有重要意义。
由于操作规程是一个企业的内部标准,因而具有行业性、适宜性、持续改进的特点。
随着公司ISO9000—2008版质量管理体系换版工作的顺利完成,全面推行该体系势在必行。
本操作规程就是在这样的背景下产生的,公司总工程师办公室本着严谨科学、通俗易懂的原则,完成了这部操作规程的编写。
同时为了力求体现该规程的适宜性,在全面征求各生产作业区技术人员、操作人员和相关各部门建议的基础上修改了操作规程并定稿。
在此对他们的辛勤劳动表示由衷的感谢!目录1 范围 (4)2 目的 (4)3 岗位说明书 (4)4 规章制度 (5)5 生产原理 (6)6 工艺流程 (8)7 主要设备一览表 (10)8 工艺指标 (11)9 低压机系统开停车程序 (13)10 正常操作控制程序 (17)11 不正常情况处理 (20)12 岗位相关计算 (22)13 岗位存在的主要危险因素辨识 (32)14 安全环保和职业卫生危害防护 (42)15 附图、附表 (45)16 参考读物 (45)17 安全操作规程 (50)碳化岗位操作规程1 范围本规程是公司生产装置操作控制的技术标准,凡是关系到本岗位生产控制的操作与管理均遵从此办法。
适用于本岗位的操作人员以及公司各级相关的技术人员、管理人员。
2 目的为了使生产控制有章可循,操作标准科学、合理,标准执行严肃、认真,最大程度地使生产装置保持长周期、安全、稳定运行,达到低耗、清洁、优质、高产的目的,特制定本操作规程。
3 岗位说明书单位名称:纯碱作业区碳化岗位编号:Q/GJH GZ.14-543-2009单位名称:纯碱作业区碳化岗位编号:Q/GJH GZ.14-544-20094 规章制度4.1 掌握的制度●现场管理规定 /GJH GL03·002—2008…………(03-9)●巡回检查管理规定 Q/GJH GL03·003—2008…………(03-12)●作业区班组基础管理规定 Q/GJH GL03·004—2008…………(03-14)●岗位基础建设管理规定 Q/GJH GL03·005—2008…………(03-29)●责任减量考核办法 Q/GJH GL06·002—2008…………(06-4)●安全核准制度 Q/GJH GL05·005—2008…………(05-23)●进入厂区安全管理规定 Q/GJH GL05·008—2008…………(05-32)4.2 了解的制度●违反公司规章制度的罚责规定 Q/GJH GL03·011—2008… (03-49)●安全生产责任制度 Q/GJH GL05·001—2008…………(05-1)●进入受限空间作业安全管理规定 Q/GJH GL05·020—2008…(05-77)●检修安全管理制度 Q/GJH GL05·009—2008…………(05-34)●压力容器安全管理制度 Q/GJH GL05·014—2008…………(05-59)●员工考勤管理制度 Q/GJH GL14·005—2008…………(14-22)●劳动合同管理制度 Q/GJH GL14·003—2008…………(14-12)5 生产原理5.1 主要物料性质5.1.1 母液的组成及温度5.1.2 重碱的组成(%)5.1.3 气体的温度、压力及CO2浓度5.1.4 热容(KJ/Kg·℃)二氧化碳,又称碳酸气,在常温常压下为无色无臭的气体,二氧化碳溶解于水生成碳酸,呈弱酸性。
纯碱的生产工艺

纯碱的生产工艺一、纯碱的工艺简述纯碱工艺简述:化学名称:碳酸钠;俗名:纯碱、重灰或轻灰;分子式:Na2CO3;分子量:105.99(按79年国际原子量);生产原料原盐、氨(NH3)、二氧化碳、水;生产基本原理:该厂采用联合制碱法生产纯碱和氯化氨。
联碱法生产采用一次加盐,两次吸氨,一次碳化,两次取出的冷法流程。
生产分为两个过程进行:?过程为纯碱生产过程,?过程为氯化氨生产过程。
两个过程构成一个封闭循环系统,不断投入原料(NH3、NaCl、H2O、CO2),同时不断地生产出纯碱和氯化氨两种产品。
联碱过程,即?和?过程:主要化学反应:N a Cl+NH3+H2O+CO2?NH4Cl+NaHCO3?+95.05kJ/mol二、纯碱工程设计中非金属管道材料的选用纯碱生产中的工作介质多为腐蚀性介质或冲刷磨损性介质,以往有的金属管道在使用较短时间就会损坏或泄漏,严重影响生产连续性,恶化了工艺指标。
从而加了大管道维护、检修工作量,增加了产品成本。
非金属管道与金属管道相比具有如下优点:?非金属管道没有电化学腐蚀,耐腐蚀性能好,不需对其进行防腐处理,维修费用低,寿命长;?非金属管道较金属管道更有内壁光滑,流体阻力小,不易结疤;?非金属管道重量轻,安装检修方便。
因此,为了改善生产条件,提高经济效益和竞争力,合理地选用新型非金属材料势在必行。
三、纯碱工业的发展纯碱是重要的工业原料,广泛应用于玻璃、化工、轻工、冶金等行业。
有人称纯碱是工业之母,其消费水平可以衡量一个国家的工业化水平,其实并不过分。
事实上,我国的民族工业也正是从范旭东先生创建永利碱厂起步的。
目前,我国的纯碱产量在国内化工产品中仅次于合成氨、化肥、硫酸,而列第四位。
在美国,尽管纯碱的产值在整个国民产值中比例很小,但由于其终端用户如汽车业、建筑业,对整个国民经济举足轻重,因此,联邦储备局将其月产量纳入工业生产经济指数,足见纯碱在国民经济中的重要性。
四、纯碱装置碳化塔的温度控制铵盐水吸收二氧化碳的碳酸化过程俗称碳化,碳化是纯碱生产过程中的一个关键工序。
联碱生产工艺及母液阻垢剂使用资料

纯碱生产工艺主要分天然碱 法和合成碱法,合成生产碱 法目前国内主要采用氨碱法 和联碱法。
氨碱法
目前国内仍有一些大型碱厂采用氨碱法, 其主要优点主要有: 原料价廉易得,产品质量好,可以生产低NaCl盐碱, 硫酸盐的含量也非常低,氨可以循环利用( 损失较少,适 用于大规模生产,易于机械化和自动化)。 主要缺点有: 存在石灰和蒸馏工序,原材料消耗高,原NaCl盐的利 用率低,转化率只能达到73~76%,Cl的利用率为零,总 利用率只有28%,产品成本高,生产副产品氯化钙处理难 度大,生产产生的废液量也较大。
氨碱法主要生产过程包括盐水制备、石灰石 煅烧、氨盐水制备、及其碳酸化、重碱的分离与 煅烧、氨的回收等。其反应过程如下: CaCO3 =CaO+CO2↑-Q CaO+H2O= Ca(OH)2+Q NaCl+NH3+H2O+CO2=NaHCO3 ↓+NH4Cl+Q NaHCO3 =Na2CO3+CO2↑+H2O↑+Q NH4Cl+ Ca(OH)2 = Ca Cl 2 +NH3 +H2O+Q
联碱法以食盐、氨及合成氨工业副产的二氧 化碳为原料,同时生产纯碱及氯化铵,即联合产 纯碱与氯化铵,简称“联合制碱”或称“联碱”, 其主要反应为: NaCl+NH3+H2O+CO2= NaHCO3 ↓+NH4Cl NaHCO3 = Na2CO3+CO2↑+H2O↑ 根据加入原料的次数及析出氯化铵温度的不同, 联合制碱有多种工艺流程。我国多采用:一次碳 化,两次吸氨,一次加盐,低温析铵流程。
联碱法主要工艺流程图
联碱法生产工艺流程

联碱法生产工艺流程英文回答:The Solvay process, also known as the ammonia-soda process, is a method used to produce sodium carbonate (soda ash) from salt, limestone, ammonia, and carbon dioxide. It was developed by Ernest Solvay in the 19th century and has been widely used in the chemical industry.The process starts with the extraction of salt (sodium chloride) from underground salt deposits or seawater. The salt is dissolved in water to form brine. Next, the brineis purified to remove impurities such as calcium and magnesium ions. This is important because these impurities can interfere with the subsequent steps of the process.After purification, the brine is mixed with ammonia and carbon dioxide. The ammonia reacts with the carbon dioxide to form ammonium bicarbonate, which is then decomposed to release carbon dioxide and water. The carbon dioxide isrecycled and used again in the process.The ammonium bicarbonate solution is then reacted with calcium hydroxide (obtained from limestone) to produce calcium carbonate and ammonia. The calcium carbonate is filtered out and the ammonia is recycled back into the process.The filtered calcium carbonate is then calcined (heated) to produce carbon dioxide and calcium oxide. The carbon dioxide is recycled, while the calcium oxide is slaked (reacted with water) to produce calcium hydroxide.Finally, the calcium hydroxide is reacted with the sodium carbonate solution obtained from the previous stepsto produce sodium carbonate and calcium carbonate. The sodium carbonate is separated and dried, while the calcium carbonate is recycled back into the process.中文回答:联碱法,也被称为氨法苏打法,是一种从盐、石灰石、氨和二氧化碳中生产碳酸钠(苏打灰)的方法。
联合制碱法

氨气与水和二氧化碳反应生成一分子的碳酸氢铵,这是第一步。
第二步是:碳酸氢铵与氯化钠反应生成一分子的氯化铵和碳酸氢钠沉淀,碳酸氢钠之所以沉淀是因为它的溶解度较小。
根据NH4Cl 在常温时的溶解度比NaCl 大,而在低温下却比NaCl 溶解度小的原理,在278K ~283K(5 ℃~10 ℃ ) 时,向母液中加入食盐细粉,而使NH4Cl 单独结晶析出供做氮肥。
化学原理侯氏制碱法又名联合制碱法(1)NH3+H2O+CO2=NH4HCO3 (2)NH4HCO3+NaCl=NH4Cl+NaHCO3↓ (3)2NaHCO3(加热)=Na2CO3+H2O+CO2↑ 即:①NaCl(饱和)+NH3+H2O+CO2=NH4Cl+NaHCO3↓ ②2NaHCO3(加热)=Na2CO3+H2O+CO2↑优点保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到96 %;NH4Cl 可做氮肥;可与合成氨厂联合,使合成氨的原料气CO 转化成CO2 ,革除了CaCO3 制CO2 这一工序。
注:纯碱就是碳酸钠国外研究情况(1862年至一战前)碳酸钠用途非常广泛。
虽然人们曾先后从盐碱地和盐湖中获得碳酸钠,但仍不能满足工业生产的需要。
1862年,比利时人索尔维(Ernest Solvay 1838—1922)发明了以食盐、氨、二氧化碳为原料制取碳酸钠的“索尔维制碱法”(又称氨碱法)。
此后,英、法、德、美等国相继建立了大规模生产纯碱的工厂,并组织了索尔维公会,对会员以外的国家实行技术封锁。
第一次世界大战期间,欧亚交通梗塞。
由于我国所需纯碱都是从英国进口的,一时间,纯碱非常缺乏,一些以纯碱为原料的民族工业难以生存。
1917年,爱国实业家范旭东在天津塘沽创办了永利碱业公司,决心打破洋人的垄断,生产出中国的纯碱。
他聘请正在美国留学的侯德榜先生出任总工程师。
侯氏制碱法的产生和发展1920年,侯德榜先生毅然回国任职。
他全身心地投入制碱工艺和设备的改进上,终于摸索出了索尔维法的各项生产技术。
联合制碱工业

比较侯德榜制碱法和氨碱法的流程图,分析两者 的异同点?
相同点: 原理相同 不同点:
原料
母液处理方法 循环物质 优缺点
抄课本p112
原料
母液处理方法 循环物质 优缺点
NaCl,CaCO3,NH3
NaCl ,CO2,NH3
Ca(OH)2+2NH4Cl →2NH3+CaCl2+2H2O
CO2 NH3
循 环
NaCl+ NH4HCO3 →
NaHCO3↓+ NH4Cl
△
2NaHCO3 → Na2CO3 + H2O + CO2
高温
母 CaCO3 → CaO + CO2
液 处
CaO + H2O → Ca(OH)2
理
△
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2O
思考:索尔维也经历过很多失败,当他把食盐水与 碳酸氢铵溶液混合时,有时并没有看到沉淀,为什 么?
联合制碱工业
在中国化学近代工业史上,有一位杰出的科学家, 猜一猜他是谁? 侯德榜
纯碱的用途有哪些?
制玻璃
制肥皂
造纸
乌 鲁 木 齐 郊 区 盐 碱 地
天 津 碱 厂
廉价的原料
N aCl CaCO3
△
NaOH
纯碱:Na2CO3 Na+
CO32-
CaO + CO2 NH3·H2O
你可以通过哪些学过的化学方法制Na2CO3 ?
例2、我国化学侯德榜改革国外的纯碱生产工 艺,生产流程可简要表示如下:
(1)上述生产纯碱的原料是
,纯碱的一种
联碱标准工艺标准流程简介

联碱工艺流程简介联碱生产按工序可分为碳滤、压缩、煅烧、重灰、重灰包装、结晶、制冷、干铵、干铵包装9个工序。
一:碳滤工序碳滤工序涉及碳化、过滤、综合回收几种过程。
1、 碳化过程碳化过程是运用氨母液II 在碳化塔中吸取CO 2生成NaHCO 3结晶同步生成NH 4Cl 旳过程。
碳化塔里旳反映可用方程式NaCl+NH 3+CO 2+H 2O NaHCO 3 +NH 4Cl 来表达。
液相流程用方框图表达为:碳化尾气中具有大量旳气氨,需通过综合回收后才干排放;其气相流程可用如下方框图表达:碳化过程是一种放热反映过程,反映过程中有大量旳反映热需要移走;本工艺选用循环水冷却,下进上出间接换热闭路循环,在此不做简介。
碳化取出液经取出槽至过滤机,气相里同样具有大量旳气氨需经引风机引至净氨塔净氨后放空;过滤机上方以及MI桶放空气体同步净氨后放空。
2、过滤过程过滤过程是运用真空过滤原理将碳化取出液里旳NaHCO3结晶分离出来,同步运用洗水减少NaHCO3里旳NaCl含量;滤液去MI桶,NaHCO3结晶去煅烧;过滤尾气经净氨后去压缩工序。
用方框图可表达为:3、综合回收过程综合回收重要是回收碳化、过滤尾气及煅烧冷凝液里旳氨;同步实现用水旳回收运用。
煅烧冷凝液回收可用如下方框图表达。
碳化尾气经综合回收后放空、过滤尾气经综合回收后去压缩工序;其回收流程可用如下方框图表达:二、压缩工序压缩工序涉及压缩和真空两个环节;压缩是运用压缩机将合成送过来旳含98.5%和68.77%旳CO2以及回收旳煅烧炉气压缩、冷却后分中、下段送入碳化塔。
可用如下方框图表达。
真空环节是运用真空机抽吸过滤尾气放空,起到使过滤机持续稳定运营旳作用。
三、煅烧工序煅烧工序使用蒸汽在煅烧炉内加热碳化工序送过来旳NaHCO 3结晶使之分解生成Na 2CO 3成品同步对炉气进行回收洗涤旳过程。
在煅烧炉内发生如下化学反映: 2 NaHCO 3Na 2CO 3 + H 2O +CO 2其流程可用如下方框图表达:因煅烧炉气中具有大量旳CO2气、氨气及碱尘,CO2气和氨气是联碱生产旳原料气;碱尘回收及是产品;而这些气体如不加以回收不光对环境导致污染,还增长生产成本。
氨碱法与联碱法

氨碱法与联碱法一、氨碱法(又称索尔维法)它是比利时工程师苏尔维(1838~1922)于1892年发明的纯碱制法。
他以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱。
先使氨气通入饱和食盐水中而成氨盐水,再通入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液。
其化学反应原理是:NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl将经过滤、洗涤得到的NaHCO3微小晶体,再加热煅烧制得纯碱产品。
2NaHCO3=Na2CO3+H2O+CO2↑放出的二氧化碳气体可回收循环使用。
含有氯化铵的滤液与石灰乳[Ca(OH)2]混合加热,所放出的氨气可回收循环使用。
CaO+H2O=Ca(OH)2,2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O氨碱法的优点是:原料(食盐和石灰石)便宜;产品纯碱的纯度高;副产品氨和二氧化碳都可以回收循环使用;制造步骤简单,适合于大规模生产。
但氨碱法也有许多缺点:首先是两种原料的成分里都只利用了一半——食盐成分里的钠离子(Na+)和石灰石成分里的碳酸根离子(CO32-)结合成了碳酸钠,可是食盐的另一成分氯离子(Cl-)和石灰石的另一成分钙离子(Ca2+)却结合成了没有多大用途的氯化钙(CaCl2),因此如何处理氯化钙成为一个很大的负担。
氨碱法的最大缺点还在于原料食盐的利用率只有72%~74%,其余的食盐都随着氯化钙溶液作为废液被抛弃了,这是一个很大的损失。
二、联合制碱法(又称侯氏制碱法)它是我国化学工程专家侯德榜(1890~1974)于1943年创立的。
是将氨碱法和合成氨法两种工艺联合起来,同时生产纯碱和氯化铵两种产品的方法。
原料是食盐、氨和二氧化碳(其中二氧化碳来自合成氨厂用水煤气制取氢气时的废气)。
其化学反应原理是:C+H2O=CO+H2CO+H2O=CO2+H2联合制碱法包括两个过程:第一个过程与氨碱法相同,将氨通入饱和食盐水而成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,经过滤、洗涤得NaHCO3微小晶体,再煅烧制得纯碱产品,其滤液是含有氯化铵和氯化钠的溶液。
氨碱法和联碱法

氨碱法和联碱法引言氨碱法和联碱法是工业生产中常用的两种制碱方法。
本文将深入探讨这两种制碱方法的原理、流程以及优缺点,并分析其在实际应用中的适用范围和特点。
氨碱法原理氨碱法是以氨为主要原料生产碱的一种方法。
其主要原理是通过将氨气与二氧化碳反应生成碳酸铵,再经过加热脱水分解得到氢氧化铵,最后通过加热分解得到氢氧化钠。
其反应方程式如下:NH3(g) + CO2(g) + H2O(l) → NH4HCO3(s)NH4HCO3(s) → NH3(g) + H2O(g) + CO2(g)流程1.氨气与二氧化碳在碱液中反应生成碳酸铵。
2.将碳酸铵加热进行脱水分解,生成氢氧化铵。
3.氢氧化铵经过加热分解,生成氢氧化钠。
优缺点优点1.原料易得:氨气广泛存在于空气中,二氧化碳也是常见气体。
2.反应条件温和:氨碱法反应温度较低,不需要高温反应。
3.产品纯度高:氨碱法制备的氢氧化钠纯度较高。
缺点1.产能较低:氨碱法生产的碱产量相对较低。
2.能耗较高:制备碳酸铵和氢氧化钠的过程需要大量能源。
联碱法原理联碱法是一种以盐类为主要原料生产碱的方法。
其原理是将氯化钠与氢氧化钠按一定比例充分反应,生成氢氧化钠和氯化氢,然后通过氯化氢的再生和氢氧化钠的重结晶来获得高纯度的氢氧化钠。
其反应方程式如下:NaCl(s) + NaOH(aq) → Na2O(s) + HCl(g)2HCl(g) + H2O(l) → Cl2(g) + 2H2O(l)流程1.氯化钠与氢氧化钠按一定比例反应生成氢氧化钠和氯化氢。
2.氯化氢通过再生装置进行氯化氢的再生。
3.氢氧化钠通过重结晶来获得高纯度的氢氧化钠。
优缺点优点1.可大规模生产:联碱法可以实现氢氧化钠的大规模生产。
2.产能高:相对于氨碱法,联碱法的碱产量更高。
3.产品品质稳定:通过重结晶装置可以得到高纯度的氢氧化钠。
缺点1.原料需求量大:联碱法的原料需求量较大,生产成本较高。
2.反应条件苛刻:联碱法需要在高温高压条件下进行反应。
热法联碱工艺

热法联碱工艺热法联碱工艺是一种重要的化学工艺,它是通过高温反应和碱性溶液的作用,将原料转化为所需的产物。
这种工艺在化工、冶金、建材等领域都有广泛的应用,可以生产出各种化学品、金属、陶瓷等产品。
热法联碱工艺的基本原理是将原料在高温下进行反应,然后通过碱性溶液进行中和和分离。
这种工艺的优点是反应速度快、产物纯度高、能耗低、生产成本低等。
同时,热法联碱工艺还可以实现废弃物的资源化利用,减少环境污染。
热法联碱工艺的应用非常广泛,下面我们就来介绍一些常见的应用。
1. 硅酸盐陶瓷制造硅酸盐陶瓷是一种高温陶瓷,具有高强度、高硬度、高耐磨性、耐高温等特点。
热法联碱工艺可以将硅酸盐原料转化为陶瓷材料,其中最常用的原料是氧化铝和硅酸盐。
在高温下,氧化铝和硅酸盐会发生反应,形成硅酸铝和水,然后通过碱性溶液进行中和和分离,最终得到硅酸盐陶瓷。
2. 钢铁冶炼钢铁冶炼是热法联碱工艺的另一个重要应用领域。
在钢铁冶炼过程中,热法联碱工艺可以用来处理废渣和废水。
废渣中含有大量的铁、钢、铜等金属,通过热法联碱工艺可以将这些金属回收利用。
废水中含有大量的酸性物质,通过热法联碱工艺可以将其中和,减少对环境的污染。
3. 硅片制造硅片是半导体制造的重要原材料,热法联碱工艺可以将硅原料转化为硅片。
在制造硅片的过程中,热法联碱工艺可以用来处理硅原料和废弃物。
硅原料经过高温反应和碱性溶液的作用,可以得到高纯度的硅片。
废弃物中含有大量的硅,通过热法联碱工艺可以将其回收利用。
4. 硝酸盐肥料制造硝酸盐肥料是一种重要的化肥,热法联碱工艺可以将氨和硝酸盐原料转化为硝酸盐肥料。
在高温下,氨和硝酸盐原料会发生反应,形成硝酸铵和水,然后通过碱性溶液进行中和和分离,最终得到硝酸盐肥料。
热法联碱工艺是一种非常重要的化学工艺,它可以应用于各种领域,生产出各种化学品、金属、陶瓷等产品。
在未来,随着科技的不断发展,热法联碱工艺将会得到更广泛的应用,为人类的生产和生活带来更多的便利和福利。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
联碱工艺流程简介
联碱生产按工序可分为碳滤、压缩、煅烧、重灰、重灰包装、结晶、制冷、干铵、干铵包装9个工序。
一:碳滤工序
碳滤工序包括碳化、过滤、综合回收几个过程。
1、 碳化过程
碳化过程是利用氨母液II 在碳化塔中吸收CO 2生成NaHCO 3结晶同时生成NH 4Cl 的过程。
碳化塔里的反应可用方程式NaCl+NH 3+CO 2+H 2
O NaHCO 3 +NH 4Cl 来表示。
液相流程用方框图表示为:
碳化尾气中含有大量的气氨,需经过综合回收后才能排放;其气相流程可用以下方框图表示:
碳化过程是一个放热反应过程,反应过程中有大量的反应热需要移走;本工艺选用循环水冷却,下进上出间接换热闭路循环,在此不做介绍。
碳化取出液经取出槽至过滤机,气相里同样含有大量的气氨需经引风机引至净氨塔净氨后放空;过滤机上方以及MI桶放空气体同时净氨后放空。
2、过滤过程
过滤过程是利用真空过滤原理将碳化取出液里的
NaHCO3结晶分离出来,同时利用洗水降低NaHCO3里的NaCl含量;滤液去MI桶,NaHCO3结晶去煅烧;过滤尾气经净氨后去压缩工序。
用方框图可表示为:
3、综合回收过程
综合回收主要是回收碳化、过滤尾气及煅烧冷凝液里的氨;同时实现用水的回收利用。
煅烧冷凝液回收可用以下方框图表示。
碳化尾气经综合回收后放空、过滤尾气经综合回收后去压缩工序;其回收流程可用以下方框图表示:
二、压缩工序
压缩工序包括压缩和真空两个环节;压缩是利用压缩机将合成送过来的含98.5%和68.77%的CO2以及回收的煅烧炉气压缩、冷却后分中、下段送入碳化塔。
可用以下方框图表示。
真空环节是利用真空机抽吸过滤尾气放空,起到使过滤机连续稳定运行的作用。
三、煅烧工序
煅烧工序使用蒸汽在煅烧炉内加热碳化工序送过来的
NaHCO 3结晶使之分解生成Na 2CO 3成品同时对炉气进行回收洗涤的过程。
在煅烧炉内发生以下化学反应: 2 NaHCO 3
Na 2CO 3 + H 2O +CO 2
其流程可用以下方框图表示:
因煅烧炉气中含有大量的CO 2气、氨气及碱尘,CO 2气
和氨气是联碱生产的原料气;碱尘回收及是产品;而这些气体如不加以回收不光对环境造成污染,还增加生产成本。
所以必须对煅烧炉气加以回收利用。
回收利用的同时需要对其进行冷却和洗涤。
其流程可用以下方框图表示:
四、重灰工序
重灰工序是利用水合结晶器让轻质纯碱在结晶器内反应生成一水碱,然后在经过流化床干燥生成结晶颗粒较大的重质纯碱。
其流程克用以下方框图表示。
因重灰工序设备相对较多,流程较为繁琐,特对流化床作单独介绍;其流程可用以下方框图表示。
五、纯碱包装工序
根据产品质量及客户要求,纯碱包装分为轻质纯碱包装、重灰包装、重灰细粉包装;其流程相对简单,用方框图表示如下。
重灰包装流程如下:
重灰细粉包装流程如下:
六、结晶工序
结晶工序是将碳化工序送来的MI经吸氨、降温、加盐等工序,使氯化铵生成结晶并将结晶分离变成氯化铵产品的过程。
具体流程可分为AI流程、MII流程及氨系统循环流程。
AI流程具体为:碳化工序送来的MI经吸氨后经水冷及母换器与MII换热后进入冷析结晶器(冷析结晶器由外冷器循环
降温)后溢流进入盐析结晶器;冷析结晶器中生成氯化铵结晶由冷析结晶器底部取出。
在盐析结晶器中加入NaCl生成的氯化铵结晶再由泵送入冷析结晶器中。
MII流程具体为:MII经母换器与AI换热后进进入吸氨器吸氨后进入AII澄清桶溢流入AII桶,再由泵送往碳化工序。
氨系统的流程具体为:来自液氨储槽的液氨经液氨循环罐进入外冷器与母液进行间接换热吸收热量后蒸发为气氨进入氨分离器,一部分气氨去吸氨,另一部分去冰机压缩冷凝后变成液氨循环使用。
几个系统的循环可用方框图表示如下:
AI系统的流程可表示为
MII系统的流程可表示为:
氨系统的流程可表示为:
七、制冷工序
制冷工序在结晶工序中已经做过介绍,其流程与上图相似,在此不另做介绍。
八、干铵工序
干铵工序是将离心机分离出来的含5%左右水分的湿氯
化铵在流化床中用蒸汽间接加热(同时通入热空气)使氯化铵水分降低制得干燥氯化铵的过程。
其流程可用以下方框图表示:
九、干铵包装
干铵根据包装要求不同分为大袋、小袋及码头包装码头包装几种,可用以下方框图表示:。
