4.1 原子的构成 习题
初三化学 原子的构成习题精选及标准答案

精品文档原子的构成习题精选含答案一、选择题1.原子和分子的区别是:( )A.分子在化学反应中分成原子,但在化学反应中原子不可再分B.分子一定比原子大C.分子能构成物质,而原子只能构成分子D.在化学反应中分子和原子都可以变成另一种分子和原子,区别在于它们发生的是不同的变化的碳原子的质量是千克,则一个氧原子的.已知一个质子数和中子数都是26( ) 质量是:16.16克 BA..千克 D C.千克3.在原子中,质子数等于:( )A.中子数B.核外电子总数C.相对原子质量D.中子数和电子数之和4.下列原子各1克,所含原子个数最多的是:( )A.氧原子B.铁原子C.氢原子D.氯原子5.一滴水能分成许许多多个水分子,分子又可分成原子,原子又由中子、质子、电子等构成,这些微粒中,一定能保持水的化学性质的是()。
A.水分子B.构成水分子的原子C.中子和质子D.电子6.原子和分子的根本区别是()A.是否能直接构成物质B.是否能保持物质的化学性质C.是否在化学反应中发生种类的变化D.是否能构成单质7.下列关于原子的说法错误的是()A.原子是化学变化中的最小微粒B.原子是最小的微粒C.原子核带正电荷,但原子不显电性D.分子能直接构成物质而原子不能精品文档.精品文档8.原子中决定相对原子质量大小的是()A.质子数和中子数B.质子数和电子数C.中子数和电子数D.核电荷数和电子数9.下列各种原子各1克,所含原子个数最多的是()A.氧原子B.铁原子C.氢原子D.氯原子10.下列各式中,表示两个氢原子的是(). 2H B.. C DA.11.碳的原子量是().千克D.1/12克 12A.克B.12C )12.在原子中(.质子数一定等于中子数A .质子数一定等于电子数B C.质子数、中子数、电子数三者都相等 D.原子核所带电量跟核外电子的电量相等 13.下列关于原子的叙述正确的是() A.物质都是由原子直接构成的B.原子是由质子和电子构成的 D.原子是由原子核和核外电子构成的C.原子是由质子和中子构成的二、填空题,,电子数是______质子数是1.硫原子的相对原子质量(原子量)为32,16,则中子数是______ ______。
新教材人教版高中化学必修第一册4.1原子结构与元素周期表 课时练习题含答案解析

4.1 原子结构与元素周期表一原子结构.......................................................................................................... - 1 -二元素周期表核素.......................................................................................... - 6 -三原子结构与元素的性质——碱金属元素..................................................... - 14 -四原子结构与元素的性质——卤族元素......................................................... - 19 -一原子结构【学习理解】共30分一、选择题(本题共4小题,每小题5分,共20分)1.(2021·淄博高一检测)俄罗斯科学家成功合成第114号元素的原子,该原子的质量数为289,存在时间达到30秒,具有很强的放射性,这项成果具有重要意义。
该原子的中子数与电子数之差是( )A.61B.114C.175D.289【解析】选A。
114号元素的原子序数是114,所以该元素的核内质子数是114,中子数=质量数-质子数=289-114=175,该原子的中子数与电子数之差=175-114=61。
【补偿训练】(2021·温州高一检测)带有2个单位正电荷的粒子X2+,它的质量数等于137,中子数是81,则其核外电子数为 ( )A.56B.54C.58D.137【解析】选B。
X2+的质子数=质量数-中子数=137-81=56,则X2+的核外电子数=56-2=54。
2.(2021·天津河北区高一检测)人类对原子及其结构的认识是一个由浅入深,由现象到本质,由不全面到比较全面的不断深化,不断完善的过程,这种过程将继续下去,而不会停止。
九年级化学第四单元第一节原子的构成练习试题及答案

九年级化学第四单元第一节原子的组成练习试题及答案一、选择题1.据报导,科学家发现了一种新元素,它的原子核内有161 此中子,质量数272。
该元素的质子数为()。
(全国高考题)(A)111(B)161(C)272(D)4332.依据元素的核电荷数,不可以确立的是()。
(A)原子核内质子数(B)原子核内中子数(C)原子最外层电子数(D)原子核外电子数3.氢原子的电子云图中的小黑点表示的意义是()。
(A)一个黑点表示一个电子(B)黑点的多少表示电子个数的多少(C)表示电子运动的轨迹(D)电子在核外空间出现时机的多少5.元素的化学性质主要决定于原子的()。
(A)质子数(B)中子数(C)核外电子数(D)最外层电子数6.周期表中16 号元素和 4 号元素的原子对比较,前者的以下数据是后者的 4 倍的是(A)电子数(B)最外层电子数(C)电子层数(D)次外层电子数7.据报导,某些建筑资料会产生放射性氡,进而对人体产生损害。
该原子的中子数和质子数之差是()。
(上海市高考题)(A)136(B)50(C)86(D)2228.以下表达中,正确的选项是()。
(A)两种微粒,若核外电子排布完整同样,则其化学性质必定同样(B)凡单原子形成的离子,必定拥有罕有气体元素原子的核外电子排布(C)两原子,假如核外电子排布同样,则必定属于同种元素(D)不存在两种质子数和电子数均同样的阳离子和阴离子9.以下说法中错误的选项是()。
(A)质量数同样的原子,其化学性质必定同样(B)质子数同样的微粒,其核外电子排布也同样(C)金属性越开朗,其原子在反响中越易失掉电子(D)非金属性越开朗,其阴离子越难失掉电子二、填空题1. A 元素原子M 电子层上有 6 个电子。
元素的原子最外电子层只有 1 个电子。
( 1) B 元素的原子构造表示图为。
( 2)A、B 两元素形成的化合物的名称是灼烧时,火焰呈色。
B 元素与 A 元素的原子核外电子层数同样,,化学式是,该化合物在无色火焰上B2.有 V、 W、 X、 Y、 Z 五种元素,它们的核电荷数挨次增大,且都小于20。
人教版高一上学期化学(必修一)《4.1.1原子结构》同步测试题带答案

人教版高一上学期化学(必修一)《4.1.1原子结构》同步测试题带答案一、选择题1.核电荷数小于或等于18的元素中,原子的最外层电子数是其余电子总数一半的元素种类有( )。
A.1种B.2种C.3种D.4种2.1~18号元素中,A元素原子最外层电子数是次外层电子数的2倍;B元素原子最外层电子数是其内层电子总数的3倍;C元素原子M层电子数等于其L层电子数的一半;D元素原子最外层有1个电子,D的阳离子与B的阴离子电子层结构相同,则4种元素核电荷数关系中正确的是( )。
A.C>D>B>AB.D>B>A>CC.A>D>C>BD.B>A>C>D3.1~18号元素的其中一种原子最外层电子数是次外层电子数的3倍,那么该原子( ) A.有3个电子层B.有2个电子层C.最外层电子数是8 D.核电荷数是104.具有12个质子和10个电子的微粒是( )。
A.O2-B.Na+C.Mg2+D.S2-5.核电荷数为16的元素和核电荷数为4的元素的原子相比较,下列数据中前者是后者4倍的是( )。
①核外电子数②最外层电子数③电子层数④次外层电子数A.①④B.①③④C.①②④D.②③6.硫的原子结构示意图为( )。
7.某元素的离子A m -核内有n 个中子,核外有x 个电子。
该原子的质量数是( )。
A.x-m+n B.x+m+n C.m+n-xD.x-n+m8.下列粒子中,各电子层电子数都达到2n 2(n 为电子层序数)的是( )。
A.Ne 、Ar B.Al 3+、S 2-C.F -、Na +D.Ne 、Cl -9.下列粒子中,各电子层电子数都达到2n 2(n 为电子层序数)的是( )。
A.Ne 、ArB.Al 3+、S 2-C.F -、Na +D.Ne 、Cl -10.溴原子结构示意图如右下图,下列有关说法错误的是( )A .溴是非金属元素B .溴原子易失电子C .溴的核电荷数为35D .溴化镁的化学式为MgBr 211.已知R 2-的核内有n 个中子,R 原子的质量数为M ,则m g R 2-含有电子的物质的量为( ) A .m (M -n )M mol B .M -n -2Mm mol C .m (M -n -2)Mmol D .m (M -n +2)Mmol 12.原子序数为1~18的三种元素X 、Y 、Z ,已知X 元素的原子最外层只有一个电子;Y 元素原子的M 电子层上的电子数是它K 层和L 层电子总数的一半;Z 元素原子的L 电子层上电子数比Y 元素原子的L 电子层上电子数少2个。
原子的构成练习题
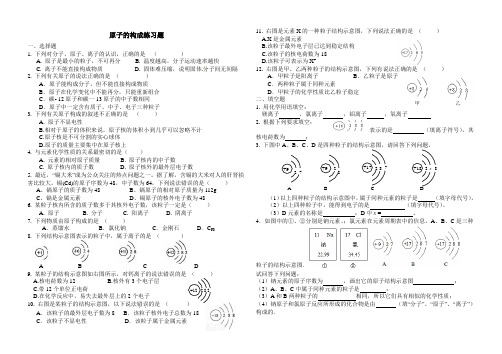
原子的构成练习题一、选择题 1. 下列对分子、原子、离子的认识,正确的是 ( ) A. 原子是最小的粒子,不可再分 B. 温度越高,分子运动速率越快 C. 离子不能直接构成物质 D. 固体难压缩,说明固体分子间无间隔 2. 下列有关原子的说法正确的是 ( ) A .原子能构成分子,但不能直接构成物质 B .原子在化学变化中不能再分,只能重新组合 C .碳- 12原子和碳一13原子的中子数相同 D .原子中一定含有质子、中子、电子三种粒子 3. 下列有关原子构成的叙述不正确的是 ( ) A. 原子不显电性 B.相对于原子的体积来说,原子核的体积小到几乎可以忽略不计 C.原子核是不可分割的实心球体 D.原子的质量主要集中在原子核上 4. 与元素化学性质的关系最密切的是( ) A. 元素的相对原子质量 B. 原子核内的中子数 C. 原子核内的质子数 D. 原子核外的最外层电子数 5. 最近,“镉大米”成为公众关注的热点问题之一。
据了解,含镉的大米对人的肝肾损害比较大。
镉(Cd)的原子序数为48,中子数为64,下列说法错误的是( ) A 、镉原子的质子数为48 B 、镉原子的相对原子质量为112g C 、镉是金属元素 D 、镉原子的核外电子数为48 6. 某粒子核内所含的质子数多于其核外电子数,该粒子一定是( ) A. 原子 B. 分子 C. 阳离子 D. 阴离子 7. 下列物质由原子构成的是 ( ) A .蒸馏水 B .氯化钠 C .金刚石 D .C 60 8. 下列结构示意图表示的粒子中,属于离子的是 ( )A B C D9. 某粒子的结构示意图如右图所示,对钙离子的说法错误的是A.核电荷数为12B.核外有3个电子层C.带12个单位正电荷D.在化学反应中,易失去最外层上的2个电子 10. 右图是某粒子的结构示意图,以下说法错误..的是 ( A .该粒子的最外层电子数为8 B .该粒子核外电子总数为18C .该粒子不显电性D .该粒子属于金属元素11. 右图是元素X 的一种粒子结构示意图,下列说法正确的是 ( ) A.X 是金属元素B.该粒子最外电子层已达到稳定结构C.该粒子的核电荷数为18D.该粒子可表示为X + 12. 右图是甲、乙两种粒子的结构示意图,下列有说法正确的是 ( ) A .甲粒子是阳离子 B .乙粒子是原子 C .两种粒子属于同种元素 D .甲粒子的化学性质比乙粒子稳定 二、填空题1. 用化学用语填空: 镁离子 ,氯离子 ,铝离子 ,氧离子2. 根据下列要求填空: 表示的是 (填离子符号),其 核电荷数为 ;3. 下图中A 、B 、C 、D(1)以上四种粒子的结构示意图中,属于同种元素的粒子是 (填字母代号)。
原子的构成习题

原子的构成习题(总3页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--1.原子的质量主要集中在( )。
A.质子B.中子C.电子D.原子核2.下列关于原子核的叙述中,正确的是( )。
①通常由中子和电子构成②通常由质子和中子构成③带负电荷④不显电性⑤不能再分⑥体积大约相当于原子⑦质量大约相当于原子A.①⑤B.②⑦C.③④D.②⑥⑦3.下列叙述中,正确的是( )。
A.相对原子质量就是原子质量的简称B.相对原子质量可用千克或克作单位C.相对原子质量是一个没有单位的比值D.原子质量约等于原子核内质子质量和中子质量之和4.下列粒子中带正电荷的是。
(填序号)①电子②质子③中子④原子核⑤原子⑥分子5.下列叙述中错误的是()。
①原子是化学变化中的最小粒子②原子是不能再分的粒子③一切物质都是由原子直接构成的④一切原子核都是由质子和中子构成的⑤原子不显电性⑥原子之间有间隔A.①和②B.②③和④C.③和⑤D.③和⑥6.有两种不同的原子,一种原子核内有6个中子和6个质子另一种原子有7个中子和6个质子,则它们不相等的是()。
A.核电荷数B.核外电子数C.原子的质量D.相对原子质量7.已知核内有6个质子和6个中子的碳原子的质量为m kg,一个钼原子的质量为8mkg,则钼的相对原子质量为()。
A.96B.72C.48D.368.据中央电视台2001年6月对云南抚仙湖湖底古城考古的现场报道,考古学家通过测定古生物遗骸中的碳14原子的含量来推测古生物的年代。
碳14原子的质子数是6,相对原子质量是14,下列有关碳14原子的叙述正确的是()A.其核外有8个电子B.其核内有6个中子C.核电荷数为6D.质子数和中子数之和为149.一个碳原子(原子核内有6个质子和6个中子)的质量是5.4mkg,R原子的相对原子质量是n/3,则一个R原子的质量应是。
10.已知一个碳12原子的质量为1.993×10-26 kg,一个氧原子的质量为2.657×10-26 kg,求氧原子的相对原子质量。
原子的构成练习题

原子的构成练习题一、选择题;1、在化学变化中可分的微粒是()A、原子B、分子C、质子D、电子2、下列关于原子的叙述,错误的是()A、能构成物质,也能构成分子B、一定含有质子、中子和电子C、原子不显电性D、是比分子小的粒子3、下列说法正确的是()A、在化学反应中,发生改变的只是原子核外的电子,而原子核没有改变B、在化学反应中,金属元素的原子容易失去电子变为带正电荷的阴离子C、在化学反应中,氯原子易失去1个电子,形成带1个单位负电荷的氯离子D、原子失去电子或得到电子后,一定会变成离子4、钠原子由11个质子和12个中子构成,下列说法错误的是()A、钠原子核所带电荷数为11B、钠的相对原子质量为23gC、钠原子核外电子数为11D、钠的相对原子质量为235、原子中,一定含有的微粒是()A、质子、中子、电子B、质子、中子C、中子、电子D、质子、电子6、碳的相对原子质量为()A、1.66×10-27kgB、 1.993×10-26kgC、12 kgD、127、构成氯化钠的粒子是()A、氯化钠分子B、钠原子和氯原子C、钠离子和氯离子D、氯化钠离子8、已知镁原子核内质子数为12,而且质子数与中子数相等,则该原子核内所含粒子总数为()A、12B、24C、36D、 489、下列关于原子核的叙述:①通常是由中子和电子构成②通常是由质子和中子构成③带正电荷④不显电性⑤不能再分⑥跟原子比较体积很小,但却集中了原子的主要质量。
其中正确的是()A、①③⑥B、②③⑥C、②③⑤D、①④⑥10、某原子中共有34个粒子,其中12个粒子不带电,则它的相对原子质量约为()A、34B、46C、23D、1211、某元素一个单位负电荷的阴离子结构示意图为,则x、y的值分别为()A、18和8B、17和8C、19和8D、14和412、某种氧原子的原子核内有8个质子和8个中子,另一种氧原子的原子核内有8个质子和10个中子,则这两种氧原子中不同的是()A、核电荷数B、核外电子数C、原子的质量D、原子的带电量13、美国“9.11事件”发生以后,美国政府扬言要用中子弹攻击恐怖分子,中子弹爆炸是()A、分子分解成原子B、原子得失电子C、原子核破裂D、中子运动或变化14、根据下列原子结构示意图判断,化学性质最稳定的是()15、根据粒子结构示意图:下列判断正确的是()A、它们都带有电荷B、它们原子的核外电子数相同C、它们都具有稳定结构D、它们表示同一种元素16、下列各组粒子的结构示意图中所表示的元素的化学性质相似的一组是()17、某粒子的结构示意图为,则它所带电荷数可能是()A、8-nB、n-8C、10-nD、n-1018、已知原子核内有6个质子和6个中子的碳原子质量为a克,若另一种原子的质量为b 克,则另一种原子的相对原子质量为()A、a/bB、b/aC、12b/aD、12a/b19、已知一种锶原子的相对原子质量为88,其质子数为38,则这种锶原子的核外电子数为()A、38B、50C、88D、12620、居里夫妇在1898年从几吨铀盐废料中提炼0.3%镭。
新人教版九年级(上)《4.1 原子的构成》同步练习卷(重庆市涪陵十九中)(2)

新人教版九年级上册《4.1 原子的构成》同步练习卷(重庆市涪陵十九中)(2)一、填空题(共5小题,每小题3分,满分15分)1.(3分)原子很小,原子核更小,电子在原子核外很大的空间里作的运动.科学研究表明,在含有多个电子的原子中,核外电子具有不同的,离核近的电子,离核越远,电子.2.(3分)核外电子的分层运动又叫做.到目前为止,人们发现元素原子核外电子的排布中,最少的只有层,最多的有层.最外层电子数最多不超过个(只有1层的,电子不超过个).3.(3分)原子结构示意图表示的意义:以镁原子为例:表示镁原子的核电荷数(质子数)为,核外共有个电子层,第一层上有个电子,最外层上有个电子。
4.(3分)稀有气体的原子最外层有个电子(氦为个电子),是一种的结构,氦、氩等化学性质比较;钠、镁等金属的原子最外层电子数一般都于4个,在化学反应中易电子;氯、氧等非金属原子的最外层电子数一般都4个,在化学反应中易电子,都趋于达到的结构.5.(3分)叫做离子,原子失去电子会带上电,叫做离子,原子得到电子会带上电,叫做离子.像氯化钠这种由阴、阳离子相互作用形成的化合物叫做离子化合物.二、基础训练6.(3分)某原子的结构示意图为:,下列说法正确的是()A.该原子中所含的质子数为16B.该原子属于金属元素的原子C.该原子属于非金属元素的原子D.该原子的核外电子数为67.(3分)根据钠原子结构示意图不能确定的是()A.质子数B.电子层数C.相对原子质量D.元素种类8.(3分)下列陈述不正确的是()A.分子可以分解成原子B.原子由原子核和电子构成C.阳离子得到电子变成原子D.原子失去电子变成阴离子9.(3分)某元素负二价阴离子的结构示意图为,则该元素原子所含的质子数为()A.6B.8C.10D.1210.(3分)下表列出了一些生活中常见元素的原子结构示意图。
下列叙述错误的是()A.上表中,8种元素原子的核外电子层数相同B.S、Cl、Ar的原子在化学反应中都易得到电子,形成带负电荷的阴离子C.上表中,非金属元素原子的最外层电子数都大于4个D.从Na到Ar,随着核电荷数的递增,原子核外最外层电子数从1个递增到8个三、能力训练11.(3分)据科学家预测,月球的土壤中吸附着百万吨的氦(He﹣3),其原子核中质子数为2、中子数为1,每百吨氦(He﹣3)核聚变所释放出的能量相当于目前人类一年消耗的能量。
原子的构成习题精选及答案

原子的构成习题精选及答案一、选择题1、原子和分子的区别是:( )A、分子在化学反应中分成原子,但在化学反应中原子不可再分B、分子一定比原子大C、分子能构成物质,而原子只能构成分子D、在化学反应中分子和原子都可以变成另一种分子和原子,区别在于它们发生的是不同的变化2、已知一个质子数和中子数都是6的碳原子的质量是千克,则一个氧原子的质量是:( )A、16克B、16C、千克D、千克3、在原子中,质子数等于:( )A、中子数B、核外电子总数C、相对原子质量D、中子数和电子数之和4、下列原子各1克,所含原子个数最多的是:( )A、氧原子B、铁原子C、氢原子D、氯原子5、一滴水能分成许许多多个水分子,分子又可分成原子,原子又由中子、质子、电子等构成,这些微粒中,一定能保持水的化学性质的是()。
A、水分子B、构成水分子的原子C、中子和质子D、电子6、原子和分子的根本区别是()A、是否能直接构成物质B、是否能保持物质的化学性质C、是否在化学反应中发生种类的变化D、是否能构成单质7、下列关于原子的说法错误的是()A、原子是化学变化中的最小微粒B、原子是最小的微粒C、原子核带正电荷,但原子不显电性D、分子能直接构成物质而原子不能8、原子中决定相对原子质量大小的是()A、质子数和中子数B、质子数和电子数C、中子数和电子数D、核电荷数和电子数9、下列各种原子各1克,所含原子个数最多的是()A、氧原子B、铁原子C、氢原子D、氯原子10、下列各式中,表示两个氢原子的是()A、2HB、C、D、11、碳的原子量是()A、12克B、12C、千克D、1/12克12、在原子中()A、质子数一定等于中子数B、质子数一定等于电子数C、质子数、中子数、电子数三者都相等D、原子核所带电量跟核外电子的电量相等13、下列关于原子的叙述正确的是()A、物质都是由原子直接构成的B、原子是由质子和电子构成的C、原子是由质子和中子构成的D、原子是由原子核和核外电子构成的二、填空题1、硫原子的相对原子质量(原子量)为32,质子数是16,则中子数是______,电子数是______,核电荷数是______。
最新-九年级化学上册 第四单元一原子的构成练习题 人教新课标版 精品
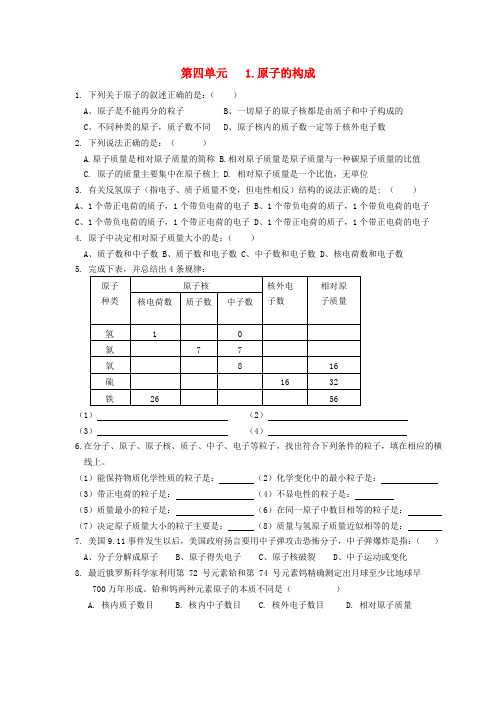
第四单元 1.原子的构成1. 下列关于原子的叙述正确的是:()A、原子是不能再分的粒子B、一切原子的原子核都是由质子和中子构成的C、不同种类的原子,质子数不同D、原子核内的质子数一定等于核外电子数2. 下列说法正确的是:()A.原子质量是相对原子质量的简称B.相对原子质量是原子质量与一种碳原子质量的比值C. 原子的质量主要集中在原子核上D. 相对原子质量是一个比值,无单位3. 有关反氢原子(指电子、质子质量不变,但电性相反)结构的说法正确的是: ()A、1个带正电荷的质子,1个带负电荷的电子B、1个带负电荷的质子,1个带负电荷的电子C、1个带负电荷的质子,1个带正电荷的电子D、1个带正电荷的质子,1个带正电荷的电子4. 原子中决定相对原子质量大小的是:()A、质子数和中子数B、质子数和电子数C、中子数和电子数D、核电荷数和电子数(1)(2)(3)(4)6.在分子、原子、原子核、质子、中子、电子等粒子,找出符合下列条件的粒子,填在相应的横线上。
(1)能保持物质化学性质的粒子是:(2)化学变化中的最小粒子是:(3)带正电荷的粒子是:(4)不显电性的粒子是:(5)质量最小的粒子是:(6)在同一原子中数目相等的粒子是:(7)决定原子质量大小的粒子主要是:(8)质量与氢原子质量近似相等的是:7. 美国9.11事件发生以后,美国政府扬言要用中子弹攻击恐怖分子,中子弹爆炸是指:()A、分子分解成原子B、原子得失电子C、原子核破裂D、中子运动或变化8. 最近俄罗斯科学家利用第72号元素铪和第74号元素钨精确测定出月球至少比地球早700万年形成。
铪和钨两种元素原子的本质不同是()A. 核内质子数目B. 核内中子数目C. 核外电子数目D. 相对原子质量9.1911年著名物理学家卢瑟福为探索原子的内部结构进行了实验。
在用一束带正电的、质量比电子大得多的高速运动的α粒子轰击金箔时发现: (1)大多数α粒子能穿透金箔而不改变原来的运动方向;(2)一小部分α粒子改变了原来的运动方向;(3)有极少部分α粒子被弹了回来。
初三化学《原子的构成》拓展练习

《原子的构成》拓展练习一:原子的结构1、原子是由居于原子中心带电的和核外带电的构成的,原子核一般是由、构成的,质子带,中子,原子的质量主要集中在上。
2、由于所带电量和核外所带的电量,但电性,因此整个原子不显电性。
原子核所带的正电荷数称为,在原子里核电荷数=数=数。
3、原子是构成物质的一种基本粒子,具有以下性质:(1)原子的质量和体积;(2)原子之间存在和;(3)原子在不断。
二:原子中的电子1、在多电子的原子里,核外电子的能量是不同的。
能量___的离核较近,能量___的离核较远。
通常把电子在离核远近不同的区域运动称为电子的。
2、原子的核外电子分层排布可用表示。
在画原子结构示意图的时候,第一层上最多排布个电子,排满后再排第二层,第二层上最多排布个电子,排满后剩下的电子排在第三层(只适用质子数从1~18的原子)。
3、原子结构示意图的意义:圆圈和圈内的数字表示和,弧线表示,弧线上面的数字表示该层的。
4、在化学反应中,是不变的,发生改变的只是原子核外的。
5、金属原子最外层电子数一般个,在化学反应中易电子;非金属原子最外层电子数一般个,在化学反应中容易电子;稀有气体的原子最外层都有个电子(氦除外,是个),一般不易得、失电子。
6、原子得、失电子后会形成。
离子分为:带的(核内质子数大于电子数)和带的(核内质子数小于电子数);常见的离子如:钠离子:(符号)、氯离子:(符号)。
三:相对原子质量1、公式:相对原子质量=2、相对原子质量= 数+ 数。
针对练习1.与原子的化学性质关系最密切的是()A.核内质子数B.核内电子数C.电子层数D.最外层电子数2.下列说法不正确的是()A.在多个电子的原子里,电子是分层排布的B.具有稳定结构的粒子一定是稀有气体原子的原子C.非金属原子的最外电子层上电子一般多于4个D.原子结构示意图可简明、方便地来表示原子的结构3..铝原子失去三个电子后,发生变化的是()A.相对原子质量B.中子数C.质子数D.电子层数4. Al3+右上角的数字表示的确切意义是()A.铝原子最外层有3个电子B.铝原子有3个电子层C.铝离子带3个单位正电荷D.3个铝离子5. 1个氢原子由一个质子和一个电子构成,不含中子,当一个氢原子失去1个电子后,它不会变成()A.质子B.原子核C.阳离子D.带负电的离子6. 原子变成离子,一定发生变化的是()A.核外电子的排布B.原子的核电荷数C.相对原子质量D.电子层数7.一种离子变成原子,下列叙述正确的是()A.一定失去电子B.一定得到电子C.得失电子都有可能D.既不能得到电子,也不能失去电子8. 某原子结构示意图,有关说法错误的是()A.原子的核内质子数为16B.原子的核外有3个电子层C.原子的最外层电子数为6D.属于金属原子 9. 核内有19个质子和20个中子,核外有18个电子的粒子一定是( ) A.原子 B.分子C.阴离子D.阳离子 10. 原子A 和B 的核电荷数分别为10和18,它们在结构上的共同特点是( )A.核外电子总数相等 B .核内中子数相等 C.最外层电子数相等 D 原子种类相同12. 下列说法正确的是( )A.分子是保持物质性质的一种粒子B.原子是不能再分的粒子C.离子是带电荷的原子或原子团D.不同种离子的核外电子数一定不相同 13. 下列说法正确的是( )A.钠原子失去一个电子就变成稀有气体的原子B.氯原子得到一个电子后,就变成了与氩原子核外电子排布相同的阴离子C.两种离子,核外电子排布相同,化学性质一定相同D.原子最外层电子数少于4个的原子,一定是金属原子14. 某粒子X 3+核外有23个电子,核内有30个中子,则该原子的核内质子数为( )A .23B .26C .30D .5615. 关于Fe 、Fe 2+、Fe 3+三种粒子,下列判断错误的是( )A .它们质子数相同B .它们核外电子数不同C .它们三者质量几乎相等D .三者都是稳定结构16.某粒子第二电子层上有8个电子,则该粒子( )A .一定是稀有气体的原子B .一定是已达到稳定结构的阴离子C .一定有10个质子D .以上说法都不对17. 已知M 2-离子核外有n 个电子,则该原子核内质子数为( )A.nB.n -2C.n +2D.2-n18. 下列有关说法中,正确的是( )A .原子不显电性,是因为原子中不存在带点的粒子B .水通电产生氢气和氧气,说明水中含有氢分子和氧分子C .在化学反应中,反应前后的原子的种类没有改变,数目没有增减D .不同元素最本质的区别在是相对原子质量不同19.下列叙述错误的是( )A .分子、原子和离子都能直接构成物质B .原子中原子核与核外电子的电量相等,电性相反,所以整个原子不显电性C .决定原子质量大小的主要是质子和电子D .原子如果得到或失去电子就变成离子20.下列粒子结构示意图中,表示阴离子的是( ) A B C D 21.根据右表判断,下列说法正确的是( )A.铝的相对原子质量是13B.钠离子核外有三个电子层C.第二、三周期元素的原子从左至右最外层电子数逐渐增多D.在化学变化中镁元素容易失去最外层2个电子形成镁离子22.下列变化能证明分子可以再分的是( )A.水蒸发B.石蜡熔化C.干冰升华D.水通电分解23.化学上常用元素符号左下角的数字表示原子的质子数,左上角的数字表示原子的中子数与质子数之和,如613C 表示核内有6个质子和7个中子的碳原子。
原子的构成典型例题

原子的构成典型例题例1 下列是对原子的叙述(1)原子是最小的粒子(2)原子核都是由质子和中子构成的(3)原子不显电性(4)原子都在不停运动着说法正确的是()A.(1)B.(3)C.(2)D.(3)和(4)选题目的:考察学生对原子及原子构成知识是否真正理解思路分析:原子是化学变化中的最小粒子。
但原子还可再分,科学实验证明,原子是由居于原子中心的带正电的原子核和核外带负电的电子构成的。
由于原子核所带电量和核外电子所带电量相等,但电性相反所以原子不显电性。
因此答案(3)正确。
原子核内一定含有质子,但不是任何原子的原子核内都含有中子。
如一种氢原子的核内只有一个质子,而不含中子。
原子和分子一样,不是静止不动的。
答案(4)正确解答:D启示:对于知识要掌握准确,不能模棱两可。
例2 某原子的实际质量是一种碳原子实际质量1/12的24倍,则该原子的相对原子质量是()A.1/12B.24C.48D.12选题目的:考察学生对相对原子质量是否真正理解思路分析:原子很小,原子的实际质量也很小。
在实际应用中,如果使用原子的实际质量,书写、记忆都很不方便。
因此,在国际上不直接使用原子的实际质量,而采用原子的相对质量—相对原子质量。
相对原子质量是:以一种碳原子质量的1/12作为标准其它原子质量和它相比所得的数值就是该种原子的相对原子质量。
实际上相对原子质量就是:某原子的实际质量是碳原子实际质量1/12的多少倍,有多少倍相对原子质量就是多少。
解答: B启示:对于知识要能从多角度理解。
例3 某原子的相对原子质量为12,核外电子数为6,则此原子中原子核内的中子数为()A.6B.2C.12D.18选题目的:考察学生分析及灵活运用知识的能力思路分析:在原子中,质子和中子的质量大约相等,且都约等于一种碳原子质量的1/12,而电子的质量很小,可以忽略不计,原子的质量主要集中在原子核上,所以相对原子质量≈质子数+中子数,而题目中有的是电子数,根据原子不显电性可知:核电荷数=质子数=核外电子数则中子数为6解答:A启示:对于知识要能建立起联系。
九年级化学上册41原子的构成知识点课标 试题

第四单元 物质构成的奥秘课题1 原 子考试要求:知道原子是由原子核和电子构成的 考点一、原子的构成〔1〕原子构造的认识〔2〕在原子中由于原子核带正电,带的正电荷数〔即核电荷数〕与核外电子带的负电荷数〔数值上等于核外电子数〕相等,电性相反,所以原子不显电性因此: 核电荷数 = 质子数 = 核外电子数〔3〕原子的质量主要集中在原子核上注意:①原子中质子数不一定等于中子数②并不是所有原子的原子核中都有中子。
例如:氢原子核中无中子2、相对原子质量:⑴ ⑵相对原子质量与原子核内微粒的关系:相对原子质量 = 质子数 + 中子数励志赠言经典语录精选句;挥动**,放飞梦想。
厚积薄发,一鸣惊人。
关于努力学习的语录。
自古以来就有许多文人留下如头悬梁锥刺股的经典的,而近代又有哪些经典的高中励志赠言出现呢?小编筛选了高中励志赠言句经典语录,看看是否有些帮助吧。
相对原子质量=好男儿踌躇满志,你将如愿;真巾帼灿烂扬眉,我要成功。
含泪播种的人一定能含笑收获。
贵在坚持、难在坚持、成在坚持。
功崇惟志,业广为勤。
耕耘今天,收获明天。
成功,要靠辛勤与汗水,也要靠技巧与方法。
常说口里顺,常做手不笨。
不要自卑,你不比别人笨。
不要自满,别人不比你笨。
高三某班,青春无限,超越梦想,勇于争先。
敢闯敢拼,**协力,争创佳绩。
丰富学校体育内涵,共建时代校园文化。
奋勇冲击,永争第一。
奋斗冲刺,誓要蟾宫折桂;全心拼搏,定能金榜题名。
放心去飞,勇敢去追,追一切我们为完成的梦。
翻手为云,覆手为雨。
二人同心,其利断金。
短暂辛苦,终身幸福。
东隅已逝,桑榆非晚。
登高山,以知天之高;临深溪,以明地之厚。
大智若愚,大巧若拙。
聪明出于勤奋,天才在于积累。
把握机遇,心想事成。
奥运精神,永驻我心。
“想”要壮志凌云,“干”要脚踏实地。
**燃烧希望,励志赢来成功。
楚汉名城,喜迎城运盛会,三湘四水,欢聚体坛精英。
乘风破浪会有时,直挂云帆济沧海。
不学习,如何养活你的众多女人。
不为失败找理由,要为成功想办法。
原子的构成习题

原子习题一、填空题1.在分子、原子、原子核、质子、中子、电子等粒子中,找出切合以下条件的粒子填在相应的横线上:(1)能保持物质化学性质的粒子是 ________。
(2)化学变化中的最小粒子是 ________。
(3)带正电荷的粒子是 ________。
(4)不显电性的粒子是 ________。
( 5)质量最小的粒子是 ________。
(6)在同一原子中数量相等的粒子是 ________。
(7)决定原子质量大小的粒子主假如 ________。
2.已知每个电子的质量约为每个质子(或中子)质量的 1/1836,因此在科学上计算原子的质量时只计算质子和中子的质量,电子质量忽视不计,下表是部分原子的组成指数。
原子种类质子数中子数核外电子数相对原子质量氢1011碳66612氧88816钠11121123铁26302656经过此表,可总结出“在原子里质子数等于电子数”。
还可以总结出:( 1)。
( 2)。
( 3)。
二、选择题1.某些花岗岩石材中含有放射性元素氡。
一种氡原子的质子数为86,中子数为136,这类氡原子核外电子数为()2.以下说法正确的选项是()A. 原子不可以再分B.原子核都是由质子和中子组成的C.相对原子质量不过一个比,没有单位D.原子能够组成分子,也能够直接组成物质3.有两种原子,一种原子核内有 17 个质子和 18 其中子,另一种原子核内有 17 个质子和 19 其中子,则它们不相等的是()A. 核电荷数B.核外电子数C.原子质量D.原子的带电荷量。
4.1 原子结构 练习【新教材】人教版(2019)高中化学必修一

第四章原子结构元素周期律4.1 原子结构与元素周期表基础知识点练习知识点1 原子结构1.(2020·陕西榆阳·榆林十二中高一月考)下列说法正确的是()A.质子数相同的粒子一定是同种元素的原子B.同种元素的原子质子数一定相同C.所有的原子都是由质子、中子、电子构成D.有氧气参加的反应叫做氧化反应答案B2.某元素的离子A m-核内有n个中子,核外有x个电子。
该原子的质量数是()。
A.x-m+nB.x+m+nC.m+n-xD.x-n+m答案 A3.原子核外电子是分层排布的,下列关于L层与M层的比较不正确的是()。
A.L层离核比M层离核近B.M层上电子所具有的能量高于L层上的电子C.当L层上的电子数为奇数时,M层上不可能有电子D.当L层上的电子数为偶数时,M层上一定有电子答案D,则该元素的符号是()。
4.某元素的原子核外有三个电子层,M层的电子数是L层电子数的14A.LiB.MgC.AlD.Si答案B5.下列粒子中,各电子层电子数都达到2n2(n为电子层序数)的是()。
A.Ne、ArB.Al3+、S2-C.F-、Na+D.Ne、Cl-答案C知识点2 元素周期表6.下列关于元素周期表的说法不正确的是()A.编制第一张元素周期表的是俄国化学家门捷列夫B.门捷列夫编制元素周期表的排序依据是原子的核电荷数C.门捷列夫编制元素周期表的排序依据是相对原子质量D.元素周期表揭示了化学元素间的内在规律答案B7.下列说法中正确的是( )A.元素的原子序数越大,其在周期表中所在族序数越大B.元素在周期表中的周期数等于其原子的核外电子层数C.原子的最外层电子数为2的元素为第ⅡA族元素D.元素在周期表中的族序数等于其原子核外最外层电子数答案B8.元素周期表共有18个纵列,下列有关元素周期表的说法错误的是()A.第3列含有的元素种类最多B.第14列元素所形成的化合物种类最多C.第2列到第12列都是金属元素D.最高价为+7的元素均在第17列答案D9.在元素周期表中,第三、四、五、六周期元素的数目分别是()A.8、18、32、32B.8、18、18、32C.8、18、18、18D.8、18、18、18答案B10.在元素周期表中前四周期的五种元素的位置关系如图所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4.1 原子的构成习题
一、选择题
1.原子的质量主要集中在()
A.质子
B.中子
C.电子
D.原子核
2.下列叙述中错误的是()
①原子是化学变化中的最小粒子②原子是不能再分的粒子③一切物质都是由原子直接构成的④一切原子核都是由质子和中子构成的⑤原子不显电性⑥原子之间有间隔
A.①和②
B.②③和④
C.③和⑤
D.③和⑥
3.已知一个质子数和中子数都是6的碳原子的质量是千克,氧原子的相对原子质量是16,则一个氧原子的质量是()
A.16克 B.16
C.千克 D.千克
4.在原子中,质子数等于()
A.中子数B.核外电子总数C.相对原子质量 D.中子数和电子数之和
5.一滴水能分成许许多多个水分子,分子又可分成原子,原子又由中子、质子、电子等构成,这些微粒中,一定能保持水的化学性质的是()
A.水分子 B.构成水分子的原子 C.中子和质子 D.电子
6.下列关于原子的说法错误的是()
A.原子是化学变化中的最小微粒 B.原子是最小的微粒
C.原子核带正电荷,但原子不显电性D.分子能直接构成物质而原子不能
7.原子中决定相对原子质量大小的是()
A.质子数和中子数 B.质子数和电子数 C.中子数和电子数 D.核电荷数和电子数
8.碳的相对原子质量是()
A.12克
B.12 C.千克 D.1/12克
9.在原子中()
A.质子数一定等于中子数B.质子数一定等于电子数
C.质子数、中子数、电子数三者都相等D.原子核所带电荷数跟核外电子的电荷数相等
10.下列关于原子的叙述正确的是()
A.物质都是由原子直接构成的 B.任何一种原子都含有质子、中子和电子
C.原子是由质子和中子构成的 D.原子是由原子核和核外电子构成的
11.美国铱星公司原计划发射77颗卫星以实现卫星通讯,发射卫星的数目与铱元素的原子核外电子数目恰好相等。
下列关于铱元素的各种说法中正确的是()
A.铱原子的质子数为70 B.铱原子的相对原子质量为77
C.铱原子的核电荷数为77 D.铱原子是金属原子
12.绝大多数原子的原子核中含有()
A.质子、中子、电子 B.质子、电子 C.中子、电子 D.质子、中子
13.由我国著名科学家、中国科学院院士张青莲教授主持测定了铟、铱、锑、铕等几种元素的相对原子质量新值,其中他测定核电荷数为63的铕元素的相对原子质量的新值为152。
则下列说法正确的是()
A.铕元素的原子质子数为63 B.铕元素的原子中子数为63
C.铕元素的原子核外电子数为152 D.铕元素的原子的质量为152
14.科学家用单个分子制成了“纳米车”(如右图),它能在人工操纵下运输药物分子到病源处释放以杀死癌细胞。
下列有关“纳米车”的说法正确的是()
A.“纳米车”的研制成功说明分子要在人为外力作用下才能运动
B.“纳米车”分子不是由原子构成的
C.“纳米车”运输药物分子的过程是肉眼可以直接看见的
D.“纳米车”研制成功说明在一定条件下人可以控制分子运动
二、填空题
15.原子是由居于原子中心的带电荷的和核外带电荷的构成的,由于与相等,所以整个原子不显电性。
16.一般原子的原子核是由和构成的。
17.原子的质量很小,使用、记忆不方便。
国际上一般采用表示原子的质量。
即以为标准,其他跟它(标准)相比较所得到的比。
18.科学家测定:一个质子和一个中子的质量大约相等,跟相对原子质量标准比较,均约等于。
跟质子、中子相比,电子的质量很(大或小),因此原子的质量主要集中在上。
19.硫原子的相对原子质量(原子量)为32,质子数是16,则中子数是______,电子数是
______,核电荷数是______。
20.铁是由______构成;水由___ ___构成;二氧化碳分子由____ _ _构成;氧分子由___ ___构成;氩气由_____ _构成。
三、计算题
21.一个铁原子质量是千克,一个碳12原子质量是千克,问铁原
子的相对原子质量是多少?。
