7-纠正措施与预防措施CAPA(英)
CAPA纠正措施与预防措施

第四步 规划、实施CAPA
2. 实施CAPA计划 • 受控、按计划实施 • CAPA推迟、实施中
带来的风险及时报告 和管理
第一步 确认执行 CAPA流程
第二步 初步确定
CAPA
第三步 确定、评估 、同意方案
第四步 规划/实施
CAPA
第五步 关闭CAPA
决策点1
关键决策点1 •评估潜在的CAPA;决定执 行CAPA程序
– 事件影响范围, 如:经营
– 制定CA?PA?还是 CAPA?
– 是独立事件?过去 已采取CAPA,又重 复发生过?
– 事件根本原因
– 基于风险评估,事 件严重性
第一步 确认执行 CAPA流程
第二步 初步确定
CAPA
第三步 确定、评估 、同意方案
第四步 规划/实施
CAPA
第五步 关闭CAPA
决策点1
• 实施纠正和预防措施应有文件记录,并由质量管理部门保存。
CAPA适用于产品生命周期 - 设计/开发/生产/控制/供应
CAPA
不适用于:矫正措施,已经采取的立即纠正的行动
定义
• 矫正措施(Remedial action):采取行 动立即消除已发现的质量和不符合或其它 不期望的现象。
• 纠正行动:消除已发现的不符合和其它不 期望现象的根源所采取的行动,防止重复 出现(recurrence) 。
的影响的评估,各个子CAPA完成日期的更新 –避免整体CAPA完成日期的超出
建立CAPA跟踪系统
• CAPA来源 • CAPA特定编号 • 问题描述 • CAPA描述,部门,协调人 • 设定结束日期,延期日期,实际结束日期,
CAPA目前状态,CAPA上报级别
纠正和预防措施标准管理规程SMP for Corrective and Preventive Actions中英文双译
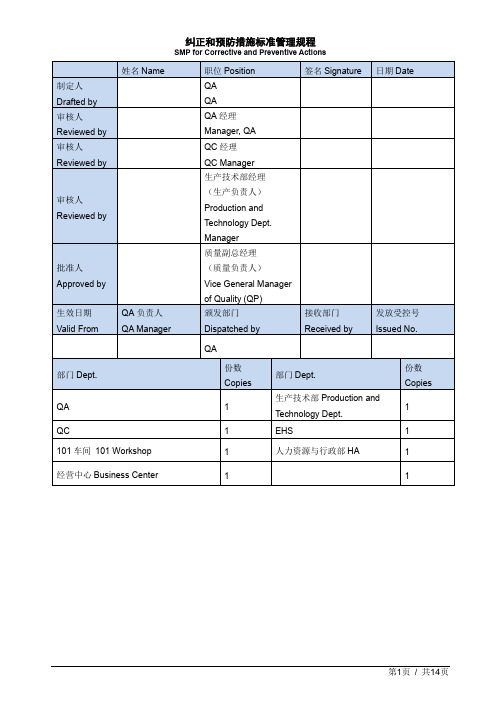
1.目的Purpose本文件规定企业纠正预防措施系统(CAPA)如何建立,通过对纠正措施的制订和实施进行有效的控制,消除产生问题的实际原因,防止再次发生不合格/不符合,以达到持续改进的目的。
This document defines how the company creates CAPA system and then effectively controls it by making and implementing corrective and active actions to eliminate the real reasons of problem, prevent against disqualification and non-compliance and reach the goal of continuous improvement.2.适用范围Scope本文件适用于全公司所有部门和场所对有关产品、过程及质量管理体系纠正和预防措施的控制。
This document applies to the control of corrective and preventive actions regarding products, process and quality management system .3.职责Responsibility3.1.责任部门为CAPA的发起人。
发起人负责发起CAPA,填写CAPA来源,描述事件,识别根本原因,写出采取的纠正与预防措施,预计的时限,CAPA人员的姓名并获得责任部门负责人的批准。
Responsible department is the initiator of CAPA. Initiator is responsible to raise CAPA, write the source of CAPA, description of incident, Identify the root cause, write CAPA to be taken, write estimated timeline, write the responsible person’s name for CAPA completion and take approval from the head of the responsible department.3.2.CAPA责任人负责CAPA的延期申请并在措施完成后通知QA。
医疗器械纠正预防措施CAPA详解

医疗器械纠正预防措施CAPA详解医疗器械是保障患者安全和疾病治疗效果的重要工具。
然而,器械使用过程中存在一定的风险,包括设计缺陷、制造不合格、使用错误等方面,这些问题都可能对患者造成伤害。
因此,医疗器械纠正预防措施CAPA应运而生。
一、什么是CAPA?CAPA全称为"Corrective and Preventive Actions",即纠正和预防措施。
它是一种质量管理工具,用于解决潜在和实际问题,以确保产品和服务满足需求和要求。
对于医疗器械行业来说,CAPA可以帮助企业对纠正和预防问题进行管理,提高产品质量和患者安全。
二、CAPA的重要性1. 提升产品质量:CAPA能帮助企业及时发现和解决潜在问题,改进产品或服务的设计和制造过程,提高产品质量。
2. 保障患者安全:通过CAPA,企业可以及时纠正和预防可能影响患者健康和安全的问题,降低患者风险。
3. 满足法规要求:医疗器械行业有严格的法规要求,CAPA能帮助企业确保其产品和服务符合相关法规,避免遭受处罚和法律纠纷。
4. 提高企业信誉:通过有效的CAPA实施,企业可以提高其可信度和信誉,增加患者和合作伙伴的信任,为企业的持续发展提供有力支持。
三、CAPA的步骤1. 问题定义和原因分析:首先,企业需要明确问题的性质和范围,并进行根本原因分析,找出问题发生的原因。
2. 确定纠正措施:基于问题分析的结果,企业需要制定相应的纠正措施,解决已经发生的问题。
3. 确定预防措施:除了纠正已发生的问题外,企业还需要制定预防措施,防止类似问题再次发生。
4. 实施措施:在确定措施后,企业需要将其付诸实施,确保纠正和预防措施得以落实。
5. 效果验证和记录:企业应监测实施的措施效果,确保问题得到了解决,并记录相关数据和结果。
6. 审核和审计:定期进行CAPA体系的内部审核和外部审计,确保纠正和预防措施的有效性和持续改进。
四、CAPA的案例分析以医疗器械产品销售存在的质量问题为例,我们来探讨CAPA的具体应用。
纠正与预防措施(CAPA)

02
确定根本原因
03
制定预防措施
深入调查和分析,确定导致问题 的根本原因,为制定预防措施提 供依据。
针对根本原因,制定相应的预防 措施,以降低或消除潜在问题的 发生。
预防措施的实施
培训员工
向员工传达预防措施的内容和重要性,确保员工了解 并遵循。
监督与检查
定期对预防措施的执行情况进行监督和检查,确保措 施得到有效执行。
持续改进
根据实施情况,对预防措施进行持续改进,以提高其 针对性和有效性。
预防措施的验证与确认
验证方法
01
采用适当的验证方法,如过程审计、质量抽检等,对预防措施
的有效性进行验证。
数据分析
02
收集相关数据并进行统计分析,以评估预防措施的实施效果和
CAPA对于企业来说至关重要,因为 它有助于提高产品质量、降低成本、 增强客户满意度,并增强企业的竞争 力和市场地位。
CAPA的流程与步骤
识别问题
通过质量检查、客户反馈、内部审核等途径,发现产品或过程中的不合格或潜在不 合格。
02
识别问题与根本原因
问题识别
1 3
收集数据
通过收集相关数据和信息,了解产品或过程的问题表现。
预测潜在风险
预测问题可能引发的潜在风险和后果。
制定应对措施
根据风险评估结果,制定相应的应对措施和 预案。
03
制定纠正措施
纠正措施的制定
确定问题
明确问题的性质、范围和影响, 收集相关数据和信息,以便准确 评估问题。
分析问题
对问题进行深入分析,找出问题 的根本原因,为制定纠正措施提 供依据。
纠正与预防措施(CAPA)标准管理规程
建立纠正与预防措施(CAPA )管理制度,为消除已发生的不合格或潜在的不合格的原因,采取续改进。
内容11.11.222.12.2正预防措施的效果评审。
2.3生产部及相关责任部门参与纠正预防措施的制订,负责纠正预防措施的实施。
3管理流程44.14.2原因调查和分析4.2.1当发生下列情况时,缺陷发生部门必须进行原因调查和分析。
◆用户质量投诉或同一不良质量因素再次出现时;◆因产品有不良事件或有缺陷或怀疑有缺陷而需从市场召回时;◆生产过程中发生偏差或发生重大质量事故时;◆自检过程中或外部检查出现不合格项(包括法律、法规要求)时;◆质量改进会议决定更改工艺或更改设备、设施、仪器、检验方法时;◆产品质量回顾发现不良趋势时;4.34.4行编号。
水号,从如5纠正预防措施的实施和记录5.1经评估认可的纠正预防措施,由责任部门在规定的时间内进行实施并对实施的过程进行记录。
5.2质量管理部QA在纠正预防措施的实施过程中对实施效果开展跟踪,确定其有效性和可操作性,并不断对纠正预防措施作进一步完善。
5.3质量管理部应对纠正预防措施的实施过程进行检查、监督,确保纠正预防措施的实施。
6纠正预防措施的效果评审6.1纠正预防措施完成后,由公司质量管理部对纠正预防措施的有效性进行评审,经评审确认有效的纠正和预防措施应列入日常管理中。
6.2对实施结果表明无效的纠正预防措施,应重新分析、制订新纠正预防措施。
7纠正和预防措施的级别7.1轻微缺陷项目。
7.2一般缺陷项目。
7.3严重缺陷项目。
8纠正预防措施实施完成时限8.18.28.3部门;8.499.19.2。
纠正和预防措施(CAPA)管理与实践

张三家养了一群羊,有一天一只羊跳过羊圈跑掉了,张三马上把羊找了回来。张三分析为什么羊 能够跑掉呢?得出结论是羊圈围墙太低,张三为了防止羊再次跳出羊圈跑掉,遂加高羊圈的围墙,羊 以后再也没有跑掉过。
邻居家李四也养了一群羊,李四家没有丢过羊,但李四看到张三家丢羊的事情后,也把羊圈的围 墙加高了,防止自己家的羊像张三家的羊那样越墙而出。
纠正及预防措施(CAPA)

CAPA-质量持续改进来源(Q10)
环境监测
投诉/退货 维修 校验/维护
CAPA 纠正措施与预防措施
偏差处理 稳定性数据 年度回顾
审计
物料平衡/收率
背景介绍
首先要进行补救或改正,随后要采取纠正措 施和预防措施。这个体系叫CAPA 体系(纠 正和预防措施)。
一般而言,在程序或产品出现问题时必须始 终按照CAPA 体系的方法进行管理。
法规要求
《药品生产质量管理规范》2010 修订版: 第十章 质量控制与质量保证 第六节 纠正和预防措施 第二百六十条 企业应建立纠正和预防措施系统,对
投诉、召回、偏差、自检或外部检查结果、工艺性 能和质量监测趋势等进行调查并采取纠正和预防措 施。调查的深度和形式应与风险的级别相适应。纠 正和预防措施系统采用的方法应能改进产品和工艺, 增进对产品和工艺的理解。
背景介绍
在生产、质量控制以及系统运行的过程中经 常会有不期望的情况发生,那么除了进行纠 正消除现实的危害以外,也必须采取纠正措 施和预防措施,以确保相同或类似的危害不 再发生。
背景介绍
因此,在多数情况下纠正之后要有纠正措施和预防 措施,例如在进行如下处理时: 偏差 拒收 召回 OOS 投诉 内部或外部审计检查的缺陷项 产品质量回顾 质量管理回顾 风险评估
包括:如何启动CAPA 程序、如何报告和跟踪、职责分配、合 适或如何评估CAPA 的效果、如何管理CAPA 过程中形成的文 件、何时或如何同管理层沟通等。
如前面章节所述,偏差、投诉等问题通常需要一个由质量管理 部门领导的跨职能(跨学科)团队进行调查处理,相同的团队 可以负责其后续CAPA 的管理。必要时,管理层的支持和批准 也是CAPA 所需要的。
纠正和预防措施(CAPA)管理规程完整

纠正和预防措施(CAPA)管理规程1 目的建立纠正措施和预防措施(CAPA)程序,纠正与预防不符合、潜在不符合、不期望事件的发生,确保公司持续、有效地执行GMP规范及相关法律法规,实现质量管理体系的持续改进。
2 适用范围本规程适用于生产质量管理活动中所有纠正措施和预防措施的制定、实施和控制。
3 定义3.1 纠正措施:为消除已发现的不合格或其他不期望情况的发生所采取的措施,纠正措施是针对问题的根本原因,减少或消除问题再发生的措施。
3.2 预防措施:为消除潜在不合格或其他潜在不期望情况的发生所采取的措施,采取预防措施是为了防止不合格或其他潜在不期望情况的发生。
3.3 根本原因:通过各种方法和工具,深入分析而确定问题发生的内在根本因素。
4 纠正预防措施(CAPA)的范围来源于客户投诉、产品缺陷、召回、生产偏差、实验室异常检验结果偏差、自检、外部审计(包括政府检查)、工艺性能和产品质量监测趋势、变更控制、产品年度回顾等活动中发现问题所采取的措施。
整改措施的深度和形式应与风险评估的级别相适应。
5 职责5.1 企业所有员工:(1)正确理解纠正和预防措施(CAPA)规程的要求(2)在不合格总是发生时,按要求采取适当的措施,并报告主管或直接领导5.2 生产部经理、工程部经理、物料供应部经理及车间负责人:(1)根据批准的计划,在规定期限内完成相应的整改措施。
(2)定期检查整改措施计划的进展,直到所有的整改措施均已完成并最终得到质量部的确认批准。
(3)因特殊原因,整改措施计划需要进行变更或延长时,在原计划完成日之前提出申请,并得到部门负责人、质量管理部经理的批准。
5.3 质量部:(1)负责建立和维护纠正和预防措施(CAPA)系统。
(2)批准(CAPA)的执行。
(3)批准(CAPA)的变更、包括完成期限的延长。
(4)跟踪(CAPA)实施进展情况。
(5)确保(CAPA)的合理性、有效期和充分性。
(6)保存纠正和预防措施(CAPA)的记录。
质量管理纠正与预防(CAPA)是什么?

(质量管理纠正与预防(CAPA)是什么?2020-07-03每当在制程中出现质量异常是每个质量人最头疼的事情,其实不然,做好质量纠正与预防(CAPA)就会让你轻松应对。
1. 现象调查查清事实,摸清规律,确定是人为误判还是问题真实存在,情况属实,立马启动质量异常和不符合项闭环流程。
抓起相关人员进行分析。
记住:质量人员是资源的组织者,协调者,不是问题的研究者。
2. 故障复现质量异常要能够稳定复现,对找出根因是最为关键的一步,故障问题不能复现直接影响下一步的根因分析。
3. 根因分析,故障机理明确复现问题后,从人机料法环测6个维度分析出现质量异常的根本原因,导致问题的原因有很多,但是根因只有一个。
抓住根因。
如果原因很多,就会出现多部门推诿,抓不住重点,到头来问题还是问题,影响下一步的决策。
4. 临时纠正措施的制定分析质量异常的影响范围,排查产线在制,库房存储、物料在途、计划下单。
寻找一些与质量异常有关的因素,制定纠正措施予以解决。
千万不能有遗漏,遗漏一项,问题还会再犯,这一步的关键是清查彻底。
5. 纠正措施的验证一定要有数据支撑,纠正措施的连续性要体现出来,连续跟进几批次的质量数据,用数据说话。
没有异常数据的出现,那么纠正措施已经到位,这一步就可以结束了,进入下一环节。
6. 预防措施的制定这一步是整个处理质量异常的魂,也是体现一个质量管理人员或团队的整体质量素质。
抓住资源线,协调人力物力,就是给各部门下任务的时候,制定预防措施计划,永久性规避此类问题。
水平展开查看其它产品是否也存在需要预防的情况。
质量的高级管理思想就是预防,利用质量数据做分析与监控。
到此为止,整个质量异常的闭环还没有完成,一定要监控待预防措施计划的真正执行有效才可闭环,预防措施无效,重新上会讨论,制定措施,直至闭环。
总体来说:纠正与预防的形象区别就是:亡羊补牢--纠正措施,未雨绸缪--预防措施。
纠正措施:为消除已发现的不符合或其他不期望情况的原因所采取的措施。
纠正措施与预防措施处理规程-翻译

1 目的为规范GMP运行过程产生的(潜在)不符合的处理行为,使药品生产符合法规、行业标准规定,降低产品缺陷率及偏差发生的机率,实现质量管理体系的持续改进,特制定纠正措施与预防措施(Corrective Action & Preventive Action,以下简称CAPA)的管理程序。
To regulate the incongruent processing behavior generated in the GMP, and meet the drug production in line with regulations and industry standards, and reduce product defect rate and the probability of the deviation occurrence, and realize the continuous improvement of the quality management system, we specially formulated corrective measures and prevention measures (Corrective Action & Preventive Action, hereinafter referred to as CAPA) management program.2 适用范围2.1 适用于药品GMP运行过程产生的各类(潜在)不符合的CAPA制定、实施及闭环确认。
Applies to all kinds of (potential) formulation, implementation and closed-loop confirmation which do not meet the CAPA in the GMP2.2在生产质量活动中,能够立即采取应急措施解决问题且相关批次产品质量无影响,可以不执行该程序。
纠正和预防措施控制程序(中英文)

质量管理体系程序文件QUALITY SYSTEM PROCEDURE编制Initiated by:审核Reviewed by:批准Approved by:发放范围(applied for):生效日期(Effective Date):2022年05月10日文件修改履历Document History Summary目录Ta b l e o f C o n t e n t序号名称页码Item #Title Page1 目的(Purpose) (2)2 范围(Scopes) (2)3. 定义(Definitions) (2)4 职责(Responsibilities) (2)5 工作流程(Working procedures) (3)6 相关文件(Relevant Documents) (8)7 相关记录(Relevant Records) (8)8 附件(Appendixes) (8)Document History Summary (1)1 目的(Purpose)本程序规范了为消除实际或潜在的不合格而采取纠正预防措施的流程,以确保类似或潜在不合格不再发生,促进质量管理体系的持续改进。
The procedure clarifies the process to adopt corrective and preventive action to eliminate the existing or potential non-conforming and prevent similar non-conforming in the future and promote the sustained improvement of the quality management system.2 范围(Scopes)本程序适用于本公司质量管理体系范围内纠正措施和预防措施的制定、实施与有效性验证。
The procedure is applicable to the establishment, implementation and validation of corrective and preventive action within the quality management system.3. 定义(Definitions)3.1 纠正:为消除已发现的不合格所采取的措施;Correction: Action to eliminate a detected nonconformity.3.2 纠正措施:为消除已发现的不合格或其他不期望情况的原因所采取的措施;Corrective action: Action to eliminate the cause(s) of a detected nonconformity or other undesirable situation. 3.3 预防措施:为消除潜在不合格或其他潜在不期望情况的原因所采取的措施;Preventive action: Action to eliminate the cause of a potential nonconformity or other undesirable potential4 职责(Responsibilities)4.1 质量管理体系内各部门负责将质量管理体系持续改进的机会,包括不合格情况、潜在不合格情况、改进机会反馈至QA。
偏差管理及纠正和预防措施(CAPA)的制定和实施

偏差管理及纠正和预防措施(CAPA)的制定和实施偏差调查的必要性:对在生产过程中发生的差异、难以解释的不符合产品质量要求的缺陷,采取慎重而可靠的处理是GMP质量管理制度的一个重要方面,应对此差异进行彻底调查,并对结论和改进措施进行记录和跟踪。
当发生下列事件或结果时,必须填写差异报告:1)IPC试验失败2)IPC设备异常3)生产设备或设施异常4)功能测试失败5)物料衡算和/或产率结果超标6)配方错误7)操作失误8)生产环境异常9)缺少生产记录文件10)超标结果已经确认11)纯化水供水系统12)监测结果超出规定限度13)在生产/包装区域发现昆虫14)计量仪器的校准不合格15)超出时限的维护16)一批内设备连续停止超过3小时17)—批内设备同一故障停止超过3次18)其他重大事件和结果责任:1)生产主管负责报告与生产相关的偏差;2)当监测结果超出限定范围时,实验室负责人负责提出差异报告;如纯化水或尘埃粒子数3)当计量仪器校准不合格或维护超出时间限制时,工程部主管负责提出差异报告;由工程、生产、质量经理共同进行风险评估,以确定对所生产的产品质量的影响。
4)生产部经理负责确认是否涉及注册内容,是否同意生产主管已采取的措施及需要追加的措施;5)质量部经理负责给出评估,负责给出是否需要采取更进一步措施;6)当偏差与其他部门有关时,相应部门负责人应提出处理意见。
每一份差异报告中,相关责任人必须给出下列信息:1)产品物料号和产品名称2)批号3)偏差发现者4)发现了什么偏差5)偏差发现的时间和曰期6)向主管报告偏差的时间和日期7)差异/失败的详细描述8)发生差异/失败的可能原因或解释9)差异在药物的风险性中的分类10)陈述是否影响其他批次或其他产品11)生产主管通知的人员12)通知的时间和日期13)生产是否停止14)最初采取的措施生产部经理必须给出下列信息:1)差异是否影响注册内容2)是否同意已采取的措施3)如需要,其他追加措施当涉及到工程部、釆购部或物流管理部等部门时:各部门经理必须就涉及到本部门部分的内容给出意见和相应的措施质量部经理必须给出一份综述,包括:1)差异是否影响本批产品质量2)对本批产品需要釆取的追加措施3)本批产品是否可以放行4)防止这类差异今后再次发生的措施每个差异报告“完成日期”的规定:1)正常情况下,即跟踪行动在我们的控制能力内,“完成日期”为15个日历日。
纠正与预防措施(CAPA)

精细化发展
CAPA将更加注重细节和过程控 制,通过对每个环节的精细化管 理,提升整体运营效率和质量。
国际化发展
随着全球化进程的加速,CAPA 将逐渐走向国际化,跨国公司将 在全球范围内推广和应用CAPA ,促进全球范围内的质量提升。
CAPA面临的挑战和解决方案
数据安全和隐私保护
随着信息化程度的提升,CAPA面临着数据安全和隐私保护的挑战。为解决这一问题,应 加强数据保护措施,建立完善的数据安全管理制度,确保数据的安全性和隐私性。
02
预防措施
预防措施的定义和重要性
预防措施的定义
预防措施是为防止潜在的问题或不符合项的发生而采取的措 施。
预防措施的重要性
预防措施能够减少问题的发生,提高产品质量和生产效率, 降低生产成本和客户投诉。
预防措施的步骤和方法
确定潜在问题和不符合项
通过风险评估、质量审计等手段识别 出潜在问题和不符合项。
按照计划实施纠正措施,确保措施的有效 性和及时性。
5. 预防措施的制定和实施
6. 监督和评估
分析问题的根源,制定相应的预防措施, 以避免类似问题的再次发生。
对CAPA体系的实施过程进行监督和评估, 确保体系的有效性和持续性。
CAPA体系的实施案例分析
总结词
通过案例分析,可以深入了解CAPA体系的实际应用和 效果。
详细描述
CAPA体系是一种系统化的方法,旨在确保组织在发现质量问题后及时采取纠正措施,同时通过分析问题的根本 原因,采取预防措施以避免类似问题的再次发生。
CAPA体系的建立步骤和方法
• 总结词:CAPA体系的建立需要遵循一系列步骤和方法,包括问 题识别、问题分析、制定纠正措施、实施纠正措施、预防措施 的制定和实施以及监督和评估。
纠正与预防措施(CAPA)标准管理规程
目的建立纠正与预防措施(CAPA)管理制度,为消除已发生的不合格或潜在的不合格的原因,采取相应的纠正或预防措施,以防止不合格的再发生或潜在不合格的发生,保证公司质量管理体系的持续改进。
内容1 定义1.1 纠正措施(Corrective Actions,CA)为消除已发现的不合格或其他不期望情况的发生所采取的措施。
1.2 预防措施(Preventive Actions,PA)为消除潜在不合格或其他潜在不期望情况的发生所采取的措施。
2 职责2.1 质量管理部为纠正预防措施的归口管理部门。
2.1.1 组织有关部门进行不合格原因分析以及纠正措施的制订、实施、检查、评审等管理活动;2.1.2 根据产品质量的异常波动,组织有关部门对潜在不合格原因进行分析,评价预防措施的可行性,评估预防措施的适宜性和合理性以及督促预防措施的实施。
2.1.3 负责质量管理体系审核和管理评审中的不合格项的纠正预防措施的制订、实施、检查、评审等管理活动;2.1.4 负责纠正预防措施实施过程中记录的整理归档。
2.2 工程设备部负责工艺设备和公用工程方面的纠正预防措施的制订、实施、检查,并参与纠正预防措施的效果评审。
2.3 生产部及相关责任部门参与纠正预防措施的制订,负责纠正预防措施的实施。
3 管理流程4 管理内容与要求4.1 通过用户调查、用户投诉、产品召回、公司内部自检、外部审计、生产过程监控和产品检验的结果、工艺性能和质量检测趋势分析等进行调查来识别不合格和潜在质量风险,并予以确认。
4.2 原因调查和分析4.2.1 当发生下列情况时,缺陷发生部门必须进行原因调查和分析。
◆用户质量投诉或同一不良质量因素再次出现时;◆因产品有不良事件或有缺陷或怀疑有缺陷而需从市场召回时;◆生产过程中发生偏差或发生重大质量事故时;◆自检过程中或外部检查出现不合格项(包括法律、法规要求)时;◆质量改进会议决定更改工艺或更改设备、设施、仪器、检验方法时;◆产品质量回顾发现不良趋势时;◆留样观察或持续稳定性考察发现产品的不良趋势或出现明显变化时;◆环境测试、制药用水检验或其它常规检验发现有不良趋势或不合格时;◆生产过程中出现仪器、仪表或设备不符合要求(失效损坏、调整维修)且影响产品质量时;◆同一供方或同一物料,检验结果不合格时;◆生产环境出现污染事故时。
纠正与预防措施(CAPA)管理规程
姓名/职务Name/Title 起草人/Written by审核人/Reviewed by批准人/Accepted by签名/日期Signature/Date分发质量控制部102 车间销售部财务部人力资源部部门【1】份【】份【1】份【】份【】份质量保证部101 车间104 车间总经办生产部注册部103 车间工程技术部安全环保部档案室【1】份【1】份【1】份【1】份【1】份【1】份【1】份【】份【1】份【1】份针对某个质量问题进行调查,找出根本原因,采取纠正和预防措施,以消除缺陷及潜在的风险,防止缺陷及不良趋势再次发生,以提高产品质量、优化质量体系,实现质量体系的持续改进。
本规程描述了有关 CAPA 活动的确定、实施及跟踪检查和监控的全面纠正和预防描述计划,合用于诺泰制药的所有质量、生产、研发及销售过程。
令部门➢相关部门负责根据已批准的规程申请纠正及预防描述;➢负责对缺陷和不良隐患进行充分调查以了解质量问题的根本原因;➢分析原因、制定实施相应的纠正、预防措施并对过程中所有发生的处理措施和变更处理予以记录;➢CAPA 所有人及每一个部门主管人员负责确认在获得质量部门批准前不得实施CAPA;➢每一个部门负责确保纠正和预防行动的实施及遵循。
◆注册部负责对所提议的 CAPA 行动进行药政评估,以确保制定的纠正、预防措施符合相关的政府机构的规定。
◆质量保证部➢负责创建、维护和监控 CAPA 计划、评估纠正预防措施的实施效果。
➢负责确保使用该计划的相关人员得到培训。
1.1 不符合:不满足规定的要求或者不在预期范围内;1.2 根本原因:导致不合格的根本原因、实际情况或者过程。
1.3 纠正措施:为消除已发现的不符合所采取的措施;1.4 预防措施:为消除潜在不符合所采取的措施;1.5 纠正预防措施:为防止已浮现的不合格、缺陷或者其它不希翼情况的再次发生,消除其直接原因和潜在原因所采取的措施。
1.6 CAPA 行动申请表(CAR):用来支持/记录 CAPA 过程的文件。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CORRECT APPROACH
• It is essential that CAPA actions should be efficient (adequate correction from the beginning) and rapid (action within a reasonable time) • CAPA is very important to regulatory authorities and will be audited as such. • The problem is often that companies/departments are afraid to face the fact that there are problems, so that they are ignored, or people are afraid to report them • Problems/deviations should not be accepted, but are unavoidable
3
CORRECT APPROACH
• A successful CAPA implementation needs an efficient and strong organisation. • It is tempting to adopt the philosophy “just do it !” or “just fix it quickly !” • This method (often very admired) leads to improvisation, is mainly oriented to the fixing of problems and does not lead to a real correction of problems, which should be • To find the real cause of the problem, • To define a corrective action in order … • To avoid the recurrence of the problem (preventive action)
8
CAPA – SOLUTION STRATEGIES
How to best use the CAPA system?
1.Identify the issue, 2.Implement corrective action for the specific issue, 3.Implement a preventive action that will eliminate similar issues in future, and 4.Verify that the preventive action is effective by monitoring trend data in the future Warning letters indicate that step 3 is seldom done, while step 4 is almost never done
CORRECT APPROACH
• GMP rules recognize problems and errors, and this is why you will find complete chapters on those subjects: complaints, deviations, OOS, CAPA,… • Of course, the idea is not to list and classify problems, but to have a system to evidence them, to bring them to the attention of adequately trained personnel, so that they can be solved in a systematic and scientific way. • The problems can be found through appropriate systems (internal audits, complaints, handling of deviations, quality circles, risk analysis) or through external audits and inspections.
CONSIDERATIONS FOR CAPA PLANNING
• To find out the real cause of the problem • To determine the extent of the problem
(just one batch, just one product, or all batches and products on a machine ?)Fra bibliotek• • •
CAPA IMPLEMENTATION
• 21 CFR 820.100 (a) • The procedure shall include requirements for: • analyzing processes, • work operations, • quality audit reports, • quality records, • service records, • complaints, • returned products and other sources of quality data to identify existing and potential causes of nonconforming product, or other quality problems.
CAPA – DEFINITIONS
According to International Organization for Standardization (ISO 8402),
A corrective action is one undertaken to eliminate the causes of an existing non-conformity, defect or other undesirable situation in order to prevent recurrence. A preventive action, is an action undertaken to eliminate the cause of a potential non-conformity, defect or other undesirable situation in order to prevent its occurrence.
CAPA PHILOSOPHY
• First, the quality system must have some prerequisite data collection systems already installed, such as: • rejected material reports, documented quality audits, • production and analytical data, • complaint data, • returned product reports and • any other reports pertinent to the activities of the quality program. • In order to be compliant, all the information being generated by the prerequisite data collection systems should be captured and trended. • The issues identified during the analysis of these data should be documented in Corrective Action(s).
CORRECTIVE ACTION PREVENTIVE ACTION (CAPA) HOW TO SIMPLY COMPLY WITH GMP
Alain Kupferman, Industry Pharmacist
WHAT IS CAPA ?
Corrective and Preventive Action (CAPA) is a system of: Quality procedures required to eliminate the causes of
an existing nonconformity and
to prevent recurrence of:
o nonconforming product, o nonconforming processes, and o other quality problems.
Quality should be built into the product, and testing alone cannot be relied on to ensure product quality.
• To prevent recurrence at system level • To prevent recurrence at company level.
CAPA – SOLUTION STRATEGIES
Determining the right CAPA requires: – Imagination – instinct, – Experience – of handling failures, – Knowledge – of processes, procedures, laboratory systems, etc. – Training
