配位化合物PPT课件
合集下载
《配位化合物》课件

部分金属在配合物中不带电荷。
负离子
非金属元素形成的阴离子在配合物中带有负 电荷。
稀土金属配离子
稀土金属作为特殊的金属离子在配合物中具 有重要的应用价值。
配合物的合成方法
直接溶液法
通过将金属离子和配体直接 溶解在溶剂中形成配位化合 物。
配体置换法
通过将原有配体置换为新的 配体来合成具有不同结构和 性质的配位化合物。
3 重要性
配位化合物广泛应用于医药、化妆品、催化剂等众多领域。
配位基概述
配体定义
配体是指能够通过一个或多 个配位键与金属离子结合的 化学物质。
配位键
配位键是指配体与金属离子 之间共享的电子对。
配位数
配位数指配位中心金属离子 周围配位体的个数。
金属配离子概述
正离子
金属离子在配合物中带有正电荷。
零价配离子
气相法
通过在气相中使金属原子与 配体反应生成配位化合物。
配合物的分类
1 单核配合物
配位中心金属离子与多 个配体结合形成。
3 簇合物
多个金属离子通过配位 键相互连接形成。
配位数与配位几何
1
配位几何
2
配位几何是指配合物中配体排列的空
间结构。
3
六配体
4
六配体通常呈现八面体或六面体配位 几何。
《配位化合物》PPT课件
本课件旨在介绍配位化合物的基本概念和性质,以及其在不同领域的应用。 通过清晰的内容和生动的图像,希望您能对配位化合物有一个全面而深入的 了解。
初识配位化合物
1 定义
配位化合物是指通过配位键将中心金属离子与一个或多个配体结合形成的化合物。
2 历史
配位化合物的研究始于18世纪,为现代配位化学的奠基。
负离子
非金属元素形成的阴离子在配合物中带有负 电荷。
稀土金属配离子
稀土金属作为特殊的金属离子在配合物中具 有重要的应用价值。
配合物的合成方法
直接溶液法
通过将金属离子和配体直接 溶解在溶剂中形成配位化合 物。
配体置换法
通过将原有配体置换为新的 配体来合成具有不同结构和 性质的配位化合物。
3 重要性
配位化合物广泛应用于医药、化妆品、催化剂等众多领域。
配位基概述
配体定义
配体是指能够通过一个或多 个配位键与金属离子结合的 化学物质。
配位键
配位键是指配体与金属离子 之间共享的电子对。
配位数
配位数指配位中心金属离子 周围配位体的个数。
金属配离子概述
正离子
金属离子在配合物中带有正电荷。
零价配离子
气相法
通过在气相中使金属原子与 配体反应生成配位化合物。
配合物的分类
1 单核配合物
配位中心金属离子与多 个配体结合形成。
3 簇合物
多个金属离子通过配位 键相互连接形成。
配位数与配位几何
1
配位几何
2
配位几何是指配合物中配体排列的空
间结构。
3
六配体
4
六配体通常呈现八面体或六面体配位 几何。
《配位化合物》PPT课件
本课件旨在介绍配位化合物的基本概念和性质,以及其在不同领域的应用。 通过清晰的内容和生动的图像,希望您能对配位化合物有一个全面而深入的 了解。
初识配位化合物
1 定义
配位化合物是指通过配位键将中心金属离子与一个或多个配体结合形成的化合物。
2 历史
配位化合物的研究始于18世纪,为现代配位化学的奠基。
无机化学课件-配位化合物
乙二酸根(草酸根):
O
O 2-
CC
OO
六齿配体:乙二胺四乙酸根 EDTA(Y4-)
OOC– H2C
CH2 – COO 4-
N–CH2 –CH2 –N
OOC– H2C
CH2 – COO
3.配位数:
指在配合物中直接与中心原子配合的配位 原子的数目
表示:n 特点:一般是2,4,6,8 (偶数)
单齿配体: [ Cu(NH3)4]2+
{ 3.特殊配合物
簇状配合物
π-酸配体配合物
桥基配合物:
H O (H2O)4 Fe Fe(OH2)4 O H
簇状配合物 :
CO CO CO CO
Fe Fe
CO
CO CO
CO
CO
四、配合物的几何异构现象
几何异构体:组成相同、空间排列方式不同的物质 平面四方形空间构型的[Pt(NH3)2Cl2],就有两
种不同的排列方式:
Cl
NH3
Pt
Cl
NH3
顺式
μ≠0 棕黄色
有抗癌活性
Cl
NH3
Pt
NH3
Cl
Байду номын сангаас
反式
μ=0 亮黄色 无抗癌活性
第二节 配合物的化学键理论
一、价键理论
(一)基本要点:
1.配合物的中心原子与配体之间是以配位键结合的: M ← L。
2.在形成配离子时,中心原子所提供的空轨道必须首 先进行杂化,形成数目相同的新杂化轨道,M以杂化 空轨道接受L提供的电子而形成σ配键。配离子的空间 构型、配位数、稳定性,主要取决于形成配位键时, M所用的杂化轨道的类型。 3.M的原子轨道杂化时,由于参加杂化的轨道能级不 同,形成的配离子可分为内轨型、外轨型。
大学无机化学配位化合物PPT课件

② 配位原子:直接与中心原子以配位键相连的原子。
通常是电负性较大的原子,如C、N、O、X和S。
③ 单齿配体:配体中只含一个配位原子。
如:X--、S2--、H2O、NH3、CO、CN--等。
④ 多齿配体:配体中含两个或更多的配位原子。如
C2O42-、氨基乙酸根、乙二胺、乙二胺四乙酸根(edta)。
N**H2-CH2-COO-*, N*H2-CH2-CH2-NH2 (en)
第11页/共38页
二、配键和配位化合物分类
1. 外轨型配合物
中心原子是用最外层的ns、np或ns、np、nd组成
的杂化空轨道接受电子,与配体形成配位键.
例:[FeF6]3--中Fe3+:3d5
↑↑↑↑↑ _ _ _ _ _ _ __ _
3d
4s 4p
4d
sp3d2杂化,八面体构型
第12页/共38页
d2sp3
6
Fe (CN)63-,Co(NH3)6
第18页9.3.1 配合物的稳定常数 9.3.2 影响配合物稳定性的因素
(自学) 9.3.3 配位平衡的移动
第19页/共38页
9.3.1 配合物的稳定常数
一、配合物的稳定常数 (K稳)
Cu2+ + 4NH3 = Cu(NH3)42+ K稳
3d
d2 sp3 杂化轨道
内轨型配合物,低自旋 µ = 0 第16页/共38页
CoF63– , Co3+: 3d6
4d 4p 4s 3d
sp3d2杂化 3d
sp3d2 杂化轨道
外轨型配合物,高自旋 µB.M. 正八面体构型
第17页/共38页
三、 杂化轨道形式与配合物的空间构型
通常是电负性较大的原子,如C、N、O、X和S。
③ 单齿配体:配体中只含一个配位原子。
如:X--、S2--、H2O、NH3、CO、CN--等。
④ 多齿配体:配体中含两个或更多的配位原子。如
C2O42-、氨基乙酸根、乙二胺、乙二胺四乙酸根(edta)。
N**H2-CH2-COO-*, N*H2-CH2-CH2-NH2 (en)
第11页/共38页
二、配键和配位化合物分类
1. 外轨型配合物
中心原子是用最外层的ns、np或ns、np、nd组成
的杂化空轨道接受电子,与配体形成配位键.
例:[FeF6]3--中Fe3+:3d5
↑↑↑↑↑ _ _ _ _ _ _ __ _
3d
4s 4p
4d
sp3d2杂化,八面体构型
第12页/共38页
d2sp3
6
Fe (CN)63-,Co(NH3)6
第18页9.3.1 配合物的稳定常数 9.3.2 影响配合物稳定性的因素
(自学) 9.3.3 配位平衡的移动
第19页/共38页
9.3.1 配合物的稳定常数
一、配合物的稳定常数 (K稳)
Cu2+ + 4NH3 = Cu(NH3)42+ K稳
3d
d2 sp3 杂化轨道
内轨型配合物,低自旋 µ = 0 第16页/共38页
CoF63– , Co3+: 3d6
4d 4p 4s 3d
sp3d2杂化 3d
sp3d2 杂化轨道
外轨型配合物,高自旋 µB.M. 正八面体构型
第17页/共38页
三、 杂化轨道形式与配合物的空间构型
基础化学教学课件:8.1 配位化合物

在配合物中与中心离子(或原子)结合的阴离 子或中性分子。
配体
阴离子 X- OH- SCN- PO43-
中性分子 CO RCH2NH2 ROR
配合物的组成
配位原子:
结构特点
配体中直接与中心离子(或原子)形成配位键的原子。
F-
NH3
H2O
F-、N、O原子
外围电子层中有能提供给中心离子(或原子)的孤电子对 配位原子主要是电负性较大的非金属元素
废水的处理
配位化合物
谢谢
NH3与H2O同为配位体时
前后
Br - 、Cl - 同为配位体时
配合物的命名
配位Байду номын сангаас衡
配位平衡描述的是中心原子与配体之间 配位键的形成与断裂达到的动态平衡。
配合物的命名
配离子
离子键
外界
在水溶液中完全离解为配离子和外界离子 而中心离子与配位体之间是以配位键结合的 与弱电解质相似,在水溶液中只是部分离解
配合物的组成
1.中心离子(或原子)
中心离子(或中心原子)是配合物的形成体,位于配合物的中心,一般为带 正电荷的金属离子或中性原子。
配原子 配位数
[Cu (NH3)4] SO4
配原子 配位数
H2[ SiF6 ]
中心离子 配位体
(配离子) 内界 外界
配合物
配位体 中心离子
(配离子) 外界 内界
配合物
2. 配位体简称配体
理解和掌握配位化合物
组成、命名 配位平衡和配位常数的概念
对于进一步学习化学和相关领域的知识至关重要。
配合物的命名
配合物在工业生产中有着广泛的应用
催化剂
颜料
染料
《无机化学》第8章.配位化合物PPT课件

配位化合物的发展趋势与展望
新材料与新能源
随着人类对新材料和新能源需求的不断增加,配位化合物有望在太 阳能电池、燃料电池等领域发挥重要作用。
生物医药领域
配位化合物在药物设计和治疗方面的应用前景广阔,有望为人类疾 病的治疗提供新的解决方案。
环境科学领域
配位化合物在处理环境污染和保护生态环境方面具有潜在的应用价值, 未来有望为环境保护做出贡献。
螯合物
由两个或更多的配位体与同一 中心原子结合而成的配合物,
形成环状结构,如: Fe(SCN)3。
命名
一般命名法
根据配位体和中心原子的名称,加上 “合”字和数字表示配位数的顺序来 命名,如:Co(NH3)5Cl。
系统命名法
采用系统命名法,将配位体名称按照 一定的顺序列出,加上“合”字和数 字表示配位数的顺序,最后加上中心 原子名称,如: (NH4)2[Co(CO3)2(NH3)4]·2H2O。
配位化合物的种类繁多,其组成和结 构取决于中心原子或离子和配位体的 性质。
配位化合物的形成条件
01
存在可用的空轨道 和孤对电子
中心原子或离子必须有可用的空 轨道,而配位体则需提供孤对电 子来形成配位键。
02
能量匹配
中心原子或离子和配位体的能量 状态需要匹配,以便形成稳定的 配位化合物。
03
空间和电子构型适 应性
中心原子或离子和配位体的空间 和电子构型需相互适应,以形成 合适的几何构型和电子排布。
02
配位化合物的组成与结构
组成
配位体
提供孤电子对与中心原子形成配位键的分子或离子。常见的配位 体有:氨、羧酸、酰胺、酸酐、醛、酮、醇、醚等。
中心原子
接受配位体提供的孤电子对形成配位键的原子。常见的中心原子有: 过渡金属元素的离子。
《配位化学》课件

配位化合物的稳定性
总结词
配位化合物的稳定性
详细描述
配位化合物的稳定性取决于多个因素,包括中心原子或离子的性质、配位体的数目和类型、配位键的 数目和类型等。一般来说,配位数越大,配位化合物的稳定性越高。此外,具有强给电子能力的配位 体也能提高配位化合物的稳定性。
03
配位键理论
配位键的定义
总结词
配位键是一种特殊的共价键,由一个 中心原子和两个或更多的配位体通过 共享电子形成。
《配位化学》PPT课件
目录
• 配位化学简介 • 配位化合物 • 配位键理论 • 配位反应动力学 • 配位化学的应用
01
配位化学简介
配位化学的定义
配位化学是研究金属离子与有机配体 之间相互作用形成络合物的科学。
它主要关注配位键的形成、性质和反 应机制,以及络合物在催化、分离、 分析等领域的应用。
方向性是指配位键的形成要求中心原子和配 位体的电子云在特定的方向上重叠。这决定 了配合物的特定空间构型。饱和性则是指一 个中心原子最多只能与数目有限的配位体形 成配位键,这取决于中心原子的空轨道数量 和配位体的可用孤对电子数。
04
配位反应动力学
配位反应的动力学基础
反应速率
01
配位反应的速率是研究配位反应动力学的关键参数,它决定了
05
配位化学的应用
在工业生产中的应用
催化剂
配位化合物可以作为工业生产中的催化剂,如烯烃的氢化反应、 烷基化反应等。
分离和提纯
利用配位化合物的特性,可以实现工业生产中的分离和提纯过程 ,如金属离子的分离和提纯。
化学反应控制
通过配位化合物可以控制化学反应的速率、方向和选择性,从而 实现工业化生产中的优化。
配位化合物课件

理 论, 提出了 配位数 这个主要概念。韦 尔纳旳理论能够说 是当代 无机化学 发
展旳基础,因为它打破了只基于碳化合 物 研究所得到旳不全方面旳构造理论,并为 化合价旳电子理论开辟了道路。韦尔纳 抛弃了 F.A.凯库勒 有关化合价恒定不变 旳观点, 大胆地提出了副价旳概念, 创建 了配位理论。韦尔纳因创建配位化学而 取得1923年诺贝尔化学奖。
外界 内界 配离子 K3[ Fe ( C N ) 6 ]
配离子以配位键结合,在水内中很稳定; K+为外界,内、外界以离子键结合,易解离
2. 配合物旳构成:
(1) 中心离子(原子):(能够接受孤对电子)位于配 离子旳几何中心,是配离子旳形成体。中心离 子(原子)一般具有接受孤对电子旳空轨道, 常见旳为过渡元素原子或离子,如:Fe3+、Fe、 Cr3+、Ag+等,还有p区旳非金属元素,还有某 些半径小和电荷高旳p区金属离子,如:B(Ⅲ)、 Si(Ⅳ)、Al3+等,也有个别旳非金属元素阴离 子,如:I—等。
中心离子: Co3+
配位体: --NO2 、 C2O42 -
配位原子:N、O、O 配位数:2×1+2×2=6
内界:[Co(NO2)2(C2O4)2]3- 外界:NH4+
配离子电荷=+3 -2×1 - 2 ×2 = -3
[CoCl(NO2)(NH3)(H2O)]Cl
中心离子
Co3+
配位体 配位原子
Cl-、-NO2 、NH3、H2O
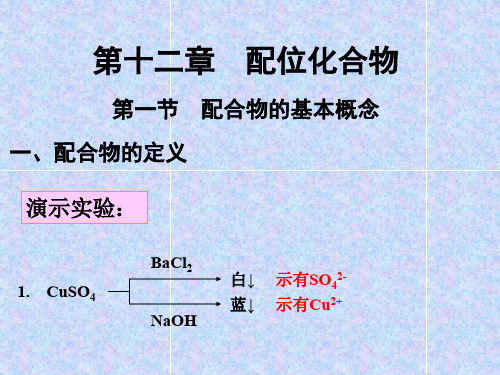
明没有明显NH3 ,
(2)加入稀NaOH时无沉淀生成,阐 明无简朴Cu2+离子 (3)加入BaCl2+HNO3溶液有沉淀生 成,示有SO42-离子
展旳基础,因为它打破了只基于碳化合 物 研究所得到旳不全方面旳构造理论,并为 化合价旳电子理论开辟了道路。韦尔纳 抛弃了 F.A.凯库勒 有关化合价恒定不变 旳观点, 大胆地提出了副价旳概念, 创建 了配位理论。韦尔纳因创建配位化学而 取得1923年诺贝尔化学奖。
外界 内界 配离子 K3[ Fe ( C N ) 6 ]
配离子以配位键结合,在水内中很稳定; K+为外界,内、外界以离子键结合,易解离
2. 配合物旳构成:
(1) 中心离子(原子):(能够接受孤对电子)位于配 离子旳几何中心,是配离子旳形成体。中心离 子(原子)一般具有接受孤对电子旳空轨道, 常见旳为过渡元素原子或离子,如:Fe3+、Fe、 Cr3+、Ag+等,还有p区旳非金属元素,还有某 些半径小和电荷高旳p区金属离子,如:B(Ⅲ)、 Si(Ⅳ)、Al3+等,也有个别旳非金属元素阴离 子,如:I—等。
中心离子: Co3+
配位体: --NO2 、 C2O42 -
配位原子:N、O、O 配位数:2×1+2×2=6
内界:[Co(NO2)2(C2O4)2]3- 外界:NH4+
配离子电荷=+3 -2×1 - 2 ×2 = -3
[CoCl(NO2)(NH3)(H2O)]Cl
中心离子
Co3+
配位体 配位原子
Cl-、-NO2 、NH3、H2O
明没有明显NH3 ,
(2)加入稀NaOH时无沉淀生成,阐 明无简朴Cu2+离子 (3)加入BaCl2+HNO3溶液有沉淀生 成,示有SO42-离子
配位化合物命名ppt课件

7
3、含配阴离子的配合物:
在配阴离子与外界阳离子之间用酸字相连
例:K2[Fe(CN)6]
六氰合铁(III)酸钾
➢阴离子命名顺序: 阴离子配体→中性分子配体→合→中心离子 →酸。
如:K[PtCl3NH3], 三氯·一氨合铂(II)酸钾
8
4、含配阳离子的配合物
阴离子在前,配阳离子在后
例:[Cr(en)3](ClO4)3 高氯酸三(乙二胺)合铬(III)
[Pt(NH3)6][PtCl4] 四氯合铂(II)酸六氨合铂(II)
10
6、简名和俗[Fe(CN)6] Na[Co(NO)2]
亚铁氰化钾 铁氰化钾 亚硝酸钴钠
俗名
黄血盐 赤血盐
11
Exercises
命名下列配合物和配离子: (1)(NH4)3[SbCl6]; (2)[Co(en)3]Cl3 (3)[Cr(H2O)4Br2]Br ·2H2O (4)[Cr(OH)(H2O)(C2O4)(en)] (5)[Pt(Py)(NH3)ClBr] (6) H2[PtCl 6] (7) [Co(NH3)6]Cl3 (8) [Co(NH3)6]2(SO4)3
四. 配合物的命名
原则: 先阴离子后阳离子, 先简单后复杂。
1
1、配合物的整体命名 ✓ 配合物外界是简单阴离子(如Cl-),叫某化某;
[Co(NH3)6]Cl3
三氯化六氨合钴(III)
✓ 若外界是一复杂阴离子(如SO42-),叫某酸某;
[Cr(en)3](ClO4)3
高氯酸三(乙二胺)合铬(III)
4
四个角。
和[Ni(CO)4]
平面正方形 构型
dsp2或d2p2
中心离子位于正方形中心, 配体位于四角
3、含配阴离子的配合物:
在配阴离子与外界阳离子之间用酸字相连
例:K2[Fe(CN)6]
六氰合铁(III)酸钾
➢阴离子命名顺序: 阴离子配体→中性分子配体→合→中心离子 →酸。
如:K[PtCl3NH3], 三氯·一氨合铂(II)酸钾
8
4、含配阳离子的配合物
阴离子在前,配阳离子在后
例:[Cr(en)3](ClO4)3 高氯酸三(乙二胺)合铬(III)
[Pt(NH3)6][PtCl4] 四氯合铂(II)酸六氨合铂(II)
10
6、简名和俗[Fe(CN)6] Na[Co(NO)2]
亚铁氰化钾 铁氰化钾 亚硝酸钴钠
俗名
黄血盐 赤血盐
11
Exercises
命名下列配合物和配离子: (1)(NH4)3[SbCl6]; (2)[Co(en)3]Cl3 (3)[Cr(H2O)4Br2]Br ·2H2O (4)[Cr(OH)(H2O)(C2O4)(en)] (5)[Pt(Py)(NH3)ClBr] (6) H2[PtCl 6] (7) [Co(NH3)6]Cl3 (8) [Co(NH3)6]2(SO4)3
四. 配合物的命名
原则: 先阴离子后阳离子, 先简单后复杂。
1
1、配合物的整体命名 ✓ 配合物外界是简单阴离子(如Cl-),叫某化某;
[Co(NH3)6]Cl3
三氯化六氨合钴(III)
✓ 若外界是一复杂阴离子(如SO42-),叫某酸某;
[Cr(en)3](ClO4)3
高氯酸三(乙二胺)合铬(III)
4
四个角。
和[Ni(CO)4]
平面正方形 构型
dsp2或d2p2
中心离子位于正方形中心, 配体位于四角
配位化合物与配位滴定法精品PPT课件

7
二、 配合物的组成 1. 内界和外界
配合物一般由内界和外界两部分组成。 内界:即配位单元,是配合物的特征部分; 外界:除内界以外的部分。 若所含配位单元是电中性的配合物,则只有内
界没有外界 ,如[Ni(CO)4]、[Pt(NH3)2Cl2]
注意:配合物内界与外界之间是静电作用,在 水中易解离;内界的中心原子与配体之间是配
17
配体数: 配合物中含有配体的数目,如: Ni(CO)4中为4,[Fe(C2O4)3]3-中是3。
配位数与配体数是有区别的:
(1)简单配合物中,配位数等于配体数,如 [Ag(CN)2]-中配位数和配体数均为2。
(2)在螯合物中,配位数等于配体的数目与其 基数的乘积。如[Cu(en)2]2+中配体数是2,其配 位数则为4; [Fe(C2O4)3]3-中配体数是3,其配 位数却为6。
4
一、 配合物的定义
《无机化学命名原则》中定义:配位化合 物(简称配合物)是由可以给出孤对电子或 多个不定域电子的一定数目的离子或分子 (称为配体)和具有接受孤对电子或多个不 定域电子的空位的原子或离子(统称中心原 子)按一定的组成和空间构型所形成的化合 物。
5
一般将中心原子(或离子)与它周围按一定 几何构型围绕着的阴离子或中性分子配体以配位 键结合的复杂分子或离子,称为配位单元。
14
双基配体:草酸根 1
C
2O
2 4
O O 2– CC
OO
••
••
六基配体:乙二胺四乙酸根(简称 EDTA)
••
O OC H2C
• • 4–
CH2 CO O
•• ••
N CH2 CH2 N
O OC H2C
••
二、 配合物的组成 1. 内界和外界
配合物一般由内界和外界两部分组成。 内界:即配位单元,是配合物的特征部分; 外界:除内界以外的部分。 若所含配位单元是电中性的配合物,则只有内
界没有外界 ,如[Ni(CO)4]、[Pt(NH3)2Cl2]
注意:配合物内界与外界之间是静电作用,在 水中易解离;内界的中心原子与配体之间是配
17
配体数: 配合物中含有配体的数目,如: Ni(CO)4中为4,[Fe(C2O4)3]3-中是3。
配位数与配体数是有区别的:
(1)简单配合物中,配位数等于配体数,如 [Ag(CN)2]-中配位数和配体数均为2。
(2)在螯合物中,配位数等于配体的数目与其 基数的乘积。如[Cu(en)2]2+中配体数是2,其配 位数则为4; [Fe(C2O4)3]3-中配体数是3,其配 位数却为6。
4
一、 配合物的定义
《无机化学命名原则》中定义:配位化合 物(简称配合物)是由可以给出孤对电子或 多个不定域电子的一定数目的离子或分子 (称为配体)和具有接受孤对电子或多个不 定域电子的空位的原子或离子(统称中心原 子)按一定的组成和空间构型所形成的化合 物。
5
一般将中心原子(或离子)与它周围按一定 几何构型围绕着的阴离子或中性分子配体以配位 键结合的复杂分子或离子,称为配位单元。
14
双基配体:草酸根 1
C
2O
2 4
O O 2– CC
OO
••
••
六基配体:乙二胺四乙酸根(简称 EDTA)
••
O OC H2C
• • 4–
CH2 CO O
•• ••
N CH2 CH2 N
O OC H2C
••
无机化学 配位化合物PPT课件

获1913年诺贝尔化学奖
1893年苏黎世大学维尔纳 (Werner A)教授对这类化 合物本性提出了天才见解, 被后人称为维尔纳配位学 说,成为配位化学的奠基 人。维尔纳因此而获得 1913年诺贝尔化学奖。
维尔纳 (Werner, A, 1866-1919)
配位化学的奠基人—维尔纳
配位化学是当今化学学科的前沿领域之一, 配合物在医疗、药物、分离分析、染料、化学合 成等诸多方面具有极为广泛的应用。
② 配离子的解离如同弱电解质:
[Cu(NH3)4]2+
Hale Waihona Puke Cu2++4NH3
浓度非常低
+
+ [Cu(NH3)4]2+
[Cu(NH3)4]2+
Cu2+
Cu2+ 4NH3
4NH3
配离子解离出中心原子和配体,同
时,二者C重u(新O结H合)2成配离子Cu,S是动态平
衡的过程,这种平衡就叫做配位平衡。
一、稳定常数
内界
外界
离子键
➢ 配合物的解离如同强电解质:
[Cu(NH3)4]SO4→[Cu(NH3)4]2++SO42-
[ Cu (NH3)4 ]2+
中心原子 配体 配位键
➢ 配离子的解离如同弱电解质:
[Cu(NH3)4]2+
Cu2+ + 4 NH3
配合物的解离:
① 配合物的解离如同强电解质:
[Cu(NH3)4]SO4→[Cu(NH3)4]2++SO42-
Fe4[Fe(CN)6]3 [Cu(NH3)4]SO4
K2[Ag(CN)2]
[Ag(NH3)2]OH
1893年苏黎世大学维尔纳 (Werner A)教授对这类化 合物本性提出了天才见解, 被后人称为维尔纳配位学 说,成为配位化学的奠基 人。维尔纳因此而获得 1913年诺贝尔化学奖。
维尔纳 (Werner, A, 1866-1919)
配位化学的奠基人—维尔纳
配位化学是当今化学学科的前沿领域之一, 配合物在医疗、药物、分离分析、染料、化学合 成等诸多方面具有极为广泛的应用。
② 配离子的解离如同弱电解质:
[Cu(NH3)4]2+
Hale Waihona Puke Cu2++4NH3
浓度非常低
+
+ [Cu(NH3)4]2+
[Cu(NH3)4]2+
Cu2+
Cu2+ 4NH3
4NH3
配离子解离出中心原子和配体,同
时,二者C重u(新O结H合)2成配离子Cu,S是动态平
衡的过程,这种平衡就叫做配位平衡。
一、稳定常数
内界
外界
离子键
➢ 配合物的解离如同强电解质:
[Cu(NH3)4]SO4→[Cu(NH3)4]2++SO42-
[ Cu (NH3)4 ]2+
中心原子 配体 配位键
➢ 配离子的解离如同弱电解质:
[Cu(NH3)4]2+
Cu2+ + 4 NH3
配合物的解离:
① 配合物的解离如同强电解质:
[Cu(NH3)4]SO4→[Cu(NH3)4]2++SO42-
Fe4[Fe(CN)6]3 [Cu(NH3)4]SO4
K2[Ag(CN)2]
[Ag(NH3)2]OH
配位化合物课件

硫氰根 异硫氰根
C6H5 -
py ( en Ph3P )
苯基
吡啶 乙二胺 三苯基膦
NO CO H2O
亚硝酰 羰基 水
NH3
(O2)
氨
双氧
3. 配体的先后顺序 在配位单元中,可能涉及多种
配体,所以要明确规定命名时配体
的次序。 下述的每条规定均以其前一条 规定为基础。
(1) 先无机配体后有机配体。
配体前面用 二、三、四 · · ·
· ·表示该配体的个数。 ·
[ Co NH3)H2O ] Cl3 ( 5 三氯化五氨•水合钴(III)
Cu2 [ SiF6 ]
六氟合硅(IV)酸亚铜
几种不同的配体之间加 ‘ • ’
隔开。
[ Co NH3)H2O ] Cl3 ( 5 三氯化五氨•水合钴(III)
Cu2 [ SiF6 ]
2. 空间异构 空间异构又叫立体异构。 空间异构分为:
(1) 几何异构 (2) 旋光异构
空间异构特点是 配位单元的中心与配体之间键 联关系相同,但配体相互位置不同, 或配体在中心周围排列方式不同。
(1) 几何异构 几何异构又叫顺反异构,其特点是
配体相互位置不同。
例如配位数为 4 的平面正方形结构 的 [ PtCl(NH3)],有几何异构现象。 2 2
[ CrCl H2O) ] Cl2•H2O ( 5
(2) 配位异构 内界之间交换配体,得到的异构 体称为配位异构。 如 [ Co NH3) ] [ Cr CN )] 和 ( ( 6 6 [ Cr NH3)] [ Co CN )] ( ( 6 6 互为配位异构。
(3) 键合异构
组成和结构均相同但配位原子
(4) 配位原子相同,配体
配位化合物获奖课件

十一配位旳Eu配合物
3.共价键还是离子键旳进一步考虑(略)
配合物中旳配位键是共价键还是离子键,仍可能存在争议。
配位几何显然并非可靠旳判断根据。 熔融状态或水溶液中能否导电,也不是 可靠旳证据。 例如,[Fe(H2O)4SO4]2水溶液能导电, 阐明水溶液中存在硫酸根离子和Fe2+离子。 但是晶体构造显示六个Fe-O配位键长几 乎相等,结合正八面体旳配位几何,提醒 了SO4-Fe配位键可能与H2O- Fe配位键 具有相同旳共价性质。
但许多配合物并不具有规则旳配位几何,难以用共价键理 论解释配位几何。一般以为这些配合物中,配位键具有离子 键性质。
稀土元素配合物旳配位键,被以为 具有离子键性质。在稀土配合物中, 配位数和配位键方向,主要由稀土离 子半径和配体体积决定。具有大半径 旳稀土元素,如钐(Sm)、铕(Eu)旳 配位数可高达12。
Cu(NH3 )22 NH3 Cu(NH3 )32
K 2 9 10-4
Cu(NH3 )2 NH3
Cu(NH3 )22
K3 2 10-4
Cu2 NH3 Cu(NH3 )2
K 4 510-5
总旳配位平衡常数K等K1、K2、K3、K4乘积。
3.金属配合物合成
溶液中金属配合物旳合成反应,就是配体互换旳过程。 配合物合成就是让所选择旳配体与金属离子形成配位键。 因为金属离子原来就已经与水分子、酸根阴离子等形成了 配位键,所以需要发明条件,使发生配体互换反应,得到希 望旳配合物。 把[Cu(H2O)4SO4].H2O晶体溶解在氨水中,氨分子就会与水 分子发生配体互换,形成水、氨同步配位旳配合物,如 [Cu(H2O)2(NH3)2SO4],[Cu(H2O)3(NH3)SO4] 等。
[Fe(H2O)4SO4]2
3.共价键还是离子键旳进一步考虑(略)
配合物中旳配位键是共价键还是离子键,仍可能存在争议。
配位几何显然并非可靠旳判断根据。 熔融状态或水溶液中能否导电,也不是 可靠旳证据。 例如,[Fe(H2O)4SO4]2水溶液能导电, 阐明水溶液中存在硫酸根离子和Fe2+离子。 但是晶体构造显示六个Fe-O配位键长几 乎相等,结合正八面体旳配位几何,提醒 了SO4-Fe配位键可能与H2O- Fe配位键 具有相同旳共价性质。
但许多配合物并不具有规则旳配位几何,难以用共价键理 论解释配位几何。一般以为这些配合物中,配位键具有离子 键性质。
稀土元素配合物旳配位键,被以为 具有离子键性质。在稀土配合物中, 配位数和配位键方向,主要由稀土离 子半径和配体体积决定。具有大半径 旳稀土元素,如钐(Sm)、铕(Eu)旳 配位数可高达12。
Cu(NH3 )22 NH3 Cu(NH3 )32
K 2 9 10-4
Cu(NH3 )2 NH3
Cu(NH3 )22
K3 2 10-4
Cu2 NH3 Cu(NH3 )2
K 4 510-5
总旳配位平衡常数K等K1、K2、K3、K4乘积。
3.金属配合物合成
溶液中金属配合物旳合成反应,就是配体互换旳过程。 配合物合成就是让所选择旳配体与金属离子形成配位键。 因为金属离子原来就已经与水分子、酸根阴离子等形成了 配位键,所以需要发明条件,使发生配体互换反应,得到希 望旳配合物。 把[Cu(H2O)4SO4].H2O晶体溶解在氨水中,氨分子就会与水 分子发生配体互换,形成水、氨同步配位旳配合物,如 [Cu(H2O)2(NH3)2SO4],[Cu(H2O)3(NH3)SO4] 等。
[Fe(H2O)4SO4]2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二氨合银(Ⅰ)离子 四氨合锌(Ⅱ)离子 六氟合铝(Ⅲ)离子 六氯合铂(Ⅳ)离子
学习目的:
1.了解配合物在医学中的意义。 2.理解配合物的定义、配合物的组成、鳌合物和鳌合剂的概念及氨羧鳌合剂。 3.掌握配合物的命名及氨羧鳌合滴定。
复习引入:
配位键是一种特殊的共价键,是由一个原子单独供给电子对为两个原 子共用而形成的共价键。如:氨分子和氢离子反应生成铵根离子时,就 形成配位键。
2.配位体 配合物中,与中心原子以配位键相结合的中性分子或阴离子
称为配位体,简称配体。配体中提供孤对电子的原子称为配原子。
配体可分为单齿配体和多齿配体两类
单齿配体 只有一个配原子与中心原子以配位键结合的配体
常见单齿配位体有:NH3、H2O 、CN- 、F- 、Cl-、I-、SCN- 、CO、NO2等。配原子分别为: N、 O、 C、 F、 Cl、 I、 S、 C、 O。
[Cu(NH3)] SO4
[Cu(NH3)]2+
K3[Fe(CN)6]
[Fe(CN)6]3
K4[Fe(CN)6]
[Fe(CN)6]4
(2)根据配离子的电荷数等于中心离子的电荷数和配位体的电
荷数的代数和。确定中心离子的电荷数
[Cu(NH3)]2+ SO42_
X + 0 = +2 X = +2
K4+
[Fe(CN)6]4- X+(- 1)× 6 = -4 X = (- 4 ) + 6 =+2
计算下列配离子和中心离子的电荷数:
1、[Zn(NH3)4] (NO3)2 [Zn(NH3)4] 2+
2、K3[Fe(CN)6]
[Fe(CN)6]3-
3、Na[Ag(CN)2]
[Ag(CN)2]+
Zn2+ Fe3+ Ag+
三、配离子和配合物的命名
(一)配离子的分类
阳离子 配离子
阴离子
(二)配离子的命名 原则:
如:
硫酸四氨合铜(Ⅱ)
[Cu(NH3)4] SO4
六氰合铁(Ⅲ)酸钾
K3[Fe(CN)6]
中 心 离
配配 位位
子 体数
中 心 离
配配 位位
子 体数
内界 外界
外界 内界
配合物
配合物
注意:有的配合物只有内界,没有外界,如配分子[Co(NH3)3Cl3]、[Fe(CO)5]
[Cu(NH3)4] SO4
பைடு நூலகம்中 心 离
现象:1.在CuSO4溶液中加入NaOH溶液会生成的Cu(OH)2的蓝色沉淀, 再加入NH3·H2O,会发现Cu(OH)2逐渐溶解,溶液变成深蓝色。 原因:Cu(OH)2 和NH3·H2O反应,生成了深蓝色的复杂离子 [Cu(NH3)4]+。 现象:2.含CN-离子的化合物都有剧毒,但在含CN-离子的溶液中加入 Fe2(SO4)3溶液后,其毒性几乎消失。
[Cu(NH3)4]2+ [Fe(CN)6]4
配位数—配位体—合—中心离子—化合价(罗马数字)—离子
[Cu(NH3)]2+ [Fe(CN)6]4[Fe(CN)6]3练习:命名下列配离子 1、[Ag(NH3)2]+ 2、[Zn(NH3)4]2+ 3、[AlF6]34、[PtCl6]2-
四氨合铜(Ⅱ)离子 六氰合铁(Ⅱ)离子 六氰合铁(Ⅲ)离子
例:Ag+ + 2NH3 → [H3N:→ Ag ←:NH3]+
多齿配体 一个配体中有两个或两个以上配原子同时与中心原子以配位键结合的配体。
如NH2CH2CH2NH2 乙二胺 ,简写为en 、乙二胺四乙酸根(通常用符号 Y4-表示),它们分别为二齿、六齿配体。
3.配位数 直接与中心原子以配位键结合的配原子的总数,称 为中心原子的配位数。一般中心原子的配位数为2、4、6、 8(常见的是2、4和6)。 如[Ag(CN)2]-配离子中,Ag+的配位数是2;在 [Cu(NH3)4]2+配离子中,Cu2+的配位数是4;在 [Cr(H2O)4C12]+配离子中,Cr3+的配位数是6;而在 [Cu(en)2]2+配离子中,Cu2+的配位数不是2,而是4。因为 en是二齿配体,2个en分子中共含有4个可被利用的配原子N。
配配 位位
子 体数
内界 外界
配合物
NH3
NH3 Cu2+ NH3 SO42-
NH3
K3[Fe(CN)6]
中 心 离
配配 位位
子 体数
外界 内界 配合物
K+
CN
CN
CN
Fe3+
CN K+
CN
CN
K+
1:中心原子(离子) 中心原子也称为配合物形成体,它位于配离子的
中心,一般是金属离子,特别是过渡金属离子,也有一些是金属原子。 注意,书写中心原子时应标出其所带电荷数。 常见的中心离子有:Ag+、Cu2+、 Zn2+、 Fe2+、 Fe3+、 Al3+ 、Cr3+ 、Co3+ 、 Pt4+等。
由单齿配体形成的配合物,中心离子的配位数等于配体的数目;若配体
是多齿的,那么配体的数目不等于中心离子的配位数。
一般地说,中心原子的电荷数为+1、+2、+3时,其配位数分别为2、4、 6。
4. 配离子的电荷数 配离子所带的电荷数等于中心原子的化合价和配
体总电荷数的代数和 。
(1)根据外界离子确定配离子的正负电荷数。
原因:加入Fe2(SO4)3后,Fe3+与CN-生成了复杂离子[Fe(CN)6]3-,虽 然[Fe(CN)6]3-离子结构中似乎还存在CN-,但溶液中已不存在游离的 CN-离子,因而毒性消失。
配离子:由简单阳离子(或原子)和一定数目的中性分子或阴离子通过配位 键结合,并按照一定的组成和空间构型所形成的复杂离子称为配离子。如: [Cu(NH3)4]+ 四氨合铜(Ⅱ)离子 [Fe(CN)6]3- 六氰合铁(Ⅲ)离子
配位化合物(简称配合物):含有配离子化合物或配分子称为配合物。
如: [Cu(NH3)4]SO
硫4 酸四氨合铜(Ⅱ)
K3[Fe(CN)6] 六氰合铁(Ⅲ)酸钾
二、配合物的组成
配离子是配合物的核心部分,而配位键则是其结构的基本特征。配合 物一般可分为内界和外界两个组成部分。内界是由配离子组成的,写在 方括号内,与配离子带相反电荷的其它离子为外界。
.
铵离子的形成:
氨分子中氮原子上有一对孤对电子,而氢离子没有电子,当它们 相互作用时,氮原子的孤对电子就和氢离子共用,形成配位键。
配位键形成的条件为:
(1)成键的一方必须具有含孤对电子的原子;
(2)成键的另一方必须是具有空轨道的离子或原子团。
讲授新课: 第一节 配合物的基本概念
一、配位化合物的定义
学习目的:
1.了解配合物在医学中的意义。 2.理解配合物的定义、配合物的组成、鳌合物和鳌合剂的概念及氨羧鳌合剂。 3.掌握配合物的命名及氨羧鳌合滴定。
复习引入:
配位键是一种特殊的共价键,是由一个原子单独供给电子对为两个原 子共用而形成的共价键。如:氨分子和氢离子反应生成铵根离子时,就 形成配位键。
2.配位体 配合物中,与中心原子以配位键相结合的中性分子或阴离子
称为配位体,简称配体。配体中提供孤对电子的原子称为配原子。
配体可分为单齿配体和多齿配体两类
单齿配体 只有一个配原子与中心原子以配位键结合的配体
常见单齿配位体有:NH3、H2O 、CN- 、F- 、Cl-、I-、SCN- 、CO、NO2等。配原子分别为: N、 O、 C、 F、 Cl、 I、 S、 C、 O。
[Cu(NH3)] SO4
[Cu(NH3)]2+
K3[Fe(CN)6]
[Fe(CN)6]3
K4[Fe(CN)6]
[Fe(CN)6]4
(2)根据配离子的电荷数等于中心离子的电荷数和配位体的电
荷数的代数和。确定中心离子的电荷数
[Cu(NH3)]2+ SO42_
X + 0 = +2 X = +2
K4+
[Fe(CN)6]4- X+(- 1)× 6 = -4 X = (- 4 ) + 6 =+2
计算下列配离子和中心离子的电荷数:
1、[Zn(NH3)4] (NO3)2 [Zn(NH3)4] 2+
2、K3[Fe(CN)6]
[Fe(CN)6]3-
3、Na[Ag(CN)2]
[Ag(CN)2]+
Zn2+ Fe3+ Ag+
三、配离子和配合物的命名
(一)配离子的分类
阳离子 配离子
阴离子
(二)配离子的命名 原则:
如:
硫酸四氨合铜(Ⅱ)
[Cu(NH3)4] SO4
六氰合铁(Ⅲ)酸钾
K3[Fe(CN)6]
中 心 离
配配 位位
子 体数
中 心 离
配配 位位
子 体数
内界 外界
外界 内界
配合物
配合物
注意:有的配合物只有内界,没有外界,如配分子[Co(NH3)3Cl3]、[Fe(CO)5]
[Cu(NH3)4] SO4
பைடு நூலகம்中 心 离
现象:1.在CuSO4溶液中加入NaOH溶液会生成的Cu(OH)2的蓝色沉淀, 再加入NH3·H2O,会发现Cu(OH)2逐渐溶解,溶液变成深蓝色。 原因:Cu(OH)2 和NH3·H2O反应,生成了深蓝色的复杂离子 [Cu(NH3)4]+。 现象:2.含CN-离子的化合物都有剧毒,但在含CN-离子的溶液中加入 Fe2(SO4)3溶液后,其毒性几乎消失。
[Cu(NH3)4]2+ [Fe(CN)6]4
配位数—配位体—合—中心离子—化合价(罗马数字)—离子
[Cu(NH3)]2+ [Fe(CN)6]4[Fe(CN)6]3练习:命名下列配离子 1、[Ag(NH3)2]+ 2、[Zn(NH3)4]2+ 3、[AlF6]34、[PtCl6]2-
四氨合铜(Ⅱ)离子 六氰合铁(Ⅱ)离子 六氰合铁(Ⅲ)离子
例:Ag+ + 2NH3 → [H3N:→ Ag ←:NH3]+
多齿配体 一个配体中有两个或两个以上配原子同时与中心原子以配位键结合的配体。
如NH2CH2CH2NH2 乙二胺 ,简写为en 、乙二胺四乙酸根(通常用符号 Y4-表示),它们分别为二齿、六齿配体。
3.配位数 直接与中心原子以配位键结合的配原子的总数,称 为中心原子的配位数。一般中心原子的配位数为2、4、6、 8(常见的是2、4和6)。 如[Ag(CN)2]-配离子中,Ag+的配位数是2;在 [Cu(NH3)4]2+配离子中,Cu2+的配位数是4;在 [Cr(H2O)4C12]+配离子中,Cr3+的配位数是6;而在 [Cu(en)2]2+配离子中,Cu2+的配位数不是2,而是4。因为 en是二齿配体,2个en分子中共含有4个可被利用的配原子N。
配配 位位
子 体数
内界 外界
配合物
NH3
NH3 Cu2+ NH3 SO42-
NH3
K3[Fe(CN)6]
中 心 离
配配 位位
子 体数
外界 内界 配合物
K+
CN
CN
CN
Fe3+
CN K+
CN
CN
K+
1:中心原子(离子) 中心原子也称为配合物形成体,它位于配离子的
中心,一般是金属离子,特别是过渡金属离子,也有一些是金属原子。 注意,书写中心原子时应标出其所带电荷数。 常见的中心离子有:Ag+、Cu2+、 Zn2+、 Fe2+、 Fe3+、 Al3+ 、Cr3+ 、Co3+ 、 Pt4+等。
由单齿配体形成的配合物,中心离子的配位数等于配体的数目;若配体
是多齿的,那么配体的数目不等于中心离子的配位数。
一般地说,中心原子的电荷数为+1、+2、+3时,其配位数分别为2、4、 6。
4. 配离子的电荷数 配离子所带的电荷数等于中心原子的化合价和配
体总电荷数的代数和 。
(1)根据外界离子确定配离子的正负电荷数。
原因:加入Fe2(SO4)3后,Fe3+与CN-生成了复杂离子[Fe(CN)6]3-,虽 然[Fe(CN)6]3-离子结构中似乎还存在CN-,但溶液中已不存在游离的 CN-离子,因而毒性消失。
配离子:由简单阳离子(或原子)和一定数目的中性分子或阴离子通过配位 键结合,并按照一定的组成和空间构型所形成的复杂离子称为配离子。如: [Cu(NH3)4]+ 四氨合铜(Ⅱ)离子 [Fe(CN)6]3- 六氰合铁(Ⅲ)离子
配位化合物(简称配合物):含有配离子化合物或配分子称为配合物。
如: [Cu(NH3)4]SO
硫4 酸四氨合铜(Ⅱ)
K3[Fe(CN)6] 六氰合铁(Ⅲ)酸钾
二、配合物的组成
配离子是配合物的核心部分,而配位键则是其结构的基本特征。配合 物一般可分为内界和外界两个组成部分。内界是由配离子组成的,写在 方括号内,与配离子带相反电荷的其它离子为外界。
.
铵离子的形成:
氨分子中氮原子上有一对孤对电子,而氢离子没有电子,当它们 相互作用时,氮原子的孤对电子就和氢离子共用,形成配位键。
配位键形成的条件为:
(1)成键的一方必须具有含孤对电子的原子;
(2)成键的另一方必须是具有空轨道的离子或原子团。
讲授新课: 第一节 配合物的基本概念
一、配位化合物的定义
