OMEGA小提试剂盒提取质粒步骤(无内毒)
OMEGA试剂盒操作步骤

1.称取500 mg玻璃珠于2 mL离心管中,加入0.2~0.5 g的土壤样品(最好不要超过0.3 g)。
加入1 mL SLX Mlus Buffer。
快速研磨仪65 Hz研磨2 min(时间还需要摸索调整)。
2.加入100 μL DS Buffer涡旋混匀。
3.70 ℃水浴10 min,在水浴过程中快速涡旋一下。
对于一些难以溶解的菌体,提高温度到90 ℃。
(一般将水浴温度设定为80 ℃。
)4.常温下3000 rpm 离心 3 min。
将800 μL上清液移取到2 mL 离心管中,加入270 μL SP2 Buffer,涡旋彻底混匀。
5.冰浴5 min,4 ℃ 13000 x g 离心5 min。
6.小心吸取上清液移至2 mL 离心管中,加入0.7倍体积的异丙醇。
反复颠倒20~30次混匀,将样品置于-20 ℃下 1 h。
7. 4 ℃ 13000 x g 离心10 min,沉淀DNA。
8.小心弃去上清液,确保没有丢失DNA颗粒。
将离心管倒置在吸水纸上1 min,除干液体。
9.加入200 μL Elution Buffer,涡旋10 s。
65 ℃水浴10~20 min 溶解DNA。
(具体时间根据离心管底部沉淀决定。
)10.加入50~100 μL HTR Reagent(由溶液颜色深度决定),涡旋10 s彻底混匀。
注意:HTR Reagent使用前需要摇晃瓶子使其混匀。
11.室温下静置2 min。
13000 x g 离心2 min。
12.将清澈的上清液移至2 mL 管中。
注意:如果上清液一直是土壤的暗色的话,重复步骤10~12 HTR的处理。
13.加入等体积的 XP2 缓冲液,涡旋混匀。
例如:如果第12步处理完溶液体积为250 μL,则加入250 μL XP2 缓冲液。
14.将第13步所得的液体涂到已装上收集管HiBind DNA Column 上。
10000 x g 室温离心1 min。
弃去流下的液体,收集管可以重新使用。
OMEGA小提试剂盒提取质粒步骤

OMEGA小提试剂盒提取质粒步骤以下是使用OMEGA小提试剂盒提取质粒的步骤:1. 打开Omega小提试剂盒,并将试剂瓶放置在室温下15-30分钟,以使其达到室温。
同时,将所需试剂加热至37°C,并准备其他必要的材料和试剂。
2.使用无菌技术,取出含有目标质粒的菌落并转移到15mL离心管中。
注射100-500µL的STET缓冲液(一种细胞裂解缓冲液)至离心管中。
3. 使用无菌技术,将质粒菌落悬浮液均匀涂布到2% Made by Omicron小鼠胚胎或其他适当的琼脂糖琼脂糖板(SD盘)上。
将板培养在37°C的培养箱中,24-48小时。
4.在培养后,用移液器或吸管轻轻吹气将质粒菌落悬浮液从SD盘转移到1.5mL(或2mL)离心管中。
5.离心细胞,以将固体与培养上清分离。
将离心条件设置为13,000×g,4°C,5分钟。
6.丢弃上清液并用1mLSTET缓冲液洗涤菌落。
在洗涤步骤中,轻轻上下振荡离心管,以确保洗涤液均匀地覆盖菌落。
7.离心细胞,以将液体与固体分离。
将离心条件设置为13,000×g,4°C,5分钟。
丢弃上清液。
8.重新悬浮菌落,使用约200-500µLSTET缓冲液,并轻轻振荡离心管,直到完全悬浮。
9. 取1.5 mL离心管中的样品,加入等体积的Lysis Buffer G2,并快速倒置混合,以完全裂解细胞,并将细胞内容物释放到溶解液中。
10. 加入等体积的N3 Buffer,并轻轻倒置混合,以中和裂解反应。
11. 加入等体积的G3 Buffer,并轻轻倒置混合。
此时,样品已经准备好进行DNA纯化。
请注意,上述步骤仅提供了OMEGA小提试剂盒提取质粒的基本步骤。
根据具体实验要求和试剂盒的使用说明,步骤可能会有所不同。
在开始实验之前,请仔细阅读并遵守试剂盒的使用说明。
omega质粒提取试剂盒原理

omega质粒提取试剂盒原理
omega质粒提取试剂盒是一种快速提取质粒的试剂盒,原理基于离心法和碱裂解法。
质粒提取步骤如下:
1.细菌菌落挑选:选择莱茵氏或理光法制备的菌落,接种到含有复性2倍YT培养基中的管中,温育至15-18小时,使生长到中期即可。
2.洗涤菌体:离心收集菌体细胞,使用TE液洗涤菌体,通过离心去除菌体细胞内部的杂质。
3.裂解细胞:用离心的菌体用Alkali Lysis Buffer裂解细胞。
使得细胞壁和细胞膜破裂,游离出细菌的质粒和基因组DNA。
此时保持碱性能稳定质粒。
4.中和试剂添加:使用HCl溶液中和裂解碱的催化活性,维持实验体系pH值在7.0左右。
5.离心收集DNA:用NaCl把DNA从碱性溶液中析出,并通过离心将DNA沉淀下来。
6.洗涤DNA:用乙醇洗涤钠盐,去除残留的离子,甘油可保持溶液中的DNA
稳定性。
7.重悬质粒:将去除干扰物后的纯质粒在TE缓冲液中重悬,即可用于下一步实验。
质粒小提步骤[推荐]
![质粒小提步骤[推荐]](https://img.taocdn.com/s3/m/c8d5f3c6250c844769eae009581b6bd97f19bc97.png)
BIOMIGA质粒小提试剂盒II简明步骤(PD1213)(详细内容请参考英文说明书)I. 实验前准备 II. 注意事项RNase A: 使用前将提供的所有RNase A瞬时离心后加入Buffer A1, 使用后将Buffer A1/RNase A置于4oC保存。
质粒拷贝数:纯化中低拷贝的质粒时,使用2倍的菌液体积,2倍的Buffer A1,B1,N1, 相同体积的Wash Buffer 和Elution Buffer. DNA Wash Buffer*: 使用前请将8 mL (PD1213-00)或48 mL (PD1213-01)或216 mL (PD1213-02) or 90 mL (PD1213-转化菌:若为-70oC 甘油冻存的菌,请先涂布平板培养03)96-100% 乙醇加入DNA Wash Buffer。
后,再重新挑选新的单个菌落进行培养。
Buffer B1: 在低于室温时会沉淀,请于50oC左右水浴加热至沉切勿直接取冻存的菌种进行培养。
淀完全溶解,溶液澄清,使用后保证Buffer B1瓶盖旋紧。
在室温下(22-25oC)进行所有离心操作。
III. 操作步骤若用于提取1-5 mL的菌落,请将Buffer A1, B1, N1的量降低至250 μL, 250 μL 及350 μL,DNA wash Buffer及Elution Buffer的量不变。
1. 接种新鲜的单个菌落到5-12 mL的LB培养基(含适量抗生素),37oC震荡培养14-16小时(勿超过16小时)。
2. 室温下10,000 x g离心1分钟,收集菌体,并尽可能的吸去上清。
注:残留的液体培养基容易导致菌体裂解不充分,第5步离心后沉淀较松,不易吸取上清。
注:本说明书中的操作程序适用于标准LB (Luria Bertani)培养基培养12-16 小时后,OD600(细菌密度)在之间的菌液。
若采用的是富集培养基,如TB或2×YT,注意保证OD600不超过。
质粒小提试剂盒提取质粒

质粒小提试剂盒提取质粒
(1)柱平衡步骤:向吸附柱CP3中(吸附柱放入收集管中)加入500μL的平衡液BL,12,000rpm离心1分钟,倒掉收集管中的废液,将吸附柱重新放回收集管中;
(2)取1-5ml过夜培养的菌液,加入离心管中,使用常规台式离心机,12,000rpm离心1分钟,尽量吸除上清;
(3)向留有菌体沉淀的离心管中加入250μL溶液P1(先检查是否已加入RNaseA),使用移液器或涡旋振荡器彻底悬浮细菌沉淀;
(4)向离心管中加入250μL溶液P2,温和地上下翻转6-8次使菌体充分裂解;
(5)向离心管中加入350μL溶液P3,立即温和地上下翻转6-8次,充分混匀,此时将出现白色絮状沉淀。
12,000rpm离心10分钟,此时在离心管中底部形成沉淀;
(6)将上一步收集的上清液用移液器转移到吸附柱CP3中,注意尽量不要吸出沉淀。
12,000rpm离心30-60秒,倒掉收集管中的废液,将吸附柱CP3放入收集管中;
(7)向吸附柱CP3中加入600μL漂洗液PW(先检查是否已加入无水乙醇),12,000rpm离心30-60秒,倒掉收集管中的废液,将吸附柱CP3放入收集管中;
(8)重复操作步骤(8);
(9)将吸附柱CP3放入收集管中,12,000rpm离心2分钟,目的是将吸附柱中残余的漂洗液除去;
(10)将吸附柱CP3置于一个干净的离心管中,向吸附膜的中间部位滴加50-100μL洗脱缓冲液EB,室温放置2分钟,12,000rpm离心2分钟将质粒溶液收集到离心管中。
小提质粒实验方案及详细步骤
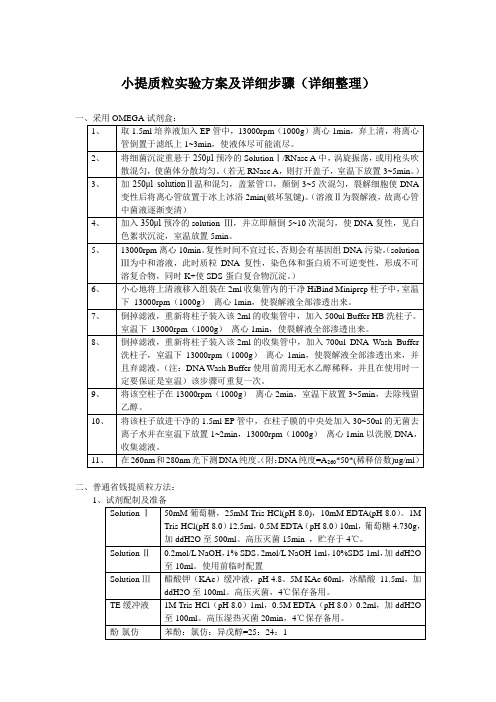
2、
3、Leabharlann 4、 5、 6、 7、Solution Ⅱ Solution Ⅲ TE 缓冲液 酚-氯仿
无水乙醇 70%乙醇 其他准备 2、具体操作步骤 1、 取 1.5ml 培养液加入 EP 管中,12000rpm 离心 2min,弃上清,将离心管倒 置于滤纸上 1~3min,使液体尽可能流尽。将细菌沉淀重悬于 100μl 预冷的 SolutionⅠ中,吹打混匀,剧烈振荡,使菌体分散均匀。打开盖子,室温 下放置 3~5min。 加 200μl 新鲜配制的 solutionⅡ,盖紧管口,颠倒 3~5 次混匀,动作温和, 裂解细胞使 DNA 变性后将离心管放置于冰上冰浴 5min(破坏氢键), (溶液 Ⅱ为裂解液,故离心管中菌液逐渐变清) 加入 150μl 预冷的 solution Ⅲ,将管温和颠倒 5~10 次混匀,使 DNA 复性, 见白色絮状沉淀,在冰上放置 5min。12000rpm 离心 10min。复性时间不 宜过长,否则会有基因组 DNA 污染。 (solution Ⅲ为中和溶液,此时质粒 DNA 复性,染色体和蛋白质不可逆变性,形成不可溶复合物,同时 K+使 SDS- 蛋 白 复 合 物 沉 淀 。 )根据菌体的量调节三种溶液的比例,保证 solution1:solution2:solution3=1:2:1.5 将上清液移入干净 EP 管中,加入 450μl 的苯酚/氯仿/异戊醇,振荡混匀, 4℃,12000rpm 离心 5min 将上清液移入另一干净 EP 管中, 加入 2.5 倍体积预冷的无水乙醇混匀 (轻 柔) ,置于-20℃冰箱放置 20min,4℃下 12000rpm 离心 10min。 弃上清,用 1ml 预冷的 70%乙醇洗涤沉淀 1-2 次,4℃离心 8000rpm,5min, 弃上清,将 EP 管倒扣与滤纸上流尽水分。静置一会儿使乙醇挥发干净。 向沉淀中加入 50μl TE 缓冲液,使 DNA 完全溶解,-20℃保存备用。 高压灭菌锅,冷冻离心机,移液枪,EP 管,滤纸,枪头,提前制冰。
质粒抽提步骤2012-6-13 OMEGA

质粒的提取
1、原理:破菌后,由于细菌基因组DNA和质粒的分子量及结构不一样,在不同pH状况下,可以将两者分离,然后进行纯化,就可以得到较纯的质粒。
2、质粒抽提步骤
(1)将带有质粒的E.coli接种于5ml LB、抗生素培养液中,37度摇床培养12-16h。
(2)取1.0-5.0ml的菌液,室温下10000×g离心1min收集菌液。
(3)倒弃培养基。
加入250μL Solution I/RNaseA混合液,漩涡振荡使细胞完全悬浮。
(4)往重悬混合液中加入250μL Solution II,轻轻颠倒混匀4-6次。
此操作避免剧烈混匀裂解液且裂解反应不要超过5min。
(5)加入350μL Solution III,温和颠倒数次至形成白色絮状沉淀。
(6)室温下,大于或等于10000×g离心10min。
(7)转移上清液至套有2ml收集管的Hi Bind DNA结合柱中,室温下,10000×g离心1min,倒去收集管中的滤液。
(8)把柱子重新装回收集管,加入500μL HB Buffer,按上述条件离心,弃去滤液。
(9)把柱子重新装回收集管,加入700μL DNA Wash Buffer,按上述条件离心,弃去滤液。
(10) (可选)弃去滤液,重复第9步骤一次。
(11)弃去滤液,把柱子重新装回收集管,10000×g离心空柱2min 以甩干柱子基质。
(12)把柱子装在干净的1.5ml离心管上,加入30-50μL Elution Buffer 到柱子基质中,静置1-2min,10000×g离心1min洗脱出DNA。
omega质粒小提protocol

Omega 质粒小提试剂盒protocol主要试剂1. 使用前,将RNase A全部加入Solution I中并于4度保存。
2. 按下表用无水乙醇稀释DNA Wash Buffer,并于室温保存。
D6942-00: 加入6 ml无水乙醇D6942-01: 加入120 ml无水乙醇3. 按下表用异丙醇稀释HBC Buffer,并于室温保存。
D6942-00: 加入1.6 ml无水乙醇D6942-01: 加入16 ml无水乙醇D6942-02: 加入32 ml无水乙醇试剂配方及作用Solution I组分浓度25 mM Tris-HCl(pH8.0),10 mM EDTA,50 mM 葡糖糖(Glucose)溶液1的主要作用是将菌体沉淀悬浮起来。
25mM Tris-HCl是缓冲溶液,保证反应体系的pH 恒定。
EDTA是金属离子螯合剂,10 mM EDTA的作用是与微生物体内的金属离子相互结合,抑制DNase的活性。
50 mM葡萄糖的作用是增加溶液的粘度,保证菌体悬浮,延缓菌体沉降的时间。
溶液1在使用前通常要加入RNA酶(RNase A),RNA酶的作用很清楚,降解掉溶液中的RNA。
由于RNA酶属于蛋白质,蛋白质稳定性很差,所以加了RNase A的溶液1需要低温4℃保存。
Solution II组份浓度250 mM NaOH,1%(W/V)SDS(十二烷基硫酸钠)溶液2的主要作用是细胞裂解。
溶液1将细胞悬浮后,就需要添加溶液2了,溶液2的作用就是对细胞进行裂解。
溶液2只包括两种成分:氢氧化钠和SDS。
真正起到到细胞裂解作用的是氢氧化钠,这也是为什么这个方法会被叫做碱裂解法。
氢氧化钠会破坏细胞膜的结构,使之发生bilayer(双层膜)结构向micelle(微囊)结构的相变化,从而导致细胞的裂解。
SDS的作用将在下一步提到。
添加溶液2后需要注意的一个是时间一定不能过长,另一个是不可以剧烈震动离心管。
时间过长以及剧烈震动都将导致氢氧化钠破坏基因组DNA,断裂的基因组DNA碎片将会与相似大小质粒一同被抽提,污染样品。
无内毒素质粒大提取试剂盒中文操作指南

无内毒素质粒大提取试剂盒中文操作指南(omega)详细内容:E.Z.N.A. ® Fastfiler Endo-free Plasmid MaxiprepProtocol(无内毒素质粒大抽提)1. 在1-4升的培养瓶中加入200-500ml LB培养基,然后加入菌种于37℃摇床培养12-16小时;Tip:为获得最好的结果,请接种1ml培养过夜的菌种(12-16hr)。
并强烈推荐使用E.coli(endA-)品系用于常规的质粒提取,如DH5a和JM109。
注意:菌液的培养时间不能超过16小时;2. 收集200ml培养基至适当的离心管,室温下,3,500-5,000×g离心10分钟沉淀;3. 吸尽并去除培养基,用干净的吸水纸吸尽壁上多余的液体。
加12.0ml Solution I/RNase A到细菌培养物中,涡旋和枪头抽打细菌以重悬细胞;注:充分重悬细菌沉淀物对获得高产量的质粒是相当关键的。
充分重悬后溶液是均匀的,不存在小块物质;请尽量吸弃残余的培养基以防止稀释加入的溶液;4. 加入12.0ml SolutionII,轻轻颠倒旋转混匀7-10次至获得澄清的裂解液;室温放置3-5分钟可以有是必须的。
避免剧烈振荡混匀而打断染色体DNA,降低质粒的纯度。
(Solution II使用后请盖紧盖子且于室温保存);5. 将取出Lysate Clearance Filter Syrine活塞,将其放置于架子上;6. 加入12 ml Neutralization Buffer,轻轻颠倒混匀几次至出现絮状沉淀。
这可能需要放置2-3分钟并间断颠倒混匀;7. 立即将裂解液转移到lysate Clearance Filter Syrine中,垂直放置5分钟。
这时白色的絮状沉淀物会漂上溶液的上层,裂解液可能开始流出过滤器,用新的50ml管子收集细菌裂解液,并将活塞轻轻插入过滤器中;8. 握住过滤器,轻轻推动活塞将裂解液打到收集管中;注意不要将任何杂质打到收集管中;9. 加入0.1体积的ETR Solution(蓝色)到收集液中,轻轻颠倒旋转混匀7-10次,冰浴放置20分钟;注意:加入ERT Solution后,溶液应变得浑浊,但冰浴静置后溶液应是澄清的。
无内毒素质粒小提中量试剂盒操作方法及步骤说明书

杭州昊鑫生物科技股份有限公司 htpp://EndoFree Plasmid Midi Kit无内毒素质粒小提中量快速提取试剂盒目录号:PL10试剂盒组成、储存、稳定性:试剂盒组成保存50次(PL1001)平衡液室温5mlRNaseA(10mg/ml)-20℃250µl溶液P1 4℃25 ml溶液P2 室温25 ml溶液N3 室温25 ml内毒素清除剂-20℃10 ml漂洗液WB 室温15 ml第一次使用前按说明加指定量乙醇洗脱缓冲液EB 室温15ml吸附柱AC 室温50个收集管(2ml)室温50个本试剂盒在室温储存12个月不影响使用效果。
内毒素清除剂常温运输,4度可以保存一个月,长期保存放-20℃。
储存事项:1.第一次使用时,将试剂盒所带的全部RNase A加入溶液P1后(终浓度100ug/ml)置于2-8℃保存。
如果溶液P1中RNase A失活,提取的质粒可能会有微量RNA 残留,在溶液P1中补加RNase A即可。
2.环境温度低时溶液P2中SDS可能会析出浑浊或者沉淀,可在37℃水浴加热几分钟,即可恢复澄清,不要剧烈摇晃,以免形成过量的泡沫。
3.避免试剂长时间暴露于空气中产生挥发、氧化、pH值变化,各溶液使用后应及时盖紧盖子。
产品介绍:本试剂盒采用改进SDS-碱裂解法裂解细胞,通过独特的内毒素清除剂选择性结合离心除去内毒素,然后离心吸附柱内的硅基质膜在高盐、低pH值状态下选择性地结合溶液中的质粒DNA,再通过去蛋白液和漂洗液将杂质和其它细菌成分去除,最后低盐、高pH值的洗脱缓冲液将纯净质粒DNA从硅基质膜上洗脱。
产品特点:1.离心吸附柱内硅基质膜全部采用进口世界著名公司特制吸附膜,柱与柱之间吸附量差异极小,可重复性好。
克服了国产试剂盒膜质量不稳定的弊端。
2.独特工艺配方清除内毒素,内毒素含量极低(<0.1 EU/μg DNA),细胞转染效果极佳。
也可直接用于酶切、转化、PCR、体外转录、测序、等各种分子生物学实验。
质粒提取试剂盒提取步骤

质粒提取试剂盒提取步骤
一、质粒抽提
1、细胞抽提:将细胞培养物加入或移植到一种含有高浓度酸性剂的6-8mm离心管里,将细胞离心至半浸没,以保持溶液沉积在离心管壁上。
2、除去膜:添加浓酸溶液(如硫酸氢钠(NaHSO3)),膜结构会被溶解,使其细胞表面的结构被破坏,从而除去细胞的膜。
3、去染色:添加RNA隔离试剂,脱去细胞染色物质以获得高纯度的RNA质粒。
4、离心:离心至接近干旱,并移除液体,这时的混合液中已只剩下RNA质粒。
5、抹拭:将离心管倒过来,将质粒在管壁上均匀抹拭,这时的RNA 质粒就会在管壁上附着。
6、冷冻干燥:将管子放到冰上,将管子中的水分蒸发冷冻干燥,使RNA质粒固定在管壁上。
7、溶解:最后,将RNA质粒溶解到可以用于后续实验的溶液中。
二、PCR扩增:
1、PCR建库:将抽提的DNA放入PCR管中,加入PCR反应混合液(包括DNA聚合酶、dNTPs和MgCl2),并添加特长引物,即可进行PCR 反应。
2、PCR扩增:使用PCR反应温度循环加热并添加高分子量DNA来将DNA片段扩增。
3、电泳:将PCR配型片段送到电泳仪中,使用添加特异性引物的特定电泳条件,检测和鉴定基因突变。
无内毒素质粒小量提取试剂盒使用说明

10、 向 吸 附 柱 中 加 入 500ul 漂 洗 液 , 12000rpm 离 心 1min, 弃 废 液 , 将吸附柱放入收集管中。
3、向 离 心 管 中 加 入 200ul 溶 液 P2,温 和 地 上 下 翻 转 6-8 次 使 菌 体 充 分 裂 解 。 注 意 : 混 匀 一 定 要 温 和 , 以 免 污 染 细 菌 基 因 组 DNA, 此 时 菌 液 应 变 得 清 亮 粘 稠 , 作 用 时 间 不 要 超 过 5 min, 以 免 质 粒 受 到 破 坏 。
2. 洗 脱 缓 冲 液 体 积 不 应 少 于 50ul, 体 积 过 小 影 响 回 收 效 率 ; 洗 脱 液 的
pH 值 对 洗 脱 效 率 也 有 影 晌 ,若 需 要 用 水 做 洗 脱 液 应 保 证 其 pH 值 在 8.0 左 右 (可 用 NaOH 将 水 的 pH 值 调 至 此 范 围 ), pH 值 低 于 7. 0 会 降 低 洗 脱 效 率。
由于质粒dna本身的性质清除过程可导致部分质粒dna丢失但内毒素却能得到最大限度清所有溶液应用无内毒素的高纯水配制所有器械材料均应不含内毒素玻璃器皿可高温烘烤非挥发性水溶液可高压处理
无内毒素质粒小量提取试剂盒使用说明 货 号 : D1140 规 格 : 50T/100T 保存:常温干燥保存,复检期为一年。 试剂盒内容:
有 机 化 合 物 。 内 毒 素 清 除 剂 可 最 大 限 度 地 除 去 内 毒 素。 从 1-5ml 大 肠 杆 菌 LB 培 养 液 中 ,可 快 速 提 取 5-15μ g 高 纯 度 质 粒 DNA,提 取 率 达 85-90%。使 用 本 试 剂 盒 提 取 的 质 粒 DNA 纯 度 高 ,可 直 接 用 于 细 胞 转 染 等 要 求 较 高 的 实 验 , 以 及 其 他 各 种 常 规 操 作 , 包 括 酶 切 、 PCR、 测 序 、 连 接 和 转 化 等 试 验 。
OMEGA质粒提取试剂盒操作步骤

OMEGA质粒提取试剂盒操作步骤1.预处理:将待测细菌液培养在含有适当抗性选择性的LB培养基中,并在适宜条件下培养至细菌达到对数期。
使用适当的离心参数和时间离心,使得细菌达到沉淀准备。
2.应激液制备:向OMEGA质粒提取试剂盒中的应激液瓶中加入8mL已过滤的异丙醇试剂A,并充分混合。
此时,应激液瓶中的液体会变成粉红色。
注意:应激液不能加入异丙醇试剂A之前。
3.柱洗液制备:向OMEGA质粒提取试剂盒中的柱洗液瓶中加入25mL已过滤的异丙醇试剂B,并充分混合。
此时,柱洗液瓶中的液体会变成黄色。
注意:柱洗液不能加入异丙醇试剂B之前。
4.提取液制备:将OMEGA质粒提取试剂盒中的提取液瓶取出,充分振荡混合,使其中的液体变为均匀的浑浊状态。
5.细菌沉淀:使用离心机将培养好的细菌培养物离心,设置好适当的离心参数和时间,使细菌达到沉淀。
6.破细胞:将上述离心后的细菌沉淀转移到50mL离心管中,加入10mL提取液,并用转粉棒均匀悬浮细菌。
细菌悬浮液较黏稠,加入提取液后需充分混匀。
7.混合物平衡:将OMEGA质粒提取试剂盒中的A离心管插入破细胞悬浮液,盖上盖子,轻轻翻转转动10次,使混合物均匀。
8.吸附:将A离心管放置于试剂离心机上,以最大转速离心3-5分钟,使质粒DNA吸附到离心管壁上。
离心后离心管内会有质粒DNA沉积在管壁上,上清液中几乎没有DNA。
9.液体除去:将上清液倒出(若有残留无形的DNA,不会影响测量质粒DNA浓度和纯度)。
10.洗涤:向吸附质粒DNA的A离心管中加入0.8mL柱洗液,并放入离心机中以最大转速离心1分钟将柱洗液完全通过。
注意:此步骤中重要的是将柱洗液完全通过以去除杂质。
11.干燥:向A离心管中加入0.8mL柱洗液(保险柱),并通过离心室加热器以60℃加热干燥10-30分钟,使水分从柱中蒸发。
注意:此过程必须在脱水状态下进行。
12.质粒DNA洗脱:向A离心管中加入50μL的去离子水,并计时5分钟,使质粒DNA从固相柱上洗脱出来。
OMEGA试剂盒使用步骤

OMEGA试剂盒1、称量0.5g的玻璃珠(一盒试剂盒中的量可以均分为五份,一次一份),加入样品中,然后加入1ml Buffer SLX, 漩涡震荡5min。
(可借助漩涡震动仪)2、加入100微升DS Buffer混匀。
(可颠倒数次)3、70摄氏度水浴10min,上下颠倒混匀。
(70摄氏度为溶菌酶最适反应温度)(此时可准备后边要用的2ml EP 管,并准备后边冰浴要用的冰)4、3000rpm离心3min,取800微升上清至2ml EP 管,再加入270微升Buffer SP2 ,混匀。
5、冰浴5min,13000g,4摄氏度,5min。
6、转上清至2ml EP 管,加入0.7倍体积异丙醇,颤倒30次,混匀。
7、13000g,4摄氏度,10min,离心。
8、弃上清,倒置于滤纸上,空干。
(不一定非常干)9、加200微升Elution Buffer,吹打混匀,再65摄氏度水浴20min。
10、加70微升(50~100微升)HTR(由于该溶液颗粒较大,可用100微升枪头剪去部分尖端,用100微升量程取加),混匀10s,室温放置2min。
11、13000g,2min,吸取上清至新2ml EP 管中。
12、加入等体积XP2 Buffer混匀。
13、吸附柱套入收集管,样品倒入吸附柱,10000g 1min,弃废液,重新套入收集管。
14、加入700微升SPW,10000g 1min,弃废液,重新套入收集管。
15、重复14。
16、套入收集管,空管离心,条件13000g,2min。
17、取吸附柱套入1.5ml EP管,加入50微升Elution Buffer或者TE Buffer,60摄氏度水浴15min。
(60摄氏度时蛋白酶K最适反应温度)18、13000g离心1min。
19、重复17、18。
20、得到100微升。
近期使用可4摄氏度保存或者-20摄氏度。
OMEGA质粒提取试剂盒操作步骤

OMEGA质粒提取试剂盒操作步骤1.在10-20ml试管中,将携带有所需质粒的接种到5ml LB培养基LB(含氨苄青霉素50μg/ml),37℃振荡培养12-16h。
需特别指出的是:endA阴性的菌株用于常规质粒提取,如DH5α和JM109.2.取~5ml菌液室温10000×g离心1min3.去上清,加250µl溶液Ⅰ(含RNase A),涡漩振荡器震荡至菌体完全悬浮。
4.加入250µl溶液Ⅱ,温和颠倒离心管4~6次,获得澄清的裂解液。
最好室温孵育2min,剧烈混合会使剪切染色体DNA,降低质粒纯度。
(储存溶液Ⅱ应拧紧瓶盖)5.加350µl溶液Ⅲ,温和颠倒数次混合,至出现白色絮状沉淀6. 室温13000×g离心10min.7.特别小心吸取上清,移至洁净的装配好容积2ml离心管的吸收柱中。
要保证没有吸入沉淀和细胞碎片。
室温10000×g离心1min,至裂解物完全通过吸收柱8.弃滤过液,加500µl Buffer HB,10000×g离心1min,清洗吸收柱,除去残余蛋白质保证DNA的纯度。
如果接下来的步骤对质粒纯度要求不高,如酶消化法等其它筛选方法,此步可省略9.弃滤过液,再用100%乙醇稀释的700µl Wash Buffer清洗吸收柱,10000×g离心1min.注意:Wash Buffer浓缩液用前必须用纯乙醇稀释,方法见标签,如果经过冷冻,用前必须恢复室温10.此步可选:再加700µl Wash Buffer清洗吸收柱11.必须将吸收柱13000×g离心2min确保乙醇被去除,乙醇会影响下面的步骤。
12.将吸收柱放入干净离心管,加30-50µl(取决于需要的终浓度)无菌去离子水或TE缓冲液在滤膜上,13000×g离心1min,一次可洗脱75-80%附着DNA(可进行再洗脱,但会降低DNA浓度)。
E.Z.N.A.试剂盒小提质粒 中文说明

E.Z.N.A.凝胶回收试剂盒操作步骤GDS8000凝胶成像系统操作说明E.Z.N.A.试剂盒小提质粒2009-03-04 21:36:08| 分类:分子克隆|字号订阅1. 在无菌条件下,从转化成功的培养板上挑取单个菌落接种于5ml含有适当抗生素的LB液体培养基,37℃、约300rpm振荡培养12~16h。
2. 菌种的保存:取菌液1ml,加入0.5ml浓度为15-20%的灭菌甘油,混匀,分装于无菌的EP管中,冻存于-70℃。
将剩余菌液分装到2个EP管中,每管1.5ml菌液。
10000g 室温下离心1min,轻轻吸掉上清,尽可能吸尽。
3. 在EP管中各加入250μl Solution Ⅰ/RNase A,吹打(或涡旋)至细胞完全悬浮。
4. 加入250μl Solution Ⅱ,轻轻颠倒混匀数次(其间旋转EP管),得到澄清的裂解液。
然后温育2min(避免剧烈混合造成染色体DNA断裂以降低质粒纯度,裂解反应不能超过5min)5. Solution Ⅱ不用时应盖紧盖子,避免空气中CO2的酸化)。
6. 加入350μl Solution Ⅲ,立即上下颠倒数次直至白色絮状沉淀生产(混匀要完全、即时,避免局部出现沉淀)。
7. 室温下13000g离心10min,出现紧密的白色沉淀,立即进行下一步。
8. 将HiBind Miniprep Column柱装到2ml收集管中,小心吸取上清,加至柱子中,确保不要扰动沉淀,以免把细胞碎片带入柱子中。
室温下10000g离心1min,使裂解液完全过柱。
9. 移开柱子,弃去收集管中的液体,并将柱子重新插入收集管中,加入500μl Buffer HB,静置2min,10000g室温离心1min,使溶液完全过柱(此步骤确保残留的蛋白被除去)。
10. 弃去收集管中的液体,重新将柱子装好,加入700μl DNA Wash Buffer(加过无水乙醇的),静置2min,10000g室温离心1min使溶液完全过柱,弃掉收集管中的液体。
omega试剂盒提取质粒实验报告

omega试剂盒提取质粒实验报告Omega试剂盒提取质粒实验报告1. 引言1.1 背景1.2 目的2. 实验设计2.1 实验材料2.2 实验步骤3. 实验结果与分析3.1 DNA浓度测定结果3.2 DNA纯度测定结果3.3 质粒提取效果评估4. 讨论与结论4.1 实验结果解读4.2 实验优化方向5. 参考文献1. 引言1.1 背景:质粒是一种环状的DNA分子,常用于基因工程和分子生物学研究中。
为了获得高质量的质粒DNA,常采用试剂盒提取方法。
Omega试剂盒是一种常用的质粒提取试剂盒,具有高效、快速、方便等优点。
1.2 目的:本实验旨在使用Omega试剂盒提取质粒,并评估其提取效果。
2. 实验设计2.1 实验材料:- Omega试剂盒- E.coli菌株含有目标质粒的培养物- TE缓冲液(pH=8)- 离心管- 离心机- 分光光度计2.2 实验步骤:1. 从含有目标质粒的E.coli培养物中取出1 mL菌液,离心10分钟(10000 rpm,4°C)。
2. 弃去上清液,加入适量的TE缓冲液悬浮细胞沉淀。
3. 加入Omega试剂盒提供的裂解缓冲液,并充分混匀。
4. 将混合物转移到Omega试剂盒提供的离心管中,并离心5分钟(12000 rpm,室温)。
5. 将上清转移至新的离心管中,加入等体积的异丙醇,并轻轻倒置混匀。
6. 离心10分钟(12000 rpm,室温),将上清弃去。
7. 加入70%乙醇洗涤沉淀物,并再次离心5分钟(12000 rpm,室温)。
8. 弃去上清液,空气干燥沉淀物。
9. 加入适量的TE缓冲液重溶。
3. 实验结果与分析3.1 DNA浓度测定结果:使用分光光度计测定提取得到的质粒DNA溶液的吸光度,根据吸光度值计算DNA浓度。
3.2 DNA纯度测定结果:使用分光光度计测定提取得到的质粒DNA溶液的吸光度比值(A260/A280),判断DNA的纯度。
3.3 质粒提取效果评估:根据实验结果中所得到的DNA浓度和纯度,评估Omega试剂盒的质粒提取效果。
试剂盒质粒提取步骤

1用1."5 ml离心管收集1-5 ml菌液。
12,000 rpm离心1min,弃上清。
●应根据所培养菌体的浓度与质粒的拷贝数,确定收集的菌液量。
菌量过大可能导致溶菌不充分,纯化时会影响质粒纯度。
菌体的体积与质粒拷贝数参见注意事项。
2加入250μl溶液Ⅰ/RNase A混合液,漩涡剧烈振荡直至菌体完全重新悬浮。
室温静臵1- 2min。
●初次使用本试剂盒时,请将RNase A全部加入到溶液Ⅰ中,均匀混合后于4℃保存。
可保存6个月。
●不要残留细小菌块。
菌体悬浮充分与否将决定质粒DNA得率的高低。
●室温静臵1-2 min是为使溶液中的RNA被充分降解。
3加入250μl溶液Ⅱ,轻柔地反复颠倒混匀5-6次。
室温放臵1-2min,使菌体充分裂解,直至形成澄清的裂解溶液。
●若溶液Ⅱ出现沉淀,请于37℃保温溶解。
待恢复至室温后使用。
沉淀的出现不会影响质粒DNA的纯化结果。
●不可剧烈混和,否则会使染色体DNA断裂。
●此步骤不宜超过5 min。
4加入350μl溶液Ⅲ,立即轻柔地反复颠倒混匀5-6次。
此时会出现白色絮状沉淀。
5 12,000 rpm室温离心10 min,收集上清。
6将上清臵于DNA纯化柱中,静臵1-2 min。
●如果收集的上清液过多,超过DNA纯化柱容积(800μl),可将上清分次加入DNA纯化柱中。
7 12,000 rpm离心1 min,弃滤液。
●此时质粒DNA被吸附于DNA纯化柱的硅胶膜上。
8加入500μl溶液PB,12,000 rpm离心1 min,弃滤液。
●此步骤的作用是将硅胶膜上吸附的蛋白、盐等杂质洗脱,以获得高质量质粒DNA。
9加入500μl溶液W,12,000 rpm离心1 min,弃滤液。
●溶液W初次使用前用无水乙醇按1:1."5稀释,即含60%乙醇。
10加入500μl溶液W,12,000 rpm离心1 min,弃滤液。
11 12,000 rpm离心3min,以彻底去除纯化柱中残留的液体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
OMEGA小提试剂盒提取质粒步骤(中文翻译版)
1、将携带目的质粒的大肠杆菌接种于含10~15ul基础培养基/氨苄西林培养介质的50ml培养瓶中。
2、室温下500×g离心10min。
3、弃去上清,剩余沉淀物中加入500ul的SolutionⅠ/RNase A,彻底混匀。
4、将混悬液移至新的2ml离心管中,加入500ul SolutionⅡ,轻柔彻底混匀,可得清亮的细菌裂解物,室温下孵育2min(混匀时用力过大,可破碎出染色体DNA,使目的质粒纯度下降)。
5、向4中液体加入250ul预冷的Buffer N3,轻柔、彻底混匀,直到出现白色絮状沉淀,4℃≥12000×g离心10min(可室温,最好4℃)(Buffer应彻底混匀,若混合物粘稠呈棕色或呈球状,应多混匀几次以中和溶液,溶液的彻底中和对于获得好的产出是必要的)。
6、小心吸取并将上清液转移进新的1.5ml离心管1:0.1的比例向上清液中加入ETR Solution 混匀溶液并于冰上孵育10min,孵育过程中颠倒几次以混匀(加入ETR Solution后,细菌裂解物将出现浑浊,但冰上孵育后将变澄清)(勿用2ml离心管收集上清,因为2ml离心管中有太多液体时,ETR Solution将悬浮于溶液中)。
7、将6中液体于42℃孵育5min,溶液将再次变浑。
室温下12000×g离心3min,ETR Solution 将于离心管底部形成蓝色层。
8、将上层水相转移入新的2ml离心管中,按1:0.5的比例加入无水乙醇(室温,96~100%),轻柔混匀,室温下孵育1~2min。
9、将8中的溶液取700ul到柱子中,组装收集管,室温下1000×g离心1min,弃去收集管中通过柱子的液体,柱子和收集管重复利用。
10、重复9中步骤,直到收集的细菌裂解物全部用完。
11、将500ul Buffer HB加入柱子中,室温下1000×g离心1min,弃去收集管中废液(目的:将残存的蛋白污染物除去,是获得高质量DNA所必需的)。
12、向柱子中加入混有乙醇的700ulDNA Wash Buffer,室温下1000×g离心1min,弃去收集管中液体。
13、重复12中的步骤。
14、弃去收集管中液体,空管在最大转速(≥13000×g)离心3min以干燥柱子(对于移除柱子中残留的乙醇是必须的)。
15、将柱子放入新的 1.5ml离心管中,直接向柱子中的白色网状物上加入Endotoxin-Free Elution Buffer 80~100ul(依终产物浓度而定,可每次30ul×2次),室温下放置2min,≥13000×g离心1min,以洗提DNA(将提取约70~85%柱子中收集的DNA,可再重复一次以提取完全,但因再次加入洗提液,会使终产物浓度下降)。
声明:文档为自己翻译后逐字打出来的,有不妥之处望各位同行不吝赐教,以方便大家实验参考,谢谢。
