物理化学课件(天津大学第五版)--课件:第一章 气体的pVT性质
第一章气体的PVT关系

§1.2 理想气体混合物
1. 混合物的组成
(1)摩尔分数x或y
xB(或yB) nB nA
A
本书中气体混合物的摩尔分数一般用 y 表示,液体混合物的摩 尔分数一般用 x 表示。
(2)质量分数 ω B
ωB mB
mA
A
(3) 体积分数 B
B
xBVm*B, (
xAVm*A, )
V
* m,
A
A
:一定压力、温度下纯物质A的摩尔体积。
临界温度下的饱和蒸汽压为临界压力,pc 是在临界温度下使气体液化做需要的
最低压力
临界摩尔体积Vm,c:在Tc, pc下物质的摩尔体积
Tc, pc , Vm,c:临界参数
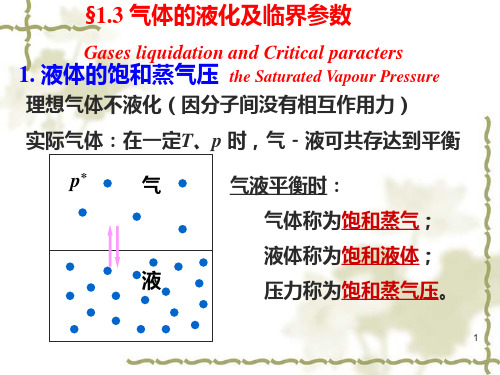
§1.3 气体的液化及临界参数
液体的饱和蒸汽压 临界参数
真实气体的p-Vm图及气体的液化
3.真实气体的p-Vm图及气体的液化
等温线的三种类型: T>Tc(不可液化) T<Tc(加压可液化) T=Tc
V VB*
B
VnR /p T ( nB)R/T p
B
(nB p R)T BV B *
VB* nBRT/ p
理想气体混合物中物质B的分体积等于纯气体B在混合 物温度及总压条件下所占有的体积。
理想气体混合物的体积具有一定的加和性。在相同 的温度和压力下,混合后的总体积等于混合前各组 分的体积之和。
由pVT数据拟合得到Z~p关系.
3. 对应状态原理
对比参数反映了气体所处状态偏离临界点 的倍数。 各种不同气体,只要两个对比参数相同, 第三个参数必相同,这就是对应状态原理。 此时的气体处于相同的对应状态。
3. 普遍化压缩因子图
将对比状态参数的表达式引入到压缩因子 定义式中,得到:
天津大学物理化学第五版上、下答案

天津大学物理化学第五版上、下答案第一章 气体pVT 性质1-1物质的体膨胀系数V α与等温压缩系数T κ的定义如下:1 1T T pV p V V T V V⎪⎪⎭⎫ ⎝⎛∂∂-=⎪⎭⎫⎝⎛∂∂=κα 试导出理想气体的V α、T κ与压力、温度的关系? 解:对于理想气体,pV=nRT111 )/(11-=⋅=⋅=⎪⎭⎫⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∂=T TVV p nR V T p nRT V T V V p p V α 1211 )/(11-=⋅=⋅=⎪⎪⎭⎫ ⎝⎛∂∂-=⎪⎪⎭⎫ ⎝⎛∂∂-=p p V V pnRT V p p nRT V p V V T T T κ 1-2 气柜内有121.6kPa 、27℃的氯乙烯(C 2H 3Cl )气体300m 3,若以每小时90kg 的流量输往使用车间,试问贮存的气体能用多少小时?解:设氯乙烯为理想气体,气柜内氯乙烯的物质的量为mol RT pV n 623.1461815.300314.8300106.1213=⨯⨯⨯== 每小时90kg 的流量折合p 摩尔数为133153.144145.621090109032-⋅=⨯=⨯=h mol M v Cl H C n/v=(14618.623÷1441.153)=10.144小时1-3 0℃、101.325kPa 的条件常称为气体的标准状况。
试求甲烷在标准状况下的密度。
解:33714.015.273314.81016101325444--⋅=⨯⨯⨯=⋅=⋅=m kg M RT p M V n CH CH CHρ 1-4 一抽成真空的球形容器,质量为25.0000g 。
充以4℃水之后,总质量为125.0000g 。
若改用充以25℃、13.33kPa 的某碳氢化合物气体,则总质量为25.0163g 。
试估算该气体的摩尔质量。
解:先求容器的容积33)(0000.10010000.100000.250000.1252cm cm V l O H ==-=ρn=m/M=pV/RTmol g pV RTm M ⋅=⨯-⨯⨯==-31.301013330)0000.250163.25(15.298314.841-5 两个体积均为V 的玻璃球泡之间用细管连接,泡内密封着标准状况条件下的空气。
1气体的pVT关系(物理化学课件(天津大学)修改版上课用)

维里方程(不要求) 维里方程(不要求)
B C D pVm = RT (1 + + 2 + 3 + L) Vm Vm Vm
pVm = RT (1 + B p + C p + Dp + L)
' ' 2 3
在计算精度要求不高时, 在计算精度要求不高时,有时只用到 第二项,所以第二维里系数B’较其他维里 第二项,所以第二维里系数 系数更为重要。 系数更为重要。
问题 2
如果在压力大于101.325 kPa下加热水(高压容 下加热水( 如果在压力大于 下加热水 器内), ),水的沸点应是 器内),水的沸点应是 (1)大于 )大于100度 度 (2)小于 )小于100度 度 (3)等于100度 )等于 度
答案:(1 答案:(1) :(
3. 临界参数
临界温度:( 临界温度 (critical temperature,Tc)使气体能够液 , 化所允许的最高温度。 化所允许的最高温度。 临界压力:( 临界压力 (critical pressure ,pc)是在临界温度下 使气体液化所需要的最低压力。 使气体液化所需要的最低压力。 临界摩尔体积:( 临界摩尔体积 (critical volume,Vm,c)是在临界温 , 度和临界压力下物质的摩尔体积。 度和临界压力下物质的摩尔体积。
从沙棘中提取沙棘油
传统的提取工艺是以氮仿或植物油为萃取 刑,存在时间长、收率低,纯度低的缺点。用超 存在时间长、收率低,纯度低的缺点。 临界CO2进行常温萃取,收率可达90%以上。 临界 进行常温萃取,收率可达 %以上。
提取啤酒花浸膏 啤酒花是啤酒配制工业中重要的原料之 类的α 一,其主要成份是含萍草图(hum lone)类的α酸 其主要成份是含萍草图 类的 和含蛇麻酮(lqpu lone)类的β-酸,使啤酒拥有 类的β 和含蛇麻酮 类的 酸 特殊口感的苦味。 特殊口感的苦味。
天津大学版物理化学课件第一章

表1.3.1
液体的沸点
当液体饱和蒸气压与外界压力相等 时,液体沸腾,此时相应的温度称为液 体的沸点。习惯将101.325kPa外压下的沸 点称为正常沸点。如水的正常沸点为 100℃,乙醇的正常沸点为78.4℃,苯的 正常沸点为80.1℃。
相对湿度
• 水在20℃时的饱和蒸气压为2.338kPa,在大气环境 中尽管有其它气体存在,只要大气中水的分压小于 2.338kPa,液体水就会蒸发成水蒸气。反之,如果 大气中水蒸气的分压大于同温度下水的饱和蒸气压, 水蒸气就会凝结成液体水。秋夜温度降低,使大气 中水蒸气的分压大于饱和蒸气压,于是结出露珠。 我们把大气中水蒸气的压力达到其饱和蒸气压时的 情况,称为相对湿度为100%。北方冬季的相对湿 度一般在30%左右,液体水很容易蒸发为水蒸气; 而夏季的相对湿度最高时可达到约90%,几乎接近 饱和蒸气压,这时液体水不再容易变为水蒸气。这 就是为什幺人们在冬季感觉气候干燥,夏季感觉天 气闷热的原因。
Z查
Tr’
Tr
例3 已知T, Vm, 求p
(1)因为 p=pc pr 从表中查出Tc,pc
(2)计算
T Tr Tc
pVm pc prVm pcVm (3)计算 Z pr f ( pr ) RT RT RT
(4)用图解法求出p Z
压缩因子图 Z=f(pr)
p’ r
pr
Liti
tu
A
(1.2.2)
(3)体积分数
B
物质B的体积分数定义为
B def x V
B m, B
/x V
A
A m, A
(1.2.3)
2.理想气体状态方程对理想气体混合物的应用
pV nRT ( n B )RT
《物理化学》(天大第五版)考点精讲教程(第1讲 气体的pVT关系)

第1讲气体的pVT 性质《物理化学》考点精讲教程(天津大学第五版)主讲人:张彩丽网学天地《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程四、物理化学课程的内容《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程二、气体常数《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程(1)指定状态下计算系统中各宏观性质。
《物理化学》(天大第五版)考点精讲教程(2)状态变化时,计算系统各宏观性质。
《物理化学》(天大第五版)考点精讲教程例:某空气《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程2. 质量分数《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程5. 理想气体方程对理想气体混合物的应用《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程2. 道尔顿分压定律《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程三、阿马格分体积定律《物理化学》(天大第五版)考点精讲教程物理意义:《物理化学》(天大第五版)考点精讲教程四、两者关系《物理化学》(天大第五版)考点精讲教程1. 指定状态下的计算《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程2. 状态变化时的计算《物理化学》(天大第五版)考点精讲教程A,0200kPap=《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程2. 性质《物理化学》(天大第五版)考点精讲教程二、临界参数c《物理化学》(天大第五版)考点精讲教程三、真实气体的《物理化学》(天大第五版)考点精讲教程1. T< T c,反映出液体的不《物理化学》(天大第五版)考点精讲教程2. T = T c《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程2. 波义尔温度《物理化学》(天大第五版)考点精讲教程二、范德华方程《物理化学》(天大第五版)考点精讲教程2. 体积修正《物理化学》(天大第五版)考点精讲教程三、维里方程《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程二、压缩因子图任何Tr ,pr→0,Z→1(理想气体);T r较小时,p r↑,Z先↓,后↑,反映出气体低压易压缩,高压难压缩;T r 较大时,Z ≈1。
物理化学课件(天大第五版)-真实气体

真实气体在相变过程中的 特性
REPORTING
相变过程的概念
相变过程
物质从一种相态转变为另一种相 态的过程,如气态转变为液态或 固态,液态转变为固态或气态,
固态转变为液态或气态。
相变点
物质发生相变的温度和压力点, 如水的冰点为0°C和1个大气压。
相平衡
在一定的温度和压力下,物质的 不同相态可以共存,形成一个平
REPORTING
真实气体的内能
总结词
真实气体的内能是指气体内部所有分子动能和势能的 总和,与温度、体积和物质的量有关。
详细描述
真实气体的内能是气体热力学状态的重要参数之一,它 反映了气体内部微观粒子所具有的能量。根据热力学的 知识,真实气体的内能与温度、体积和物质的量有关。 当温度升高时,气体分子的平均动能增大,导致内能增 加;而当体积增大时,分子间的平均距离增大,势能增 大,也会导致内能增加。物质的量越大,气体的内能也 越大。因此,在等温、等压条件下,真实气体的内能随 物质的量增加而增加。
反应速率
物质在相变过程中反应速率的快 慢,表示物质化学反应速度的变 化。
2023
REPORTING
THANKS
感谢观看
衡状态。
相变过程中的热力学性质
热容
在相变过程中,物质吸收或释放热量时温度的变 化,表示物质热稳定性的变化。
熵
物质在相变过程中熵的变化,表示物质内部无序 度的变化。
焓
物质在相变过程中焓的变化,表示物质能量的变 化。
相变过程中的动力学性质
扩散系数
物质在相变过程中扩散系数的变 化,表示物质传递速度的变化。
无序程度增加,因此气体的熵也随物质的量增加而增加。
天大物理化学课件第一章 气体的pVT关系

B
B
nBRT p
VB*
B
可有:
VB*
nBRT p
即:理想气体混合物的总体积V 等于各组分B在相同温度T 及总压p条件下占有的分体积VB*之和。 阿马格定律
24
阿马加定律表明理想气体混合物的体积具有加和性, 在相同温度、压力下,混合后的总体积等于混合前各组 分的体积之和。
二定律结合可有:
yB
nB n
xB(或yB ) =de=f nB
nA
A
显然 xB=1 , yB=1
(量纲为1)
本书中 气体混合物的摩尔分数一般用 y 表示 液体混合物的摩尔分数一般用 x 表示
(2) 质量分数wB
wB =de=f mB
mA
A
显然 wB=1
(量纲为1)
19
(3)体积分数 B
B
=de=f
x
V*
B m,B
xAVm*,A VB*
lnx,ex 中的 x 是物理量除以单位后的纯数 x x /[x] 如:lnp ln(p/ kPa) 为简便起见,公式中有时将单位省略
3. 量值计算
计算时先写出量方程式,再代入数值和单位计算
例:
Vm
RT p
8.314 273.15 101.325 103
m
3
mol
1
22.4 dm 3 mol
<<Journal of Physical Chemistry>>。 从此“物理化学”这个名词逐渐被普遍采用。
2
化学从一开始就与工业生产、国民经济紧密相联。 例如:钢铁的冶炼; 煤炭燃烧产生能量带动蒸汽机的运转。 这些推动人类历史发展的重要动力都是通过化学反应来
物理化学课件分压定律和分体积定律.

(2) 压力修正
器 壁
内部分子
靠近器壁的分子
分子间相互作用减弱了分子对器壁的碰撞, 所以:
2018/12/7
p= p理-p内 p内= a / Vm2 p理= p + p内= p + a / Vm2
a为范氏常数,其值与各气体性质有关,均为正 值。一般情况下,分子间作用力越大, a值越大。 将修正后的压力和体积项引入理想气体状态方 程:
VB y BV
y B=1
理想气体混合物的总体积V为各组分分体积VB*之和: yB = 1 V= VB*
n RT n B RT B V VB p p p B B n B RT VB p 理想气体混合物的总体积,等于气体B在与气体混 合物具有相同温度及压力条件下所占有体积的总和。 阿玛格分体积定律
注:该定律仅适用于理想气体,低压真实气体近似 服从该定律
2018/12/7
n
B
RT
气体混合物的平均摩尔质量 假定混合气体各组分之间不发生任何化学反应 , 组分A的物质的量为 nA,摩尔质量为MA;组分B的物 质的量为nB,摩尔质量为MB,则由A和B组成的混合 物体系的摩尔质量M,令nA+nB=n,则有
l2018/12/7 继续增加外压,液体被压缩,体积变化不大。
在敞口容器中,液体的饱和蒸气压等于外压时, 液体发生剧烈的汽化现象,称为沸腾,此时的温 度称为沸点 饱和蒸气压 1个大气压时的温度称为正常沸点 (373.15K) 饱和蒸气压 1个标准压力( 1个标准压力=100kPa, p)时的温度称为标准沸点(372.78K)
第一章 气体的pVቤተ መጻሕፍቲ ባይዱ性质
理想气体混合物的分压定律和分体积定律
天大考研资料 物理化学-天大物理化学课件01

上一内容 下一内容 回主目录
返回
2020/4/23
§1.2 理想气体混合物
1.混合物组成表示:
• 用物质量的分数表示: (x表示液体,y表示气体)
对于物质B 量纲为1
xB 或yB
nB nB nA n
A
显然
xB 1
B
上一内容 下一内容 回主目录
2020/4/23
3. 临界点及T = Tc的等温线
• 临界点C处的坐标是Tc, pc, Vc. Vc既是饱和气体的摩尔体 积, 又是饱和液体的摩尔体积, 此时气液之间没有区别.
• 在C点的低压侧物质处于气态, 而在高压侧是液态. 由于液 体的难压缩性, 高压侧曲线比较陡直.
p
2020/4/23
C
上一内容 下一内容 回主目录
返回
2020/4/23
§1.3 气体的液化及临界参数
• 液体的饱和蒸气压同温度有关,温度不 同,饱和蒸气压不同。(克-克方程)
• 当液体的饱和蒸气压同外界压力相等,液 体即发生沸腾,此时的温度即为沸点。
• 当外界压力为101.325kPa时的沸点称为 正常沸点。
上一内容 下一内容 回主目录
A
混合前纯B体积 混合前各纯组分体积总
和
量纲为1
显然 B 1
B
上一内容 下一内容 回主目录
返回
2020/4/23
§1.2 理想气体混合物
2.理气状态方程对理气混合物的应用
pVnRT nB RT
B
pV m RT
Mmix
Mmix混合物的摩尔质量
Mmix yBMB
天大物理化学(第五版)第一章

排斥力 分子相距较近时,电子云及核产生排斥作用。
Lennard-Jones理论:n = 12 A B
E 总 E吸 引+E 排 斥= - r
6
r 12
式中:A-吸引常数;B-排斥常数
(2) 理想气体模型 a) 分子间无相互作用力
b) 分子本身不占体积 理想气体定义: 服从 pV=nRT 的气体为理想气体 或服从理想气体模型的气体为理想气体 (低压气体)p0 理想气体
道尔顿定律 阿马加定律
RT p p B nB V B B
V
V
B
B
nB RT p B
pB VB nB yB p V n
§1.3 气体的液化及临界参数
Gases liquidation and Critical paracters
1. 液体的饱和蒸气压
the Saturated Vapour Pressure
当n一定时,等 下: p1V1=p2V2 T
p/Pa
p1 p2 等V下 : T1 T2
V1 V2 等p下: T1 T2
V/m3
2. 理想气体模型及定义 (1)分子间力
the modle and definition of ideal gas
吸引力 分子相距较远时,有范德华力;
E吸引 -1/r 6 E排斥 1/r n
5000 4500 4000 3500 3000 2500 2000 1500 1000 0
CH4
N2
He
20 40 60 80 100 120
p / MPa
§1.2 理想气体混合物
Mixtures of ideal gasas 1. 混合物的组成components of mixtures
物理化学课件分压定律和分体积定律.

2023/11/10
压缩因子法
由Z的定义式可知, pV=ZnRT
维里方程
pVm=RT(1+B/Vm+C/Vm2+D/Vm3+•••)
气体的液化与液体的饱和蒸汽压
实际气体分子间存在吸引力, 从而能发生一种理 想气体不可能发生的变化——液化.气体的液化一般 需要降温和加压. 降温可减小分子热运动产生的离 散倾向, 加压则可以缩小分子间距从而增大分子间 引力.
值.
00-7-22
20
普遍化压缩因子图
将对比状态参数的表达式引入压缩因子 Z 的定义中, 得
def Z
pVm RT
pCVC prVr RTC Tr
ZC
pr Vr Tr
式中右方第一项为临界点处的压缩因子ZC, 实验 表明多数实际气体的 ZC 在 0.270.29 的范围内(参
阅表1-2), 可看作常数;根据对应状态原理,在Tr和pr 一定时, pr也一定,因而,压缩因子Z近似为一定值,即 处于对比状态的各种气体具有相同的压缩因子,它是
分压力:混合气体中某一组分B的分压力pB是该
组份单独存在并具有与混合气体相同温度和体积
时所具有的压力。
注: 总压是构成该混合物的各组分对压力所做的贡 献之和; 气体混合物中每一种气体叫做组分气体。
yB = 1
p = pB
混合理想气体:
pB (nA nB
B
nC
) RT V
B
nB
Tr和pr的一个双变量函数.
00-7-22
21
VB yBV
y B=1
V 混合气体总体积, yB 组分B的物质的量分数
物理化学课件分压定律和分体积定律

在敞口容器中,液体的饱和蒸气压等于外压时, 液体发生剧烈的汽化现象,称为沸腾,此时的温 度称为沸点
饱和蒸气压 1个大气压时的温度称为正常沸点 (373.15K)
饱和蒸气压 1个标准压力( 1个标准压力=100kPa, p)时的温度称为标准沸点(372.78K)
饱和蒸气压是物质在一定温度下处于液气平衡共 存时蒸汽的压力,是纯物质特有的性质,由其本 性决定;其大小是温度的函数,是衡量液体蒸发 能力或液体分子逸出能力的一个物理量。
组分A的物质的量为nA,摩尔质量为MA;组分B的物 质的量为nB,摩尔质量为MB,则由A和B组成的混合 物体系的摩尔质量M,令nA+nB=n,则有
M
m n
nAMA nBMB n
nA n
MA
nB n
MB
即
M yAMA yBMB
该公式对多组分气体也同样适用,也适用于液体和
固体混合物,对任意组分,其计算平均摩尔质量通
第一章 气体的pVT性质
理想气体混合物的分压定律和分体积定律
真实气体的液化与液体的饱和蒸汽压 对应状态原理与压缩因子图
理想气体混合物的分压定律和分体积定律
道尔顿(Dalton)分压定律
鉴于热力学计算的需要,提出了既适用于理
想气体混合物,又适用于非理想气体混合物的分
压力定义 pB yBp
y B=1
压缩空间减小1。mol气体的可压缩空间以 (Vm - b)表示。 b为一范氏常数,恒为正值,其大小与气体性
质决定。 一般情况下,气体本身体积越大,b值也 越大。
对2020体/5/7积修正后,p(Vm - b)=RT。
(2) 压力修正
器 壁
2020/5/7
内部分子
最新物理化学课件(天大第五版)0102气体
而同一种气体在不同温度的 pVm-p曲线亦有 三
种类型
12
13
pVm / [ pVm ]
T > TB
T > TB : p , pVm
T = TB
T = TB : p , pVm开始 不变,然后增加
T < TB
T > TB : p , pVm先下 降,后增加
p/[p] 图1.4.1 气体在不同温度下的 pVm-p 图
气体pVT关系的影响
19
§1.5 对应状态原理及普遍化压缩因子图
the Law of Corresponding States and the Popular Compressibility Factor Chart
§1.3 气体的液化及临界参数
Gases liquidation and Critical paracters
1. 液体的饱和蒸气压 the Saturated Vapour Pressure
理想气体不液化(因分子间没有相互作用力)
实际气体:在一定T、p 时,气-液可共存达到平衡
p*
气
液
气液平衡时: 气体称为饱和蒸气; 液体称为饱和液体; 压力称为饱和蒸气压。
CO2的PV图
6
2) T=Tc
l’l1’2
T1<T2<Tc<T3<T4
T , l-g线缩短,说明Vm(g)
p / [p]
C
l2
g2
l1
g1
T4
T3
Tc
T2
g ’
T1 g’2 1
与Vm(l)之差减小 T=Tc时,l-g线变为拐点C C:临界点
Tc 临界温度
Vm / [Vm]
物理化学第一章气体的pVT性质

一、状态方程 :联系 p、V、T 之间关系的方 程称为状态方程。 二、理想气体状态方程 1. 理想气体状态方程 低压气体定律: (1)波义尔定律(R.Boyle,1662):
pV = 常数 V / T = 常数
( n ,T 一定) (n , p 一定)
(2)盖.吕萨克定律(J. Gay-Lussac,1808):
ρ ∝
a 内压力= V 2 = p i p
1 V
pi = p +
3. 范德华方程
(P +
a V2
a )(Vm b) = RT 2 Vm
n 2a (P + )( V nb ) = nRT V 2
§1-3
实际气体的PVT性质 实际气体的PVT性质 PVT
4.范德华常数及其单位 范氏方程里的两个常数a、b总称为范德华常数,常数a 标志了物质分子间所具有的相互吸引力,常数b则表示 了分子本身所具有的体积,故a与b都是与气体种类有 关的特性常数。
R=
或
PVm 1atm × 22.4140L mol = T 273.15K
= 0.082057atm L K 1 mol 1
1
(101325 N m 2 )( 22 . 4140 10 3 m 3 mol R= 273 .15 K
)
=8.3144NmK-1mol-1 =8.3144JK-1mol-1
第一章
气体的PVT性质 气体的PVT性质 PVT
§1-0 物质的聚集状态
聚集状态 1.定义:物质是由大量的不断流动着的分子、原子、 离子等微观粒子聚集而成的,所以物质所表现出来的 状态 。 2.产生原因:分子间相互作用力 运动 3.表示方法:气、液、固分别用于g、l、s表示。
物理化学课件分压定律和分体积定律

相对湿度的概念:相对湿度=
空气中pH2O p
H2O
100%
2020/3/17
在敞口容器中,液体的饱和蒸气压等于外压时,液 体发生剧烈的汽化现象,称为沸腾,此时的温度称 为沸点
饱和蒸气压=1个大气压时的温度称为正常沸点 (373.15K)
饱和蒸气压=1个标准压力( 1个标准压力=100kPa, p)时的温度称为标准沸点(372.78K)
对应状态原理与压缩因子图
对应状态原理
以临界参数为基准, 定义对比压力pr, 对比摩尔体
积Vr及对比温度Tr :
p pr pc
Tr
T TC
Vr
Vm VC
pr, Vr, Tr 不仅描述了气体所处状态, 也显示了该 状态偏离气液无差别的临界状态的程度.
对应状态原理: 若不同的气体有两个对比状态参
第一章 气体的pVT性质
理想气体混合物的分压定律和分体积定律
真实气体的液化与液体的饱和蒸汽压 对应状态原理与压缩因子图
理想气体混合物的分压定律和分体积定律 道尔顿(Dalton)分压定律
鉴于热力学计算的需要,提出了既适用于理想气 体混合物,又适用于非理想气体混合物的分压力定义
pB yBp
y B=1
V= VB*
V nRT
p
nBRT
B
p
nBRT Bp
VB
B
VB
nBRT p
理想气体混合物中物质B的分体积VB*,等于纯气
体B在混合物的温度及总压条件下所占有的体积。
阿玛格分体积定律
注:该定律仅适用于理想气体,低压真实气体近似
服从该定律
2020/3/17
物理化学第一章气体的pVT性质

如两种气体混合 V = V*A + V*B
nB RT V p
* B
(3)适用于理想气体混合物,低压下的真实气体混合物;对高压下的混 合气体,需用偏摩尔体积取代摩尔体积。
=======分体积定律是理想气体的必然规律========
11
Physical Chemistry CAI
斥力
A B E E吸引+E排斥= 6 12 r r
对真实气体,通过降低温度和增加压力都
E
引力
E
可使气体的摩尔体积减小,即分子间距减小,
最终导致液化。
r0 r
图1-2 兰纳德-琼斯势能曲线
14
Physical Chemistry CAI
物理化学教学课件
2.真实气体p-Vm等温图
1869年,Andrews T,通过研究n一定的CO2气体的系列实验,采
物理化学教学课件
(3)沸点:
当液体的饱和蒸汽压等于外界压力(pex, External)时,液体开始沸 腾(汽化),此时的温度称为液体的沸点。
习惯上将101.325kPa(标准大气压)下的沸点成为正常沸点。
水(100℃),乙醇(78℃),苯(80℃)
在外压较低 (高原上, pex <101.325kPa)时, 沸点降低(水的沸点 < 100℃),所以在高原上煮鸡蛋不熟。 在外压较高(高压釜中, pex>101.325kPa)时,沸点升高(水的沸点 >100℃),所以用高压锅煮饭易熟。 部分液体的饱和蒸汽压-温度关系表(Page13-table 1-2)。
2. 液、固体的复杂性——液、固体的分子间作用力较大,研究较复杂,甚 至无法研究。 人们常利用气体的一些性质,并加以修正,来处理液、固体行为,亦 能得到令人满意结果。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
上一内容 下一内容 回主目录
返回
2020/7/30
摩尔气体常数R的求导
3) 外推至p=0,可得
R
lim (
p0
pVm )T
/T
(2494.2 /
300)J
mol1
K
用于p, V, T, n, m, M, ρ的计算
上一内容 下一内容 回主目录
返回
2020/7/30
§1.1 理想气体的状态方程
例:计算25℃,101325Pa时空气的密度。
(空气的分子量为29)
解:
一定是常数么?
n V
p RT
101325
8.315
273.15
25
mol m3
40.87 mol m3
B
返回
2020/7/30
§1.2 理想气体混合物
• 用质量分数表示:
wB
mB mB mA m
A
wB 1
B
量纲为1
上一内容 下一内容 回主目录
返回
2020/7/30
§1.2 理想气体混合物
• 用体积分数表示:
B
xBVm*, B xAVm*, A
nBVm*, B nAVm*, A
A
A
上一内容 下一内容 回主目录
返回
2020/7/30
§1.1 理想气体的状态方程
理想气体:分子间无相互作用,分子本身无体积
××
×
×
×× ×
×
× ×
×
××
可无限压缩
在任何温度、压 力下均符合理想 气体模型,或服 从理想气体状态 方程的气体为理 想气体
上一内容 下一内容 回主目录
返回
2020/7/30
§1.1 理想气体的状态方程
第一章 气体的PVT关系
§1.1 理想气体的状态方程 §1.2 理想气体混合物 §1.3 气体的液化及临界参数
上一内容 下一内容 回主目录
返回
2020/7/30
§1.1 理想气体的状态方程
1.理想气体的状态方程
pV=c (n, T一定)
pV=nRT
V/T=c (n, p一定)
V/n=c (T, p一定)
返回
2020/7/30
3. 道尔顿定律
压力分数:混合气体中某组分B的分压与总压之 比称该组分B的压力分数。
yB
pB P
nBRT /V nRT /V
nB n
压力分数等于该组分B的摩尔分数 此规律只近似应用于低压下的实际混合气体
上一内容 下一内容 回主目录
返回
2020/7/30
4.阿马加定律
1) 分体积
上一内容 下一内容 回主目录
返回
2020/7/30
4.阿马加定律
对于理想气体
yB
pB P
nBRT /V nRT /V
nB n
yB
VB* V
nB RT / P nRT / P
nB n
体积分数等于压力分数 等于该组分B的摩尔分数
上一内容 下一内容 回主目录
返回
2020/7/30
§1.3 气体的液化与临界现象
混合前纯 B体积 混合前各纯组分体积总
和
量纲为1
显然 B 1
B
上一内容 下一内容 回主目录
返回
2020/7/30
§1.2 理想气体混合物
2.理想气状态方程对理想气体混合物的应用
pV nRT B nB RT
pV m RT
M mix
Mmix混合物的摩尔质量
M mix yBM B
B
上一内容 下一内容 回主目录
返回
2020/7/30
§1.2 理想气体混合物
m mB nBM B n yB MB nMmix
B
B
B
M mix
m n
B
yB MB
上一内容 下一内容 回主目录
返回
2020/7/30
3. 道尔顿定律
1) 分压力 (分压) 混合气体中,组分B单独存在,并且处于与混
合气体相同的温度和体积时,所产生的压力称组分 B的分压。
d空气=Vn M 40.87 29 g m3 1.185 kg m3
上一内容 下一内容 回主目录
返回
2020/7/30
§1.1 理想气体的状态方程
2.理想气体的模型
真实气体:分子间有相互作用,分子本身有体积。
AB E E吸引 E排斥 - r6 r12
E0
不
可
0
无
限
0
压
r
缩
分子势能曲线
混合气体中,组分B单独存在,并且处于与混 合气体相同的温度和压力时,所产生的体积称组 分B的分体积。
VB
nB RT p
上一内容 下一内容 回主目录
返回
2020/7/30
4.阿马加定律
混合气体的总体积V等于各组分B在相同温度T 及总压p条件下占有的体积VB*的总和。
V VB*
B
分体积定律是理想气体的必然规律
R:摩尔气体常数,数值为8.314
[R] Pa m3 Pa m3 mol 1 K 1 mol K
J mol 1 K 1
上一内容 下一内容 回主目录
返回
2020/7/30
§1.1 理想气体的状态方程
理想气体的状态方程的其他表示
也可以写为 pVm=RT
或 pV m RT M
Vm=V/n ρ=m/V
pB yB p
上一内容 下一内容 回主目录
返回
2020/7/30
3 道尔顿定律
混合气体的总压力等于各组分单独存在于混合气体 的温度、体积条件下所产生压力的总和。
p pB
B
pB nB RT /V
pA nART /V
pB nB pA nA
分压定律是理想气体的必然规律
上一内容 下一内容 回主目录
1
8.314J mol1 K 1
上一内容 下一内容 回主目录
返回
2020/7/30
§1.2 理想气体混合物
1.混合物组成表示:
• 用物质的量的分数表示: (x表示气体,y表示液体)
对于物质B 量纲为1
xB 或yB
nB nB nA n
A
显然
xB 1
B
上一内容 下一内容 回主目录
yB 1
气—液平衡
nlg ngl 微观
饱和蒸汽
v蒸发 v凝结 宏观
上一内容 下一内容 回主目录
饱和液体
返回
2020/7/30
§1.3 气体的液化与临界现象
1.饱和蒸气压 在温度为T,物质气液两相达平衡时的气相压
力为饱和蒸气压 p* 1) 纯物质在指定温度下有确定的饱和蒸气压。
2) 随着温度升高,饱和蒸气压增大。 Why?
• 理想气体的状态方程是理想气体的宏 观外在表现 • 理想气体的微观模型反映了理想气体 的微观内在本质 • 理想气体是真实气体在 p→ 0 情况下 的极限状态。
上一内容 下一内容 回主目录
返回
2020/7/30
§1.1 理想气体的状态方程
• 真实气体并不严格符合理想气体状态方 程,也就是说真实气体在方程 pV=nRT 中的R不为常数。
